Группа крови (Blood group, АВ0)
Метод определенияФильтрация проб крови сквозь гель, импрегнированный моноклональными реагентами — агглютинация + гель-фильтрация (карточки, перекрестный метод). При необходимости (обнаружение А2-подтипа) проводится дополнительное тестирование с использованием специфических реактивов.
Исследуемый материал Цельная кровь (с ЭДТА)
Синонимы: Анализ крови на определение группы; Группа крови АВ0; Группа крови по системе АВО; Определение группы крови. ABO Grouping, Blood Typing, Blood Group, Blood Type.
Краткое описание исследования Группа крови
Группа крови — это генетически наследуемый признак, не изменяющийся в течение жизни. Определение групповой принадлежности крови используется в клинической практике при переливании крови и ее компонентов, в гинекологии и акушерстве при планировании и ведении беременности.
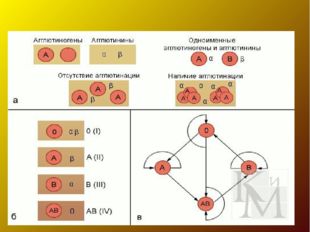
- группа 0αβ (I) − на эритроцитах отсутствуют групповые агглютиногены, в плазме крови присутствуют агглютинины α и β;
- группа Aβ (II) − эритроциты содержат только агглютиноген А, в плазме крови присутствует агглютинин β;
- группа Bα (III) − эритроциты содержат только агглютиноген В, в плазме крови содержится агглютинин α;
- группа AB (IV) − на эритроцитах присутствуют агглютиногены А и В, плазма крови агглютининов не содержит.

Определение групп крови проводят путем идентификации специфических антигенов и антител (двойной метод или перекрестная реакция).
Несовместимость крови наблюдается, если эритроциты крови донора (реципиента) несут агглютиногены (А или В), а в плазме крови реципиента (донора) содержатся соответствующие агглютинины (α или β), при этом происходит реакция агглютинации. Переливать эритроциты, плазму крови и особенно цельную кровь от донора к реципиенту нужно строго соблюдая групповую совместимость. Лучше всего переливать кровь, эритроциты и плазму той же группы, которая определена у реципиента. В экстренных случаях эритроциты группы 0 (но не цельную кровь!) можно переливать реципиентам с другими группами крови; эритроциты группы А можно переливать реципиентам с группой крови А и АВ, а эритроциты от донора группы В − реципиентам группы В и АВ.
Варианты групповой несовместимости (агглютинация обозначена знаком +)
Кровь донора | Кровь реципиента | |||
0αβ (I) | Aβ (II) | Bα (III) | AB (IV) | |
0αβ (I) | — | + | + | + |
Aβ (II) | + | — | + | + |
Bα (III) | + | + | — | + |
AB (IV) | + | + | — | |
Эритроциты донора | Кровь реципиента | |||
0αβ (I) | Aβ (II) | Bα (III) | AB (IV) | |
0 (I) | — | — | — | — |
A (II) | + | — | + | — |
B (III) | + | + | — | — |
AB (IV) | + | + | + | — |
Антигены системы АВ0 выявляются не только на эритроцитах, но и на клетках других тканей. Они развиваются на ранних стадиях внутриутробного развития и у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности − в плазме крови могут отсутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после десяти месяцев), и определение группы крови в этом случае проводится только по наличию антигенов системы АВ0.
Они развиваются на ранних стадиях внутриутробного развития и у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности − в плазме крови могут отсутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после десяти месяцев), и определение группы крови в этом случае проводится только по наличию антигенов системы АВ0.
Трудности при определении группы крови вследствие подавления реакции гемагглютинации возникают также после введения плазмозаменителей, переливания крови, трансплатации, септицемии и пр.
Наследование групп крови В основе закономерностей наследования групп крови системы АВ0 лежат следующие понятия. В локусе гена АВ0 возможны три варианта (аллеля) − 0, A и B, которые экспрессируются по аутосомно-кодоминантному типу. Это означает, что у лиц, унаследовавших гены А и В, экспрессируются продукты обоих этих генов, что приводит к образованию фенотипа АВ (IV группа крови).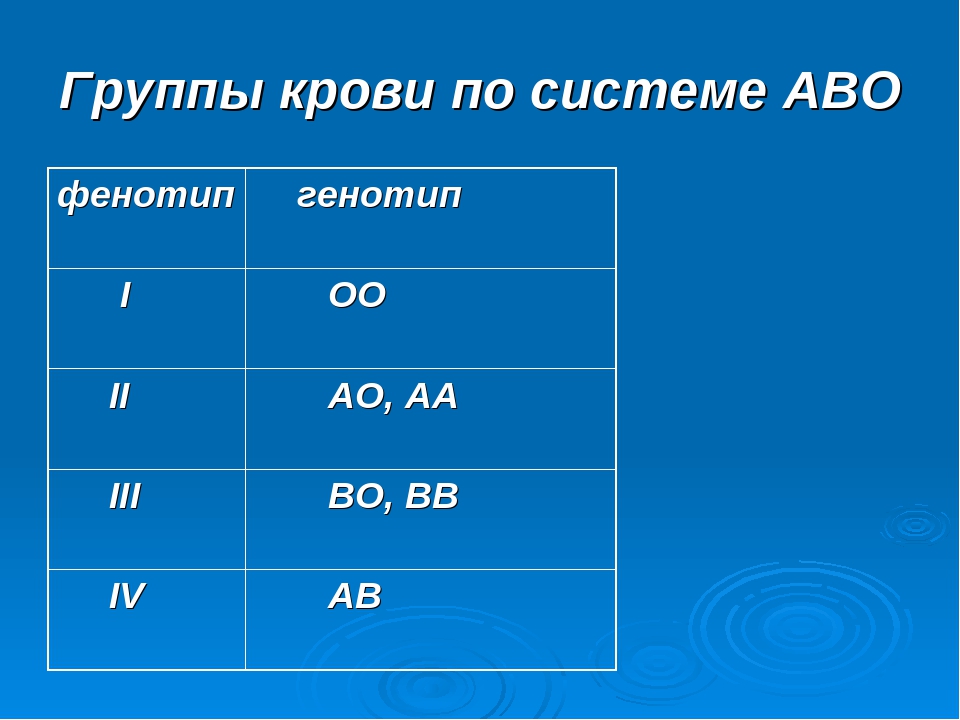 Фенотип А (II группа крови) может быть у человека, унаследовавшего от родителей или два гена А (генотип АА), или гены А и 0 (генотип А0). Соответственно, фенотип В (III группа крови) − при наследовании или двух генов В (генотип ВВ), или В и 0 (генотип В0). Фенотип 0 (I группа крови) проявляется в случае наследования двух генов 0 (генотип 00). Это объясняет, почему в том случае, если оба родителя имеют II группу крови (с возможным генотипом А0), кто-то из их детей может иметь первую группу (генотип 00), или в случае, если у одного из родителей группа крови A (II) (с возможным генотипом А0), а у другого B (III) (с возможным генотипом В0), дети могут иметь не только группы крови А (II) и B (III), но и 0 (I) и АВ (IV).
Фенотип А (II группа крови) может быть у человека, унаследовавшего от родителей или два гена А (генотип АА), или гены А и 0 (генотип А0). Соответственно, фенотип В (III группа крови) − при наследовании или двух генов В (генотип ВВ), или В и 0 (генотип В0). Фенотип 0 (I группа крови) проявляется в случае наследования двух генов 0 (генотип 00). Это объясняет, почему в том случае, если оба родителя имеют II группу крови (с возможным генотипом А0), кто-то из их детей может иметь первую группу (генотип 00), или в случае, если у одного из родителей группа крови A (II) (с возможным генотипом А0), а у другого B (III) (с возможным генотипом В0), дети могут иметь не только группы крови А (II) и B (III), но и 0 (I) и АВ (IV).
С какой целью определяют Группу крови
Помимо ситуаций, связанных с необходимостью переливания крови, определение группы крови, резус-принадлежности, определение наличия аллоиммунных (изоиммунных) антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребенка, который может приводить к гемолитической болезни новорожденных (см.
Гемолитическая болезнь новорожденных – гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в ее организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности, медицинские аборты, выкидыши, внематочные беременности, инвазивные диагностические и лечебные вмешательства (биопсия ворсин хориона, амниоцентез, кордоцентез и др.), кровотечения во время беременности, ретрохориальная гематома, абдоминальные травмы и переливания крови женщине без учета резус-фактора и др.
Отделение переливания крови
Отделение заготовки и переливания крови создано в 1970 году, его организатором и первым руководителем была заслуженный врач России Н.И. Аржакова, с 1971 по 1980 год отделением руководила кандидат медицинских наук И.В. Сабурова, а с 1981го по 2001й — кандидат медицинских наук Э.Б. Базанова. С 2001 года лабораторию возглавляет кандидат медицинских наук А.И. Бернакевич.
Задачей отделения заготовки и переливания крови является обеспечение больных в клиниках института компонентами донорской крови. Отделение ведёт консультативную работу по вопросам клинической трансфузиологии, парентерального питания и иммунной коррекции. Донорский пункт отделения проводит комплектование донорских кадров (активные доноры, доноры резерва, доноры-родственники), ведёт пропаганду донорства. Половина врачей и медсестёр отделения являются почётными донорами России.
В отделении внедрены передовые технологии лечения с использованием современных высокоэффективных лекарственных препаратов, что позволило значительно улучшить качество лечения больных и уменьшить число осложнений.
В связи с распространением среди населения носительства вирусов гепатитов В и С очень важным является подбор социально благополучного контингента постоянных доноров. Донорский пункт отделения заготовки и переливания крови проводит клиническое и лабораторное обследование доноров, осуществляет заготовку и фракционирование крови. Широко используется метод аппаратного плазмафереза с использованием приборов фирмы «Гемонетик». В качестве одной из мер повышения безопасности трансфузий в отделении внедрена система карантинизации донорской плазмы. Вся без исключения эритроцитная масса проходит процедуру удаления лейкоцитов путём фильтрации. В отделении широко используется заготовка компонентов собственной крови у больных, которым предстоят плановые операции. Взятие аутокрови проводится за несколько дней до плановой операции или непосредственно в операционной в качестве компонента нормоволемической гемодилюции. Это даёт возможность снизить риск инфицирования, избежать иммунологических конфликтов при переливании компонентов крови.
Это даёт возможность снизить риск инфицирования, избежать иммунологических конфликтов при переливании компонентов крови.
Проводится подбор для больных совместимых по фенотипу доноров. Помимо классических методов исследования в пробирках и на плоскости, используется и современная гелевая технология иммуногематологических тестов. В кабинете выдачи крови проводятся тесты на индивидуальную совместимость крови доноров и больных. Его задачей также является планирование потребности института в компонентах донорской крови и других трансфузионных средах. В лаборатории отделения ведётся строжайший контроль качества заготовленных компонентов донорской крови, выпускаемых для трансфузии. Диагностика ВИЧ-инфекции, сифилиса, вирусных гепатитов В и С проводится методом иммуноферментного анализа с использованием высокоспецифичных тест-систем. Исследование крови на наличие антител к возбудителю сифилиса проводится также в реакции агглютинации с кардиолипиновым антигеном и (или) с эритроцитарным антигенным диагностикумом. При биохимических исследованиях крови определяются количественные показатели активности аминотрансфераз и общего билирубина, концентрации общего белка и белковых фракций крови.
При биохимических исследованиях крови определяются количественные показатели активности аминотрансфераз и общего билирубина, концентрации общего белка и белковых фракций крови.
Трансфузиологи отделения переливания крови оказывают консультативную помощь клиническим отделениям в проведении трансфузионной терапии, парентерального питания, лечении анемий. В институте внедрены передовые технологии лечения послеоперационной анемии с использованием современных высокоэффективных лекарственных препаратов. Это позволило значительно улучшить качество лечения больных и уменьшить число осложнений.
Ежегодно в отделении производится более 7000 определений группы крови с использованием современного автоматического оборудования на основе магнетизированных эритроцитов и гелевых технологий. Производится обучение молодых врачей основам иммуногематологии и трансфузиологии.
Алгоритм переливания крови и плазмы. Пробы на совместимость.
 Бланки и протоколы.
Бланки и протоколы.Согласие пациента на операцию переливания донорской крои и ее компонентов
Приложение
к Инструкции по применению компонентов крови
от 25.11.2002 № 363
СОГЛАСИЕ ПАЦИЕНТА НА ОПЕРАЦИЮ ПЕРЕЛИВАНИЯ КОМПОНЕНТОВ КРОВИ
Я ________________________________________________________
получил разъяснения по поводу операции переливания крови. Мне объяснены лечащим врачом цель переливания, его необходимость, характер и особенности процедуры, ее возможные последствия, в случае развития которых я согласен на проведение всех нужных лечебных мероприятий. Я извещен о вероятном течении заболевания при отказе от операции переливания компонентов крови.
Пациент имел возможность задать любые интересующие его вопросы касательно состояния его здоровья, заболевания и лечения и получил на них удовлетворительные ответы.
Я получил информацию об альтернативных методах лечения, а также об их примерной стоимости.
| Беседу провел врач | |
| (подпись врача) |
Пациент согласился с предложенным планом лечения, в чем расписался собственноручно
| , | |
| (подпись пациента) |
или расписался (согласно пункту 1.7 “Инструкции по применению компонентов крови”, утвержденной приказом Минздрава России от 25.11.2002 № 363) ,
(подпись, Ф.И.О.)
или что удостоверяют присутствовавшие при беседе ,
(подпись врача)
| . | |
| (подпись свидетеля) |
Пациент не согласился (отказался) от предложенного лечения, в чем расписался собственноручно ,
(подпись пациента)
или расписался (согласно пункту 1.7 “Инструкции по применению компонентов крови”, утвержденной приказом Минздрава России от 25. 11.2002 № 363) ,
11.2002 № 363) ,
(подпись, Ф.И.О.)
или что удостоверяют присутствовавшие при беседе ,
(подпись врача)
| . | |
| (подпись свидетеля) |
Спасти больных раком: как стать донором костного мозга
Первый шаг для потенциального донора костного мозга — типирование — сдача крови на анализ, который определяет НLA-фенотип, набор генов, отвечающих за тканевую совместимость. Через три-шесть месяцев человека оповещают, что его результаты типирования занесены в Национальный регистр доноров костного мозга. В регистре не лежат пакеты с кровью, это банк данных доноров, а информация об их HLA-фенотипах хранится в цифровом виде.
Процедура анонимна: персональные данные в регистре закодированы. Все, что остается потенциальному донору, — ждать звонка в случае, если его HLA-фенотип подойдёт заболевшему человеку. Вероятность пациента генетически совпасть с незнакомым человеком — 1 к 10 тыс. А учитывая то, что в российском регистре меньше 100 тыс. человек (в Германии — 8,5 млн, в США — больше 20 млн), шанс из потенциального донора превратиться в реального составляет меньше 1%,
Вероятность пациента генетически совпасть с незнакомым человеком — 1 к 10 тыс. А учитывая то, что в российском регистре меньше 100 тыс. человек (в Германии — 8,5 млн, в США — больше 20 млн), шанс из потенциального донора превратиться в реального составляет меньше 1%,
От сдачи крови до пересадки костного мозга может пройти несколько лет.
Когда у какого-либо пациента появляется необходимость в пересадке костного мозга, и для него есть подходящий донор, сотрудники регистра звонят последнему и спрашивают, согласен ли он пожертвовать часть стволовых клеток. Если ответ положительный, человек проходит полное медицинское обследование и снова сдает кровь — ее проверяют на инфекции и ещё раз проводят типирование. После этого донор отправляется на трансплантацию.
Человеку дают возможность выбрать, каким способом он хочет пожертвовать гемопоэтические клетки. Первый вариант подразумевает забор крови из тазовой кости: врач делает небольшой прокол в кости и с помощью стерильного шприца вытягивает из нее 2-5% костного мозга (200-300 мл). Процедура длится от получаса до полутора часов и проводится под общим наркозом, после операции донор наблюдается в стационаре два дня. Его костный мозг полностью восстанавливается в срок от недели до месяца. Есть и другой метод: донору около недели делают инъекции специальными препаратами, которые стимулируют выход стволовых клеток из костного мозга в периферическую кровеносную систему. Дальше в течение четырёх-шести часов у донора берут кровь из вены. Кровь несколько раз перегоняется через сепаратор, который выделяет и собирает гемопоэтические клетки, а все остальное возвращает в организм человека. Объем стволовых клеток восполняется 7—10 дней.
Процедура длится от получаса до полутора часов и проводится под общим наркозом, после операции донор наблюдается в стационаре два дня. Его костный мозг полностью восстанавливается в срок от недели до месяца. Есть и другой метод: донору около недели делают инъекции специальными препаратами, которые стимулируют выход стволовых клеток из костного мозга в периферическую кровеносную систему. Дальше в течение четырёх-шести часов у донора берут кровь из вены. Кровь несколько раз перегоняется через сепаратор, который выделяет и собирает гемопоэтические клетки, а все остальное возвращает в организм человека. Объем стволовых клеток восполняется 7—10 дней.
Понять, прижился ли костный мозг, можно, если в течение как минимум ста дней после операции не произошло его отторжения. При этом группа и резус-фактор крови у пациента меняются на донорские.
Группа крови и резус фактор
Определяет принадлежность к определенной группе крови по системе АВО.
Группы крови — это генетически наследуемые признаки, не изменяющиеся в течение жизни при естественных условиях. Группа крови представляет собой определённое сочетание поверхностных антигенов эритроцитов (агглютиногенов) системы АВО.
Определение групповой принадлежности широко используется в клинической практике при переливании крови и её компонентов, в гинекологии и акушерстве при планировании и ведении беременности.
Система групп крови AB0 является основной системой, определяющей совместимость и несовместимость переливаемой крови, т. к. составляющие её антигены наиболее иммуногенны. Особенностью системы АВ0 является то, что в плазме у неиммунных людей имеются естественные антитела к отсутствующему на эритроцитах антигену. Систему группы крови АВ0 составляют два групповых эритроцитарных агглютиногена (А и В) и два соответствующих антитела — агглютинины плазмы альфа (анти-А) и бета (анти-В).
Различные сочетания антигенов и антител образуют 4 группы крови:
- Группа 0 (I) — на эритроцитах отсутствуют групповые агглютиногены, в плазме присутствуют агглютинины альфа и бета;
- Группа А (II) — эритроциты содержат только агглютиноген А, в плазме присутствует агглютинин бета;
- Группа В (III) — эритроциты содержат только агглютиноген В, в плазме содержится агглютинин альфа;
- Группа АВ (IV) — на эритроцитах присутствуют антигены А и В, плазма агглютининов не содержит.

Определение групп крови проводят путём идентификации специфических антигенов и антител (двойной метод или перекрёстная реакция).
Несовместимость крови наблюдается, если эритроциты одной крови несут агглютиногены (А или В), а в плазме другой крови содержатся соответствующие агглютинины (альфа- или бета), при этом происходит реакция агглютинации. Переливать эритроциты, плазму и особенно цельную кровь от донора к реципиенту нужно строго соблюдая групповую совместимость. Чтобы избежать несовместимости крови донора и реципиента, необходимо лабораторными методами точно определить их группы крови. Лучше всего переливать кровь, эритроциты и плазму той же группы, которая определена у реципиента. В экстренных случаях эритроциты группы 0, но не цельную кровь!, можно переливать реципиентам с другими группами крови; эритроциты группы А можно переливать реципиентам с группой крови А и АВ, а эритроциты от донора группы В — реципиентам группы В и АВ.
Карты совместимости групп крови (агглютинация обозначена знаком «+»)
Кровь донора |
Кровь реципиента |
|||
0 (I) |
A (II) |
B (III) |
AB (IV) |
|
0 (I) |
— |
+ |
+ |
+ |
A (II) |
+ |
— |
+ |
+ |
B (III) |
+ |
+ |
— |
+ |
AB (IV) |
+ |
+ |
+ |
— |
Эритроциты донора |
Кровь реципиента |
|||
0 (I) |
A (II) |
B (III) |
AB (IV) |
|
0 (I) |
— |
— |
— |
— |
A (II) |
+ |
— |
+ |
— |
B (III) |
+ |
+ |
— |
— |
AB (IV) |
+ |
+ |
+ |
— |
Групповые агглютиногены находятся в строме и оболочке эритроцитов. Антигены системы АВО выявляются не только на эритроцитах, но и на клетках других тканей или даже могут быть растворёнными в слюне и других жидкостях организма. Развиваются они на ранних стадиях внутриутробного развития, у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности — в плазме могут еще не присутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после 10 месяцев) и определение группы крови у новорожденных в этом случае проводится только по наличию антигенов системы АВО.
Антигены системы АВО выявляются не только на эритроцитах, но и на клетках других тканей или даже могут быть растворёнными в слюне и других жидкостях организма. Развиваются они на ранних стадиях внутриутробного развития, у новорожденного уже находятся в существенном количестве. Кровь новорожденных детей имеет возрастные особенности — в плазме могут еще не присутствовать характерные групповые агглютинины, которые начинают вырабатываться позже (постоянно обнаруживаются после 10 месяцев) и определение группы крови у новорожденных в этом случае проводится только по наличию антигенов системы АВО.
Помимо ситуаций, связанных с необходимостью переливания крови, определение группы крови, резус-фактора, а также наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка, который может приводить к гемолитической болезни новорожденных.
Гемолитическая болезнь новорожденных — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности и переливания крови женщине без учёта резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или выкидышей. Существуют разновидности (слабые варианты) антигена А (в большей степени) и реже антигена В. Что касается антигена А, имеются варианты: сильный А1 (более 80%), слабый А2 (менее 20%), и еще более слабые (А3, А4, Ах — редко). Это теоретическое понятие имеет значение для переливания крови и может вызвать несчастные случаи при отнесении донора А2 (II) к группе 0 (I) или донора А2В (IV) — к группе В (III), поскольку слабая форма антигена А иногда обуславливает ошибки при определении группы крови системы АВO. Правильное определение слабых вариантов антигена А может требовать повторных исследований со специфическими реагентами.
Правильное определение слабых вариантов антигена А может требовать повторных исследований со специфическими реагентами.
Снижение или полное отсутствие естественных агглютининов альфа и бета иногда отмечается при иммунодефицитных состояниях:
- новообразования и болезни крови — болезнь Ходжкина, множественная миелома, хроническая лимфатическая лейкемия;
- врождённые гипо- и агаммаглобулинемия;
- у детей раннего возраста и у пожилых;
- иммуносупрессивная терапия;
- тяжёлые инфекции.
Трудности при определении группы крови вследствие подавления реакции гемагглютинации возникают также после введения плазмозаменителей, переливания крови, трансплатации, септицемии и пр.
Наследование групп крови
В основе закономерностей наследования групп крови лежат следующие понятия. В локусе гена АВО возможны три варианта (аллеля) — 0, A и B, которые экспрессируются по аутосомно-кодоминантному типу. Это означает, что у лиц, унаследовавших гены А и В, экспрессируются продукты обоих этих генов, что приводит к образованию фенотипа АВ (IV). Фенотип А (II) может быть у человека, унаследовавшего от родителей два гена А или гены А и 0. Соответственно фенотип В (III) — при наследовании двух генов В или В и 0. Фенотип 0 (I) проявляется при наследовании двух генов 0. Таким образом, если оба родителя имеют II группу крови (генотипы AА или А0), кто-то из их детей может иметь первую группу (генотип 00). Если у одного из родителей группа крови A (II) с возможным генотипом АА и А0, а у другого B (III) с возможным генотипом BB или В0 — дети могут иметь группы крови 0 (I), А (II), B (III) или АВ (IV).
В локусе гена АВО возможны три варианта (аллеля) — 0, A и B, которые экспрессируются по аутосомно-кодоминантному типу. Это означает, что у лиц, унаследовавших гены А и В, экспрессируются продукты обоих этих генов, что приводит к образованию фенотипа АВ (IV). Фенотип А (II) может быть у человека, унаследовавшего от родителей два гена А или гены А и 0. Соответственно фенотип В (III) — при наследовании двух генов В или В и 0. Фенотип 0 (I) проявляется при наследовании двух генов 0. Таким образом, если оба родителя имеют II группу крови (генотипы AА или А0), кто-то из их детей может иметь первую группу (генотип 00). Если у одного из родителей группа крови A (II) с возможным генотипом АА и А0, а у другого B (III) с возможным генотипом BB или В0 — дети могут иметь группы крови 0 (I), А (II), B (III) или АВ (IV).
Показания:
- Определение трансфузионной совместимости.
- Гемолитическая болезнь новорожденных (выявление несовместимости крови матери и плода по системе АВ0).

- Предоперационная подготовка.
- Беременность (подготовка и наблюдение в динамике беременных с отрицательным резус-фактором).
Результат исследования:
- 0 (I) — первая группа;
- A (II) — вторая группа;
- B (III) — третья группа;
- AB (IV) — четвертая группа крови.
Основной поверхностный эритроцитарный антиген системы резус, по которому оценивают резус-принадлежность человека.
Антиген Rh — один из эритроцитарных антигенов системы резус, располагается на поверхности эритроцитов. В системе резус различают 5 основных антигенов. Основным (наиболее иммуногенным) является антиген Rh (D), который обычно подразумевают под названием резус-фактор. Эритроциты примерно 85% людей несут этот белок, поэтому их относят к резус-положительным (позитивным). У 15 % людей его нет, они резус-отрицательны (негативны).
У 15 % людей его нет, они резус-отрицательны (негативны).
Наличие резус-фактора не зависит от групповой принадлежности по системе АВ0, не изменяется в течение жизни, не зависит от внешних причин. Он появляется на ранних стадиях внутриутробного развития, у новорожденного уже обнаруживается в существенном количестве.
Определение резус-принадлежности крови применяется в общей клинической практике при переливании крови и ее компонентов, а также в гинекологии и акушерстве при планировании и ведении беременности.
Несовместимость крови по резус-фактору (резус-конфликт) при переливании крови наблюдается, если эритроциты донора несут Rh-агглютиноген, а реципиент является резус-отрицательным. В этом случае у резус-отрицательного реципиента начинают вырабатываться антитела, направленные против резус-антигена, приводящие к разрушению эритроцитов. Переливать эритроциты, плазму и особенно цельную кровь от донора к реципиенту нужно строго соблюдая совместимость не только по группе крови, но и по резус-фактору.
Присутствие и титр уже имеющихся в крови антител к резус-фактору и других аллоиммунных антител можно определить, указав тест «анти-Rh (титр)».
Определение группы крови, резус-фактора, а также наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка, который может приводить к гемолитической болезни новорожденных. Возникновение резус-конфликта и развитие гемолитической болезни новорожденных возможно в том случае, если беременная резус-отрицательна, а плод — резус-положителен. В случае, если у матери Rh +, а плод — резус-отрицателен, опасности гемолитической болезни для плода нет.
Гемолитическая болезнь плода и новорожденных — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь может быть обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, N-, Kell-, Duffy-, Kidd-антигенам (по статистике 98% случаев гемолитической болезни новорожденных связаны с D-резус-антигеном). Любой из указанных антигенов, проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Любой из указанных антигенов, проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности и переливания крови женщине без учёта резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или повторных выкидышей.
В настоящее время существует возможность медицинской профилактики развития резус-конфликта и гемолитической болезни новорожденных. Все резус-отрицательные женщины в период беременности должны находиться под наблюдением врача. Необходимо также контролировать в динамике уровень резус-антител. Есть небольшая категория резус-положительных лиц, способных образовывать анти-резус антитела. Это лица, эритроциты которых характеризуются значительно сниженной экспрессией нормального антигена Rh на мембране («слабый» D, Dweak) или экспрессией измененного антигена Rh (частичный D, Dpartial). Эти слабые варианты антигена D в лабораторной практике объединяют в группу Du , частота которой составляет около 1%. Реципиенты, содержание антиген Du, должны быть отнесены к резус-отрицательным и им должна быть перелита только резус-отрицательная кровь, так как нормальный антиген D может вызвать у таких лиц иммунный ответ. Доноры с антигеном Du квалифицируются как резус-положительные доноры, так как переливание их крови может вызвать иммунный ответ у резус-отрицательных реципиентов, а в случае предшествующей сенсибилизации к антигену D — и тяжёлые трансфузионные реакции.
Эти слабые варианты антигена D в лабораторной практике объединяют в группу Du , частота которой составляет около 1%. Реципиенты, содержание антиген Du, должны быть отнесены к резус-отрицательным и им должна быть перелита только резус-отрицательная кровь, так как нормальный антиген D может вызвать у таких лиц иммунный ответ. Доноры с антигеном Du квалифицируются как резус-положительные доноры, так как переливание их крови может вызвать иммунный ответ у резус-отрицательных реципиентов, а в случае предшествующей сенсибилизации к антигену D — и тяжёлые трансфузионные реакции.
Наследование резус-фактора крови. В основе закономерностей наследования лежат следующие понятия. Ген, кодирующий резус-фактор D (Rh), является доминантным, аллельный ему ген d — рецессивным (резус-положительные люди могут иметь генотип DD или Dd, резус-отрицательные — только генотип dd). Человек получает от каждого из родителей по 1 гену — D или d, и у него возможны, таким образом, 3 варианта генотипа — DD, Dd или dd. В первых двух случаях (DD и Dd) анализ крови на резус-фактор даст положительный результат. Только при генотипе dd человек будет иметь резус-отрицательную кровь.
В первых двух случаях (DD и Dd) анализ крови на резус-фактор даст положительный результат. Только при генотипе dd человек будет иметь резус-отрицательную кровь.
Рассмотрим некоторые варианты сочетания генов, определяющих наличие резус-фактора, у родителей и ребёнка:
- отец резус-позитивный (гомозигота, генотип DD), у матери резус-отрицательный (генотип dd). В этом случае все дети будут резус-положительными (вероятность 100%).
- отец резус-позитивный (гетерозигота, генотип Dd), мать резус-отрицательная (генотип dd). В этом случае вероятность рождения ребёнка с отрицательным или положительным резусом одинакова и равна 50 %.
- отец и мать гетерозиготы по данному гену (Dd), оба резус-позитивны. В этом случае возможно (с вероятностью около 25%) рождение ребёнка с отрицательным резусом.
Результат:
- Rh (+) положительная;
- Rh (-) отрицательная.

Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
11121314151617
18192021222324
25262728293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Антигены и антитела.
 Группы крови по системе AB0. Подбор крови по фенотипу
Группы крови по системе AB0. Подбор крови по фенотипу1. Остроумова В.Р.
Антигены и антитела.Группы крови по системе
AB0
Подбор крови по фенотипу
Остроумова В.Р.
• Антиген-вещество белкового или
углеводного происхождения
находящиеся на поверхности
клеток (тромбоцитов, лейкоцитов,
эритроцитов, белков плазмы).
• Антитело- это белок
(иммуноглобулин) который
циркулирует в плазме крови и
связывается с антигеном,
вызывавшим его образование.
• Поверхность эритроцитов,
покрыта антигенами.
Идентифицировано более 400
эритроцитарных антигенов –О, А,
В, D, С, с, Е, е, М, N, S, Келл(К),
Daffy( Fy), Кидд(Jk), Lutheran (Lu),
Diego (Di) Lewis (Le), и т.д
4. Антигены эритроцита
Антигены эритроцитов человека являютсяструктурными образованиями, расположенными
на внешней поверхности мембраны
эритроцитов,обладающими способностью
взаимодействовать с соответствующими
антителами и образовывать комплекс антигенантитело.
 Антигены эритроцитов наследуются от
Антигены эритроцитов наследуются отродителей.
При попадании в организм антигена,
отсутствующего у данного индивида, создаются
предпосылки для выработки антител и развития
аллосенсибилизации. Синтез антител может
наблюдаться в ответ на гемотрансфузии или
беременность. При последующих
гемотрансфузиях может произойти
взаимодействие антигенов эритроцитов доноров и
антител реципиентов in vivo, что приводит к
посттрансфузионному осложнению.
• Клиническая роль многочисленных антигенов
эритроцитов крови человека
неодинакова.Клиническое значение антигенов
определяется способностью аллоантител к
данным антигенам вызывать разрушение
эритроцитов в организме реципиента.В этом
аспекте первостепенное клиническое значение
имеют антигены системы АВО и Резус.Меньшее
клиническое значение других антигенов
эритроцитов объясняется низкой
иммуногенностью антигенов и, соттветственно,
редкой выработкой антител.

7. Антитела
Изоиммунные- врожденные антителаИммуные антитела возникают вследствии
1.Изоиммунизации при парентеральном
поступлении в организм
несовместимого в отношении
антигена,при ошибочном переливании
крови, несовместимым по системе
АВО,резус-фактору (С,с,Е,е) и другим
антигенам М,N, S,
Келл,Кидд,Даффи,Левис и т.д.
2.При проведении некоторых
прививок,иммунизаций
• Иммуные антитела различают полные и
неполные антитела.
• Полные антитела
Относятся преимущественно к классу IgМ
• Неполные антитела принадлежат в основном к
иммуноглобулинам класса IgG, они способны
фиксироваться на эритроцитах, не вызывая
аглютинации. Аглютинация (склеивание)
происходит только в присутствии
протеолитических ферментов,коллоидных
растворов,введение антиглобулиновой
сыворотки.
9. Антитела против антигенов эритроцитов класса- М
класс IgМ• У лиц группы О- антитела к А и В,
• У лиц группы А-антитела к антигену В
• У лиц группы В-антитела к антигену А
Выявляются в солевой среде (реакция со
стандатными эритроцитами)
10.
 Антитела класса — G Резус-антитела: анти-D, антиС,антис,анти-Е, анти-е, Келл (также и к классу
Антитела класса — G Резус-антитела: анти-D, антиС,антис,анти-Е, анти-е, Келл (также и к классуIgМ)
Они выявляются непрямой реакцией
Кумбса при + 37 С, могут иметь высокий
титр при проведении реакции в
колойдной среде по сравнению с
солевой средой.
11. Иммунная гемолитическая трансфузионная реакция- АВО-несовместимость
Иммунная гемолитическаятрансфузионная реакция- АВОнесовместимость
Последствия переливания АВОнесовместимой крови может начаться
уже после введения нескольких
миллилитров крови.
Высвобождение белков комплимента
С5,С6,С7,С8,С9 ведет к разрушению
эритроцитов –гемолиз (в мембране
эритроцитов образуются ответстия)
Белки комплемента С3а,С5а запускают
воспалительный ответ (падение АД,
шок, почечная недостаточность, ДВС)
кровь донора
Группа А
Плазма реципиента
Группа
В
антитела
Реакция антиген-антитело
Активация комплимента С3а,С5а
Разрушение эритроцитов
• Даже если донорская кровь совместима
с кровью реципиента по системе АВО,
остается риск гемолитической
трансфузионной реакции при наличии в
плазме пациента других
эритроцитарных антител (С,с, Е,е, Д,
Келл, Даффи,Кидд)
• Образование антител достигает
максимум 5-7-10-25 день(повышение
титра в 3-8 ступеней )с последующим
падением титра.
 Разрушение
Разрушениеэритроцитов может вызвать анемию и
умеренную желтуху.
• Одним из основных факторов
безопасности гемотрансфузионной
терапии является обеспечение
переливания иммунологически
совместимой среды.
• Для этого необходимо соблюдать
правила подбора крови донора и
реципиента по антигенам эритроцитов
системы АВ0 и антигенам системы
Резус, обеспечивает безопасность 9598 % гемотрансфузий.
15. Группы крови
• ОabАb
Ва
АВо
О, А1, А2, Ах….. В1, В3,Вх….
А1В, А2В….
Клинически значемые:
О, А, А2, В, АВ, А2В
16. Определение группы перекрестным методом
• Моноклональные антитела»цоликлоны»- типирующие реагентынового поколения для определения
антигенов эритроцитов человека.
Получаемые из веществ семян
некоторых видов растений (Sophora
Japonica) и экстратов бобовых растений
(Vicia cracca, Dolichos biflorus) , а также
животного происхождения (икринок
лосося)
18.
 Цоликлоны для определения фенотипа крови Группа
Цоликлоны для определения фенотипа крови Группакрови
ЦОЛИКЛОНЫ
АнтиА1
Стандартные
Эритроциты+сывор
тка
Анти-А
Анти-В
АнтиАВ
О
—
—
—
В
—
+
О(I)
А(II)
В(III)
—
+
+
+
—
+
—
А
+
+
—
+
—
—
+
А2
—
+
—
+
—
—
+
АВ
+
+
+
+
—
—
—
А2В
—
+
+
+
—
—
—
Фенотип и генотип.
• Термины фенотип и генотип имеют
различное определение.Международное
общество переливания крови установило
определенные правила для обозначения
фенотипов антигенов.Понятие фенотипа
обозначает антигены, присутствующие или
отсутствующие на эритроцитах индивида,
что определяется по взаимодействию
исследуемых эритроцитов с
сыворотками.Эритроциты можно
фенотипировать,но нельзя
генотипировать.
 До тех пор пока не
До тех пор пока невыполнено семейное исследование,генотип
всегда интерпретируется из фенотипа.
21. Система резус-фактор
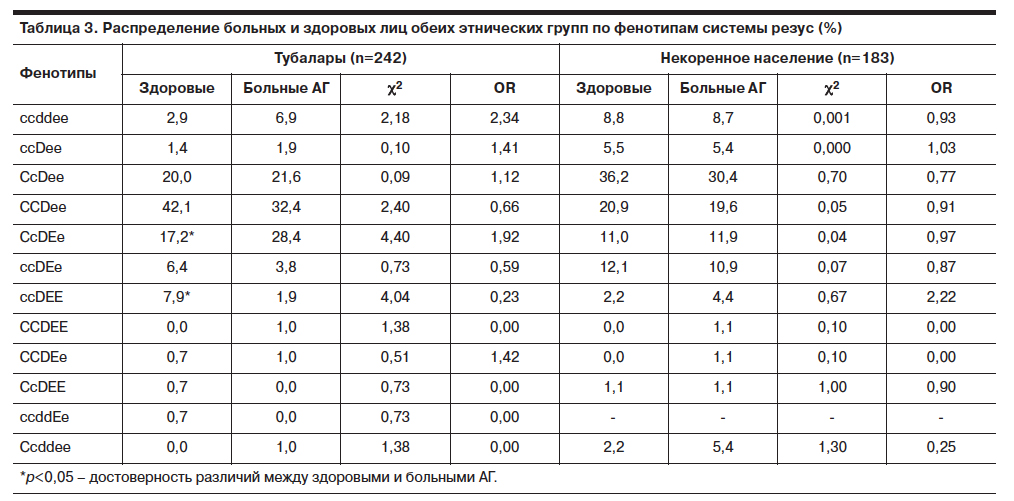
В этой системе существует 5 эритроцитарныхантигенов: С , с , D , Е , е
С
с
Е
е
D
фенотип
+
+
+
+
+
СсDЕе
+
—
+
—
+
ССDЕЕ
—
+
—
+
+
ссDее
—
+
—
+
—
ссddee (трактуется как
резус отрицательная)
+
+
—
+
—
Ccdее (трактуется как
резус положительная)
22. Совместимость по антигенам АВО
Кровь донора
А
А2
А2
А
исключить
АВ
А2В
А2В
АВ исключить
Больной
А
А
А2
А2
АВ
АВ
А2В
А2В
23. Совместимость по фенотипу
Больной1.cсdee
2.Ссdee
3.ССDee
4.ссDee
5 CcDEE
6 CcDEe
кровь
cсdee,
ccdee, Ccdee
CCDee
ccDee, ccdee
CcDEE, ccDEE, CCDEE
CcDEE ccDEE CCDee
ccdee Ccdee (любой ф-п)
24.
 Редкие и трудноопределяемые группы крови • Подгруппы со слабым вариантами
Редкие и трудноопределяемые группы крови • Подгруппы со слабым вариантамиантигенов А и В- не выявляются или
дают сомнительный результат.
• Гиперпластические группы –наличие
дополнительного серологического
признака А1bа2,A2ba1, А2Ва1 и т.д
• Кровяные химеры- О+А, О+В и т.д.
• Дефективные группы – Оа, Оb, Ао, Во
• Бомбейская группа- отсутствие в
эритроцитах всех антигенов системы
АВО-антигенов О, А, В, Н
• Для выявления редких и
трудноопределяемых применяют
перекресный способ тестирования
используя моноклоналные
антитела(цоликлоны) и стандартные
эритроциты О,А,В групп.
• Если у донора отмечается отличие от
стандарта по серологической формуле,
такую кровь переливать нельзя!
• Если у реципиента отмечается отличие
крови от стандарта по серологической
формуле, требуется подбор по «тестпанели антигенов» (в центрах крови)
26. 10. Причины ошибок при определении группы крови, резус-принадлежности и проведении проб на индивидуальную совместимость и меры
ихпредупреждения
38.
 Ошибки при определении группы крови,
Ошибки при определении группы крови,резус-принадлежности и проведении проб на
индивидуальную совместимость возникают при
нарушении техники выполнения исследования
или в случаях трудноопределимых групп крови.
11. Технические ошибки
39. Ошибочный порядок расположения реагентов.
При правильной оценке результата в каждом
отдельно взятом реагенте можно сделать
неправильное заключение о группе крови и
резус-принадлежности если нарушен порядок
расположения реагентов в штативе или на
пластинке. Каждый раз при определении группы
крови следует проверять расположение
реагентов, а также визуально оценивать их
качество, исключать использование
помутневших, частично высохших реагентов,
реагентов с истекшим сроком годности.
40. Определение группы крови производят при
температуре не ниже +15 С, поскольку исследуемая
кровь может содержать холодовые агглютинины,
вызывающие неспецифическое склеивание
эритроцитов при пониженной температуре.
 Видимость
Видимостьагглютинации может создавать образование «монетных
столбиков». Неспецифическая агрегация эритроцитов
распадается после добавления 1-2 капель
физиологического раствора и покачивания пластинки.
При повышенной температуре агглютинины утрачивают
активность, поэтому определение группы крови
производят при температуре не выше +25 С.
41. Оптимальное для реакции агглютинации
соотношение эритроцитов и тестовых реагентов — 1:10
при использовании гемагглютинирующих сывороток, 23:10 при использовании моноклональных реагентов.
При значительном избытке эритроцитов агглютинация
может быть не замечено, а особенно в тех случаях,
когда агглютинационные свойства эритроцитов
снижены — подгруппа А2. При недостаточном количестве
эритроцитов агглютинация медленно появляется, что
также может привести к неправильной трактовке
результатов.
42. Агглютинация эритроцитов появляется в течение
первых 10 секунд, однако наблюдение за ходом
реакции следует проводить не менее 5 минут, особенно
в тех каплях, где появилась агглютинация.
 Это
Этопозволяет выявить слабый антиген А2,
характеризующийся замедленной агглютинацией.
28. Руководящие принципы для распознания осложнения трансфузионных осложнений
осложнениепроявления
Причина несовместимостьантитела к лейкоцитам в плазме
Недостаточность функции легких
возникает в течении 1-4 часов после
начала трансфузии. На
рентгеновском снимке диффузное
затемнение легких
Посттрансфузионная пурпура (при Через 5-10 дней после трансфузии.
переливании тромбоцитов,чаще у Тромбоцитопения.Повышенная
женщин)
тенденция к кровоточивости
Гемолитическая при переливании
ЭМ, СЗП,ЗП. Причина
несовместимость по АВО,
резус,Кидд,Келл,Даффи
Немедленные,возникают во время
или несколько часов после
трансфузии
Отстроченные возникают через 5-10
дней после трансфузии (температура,
анемия,желтуха.увеличение
содержания билирубина)
Спасибо за внимание!!!
Фенотипирование и генотипирование антигенов красных кровяных телец
Анупам Митра, MBBS, резидент по патологии, PGY2
Сара Барнхард, доктор медицинских наук, директор службы переливания крови
Основная цель тестирования перед переливанием — предоставить пациенту наиболее совместимую кровь, чтобы свести к минимуму риск гемолитических реакций при переливании. Тип и скрининг — это первые два теста, которые требуются в качестве теста перед переливанием крови. Как следует из названия, это два теста: «тип» — для определения типа ABO и резус-фактора эритроцитов пациента и «скрининг» — для обнаружения наличия антител против антигена (ов) эритроцитов.Образование комплекса антитело / антиген зависит от температурного диапазона. Антитела против антигенов эритроцитов оптимально реагируют при теплой (при температуре тела или выше) или на холоде (ниже температуры тела) тепловых амплитудах. Обычно приобретаются теплые антитела типа IgG. Они реагируют при температуре 37 ° C или выше. Холодные антитела обычно встречаются в природе и относятся к типу IgM. Они реагируют ниже 37С. 1
Тип и скрининг — это первые два теста, которые требуются в качестве теста перед переливанием крови. Как следует из названия, это два теста: «тип» — для определения типа ABO и резус-фактора эритроцитов пациента и «скрининг» — для обнаружения наличия антител против антигена (ов) эритроцитов.Образование комплекса антитело / антиген зависит от температурного диапазона. Антитела против антигенов эритроцитов оптимально реагируют при теплой (при температуре тела или выше) или на холоде (ниже температуры тела) тепловых амплитудах. Обычно приобретаются теплые антитела типа IgG. Они реагируют при температуре 37 ° C или выше. Холодные антитела обычно встречаются в природе и относятся к типу IgM. Они реагируют ниже 37С. 1
1. Что такое фенотипирование эритроцитов?
Фенотип эритроцитов (фенотипирование эритроцитов) относится к определению типа антигенов, присутствующих в эритроцитах.Тип ABO / Rh в «Типе и скрининге» применяется ко всем пациентам, нуждающимся в переливании крови. Однако также может быть выполнен расширенный фенотип антигена. Это определяет экспрессию антигена, отличного от антигенов A, B или D. Расширенное фенотипирование по антигену красных кровяных телец почти всегда проводится как рефлекторный тест. То есть расширенное фенотипирование обычно дополняет рутинное предтрансфузионное тестирование у пациентов с клинически значимыми аллоантителами или у пациентов, которые находятся в группе риска по выработке клинически значимых аллоантител.Четыре варианта панелей расширенного фенотипирования эритроцитов выполняются в лаборатории служб переливания крови — «холодовой фенотип»; «Полный теплый фенотип»; «Полный фенотип» и «ограниченный фенотип».
Однако также может быть выполнен расширенный фенотип антигена. Это определяет экспрессию антигена, отличного от антигенов A, B или D. Расширенное фенотипирование по антигену красных кровяных телец почти всегда проводится как рефлекторный тест. То есть расширенное фенотипирование обычно дополняет рутинное предтрансфузионное тестирование у пациентов с клинически значимыми аллоантителами или у пациентов, которые находятся в группе риска по выработке клинически значимых аллоантител.Четыре варианта панелей расширенного фенотипирования эритроцитов выполняются в лаборатории служб переливания крови — «холодовой фенотип»; «Полный теплый фенотип»; «Полный фенотип» и «ограниченный фенотип».
Как следует из названия, «холодовой фенотип» — это панель, которая определяет экспрессию всех антигенов с общими соответствующими реагирующими на холод антителами (M, N, P, Lea и Leb). «Полный теплый фенотип» — это панель, которая определяет экспрессию всех антигенов с общими клинически значимыми соответствующими антителами, которые реагируют тепло (K, E, e, C, c, Fya, Fyb, Jka, Jkb, S и s) . «Полный фенотип» — это панель, которая определяет экспрессию всех антигенов с общими соответствующими антителами, либо с теплой реакцией (K, E, e, C, c, Fya, Fyb, Jka, Jkb, S и s), либо с холодной реакцией ( М, Н, П, Леа и Леб). В некоторых случаях выполняется панель «ограниченного фенотипа» для обнаружения одного или нескольких специфических антигенов. Фенотипирование эритроцитов всегда выполняется из образца перед переливанием, чтобы избежать помех от переливаемых эритроцитов. 2-3
«Полный фенотип» — это панель, которая определяет экспрессию всех антигенов с общими соответствующими антителами, либо с теплой реакцией (K, E, e, C, c, Fya, Fyb, Jka, Jkb, S и s), либо с холодной реакцией ( М, Н, П, Леа и Леб). В некоторых случаях выполняется панель «ограниченного фенотипа» для обнаружения одного или нескольких специфических антигенов. Фенотипирование эритроцитов всегда выполняется из образца перед переливанием, чтобы избежать помех от переливаемых эритроцитов. 2-3
1.1 Показания для выполнения полного теплого фенотипа по антигену эритроцитов
Полный теплый фенотип может быть выполнен в нескольких различных условиях. 2-3
1.1.1 Для предотвращения образования антител к эритроцитам — пациенты, получающие хронические переливания крови, подвергаются многократному воздействию нескольких чужеродных антигенов эритроцитов в течение длительного периода времени, что увеличивает возможность выработки новых аллоантител. Таким образом, выполнение полного теплового фенотипа перед переливанием позволяет лаборатории служб переливания крови предоставить этим пациентам единицы, полностью или частично соответствующие фенотипу, чтобы предотвратить развитие аллоантител (а).Клинические показания для полного фенотипа теплых эритроцитов перед переливанием следующие:
.- Недавно диагностированная серповидно-клеточная анемия
- Пациенты с серповидно-клеточной анемией, у которых ранее не было полного теплового фенотипа
- Другие гемоглобинопатии, зависимые от переливания крови
1.1.2 Для предотвращения образования дополнительных антител к эритроцитам — пациенты с аллоантителами эритроцитов подвергаются повышенному риску развития других аллоантител, особенно если они подвергаются воздействию большего количества иммуногенных антигенов.Выполнение фенотипирования антигена эритроцитов после выявления аллоантител имеет решающее значение для обеспечения наиболее подходящих переливаний и предотвращения образования дополнительных антител. Это выполняется либо полным теплым фенотипом, либо ограниченным фенотипом на основе пути тестирования рефлексов.
1.1.3 Для подготовки к приемам лекарств, которые мешают проведению всех анализов. У пациентов, получающих анти-CD47 (например, Hu5F9), лекарство, как известно, мешает скринингу на антитела к эритроцитам. Полный теплый фенотип выполняется перед введением лекарства, чтобы сделать возможным переливание по фенотипу в течение периода, когда лекарство вводится, когда новые антитела не могут быть обнаружены, и, таким образом, сделать возможным безопасное переливание.
1.2 Показания для проведения холодового фенотипа антигена эритроцитов
Фенотипирование антигенов эритроцитов пациента, соответствующих обычным антителам, которые реактивны к холоду, обычно выполняется, когда у пациента выработаны антитела, реагирующие на холод. Общие сценарии включают анти-М (встречающееся в природе антитело, часто встречающееся у детей) или анти-Льюис (встречающееся в природе антитело, распространенное при беременности).
1.3 Показания для выполнения полного фенотипа по антигену эритроцитов
Полный фенотип выполняется, когда у пациента есть несколько антител, которые реагируют как на холод, так и на тепло.Это определяет антигенный профиль пациента для антигенов K, E, e, C, c, Fya, Fyb, Jka, Jkb, S, s, M, N, Lea и Leb.
1.4 Признак наличия фенотипа с ограниченным антигеном
Ограниченный или частичный фенотип определяет один или несколько специфических антигенов эритроцитов вместо полного или полного фенотипа. Это делается в следующих ситуациях —
1.4.1 Чтобы помочь исследовать специфичность антител (у пациентов вырабатываются антитела против антигенов, которых им не хватает).Если панель антител идентифицирует одно или несколько аллоантител с неясной специфичностью, определение фенотипа ограниченного антигена может помочь определить специфичность антитела (ов).
1.4.2 У любого пациента, у которого выработалось антитело, лаборатория выполняет фенотипирование на соответствующий антиген, а также на любые более иммуногенные антигены.
1.4.3 Оценить риск гемолитической болезни новорожденных. Типирование антигена эритроцитов отцовской или пуповинной крови определяет экспрессию антигена, которая соответствует материнскому антителу.
1.4.4 Редко выполняется после переливания для определения ожидаемого восстановления эритроцитов. Определение собственного фенотипа эритроцитов пациента в циркулирующих эритроцитах после переливания и сравнение его с типированием антигена перед трансфузией может помочь в определении восстановления эритроцитов.
1.5 Сбор образцов
Кровь собирают в пробирку с ЭДТА (верхняя часть бледно-лиловая). ЭДТА хелатирует кальций и, таким образом, действует как антикоагулянт. Плазма в образце используется для тестирования на антитела, а эритроциты — для фенотипирования антигена.
1.6 Время анализа и методика
Обычно для перечисленных фенотипических панелей требуется время тестирования 1,5–2 часа. Для определения фенотипа некоторых антигенов требуется длительное время инкубации, в то время как другие определяются быстро. Анализы проводят с использованием известных моноклональных или поликлональных антисывороток, инкубированных с эритроцитами пациента. Реагент Кумбса требуется при использовании антисыворотки на основе моноклональных IgG для индукции агглютинации и определения наличия антигена.
1,7 Каковы клинические последствия?
У пациентов, которым требуется расширенное сопоставление фенотипа антигена, профиль антигена любых донорских единиц, которые переливаются, совпадает с ОТРИЦАТЕЛЬНЫМИ антигенами в профиле антигена пациента в дополнение к любым антителам. Если пациенту не делают хроническое переливание крови и одно или несколько антител обнаруживаются впервые, службы переливания проведут расширенное типирование антигена для высокоиммуногенных антигенов и предоставят упакованные эритроциты от донора, у которого отсутствуют соответствующие антигены.Это позволит избежать гемолитической трансфузионной реакции и образования новых антител. Если лечение пациента потребует хронических переливаний на протяжении всей жизни, перед всеми переливаниями выполняется фенотип полного теплого эритроцита. Иногда бывает трудно сопоставить отрицательный профиль антигена, и патологам службы переливания крови необходимо подвергнуть риску стратификацию антигенов по иммуногенности, чтобы найти наилучшее из имеющихся совпадений. Выполняя это рефлекторное тестирование и получая единицы эритроцитов донора, соответствующие расширенному фенотипу, мы предотвращаем гемолиз текущих антител и предотвращаем образование новых антител.
1.8 Ограничения фенотипирования эритроцитов
Фенотипирование антигена эритроцитов невозможно выполнить в определенных ситуациях:
1.8.1 Тест Кумбса положительный (DAT +). При аутоиммунной гемолитической анемии (АИГА) эритроциты пациента покрыты оболочкой IgG или IgM, что является аутоиммунным феноменом. Присутствие IgG / IgM вызывает ложноположительный фенотипический тест, и, таким образом, профиль антигена не может быть надежно определен.
1.8.2 Больному недавно сделали переливание крови.Фенотип антигена эритроцитов определяется на образце собственных эритроцитов пациента. В условиях недавнего переливания циркулирующие эритроциты состоят из смеси эритроцитов пациента и эритроцитов донора. Таким образом, фенотипирование не будет отражать нативные эритроциты пациента. В этой ситуации очень важен клинический анамнез переливания.
1.8.3 Эритроциты покрыты лекарством и вызывают интерференцию (анти-CD47). Если эритроциты пациента покрыты лекарством, то антигенный профиль не может быть надежно определен.
2. Что такое генотипирование эритроцитов?
Как следует из названия, экспрессия антигена эритроцитов также может быть определена с помощью генетического тестирования. Текущее тестирование позволяет выделить геномную ДНК пациента и выполнить генотипирование антигена эритроцитов для прогнозирования фенотипа антигена эритроцитов для выбранных антигенов. Это тест на отправку, который в настоящее время проводится в лабораториях Versiti. Доступны две панели — панель генотипирования эритроцитов (44 антигена) и панель STAT (24 антигена). 4
2.1 Показание к получению генотипа антигена эритроцитов —
- Антигены эритроцитов пациента не могут быть надежно фенотипированы из-за недавнего переливания крови
- До применения значительно мешающих препаратов (таких как анти-CD47)
- Для оценки генетических изменений, таких как частичные антигены, которые могут объяснять аллоантитела, но положительное фенотипирование
- В редких случаях, когда образуются необычные антитела и требуется определение профиля антигена, выходящего за рамки упомянутых общих антигенов.
2.2 Сбор проб
Кровь с ЭДТА (бледно-лиловая) — 5 мл
2.3 Методология и время оборота
Для 44-панельного анализа 72 зонда ПЦР-гибридизации используются в 36 полимеразных цепных реакциях для идентификации аллелей, связанных с 44 антигенами группы крови. Для панели STAT 32 зонда ПЦР-гибридизации используются в 16 полимеразных цепных реакциях для идентификации аллелей, связанных с 24 антигенами группы крови. 4 Время обработки панели с 44 антигенами составляет 2-5 дней, тогда как STAT (24- панель антигена) время оборота панели составляет 24-48 часов.
2.4 Ограничения
Генотип эритроцитов определяется с использованием специальных зондов против аллелей антигена эритроцитов. Таким образом, никакие мутации за пределами целевой области не будут обнаружены. Новые мутации, приводящие к измененной или частичной экспрессии антигена и нулевым фенотипам, могут не обнаруживаться. Результаты, полученные от реципиентов трансплантата гемопоэтических стволовых клеток, могут не совпадать с генотипом, полученным из других тканей. 4
Артикул:
- Харменнинг, Дениз.Современные методы банка крови и переливания крови, 5-е издание. Филадельфия, Пенсильвания, FA Davis Company, 2005.
- Fung MK, Grossman BJ, Hillyer CD, Westhoff CM Editors. Техническое руководство AABB, 18-е издание. Bethesda MD, AABB Press, 2014. .
- Рид М.Э., Ломас-Фрэнсис С., Олссон М.Л. Книга фактов об антигенах группы крови, 3-е издание. Лондон Великобритания, Эльзевир. 2012.
- Панели генотипирования красных кровяных телец. Лаборатории Версити, Центр крови Висконсина. Информация на сайте: https://www.versiti.org / Custom / Files / Versiti / 68 / 682cf64b-4508-4714-ae29-7f1a414b7a1e.pdf
Группа крови ABO — группы крови и антигены эритроцитов
Открытие группы крови ABO более 100 лет назад вызвало большой ажиотаж. До этого предполагалось, что вся кровь одна и та же, и часто трагедия последствия переливания крови не изучены. В нашем понимании Группа ABO росла, не только мир переливания крови стал большим делом безопаснее, но теперь ученые могут изучить одну из первых человеческих характеристик, доказанных быть унаследованным.Группа крови человека по системе ABO использовалась адвокатами в исках об установлении отцовства, полицией в судебной медицине и антропологами в изучении различных населения.
Антигены группы крови ABO по-прежнему имеют первостепенное значение при переливании медицина — они являются наиболее иммуногенными из всех антигенов группы крови. Наиболее частой причиной смерти от переливания крови является канцелярская ошибка, при которой переливается кровь несовместимого типа АВО. Антигены группы крови ABO также по-видимому, играли важную роль на протяжении всей нашей эволюции, потому что частоты разные группы крови ABO различаются среди разных групп населения, что позволяет предположить, что конкретная группа крови давала преимущество выбора (например,g., сопротивление против инфекционное заболевание.)
Однако, несмотря на их очевидную клиническую важность, физиологические функции Антигены группы крови ABO остаются загадкой. Люди с общей группой крови O не экспрессируют ни антиген A, ни B, и они совершенно здоровы. Многочисленные были сделаны ассоциации между конкретными фенотипами ABO и повышенным восприимчивость к болезням. Например, фенотип ABO был связан с язвы желудка (чаще встречаются у лиц группы O) и рак желудка (чаще встречаются в группе А особей).Другое наблюдение: люди с группой крови O имеют более низкий уровень фактора фон Виллебранда (vWF), который является белком участвует в свертывании крови.
Справочная информация
История
В начале 20 века австрийский ученый Карл Ландштайнер, отметил, что эритроциты некоторых людей были агглютинированы сывороткой из другие лица. Он отметил паттерны агглютинации и показал эту кровь можно было разделить на группы.Это ознаменовало открытие первого система группы крови, ABO, и принесла Ландштейнеру Нобелевскую премию.
Ландштейнер объяснил, что реакции между эритроцитами и сывороткой связаны между собой. на наличие маркеров (антигенов) на эритроцитах и антител в сыворотке крови. Агглютинация происходила, когда антигены эритроцитов связывались антителами в сыворотка. Он назвал антигены A и B, и в зависимости от того, какой антиген, RBC выражено, кровь принадлежала либо к группе крови А, либо к группе крови В.Треть группа крови содержала эритроциты, которые реагировали так, как будто им не хватало свойств A и B, и эта группа позже была названа «O» после немецкого слова «Ohne», которое означает «без». В следующем году к группе крови была добавлена четвертая группа крови AB. Система групп крови АВО. Эти эритроциты экспрессировали антигены как А, так и В.
В 1910 году ученые доказали, что антигены эритроцитов передаются по наследству и что A и антигены B наследуются кодоминантно по сравнению с O. путаница в том, как определялась группа крови человека, но загадка была решена в 1924 году с помощью «трехаллельной модели» Бернштейна.
Антигены группы крови ABO кодируются одним генетическим локусом, локусом ABO, который имеет три альтернативные (аллельные) формы — A, B и O. Дочерний получает один из трех аллелей от каждого родителя, что дает шесть возможных генотипы и четыре возможные группы крови (фенотипы).
Номенклатура
Количество антигенов группы крови ABO: 4
Символ ISBT: ABO
Номер ISBT: 001
Символ гена: ABO
Группа гена: ABO Трансфераза, α1,3-N-ацетилгалактозаминилтрансфераза; В-трансфераза, α1,3-галактозилтрансфераза)
Базовая биохимия
Фенотипы ABO
Четыре основных фенотипа ABO — это O, A, B и AB.После того, как было обнаружено, что кровь эритроциты группы А по-разному реагировали на конкретное антитело (позднее названное anti-A1) группа крови была разделена на два фенотипа: A 1 и А 2 . Эритроциты с фенотипом A 1 реагируют с анти-A1 и составляют около 80% группы крови А. Эритроциты с фенотипом A 2 не реагируют с анти-A1 и составляют около 20% группы крови A. A 1 красный клетки экспрессируют примерно в 5 раз больше антигена A, чем эритроциты A 2 , но оба типа эритроцитов вступают в реакцию с анти-A, и что касается целей переливания крови, В этом случае группы крови A 1 и A 2 являются взаимозаменяемыми.
Есть много других подгрупп группы крови А, в которых эритроциты имеют тенденцию к слабой экспрессируют антиген A, тогда как слабые варианты фенотипа группы крови B являются редко (2).
Иммунная система вырабатывает антитела против любых антигенов группы крови ABO. , а не , найдены в эритроцитах человека. Таким образом, группа A человек будет иметь антитела против B, а человек из группы B будет иметь антитела против A антитела. Группа крови O является обычным явлением, и люди с этой группой крови будут имеют в сыворотке как анти-A, так и анти-B.Группа крови АВ является наименее распространенной, и у этих людей не будет ни анти-A, ни анти-B в сыворотке.
Антитела ABO в сыворотке крови образуются естественным путем. Их производство стимулируется когда иммунная система сталкивается с «недостающими» антигенами группы крови ABO в продукты питания или в микроорганизмах. Это происходит в раннем возрасте, потому что сахара, которые идентичны или очень похожи на антигены группы крови ABO. по всей природе.
Локус ABO имеет три основные аллелические формы: A, B и O.Аллель A кодирует гликозилтрансфераза, продуцирующая антиген A (N-ацетилгалактозамин является ее иммунодоминантный сахар), а аллель B кодирует гликозилтрансферазу, которая создает антиген B (D-галактоза является его иммунодоминантным сахаром).
Посмотрите структуру антигенов A, B и O у Страйера. Биохимия
Аллель O кодирует фермент без функции, и, следовательно, ни A, ни B продуцируется антиген, оставляя основной предшественник (H-антиген) неизменным.Эти антигены включены в один из четырех типов олигосахаридной цепи, тип 2 является наиболее распространенным среди антиген-несущих молекул в мембранах эритроцитов. Некоторые из других ферментов, участвующих в ранних стадиях антигена ABO синтез также участвует в производстве антигенов группы крови Hh и Группа крови Льюиса.
Экспрессия
Хотя антигены группы крови ABO считаются антигенами эритроцитов, они фактически экспрессируются в самых разных тканях человека и присутствуют в большинстве эпителиальные и эндотелиальные клетки.
Каждый эритроцит человека экспрессирует около 2 миллионов антигенов группы крови ABO. Другая кровь клетки, такие как Т-клетки, В-клетки и тромбоциты, имеют антигены группы крови ABO которые были адсорбированы из плазмы. У лиц, которые являются секретарями, растворимая форма антигенов группы крови ABO содержится в слюне и во всех жидкости организма, кроме спинномозговой жидкости.
Ряд заболеваний может изменить фенотип человека по шкале АВО. Пациенты могут «приобрести» антиген B во время некротической инфекции, во время которой бактерии выделяют фермент в кровоток, который превращает антиген A1 в B-подобный антиген (3).В течение этого времени, пациенты не должны получать продукты крови, содержащие антиген B, потому что их сыворотки все еще будут содержать анти-B. После лечения основной инфекции группы крови пациентов возвращаются к норме.
Болезнь также может вызывать у пациентов «потерю» антигенов группы крови ABO. Любая болезнь который увеличивает потребность организма в эритроцитах, может ослабить экспрессию ABO в крови групповые антигены, например талассемия. Кроме того, антигены группы крови ABO могут быть изменен гематологическим раком, который может модифицировать сахарные цепи, несущие Антигены группы крови ABO, способствующие использованию антигенов A и B в качестве опухоли маркеры острого лейкоза, миелопролиферативных заболеваний и миелодисплазии.
Функция антигенов A и B
Функции антигенов группы крови ABO неизвестны. Лица, которым не хватает антигены A и B здоровы, что позволяет предположить, что любая функция антигенов не важно, по крайней мере, в наше время.
Заболевания, связанные с антигенами группы крови ABO
Неизвестно ни о каких заболеваниях, вызванных отсутствием экспрессии группы крови ABO антигенов, но восприимчивость к ряду заболеваний была связана с фенотип человека по АВО.Такие корреляции остаются спорными и включают наблюдение, что рак желудка чаще встречается у лиц группы А (4), тогда как желудочный и Язвы двенадцатиперстной кишки чаще встречаются у лиц группы O (5).
Установлена четкая корреляция между фенотипом ABO и уровнем двух белков, участвующих в свертывании крови; фактор VII (FVIII) и фон Фактор Виллебранда (vWF) (6). Люди группы крови O имеют примерно на 25% меньше FVIII и vWF в плазме. Это Хорошо известно, что низкие уровни FVIII и vWF являются причиной избыточного кровотечение, и, следовательно, также может быть случай, когда повышенный уровень вызывает свертывание крови более вероятно, увеличивая риск обоих артериальных (ишемическое сердце болезнь) и венозные (тромбоэмболическая болезнь) проблемы.Действительно, негруппа O было показано, что люди подвергаются повышенному риску как артериальных, так и венозная болезнь (6).
Клиническое значение антител ABO
Антитела ABO имеют большое клиническое значение по двум причинам: они являются естественными встречаются повсеместно и обладают высокой реакционной способностью.
Реакции при переливании
Обычная практика определения группы крови и перекрестного сопоставления продуктов крови должна предотвратить нежелательные трансфузионные реакции, вызванные антителами ABO.Тем не мение, канцелярская ошибка может привести к переливанию «не той крови» пациенту, ошибка, которая может привести к смерти пациента (7, 8).
Если реципиенту с группой крови O переливают эритроциты, не относящиеся к группе O, встречающиеся в природе анти-A и анти-B в сыворотке реципиента связываются с их соответствующие антигены на перелитых эритроцитах. Эти антитела фиксируют комплемент и вызывают быстрый внутрисосудистый гемолиз, вызывая острый гемолитический трансфузионная реакция, которая может вызвать диссеминированное внутрисосудистое свертывание, шок, острая почечная недостаточность и смерть.
Anti-A1 является менее значительной причиной трансфузионных реакций и не проявляется исправить дополнение.
Гемолитическая болезнь новорожденных
Большинство случаев гемолитической болезни новорожденных (ГБН), возникающих в результате АБО несовместимость не требует лечения. Случаи тяжелого гемолиза, требующие Менее распространены обменные переливания, а отек плода — редко (9).
ГБН, вызванная антителами АВО, встречается почти исключительно у младенцев с группой крови. A или B, рожденные от матерей группы O (10).Это потому, что анти-A и анти-B сформировали в группе O люди, как правило, относятся к типу IgG (и, следовательно, могут пересекать плацента), тогда как анти-A и анти-B, обнаруженные в сыворотке крови групп B и A индивидуумы, соответственно, имеют тенденцию к типу IgM. Хотя и нечасто, случаи HDN были зарегистрированы у младенцев, рожденных от матерей с группой крови A2 (11) и группой крови B (12).
ГБН имеет тенденцию к относительно легкой природе, главным образом потому, что эритроциты плода не экспрессируются. взрослые уровни антигенов A и B.Однако сила группы крови АВО плода антигены могут различаться, и, следовательно, степень гемолиза и, следовательно, тяжесть HDN может быть непредсказуемым (13). Ранние исследования показали, что раса новорожденного представляет опасность фактор развития АВО HDN (14). Однако более поздние исследования показали, что распространенность болезни необходимое лечение существенно не различается среди азиатских, чернокожих, латиноамериканских, и кавказские младенцы (15).
Фенотипированные компоненты | Кровь жизни Австралийского Красного Креста
Фенотипирование может быть выполнено для компонентов эритроцитов и тромбоцитов.
Фенотипированные компоненты используются по этим клиническим показаниям:
- Профилактика аллоиммунизации у часто переливаемых пациентов
- Обеспечение совместимых эритроцитов у пациентов с клинически значимыми антителами
Пациентам, у которых есть клинически значимые антитела или в анамнезе имеются клинически значимые антитела, следует предоставить эритроциты, отрицательные по соответствующему антигену. В таблице представлена частота отрицательных фенотипов антител, которые обычно считаются клинически значимыми.
Клинически значимая частота антигена
| Антиген | Частота отрицательного фенотипа |
|---|---|
| D | 17,9% |
| С | 47,3% |
| с | 17,5% |
| E | 71,6% |
| e | 2,4% |
| К | 90,9% |
| к | 0.4% (редко) |
| Jk a | 23,6% |
| Jk b | 26,3% |
| S | 48,0% |
| S | 9,4% |
| U | 0,01% (редко) |
| Fy a | 32,7% |
| Fy b | 19,7% |
Имеется полный список фенотипов основных групп крови
Для пациентов с неклинически значимыми антителами эритроциты не обязательно должны быть антиген-отрицательными для соответствующего антитела.
В следующей таблице представлена частота отрицательных фенотипов для тех антител, которые обычно не считаются клинически значимыми.
Клинически незначимая частота антигена
| Антиген | Частота отрицательного фенотипа |
|---|---|
| A 1 | 20% (группы А) |
| HI (в A 1 и A 1 B) | НЕТ |
| C Вт | 98% |
| КП а | 97.8% |
| M | 21,5% |
| N | 29,5% |
| п. 1 | 25,2% |
| Le a | 77,6% |
| Le b | 27,7% |
| Le a + b | 5,3% |
| Лю а | 92,3% |
| Wr и | 99,9% |
Для пациентов с редкими фенотипами эритроцитов или требованиями комбинации фенотипов Lifeblood необходимо будет найти подходящие единицы эритроцитов.Если совместимого устройства нет в наличии, Lifeblood может потребоваться:
- связаться с конкретными фенотипированными донорами для организации донорства,
- получает доступ к фенотипированным эритроцитам из замороженных запасов или
- запросить помощь в международной службе крови.
- Австралийское и Новозеландское общество переливания крови. Руководство по лабораторной практике перед переливанием крови, 5-е издание. Сидней: ANZSBT Ltd, март 2007 г.
- Национальный консультативный совет по аккредитации патологов. Требования к лабораторной практике переливания крови, 1-е издание. Канберра: NPAAC, октябрь 2008 г.
Совместимость компонентов | Австралийский Красный Крест Lifeblood
По возможности пациенты должны получать продукты крови, идентичные АВО, однако в некоторых случаях может возникнуть необходимость предоставить вместо них продукты крови, совместимые с АВО. В таблице ниже перечислены допустимые группы крови в порядке предпочтения.
| Эритроциты | Тромбоциты | Плазменные компоненты | |
|---|---|---|---|
| Первый выбор | O [а] | A [b, c] или O [c] | AB |
| Второй выбор | A [д, д] |
| Эритроциты | Тромбоциты | Плазменные компоненты | |
|---|---|---|---|
| Первый выбор | O | O | O |
| Второй выбор | A [б] | A | |
| Третий вариант | В | В | |
| Четвертый вариант | AB |
| Эритроциты | Тромбоциты | Плазменные компоненты | |
|---|---|---|---|
| Первый выбор | A | A | A |
| Второй выбор | O | B [c] или O [c] | AB |
| Третий вариант | AB | B [д] |
| Эритроциты | Тромбоциты | Плазменные компоненты | |
|---|---|---|---|
| Первый выбор | В | В | В |
| Второй выбор | O | A [b, c] или O [c] | AB |
| Третий вариант | AB | A [д] |
| Эритроциты | Тромбоциты | Плазменные компоненты | |
|---|---|---|---|
| Первый выбор | AB | AB | AB |
| Второй выбор | A или B | A [c] или B [c] | A [д] |
| Третий вариант | O | O [с] | B [д] |
[a] Если пациентка — женщина детородного возраста, O RhD-отрицательные эритроциты должны использоваться до тех пор, пока группа крови пациента не будет установлена.
[b] Тромбоциты группы A с подгруппой A2 не экспрессируют значительных количеств антигена A и, следовательно, предпочтительнее тромбоцитов другой группы A при переливании реципиентов группы O и
B.
[c] Аферезные тромбоциты, которые имеют низкий титр анти-A / B или объединенных тромбоцитов, представляют меньший риск гемолиза при переливании компонентов, несовместимых с ABO.
[d] Компоненты плазмы с низким титром anti-A / B представляют меньший риск гемолиза при переливании компонентов, несовместимых с ABO.
[e] Плазма группы А может использоваться в соответствии с политикой местного учреждения.
Клиническая информация
Вы всегда должны обращаться к политике вашей местной больницы и обращаться за советом к консультанту-гематологу, местному поставщику лабораторных услуг, специалисту по переливанию крови или ученому, когда необходимо переливание компонентов, отличных от собственной группы крови пациента, особенно в экстренных ситуациях или когда запасы ограничены или недоступны.
Несовместимые переливания крови могут привести к серьезным травмам или смерти реципиента.
Совместимость с эритроцитами
Тестирование перед трансфузией необходимо для выделения совместимых эритроцитов. Проконсультируйтесь с вашим поставщиком лабораторных услуг относительно ваших требований к образцам и формам запроса.
RhD
Группа RhD-отрицательных эритроцитов можно безопасно переливать RhD-положительным реципиентам, однако переливание RhD-отрицательным реципиентам RhD-положительных эритроцитов может привести к образованию анти-D.
Следующие группы пациентов должны получить RhD-отрицательные эритроциты:
- RhD-отрицательные пациенты с анти-D
- RhD-отрицательные женщины детородного возраста
- женщины детородного возраста с неизвестной группой крови (в экстренных случаях)
- RhD-отрицательные дети (мужчины и женщины <16 лет)
- RhD-отрицательные пациенты, которые будут получать повторные переливания или могут стать зависимыми от гемотрансфузий
Следует отметить, что некоторые региональные и небольшие столичные больницы могут содержать эритроциты с RhD-положительной реакцией группы O только для экстренного использования (например, в ситуациях, угрожающих жизни).
Kell
Система группы крови Kell сложна и содержит антигены, обладающие высокой иммуногенностью. Антитела келл-системы следует рассматривать как клинически значимые, поскольку известно, что они вызывают как реакции переливания крови, так и гемолитическую болезнь плода и новорожденного (HDFN). Австралийско-новозеландское общество переливания крови и жизненной крови выпустило совместное консенсусное заявление об использовании и распределении эритроцитов, отрицательных по Kell, в котором были сделаны следующие рекомендации:
Клинические сценарии, в которых указаны отрицательные K эритроциты (перечислены в порядке приоритета), включают:
- Любой пациент с (или в анамнезе продуцирующим) анти-K
- Переливание беременным женщинам или женщинам с детородным потенциалом с K-отрицательным фенотипом (~ 90% женщин)
- Переливание беременным женщинам или женщинам детородного возраста, которые не могут быть фенотипированы до переливания.Следует учитывать клиническую срочность переливания, и не следует откладывать экстренное переливание из-за попыток получить отрицательные единицы калия.
- Пациенты, которые будут проходить терапию даратумумабом, которые имеют отрицательный К или не могут быть фенотипированы (или генотипированы) К.
К отрицательных единиц могут быть клинически показаны в следующем сценарии:
- Пациенты, зависимые от переливания крови, у которых обнаружен K-отрицательный фенотип (~ 90% пациентов). Лаборатории могут выбрать фенотип, но могут оставить вариант переливания K-отрицательных единиц только в том случае, если у пациента впоследствии разовьются анти-K или, если это необходимо для удовлетворения других требований фенотипа.
Совместимость тромбоцитов
Если необходимо предоставить тромбоциты, отличные от собственной группы крови пациента, на решение могут повлиять возраст пациента, диагноз, терапия, доступность компонентов (например, тромбоциты афереза по сравнению с объединенными тромбоцитами), а также любые особые обстоятельства (например, соответствие HLA). для получения тромбоцитов, несовместимых с антигеном или несовместимых с антителами.
При переливании тромбоцитов, совместимых с антигеном ABO / несовместимых с плазмой (например, пациенту группы A вводятся тромбоциты группы O), у реципиента может развиться положительный прямой антиглобулиновый тест (DAT), который может привести к гемолизу.Это имеет большее значение для детей, поскольку у них более низкие уровни растворимых веществ A и B в жидкостях их тела.
Если при трансфузии тромбоцитов, несовместимых с антигеном ABO и / или RhD / совместимой с плазмой (например, пациенту с отрицательным RhD группы O, получавшему тромбоциты с положительным RhD) назначается посттрансфузионный прирост тромбоцитов, и выживаемость тромбоцитов у некоторых пациентов может быть ниже. Также может произойти сенсибилизация к чужеродным антигенам эритроцитов и, в частности, к RhD.
Профилактический иммуноглобулин RhD может быть показан при переливании RhD-положительных тромбоцитов RhD-отрицательному реципиенту, особенно детям женского пола или женщинам детородного возраста.Обратитесь к вашему поставщику услуг переливания крови или гематологу за дополнительной консультацией.
Совместимость с плазмой
Компоненты плазмы (например, свежезамороженная плазма, криопреципитат и криодеплетированная плазма) должны быть совместимы с группой ABO реципиента, чтобы избежать потенциального гемолиза, вызванного донорскими анти-A или анти-B. Компоненты плазмы любого типа RhD могут быть предоставлены независимо от типа RhD получателя. В этих ситуациях иммуноглобулин RhD не требуется.
Группа крови Система Kell — обзор
Система группы крови Kell
Система группы крови Kell, которая состоит как минимум из 34 антигенов, 13 является третьей по иммуногенности системой после систем ABO и Rh.По сравнению с антигеном RhD, антиген K примерно в 8–10 раз менее иммуногенен. Антигены Kell кодируются геном KEL , расположенным на хромосоме 7q33 и переносимым гликопротеином Kell, однопроходным мембранным белком 93 кДа. Следующее обсуждение будет сосредоточено на наиболее часто встречающихся в клинических условиях антигенах, включая K, k, Kp a , Kp b , Js a и Js b . Исчерпывающий обзор всех антигенов можно найти во многих текстах. 21,22,48,49
В системе Kell наиболее часто клинически встречается антиген K и его альтернативный аллель k. K- и k-антигены кодируются одним белком, который отличается только одной аминокислотной заменой, T193M, которая нарушает мотив N-гликозилирования и может объяснять высокую иммуногенность K-антигена. 50 Антиген K экспрессируется примерно у 9% белых и 1,5% черных в гомозиготной или гетерозиготной (Kk) форме.Напротив, k-антиген (также называемый «Cellano») присутствует почти у 100% пациентов. Дополнительные аллели K, также на 7q33, кодируют близкородственные антигены Kp a , Kp b , Js a и Js b . Антигены Kp a и Kp b отличаются одной заменой аминокислоты, W281 и R281, соответственно. Точно так же антигены Js a и Js b различаются одной заменой аминокислоты, P597 и L597, соответственно. 13
После ABO и резус-антител, анти-K является следующим по распространенности аллоантителом с частотой от 14% до 28%. 51,52 Исследования оценили риск образования анти-K на уровне 10%, если человеку переливают по крайней мере 1 единицу K-антиген-положительной крови. 53,54 Подобно образованию анти-C-антител, реципиенты, которые формируют анти-D-антитела, с большей вероятностью также будут образовывать анти-K-антитела, что, вероятно, отражает общую «отвечающую» способность отдельного пациента.Хотя анти-K антитела способны фиксировать комплемент, они делают это не полностью и не вызывают образование комплекса атаки на мембрану. Тем не менее, анти-K является преимущественно антителом класса IgG 1 , поэтому может вызывать тяжелые гемолитические трансфузионные реакции. Кроме того, тяжелая форма HDFN может возникать у K-антиген-положительных плодов из-за способности антитела проникать через плаценту и выводить из кровообращения эритроциты плода, а также связывать и разрушать предшественники эритроцитов плода, которые экспрессируют K-антиген на ранней стадии развития клонов. . 55–57 Как следствие, тяжелая анемия плода возникает из-за подавления кроветворения плода. Частота анти-K у беременных составляет примерно 1/1000, 58,59 , а частота HDFN, вызванная анти-K, оценивается в 1/20 000. В отличие от других случаев аллоиммунизации матери и плода, когда титр антител коррелирует с тяжестью анемии плода, титры анти-K не коррелируют со степенью анемии. В присутствии материнских анти-К-антител уровень водянки или гибели плода колеблется от 15% до 38%. 60–64 В настоящее время существуют методы тестирования внеклеточной ДНК плода для проверки генотипа К плода у беременных матерей с помощью известного анти-K. Хотя анти-K является наиболее распространенной и серьезной причиной HDNF, антитела Js a и Js b и Kp a также были связаны с HDFN.
В отличие от анти-K, анти-k-антитело встречается редко из-за своего статуса антигена с высокой частотой встречаемости и экспрессируется примерно у 98% пациентов. И наоборот, частота anti-k колеблется от 0.От 005% черных до 2% белых в США. 22 Anti-Kp a и Kp b также редки, как и anti-Js a и Js b, около 0,5% и 0,4% соответственно. 47 Подобно анти-K, они также способны опосредовать гемолитические трансфузионные реакции. Антигенные частоты различных антигенов группы Kell приведены в таблице 2.3.
Таблица 2.3. Разнообразие фенотипов келл по этнической принадлежности.
| Фенотип Келла | Кавказский (%) | Черный (%) | ||
|---|---|---|---|---|
| K − k + | 91 | 98 | ||
| 903 | К + к — | 0.2 | & lt; 1 | |
| Kp a −Kp b + | 98 | 100 | ||
| Kp a + Kp b + | 3||||
| Js a −Js b + | & lt; 1 | 0 | ||
| Js a + Js b + | 100 | 80 | & lt; 1 | 19 |
Границы | Организация переливания крови для пациентов, получавших моноклональные антитела против CD38
Введение
В 2015 году даратумумаб стал первым моноклональным антителом к CD38, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Его высокая эффективность и благоприятный профиль безопасности в недавних испытаниях привели к расширению показаний для рецидивирующей или рефрактерной множественной миеломы (ММ) (1–3), и недавно он стал первым моноклональным антителом, одобренным для первичной терапии ММ при трансплантации. пациенты, не отвечающие критериям назначения наряду с бортезомибом, мелфаланом и преднизоном (4).
Кроме того, в будущем могут появиться дополнительные разрешения на моноклональные антитела к CD38. Даратумумаб тестируется на различных стадиях разработки при самых разных формах рака, а также в виде подкожного препарата.Другие моноклональные антитела к CD38 также находятся в стадии исследования, включая изатуксимаб, в настоящее время проводится несколько исследований фазы 3 по ММ, а также MOR202 и TAK079 в ранних клинических испытаниях по ММ (5). Биспецифическое моноклональное антитело, нацеленное на CD38 и CD3, GBR-1342, также начало фазу 1 испытания MM.
С самого начала было установлено, что даратумумаб мешает тестированию на совместимость с кровью, вызывая панагглютинацию в непрямом тесте на антиглобулин (IAT) (6). Было также показано, что это справедливо для изатуксимаба и суррогатов MOR-202, и действительно, вероятно, это классовый эффект, а не специфический для какого-либо одного антитела (7).С увеличением числа пациентов, получающих терапию анти-CD38, важно осознавать эту проблему, чтобы предотвратить задержки в получении эритроцитов и снизить затраты на лабораторные исследования.
Учитывая частоту анемии у пациентов с миеломой из-за замещения костного мозга плазматическими клетками, сопутствующие заболевания (например, инфекции, миелодиспластический синдром) и различные миелосупрессивные методы лечения, переливание крови является важной частью поддерживающей терапии пациентов с ММ. В этом обзоре мы суммируем патофизиологию влияния анти-CD38 на тестирование банка крови, рассмотрим опубликованные клинические данные, изучим различные решения этой проблемы и, наконец, предложим алгоритм клинического решения для оптимизации управления переливанием крови.
Патофизиология
CD38 — трансмембранный гликопротеин с различными рецепторными и ферментативными функциями (8). Он обнаруживается в низких количествах во многих клетках как гемопоэтических, так и негематопоэтических клонов, но имеет высокую экспрессию в нормальных плазматических клетках. Кроме того, CD38 высоко экспрессируется почти во всех клетках миеломы, что делает его привлекательной мишенью для терапии (9). Антитела к CD38 работают через множество механизмов, включая комплемент-зависимую цитотоксичность, антителозависимую клеточно-опосредованную цитотоксичность, антителозависимый клеточный фагоцитоз, индукцию апоптоза и не полностью изученные иммуномодулирующие функции, влияющие на регуляторные клетки и цитотоксические Т-клетки (8, 10, 11).
Непрямой тест на антиглобулин (IAT) использует вторичное антитело, антиглобулин человека (AHG), направленное против Fc-части молекулы иммуноглобулина, для обнаружения антител, связанных с мембраной красных кровяных телец (RBC). Этот тест используется как часть скрининга на антитела к эритроцитам, тестирования на определение антител к эритроцитам, фенотипирования эритроцитов на антигены эритроцитов и для полного перекрестного сопоставления. CD38 экспрессируется на низких уровнях в эритроцитах (12–14), что приводит к положительным результатам (агглютинации), когда плазма пациентов с моноклональными антителами к CD38 используется в IAT.Когда скрининг антител и панели идентификации антител выполняются как часть предтрансфузионного тестирования, антитело к CD38 в сыворотке крови пациента связывается с CD38 на эритроцитах реагента, вызывая слабую, обычно 1+ панагглютинацию, во всех тестах с использованием AHG (гель, пробирка, твердое вещество). фаза) (см. рисунок 1) (6). Требуется дополнительное тестирование для определения наличия аллоантител к эритроцитам, что приводит к задержкам в предоставлении эритроцитов пациенту для обычных переливаний. Это не может считаться ложноположительным, поскольку многие пациенты получили несколько переливаний в контексте рецидива и рефрактерной ММ и на самом деле могут иметь аллоантитела эритроцитов, что требует идентификации антиген-отрицательных эритроцитов для переливания.Важно отметить, что антитела к CD38 не влияют на типирование ABO и Rh (D).
Рисунок 1 . Механизм влияния даратумумаба на непрямой антиглобулиновый тест (IAT). (A) Отрицательный IAT в образце без аллоантител эритроцитов или даратумумаба. (B) Положительный IAT из-за аллоантител эритроцитов в образце. (C) Положительный IAT из-за вмешательства со стороны даратумумаба, который связывается с CD38 на эритроцитах и вызывает агглютинацию с добавлением реагента Кумбса.
Это явление обычно не наблюдается с собственными эритроцитами пациента, и прямое тестирование на антиглобулин (DAT) и автоконтроль (AC) на панели идентификации антител к эритроцитам часто бывают отрицательными. В DAT эритроциты пациента реагируют с AHG для выявления присутствия in vivo связанных антител или комплемента, в то время как в AC собственная плазма пациента реагирует против его собственных эритроцитов для обнаружения как антител, связанных с мембраной эритроцитов, так и комплемента. самореактивные антитела.Было показано, что отсутствие выявления антител в обоих тестах связано, по крайней мере частично, с подавлением CD38 в эритроцитах после воздействия даратумумаба (12). Даже в период сразу после инфузии даратумумаба не было никаких доказательств клинически значимого гемолиза (15), возможно, из-за низкой экспрессии CD38 в эритроцитах.
Клинические данные о влиянии антител к CD38 на типирование крови
Насколько нам известно, в 10 опубликованных исследованиях представлены результаты анализа банков крови образцов пациентов после начала терапии анти-CD38 (6, 7, 12, 15–21).В совокупности эти исследования предоставили результаты для 91 пациента (88 лечились даратумумабом и 3 лечились изатуксимабом). Все 91 (100%) продемонстрировали положительную ВАТ после терапии. Среди пациентов, прошедших тестирование до начала терапии, 5/65 (7,7%) имели аллоантитела эритроцитов; специфические антитела подробно описаны в таблице 1. Шесть из 43 (14,0%) пациентов имели положительный автоконтроль IAT, а 13 из 67 (19,4%) имели положительный DAT. В одном исследовании проводилось длительное контрольное DAT у трех пациентов, у которых ранее был положительный результат, и все они стали отрицательными (17).В трех исследованиях сообщалось о времени исчезновения положительного ВАТ после прекращения терапии; продолжительность составляла 2–6 месяцев (диапазон), медиана 5 месяцев (диапазон 1–9 месяцев) и медиана 3,4 месяца (диапазон 2,1–6,3) (7, 15, 17). Данные этих отдельных исследований представлены в таблице 1.
Таблица 1 . Клинические данные о влиянии моноклональных антител против CD38 на тестирование банка крови.
Растворы анти-CD 38 антител, мешающих IAT
Преодоление этой помехи возможно с помощью множества методов, каждый из которых имеет свои преимущества и недостатки.Универсального решения, которое можно было бы применить практически во всех сценариях, не существует, поэтому необходимо разбираться в доступных вариантах. В этом разделе мы обсудим методологию, применимость, оптимальное использование и относительную стоимость каждого из них, а также подтверждающие клинические данные. Сводная информация представлена в таблице 2.
Таблица 2 . Подходы к преодолению интерференции моноклональных антител против CD38 с IAT.
Дитиотреитол и протеолитические ферменты
Наиболее распространенный метод прерывания связывания антитела к CD38 с рецептором CD38 — обработка реагентных эритроцитов дитиотреитолом (DTT).Точная лабораторная техника подробно описана в другом месте (22). DTT — это восстанавливающий агент, который расщепляет дисульфидные связи, присутствующие на рецепторах CD38. В результате он может денатурировать антиген CD38 и препятствовать связыванию антитела. Однако этот метод также денатурирует другие клинически значимые антигены эритроцитов, в первую очередь Kell, но также и менее иммуногенные антигены, в том числе лютеранские антигены, Yt, JMH, LW, Cromer, Indian, Dombrock и Knops (23). Следовательно, чтобы снизить риск возможной гемолитической трансфузионной реакции из-за неидентифицированного анти-Kell-антитела, всем пациентам необходимо переливать Kell-отрицательную кровь, если только они не известны как Kell-положительные.Клинически значимые антитела у пациентов с антителами против DTT-чувствительных антигенов, таких как система групп крови Картрайта (Yt), могут быть пропущены при использовании этого метода тестирования, что подвергнет пациента риску гемолитической трансфузионной реакции.
Хотя лечение DTT является технически простым методом для выполнения в лаборатории, для его выполнения вручную может потребоваться более 2–4 часов, требуются должным образом обученные медицинские технологи, использующие стандартные процедуры, а DTT опасен и должен использоваться в закрытом режиме.Стоимость реагента минимальна, но реализация обычно затруднена из-за отсутствия ресурсов, которые обычно не доступны во многих больничных банках крови.
Лечение эритроцитов с помощью DTT очень надежно и подтверждено международным многоцентровым исследованием (22). В этом исследовании 25 центров получили по два образца крови, один с добавлением даратумумаба, а другой с добавлением даратумумаба плюс клинически значимое аллоантитело эритроцитов (анти-s, анти-D или анти-Fy a ).24/25 (96%) центров наблюдали интерференцию даратумумаба в первом образце с их обычными тестами, и все они могли решить эту проблему, используя DTT-обработанные эритроциты с реагентом. Во второй части исследования 100% исследовательских центров смогли идентифицировать RBC-антитела после устранения влияния даратумумаба на DTT. Большинство центров, опрошенных по завершении исследования, сочли этот метод простым и сообщили, что будут использовать его в будущем в качестве своего стандарта лечения. Однако важно отметить, что все это были академические медицинские центры или справочные лаборатории центров крови, и возможности для небольших местных лабораторий могут отличаться.
Обработка эритроцитов протеолитическими ферментами трипсином или папаином не изучена в той же степени, что и DTT, и эти методы вряд ли заменят DTT в настоящее время. Chapuy et al. продемонстрировали, что 2% трипсина снижает связывание даратумумаба с CD38-трансдуцированными клетками HL-60 на 40% по сравнению с 92% для 10 ммоль / л DTT (6). Трипсин не разрушает антигены Kell, но разрушает ряд других клинически значимых антигенов, включая M, N, En и TS, а также менее иммуногенные Ge2, Ge3, Ge4, Ch / Rg и лютеранские антигены (24).Необходимы дополнительные исследования для определения преимуществ использования трипсина в клинической и лабораторной практике по сравнению с DTT.
Папаин был успешно использован для устранения интерференции ВАТ со стороны даратумумаба и изатуксимаба у всех 33 пациентов в одном исследовании (16). Авторам удалось идентифицировать антитела группы Rh у всех трех пациентов с уже существующими аллоантителами. Гипотетически папаин можно было бы использовать для быстрой идентификации антител Kell, поскольку он не денатурирует антиген Kell, но это не было проверено в исследовании.Папаин действительно разрушает антигены из систем групп крови Даффи и MNS, а также несколько второстепенных антигенов, включая Ch / Rg, Ge2 и Ge4 (24), поэтому его использование в основном будет дополнять другие подходы. В исследовании папаин использовался в сочетании с фенотипически подобранными эритроцитами для безопасного проведения переливаний. При использовании параллельно с DTT можно было бы преодолеть ограничение, связанное с предоставлением Kell-отрицательной крови при использовании только DTT. Однако это повысит сложность лабораторных процедур и может оказаться непрактичным в рутинных условиях.
Набор эритроцитов
Расширенное фенотипирование и генотипирование эритроцитов пациентов — эффективные, хотя и дорогостоящие методы безопасного получения совместимой крови. Фенотипирование должно быть выполнено до начала терапии анти-CD38 антителами и при отсутствии как переливания эритроцитов в предшествующие 3 месяца, так и положительного результата DAT. Расширенное фенотипирование оценивает, как минимум, наиболее распространенные иммуногенные антигены, а именно антигены в системах групп крови Rh, Duffy, Kidd, Kell и MNS (18). Генотипирование на антигены эритроцитов может быть выполнено в любое время во время терапии и может предоставить более полную информацию, чем фенотипирование, особенно в отношении минорных антигенов (25).Генотипирование стоит дорого и в большинстве случаев требует не менее 1 недели рабочего времени.
Информация, полученная при типировании эритроцитов, сохраняется, а затем используется для получения фенотипически подобранной крови для будущих переливаний. Предоставление эритроцитов, соответствующих антигену, может быть проблемой для банков крови с меньшими запасами и может излишне использовать ограниченные ресурсы, которые лучше использовать для пациентов, которые с большей вероятностью будут иметь широкую аллоиммунизацию (например, серповидно-клеточная анемия). Использование тщательно подобранных эритроцитов может не потребоваться, если используется лечение DTT; отрицательный скрининг на антитела после лечения DTT потребует только крови, совместимой с RhD и Kell.
На практике переливание фенотипически подобранных эритроцитов было очень безопасным. Chari et al. (15) сообщили о результатах переливания в SIRIUS, исследовании фазы 2 монотерапии даратумумабом для лечения резистентной к лечению ММ (26). В этом исследовании 47 пациентов получили в общей сложности 147 единиц упакованных эритроцитов без каких-либо реакций на переливание крови или признаков гемолиза (15). Углубленный анализ двух клинических центров показал, что использование исключительно фенотипически подобранных эритроцитов не привело к побочным реакциям при переливании крови, гемолизу или развитию новых аллоантител.
Deneys et al. сообщили об 11 пациентах в своем учреждении, которые участвовали в клинических испытаниях даратумумаба и нуждались в переливании крови (18). Этим пациентам были назначены фенотипически подобранные эритроциты, которые были совместимы с перекрестным соответствием при тестировании донорских эритроцитов, обработанных DTT, в сравнении с сывороткой пациентов. Пациенты получали от 2 до 44 единиц эритроцитов, и было только 2 легкие реакции на переливание крови (1 лихорадка, 1 эритема). В другом коротком письме сообщалось о пяти пациентах, участвовавших в клиническом испытании даратумумаба, которые получили от 1 до 20 единиц эритроцитов на основании расширенного фенотипирования и / или генотипирования; опять же, о побочных эффектах не сообщалось (16).
Следует отметить, что эти данные, хотя и обнадеживающие, были получены в контексте клинических испытаний в крупных академических центрах. Возможность типирования эритроцитов и предоставления эритроцитов, соответствующих антигену, в условиях сообщества следует оценивать в индивидуальном порядке.
Антиидиотипическое антитело и растворимый рецептор CD38
Самый прямой способ предотвратить панреактивность IAT — нейтрализовать антитело к CD38 в сыворотке пациента перед проведением IAT. Это можно сделать с помощью реагентного антитела, направленного против специфического моноклонального антитела против CD38 или растворимого рецептора CD38.Эффективность этих методов была продемонстрирована в двух исследованиях, в которых в образцы крови добавляли даратумумаб, а затем обрабатывали антителом против даратумумаба или растворимым рецептором CD38 (6, 7). Оба смогли устранить влияние на IAT, хотя в одном исследовании растворимый рецептор CD38 был, возможно, немного менее эффективным (6). Важно отметить, что они не влияют на известные аллоантитела, присутствующие в сыворотке с добавкой.
Недавно было одобрено антитело против даратумумаба для аналогичного уменьшения влияния даратумумаба на тесты иммунофиксации сыворотки (27).Однако эти реагенты дороги, и для каждого нового моноклонального антитела к CD38 необходимо было бы разработать специфическое антиидиотипическое антитело. Для растворимого рецептора CD38 необходимо использовать большие количества, чтобы надежно преодолеть концентрацию анти-CD38-антитела в сыворотке пациента. В недавней переписке сообщалось об использовании фрагментов F (ab ‘) 2 , полученных расщеплением даратумумаба пепсином, для преимущественного связывания CD38 с реагентами RBC и предотвращения интерференции даратумумаба (28).С помощью этого метода авторам удалось обнаружить известные алло-антитела к эритроцитам в нескольких образцах. Этот метод может оказаться полезным, но требует дальнейшей проверки и широкой коммерческой доступности. В обозримом будущем они, вероятно, будут использоваться только в исследовательских целях.
CD38-отрицательные эритроциты
RBC, лишенные антигенов CD38, не связывают моноклональные антитела против CD38 и, следовательно, не демонстрируют панагглютинацию в IAT. Было показано, что в пуповинной крови может отсутствовать антиген CD38, что использовалось в тестах перед переливанием для успешного скрининга антител в одном клиническом центре; Было перелито 17 единиц эритроцитов без побочных эффектов (29).Однако пуповинная кровь может иметь иную экспрессию антигена, чем эритроциты, обычно используемые в тестировании банка крови (например, P1, Lewis), и ее необходимо типировать перед использованием (30). Точно так же редкие эритроциты In (Lu), которые представляют собой Lu (a– b–), не реагируют с даратумумабом (31). Однако они недоступны и поэтому не являются практическим решением.
Принятие клинических решений
На данный момент не существует универсального решения проблемы интерференции анти-CD38 антител в тестах на совместимость перед переливанием крови и эритроцитах.В результате клиницисты должны понимать различные описанные методы и учитывать местную практику, стоимость и доступность при решении этой проблемы. Этот раздел будет служить общим руководством по приближению к переливанию крови пациентам, получающим моноклональные антитела к CD38. Алгоритм клинического ведения представлен на Рисунке 2.
Рисунок 2 . Алгоритм управления переливанием крови для пациентов, получавших моноклональные антитела к CD38.
До начала терапии
Перед введением первой дозы моноклонального антитела к CD38 все пациенты должны получить тип и пройти скрининг для выявления любых аллоантител, присутствующих на исходном уровне.Они также должны получить расширенный фенотип или генотип, в зависимости от имеющихся ресурсов. Включение базового типа и скрининга и фенотипа / генотипа в электронный или письменный набор заказов на химиотерапию может гарантировать, что тип и скрининговый образец будут собраны и отправлены в банк крови вместе с уведомлением о предстоящей терапии анти-CD38. Важно отметить, что фенотипирование может быть неточным, если пациенту сделали переливание крови в течение предшествующих 3 месяцев или если у него положительный DAT; генотипирование не затронуто.
Это базовое тестирование гарантирует, что пациент может получить должным образом подобранную кровь, даже если в местном банке крови не проводится тестирование на DTT или трипсин. Это особенно ценно для пациентов, которым в будущем потребуется много переливаний. В идеале банк крови должен предоставить пациентам карточку с указанием их группы крови и антигенов эритроцитов. Тем не менее, как минимум, пациенты должны всегда иметь при себе карточку, указывающую, что они получают терапию против CD38, которая может повлиять на определение группы крови, а также контактную информацию лечащего онколога и банк крови.Это позволяет другим специалистам легко получить эту информацию в случае путешествия или экстренной помощи, требующей ухода вдали от онкологического центра.
Пациенты, получающие терапию, которым требуется переливание крови
Если пациент уже получил терапию и ему требуется переливание крови, банк крови должен быть четко уведомлен о том, что пациент принимает моноклональные антитела к CD38 и требует специального тестирования. Учитывая почти универсальный положительный результат IAT в этом сценарии, банк крови может продолжить лечение эритроцитов DTT, если таковые имеются, поскольку в настоящее время это наиболее проверенный метод.Если после применения DTT имеется отрицательный результат скрининга на антитела к эритроцитам, можно предположить, что у пациента нет аллоантител, принимая во внимание те антигены, особенно Kell, денатурированные реагентом. Затем банк крови может провести перекрестное сопоставление Kell-отрицательных эритроцитов, обработанных DTT, с сывороткой пациента и безопасно выдать совместимую кровь. Остается очень малая вероятность реакции переливания на один из второстепенных антигенов, разрушенных лечением DTT, поэтому клиницисты должны помнить об этой возможности.Если IAT положительный даже после применения DTT, это указывает на истинное аллоантитело, и идентификацию антител следует проводить с использованием обработанных DTT эритроцитов.
Наличие расширенного фенотипа или генотипа эритроцитов может упростить этот процесс. Соответствующие эритроциты могут быть выпущены банком крови в зависимости от требуемой степени соответствия и наличия этих единиц. Не все банки крови будут иметь достаточный инвентарь для обеспечения расширенных совпадений и, возможно, пожелают сохранить эти скудные ресурсы для пациентов, у которых, как известно, есть несколько аллоантител.В этом случае банк крови может продолжить скрининг на антитела к эритроцитам, обработанным DTT, с тем преимуществом, что заранее узнает статус Kell пациента. Затем банк крови может предоставить перекрестно сопоставленную и Kell-совместимую кровь без необходимости тщательного сопоставления антигенов.
В случае, если банк крови не может провести тестирование с помощью DTT и нет доступного фенотипа или генотипа, образец следует отправить в референс-лабораторию, у которой есть методы для устранения интерференции анти-CD38.Это увеличит время, необходимое для получения подходящей крови, но это необходимый шаг для обеспечения безопасности пациента, при условии, что нет срочности переливания.
Неотложные и неотложные переливания крови
Пациенты, которым требуется переливание крови в опасной для жизни ситуации, должны получать кровь, не имеющую аналогов по АВО и резус-совместимую кровь. Если группа крови пациента неизвестна, ему следует назначить эритроциты группы O, как и другим пациентам. Не должно быть никаких задержек из-за положительности IAT.
В случае неотложной, но не опасной для жизни необходимости в переливании, врач должен взвесить риски и преимущества предоставления непревзойденной крови. В целом, острый риск для пациента довольно низок, так как вероятность предшествующей аллоиммунизации мала. В большом исследовании переливаний с экстренным освобождением, в котором участвовали 1407 пациентов и 4144 единицы эритроцитов, у 3% пациентов развились аллоантитела после острого события, в то время как только 0,3% получали несовместимую кровь и 0,02% имели отсроченную гемолитическую трансфузионную реакцию без острого заболевания. сообщалось о гемолитических реакциях (32).Эти показатели, вероятно, будут выше у пациентов с ММ, которым ранее делали переливание крови. Время, необходимое для получения эритроцитов, соответствующих фенотипу (если у пациента есть известный фенотип или генотип), или проведения тестирования DTT, следует рассматривать в контексте срочности клинической ситуации и рисков аллоиммунизации.
Заключение
Моноклональные антителак CD38 являются высокоэффективными препаратами для лечения ММ, и их использование, вероятно, будет расти по мере появления новых показаний.Даратумумаб в настоящее время одобрен для лечения ММ, не подходящих для трансплантации, и находится на поздней стадии тестирования на многие другие злокачественные новообразования, в то время как изатуксимаб находится на третьей фазе испытаний ММ. По мере того, как использование этих антител становится рутинным и распространяется в условиях сообщества, проблемы и затраты, связанные с тестированием на совместимость крови, будут продолжать расти. Лабораториям и медицинским центрам необходимо будет оптимизировать процессы и поддерживать открытое общение. На сегодняшний день не было никаких проблем с безопасностью для этих пациентов, получающих переливание крови, и это должно оставаться приоритетом для обеспечения безопасности пациентов.Это потребует осведомленности и обучения пациентов, врачей и персонала банка крови.
Авторские взносы
GL разработал и подготовил рукопись; SA, JJ, HC, SJ, DM, SP и JR критически отредактировали рукопись; AC задумал, разработал и отредактировал рукопись. Все авторы согласились с тем, что будет представлена окончательная версия.
Заявление о конфликте интересов
HC: Финансирование исследований: BMS, Janssen, Agenus Inc. Консультации: BMS, Roche. SJ: Консультативный совет: Celgene, BMS, Merck, Janssen, Novartis.JR: Консультативный совет и бюро докладчиков: Janssen AC: Консультативный совет: Adaptive Biotechnology, Amgen, Celgene, Janssen, Millennium / Takeda, Фонд исследования множественной миеломы, Novartis, Seattle Genetics. Финансирование исследований: Amgen, Array Biopharma, Celgene, Janssen, Millennium / Takeda, Novartis, Pharmacyclics. Консультации: Amgen, Bioascend, BMS, Celgene, Imedex, Janssen, Karyopharm, Millennium / Takeda, Novartis, ресурсы для обучения врачей, сайт привязки.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Димопулос М.А., Ориол А., Нахи Х., Сан-Мигель Дж., Бахлис, штат Нью-Джерси, Усмани С.З. и др. Даратумумаб, леналидомид и дексаметазон при множественной миеломе. N Engl J Med. (2016) 375: 1319–31. DOI: 10.1056 / NEJMoa1607751
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Палумбо А., Чанан-Хан А., Вайзель К., Нука А.К., Массзи Т., Бексак М. и др. Даратумумаб, бортезомиб и дексаметазон при множественной миеломе. N Engl J Med. (2016) 375: 754–66. DOI: 10.1056 / NEJMoa1606038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Чари А., Суваннасанка А., Фэй Дж. У., Арнульф Б., Кауфман Дж. Л., Ифтихаруддин Дж. Дж. И др. Даратумумаб плюс помалидомид и дексаметазон при рецидивирующей и / или рефрактерной множественной миеломе. Кровь (2017) 130: 974–81. DOI: 10.1182 / кровь-2017-05-785246
CrossRef Полный текст | Google Scholar
4. Матеос М.В., Димопулос М.А., Каво М., Сузуки К., Якубовяк А., Кноп С. и др.Даратумумаб плюс бортезомиб, мелфалан и преднизон при нелеченной миеломе. N Engl J Med. (2018) 378: 518–28. DOI: 10.1056 / NEJMoa1714678
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Ван де Донк Н., Ричардсон П.Г., Малавази Ф. Антитела к CD38 при множественной миеломе: назад в будущее. Кровь (2018) 131: 13–29. DOI: 10.1182 / кровь-2017-06-740944
CrossRef Полный текст | Google Scholar
6. Чапуи К.И., Николсон Р.Т., Агуад М.Д., Чапуи Б., Лаубах Д.П., Ричардсон П.Г. и др.Устранение влияния даратумумаба на анализ совместимости с кровью. Переливание (2015) 55 (6 Pt 2): 1545–54. DOI: 10.1111 / trf.13069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Остендорп М., Ламмертс ван Бюрен Дж. Дж., Доши П., Хан И., Ахмади Т., Паррен П. В. и др. Когда лечение переливания крови усложняется из-за вмешательства терапии моноклональными антителами. Переливание (2015) 55 (6 Pt 2): 1555–62. DOI: 10.1111 / trf.13150
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.ван де Донк Н.В., Джанмаат М.Л., Мутис Т., Ламмертс ван Бюрен Дж.Дж., Ахмади Т., Сассер А.К. и др. Моноклональные антитела, нацеленные на CD38 при гематологических злокачественных новообразованиях и не только. Immunol Rev. (2016) 270: 95–112. DOI: 10.1111 / imr.12389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. де Веерс М., Тай Ю.Т., ван дер Веер М.С., Баккер Дж.М., Винк Т., Джейкобс Д.К. и др. Даратумумаб, новое терапевтическое моноклональное антитело человека к CD38, вызывает уничтожение множественной миеломы и других гематологических опухолей. J Immunol. (2011) 186: 1840–8. DOI: 10.4049 / jimmunol.1003032
CrossRef Полный текст | Google Scholar
11. Овердийк М.Б., Верплоеген С., Богельс М., ван Эгмонд М., Ламмертс ван Бюрен Дж. Дж., Мутис Т. и др. Опосредованный антителами фагоцитоз способствует противоопухолевой активности терапевтического антитела даратумумаба при лимфоме и множественной миеломе. MAbs (2015) 7: 311–21. DOI: 10.1080 / 19420862.2015.1007813
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Салливан Х.С., Гернер-Смидт С., Нука А.К., Артур С.М., Томпсон Л., Менер А. и др. Даратумумаб (анти-CD38) вызывает потерю CD38 в красных кровяных тельцах. Кровь (2017) 129: 3033–7. DOI: 10.1182 / кровь-2016-11-749432
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Zocchi E, Franco L., Guida L, Benatti U, Bargellesi A, Malavasi F, et al. Один белок, иммунологически идентифицированный как CD38, проявляет активность НАД + гликогидролазы, АДФ-рибозилциклазы и циклической АДФ-рибозогидролазы на внешней поверхности эритроцитов человека. Biochem Biophys Res Commun. (1993) 196: 1459–65. DOI: 10.1006 / bbrc.1993.2416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Чари А., Аринсбург С., Джаганнатх С., Сатта Т., Тредуэлл I, Катамеро Д. и др. Управление переливанием крови и связанные с переливанием исходы у пациентов, получавших даратумумаб, с рецидивирующей или рефрактерной множественной миеломой. Clin Lymphoma Myeloma Leuk. (2018) 18: 44–51. DOI: 10.1016 / j.clml.2017.09.002
CrossRef Полный текст | Google Scholar
16.Bub CB, Reis IND, Aravechia MG, Santos LD, Bastos EP, Kutner JM и др. Организация переливания крови для пациентов, принимающих моноклональные антитела к CD38. Rev Bras Hematol Hemoter. (2018) 40: 25–9. DOI: 10.1016 / j.bjhh.2017.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Каррено-Таррагона Г., Седена Т., Монтехано Л., Алонсо Р., Мирас Ф., Валери А. и др. Панели, обработанные папаином, представляют собой простой метод идентификации аллоантител у пациентов с множественной миеломой, получавших терапию на основе анти-CD38. Transfus Med. (2018). DOI: 10.1111 / tme.1250. [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Субраманиян Р., Сатешкумар Р., Перейра КР. Роль даратумумаба в медицине переливания крови: необходимо знать. Rev Bras Hematol Hemoter. (2017) 39: 375–8. DOI: 10.1016 / j.bjhh.2017.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Линь М.Х., Лю Ф.Й., Ван Х.М., Чо Х.С., Ло СК. Вмешательство даратумумаба в предтрансфузионное тестирование, имитирующее высокий титр и низкую авидность, как у антител. Asian J Transfus Sci. (2017) 11: 209–11. DOI: 10.4103 / 0973-6247.214358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Сетия Р., Догра М., Сачдева П., Ханду А., Чоудхари Д., А. А. Вмешательство даратумумаба (анти-CD38) в серологическое тестирование: новая проблема для банков крови в развивающихся странах. Global J Transfus Med. (2017) 2: 163–5. DOI: 10.4103 / GJTM.GJTM_42_17
CrossRef Полный текст | Google Scholar
22.Чапуи К.И., Агуад М.Д., Николсон Р.Т., Обюшон Дж. П., Кон С.С., Делани М. и др. Международная валидация метода на основе дитиотреитола (DTT) для устранения влияния даратумумаба на тестирование совместимости с кровью. Переливание (2016) 56: 2964–72. DOI: 10.1111 / trf.13789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Рейд М.Э., Ломас-Фрэнсис К., Олссон М.Л. Справочник фактов по антигенам группы крови. 3-е изд. Амстердам: Elsevier / AP (2012).
Google Scholar
25.Анани В.К., Марчан М.Г., Бенсинг К.М., Шанен М., Пифер С., Готтшалл Дж. Л. и др. Практические подходы и затраты на обеспечение безопасных переливаний во время терапии анти-CD38. Переливание (2017) 57: 1470–9. DOI: 10.1111 / trf.14021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Лониал С., Вайс Б.М., Усмани С.З., Сингхал С., Чари А., Бахлис, штат Нью-Джерси, и др. Монотерапия даратумумабом у пациентов с резистентной к лечению множественной миеломой (SIRIUS): открытое рандомизированное исследование фазы 2. Ланцет (2016) 387: 1551–60. DOI: 10.1016 / S0140-6736 (15) 01120-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. McCudden C, Axel AE, Slaets D, Dejoie T., Clemens PL, Frans S, et al. Мониторинг пациентов с множественной миеломой, получавших даратумумаб: устранение помех от моноклональных антител. Clin Chem Lab Med (2016) 54: 1095–104. DOI: 10.1515 / cclm-2015-1031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Шмидт А.Е., Киркли С., Патель Н., Мазел Д., Боуэн Р., Блумберг Н. и др. Альтернативный метод лечения дитиотреитолом для скрининга антител у пациентов, получающих даратумумаб. Переливание (2015) 55: 2292–3. DOI: 10.1111 / trf.13174
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Велликетт Р., Шакариан Дж., Джанг Дж., Родригес М., Моррисон М., Адами Дж. И др. Анти-CD38, производный от даратумумаба, можно легко принять за клинически значимые антитела к лютеранским антигенам или антигенам Нопса [аннотация]. Переливание (2015) 55: 26A.
Google Scholar
32. Мулай С.Б., Джабен Э.А., Джонсон П., Баджи К., Стаббс мл. Риски и неблагоприятные исходы, связанные с переливанием эритроцитов в экстренном порядке. Переливание (2013) 53: 1416–20. DOI: 10.1111 / j.1537-2995.2012.03922.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фенотипирование антигена
Фенотипирование антигена ВведениеТипирование эритроцитов на антигены, отличные от ABO и Rh (D), не выполняется для рутинных тестов перед трансфузией, в которых у пациента отсутствуют неожиданные антитела.Однако, если у пациентов обнаруживаются нерегулярные антитела, их типируют на соответствующие антигены, чтобы подтвердить, являются ли антитела аллоантителами или аутоантителами. Кроме того, если такому пациенту требуется переливание крови, все донорские единицы, подлежащие перекрестному сопоставлению, имеют типирование по антигену.
Примечание: Если перекрестное сопоставление с донорами проводилось параллельно со скринингом антител, любые несовместимые донорские единицы типируются по антигену, чтобы подтвердить, что они действительно антиген-положительные, что объясняет их несовместимость.[Некоторые лаборатории могут не иметь доноров, несовместимых по типу антигена, из-за финансовых ограничений.]
Если несовместимый донор оказался антиген-отрицательным, то нужно было бы найти другое объяснение для объяснения агглютинации в перекрестном матче, например, возможно, клетки донора имеют положительный DAT. Любые явно совместимые донорские единицы также должны быть типированы по антигену, чтобы быть уверенным, что в них действительно отсутствует соответствующий антиген и, следовательно, они безопасны для переливания.
Как правило, перед проведением перекрестного сравнения доноров типируют по антигену.




