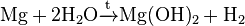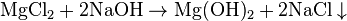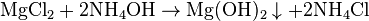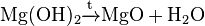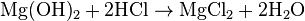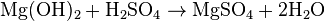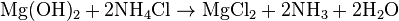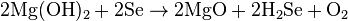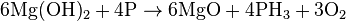Гидроксид магния | Info-Farm.RU
Гидроксид магния, магний гидроксид — неорганическое соединение состава Mg (OH) 2. Белые кристаллы, которые плохо растворяются в воде. Соединение проявляет слабые основные свойства.
Применяется как препарат для снижения кислотности желудочного сока и как антидот при отравлениях мышьяком. Промежуточное соединение в синтезе металлического магния.
Распространение в природе
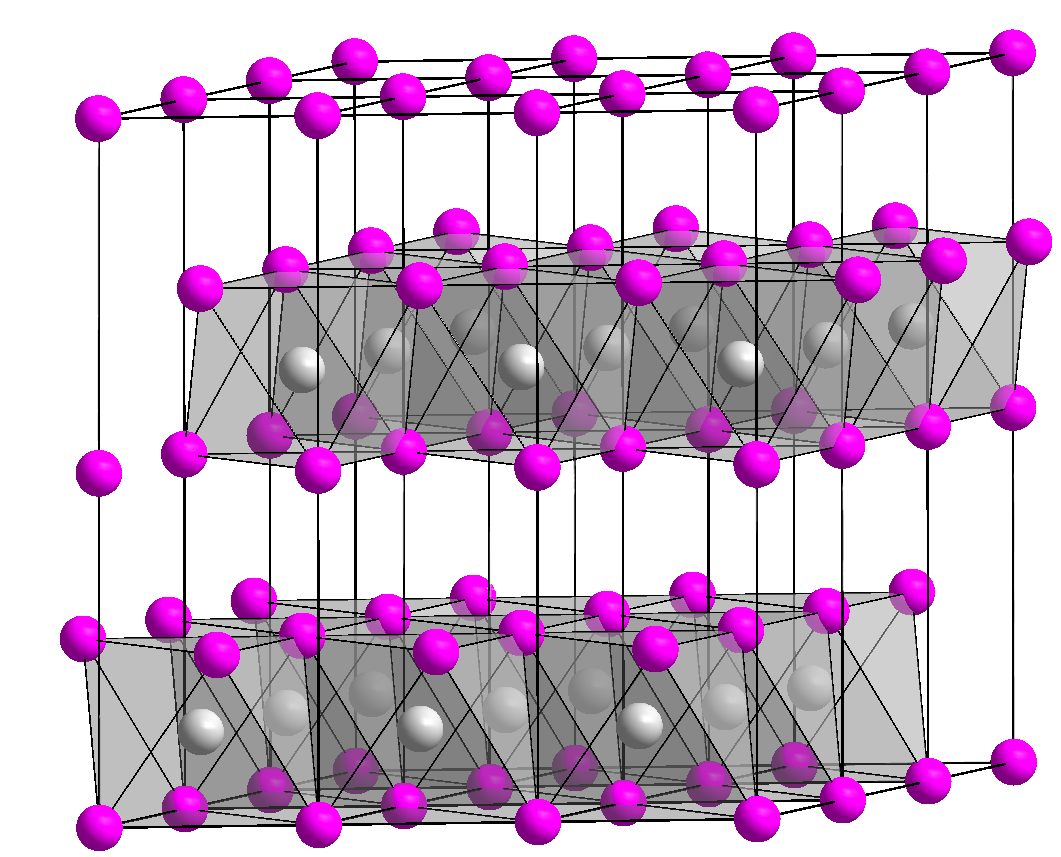
Минералы, в состав которых входит гидроксид магния, довольно малораспространенными. Среди таких минералов наибольшее значение имеет брусит. Кроме основного соединения, Mg (OH) 2, в нем могут находиться примеси MnO, FeO, Fe 2 O 3. Брусит образуется в результате гидролиза растворимых в лугах природных соединений магния.
Также Mg (OH) 2 встречается в составе минерала гидромагнезиту, который по составу приближен к смеси гидроксида и карбоната магния, — 4MgCO 3 · Mg (OH) 2 · 2H 2 O.
Физические свойства
Гидроксид магния являются белыми кристаллами, которые плохо растворяются в воде и не проводят ток. Активно осушает воздух путем поглощения воды и углекислого газа. Хорошо растворяется в солях аммония.
Получение
Учитывая малую распространенность гидроксида магния в минеральных залежах, его добывают другим способом. Для нужд промышленности Mg (OH) 2 получают преципитацией морской воды и рассолов. Впервые добычи гидроксида из морской воды применили в 1865 году на побережье французского Средиземноморья.
В лабораторных в языках гидроксид магния можно синтезировать сожжением металлического магния в паре воды:
Также применяется осаждения малорастворимого гидроксида при взаимодействии солей магния с щелочами и гидроксидом аммония.
Однако, осаждения с помощью гидроксида аммония происходит полностью из-за постоянного уменьшения ионов OH -.
Химические свойства
Гидроксид магния разлагается при нагревании свыше 350 ° C вакууме и при 800 ° C — на воздухе:
Соединение является слабым основанием, взаимодействует с кислотами, солями аммония и кислотными оксидами (активно поглощает из воздуха углекислый газ):
При нагревании реагирует с некоторыми неметаллами, которые в результате образуют соответствующие гидриды:
Комплексообразования с неорганическими лигандами для катионы Mg 2+ нехарактерное (неустойчивые комплексы с оксигеновмиснимы молекулами известны для галогенидов магния), поэтому в лугах Mg (OH) 2 нерастворимый.
Применение
Гидроксид магния применяется как промежуточное соединение в синтезе металлического магния. Применяется для очистки сахара, воды в котельных, в изготовлении зубных паст.
В медицине
Гидроксид магния широко используется как антацидное средство при повышенной кислотности желудочного сока (при гастритах, язвенной болезни желудка и двенадцатиперстной кишки). Входит в состав препарата «Маалокс» (акроним от «ма навоз ал Юминов окс ид»), а также его аналога «альмагель», которые снижают кислотность.
Нейтрализуя хлорную кислоту, содержащуюся в желудке превращается в хлорид магния, который обладает слабительным действием. Применяется при отравлении кислотами и соединениями мышьяка.
Видео по теме
Изображения по теме
описание вещества, свойства и применение :: SYL.ru
Гидроксид магния — это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния — Mg(OH)2, то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы — большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.

Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит — уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Получение
Основная реакция получения нерастворимых гидроксидов — это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример — при взаимодействии хлорида магния и гидроксида калия.
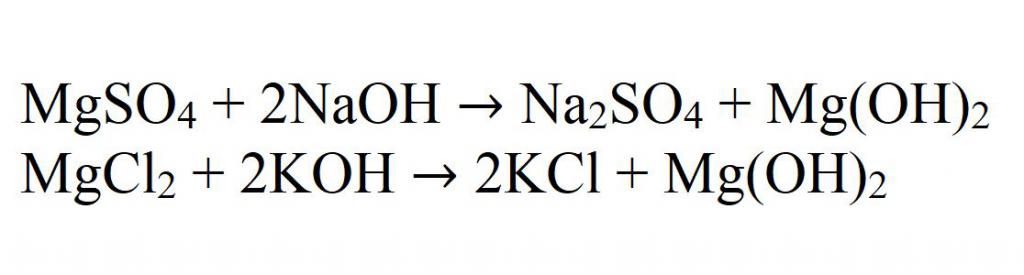
В ионном виде все подобные реакции записываются как:
Mg2+ + OH— → Mg(OH)2
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.
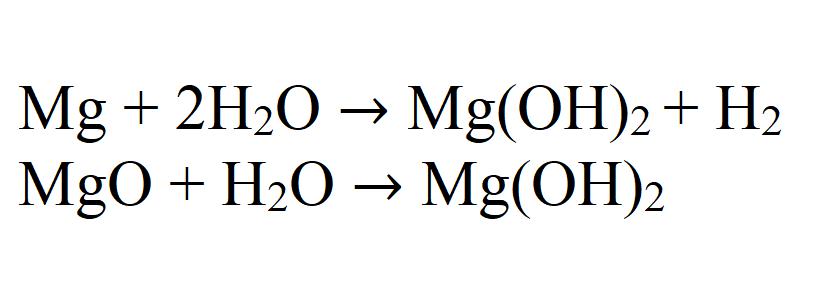
Существует такой достаточно распространенный минерал — доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
MgCO3·CaCO3 + 2H2O + MgCl2 → Mg(OH)2 + CaCl2 + 2CO2
Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480
Химические свойства
Гидроксид магния — типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:
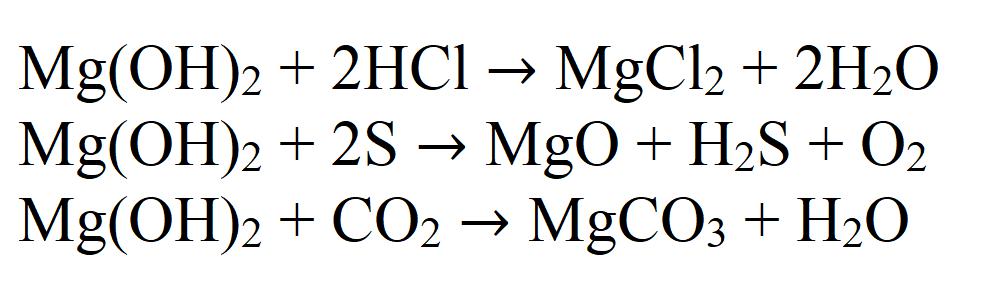
Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:
Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Mg(OH)2 → H2O + MgO
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Mg(OH)2 + 2NaOH → Na2[Mg(OH)4]
Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения — расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид — довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
Гидроксид магния — характеристика, свойства, получение
Гидроксид магния (е528) – пищевая добавка группы эмульгаторов.
Характеристика
 Внешне химическое соединение представляет собой кристаллический порошок белого цвета, без запаха, с характерным вкусом щелочи. Применяют е528 в качестве пищевой добавки. Основное ее предназначение – стабилизация оттенков продуктов и регуляция кислотности.
Внешне химическое соединение представляет собой кристаллический порошок белого цвета, без запаха, с характерным вкусом щелочи. Применяют е528 в качестве пищевой добавки. Основное ее предназначение – стабилизация оттенков продуктов и регуляция кислотности.
При температуре 350 градусов по Цельсию гидроксид магния разлагается на воду и оксид магния. В воде практически не растворяется. Из воздуха поглощает углекислый газ и воду, при этом образуя основной карбонат магния. В природе е528 можно встретить в виде особого минерала – брусита.
Получение гидроксида магния
В промышленных масштабах получение гидроксида магния происходит посредством взаимодействия солей магния с различными щелочами.
Также химическое соединение получают путем реакции раствора магния хлорида с обожженным доломитом, либо при взаимодействии паров воды с металлическим магнием.
Свойства гидроксида магния
В пищевой промышленности свойства гидроксида магния получили распространение при изготовлении продуктов из какао (до 70 г/кг), консервированных овощей (соленые и квашеные овощи, соусы, маринады, овощные закусочные консервы, овощные натуральные консервы), сыра. В качестве пищевой добавки е528 применяют для связывания диоксида серы.
Используют вещество в качестве флокулянта для очистки сточных вод, в качестве добавки в различные моющие средства, антиперспиранты, дезодоранты и зубную пасту. Применяют для рафинирования сахара и получения оксида магния.
Отдельного внимания заслуживают свойства гидроксида магния, позволяющие использовать его в медицине. Вещество оказывает антацидное и слабительное действие, снижает активность желудочного сока и нейтрализует соляную кислоту в желудке. При этом, применение е528 не сопровождается изменения КЩР или вторичной гиперсекрецией соляной кислоты. Также в медицине вещество используют для повышения перистальтики кишечника. В качестве слабительного начинает действовать спустя 2-6 часов после применения.
 Показания к применению химического соединения: изжога после употребления кофе, алкоголя или курения, хронический гастрит с нормальной или повышенной секрецией, язва желудка и 12-перстной кишки, запоры, боли в эпигастрии и чувство дискомфорта.
Показания к применению химического соединения: изжога после употребления кофе, алкоголя или курения, хронический гастрит с нормальной или повышенной секрецией, язва желудка и 12-перстной кишки, запоры, боли в эпигастрии и чувство дискомфорта.
В медицине получил распространения алгелдрат магния гидроксид – средство, которое используют при остром дуодените, язве желудка, гастралгии, изжоге, хроническом панкреатите, бродильной или гнилостной диспепсии, гиперацидном гастрите. Однако, следует знать, что этот препарат противопоказан пациентам с гиперчувствительностью к гидроксиду магния, при болезни Альцгеймера и в период беременности и лактации. С осторожностью следует применять его пациентам, имеющим проблемы с почками, так как после его применения может развиться избыток магния в организме (гипермагниемия).
Влияние на организм человека
Пищевая добавка е528 запрещена в Австралии, Великобритании, Новой Зеландии. Вообще, добавка для организма считается безвредной. Однако ее употребление в больших концентрациях может спровоцировать расстройство желудка и вызвать понос, так как она всасывает жидкость из кишечника, усиливая его моторику.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Знаете ли вы, что:Препарат от кашля «Терпинкод» является одним из лидеров продаж, совсем не из-за своих лечебных свойств.
В Великобритании есть закон, согласно которому хирург может отказаться делать пациенту операцию, если он курит или имеет избыточный вес. Человек должен отказаться от вредных привычек, и тогда, возможно, ему не потребуется оперативное вмешательство.
При регулярном посещении солярия шанс заболеть раком кожи увеличивается на 60%.
Многие наркотики изначально продвигались на рынке, как лекарства. Героин, например, изначально был выведен на рынок как лекарство от детского кашля. А кокаин рекомендовался врачами в качестве анестезии и как средство повышающее выносливость.
Упав с осла, вы с большей вероятностью свернете себе шею, чем упав с лошади. Только не пытайтесь опровергнуть это утверждение.
Желудок человека неплохо справляется с посторонними предметами и без врачебного вмешательства. Известно, что желудочный сок способен растворять даже монеты.
Американские ученые провели опыты на мышах и пришли к выводу, что арбузный сок предотвращает развитие атеросклероза сосудов. Одна группа мышей пила обычную воду, а вторая – арбузный сок. В результате сосуды второй группы были свободны от холестериновых бляшек.
Раньше считалось, что зевота обогащает организм кислородом. Однако это мнение было опровергнуто. Ученые доказали, что зевая, человек охлаждает мозг и улучшает его работоспособность.
Кроме людей, от простатита страдает всего одно живое существо на планете Земля – собаки. Вот уж действительно наши самые верные друзья.
Люди, которые привыкли регулярно завтракать, гораздо реже страдают ожирением.
74-летний житель Австралии Джеймс Харрисон становился донором крови около 1000 раз. У него редкая группа крови, антитела которой помогают выжить новорожденным с тяжелой формой анемии. Таким образом, австралиец спас около двух миллионов детей.
Наши почки способны очистить за одну минуту три литра крови.
У 5% пациентов антидепрессант Кломипрамин вызывает оргазм.
Вес человеческого мозга составляет около 2% от всей массы тела, однако потребляет он около 20% кислорода, поступающего в кровь. Этот факт делает человеческий мозг чрезвычайно восприимчивым к повреждениям, вызванным нехваткой кислорода.
Существуют очень любопытные медицинские синдромы, например, навязчивое заглатывание предметов. В желудке одной пациентки, страдающей от этой мании, было обнаружено 2500 инородных предметов.
Гидроксид магния
Гидроксид магния
Mg(OH)2
ТУ 6-09-3759-86
Гидроксид магния — неорганическое вещество, основный гидроксид металла магния, имеет формулу Mg(OH)2. Слабое малорастворимое основание.
Гидроксид магния представляет собой неорганическое соединение, встречающееся в природе в виде минерала брусита. Действует как антацид с очистительным эффектом. Стандартно имеет виду кристаллическую форму, при нагреве разлагающуюся на воду и магний оксид. Является слабым основанием.
При стандартных условиях гидроксид магния представляет собой аморфное вещество. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию и окрашивает индикаторы, например — фенолфталеин в розовый цвет. Встречается в природе в виде минерала брусита.
| Физические свойства | |
|---|---|
| Состояние | твёрдое |
| Молярная масса | 58.35 г/моль |
| Плотность | 2,3446 (20 °C) |
| Термические свойства | |
| Т. плав. | 350 °C |
| Т. всп. | невоспламеняющийся °C |
| Энтальпия образования | –925 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,0012 г/100 мл |
Физические данные гидроксида магния:
| Физическое состояние | твердое |
| Цвет | без цвета, белый окрас |
| Форма | кристаллический аморфный порошок, гексагональные кристаллы, гранулы. |
| Запах | отсутствуют |
| Молекулярная масса | 58.33 г/моль |
| Температура кипения | 100°C. |
| Температура плавления | 350°C |
| Плотность | 2,36 г/см3 |
| Растворимость | в воде 0,9 мл в 100 мл при 18°C; хорошо растворим в солях аммония. |
| Стабильность | стабильное, чувствительно к воздуху |
| Чистота | 99% |
Химические свойства гидрооксида магния:
- Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается при нагревании до 350 °C:
M g ( O H ) 2 → Δ T M g O + H 2 O {\displaystyle {\mathsf {Mg(OH)_{2}{\xrightarrow {\Delta T}}MgO+H_{2}O}}}
- Взаимодействует с кислотами с образованием соли и воды (реакция нейтрализации):
M g ( O H ) 2 + 2 H C l ⟶ M g C l 2 + 2 H 2 O {\displaystyle {\mathsf {Mg(OH)_{2}+2HCl\longrightarrow MgCl_{2}+2H_{2}O}}}
M g ( O H ) 2 + H 2 S O 4 ⟶ M g S O 4 + 2 H 2 O {\displaystyle {\mathsf {Mg(OH)_{2}+H_{2}SO_{4}\longrightarrow MgSO_{4}+2H_{2}O}}}
- Взаимодействие с кислотными оксидами с образованием соли и воды:
M g ( O H ) 2 + S O 3 ⟶ M g S O 4 + H 2 O {\displaystyle {\mathsf {Mg(OH)_{2}+SO_{3}\longrightarrow MgSO_{4}+H_{2}O}}}
- Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
M g ( O H ) 2 + 2 N a O H ⟶ N a 2 [ M g ( O H ) 4 ] {\displaystyle {\mathsf {Mg(OH)_{2}+2NaOH\longrightarrow Na_{2}[Mg(OH)_{4}]}}}
M g ( O H ) 2 + S r ( O H ) 2 ⟶ S r [ M g ( O H ) 4 ] {\displaystyle {\mathsf {Mg(OH)_{2}+Sr(OH)_{2}\longrightarrow Sr[Mg(OH)_{4}]}}}
Применение гидрооксида магня
Гидроксид магния применяется для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
Имеет вид таблеток или жидкости.
Используется для очистки сточных вод, для огнеупорной обработки, добавляется в бытовую химию и зубные пасты.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
описание вещества, свойства и применение
Гидроксид магния — это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния — Mg(OH)2, то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы — большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.

Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит — уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Получение
Основная реакция получения нерастворимых гидроксидов — это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример — при взаимодействии хлорида магния и гидроксида калия.

В ионном виде все подобные реакции записываются как:
Mg2+ + OH- → Mg(OH)2
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.

Существует такой достаточно распространенный минерал — доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
MgCO3·CaCO3 + 2h3O + MgCl2 → Mg(OH)2 + CaCl2 + 2CO2
Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480 oC разлагается на оксид магния и воду, как и любое другое нерастворимое основание. Плотность при нормальных условиях: 2,4 г/см3.
Химические свойства
Гидроксид магния — типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:

Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:

Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Mg(OH)2 → h3O + MgO
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Mg(OH)2 + 2NaOH → Na2[Mg(OH)4]
Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения — расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид — довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
Гидроксид магния — получение, свойства, применение
Гидроксид магния в стандартных условиях имеет вид кристаллов, не обладающих цветом. Основное предназначение в качестве пищевой добавки под номером Е528 – это регуляция кислотности, а также стабилизация оттенков продуктов. Соединение имеет характерный щелочной вкус.
Одним из свойств этого вещества является способность к поглощению из воды углекислого газа, при этом происходит образование основного карбоната магния. Следующим свойством является малая степень растворимости в воде, но довольно высокая – в солях аммония, а также способность разлагаться при нагревании.
В общем, соединение представляет собой основание со средней силой. В природных условиях может встречаться как минерал брусит.
В промышленных условиях гидроксид магния получают путем взаимодействия различных щелочей и солей магния. Кроме того, данное химическое соединение может образовываться в результате реакции обожженного доломита и раствора магния хлорида, либо взаимодействия металлического магния и паров воды.
Сфера применения
Благодаря особым свойствам применение гидроксид магния получил в производстве пищевых продуктов:
- консервированные овощи – квашеные и соленые овощи, закусочные овощные консервы, маринады, соусы, овощные натуральные консервы;
- сыр;
- продукты из какао.
Пищевая добавка Е528 используется с целью связывания диоксида серы.
Применение гидроксид серы нашел и как флокулянт во время очистки сточных вод, как добавка в разнообразные моющие средства, дезодоранты, антиперспиранты, зубную пасту. Применяется также с целью получения оксида магния и рафинирования сахара, как огнезащитное средство в ПВХ и полиолефинах.
Применение в медицине

В медицине гидроксид магния используется как лекарство с целью нейтрализации кислоты в желудке, а также как слабительное средство сильного действия.
Фармакологическое действие соединения – слабительное, антацидное средство. Способно нейтрализовать соляную кислоту в желудке, сокращает пептическую активность желудочного сока. Действие вещества не вызывает вторичную гиперсекрецию соляной кислоты, изменения кислотно-щелочного равновесия. Слабительное действие соединения наступает спустя 0,5-6 часов. Кроме этого, препарат приводит к повышению перистальтики во всех отделах кишечника.
В качестве побочных эффектов могут наблюдаться: постоянное чувство дискомфорта, головокружение, аритмия, изменение настроения, потеря аппетита, необычная утомляемость, мышечная слабость, кровотечения из прямой кишки, потеря веса. В случае возникновения хотя бы одного симптома из вышеперечисленных следует обратиться к врачу. Также возможна усиленная жажда, тошнота, беловатый или пятнистый стул, диарея, желудочные спазмы.
Показаниями к применению соединения являются:
- изжога после потребления кофе, никотина, алкогольных напитков;
- запоры;
- боли за грудиной;
- обострения гастрита в хронической форме с повышенной и нормальной кислотностью;
- обострение язвы двенадцатиперстной кишки и желудка.
Препарат противопоказан при болезни Альцгеймера, во время грудного вскармливания, беременности, при повышенной чувствительности к гидроксиду.
Вред гидроксида магния
Гидроксид магния как пищевая добавка запрещен в Великобритании, Австралии, Новой Зеландии. Данное соединение считается безопасным и безвредным. Но чрезмерное употребление гидроксида провоцирует понос, расстройство желудка, поскольку вещество всасывает жидкость, находящуюся в кишечнике, тем самым усиливая его моторику.
Гидроксид магния — применение и свойства

Как нам известно из школьного курса химии, гидроксиды – это класс химических соединений, содержащих в составе группу -ОН. Магния гидроокись относится к основным гидроксидам, то есть может реагировать с кислотами.
Магний – необходимый микроэлемент, участвующий во многих процессах нашего организма, в том числе в передаче нервных импульсов, в мышечной деятельности. Гидроокись магнияявляется лекарственным средством. Она применяется как слабительное и антацид (понижает кислотность в желудке).
Она используется также в таких препаратах, как Маалокс, Альмагель, Релцер, Гастрацид, но поскольку в их составе есть гидроксид алюминия, снижающий некоторые эффекты гидроокиси магния, слабительный эффект в них не выражен.
Чистый магний при попадании в кровь может вызвать токсические эффекты, в частности, выражающиеся угнетением центральной нервной системы.
Свойства гидроксида магния
Гидроокись магния представляет собой бесцветные кристаллы, порошок беловатого цвета. Он не растворяется в воде, но вступает в химическую реакцию с соляной кислотой в желудке, образуя соль – хлорид магния. Хлорид магния из желудка попадает в кишечник, оказывая сильный слабительный эффект, который наступает в среднем через шесть часов.
Поскольку он нейтрализует соляную кислоту, кислотность желудочного сока понижается, однако понижается до таких пределов, что пищеварение и антимикробная активность желудочного сока не снижаются, что является огромным плюсом. Кроме того, препарат связывает фермент желудка, спасая желудок и тонкий кишечник от раздражения.
Гидроксид магния относится к солевым слабительным. Это самый мощный класс слабительных, поэтому их нужно применять с осторожностью. Часто их используют при подготовке к операции или при некоторых диагностических процедурах для полной очистки кишечника, при острых запорах, при отравлении.
Как все солевые слабительные, соль магния в кишечнике создаёт осмотическое давление, вынуждая воду из тканей переходить в просвет кишечника, размягчая каловые массы, вызывая их набухание. Перистальтика кишечника при этом тоже усиливается.
Препарат может вызвать тошноту, вздутие живота. Таковы основные свойства гидроксида магния
Применение гидроксида магния

Гидроокись магния применяется при обострении хронического гастрита, язве, боли и дискомфорте в желудке, при изжоге и запорах. Выпускается он в форме суспензии и таблеток, принимается внутрь (таблетки разжёвываются) и запивается небольшим количеством воды. Для устранения изжоги применяется либо за один час до еды, либо через три часа после. В сутки можно принимать до 5 г гидроокиси магния (4 раза в день по 1,2 г). В народе применение гидроксиду магния нашли в полном очищении кишечника при подготовке к голоданию.
В Европе он зарегистрирован как пищевая добавка Е528, способствующая связыванию вредного диоксида серы. Для слабительного эффекта нужно принять два грамма препарата и запить стаканом воды.
Меры предосторожности
При нарушении работы почек в кровь может попасть некоторое количество чистого магния, достаточного для развития токсического эффекта. Иногда препарат вызывает аллергию. Следует помнить, что солевые слабительные вызывают сильное обезвоживание, способствуя выходу воды через кишечник с каловыми массами, что также влияет на давление, вызывая его снижение.
Если есть текущие или перенесённые заболевания желудочно-кишечного тракта, обязательно нужно проконсультироваться с врачом перед приёмом такого сильного слабительного. Категорически запрещено принимать магния гидроксид при кишечной непроходимости.