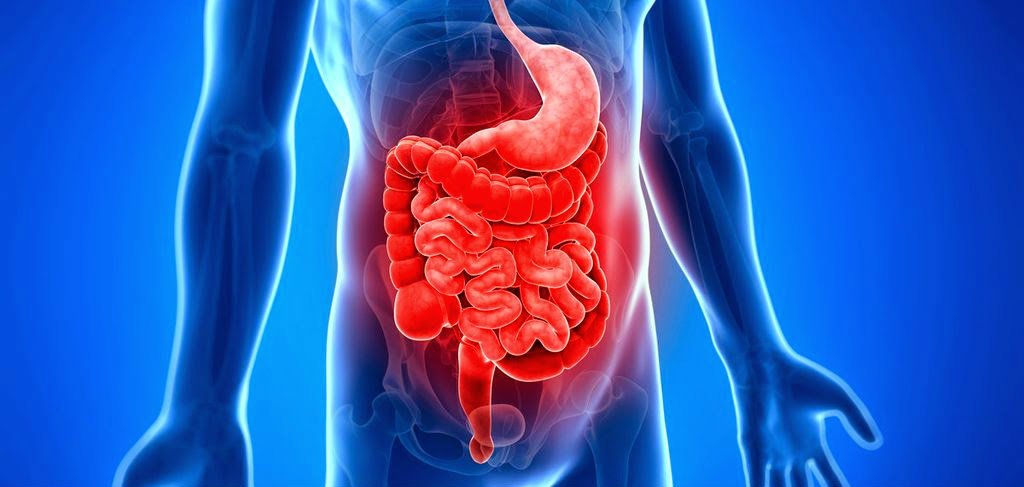
Современные методы диагностики язвенного колита и болезни Крона
Болезнь Крона – это воспалительное заболевание всего желудочно-кишечного тракта или отдельной его части.
В воспалительный процесс вовлекаются внутренняя слизистая оболочка, подслизистая, возможно поражение мышечного слоя. В динамике болезни Крона наблюдаются периоды обострений и неполных ремиссий. Болезнью Крона страдают примерно 50-60 человек из 100 000 популяции.
В патологический процесс могут быть вовлечены все отделы пищеварительного тракта, но статистически чаще всего встречается поражение подвздошной кишки, конечного отдела тонкого кишечника при его переходе в слепую кишку. Воспаление может распространяться и на другие органы пищеварительной системы. Воспалительный процесс, затрагивающий три слоя кишечника, способен провоцировать развитие многочисленных осложнений, значительная часть которых излечивается исключительно хирургическими методами терапии. Заболевание относится к редко встречающимся патологиям.
Причины возникновения болезни Крона
Причинный фактор заболевания не установлен. Предполагается провоцирующая роль вирусов, бактерий (например, вируса кори, микобактерии паратуберкулеза).
Вторая гипотеза связана с предположением, что какой-то пищевой антиген или неболезнетворный микробный агент способен вызвать аномальный иммунный ответ.
Третья гипотеза утверждает, что роль провокатора в развитии болезни играют аутоантигены (т. е. собственные белки организма) на стенке кишечника больного.
е. собственные белки организма) на стенке кишечника больного.
Следует отметить, что данное заболевание имеет хронический рецидивирующий характер. Причем, нередко происходит обострение. Оно носит сезонный характер.
- Кровь — характерны: анемия (как правило, смешанного генеза: анемия хронических заболеваний с дефицитом железа), лейкоцитоз, тромбоцитоз, ускорение СОЭ и повышение С-реактивного белка. Возможно снижение железа, сывороточного ферритина, витамина B12 (в случае поражение проксимальных отделов кишечника и желдука), диспротеинемия с гипоальбуминемией (как результат нарушения всасывания в кишечнике). В иммунограмме: часто — повышение гипергаммаглобулениемия (IgG), иногда отмечается селективный дефицит IgA[3].
- Определение ASCA (антител к Saccharomyces cerevisae), для диагностически сложных случаев, помогает подтвердить, может служить дополнительным серологическим маркером в диагностике болезни Крона;
- Анализы кала— с целью исключения инфекционной причины энтерита и колита.
 Включают бактериологические тесты на определение шигел, сальмонел, иерсиний, кампилобактера, клостридий (Cl. Difficile), туберкулезной палочки, дизентерийной амебы, различных гельминтов и паразитов.
Включают бактериологические тесты на определение шигел, сальмонел, иерсиний, кампилобактера, клостридий (Cl. Difficile), туберкулезной палочки, дизентерийной амебы, различных гельминтов и паразитов. - В последнее время в качестве высокочувствительного и специфического показателя применяется определение уровня кальпротектинав кале. Кальпротектин — белок, продуцируемый нейтрофилами слизистой оболочки кишечника. Его уровень повышен при болезни Крона и язвенном колите, кроме того этот показатель повышен при инфекционных поражениях кишечника, онкологических заболеваниях. Высокий уровень кальпротектина отражает активность воспаления в слизистой оболочке кишечника, а также является предиктором близкого обострения у пациентов с болезнью Крона в фазе ремиссии. Редко при наличии активности болезни Крона уровень кальпротектина остается нормальным. По всей видимости, это связано с преимущественным поражением подслизистой и/или мышечной оболочки кишки, где нет нейтрофилов, продуцирующих кальпротектин.

- Проведение посевов крови и кала обязательно в случае септических состояний
Неспецифический язвенный колит (НЯК) является хроническим заболеванием ЖКТ рецидивирующего характера, при котором воспаляется слизистая оболочка толстого кишечника, на которой образуются язвы и участки некроза. Болезнь носит иммунный характер. Причины язвенного колита.
Причины возникновения болезни до конца не выяснены. Считается, что она возникает вследствие генетически обусловленного нарушения реакции иммунной системы, вследствие которого иммунные клетки атакуют собственные здоровые клетки организма, повреждая микрофлору толстой кишки. Это сопровождается воспалительным процессом, дегенеративным изменением тканей пищеварительного тракта вследствие изменения функции защиты внутренней оболочки кишки.
Лабораторная диагностика.
В общем анализе крови у больного язвенным колитом отмечается анемия (снижается количество эритроцитов и гемоглобина), имеется лейкоцитоз.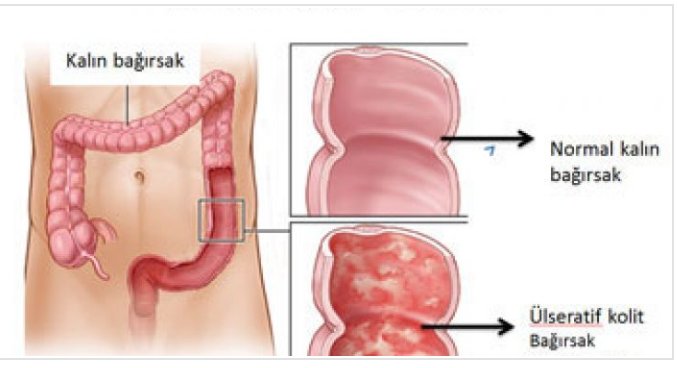 В биохимическом анализе крови отмечается увеличение содержания в крови С — реактивного белка, который является показателем наличия в организме человека воспаления. Кроме того, снижается концентрация альбуминов, магния, кальция, повышается количество гаммаглобулинов, что связано с активной выработкой антител. В иммунологическом анализе крови у большинства пациентов отмечается увеличение концентрации цитоплазматических антинейтрофильных антител (они появляются по причине аномального иммунного ответа). В анализе кала больного язвенным колитом отмечается кровь, гной и слизь. В кале высеивается патогенная микрофлора.
В биохимическом анализе крови отмечается увеличение содержания в крови С — реактивного белка, который является показателем наличия в организме человека воспаления. Кроме того, снижается концентрация альбуминов, магния, кальция, повышается количество гаммаглобулинов, что связано с активной выработкой антител. В иммунологическом анализе крови у большинства пациентов отмечается увеличение концентрации цитоплазматических антинейтрофильных антител (они появляются по причине аномального иммунного ответа). В анализе кала больного язвенным колитом отмечается кровь, гной и слизь. В кале высеивается патогенная микрофлора.
Врач лабораторной диагностики клинико-диагностической лаборатории Давыдова Ольга Владимировна
Даже кратковременный избыток сахара повлиял на риск воспаления кишечника — Наука
Всего два дня диеты с высоким содержанием сахара увеличили количество повреждений в тканях кишечника у мышей и негативно повлияли на их иммунитет. К такому выводу пришли канадские биологи, статью которых опубликовал научный журнал Scientific Reports.
«Наше исследование показывает, что пагубные последствия могут проявиться даже в том случае, если вы едите пищу с повышенным содержанием сахара в течение недолгого времени», — прокомментировала Карен Мэдсен, один из авторов исследования, диетолог из Альбертского университета (Канада).
Ученые неоднократно доказывали вред повышенного содержания сахара в пище. В новом исследовании канадские исследователи решили проверить, как подобная диета в короткие сроки может повлиять на развитие колита – воспалительного заболевания слизистой оболочки толстой кишки.
Для этого специалисты в течение двух дней кормили мышей пищей с большим количеством сахарозы. Такая диета сделала животных гораздо восприимчивей к колиту – у них увеличилась проницаемость кишечника, а также уменьшилось количество специфических жирных кислот, которые защищают организм от воспаления. При этом добавление тех же кислот в рацион мышей сдвинуло ситуацию к лучшему.
Таким образом, оказалось, что если в рационе даже на короткое время оказывается повышенное количество сахара, то это может негативно сказаться на здоровье его кишечника. «Идея о том, что можно в будни питаться здоровой пищей, а в выходные позволять себе вредную, неверна», — резуюмировала Мэдсен.
«Идея о том, что можно в будни питаться здоровой пищей, а в выходные позволять себе вредную, неверна», — резуюмировала Мэдсен.
Кроме того, ученые добавляют, что это может вызвать еще и нейродегенеративные заболевания. «Поскольку наше исследование показало, что проницаемость кишечника у мышей, которые были на диете с высоким содержанием сахара, значительно выросла, это означает, что продукты жизнедеятельности бактерий могут свободно перемещаться из кишечника, где они обычно находятся, к остальной части организма. В результате вероятность того, что это может стать причиной нейродегенеративных болезней, повышается. Это нужно учитывать», — добавила ученый.
Обследования желудочно-кишечного тракта — Medicīnas centrs ARS
ЭНДОСКОПИЧЕСКИЕ ОБСЛЕДОВАНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
ARS Diagnostikas klīnika предлагает уникальные диагностические возможности, позволяющие вовремя констатировать изменения слизистой поверхности желудочно-кишечного тракта и получать образец тканей для исследования.
Эндоскопический кабинет в ARS Diagnostikas klīnika оборудован современным видеоэндоскопическим оборудование последнего поколения Olympus EVIS EXERA III, которое обеспечивает точную диагностику желудочно-кишечного тракта, используя лучший мировой опыт и новейшие достижения медицинских технологий.
Верхняя эндоскопия или ГАСТРОСКОПИЯ
Гастроскопия это обследование пищевода, желудка и двенадцатиперстной кишки. Это самый точный метод для ранней диагностики и лечения заболеваний желудочно-кишечного. Во время процедуры через рот в пищеварительную систему пациента вводится оптическое устройство — гибкая трубка, на конце которой находится источник света и камера. Это позволяет на мониторе детально рассмотреть слизистую оболочку пищевода, желудка и двенадцатиперстной кишки. Оборудование позволяет многократно увеличивать полученные изображения для более детального изучения.
Подробнее об исследовании ГАСТРОСКОПИЯ
Нижняя эндоскопия или КОЛОНОСКОПИЯ
Колоноскопия — это обследование толстой и прямой кишки. “Золотой стандарт” среди методов своевременной диагностики рака толстой кишки или колоректального рака. Обследование выполняется через анальное отверстие. Для выполнения колоноскопии используется специальное оптическое устройство — гибкая трубка, на конце которой находится источник света и камера. Это позволяет на мониторе детально рассмотреть слизистую оболочку толстой кишки. Оборудование позволяет многократно увеличивать полученные изображения для более детального изучения. У нового колоноскопа, чтобы сделать обследование более щадящим, кардинально улучшена вводимая часть эндоскопа. Это существенно облегчает выполнение процедуры как для пациента, так и для врача. Эндоскоп легко управляется и его высокая разрешающая способность и управление является главными факторами, которые позволяют врачу качественно оценить слизистую оболочку толстой и прямой кишки, практически не допуская возможности пропустить патологические изменения в кишке. К тому же, во время колоноскопии можно выполнять различные лечебные манипуляции, например, изъять образец слизистой ткани для анализов, выполнить полипэктомию — удалить полипы размером до 4 мм., остановить кровотечении и др.
К тому же, во время колоноскопии можно выполнять различные лечебные манипуляции, например, изъять образец слизистой ткани для анализов, выполнить полипэктомию — удалить полипы размером до 4 мм., остановить кровотечении и др.
Подробнее о колоноскопии
РЕКОМЕНДУЕМ:
Каждому человеку старше 50 лет выполнить колоноскопическое обследование — диагностику рака толстой и прямой кишки, чтобы не пропустить какие-либо патологические изменения на ранней стадии развития. Своевременная диагностика рака кишечника с помощью скрининга выявляет предраковое состояние или злокачественные опухоли на ранней стадии, значительно повышая таким образом показатели полного излечения.
РЕКТОСКОПИЯ
Ректоскопия — это обследование прямой кишки с помощью специального устройства — ректоскоп. Это металлическая трубка с источником света и оптической системой. Этот метод дает возможность констатировать воспаления слизистой поверхности, геморроиды, рубцовые сужения, доброкачественные и злокачественные опухоли.
РАДИОЛОГИЧЕСКАЯ ДИАГНОСТИКА
ДЕФЕКОГРАФИЯ
Дефекография или эвакуаторная проктография – это метод рентгеновского обследования, который позволяет визуально оценить состояние прямой кишки и анального канала, а также особенности опорожнения. С помощью этого метода можно определить такие патологии как ректоцеле, инвагинация, пролапс прямой кишки, энтероцеле, диссинергия аноректального рефлекса (функциональные нарушения опорожнения прямой кишки). Эту информацию невозможно получить другими доступными методами визуальными диагностики.
Подробнее о дефекографии
ОПРЕДЕЛЕНИЕ ВРЕМЕНИ КИШЕЧНОГО ТРАНЗИТА
Определение времени кишечного транзита – это определение времени прохождения каловых масс по толстой кишке. Рентгенологическое исследование кишечного транзита дает информацию о скорости двигательной функции толстой кишки.
Подробнее об обследовании
ИРРИГОСКОПИЯ
Ирригоскопия – это рентгенологический метод обследования толстой кишки, который позволяет оценить форму, размеры, контуры стенок толстой кишки. При обследовании применяется контрастное вещество на основе бария. Этот метод особенно результативен при сужениях толстой кишки, а также для диагностики язв и образований в толстой кишке.
При обследовании применяется контрастное вещество на основе бария. Этот метод особенно результативен при сужениях толстой кишки, а также для диагностики язв и образований в толстой кишке.
ВИЗУАЛЬНАЯ ДИАГНОСТИКА
УЗИ
УЗИ обследование брюшной полости — печени, желчного пузыря, поджелудочной железы, селезенки, почек и мочевого пузыря.
КОМПЬЮТЕРНАЯ ТОМОГРФИЯ
КТ органов брюшной полости и малого таза:
- печень, желчный пузырь, желчевыводящие пути
- поджелудочная железа
- селезенка
- надпочечники, почки, мочевыводящие пути, мочевой пузырь
- лимфатические узлы
- можно получить информацию и о желудочно-кишечном тракте, позвоночнике и о костях таза, мышцах, органах малого таза, о передней стенке брюшной полости и др.
Подробнее о компьютерной томографии
МАГНИТНЫЙ РЕЗОНАНС
Исследования органов брюшной полости и малого таза методом магнитного резонанса:
- поджелудочная железа, желчный пузырь, желчные протоки (МР холангиография), печень, почки, надпочечники, лимфатические узлы,
- гинекология — матка, яичники,
- простата,
- мочевой пузырь,
- энтерография тонкого кишечника,
- колонография толстой кишки,
- тазовые лимфатические узлы.

Подробнее о МР исследовании
ВИДЕО:
Городская клиническая больница №31 — ВЗК: Язвенный колит. Что нужно знать пациенту? (страница 7)
Страница 7 из 10
ДиагностикаПеред обсуждением методов обследования, позволяющих правильно установить диагноз, хочется обратить внимание,что воспалительные и язвенные поражения слизистой оболочки толстой кишки далеко не всегда являются проявлением ЯК. Список заболеваний, протекающих со схожей клинической и эндоскопической картиной велик:
- инфекционные колиты (бактериальные, вирусные, паразитарные),
- болезнь Крона,
- ишемический колит (связан с недостаточным кровоснабжением кишечной стенки),
- дивертикулит,
- ассоциированный с приемом лекарственных препаратов колит,
- радиационный колит,
- рак ободочной кишки,
- солитарная язва прямой кишки
- эндометриоз и др.

Лечение же перечисленных заболеваний различается. Поэтому при появлении рассмотренных выше симптомов пациенту обязательно нужно обратиться за квалифицированной врачебной помощью, а не заниматься самолечением.
Для полного видения врачом картины заболевания и выбора оптимальной лечебной тактики должно быть проведено комплексное обследование больного. Необходимые диагностические процедуры включают лабораторные и инструментальные методы.
Анализы крови необходимы для оценки активности воспаления, степени кровопотери, выявления нарушений обмена веществ (белкового, водно-солевого), вовлечения в патологический процесс печени, других органов (почек, поджелудочной железы и др.), определения эффективности проводимого лечения, отслеживания побочных реакций от принимаемых лекарств.
Однако, к сожалению, пока не существует анализов крови «на язвенный колит», достаточных для постановки диагноза. Современные иммунологические исследования на специфические показатели (перинуклеарные цитоплазматические антинейтрофильные антитела (рANCA), антитела к сахаромицетам (ASCA) и др.) служат лишь дополнительным подспорьем при трактовке результатов всех проведенных обследований и дифференциальной диагностике ЯК и болезни Крона.
Анализы кала, которые возможно выполнить в любой поликлинике и стационаре (копрограмма, реакция Грегерсена – исследование на скрытую кровь) позволяют выявить невидимые невооруженному глазу патологические примесикрови, гноя, слизи. Бактериологические (посевы) и молекулярно-генетические (ПЦР) исследования стула обязательны для исключения инфекционной патологии и подбора антибиотиков. Сравнительно новым перспективным исследованием считается определение в кале показателей кишечного воспаления (фекального кальпротектина, лактоферрина и др.), позволяющее исключить функциональные расстройства (синдром раздраженного кишечника).
Эндоскопические процедуры занимают ведущее место в диагностике воспалительных заболеваний кишечника. Они могут проводиться как в амбулаторных, так и в стационарных условиях. Перед обследованием кишечника очень важно получить рекомендации врача по правильной подготовке к процедуре. В зависимости объема эндоскопического исследования для полноценной очистки кишечника обычно используют специальные слабительные препараты, очистительные клизмы или их комбинацию. В день исследования разрешается прием только жидкостей. Суть процедуры заключается во введении через задний проход в кишечник эндоскопического аппарата – трубки с источником света и присоединенной видеокамерой на конце. Это позволяет доктору не только оценить состояние слизистой оболочки кишечника, выявить характерные признаки ЯК, но и произвести безболезненный забор нескольких биоптатов (маленьких кусочков кишечной ткани) с помощью специальных щипцов. Биоптаты в дальнейшем используются для осуществления гистологического исследования, необходимого для правильной постановки диагноза.
В зависимости от объема обследования кишечника проводят:
- ректороманоскопию (осмотр жестким ректороманоскопом прямой и части сигмовидной кишки),
- фибросигмоидоскопию (исследование гибким эндоскопом прямой и сигмовидной кишки),
- фиброколоноскопию (исследование гибким эндоскопом толстой кишки),
- фиброилеоколоноскопию (обследование гибким эндоскопом всей толстой и участка тонкой (подвздошной) кишки).
Предпочтительным диагностическим исследованием является фиброилеоколоноскопия, позволяющая отличить ЯК от болезни Крона. Для уменьшения неприятных ощущений пациента во время процедуры часто используется поверхностный наркоз. Длительность этого исследования составляет от 20 минут до 1,5 часов.
Рентгенологические исследования толстой кишки проводятся при невозможности проведения полноценного эндоскопического осмотра.
Ирригоскопия(клизма с барием) также может быть осуществлена в условиях больницы или амбулаторно. Накануне исследования пациент принимает слабительное средство, ему делают очистительные клизмы. Во время исследования в кишку больному с помощью клизмы вводят контрастное вещество — бариевую взвесь, затем выполняют рентгенологические снимки толстой кишки. После опорожнения в кишку вводят воздух, который раздувает ее, и снова делают рентгенологические снимки. Полученные изображения могут выявить участки воспаленной и изъязвленной слизистой толстой кишки, а также ее сужения и расширения.
Обзорная рентгенография брюшной полости у больных ЯК позволяет исключить развитие осложнений: токсической дилатации кишки и ее перфорации. Специальной подготовки больного не требует.
Ультразвуковое исследование (УЗИ) органов брюшной полости, гидроколоно-УЗИ, лейкоцитарная сцинтиграфия, выявляющие воспалительный процесс в толстой кишке, имеют низкую специфичность в дифференцировке ЯК от колитов другого происхождения. Диагностическая значимость МРТ- и КТ-колонографии (виртуальной колоноскопии) продолжает уточняться.
Иногда чрезвычайно сложно отличить ЯК от болезни Крона, для этого требуются дополнительные обследования: иммунологические, рентгенологические (энтерография, гидроМРТ) и эндоскопические (фибродуоденоскопия, энтероскопия, исследование с помощью эндоскопической видеокапсулы) обследования тонкой кишки. Правильная постановка диагноза важна, так как, несмотря на то, что в развитии обоих заболеваний задействованы иммунные механизмы, в некоторых ситуациях лечебные подходы могут принципиально различаться. Но даже в развитых странах при полноценном обследовании не менее чем в 10-15% случаев не удается отличить друг от друга эти две патологии. Тогда устанавливается диагноз недифференцированного (неклассифицированного) колита, имеющего анамнестические, эндоскопические, рентгенологические и гистологические признаки, как ЯК, так и болезни Крона.
Воспалительное заболевание кишечника: симптомы, лечение и диагностика
Обзор
Что такое воспалительное заболевание кишечника (ВЗК)?
Воспалительное заболевание кишечника (ВЗК) — это группа заболеваний, вызывающих хроническое воспаление (боль и отек) в кишечнике. ВЗК включает болезнь Крона и язвенный колит. Оба типа влияют на пищеварительную систему. Лечение может помочь справиться с этим заболеванием на протяжении всей жизни.
Насколько распространено ВЗК?
До трех миллионов американцев страдают той или иной формой ВЗК.Заболевание поражает людей всех возрастов и полов. ВЗК чаще всего возникает в возрасте от 15 до 30 лет.
Какие бывают типы ВЗК?
Болезнь Крона и язвенный колит являются основными типами ВЗК. Типы включают:
- Болезнь Крона вызывает боль и опухоль в пищеварительном тракте. Это может повлиять на любую часть от рта до ануса. Чаще всего поражается тонкий кишечник и верхняя часть толстого кишечника.
- Язвенный колит вызывает отек и язвы (язвы) в толстой кишке (ободочной и прямой кишке).
- Микроскопический колит вызывает воспаление кишечника, которое можно обнаружить только под микроскопом.
В чем разница между воспалительным заболеванием кишечника (ВЗК) и синдромом раздраженного кишечника (СРК)?
ВЗК — болезнь; СРК — это синдром или группа симптомов. Причины и методы лечения разные.
СРК — это разновидность функционального желудочно-кишечного заболевания. Это влияет на работу кишечника, заставляя его сокращаться чаще (а иногда реже), чем обычно.СРК также известен как спастическая толстая кишка или нервный желудок.
IBS не вызывает воспаление и не повреждает кишечник, как ВЗК, поэтому визуализация не может обнаружить его и не увеличивает риск рака толстой кишки. Людям с СРК редко требуется госпитализация или хирургическое вмешательство.
Можно ли болеть ВЗК и СРК?
Да, возможно наличие и IBD, и IBS. Хотя ВЗК может вызывать симптомы СРК, нет никаких доказательств того, что наличие СРК увеличивает риск ВЗК.
Симптомы и причины
Что вызывает ВЗК?
Исследователи все еще пытаются определить, почему у некоторых людей развивается ВЗК.Три фактора, по-видимому, играют роль:
- Генетика: Каждый четвертый человек с ВЗК имеет семейный анамнез этого заболевания.
- Ответ иммунной системы: Иммунная система обычно борется с инфекциями. У людей с ВЗК иммунная система принимает пищу за чужеродные вещества. Он высвобождает антитела (белки) для борьбы с этой угрозой, вызывая симптомы ВЗК.
- Триггеры окружающей среды: Люди с семейным анамнезом ВЗК могут заболеть этим заболеванием после воздействия триггера окружающей среды.Эти триггеры включают курение, стресс, прием лекарств и депрессию.
Каковы симптомы ВЗК?
Симптомы ВЗК могут приходить и уходить. Они могут быть легкими или тяжелыми, появляться внезапно или постепенно. Периоды симптомов ВЗК — это обострения ВЗК. Когда у вас нет симптомов, у вас ремиссия.
Симптомы ВЗК включают:
Редко ВЗК может также вызывать:
Каковы осложнения воспалительного заболевания кишечника (ВЗК)?
Люди с ВЗК имеют более высокий риск развития рака толстой кишки (колоректального).Другие возможные осложнения включают:
- Анальный свищ (туннель, образующийся под кожей, соединяющий инфицированную анальную железу и задний проход).
- Стеноз или стриктура заднего прохода (сужение анального канала, где стул выходит из тела).
- Анемия (низкий уровень эритроцитов) или сгустки крови.
- Камни в почках.
- Заболевания печени, такие как цирроз и первичный склерозирующий холангит (воспаление желчных протоков).
- Нарушение всасывания и недостаточность питания (неспособность получать достаточное количество питательных веществ через тонкий кишечник).
- Остеопороз.
- Перфорированная кишка (отверстие или разрыв в толстой кишке).
- Токсичный мегаколон (сильное вздутие кишечника).
Диагностика и тесты
Как диагностируется ВЗК?
Болезнь Крона и язвенный колит вызывают аналогичные симптомы. Ни один тест не может диагностировать ни одно из состояний.
Чтобы поставить диагноз, ваш лечащий врач спросит о ваших симптомах. Обследование может начаться с общего анализа крови (CBC) и анализа стула для выявления признаков воспаления кишечника.
Вы также можете пройти один или несколько из следующих диагностических тестов:
- Колоноскопия для исследования толстого и тонкого кишечника.
- EUS (эндоскопическое ультразвуковое исследование) для проверки пищеварительного тракта на наличие отеков и язв.
- Гибкая ректороманоскопия для исследования внутренней части прямой кишки и заднего прохода.
- Визуальное сканирование , такое как компьютерная томография или МРТ, для проверки признаков воспаления или абсцесса.
- Верхняя эндоскопия для исследования пищеварительного тракта от рта до начала тонкой кишки.
- Капсульная эндоскопия с помощью небольшой камеры, которую вы проглатываете. Камера делает снимки во время прохождения через пищеварительный тракт.
Ведение и лечение
Что такое нехирургическое лечение воспалительного заболевания кишечника (ВЗК)?
Лечение ВЗК варьируется в зависимости от конкретного типа и симптомов. Лекарства могут помочь контролировать воспаление, чтобы у вас не было симптомов (ремиссии). Лекарства для лечения ВЗК включают:
- Аминосалицилаты (противовоспалительное средство, такое как сульфасалазин, месаламин или бальсалазид) минимизируют раздражение кишечника.
- Антибиотики лечат инфекции и абсцессы.
- Biologics прерывают сигналы иммунной системы, вызывающие воспаление.
- Кортикостероиды , такие как преднизон, контролируют иммунную систему и управляют обострениями.
- Иммуномодуляторы успокаивают сверхактивную иммунную систему.
Вы также можете воспользоваться этими безрецептурными препаратами для лечения ВЗК:
Какие хирургические методы лечения болезни Крона?
Примерно 7 из 10 человек с болезнью Крона в конечном итоге нуждаются в хирургическом вмешательстве, когда лекарства больше не облегчают симптомы.Во время резекции кишечника хирург:
- Удаляет пораженный сегмент кишечника.
- Соединяет два конца здорового кишечника вместе (анастомоз).
После операции оставшаяся часть кишечника адаптируется и функционирует так же, как и раньше. Примерно у 6 из 10 человек, перенесших операцию по поводу болезни Крона, в течение 10 лет будет рецидив. Вам может подойти еще одна резекция кишечника.
Какие хирургические методы лечения язвенного колита?
После 30 с лишним лет жизни с язвенным колитом примерно 1 из 3 человек нуждается в операции.
Хирург:
- Удаляет толстую кишку (колэктомия) или толстую и прямую кишку (проктоколэктомия).
- Соединяет тонкий кишечник и задний проход.
- Создает мешочек подвздошной кишки, в который собирается кал, который затем выходит через задний проход.
В редких случаях может потребоваться илеостомия вместо подвздошной сумки. Мешок для илеостомии прикрепляется снаружи живота для сбора стула.
Проктоколэктомия является лечебной. Симптомы не вернутся после операции по удалению толстой и прямой кишки.Однако у вас могут возникнуть проблемы с илеостомией или подвздошной кишкой, например, поучит (воспаление и инфекция).
Профилактика
Как предотвратить воспалительное заболевание кишечника (ВЗК)?
Хотя нет ничего, что можно сделать для предотвращения ВЗК, определенные изменения в питании и образе жизни могут контролировать симптомы. Вы можете:
- Ешьте небольшими порциями каждые два-четыре часа.
- Найдите здоровые способы справиться со стрессом, такие как медитация, движения, такие как тай-чи, прослушивание музыки или прогулка.
- Высыпайтесь и оставайтесь физически активными.
- Вести дневник питания, чтобы определять продукты, вызывающие вспышки ВЗК. Вы можете столкнуться с пищевой непереносимостью, например непереносимостью лактозы. Если это так, вашему организму труднее переваривать определенные продукты, что вызывает расстройство желудка.
- Сократите количество продуктов, раздражающих кишечник, например, волокнистых, острых, жирных или приготовленных с молоком. Во время обострения выбирайте мягкую безвкусную пищу, которая не вызывает воспаления.
- Сократите потребление кофеиновых, газированных и алкогольных напитков.Пейте больше воды, чтобы предотвратить обезвоживание.
- Бросить курить.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с воспалительным заболеванием кишечника (ВЗК)?
IBD — это пожизненное заболевание, но оно не должно сокращать продолжительность вашей жизни. При правильном лечении вы можете предотвратить обострения и добиться длительных периодов ремиссии.
Управлять таким пожизненным заболеванием, как ВЗК, может быть непросто. Для людей с ВЗК нет ничего необычного в том, чтобы впадать в тревогу или депрессию.Посещение консультанта по психическому здоровью может помочь.
Жить с
Когда мне следует позвонить своему врачу?
Вы должны позвонить своему врачу, если у вас возникли проблемы:
- Избыточное похудание.
- Сильная боль в животе или диарея.
- Повышенная температура или признаки инфекции.
- IBD под отбортовку.
- Признаки обезвоживания.
Какие вопросы я должен задать своему врачу?
Вы можете спросить своего поставщика медицинских услуг:
- Какой у меня тип ВЗК?
- Какое лечение для меня лучше всего?
- Каких продуктов или напитков мне следует избегать?
- Какие изменения в образе жизни мне следует сделать?
- Могу ли я столкнуться с другими проблемами?
- Стоит ли обращать внимание на признаки осложнений?
Записка из клиники Кливленда
Большинство людей с воспалительными заболеваниями кишечника (ВЗК) ведут активный образ жизни.Тем не менее, симптомы болезни Крона и язвенного колита могут разрушить жизнь. У некоторых людей наступает ремиссия (без симптомов) после приема лекарств. Некоторым людям требуется операция, чтобы справиться с серьезными обострениями симптомов. Ваш лечащий врач может посоветовать изменения в питании и образе жизни для лечения ВЗК.
Хроническое воспаление кишечника: воспалительное заболевание кишечника и рак толстой кишки, связанный с колитом
Воспалительные заболевания кишечника (ВЗК), включая болезнь Крона (БК) и язвенный колит (ЯК), являются хроническими воспалительными заболеваниями кишечника.Распространенность в США превышает 200 случаев на 100 000, а общее число пациентов с ВЗК составляет от 1 до 1,5 миллиона. БК может поражать все части желудочно-кишечного тракта, от рта до ануса, но чаще всего поражает дистальную часть тонкой кишки или подвздошной кишки и толстой кишки. ЯК приводит к воспалению толстой кишки, которое может поражать только прямую кишку или может прогрессировать проксимально, поражая часть или всю толстую кишку. Клинические симптомы включают диарею, боль в животе, желудочно-кишечное кровотечение и потерю веса.Серьезным длительным осложнением хронического воспаления является развитие рака прямой кишки. Долгое время была признана генетическая основа ВЗК, основанная на повышенном семейном риске. Однако значительное несоответствие БК у близнецов и гораздо менее надежное фенотипическое соответствие ЯК предполагают, что в патогенезе заболевания играют роль дополнительные факторы, включая факторы окружающей среды. За последние несколько лет прогресс в понимании молекулярных основ ВЗК ускорился, начиная с создания моделей колита на животных и заканчивая идентификацией конкретных генетических маркеров на основе анализа генов-кандидатов, сцепления генов и анализа ассоциаций в целом.Генетические исследования также привели к признанию важности факторов окружающей среды, особенно решающей роли микробиоты кишечника при БК и ЯК. Измененные иммунные ответы на нормальную кишечную флору являются ключевыми факторами патогенеза ВЗК. В этой теме исследования будут рассмотрены генетическая основа ВЗК, генетические и клеточные изменения, связанные с раком толстой кишки, связанным с колитом, а также новая роль кишечной микробиоты и других факторов окружающей среды.
Ключевые слова: Болезнь Крона; хроническое воспаление кишечника; рак толстой кишки, связанный с колитом; воспалительное заболевание кишечника; язвенный колит.
Границы | Стресс вызывает вспышку воспалительного заболевания кишечника у детей и взрослых
Введение
Воспалительное заболевание кишечника (ВЗК), которое включает язвенный колит (ЯК) и болезнь Крона (БК), является хроническим, рецидивирующим и перемежающимся кишечным воспалительным заболеванием (1), поражающим миллионы людей во всем мире (2). Примечательно, что ВЗК постепенно становится глобальным заболеванием, заболеваемость которым быстро растет в развивающихся индустриальных странах в двадцать первом веке (3).Хотя ВЗК может возникать в любом возрасте, у ~ 25% пациентов ВЗК диагностируется до 20 лет (4). Заболеваемость ВЗК у детей варьируется в разных странах, но общая тенденция растет во всем мире. Заболеваемость составляет около 0,5–23 / 1,00,000 для IBD, от 0,1 до 13,9 / 1,00,000 для CD, от 0,3 до 15,0 / 1,00,000 для UC (3, 5–7). В дополнение к обычным желудочно-кишечным симптомам (боль в животе, диарея, гематохезия и потеря веса), сходным с таковыми у взрослых, у детей могут быть уникальные проявления, включая замедленный рост и задержку полового созревания (8).ВЗК считается иммуноопосредованным кишечным расстройством, возникающим в результате сложных взаимодействий между генетикой, факторами окружающей среды и микробиотой кишечника (9). Было обнаружено, что различные факторы, такие как генетическая передача, нарушение иммунной системы кишечника, нарушение микробиоты кишечника, диета, инфекции, образ жизни, психологический стресс, нарушения сна, курение и воздействие антибиотиков в раннем возрасте, влияют на прогрессирование ВЗК на основе следующих факторов: исследования последних десятилетий (10, 11). Однако точный патофизиологический механизм ВЗК остается неясным.Его сложный и многофакторный патогенез, тяжесть симптомов, неопределенность состояния и прогноза, а также побочные реакции на лекарства и риск рака создают множество проблем для лечения ВЗК. Эти проблемы могут существенно повлиять на качество жизни пациентов, особенно из-за увеличения психосоциального бремени и возникновения психических расстройств. Для детей и подростков ВЗК может даже угрожать здоровому психосоциальному развитию.
Стресс может вызывать отклонения в поведении и / или психике, такие как тревожность и депрессия, а также влиять на функции внутренних органов, особенно пищеварительной системы.Сопутствующие психологические заболевания, особенно депрессия, имеют патофизиологические механизмы, аналогичные ВЗК. Провоспалительные цитокины и плазменный протеин C острой фазы повышены у пациентов с депрессией (12). Повышенный уровень малонового диальдегида, пероксида жирной кислоты, в сыворотке пациентов с депрессией предполагает, что психические расстройства могут быть связаны с окислением и окислительным стрессом (13). Между тем при депрессии также наблюдаются аутоиммунные изменения и бактериальные транслокации (14, 15). Таким образом, депрессия и ВЗК имеют общий путь, который, по-видимому, объясняет взаимодействие между двумя заболеваниями.В последние годы растет количество исследований, показывающих, что распространенность психических расстройств как у детей, так и у взрослых с ВЗК выше, чем у здоровых людей (16). Значительный прогресс был достигнут в выяснении патофизиологических механизмов ВЗК, что указывает на то, что стресс тесно связан с ВЗК. Накапливающиеся данные свидетельствуют о двунаправленном влиянии ВЗК и стресса. Основные механизмы включают иммунную дисфункцию, нарушение кишечной микробиоты, нарушение функции кишечного барьера и изменения нейроэндокринной системы (17).Кроме того, всякий раз, когда возникает стресс, будь то в раннем возрасте или во взрослом возрасте, это может в некоторой степени повлиять на развитие ВЗК.
В этой статье представлен обзор недавней литературы, посвященной связи между стрессом и ВЗК у детей и взрослых. В этом обзоре представлены как экспериментальные, так и клинические данные, иллюстрирующие важность стресса в патогенезе ВЗК. Наконец, дается представление о комплексных подходах к ведению ВЗК и потенциальных терапевтических последствиях психологического вмешательства.
Стресс: пути и патофизиология
Более 80 лет назад венгерский эндокринолог Ханс Хуго Бруно Селье впервые определил медицинский термин «стресс» как физиологические адаптивные реакции организмов на неблагоприятные угрозы (стрессоры), которые являются эндогенными или экзогенными, психологическими или физическими, реальными или предполагаемыми (18 ). Чтобы поддерживать гомеостаз под угрозой, организмы развили чрезвычайно сложную систему, называемую системой стресса, которая включает физиологические и поведенческие адаптации через соответствующие центральные и периферические нейроэндокринные реакции.Под воздействием длительного или тяжелого стресса организмы могут достичь состояния, называемого какостазом, при котором нарушаются многие жизненно важные физиологические функции, и могут развиваться многие острые и хронические заболевания (19). Вызванные стрессом расстройства возникают во многих системах по всему телу, среди которых желудочно-кишечный тракт является чувствительной системой.
Когда мозг получает сигнал стресса, активируются многочисленные пути, содержащие вегетативную нервную систему и ось гипоталамус-гипофиз-надпочечники (ось HPA) (20).Стресс из разных источников приводит к модификации оси мозг-кишечник, что в конечном итоге приводит к прогрессированию широкого спектра желудочно-кишечных расстройств. Часто встречающиеся заболевания включают ВЗК, синдром раздраженного кишечника (СРК), пептические язвы, аллергические реакции на пищевые антигены и гастроэзофагеальную рефлюксную болезнь. Возможные механизмы суммированы в следующих разделах (Рисунок 1).
Рисунок 1 . Пути воздействия стресса на воспалительные заболевания кишечника.Воздействие стресса на кишечник включает комплексные реакции нейрональной, эндокринной и иммунной систем. Стресс вызывает активацию оси мозг-кишечник, гипоталамо-гипофизарно-надпочечниковой оси (ось HPA), вегетативной нервной системы (ANS) и кишечной нервной системы (ENS), способствуя развитию воспалительного заболевания кишечника (IBD). через дисбактериоз, нарушение секреции и подвижности, нарушение кишечного барьера и высвобождение медиаторов воспаления. ЦНС, центральная нервная система; CRF, рилизинг-фактор кортикотропина; СП, вещество Р; 5-HT, 5-гидрокситриптамин.
Ось HPA
Фактор высвобождения кортикотропина (CRF) считается ключевым компонентом оси HPA. Он вырабатывается центральными и периферическими тканями в ответ на стресс. CRF играет важную роль в преобразовании стимулов в физические реакции мозга (21). Стресс напрямую активирует гипоталамус (в основном паравентрикулярное ядро системы гипоталамуса), чтобы высвободить CRF, побуждая переднюю долю гипофиза секретировать адренокортикотропный гормон, который дополнительно стимулирует кору надпочечников секретировать кортизол.В конечном итоге кортизол воздействует на все ткани тела через кровообращение. Рецепторы CRF, а также их лиганды, которые могут модулироваться стрессом, экспрессируются как в кишечнике, так и в головном мозге (22).
CRF воздействует на перистальтику кишечника, секрецию и слизистый барьер, играя роль в функциональных и органических нарушениях, таких как IBS и IBD (23). В экспериментальных исследованиях на животных CRF имеет противоположный эффект на верхний и нижний пищеварительный транзит, такой как ингибирование опорожнения желудка, уменьшение транзита через тонкий кишечник и увеличение транзита через толстую кишку и дефекации (24, 25).Кроме того, CRF может вызывать дегрануляцию тучных клеток и увеличивать проницаемость слизистой оболочки (26), что является ключевым механизмом кишечных расстройств. Блокирование CRF сдерживает развитие ВЗК за счет ингибирования дегрануляции тучных клеток и снижения фактора некроза опухоли-альфа (TNF-α) и продукции протеазы (27).
Результаты клинических исследований согласуются с вышеуказанными выводами. В одном исследовании здоровых добровольцев попросили выступить с публичной речью, чтобы вызвать психологическое давление. Давление, вызванное публичными выступлениями, увеличивало проницаемость кишечника только у субъектов со значительно повышенным уровнем кортизола, предполагая, что это влияет на активацию оси HPA.Кроме того, вводили периферические инъекции CRF для воспроизведения вызванного стрессом расстройства. Результаты показали, что экзогенная ХПН, а также психологический стресс могут увеличивать соотношение уровней экскреции с мочой фруктозы молока и маннита, показывая признаки повышенной проницаемости в тонком кишечнике. Кроме того, этот механизм, по-видимому, зависит от тучных клеток кишечника, поскольку он может быть отменен стабилизатором тучных клеток (28).
Во время стресс-индуцированных изменений кишечника эффекторные клетки, включая тучные клетки (28), нейтрофилы (29) и лимфоциты, а также провоспалительные цитокины, оказываются в центральном положении.Тучные клетки играют важную роль в передаче сигналов стресса в кишечник. Эксперименты на животных показали, что стресс может повредить функцию кишечного барьера в зависимости от тучных клеток, что может способствовать развитию ВЗК (30, 31). У крыс дикого типа хронический стресс может вызывать дисфункцию кишечного барьера, инфильтрацию воспалительных клеток, ультраструктурные изменения в эпителиальных клетках, а также пролиферацию и активацию тучных клеток. Напротив, функция и морфология кишечного эпителия не нарушаются у крыс с дефицитом тучных клеток, и нет доказательств инфильтрации воспалительных клеток, что подчеркивает регуляторную роль, которую играют тучные клетки (32).
Вегетативная нервная система
Симпатическая и парасимпатическая вегетативная нервная система обслуживает весь желудочно-кишечный тракт и тесно связана с кишечной нервной системой (ENS). Вместе эти системы регулируют секрецию, моторику, контроль сфинктера и микроциркуляцию в кишечнике (33). В стрессовых условиях ENS производит крупные нейропептиды, которые, в свою очередь, влияют на иммунитет кишечника и воспаление. Geboes et al. обнаружили, что у всех пациентов с БК и ЯК наблюдаются смешанные аномалии для разных типов клеток ENS (34).Другое исследование показало, что пациенты с ЯК имеют значительно более низкие вегетативные функции по сравнению с пациентами с БК и здоровой контрольной группой (35).
Стресс может активировать симпатическую вегетативную систему, что приводит к увеличению выработки основных гормонов мозгового вещества надпочечников, в основном катехоламинов, таких как адреналин и норадреналин. Катехоламины опосредуют увеличение центральных и периферических воспалительных цитокинов и активацию сигнального пути воспалительного ядерного фактора κB в ответ на стресс (36).Кроме того, блуждающий нерв, обладающий противовоспалительным действием, подавляется стрессом, что приводит к усилению системной воспалительной реакции на эндотоксин и воспалению кишечника (37, 38).
Кроме того, у пациентов с ВЗК были продемонстрированы изменения в тканевых уровнях нейромедиаторов. Стресс также может влиять на связанный с фолликулом эпителиальный барьер через вазоактивный кишечный полипептид (VIP) и его рецептор на тучных клетках слизистой оболочки. Эти данные подчеркивают важное влияние VIP-бактериально-эпителиальных взаимодействий на регуляцию функции кишечного барьера (39).В модели хронического сдерживающего стресса на мышах вещество P (SP) и его рецепторы усиливали экспрессию и высвобождение CRH в эозинофилах, что приводило к дисфункции эпителиального барьера, опосредованной тучными клетками (40). Другое исследование показало, что вызванная стрессом избегания воды (WAS) повышенная подвижность толстой кишки, вероятно, зависит от активации рецептора нейрокинина-1 (NK1R) в толстой кишке и повышенных уровней SP в сыворотке, что указывает на потенциальный механизм диареи у пациентов с ВЗК с тревогой или тревогой. депрессия (41).
Ось микробиоты, мозг-кишечник и иммунная система
Влияние микробиоты кишечника на ВЗК привлекло большое внимание в последнее десятилетие. Микробиота взаимодействует с осью мозг-кишечник через клетки слизистой оболочки, иммунные клетки и нервные окончания (42). Опубликованные данные клинических исследований и исследований на животных показывают, что стресс вызывает дисбактериоз. Стресс-индуцированный дисбактериоз характеризуется уменьшением количества Lactobacillus и усилением бактериальной транслокации. Примечательно, что снижение численности Lactobacillus способствует оппортунистическим инфекциям, вызываемым у обезьян Campylobacter jejuni и Shigella flexneri (43).Микробиота кишечника мышей-самцов, подвергшихся хроническому социальному поражению, характеризуется пониженным богатством и разнообразием. Прогнозируемый функциональный профиль показывает снижение функционального разнообразия. В частности, описана более низкая распространенность путей, участвующих в синтезе и метаболизме короткоцепочечных жирных кислот и предшественников нейромедиаторов (44). Исследование показало, что воздействие стресса ингибирует NOD-подобный рецептор, содержащий пириновый домен (NLRP) -6, инфламмасому, изменяя состав кишечной флоры, что приводит к воспалению кишечника.Интересно, что трансмиссивное кишечное воспаление, сопровождающееся повышенной регуляцией CRF и снижением NLRP6, наблюдалось после того, как мышей поместили вместе (45).
Стресс также может нарушить установленную толерантность и усилить иммунные реакции при хроническом воспалении кишечника. Повышенная кишечная проницаемость, вызванная стрессом, позволяет микробиоте преодолевать эпителиальный барьер кишечника, запускать иммунные реакции слизистой оболочки (42), а затем переноситься во вторичные лимфоидные органы (46) для активации врожденной иммунной системы.Недавнее исследование, основанное на модели колита, вызванного декстрансульфатом натрия (DSS), предоставило доказательства того, что хронический стресс увеличивает чувствительность к колиту из-за дисбактериоза и дисфункции иммунной системы. В условиях хронического стресса собственная пластинка толстой кишки показала инфильтрацию В-клеток, нейтрофилов и провоспалительных макрофагов ly6C hi . Изменения брыжеечных лимфатических узлов (MLN) также были обнаружены со значительным изменением доли иммунных клеток, связанных с MLN. Результаты этого исследования также показали заметную активацию передачи сигналов IL-6 / STAT3 в ответ на стресс.Интересно, что пагубные эффекты стресса не прекратились у мышей IL-6, , — / — , что указывает на то, что гипервоспалительная реакция не является реальной причиной. Напротив, когда кишечная микробиота была разделена кохаузингом или была разрушена антибиотиками, тяжесть вызванного DSS колита была неразличима между стрессовой и контрольной группами, что недвусмысленно предполагало, что микробиота кишечника ответственна за пагубные последствия стресса. В целом стресс нарушает микробиоту кишечника, вызывает дисфункцию иммунной системы и способствует развитию колита, вызванного DSS (47).Обнаружен новый феномен, показывающий, что стресс сдерживает подавляющее действие кишечных регуляторных Т-клеток (Tregs), вместо того, чтобы изменять их количество. Было обнаружено, что пролактин, медиатор, связанный со стрессом, может трансформировать фенотип кишечных Treg, тем самым способствуя воспалению кишечника (48).
Было показано, что вызванное стрессом нарушение флоры оказывает жизненно важное влияние на ВЗК, влияя на перекрестные помехи между хозяином и микробиотой и регулируя нейроиммунно-эндокринную систему (49–51).Между микробным ландшафтом кишечника, иммунной системой и нервной системой существует сложная сеть. Терапия, направленная на микробиоту, была выделена как новый подход к лечению системных воспалительных заболеваний, таких как ВЗК, рассеянный склероз, системный воспалительный артрит и астма (52). Общая терапия, направленная на микробиоту, включает антибиотики, антибактериальные конъюгированные вакцины, пробиотики, трансплантацию фекальной микробиоты (FMT) и другие вмешательства, которые изменяют состав сообщества (53).В заключение, эти методы лечения могут быть полезны как для физического, так и для психологического восстановления пациентов с ВЗК.
Взаимодействие стресса и ВЗК
В 1950-х годах ВЗК считалось психосоматическим расстройством (54), и предыдущие исследования продемонстрировали тесную связь между ВЗК и стрессом. В частности, пациенты с ВЗК часто подвергаются стрессу, который вызывает перепады настроения или даже приводит к психическим осложнениям. Между тем усиление эмоциональных расстройств может усугубить такие симптомы, как боль в животе, и, в свою очередь, усилить тяжесть ВЗК.
Распространенность сопутствующих психологических заболеваний при ВЗК
Психологические сопутствующие заболевания ВЗК у взрослых
Большинство клинических исследований показали, что расстройства настроения связаны с повышенным риском различных хронических заболеваний, таких как ВЗК, артрит, астма и сахарный диабет (55, 56). В когорте пациентов с ВЗК наблюдалась высокая частота психологического дистресса и сопутствующих заболеваний, включая депрессию, тревожные расстройства и биполярное расстройство (57). В исследовании, проведенном в Канаде, изучалась распространенность депрессии в двух типичных опросах большой выборки.Статистические данные показали, что показатели 12-месячной заболеваемости депрессией у людей с ВЗК и аналогичными кишечными расстройствами в вышеупомянутом опросе составляли 14,7 и 16,3% соответственно. Кроме того, у пациентов с ВЗК частота депрессии в три раза выше, чем у здоровых людей (58). В Национальном обследовании здоровья и питания американцев (NHANES) изучалась взаимосвязь между ВЗК и депрессией. В этом исследовании с большими данными было обнаружено, что ВЗК, характеризующаяся хроническим и рецидивирующим заболеванием, действует как независимый фактор риска депрессии (59).Обследование общественного здоровья в Канаде, проведенное в 2012 году, показало, что ВЗК тесно связано с генерализованным тревожным расстройством. Генерализованное тревожное расстройство идентифицировали по пожизненным критериям ВОЗ-CIDI. Результаты показали, что пациенты с ВЗК были склонны к генерализованной тревоге с двукратным увеличением заболеваемости (60). Neuendorf et al. отобрали 171 статью, в том числе 158 371 участника, для проведения всестороннего систематического обзора. Результаты показали, что у 35% пациентов с ВЗК развиваются симптомы тревоги, а у 21% — тревожные расстройства; У 22% пациентов с ВЗК появляются симптомы депрессии; и у 15% развивается депрессивное расстройство.Кроме того, это исследование показало, что это состояние чаще встречается в активный период болезни (61).
С целью изучения двунаправленной связи Sexton et al. оценивали активность симптомов, воспаление кишечника и воспринимаемый стресс с помощью индекса ВЗК Манитобы, калпротектина в стуле и шкалы воспринимаемого стресса Коэна в месяцы 0, 3 и 6. Было обнаружено, что воспринимаемый стресс в месяц 0 положительно коррелировал с активностью заболевания в 3-й и 6-й месяцы как в UC, так и в CD.Тем не менее, корреляции между воспалением кишечника, оцениваемым с помощью фекального кальпротектина, и ощущением стресса не обнаружено (62).
В общей сложности 403 665 пациентов с депрессией и 5323 986 человек без депрессии в анамнезе наблюдались в среднем в течение 6,7 лет. В общей сложности у 0,05% когорты депрессии развился CD, в то время как у 0,03% людей в когорте без депрессии развился CD. Кроме того, у 0,13% пациентов в когорте депрессии развился ЯК, и только у 0,09% пациентов в когорте без депрессии развился ЯК.По сравнению с когортой без депрессии нескорректированные риски БК и ЯК в когорте депрессии увеличились на 67 и 41% соответственно. После внесения поправок на различные сопутствующие факторы риск развития ВЗК оставался значительно повышенным в когорте депрессивных пациентов (63).
Психологические сопутствующие заболевания в детстве ВЗК
Несмотря на ограничение возрастных критериев включения для подростков, можно сделать вывод о том, что подростки с ВЗК имеют более высокую распространенность симптомов тревоги и депрессии (64, 65).Согласно отчетам родителей, эмоциональные проблемы, включая тревожное / подавленное настроение и замкнутость / депрессивное настроение, по-видимому, чаще встречаются у подростков с ВЗК, чем национальное обследование здоровья и питания в контрольной группе населения. Психосоциальные симптомы как со стороны родителей, так и со стороны самих родителей связаны с повышенной тяжестью воспринимаемых ими симптомов ВЗК (66). Распространенность психических заболеваний, особенно депрессии, среди молодых людей с ВЗК увеличивается (67). В проспективном исследовании 121 пациента с ВЗК в возрасте от 16 до 21 года 55% сообщили об усилении симптомов тревоги / депрессии, а 83% — о снижении качества жизни по сравнению с исходным уровнем (68).Исследование с участием 374 пациентов с ВЗК из Нидерландов выявило усиление симптомов сопутствующих психологических заболеваний как у подростков (10–17 лет), так и у молодых людей (18–25 лет), но разницы не было (64). Шведское исследование показало, что у детей с ВЗК младше 18 лет коэффициент риска смерти в зрелом возрасте в три раза выше, чем у детей в общей популяции. Самый высокий оценочный риск общей смертности был выше у пациентов с ЯК, чем у пациентов с БК (69).
Модели на животных для оценки психологического воздействия ВЗК
Подобные явления наблюдались в экспериментах на животных. Депрессивное и тревожное поведение было обнаружено у мышей с колитом, вызванным динитробензолсульфоновой кислотой (DNBS). Повышенная экспрессия воспалительных генов и дисфункция митохондрий в гиппокампе могут быть ответственны за ненормальное поведение мышей (70). Недавние исследования показали, что мыши с хроническим колитом демонстрируют повышенное поведение, связанное с тревогой, в тестах открытого поля и акустического стресса, что сопровождается висцеральной гиперчувствительностью и низким уровнем воспаления кишечника (71).
В целом пациенты с ВЗК более склонны к развитию эмоциональных расстройств, чем население в целом. Кроме того, депрессия и беспокойство отрицательно влияют на течение болезни. Психологическая коморбидность и ВЗК, кажется, попадают в порочный круг.
Влияние стресса на ВБК
В жизни всегда есть стрессы, которые меняются со временем. В зрелом возрасте стресс в основном возникает из-за семьи, работы, экономического положения и серьезных событий, угрожающих жизни. Воздействие антибиотиков, вакцинации, диеты, дыма и психосоциального стресса в раннем и детском возрасте, по-видимому, оказывает долгосрочное неблагоприятное влияние на протяжении всей жизни.Стрессоры в указанные выше периоды могут повышать восприимчивость в зрелом возрасте к диабету, сердечно-сосудистым заболеваниям, аутоиммунным заболеваниям, инсульту и некоторым видам рака (72–74).
Стресс и риск возникновения ВЗК
Когортное исследование ВБК, проведенное в Манитобе в Канаде, установило первое проявление психотических симптомов с помощью структурированного диагностического интервью. Отчет показал, что примерно у двух третей пациентов, страдающих как тревожным расстройством, так и ВЗК, на самом деле развились психиатрические симптомы до постановки диагноза ВЗК более чем на 2 года.Этот более чем 2-летний временной интервал для диагностики также присутствовал более чем у половины пациентов с ВЗК с расстройствами настроения. Более того, пациенты с ВЗК с пожизненной тревогой или расстройствами настроения демонстрировали более раннее начало симптомов ВЗК, чем пациенты без вышеуказанных расстройств, и была тенденция к ранней диагностике ВЗК (75). Эти результаты напомнили нам о потенциальных взаимодействиях между ВЗК и психическими заболеваниями. Возможно, что наличие этих психических заболеваний может повысить предрасположенность людей к ВЗК.
Недавние исследования были сосредоточены на долгосрочном воздействии неблагоприятных факторов раннего возраста на иммунную систему, включая нарушение клеточного иммунитета, усиление воспаления и ускоренное старение иммунитета (76, 77). Эксперимент на животных показал, что стресс в раннем детстве приводит к изменению микробиоты, усилению висцеральных ощущений и психическим заболеваниям (78). Недавнее исследование показало, что опосредованная фактором роста нервов (NGF) передача сигналов киназы A (TrkA) рецептора тропомиозина опосредует дисфункции кишечника, напоминающие СРК, вызванные разлучением с матерью новорожденного (79).Кроме того, существуют половые различия в влиянии неблагоприятных факторов ранней жизни на микробиоту кишечника и эмоциональное поведение (80). Разделение родителей в детстве может привести к психологическому стрессу во взрослом возрасте в той или иной степени. Неблагоприятное воздействие, вызванное этой ненормальной семейной структурой, способствует развитию ВЗК во взрослом возрасте (81). Исследователи проанализировали взаимосвязь между годовым ритмом появления симптомов ВЗК и академическими семестрами у детей. Результаты показали, что академический стресс может способствовать возникновению заболевания у детей с ВЗК (82).
В моделях на животных, по-видимому, существуют разные взгляды на то, увеличивает ли ранний стресс частоту ВЗК, что может быть связано с различными моделями и периодами стресса (83–85).
У животных, подвергшихся воздействию WAS, развилось острое воспаление тонкого кишечника, что было оценено с помощью гистологических баллов в экспериментальном исследовании. Лейкоцитарная инфильтрация, повышенная проницаемость кишечника, повышенный уровень сывороточного TNF-α и повышенная экспрессия IL-17 и IL-6 в слизистой оболочке также были обнаружены во время стресса (45).Кроме того, было обнаружено, что акустический стресс вызывает тяжелый энтерит в здоровом кишечном тракте (86). Хронический стресс может вызвать чрезмерный рост провоспалительных бактерий и, таким образом, вызвать повышенную восприимчивость к колиту у субъектов после трансплантации фекальной микробиоты. Известно, что стресс вызывает воспаление кишечника слабой степени за счет увеличения бактериальной транслокации и производства ядов (87).
Влияние стресса на течение IBD
Стресс вызывает широкий спектр последствий у пациентов с ВЗК, особенно при рецидивах и обострении болезни.Некоторые исследования показали, что высокий уровень воспринимаемого стресса влияет на частоту симптоматических обострений (88). Систематический обзор 15 высококачественных исследований пришел к выводу, что эмоции связаны с симптомами боли в животе у пациентов с ВЗК. Среди пациентов с ВЗК распространенными эмоциональными расстройствами являются депрессия, тревога и воспринимаемый стресс (89). Хотя симптомы явно усиливаются, активность ВЗК, оцениваемая по уровню калпротектина, может не проявляться во время воспринимаемого стресса (90).Напротив, поперечное исследование, проведенное в Германии с участием 1032 пациентов с ВЗК, показало, что соответствующие зарегистрированные депрессивные симптомы коррелируют с повышенными показателями активности заболевания (91). Помимо обострения симптомов, стресс также может привести к рецидиву у пациентов с ВЗК (92). Более того, в проспективном продольном исследовании 60 пациентов с ВЗК в покое наблюдались в течение 18 месяцев. Установлено, что исходная оценка депрессии связана со временем первого рецидива. В частности, у пациентов с тревогой наблюдалась повышенная частота рецидивов (93).Многоцентровое когортное исследование в Германии показало, что пациенты с CD более подвержены психологическим расстройствам, чем пациенты с UC или контрольная группа. По сравнению со здоровыми людьми из контрольной группы пациенты как с ЯК, так и с БК получили более высокие баллы по психологическим расстройствам и неадаптивным стресс-тестам на преодоление стресса во время активной фазы. Интересно, что пациенты с ЯК в ремиссии были минимально затронуты психологическими расстройствами, в то время как пациенты с БК в ремиссии проявляли незащищенность и параноидальные представления. Показатель невротизма у пациентов с БК оказался выше, чем у здоровых людей из контрольной группы, в то время как у пациентов с ЯК — нет (94).Другое исследование также показало, что у пациентов с CD с депрессией вероятность ухудшения состояния выше, чем у пациентов с UC с депрессией (95). Кроме того, проспективное исследование показало, что депрессия увеличивает риск БК, а не ЯК, у женщин (96). В исследовании, проведенном в Швейцарии, приняли участие 468 взрослых с БК, за которыми наблюдали в течение 18 месяцев. Результаты исследования показали, что среди тех, кто находился в состоянии стресса, у пациентов с тревогой и депрессией чаще развивалось обострение болезни, что указывает на значимость эмоциональных элементов (97).
Несколько недавних исследований выявили факторы помимо активности заболевания, связанные с болью при рождении. Было обнаружено, что факторы семейного стресса, такие как развод и потеря членов семьи, усиливают связанный с болью дистресс у детей, влияя на симптомы совладания и депрессии (98). 13% детей с БК все еще страдают от болей в животе, несмотря на клиническую ремиссию (99).
Сообщалось, что ограничивающий стресс усугубляет спонтанный колит у мышей IL-10 — / — по сравнению с мышами без стресса (100).Другое исследование продемонстрировало, что отделение новорожденных от матери вызывает нарушение барьера толстой кишки и усугубляет симптомы колита у взрослых мышей IL-10 — / — (83). Более того, недавнее исследование показало, что хронический стресс повреждает микробиоту кишечника и увеличивает восприимчивость к колиту, вызванному DSS, у мышей. Снижение экспрессии муцина-2 и лизоцима, вызванное стрессом, связано с нарушением микробиоты (47). Кроме того, 12 недель WAS значительно увеличили относительную численность рода Clostridium , который продуцирует токсинфосфолипазу C у мышей C57BL / 6.Было также доказано, что WAS изменяет концентрацию секретируемого в просвете просвета иммуноглобулина A, что, вероятно, связано с изменениями кишечной микробиоты и ухудшением, связанным с колитом (51).
Влияние стресса на прогноз ВЗК
Психосоциальная дисфункция отрицательно влияет на лечение ВЗК у взрослых. Психосоциальная дисфункция отрицательно сказывается на качестве жизни пациентов с ВЗК. Пациенты с ВЗК с сопутствующими психологическими заболеваниями чаще госпитализируются, чем пациенты без них (101).Опросник по воспалительному заболеванию кишечника (IBDQ), который включает симптомы кишечника (испражнения и боль в животе), системные симптомы, а также эмоциональные и социальные факторы, применялся для оценки связанного со здоровьем качества жизни (HRQOL) пациентов с IBD. Данные показали, что повышенный уровень воспринимаемого стресса, судя по шкале воспринимаемого стресса из 10 пунктов, является одним из наиболее прогностических факторов снижения качества жизни человека (102). Было подтверждено, что психологические симптомы, воспринимаемый стресс и тяжесть заболевания могут оказывать пагубное влияние на качество жизни человека (103, 104).Когортное исследование ВЗК в Бостоне, включавшее 5 405 пациентов с БК и 5429 пациентов с ЯК, показало, что у пациентов с БК с эмоциональными или тревожными расстройствами риск хирургического вмешательства на 28% выше по сравнению с пациентами без психосоциальных расстройств (105).
Недавнее исследование показало, что стресс может ингибировать эндогенные опиоиды и может переключать их передачу сигналов в нейронах ганглия дорсального корешка с торможения на возбуждение во время хронического колита, вызывая обострение боли и требуя повышенных доз опиоидных анальгетиков у пациентов с ВЗК (106).Для пациентов подросткового возраста с ВЗК несоблюдение режима лечения считается серьезной проблемой здравоохранения. Систематический обзор показал, что психосоциальные факторы, включая плохие стратегии выживания ребенка, семейную дисфункцию, тревогу и депрессивные симптомы, имеют отношение к несоблюдению режима лечения, что может привести к ненужной эскалации лечения и может поставить под угрозу результаты терапии ВЗК (107). .
Из-за двунаправленного эффекта между стрессом и ВЗК пациенты могут попасть в порочный круг, что приводит к плохому прогнозу.Поэтому следует обратить внимание на роль стресс-терапии в лечении ВЗК.
Управление ВЗК: целевой стресс
В соответствии с настоящими рекомендациями по клинической практике ВЗК, терапевтические вмешательства в основном включают 5-аминосалициловую кислоту (АСК), кортикостероиды, иммуномодуляторы, антибиотики, пробиотики и агенты против TNF. Эти традиционные методы лечения могут эффективно облегчить симптомы и способствовать заживлению слизистой оболочки (108). Тем не менее, с углубленным изучением неблагоприятных эффектов стресса на ВЗК, психическое исцеление, по-видимому, является конечной целью лечения ВЗК и, как ожидается, превзойдет заживление слизистой оболочки.Снятие психологического стресса имеет большое значение для улучшения симптомов и повышения качества жизни. Возникающая область психогастроэнтерологии сосредоточена на применении психотерапии головного мозга и кишечника, которая считается неотъемлемой частью лечения заболеваний пищеварительной системы (109). Хотя психотерапия имеет ограничения, ее следует рассматривать как одну из терапевтических стратегий при ВЗК.
Фармакологические препараты
Болевые симптомы у пациентов с ВЗК, по-видимому, связаны с воспалением кишечных нейронов (110).Кишечные неврологические аномалии, включая гиперплазию и гипертрофию глиальных клеток, были более выражены у пациентов с БК, чем у пациентов с ЯК (111), и, по-видимому, связаны с ухудшением симптомов и прогнозом у пациентов с БК. Воспаление кишечника может вызывать висцеральную гиперчувствительность периферических и центральных систем (112). Антидепрессанты полезны для облегчения хронической боли, особенно у пациентов с эмоциональными расстройствами (113). Исследования показали, что высокий процент пациентов с ВЗК получают психотропные препараты (114), причем около 30% пациентов принимают антидепрессанты (115).Селективные ингибиторы обратного захвата серотонина (СИОЗС) и трициклические антидепрессанты (ТЦА) являются наиболее распространенными препаратами, используемыми для лечения пациентов с ВЗК с эмоциональными осложнениями, особенно тревогой и депрессией (116). Было доказано, что ТЦА обладают противовоспалительным действием в кишечнике животных. Между тем, ТЦА, кажется, снимают сильную боль у пациентов с ВЗК даже в низких дозах. Однако ТЦА также могут вызывать побочные эффекты, такие как сухость во рту, помутнение зрения и запор, особенно в высоких дозах. Эти побочные эффекты обычно проходят через несколько недель.Тетрациклические антидепрессанты полезны для пациентов, страдающих нарушениями сна и болями, но они не испытывались на пациентах с ВЗК (117). Кроме того, было доказано, что пропранолол, ингибитор β1-адренорецепторов / β2-адренорецепторов, подавляет инфильтрацию нейтрофилов в толстой кишке и ослабляет повреждения тканей, вызванные хроническим стрессом, что указывает на потенциальную терапевтическую ценность нейропротекторов, которые предохраняют от рецидива ВЗК из-за подавление активации иммунной системы (29).
Психологические вмешательства
Немедикаментозные психологические вмешательства при ВЗК включают когнитивно-поведенческую терапию (КПТ), медицинский гипноз и медитацию осознанности.Некоторые исследования показали, что эти методы уменьшают желудочно-кишечные симптомы у пациентов с ВЗК (117, 118).
КПТ, специфичная для ВЗК, способствует повышению качества жизни и снижению тревожности и депрессии у пациентов с ВЗК с низким уровнем HRQOL (119). Кроме того, сравнительное исследование показало, что КПТ может помочь пациентам с ВЗК с умеренными и тяжелыми расстройствами настроения (120). Moser G использовал кишечную гипнотерапию (GHT) при лечении ВЗК. Результаты показали, что ГГТ может увеличивать продолжительность ремиссии у пациентов с неактивным ЯК (121).Клинический гипноз используется, чтобы помочь подросткам справиться с различными заболеваниями. Гипноз может эффективно облегчить хроническую боль в животе у подростков с ВЗК (122). Современные методы терапии осознанности включают снижение стресса осознанности и поведенческую когнитивную терапию внимательностью, большинство из которых используются у взрослых и показывают эффективность у пациентов, страдающих ВЗК. Кроме того, было обнаружено, что физическое и психическое вмешательство семинара «Дыхание-тело-разум» (BBMW) было полезным для пациентов с ВЗК для облегчения симптомов и эмоциональных расстройств (123).В качестве общепринятого метода декомпрессии йога представляется безопасным и эффективным методом лечения пациентов с ЯК (124). В исследовании подростков с ВЗК было обнаружено, что йога является эффективной дополнительной терапией. К сожалению, это был короткий обзор с небольшой выборкой (31).
Рандомизированное контролируемое исследование показало, что психотерапия (психотерапия, решение проблем и расслабление) для пациентов с ВЗК не препятствовала прогрессированию или рецидиву заболевания, но улучшала качество жизни (125).В параллельном групповом, рандомизированном и контролируемом исследовании оценивалась эффективность протокола КПТ по конкретному заболеванию в отношении тревожности, депрессивных симптомов и HRQOL у подростков и молодых людей с ВЗК. Предварительные результаты показали, что КПТ, специфичная для ВЗК, добавленная к стандартной медицинской помощи, не эффективнее, чем одна только стандартная медицинская помощь, в улучшении психологических симптомов или HRQOL у молодых людей с ВЗК (126).
Вмешательства оси мозг-кишечник-микробиота
С четкими доказательствами дисбактериоза кишечника при ВЗК новые методы лечения, несомненно, потребуют подхода, регулирующего микробиоту (127).Это была активная область исследований с неоднозначными результатами.
Хотя воздействие антибиотиков считается потенциальным фактором риска ВЗК (11, 128, 129), несколько метаанализов показали, что антибиотики эффективны для индукции ремиссии и лечения обострений у пациентов с ВЗК (130, 131). Антибиотикотерапия остается противоречивой, особенно с учетом текущих неоднозначных результатов и потенциальных рисков системных нежелательных явлений и устойчивости бактерий к антибиотикам (132, 133).Рифаксимин, несистемный бактерицидный антибиотик, может быть терапевтически полезным при ВЗК (134). Исследование показало, что видов Lactobacillus были значительно обогащены после перорального приема рифаксимина. Кроме того, лечение рифаксимином защищало от воспаления кишечника, повреждения барьера и висцеральной гиперчувствительности, вызванных хроническим избеганием воды и повторяющимися стрессорами сдерживания у крыс Wistar (135).
Добавки с пребиотиками и пробиотиками полезны для снижения поведения, связанного со стрессом, и активации HPA.Пробиотики, такие как Bifidobacterium и Lactobacillus , могут облегчить тревогу и депрессию (136). Arase et al. изучили терапию, направленную на микробиоту, и обнаружили, что пробиотик Lactobacillus штамм может помочь в защите от энтерита, усугубляемого стрессом (137). Исследования на животных показали, что Bifidobacterium P122, Lactobacillus LA804 и Lactobacillus Switzerland полезны при колите (138). B. longum 536 облегчает симптомы у пациентов с легким и умеренно активным ЯК (139).Однако недавнее исследование показало, что штамм B. breve в Якульте не замедлял время рецидива по сравнению с плацебо у пациентов с неактивным ЯК. Этот результат может быть связан с дефицитом в количестве B. breve (140). Большинство исследований показали, что пробиотики полезны для пациентов с ВЗК. Эффективность и безопасность пробиотиков для облегчения воспаления кишечника у пациентов с ВЗК требует дополнительных исследований (141).
FMT стал полезным и все более доступным методом лечения благодаря банкам стула (142).Рандомизированные контролируемые исследования показали, что FMT в некоторой степени эффективен при лечении ЯК (143, 144). В проспективном исследовании 21 ребенок со средним возрастом 12 лет, с ВЗК, не поддающимся лечению, были подвергнуты единственному FMT. Клинические ответы наблюдались у 57 и 28% пациентов через 1 и 6 месяцев после FMT соответственно (145). Paramsothy et al. провели систематический обзор и метаанализ для оценки эффективности и безопасности FMT при ВЗК. Всего было включено 53 исследования (41 в UC, 11 в CD, 4 в pouchitis), опубликованных до января 2017 года.Результаты показали, что частота клинической ремиссии при ЯК, БК и поучите составила 36, 50,5 и 21,5% соответственно. Субанализы показали, что ремиссия при ЯК улучшалась при введении в нижний отдел желудочно-кишечного тракта и увеличении количества инфузий FMT (146). Однако некоторые исследователи не обнаружили значительных различий в эффективности FMT, что может быть связано с количеством и циклом клизм, процессом приготовления и ограниченным количеством (147, 148). Дальнейшим многообещающим направлением были бы более крупномасштабные исследования, оценивающие безопасность и эффективность FMT для пациентов с ВЗК.
Rooks et al. продемонстрировали, что генетическая инактивация кворум-чувствительного регулятора С Escherichia coli (QseC) может снизить вирулентность и способность к колонизации в патогенном, ассоциированном с ВЗК штамме E. coli . Дальнейшие результаты показали, что биохимическое ингибирование QseC может уменьшить воспаление кишечника в различных доклинических моделях ВЗК и обеспечивает новый подход к лечению колита (149). Кроме того, диетические вмешательства, которые модулируют взаимодействие между иммунной системой и микробиотой, также могут быть вариантом лечения ВЗК (150).
Исследования эффективности психотерапии и психофармакологического лечения пациентов с ВЗК противоречивы и ограничены. Систематический обзор литературы показал, что 1/3 из включенных 43 исследований подтверждают эффективность психотерапии в отношении качества жизни и активности болезни (113). Для подтверждения этого результата необходимы дополнительные исследования. Как вспомогательная терапия, управление стрессом не может полностью заменить лекарства. Кроме того, изучение микробиома кишечника и диетическая терапия могут стать будущими направлениями лечения ВЗК.
Перспективы
Достаточно доказательств того, что частота сопутствующих психических заболеваний у пациентов с ВЗК выше, чем у здоровых людей из контрольной группы. В свою очередь, эти сопутствующие заболевания усугубляют симптомы ВЗК и способствуют воспалению кишечника. Основные механизмы могут включать изменения нейроэндокринной системы и оси мозг-кишечник-микробиота. Однако точные механизмы, лежащие в основе иммунной активации слизистых оболочек, еще предстоит изучить. Следует подчеркнуть влияние психологического стресса на ВЗК, особенно у детей и подростков, из-за уникальных психологических проблем, с которыми сталкивается педиатрическое население.На данный момент некоторые клинические данные подтверждают мнение о том, что управление стрессом, например, с помощью упражнений на расслабление, полезно для пациентов с ВЗК, особенно для тех, кто не поддается лечению. Психологическая оценка может выступать в качестве нового показателя для оценки тяжести и прогноза ВЗК. В ходе будущего лечения ВЗК необходимо уделять особое внимание управлению эмоциями, снятию стресса, использованию психотропных препаратов и заботе со стороны семьи. Кроме того, следует подчеркнуть, что сочетание лечения слизистой оболочки и психологического лечения в качестве конечной цели терапии улучшит прогноз.Лечение ВЗК выходит далеко за рамки традиционных лекарств и хирургического лечения. Что более важно, так это практика психогастроэнтерологии, которая кажется многообещающей.
Авторские взносы
Рукопись написалиYS и LL. Обзор разработали HC, RX, KJ и BW. YS, LL и RX участвовали в поиске литературы. YS и RX разработали и создали фигуру. ХК внес критические исправления. Все авторы прочитали рукопись и в конечном итоге одобрили статью.
Финансирование
Это исследование было поддержано грантами 81741075 и 81570478 Национального фонда естественных наук Китая, а также грантом 17JCYBJC24900 и Тяньцзиньской исследовательской программой прикладного фонда и передовых технологий Китая.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
3. Ng SC, Shi HY, Hamidi N, Underwood FE, Tang W., Benchimol EI, et al. Заболеваемость и распространенность воспалительных заболеваний кишечника в 21 веке во всем мире: систематический обзор популяционных исследований. Ланцет. (2018) 390: 2769–78.DOI: 10.1016 / S0140-6736 (17) 32448-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Sýkora J, Pomahačová R, Kreslová M, Cvalínová D, Štych P, Schwarz J. Текущие глобальные тенденции заболеваемости воспалительными заболеваниями кишечника у детей. World J Gastroenterol. (2018) 24: 2741–63. DOI: 10.3748 / wjg.v24.i25.2741
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Бенчимол Э.И., Фортински К.Дж., Гоздира П., Ван ден Хеувель М., Ван Лимберген Дж., Гриффитс AM.Эпидемиология воспалительных заболеваний кишечника у детей: систематический обзор международных тенденций. Воспаление кишечника. (2011) 17: 423–39. DOI: 10.1002 / ibd.21349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Abraham BP, Mehta S, El-Serag HB. Естественная история воспалительного заболевания кишечника у детей: систематический обзор. J Clin Gastroenterol. (2012) 46: 581–9. DOI: 10.1097 / MCG.0b013e318247c32f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.de Souza HSP, Fiocchi C, Iliopoulos D. Интерактом IBD: комплексный взгляд на этиологию, патогенез и терапию. Nat Rev Gastroenterol Hepatol. (2017) 14: 739–49. DOI: 10.1038 / nrgastro.2017.110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Анантакришнан А.Н., Бернштейн С.Н., Илиопулос Д., Макферсон А., Нейрат М.Ф., Ай РАР и др. Экологические триггеры в IBD: обзор прогресса и доказательств. Nat Rev Gastroenterol Hepatol. (2018) 15: 39–49.DOI: 10.1038 / nrgastro.2017.136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Леонард Б., Маес М. Механистические объяснения того, как клеточно-опосредованная активация иммунной системы, воспаление и пути окислительного и нитрозативного стресса, а также их последствия и сопутствующие факторы играют роль в патофизиологии униполярной депрессии. Neurosci Biobehav Rev. (2012) 36: 764–85. DOI: 10.1016 / j.neubiorev.2011.12.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Маес М., Кубера М., Михайлова И., Геффард М., Галецки П., Леунис Дж. К. и др. Повышенные аутоиммунные ответы против аутоэпитопов, модифицированных окислительным и нитрозативным повреждением при депрессии: последствия для путей к хронической депрессии и нейропрогрессии. J Affect Disord. (2013) 149: 23–9. DOI: 10.1016 / j.jad.2012.06.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Олссон Л., Густафссон А., Лавант Е., Сунесон К., Брундин Л., Вестрин А. и др.Биомаркеры протекающего кишечника при депрессии и суицидальном поведении. Acta Psychiatr Scand. (2019) 139: 185–93. DOI: 10.1111 / acps.12978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Кери С., Сабо С., Келемен О. Экспрессия толл-подобных рецепторов в мононуклеарных клетках периферической крови и ответ на когнитивно-поведенческую терапию при большом депрессивном расстройстве. Brain Behav Immun. (2014) 40: 235–43. DOI: 10.1016 / j.bbi.2014.03.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Микока-Валус А., Ноулз С. Р., Кифер Л., Графф Л. Повторные дискуссии: систематический обзор коморбидности депрессии и тревоги с воспалительными заболеваниями кишечника. Воспаление кишечника. (2016) 22: 752–62. DOI: 10.1097 / MIB.0000000000000620
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Konturek PC, Brzozowski T, Konturek SJ. Стресс и кишечник: патофизиология, клинические последствия, диагностический подход и варианты лечения. J Physiol Pharmacol. (2011) 62: 591–9.
PubMed Аннотация | Google Scholar
18. Chrousos GP, Gold PW. Понятия стресса и расстройства стрессовой системы. Обзор физического и поведенческого гомеостаза. JAMA. (1992) 267: 1244–52. DOI: 10.1001 / jama.1992.034800034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Николаидес NC, Кираци Э., Лампрокостопулу А., Хрусос Г.П., Чармандари Э. Стресс, система стресса и роль глюкокортикоидов. Нейроиммуномодуляция. (2015) 22: 6–19. DOI: 10.1159 / 000362736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Larauche M, Kiank C, Tache Y. Передача сигналов рилизинг-фактора кортикотропина в толстой и подвздошной кишке: регуляция стрессом и патофизиологические последствия. J Physiol Pharmacol. (2009) 60 (Дополнение 7): 33–46.
PubMed Аннотация | Google Scholar
23. Tache Y, Larauche M, Yuan PQ, Million M. Передача сигналов CRF в мозге и кишечнике: биологические действия и роль в желудочно-кишечном тракте. Curr Mol Pharmacol. (2018) 11: 51–71. DOI: 10.2174 / 1874467210666170224095741
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Chatoo M, Li Y, Ma Z, Coote J, Du J, Chen X. Участие кортикотропин-рилизинг-фактора и рецепторов в иммунных клетках при синдроме раздраженного кишечника. Front Endocrinol. (2018) 9:21. DOI: 10.3389 / fendo.2018.00021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Czimmer J, Tache Y.Передача сигналов периферического рилизинг-фактора кортикотропина подавляет опорожнение желудка: механизмы действия и роль в связанных со стрессом желудочных изменениях двигательной функции. Curr Pharm Des. (2017) 23: 4042–7. DOI: 10.2174/1381612823666170228142428
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Hill LT, Kidson SH, Michell WL. Фактор высвобождения кортикотропина: возможный ключ к дисфункции кишечника у тяжелобольных. Питание. (2013) 29: 948–52.DOI: 10.1016 / j.nut.2012.12.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Оверман Е.Л., Ривье Дж. Э., Мозер А. Дж. CRF вызывает повреждение кишечного эпителиального барьера за счет высвобождения протеаз тучных клеток и TNF-α. PLoS ONE. (2012) 7: e39935. DOI: 10.1371 / journal.pone.0039935
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Вануйцель Т., ван Ванрой С., Ванхил Х., Ванормелинген С., Вершуерен С., Хубен Э. и др.Психологический стресс и кортикотропин-рилизинг-гормон увеличивают кишечную проницаемость у людей по механизму, зависящему от тучных клеток. Gut. (2014) 63: 1293–9. DOI: 10.1136 / gutjnl-2013-305690
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Дэн Ц., Чен Х, Лю И, Сяо Ф, Го Л., Лю Д. и др. Психологический стресс способствует инфильтрации нейтрофилов в ткани толстой кишки посредством адренергической передачи сигналов в модели колита, индуцированного DSS. Brain Behav Immun. (2016) 57: 243–54. DOI: 10.1016 / j.bbi.2016.04.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Викарио М., Гиларте М., Алонсо К., Ян П., Мартинес С., Рамос Л. и др. Хронологическая оценка опосредованной тучными клетками дисфункции кишечника и воспаления слизистой оболочки на крысиной модели хронического психосоциального стресса. Brain Behav Immun. (2010) 24: 1166–75. DOI: 10.1016 / j.bbi.2010.06.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Арруда Дж. М., Богец А. Л., Велланки С., Рен А., Йе А. М.. Йога как дополнительная терапия для подростков с воспалительным заболеванием кишечника: пилотное клиническое испытание. Complement Ther Med. (2018) 41: 99–104. DOI: 10.1016 / j.ctim.2018.09.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Седерхольм Дж. Д., Янг П. К., Сепонис П., Вохра А., Ридделл Р., Шерман П. М. и др. Хронический стресс вызывает зависящее от тучных клеток связывание бактерий и инициирует воспаление слизистой оболочки кишечника крысы. Гастроэнтерология. (2002) 123: 1099–108. DOI: 10.1053 / gast.2002.36019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Вилланаччи В., Бассотти Г., Насимбени Р., Антонелли Е., Кадей М., Физони С. и др. Нарушения кишечной нервной системы при воспалительных заболеваниях кишечника. Neurogastroenterol Motil. (2008) 20: 1009–16. DOI: 10.1111 / j.1365-2982.2008.01146.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Шарма П., Махария Г.К., Ахуджа В., Двиведи С.Н., Дипак К.К. Вегетативные дисфункции у пациентов с воспалительными заболеваниями кишечника в стадии клинической ремиссии. Dig Dis Sci. (2009) 54: 853–61. DOI: 10.1007 / s10620-008-0424-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Джонсон Дж. Д., Кампизи Дж., Шарки С. М., Кеннеди С. Л., Никерсон М., Гринвуд Б. Н. и др. Катехоламины опосредуют вызванное стрессом повышение периферических и центральных воспалительных цитокинов. Неврология. (2005) 135: 1295–307. DOI: 10.1016 / j.neuroscience.2005.06.090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. де Йонге WJ, ван дер Занден EP, The FO, Bijlsma MF, van Westerloo DJ, Bennink RJ, et al. Стимуляция блуждающего нерва ослабляет активацию макрофагов за счет активации сигнального пути Jak2-STAT3. Nat Immunol. (2005) 6: 844–51. DOI: 10.1038 / ni1229
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38.Meregnani J, Clarençon D, Vivier M, Peinnequin A, Mouret C, Sinniger V и др. Противовоспалительный эффект стимуляции блуждающего нерва на крысиной модели воспалительного заболевания кишечника. Auton Neurosci. (2011) 160: 82–9. DOI: 10.1016 / j.autneu.2010.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Кейта А.В., Карлссон А.Х., Сиген М., Эриксон А.С., Маккей Д.М., Седерхольм Д.Д. Вазоактивный кишечный полипептид регулирует барьерную функцию через тучные клетки в эпителии кишечного фолликула человека и во время стресса у крыс. Neurogastroenterol Motil. (2013) 25 e406–17. DOI: 10.1111 / nmo.12127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Zheng PY, Feng BS, Oluwole C, Struiksma S, Chen X, Li P и др. Психологический стресс побуждает эозинофилы вырабатывать в кишечнике рилизинг-гормон кортикотропина. Gut. (2009) 58: 1473–9. DOI: 10.1136 / gut.2009.181701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Лу П, Луо Х, Цюань Х, Фан Х, Тан Кью, Ю Г и др.Роль вещества P в поддержании повышенной подвижности толстой кишки, вызванной повторным стрессом у крыс. Нейропептиды. (2016) 56: 75–82. DOI: 10.1016 / j.npep.2016.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Килиан А.Дж., Сондерс П.Р., Бийлсма П.Б., Берин М.С., Таминиау Дж.А., Грут Дж.А. и др. Стресс стимулирует трансэпителиальный захват макромолекул в тощей кишке крыс. Am J Physiol. (1998) 275 G1037–44. DOI: 10.1152 / ajpgi.1998.275.5.G1037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Bailey MT. Содействующая роль кишечной микробиоты в индуцированном стрессором повышении восприимчивости к кишечной инфекции и системной иммуномодуляции. Horm Behav. (2012) 62: 286–94. DOI: 10.1016 / j.yhbeh.2012.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Бхарвани А., Миан М.Ф., Фостер Дж. А., Суретт М.Г., Биненшток Дж., Форсайт П. Структурные и функциональные последствия хронического психосоциального стресса для микробиома и хозяина. Психонейроэндокринология. (2016) 63: 217–27. DOI: 10.1016 / j.psyneuen.2015.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Sun Y, Zhang M, Chen CC, Gillilland M, Sun X, El-Zaatari M, et al. Индуцированное стрессом подавление инфламмасомы NLRP6, опосредованное кортикотропин-рилизинг-гормоном, и трансмиссивный энтерит у мышей. Гастроэнтерология. (2013) 144: 1478–87, 1487.e1–8. DOI: 10.1053 / j.gastro.2013.02.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Бейли MT, Энглер H, Шеридан JF. Стресс вызывает транслокацию кожной и желудочно-кишечной микрофлоры во вторичные лимфоидные органы мышей C57BL / 6. J Neuroimmunol. (2006) 171: 29–37. DOI: 10.1016 / j.jneuroim.2005.09.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Гао Х, Цао Кью, Ченг Й., Чжао Д., Ван З., Ян Х. и др. Хронический стресс способствует развитию колита, нарушая микробиоту кишечника и вызывая реакцию иммунной системы. Proc Natl Acad Sci USA. (2018) 115: E2960–9. DOI: 10.1073 / pnas.1720696115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Wu W, Sun M, Zhang HP, Chen T, Wu R, Liu C и др. Пролактин опосредует вызванную психологическим стрессом дисфункцию регуляторных Т-клеток, способствуя воспалению кишечника. Gut. (2014) 63: 1883–92. DOI: 10.1136 / gutjnl-2013-306083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Ватанабэ И, Арасе С., Нагаока Н., Каваи М., Мацумото С.Хронический психологический стресс нарушил состав микробиоты толстой кишки мышей и ускорил создание модели воспалительного заболевания кишечника на мышах. PLoS ONE. (2016) 11: e0150559. DOI: 10.1371 / journal.pone.0150559
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Uchiyama K, Naito Y, Takagi T. Кишечный микробиом как новая терапевтическая мишень для местного и системного воспаления. Pharmacol Ther. (2019) 199: 164–72. DOI: 10.1016 / j.Pharmthera.2019.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Филипчич И., Шимунович Ф.И., Грошич В., Бакия И., Шаго Д., Беняк Т. и др. Модели хронической физической мультиморбидности в психиатрической и общей популяции. J Psychosom Res. (2018) 114: 72–80. DOI: 10.1016 / j.jpsychores.2018.09.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Скотт К.М., Лим К., Аль-Хамзави А., Алонсо Дж., Брюффертс Р., Калдас-де-Алмейда Дж. М. и др.Связь психических расстройств с последующими хроническими физическими состояниями: мировые исследования психического здоровья в 17 странах. JAMA Psychiatry. (2016) 73: 150–8. DOI: 10.1001 / jamapsychiatry.2015.2688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Марри Р.А., Уоллд Р., Болтон Дж. М., Сарин Дж., Уокер Дж. Р., Паттен С. Б. и др. Сопутствующие соматические заболевания повышают риск сопутствующих психических заболеваний при иммуноопосредованном воспалительном заболевании. Gen Hosp Psychiatry. (2018) 51: 71–8. DOI: 10.1016 / j.genhosppsych.2018.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Фуллер-Томсон Э., Сульман Дж. Депрессия и воспалительные заболевания кишечника: результаты двух репрезентативных на национальном уровне исследований в Канаде. Воспаление кишечника. (2006) 12: 697–707. DOI: 10.1097 / 00054725-200608000-00005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Бхандари С., Ларсон М.Э., Кумар Н., Стейн Д.Ассоциация воспалительного заболевания кишечника (ВЗК) с депрессивными симптомами в популяции США и независимые предикторы депрессивных симптомов в популяции ВЗК: исследование NHANES. Кишечная печень. (2017) 11: 512–9. DOI: 10.5009 / gnl16347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Фуллер-Томсон E, Lateef R, Sulman J. Устойчивая связь между воспалительным заболеванием кишечника и генерализованным тревожным расстройством: результаты национального репрезентативного канадского исследования. Воспаление кишечника. (2015) 21: 2341–8. DOI: 10.1097 / MIB.0000000000000518
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Neuendorf R, Harding A, Stello N, Hanes D, Wahbeh H. Депрессия и тревога у пациентов с воспалительным заболеванием кишечника: систематический обзор. J Psychosom Res. (2016) 87: 70–80. DOI: 10.1016 / j.jpsychores.2016.06.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Секстон К.А., Уокер Дж. Р., Графф Л. А., Бернштейн М. Т., Бити Б., Миллер Н. и др.Доказательства двунаправленной связи между воспринимаемым стрессом и активностью симптомов: проспективное продольное исследование воспалительного заболевания кишечника. Воспаление кишечника. (2017) 23: 473–83. DOI: 10.1097 / MIB.0000000000001040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Фролкис А.Д., Валлеран И.А., Шахин А.А., Лоуэрисон М.В., Суэйн М.Г., Барнабе С. и др. Депрессия увеличивает риск воспалительного заболевания кишечника, который можно уменьшить, применяя антидепрессанты для лечения депрессии. Gut. (2018) 68: 1606–12. DOI: 10.1136 / gutjnl-2018-317182
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. van den Brink G, Stapersma L, Vlug LE, Rizopolous D, Bodelier AG, van Wering H, et al. Клиническая активность заболевания связана с тревожными и депрессивными симптомами у подростков и молодых людей с воспалительным заболеванием кишечника. Aliment Pharmacol Ther. (2018) 48: 358–69. DOI: 10.1111 / apt.14832
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65.Reigada LC, Hoogendoorn CJ, Walsh LC, Lai J, Szigethy E, Cohen BH и др. Симптомы тревоги и тяжесть заболевания у детей и подростков с болезнью Крона. J Pediatr Gastroenterol Nutr. (2015) 60: 30–5. DOI: 10.1097 / MPG.0000000000000552
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Väistö T, Aronen ET, Simola P, Ashorn M, Kolho KL. Психосоциальные симптомы и компетентность подростков с воспалительными заболеваниями кишечника и их сверстников. Воспаление кишечника. (2010) 16: 27–35. DOI: 10.1002 / ibd.21002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Брукс А.Дж., Роуз Дж., Райдер А., Пич Э.Дж., Корф Б.М., Лобо А.Дж.. Систематический обзор: психологическая заболеваемость у молодых людей с воспалительными заболеваниями кишечника — факторы риска и последствия. Aliment Pharmacol Ther. (2016) 44: 3–15. DOI: 10.1111 / apt.13645
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Брукс А.Дж., Норман П., Пич Э.Дж., Райдер А.Х., Скотт А.Дж., Нарула П. и др.Проспективное исследование психологической заболеваемости и восприятия болезней у молодых людей с воспалительными заболеваниями кишечника. J Crohns Colitis. (2019) 13: 1003–11. DOI: 10.1093 / ecco-jcc / jjz028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Олен О., Асклинг Дж., Сакс М.К., Фрументо П., Неовиус М., Смедби К.Э. и др. Повышенная смертность пациентов с воспалительными заболеваниями кишечника в детском возрасте по сравнению с населением в целом. Гастроэнтерология. (2019) 156: 614–22. DOI: 10.1053 / j.gastro.2018.10.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Хадж-Мирзаян А., Амири С., Амини-Хоэй Х., Хоссейни М.Дж., Хадж-Мирзаян А., Момени М. и др. Поведение, подобное тревожному и депрессивному, связано с изменением энергии гиппокампа и воспалительным статусом на мышиной модели болезни Крона. Неврология. (2017) 366: 124–37. DOI: 10.1016 / j.neuroscience.2017.10.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71.Salameh E, Meleine M, Gourcerol G, do RJC, do RJL, Legrand R и др. Висцеральная боль, вызванная хроническим колитом, связана с повышенной тревожностью во время фазы покоя. Am J Physiol Gastrointest Liver Physiol. (2019) 316: G692–700. DOI: 10.1152 / ajpgi.00248.2018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Ольвера А.Х., Кубзанский Л.Д., Кампен М.Дж., Славич Г.М. Стресс в раннем возрасте, загрязнение воздуха, воспаление и болезни: комплексный обзор и иммунологическая модель социально-экологических неблагоприятных факторов и здоровья на протяжении всей жизни. Neurosci Biobehav Rev. (2018) 92: 226–42. DOI: 10.1016 / j.neubiorev.2018.06.002
CrossRef Полный текст | Google Scholar
73. Slopen N, Koenen KC, Кубзанский LD. Неблагоприятные факторы в детстве, иммунные и воспалительные биомаркеры, связанные с сердечно-сосудистым риском у молодежи: систематический обзор. Brain Behav Immun. (2012) 26: 239–50. DOI: 10.1016 / j.bbi.2011.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Уокер Дж. Р., Эдигер Дж. П., Графф Л. А., Гринфельд Дж. М., Клара И., Ликс Л. и др.Когортное исследование Manitoba IBD: популяционное исследование распространенности пожизненных и 12-месячных тревожных и эмоциональных расстройств. Am J Gastroenterol. (2008) 103: 1989–97. DOI: 10.1111 / j.1572-0241.2008.01980.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. MMC E, Kuehn A, Muller CP, Turner JD. Влияние невзгод в раннем возрасте на иммунную систему. Психонейроэндокринология. (2017) 82: 140–54. DOI: 10.1016 / j.psyneuen.2017.05.012
CrossRef Полный текст | Google Scholar
78.О’Махони С.М., Марчези Дж. Р., Скалли П., Кодлинг С., Сеолхо А. М., Куигли Е. М. и др. Стресс в раннем возрасте изменяет поведение, иммунитет и микробиоту у крыс: последствия для синдрома раздраженного кишечника и психических заболеваний. Biol Psychiatry. (2009) 65: 263–7. DOI: 10.1016 / j.biopsych.2008.06.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. HLX W, Qin HY, Tsang SW, Zuo X, Che S, CFW C и др. Стресс в раннем возрасте нарушает гомеостаз кишечника посредством передачи сигналов NGF-TrkA. Nat Commun. (2019) 10: 1745. DOI: 10.1038 / s41467-019-09744-3
CrossRef Полный текст | Google Scholar
80. Ринсель М., Обер П., Шевалье Дж., Грохард П.А., Бассо Л., де Оливейра С.М. и др. Множественные невзгоды в раннем возрасте влияют на микробиоту кишечника, мозг и поведение в зависимости от пола. Brain Behav Immun. (2019) 80: 179–92. DOI: 10.1016 / j.bbi.2019.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Włodarczyk M, Sobolewska-Włodarczyk A, Stec-Michalska K, Fichna J, Wiśniewska-Jarosinska M.Влияние аномалий семейного уклада на ранних этапах жизни на течение воспалительных заболеваний кишечника. Pharmacol Rep. (2016) 68: 852–8. DOI: 10.1016 / j.pharep.2016.04.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Кришна М.З., Бартон К.Р., Перес С.М., Уолш С.М., Асса А., Келлермайер Р. Академический стресс может способствовать возникновению воспалительных заболеваний кишечника у детей. J Pediatr Gastroenterol Nutr. (2018) 67: e73–6.DOI: 10.1097 / MPG.0000000000002032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Леннон Е.М., Махаршак Н., Эллуми Х., Борст Л., Плеви С.Е., Мозер А.Дж. Стресс в раннем детстве вызывает стойкую дисфункцию кишечного барьера и обостряет колит у взрослых мышей IL-10 — / -. Воспаление кишечника. (2013) 19: 712–9. DOI: 10.1097 / MIB.0b013e3182802a4e
CrossRef Полный текст | Google Scholar
84. Риба А., Олиер М., Лакруа-Ламанд С., Ленсина С., Бакке В., Харкат С. и др.Стресс в раннем возрасте у мышей является подходящей моделью для синдрома раздраженного кишечника, но не предрасполагает к колиту и не повышает восприимчивость к кишечным инфекциям. Brain Behav Immun. (2018) 73: 403–15. DOI: 10.1016 / j.bbi.2018.05.024
CrossRef Полный текст | Google Scholar
85. Veenema AH, Reber SO, Selch S, Obermeier F, Neumann ID. Стресс в раннем возрасте повышает уязвимость взрослых мышей к хроническому психосоциальному стрессу и экспериментальному колиту. Эндокринология. (2008) 149: 2727–36. DOI: 10.1210 / en.2007-1469
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Bernstein CN, Singh S, Graff LA, Walker JR, Miller N, Cheang M. Проспективное популяционное исследование триггеров симптоматических обострений при ВЗК. Am J Gastroenterol. (2010) 105: 1994–2002. DOI: 10.1038 / ajg.2010.140
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Суини Л., Мосс-Моррис Р., Цубер-Дочан В., Мид Л., Чамбли Дж., Нортон К.Систематический обзор: психосоциальные факторы, связанные с болью при воспалительном заболевании кишечника. Aliment Pharmacol Ther. (2018) 47: 715–29. DOI: 10.1111 / apt.14493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Бокемейер Б., Хардт Дж., Хюппе Д., Пренцлер А., Конрад С., Дюффельмейер М. и др. Клинический статус, психосоциальные нарушения, лечение и расходы на здравоохранение для пациентов с воспалительным заболеванием кишечника (ВЗК) в Германии: онлайн-реестр ВЗК. J Crohns Colitis. (2013) 7: 355–68. DOI: 10.1016 / j.crohns.2012.02.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Jaghult S, Saboonchi F, Moller J, Johansson UB, Wredling R, Kapraali M. Стресс как триггер для рецидивов при ВЗК: перекрестное исследование. Gastroenterology Res. (2013) 6: 10–16. DOI: 10.4021 / gr528e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Mittermaier C, Dejaco C, Waldhoer T., Oefferlbauer-Ernst A, Miehsler W., Beier M, et al.Влияние депрессивного настроения на рецидив у пациентов с воспалительным заболеванием кишечника: проспективное 18-месячное последующее исследование. Psychosom Med. (2004) 66: 79–84. DOI: 10.1097 / 01.psy.0000106907.24881.f2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Петруо В.А., Краусс Э., Клейст А., Хардт Дж., Хейк К., Пейрано Дж. И др. Воспринимаемый дистресс, личностные характеристики, стратегии преодоления и психосоциальные нарушения в многоцентровой когорте пациентов с болезнью Крона и язвенным колитом в Германии. Z Гастроэнтерол. (2019) 57: 473–83. DOI: 10.1055 / a-0838-6371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Alexakis C, Kumar S, Saxena S, Pollok R. Систематический обзор с метаанализом: влияние депрессивного состояния на течение болезни при воспалительном заболевании кишечника у взрослых. Aliment Pharmacol Ther. (2017) 46: 225–35. DOI: 10.1111 / apt.14171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Анантакришнан А.Н., Халили Х., Пан А., Хигучи Л.М., де Сильва П., Рихтер Дж. М. и др.Связь между депрессивными симптомами и заболеваемостью болезнью Крона и язвенным колитом: результаты исследования здоровья медсестер. Clin Gastroenterol Hepatol. (2013) 11: 57–62. DOI: 10.1016 / j.cgh.2012.08.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Камара Р.Дж., Шопфер А.М., Питте В., Бегре С., фон К.Р. Компоненты настроения и отсутствия настроения воспринимаемого стресса и обострения болезни Крона. Воспаление кишечника. (2011) 17: 2358–65.DOI: 10.1002 / ibd.21623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Рид-Найт Б., ван Тилбург М.А.Л., Леви Р.Л., Лангер С.Л., Романо Дж. М., Мерфи Т. Б. и др. Неадаптивное совладание и депрессивные симптомы частично объясняют связь между семейным стрессом и связанным с болью дистрессом у молодежи с ВЗК. J Pediatr Psychol. (2018) 43: 94–103. DOI: 10.1093 / jpepsy / jsx082
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99.Циммерман Л.А., Сринат А.И., Гоял А., Бусварош А., Дюшарм П., Сигети Е. и др. Наложение функциональной боли в животе при болезни Крона у детей. Воспаление кишечника. (2013) 19: 826–31. DOI: 10.1097 / MIB.0b013e3182802a0a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Ко С.Дж., Ким Дж.В., Ким Б.Г., Ли К.Л., Ким Дж.С. Сдерживающий стресс вызывает и обостряет воспаление кишечника у мышей с дефицитом интерлейкина-10. World J Gastroenterol. (2015) 21: 8580–7.DOI: 10.3748 / wjg.v21.i28.8580
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Mikocka-Walus AA, Turnbull D, Holtmann G, Andrews JM. Интегрированная модель помощи пациентам с воспалительными заболеваниями кишечника в Австралии: разработка и результаты ее внедрения. Воспаление кишечника. (2012) 18: 1573–81. DOI: 10.1002 / ibd.22850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Табибиан А., Табибиан Дж. Х., Бекман Л. Дж., Раффалс Л. Л., Пападакис К. А., Кейн С. В..Предикторы качества жизни, связанного со здоровьем, и приверженности лечению при болезни Крона и язвенном колите: значение для клинического ведения. Dig Dis Sci. (2015) 60: 1366–74. DOI: 10.1007 / s10620-014-3471-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Гатри Э., Джексон Дж., Шаффер Дж., Томпсон Д., Томенсон Б., Крид Ф. Психологическое расстройство и тяжесть воспалительного заболевания кишечника позволяют прогнозировать качество жизни, связанное со здоровьем, при язвенном колите и болезни Крона. Am J Gastroenterol. (2002) 97: 1994–9. DOI: 10.1111 / j.1572-0241.2002.05842.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Энгельманн Г., Эрхард Д., Петерсен М., Парзер П., Шларб А.А., Реш Ф. и др. Связанное со здоровьем качество жизни подростков с воспалительным заболеванием кишечника зависит от активности заболевания и сопутствующей психической патологии. Детская психиатрия Hum Dev. (2015) 46: 300–7. DOI: 10.1007 / s10578-014-0471-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105.Анантакришнан А.Н., Гейнер В.С., Перес Р.Г., Цай Т., Ченг С.К., Савова Г. и др. Сопутствующие психические заболевания связаны с повышенным риском хирургического вмешательства при болезни Крона. Aliment Pharmacol Ther. (2013) 37: 445–54. DOI: 10.1111 / apt.12195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Герреро-Альба Р., Вальдес-Моралес Е.Е., Хименес-Варгас Н.Н., Лопес-Лопес К., Харамилло-Поланко Дж., Окамото Т. и др. Стресс активирует проноцицептивную эндогенную передачу опиоидных сигналов в нейронах DRG во время хронического колита. Gut. (2017) 66: 2121–31. DOI: 10.1136 / gutjnl-2016-311456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Spekhorst LM, Hummel TZ, Benninga MA, van Rheenen PF, Kindermann A. Приверженность пероральному поддерживающему лечению у подростков с воспалительным заболеванием кишечника. J Pediatr Gastroenterol Nutr. (2016) 62: 264–70. DOI: 10.1097 / MPG.0000000000000924
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108.Мацуока К., Кобаяси Т., Уэно Ф., Мацуи Т., Хираи Ф., Иноуэ Н. и др. Основанные на фактических данных клинические рекомендации по воспалительным заболеваниям кишечника. J Гастроэнтерол. (2018) 53: 305–53. DOI: 10.1007 / s00535-018-1439-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Кифер Л., Палссон О.С., Пандольфино Дж. Э. Обновление передовой практики: включение психогастроэнтерологии в управление расстройствами пищеварения. Гастроэнтерология. (2018) 154: 1249–57.DOI: 10.1053 / j.gastro.2018.01.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Beyak MJ, Vanner S. Воспаление вызванная гипервозбудимостью ноцицептивных желудочно-кишечных нейронов DRG: роль потенциалзависимых ионных каналов. Neurogastroenterol Motil. (2005) 17: 175–186. DOI: 10.1111 / j.1365-2982.2004.00596.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Сринатх А.И., Уолтер К., Ньюара М.К., Сигети Э.М.Управление болью у пациентов с воспалительным заболеванием кишечника: идеи для клинициста. Терапевт Гастроэнтерол. (2012) 5: 339–57. DOI: 10.1177 / 1756283X12446158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Tarricone I, Regazzi MG, Bonucci G, Rizzello F, Carini G, Muratori R и др. Распространенность и эффективность психиатрического лечения пациентов с ВЗК: систематический обзор литературы. J Psychosom Res. (2017) 101: 68–95.DOI: 10.1016 / j.jpsychores.2017.07.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Микока-Валус А.А., Гордон А.Л., Стюарт Б.Дж., Эндрюс Дж.М. Роль антидепрессантов в лечении воспалительного заболевания кишечника (ВЗК): краткий отчет о ревизии клинического случая. J Psychosom Res. (2012) 72: 165–7. DOI: 10.1016 / j.jpsychores.2011.06.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Микока-Валус А., Пради С.Л., Поллок Дж., Эстерман А.Дж., Гордон А.Л., Ноулз С. и др.Адъювантная терапия антидепрессантами для лечения воспалительного заболевания кишечника. Кокрановская база данных Syst Rev. (2019) 4: CD012680. DOI: 10.1002 / 14651858.CD012680.pub2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Thorkelson G, Bielefeldt K, Szigethy E. Эмпирически подтвержденное использование психиатрических препаратов у подростков и взрослых с ВЗК. Воспаление кишечника. (2016) 22: 1509–22. DOI: 10.1097 / MIB.0000000000000734
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117.Сигети Э. Управление болью у пациентов с воспалительным заболеванием кишечника. Гастроэнтерол Гепатол. (2018) 14: 53–56.
PubMed Аннотация | Google Scholar
118. Каселлас Дж. Ф., Вера М. И., Баррейро-де А. М., Васкес М. Дж. М., Лопес Р. Дж., Худес Дж. Дж. Управление железодефицитной и железодефицитной анемией при воспалительном заболевании кишечника. Результаты исследования «Gestiona hierro-EII». Rev Esp Enferm Dig. (2018) 110: 172–8. DOI: 10.17235 / reed.2018.5354 / 2017
CrossRef Полный текст | Google Scholar
119.Беннебрук Э.Ф., MAG S, Ситникова К., PCF S, Ponsioen CY, Bartelsman JFWM B и др. Эффективность когнитивно-поведенческой терапии на качество жизни, тревожность и депрессивные симптомы у пациентов с воспалительным заболеванием кишечника: многоцентровое рандомизированное контролируемое исследование. J Консультируйтесь с Clin Psychol. (2017) 85: 918–925. DOI: 10.1037 / ccp0000227
CrossRef Полный текст | Google Scholar
120. Джордан С., Хейи Б., Чалдер Т. Когнитивно-поведенческая терапия для лечения дистресса у людей с воспалительным заболеванием кишечника: сравнительное исследование. Clin Psychol Psychother. (2019) 26: 14–23. DOI: 10.1002 / cpp.2326
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Sawni A, Breuner CC. Клинический гипноз, эффективный метод психофизического лечения для подростков с поведенческими и физическими жалобами. Дети. (2017) 4: E19. DOI: 10.3390 / children4040019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Гербарг П.Л., Якоб В.Е., Стивенс Л., Босуорт Б.П., Чабуни Ф., ДеФилиппис Е.М. и др.Влияние дыхания, движения и медитации на психологические и физические симптомы и воспалительные биомаркеры при воспалительном заболевании кишечника: рандомизированное контролируемое исследование. Воспаление кишечника. (2015) 21: 2886–96. DOI: 10.1097 / MIB.0000000000000568
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Крамер Х., Шефер М., Шёльс М., Кёке Дж., Эльзенбрух С., Лауч Р. и др. Рандомизированное клиническое испытание: йога против письменных советов по уходу за собой при язвенном колите. Aliment Pharmacol Ther. (2017) 45: 1379–89. DOI: 10.1111 / apt.14062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Бойе Б., Лундин К.Е., Янцчек Г., Легангер С., Моклеби К., Танген Т. и др. Исследование INSPIRE: улучшает ли управление стрессом течение воспалительного заболевания кишечника и качество жизни пациентов с язвенным колитом или болезнью Крона, страдающих заболеванием? Рандомизированное контролируемое исследование. Воспаление кишечника. (2011) 17: 1863–73.DOI: 10.1002 / ibd.21575
CrossRef Полный текст | Google Scholar
126. Стаперса Л., ван ден Бринк Дж., Ван дер Энде Дж., Сигети Е.М., Бекерс Р., Корпершук Т.А. и др. Эффективность когнитивно-поведенческой терапии, связанной с конкретным заболеванием, на тревожность, депрессию и качество жизни у молодежи с воспалительным заболеванием кишечника: рандомизированное контролируемое исследование. J Pediatr Psychol. (2018) 43: 967–80. DOI: 10.1093 / jpepsy / jsy029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127.Нокс NC, Forbes JD, Van Domselaar G, Bernstein CN. Микробиом кишечника как мишень для лечения ВЗК: мы еще там? Curr Treat Options Gastroenterol. (2019) 17: 115–26. DOI: 10.1007 / s11938-019-00221-w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Унгаро Р., Бернштейн С.Н., Гирри Р., Хвиид А., Колхо К.Л., Кронман М.П. и др. Антибиотики, связанные с повышенным риском впервые возникшей болезни Крона, но не язвенного колита: метаанализ. Am J Gastroenterol. (2014) 109: 1728–38. DOI: 10.1038 / ajg.2014.246
CrossRef Полный текст | Google Scholar
129. Теохари Н.А., Стефанопулос А., Милонас К.С., Экономопулос К.П. Воздействие антибиотиков и риск воспалительного заболевания кишечника: систематический обзор. Сканд Дж Гастроэнтерол. (2018) 53: 1–7. DOI: 10.1080 / 00365521.2017.1386711
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Kerman DH, Deshpande AR. Микробиота кишечника и воспалительные заболевания кишечника: роль антибиотиков в управлении заболеванием. Postgrad Med. (2014) 126: 7–19. DOI: 10.3810 / PGM.2014.07.2779
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131. Хан К.Дж., Ульман Т.А., Форд А.С., Абреу М.Т., Абадир А., Абадир А. и др. Антибактериальная терапия при воспалительном заболевании кишечника: систематический обзор и метаанализ. Am J Gastroenterol. (2011) 106: 661–73. DOI: 10.1038 / ajg.2011.72
PubMed Аннотация | CrossRef Полный текст | Google Scholar
133. Хансен Дж. Дж., Сартор РБ.Терапевтическая манипуляция микробиомом при ВЗК: текущие результаты и будущие подходы. Curr Treat Options Gastroenterol. (2015) 13: 105–20. DOI: 10.1007 / s11938-014-0042-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Sartor RB. Обзорная статья: потенциальные механизмы действия рифаксимина при воспалительных заболеваниях кишечника. Aliment Pharmacol Ther. (2016) 43 (Дополнение 1): 27–36. DOI: 10.1111 / apt.13436
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135.Xu D, Gao J, Gillilland M III, Wu X, Song I, Kao JY и др. Рифаксимин изменяет кишечные бактерии и предотвращает вызванное стрессом воспаление кишечника и висцеральную гипералгезию у крыс. Гастроэнтерология. (2014) 146: 484–96.e4. DOI: 10.1053 / j.gastro.2013.10.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Фостер Дж. А., Ринаман Л., Крайан Дж. Ф. Стресс и ось кишечник-мозг: регулирование микробиомом. Neurobiol Stress. (2017) 7: 124–36. DOI: 10.1016 / j.ynstr.2017.03.001
CrossRef Полный текст | Google Scholar
137. Аразе С., Ватанабе Й., Сетояма Х., Нагаока Н., Кавай М., Мацумото С. Нарушение комменсальных бактерий слизистой оболочки связано с обострением хронического колита из-за повторяющегося психологического стресса; это новая цель пробиотиков. PLoS ONE. (2016) 11: e0160736. DOI: 10.1371 / journal.pone.0160736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138.Alard J, Peucelle V, Boutillier D, Breton J, Kuylle S, Pot B и др. Новые пробиотические штаммы для лечения воспалительных заболеваний кишечника, идентифицированные путем комбинирования подходов in vitro, и in vivo, . Benef Microbes. (2018) 9: 317–31. DOI: 10.3920 / BM2017.0097
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139. Тамаки Х., Накасе Х., Иноуэ С., Каванами С., Итани Т., Охана М. и др. Эффективность лечения пробиотиками Bifidobacterium longum 536 для индукции ремиссии при активном язвенном колите: рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Dig Endosc. (2016) 28: 67–74. DOI: 10.1111 / den.12553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Мацуока К., Уэмура Ю., Канаи Т., Кунисаки Р., Сузуки Ю., Йокояма К. и др. Эффективность ферментированного молока Bifidobacterium breve в поддержании ремиссии язвенного колита. Dig Dis Sci. (2018) 63: 1910–19. DOI: 10.1007 / s10620-018-4946-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
142.Ooijevaar RE, Terveer EM, Verspaget HW, Kuijper EJ, Keller JJ. Клиническое применение и возможности трансплантации фекальной микробиоты. Annu Rev Med. (2019) 70: 335–51. DOI: 10.1146 / annurev-med-111717-122956
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143. Моайеди П., Суретт М.Г., Ким П.Т., Либертуччи Дж., Вулф М., Ониски С. и др. Трансплантация фекальной микробиоты вызывает ремиссию у пациентов с активным язвенным колитом в рандомизированном контролируемом исследовании. Гастроэнтерология. (2015) 149: 102–9.e6. DOI: 10.1053 / j.gastro.2015.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144. Paramsothy S, Kamm MA, Kaakoush NO, Walsh AJ, van den Bogaerde J, Samuel D, et al. Многодонорная интенсивная трансплантация фекальной микробиоты при активном язвенном колите: рандомизированное плацебо-контролируемое исследование. Ланцет. (2017) 389: 1218–28. DOI: 10.1016 / S0140-6736 (17) 30182-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145.Гоял А., Йе А., Буш Б.Р., Файрек Б.А., Зиболд Л.М., Роджерс МБ и др. Безопасность, клинический ответ и результаты микробиома после трансплантации фекальной микробиоты у детей с воспалительным заболеванием кишечника. Воспаление кишечника. (2018) 24: 410–21. DOI: 10.1093 / ibd / izx035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
146. Paramsothy S, Paramsothy R, Rubin DT, Kamm MA, Kaakoush NO, Mitchell HM, et al. Трансплантация фекальной микробиоты при воспалительном заболевании кишечника: систематический обзор и метаанализ. J Crohns Colitis. (2017) 11: 1180–99. DOI: 10.1093 / ecco-jcc / jjx063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147. Нишида А., Имаеда Х, Оно М., Инатоми О, Бамба С., Сугимото М. и др. Эффективность и безопасность трансплантации единичной фекальной микробиоты японским пациентам с язвенным колитом легкой и средней степени активности. J Гастроэнтерол. (2017) 52: 476–82. DOI: 10.1007 / s00535-016-1271-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
148.Россен Н. Г., Фуэнтес С., ван дер Спек М. Дж., Тейссен Дж. Г., Хартман Дж. Х., Дюфлоу А. и др. Результаты рандомизированного контролируемого исследования трансплантации фекалий пациентам с язвенным колитом. Гастроэнтерология. (2015) 149: 110–8.e4. DOI: 10.1053 / j.gastro.2015.03.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Грачи М.Г., Вейга П., Ривз А.З., Лавуа С., Ясуда К., Асано Ю. и др. Ингибирование QseC как антивирулентный подход к бактериям, ассоциированным с колитом. Proc Natl Acad Sci USA. (2017) 114: 142–7. DOI: 10.1073 / pnas.1612836114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
150. Витковски М., Витковски М., Гаглиани Н., Хубер С. Рецепт от ВЗК: можем ли мы использовать пищу для борьбы с воспалительными заболеваниями кишечника. Semin Immunopathol. (2018) 40: 145–56. DOI: 10.1007 / s00281-017-0658-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
границ | Взаимодействие между кишечной микробиотой и иммунным ответом хозяина при воспалительном заболевании кишечника
Введение
Воспалительное заболевание кишечника (ВЗК), включая язвенный колит (ЯК) и болезнь Крона (БК), представляет собой хроническое и рецидивирующее воспалительное состояние желудочно-кишечного тракта (ЖКТ), характеризующееся болью в животе, диареей и кровавым стулом (1–3) .ВЗК поражает примерно 3,7 миллиона человек в Северной Америке и Европе (4–6). Кроме того, за последние два десятилетия рост заболеваемости ВЗК наблюдается в азиатских странах, таких как Китай (7), Индия, Южная Корея (4, 8) и Саудовская Аравия (9). Хотя БК и ЯК имеют частично совпадающие патологические и клинические симптомы, существуют различные клинические характеристики; например, CD может поражать один или несколько сегментов пищеварительного тракта, тогда как UC в основном ограничивается слизистым слоем толстой или прямой кишки, не затрагивая другие области желудочно-кишечного тракта (2, 10).Клинические проявления ВЗК были четко определены много лет назад. Тем не менее этиология и патогенез этого расстройства остаются в значительной степени неуловимыми (11). Идентификация генетических локусов, связанных с восприимчивостью к ВЗК, указала на роль генетического фона в патофизиологии ВЗК (12). Однако сам по себе генетический полиморфизм не предсказывает развитие ВЗК, что подчеркивает участие других факторов окружающей среды в патогенезе (13).
Кишечник человека является средой обитания 100 триллионов различных микробных организмов, включая бактерии, вирусы, грибы и простейшие, которых в 10 раз больше, чем всех клеток в организме человека (14, 15).Обычно считается, что кишечник человека заселяется комменсальными микробами из влагалищного канала, кожи, фекалий или грудного молока во время родов или после родов (16, 17). Филогенетическое разнообразие кишечной микробиоты увеличивается с ростом и развитием и в конечном итоге приводит к сложному и относительно стабильному сообществу микроорганизмов в возрасте примерно 2–3 лет (18, 19). На основе методов молекулярного профилирования, не зависящих от культуры (20, 21), подсчитано, что в желудочно-кишечном тракте представлено более 1000 видов бактерий, большинство из которых являются облигатно-анаэробными организмами, в том числе Firmicutes, Bacteroidetes, Proteobacteria , и Actinobacteria (22).Среди них Firmicutes (грамположительные) и Bacteroidetes (грамотрицательные) являются преобладающими типами среди всех видов млекопитающих, составляя более 90% всех кишечных бактерий (12, 23–25). Общее количество и состав бактерий различаются в разных сегментах желудочно-кишечного тракта, при этом относительно небольшое количество и несколько видов бактерий обитают в желудке и верхней части тонкой кишки. Количество резидентных микробов увеличивается от тощей кишки к каждой последующей части кишечника, достигая 10 12 / г в кале (18, 26).
Изменения в составе кишечных бактерий могут влиять на гомеостаз кишечника через различные сигнальные пути, влияя, таким образом, на взаимодействие между бактериями и хозяином (27, 28). Кишечные бактерии отвечают за разложение неперевариваемых углеводов с образованием короткоцепочечных жирных кислот (SCFA), синтез витаминов (витамин K, витамин B12 и фолиевая кислота), синтез аминокислот и регуляцию метаболизма жиров, что необходимо. для целостности кишечной барьерной функции (29–31).Соответственно, исследования показали, что крипты тонкого кишечника стерильных мышей атрофичны, имеют пониженную скорость пролиферации и нарушенный ангиогенез (32, 33). Кроме того, бактерии в кишечнике защищают эпителий кишечника от вредного воздействия патогенов, подавляя колонизацию патогенных бактерий и производя антимикробные соединения, тем самым способствуя гомеостазу (34). Кроме того, кишечная микробиота активно стимулирует и способствует развитию и созреванию иммунной системы, которая необходима для защиты организма от патогенов и периферической иммунной толерантности против потенциальных антигенов в просвете (35–37).Резидентная микробиота кишечника жизненно важна для физиологии и здоровья хозяина. Однако это не означает, что конкретный вид полностью полезен (38). Bacteroides fragilis , комменсальная бактерия, которая хорошо контролируется в нормальных условиях, как сообщается, проникает в ткани кишечника и представляет серьезную угрозу для людей с ослабленным иммунитетом (39).
На разнообразие и состав кишечной флоры может влиять диета, факторы окружающей среды, стресс, образ жизни, экзогенные пробиотики и использование антибиотиков (40, 41), что, в свою очередь, может влиять на гомеостаз кишечника.Взаимоотношения и взаимодействие между кишечной флорой и хозяином все больше привлекают внимание как ученых-исследователей, так и практикующих врачей, и это привело к лучшему пониманию микробиома человека в последние годы (42). Соответственно, дисфункция взаимодействия между кишечной микробиотой и хозяином может привести к чрезмерному воспалительному ответу и способствовать инициированию и / или прогрессированию ВЗК (28), синдрома кишечного кишечника и функциональной диспепсии у людей (43), таким образом подчеркивая критическая роль кишечной микробиоты для здоровья и ВЗК (44).Учитывая эти наблюдения, ВЗК рассматривается как чрезмерная активация иммунного ответа хозяина на кишечную микробиоту у генетически предрасположенных пациентов (7). Здесь мы обобщаем текущую литературу, в которой описывается связь между микробиотой кишечника и иммунным ответом хозяина в патогенезе ВЗК, а также потенциальные терапевтические стратегии, включающие модуляцию кишечной микросистемы.
Кишечная микробиота при ВБК
Большое количество исследований показали, что нарушение нормальных микробных популяций в желудочно-кишечном тракте связано как с острыми инфекциями, такими как инфекция Clostridium difficile (CDI) , так и с хроническими заболеваниями, включая ВЗК, синдром раздраженного кишечника, метаболические заболевания. и аутоиммунные расстройства (45, 46).Термин «дисбактериоз» был впервые введен в употребление Мечниковым в начале двадцатого века для описания изменений кишечных бактерий, которые были дополнительно определены и расширены другими (47). Концепция дисбактериоза подразумевает, что дисбаланс в микробной экосистеме нарушает иммунный гомеостаз и приводит к кишечным расстройствам, включая как БК, так и ЯК (48). Он подчеркивает критическую роль взаимодействий между кишечной флорой и иммунной системой хозяина в патогенезе кишечных заболеваний (49).В первоначальном исследовании, проведенном в 2002 году, Swidsinski et al. продемонстрировали, что обилие микробиоты слизистой оболочки у пациентов с ВЗК положительно коррелирует с тяжестью заболевания (50). Хотя они не наблюдали существенных изменений в составе кишечной флоры у пациентов с ВЗК из-за технологических ограничений (24, 25), это первое исследование, показывающее возможную связь между бактериями и ВЗК. В последнее десятилетие применение независимых от культуры молекулярных подходов к изучению разнообразия кишечной микробиоты улучшило наше понимание кишечной микробиоты и иммунного ответа при кишечных расстройствах (51).Метагеномные исследования показали, что микробное разнообразие и стабильность кишечной микробиоты снижаются у пациентов с ВЗК по сравнению с людьми без ВЗК (52). Соответственно, в образцах кала пациентов с ВЗК было обнаружено на 25% меньше генов, чем в образцах контрольных пациентов (26). Дальнейшие исследования показали, что у пациентов с ВЗК меньше бактерий с противовоспалительными свойствами (бактерии типа Firmicutes ) и / или больше бактерий с провоспалительными свойствами (24, 53–55). Joossens et al.продемонстрировали, что фекальная микробиота у пациентов с БК имеет пониженное количество противовоспалительных F. prausnitzii, B. adolescentis и D. invisus и повышенное количество потенциально провоспалительных R. gnavus (56). Это изменение кишечной флоры может способствовать хроническому воспалению, наблюдаемому в желудочно-кишечном тракте пациентов с ВЗК.
Другой бактерией с провоспалительными свойствами является E. coli AIEC (адгезивная / инвазивная E.coli ), ассоциированный со слизистой оболочкой E. coli с сильными адгезивно-инвазивными свойствами, который первоначально был изолирован от взрослых пациентов с БК (57). По сравнению с нормальным контролем и пациентами с БК толстой кишки было обнаружено, что около 38% пациентов с активной подвздошной БК имеют повышенную концентрацию AIEC (58, 59). Campylobacter concisu s, другая инвазивная протеобактерия, также, как сообщается, преимущественно колонизирует пациентов с CD (60–62). Увеличение количества патогенных бактерий, которые прикрепляются к эпителиальным клеткам кишечника, влияет на проницаемость кишечника, изменяет разнообразие и состав микробиоты кишечника и вызывает воспалительные реакции, регулируя экспрессию провоспалительных генов, что в конечном итоге приводит к колиту (63).Кроме того, разрушение кишечных бактерий влияет на патогенез ВЗК за счет их метаболитов. Например, SCFAs, продуцируемые комменсальными бактериями, обладают противовоспалительной активностью и служат основным источником энергии для эпителия толстой кишки. Сообщалось, что продукция SCFAs снижается у пациентов с ВЗК из-за уменьшения содержания в кишечнике F. prausnitzii , бактерии, продуцирующей бутират (64–67). Напротив, концентрация сульфатредуцирующих бактерий выше у пациентов с ВЗК, что может привести к метаболической выработке сероводорода, который токсичен для эпителиальных клеток кишечника и вызвать воспаление слизистой оболочки, что приводит к ЯК (68).Взятые вместе, общие данные указывают на сильную корреляцию между изменением кишечной микробиоты и патогенезом ВЗК (69–71). Однако следует иметь в виду, что разнообразие и состав бактерий в экспериментальных исследованиях на животных или у пациентов с ВЗК несовместимы, а результаты при некоторых условиях противоречат друг другу (72). Более того, остается неясным, являются ли наблюдаемые изменения филогенетического состава причиной развития ВЗК или просто следствием изменения кишечной среды во время прогрессирования ВЗК (18, 72, 73).Для решения этих проблем необходимы дополнительные исследования и углубленный анализ кишечной флоры, прежде чем можно будет сделать какие-либо выводы.
Иммунные механизмы поддержания гомеостаза кишечника
Клетки эпителия кишечника находятся в прямом контакте с различными ксенобиотическими факторами, включая патогенные микроорганизмы, пищевые антигены или токсические компоненты, которые могут запускать и активировать иммунную систему хозяина (74, 75). Воспаление — это защитная реакция иммунной системы на инфекцию или повреждение тканей.Однако длительное или хроническое воспаление вредно и связано с развитием ВЗК (76). Следовательно, адекватный иммунный ответ на кишечные патогены, не вызывающий воспалительного ответа на комменсальные бактерии, имеет решающее значение для поддержания гомеостаза кишечника (77). Иммунные клетки-хозяева выработали различные механизмы для обеспечения гомеостаза кишечника, включая слизистый и эпителиальный барьер, провоспалительные сигнальные пути, а также врожденные и адаптивные компоненты кишечника (78) (рис. 1).Эти механизмы позволяют формировать относительно стабильную бактериальную популяцию и ограничивать колонизацию патогенных бактерий и воспаление, вызванное микробиотой (76, 79). Во-первых, кишечный барьер, образованный эпителиальными клетками, обеспечивает физический барьер, отделяющий содержимое просвета от нижележащих иммунных компартментов, тем самым блокируя проникновение микрофлоры в собственную пластинку (76). Во-вторых, специализированные секреторные клетки в желудочно-кишечном тракте, такие как плазматические клетки, бокаловидные клетки и клетки Панета, производят и секретируют IgA, слизь и антимикробные белки, соответственно; они составляют основные компоненты слизистой оболочки кишечника, которые действуют как линия защиты, снижая микробную нагрузку на эпителий (38).Экспрессия антимикробных белков в кишечнике регулируется различными механизмами (рис. 1). Например, большинство α-дефенсинов экспрессируются конститутивно, тогда как экспрессия β-дефенсинов, лектина C-типа, регенерирующего островковый белок 3γ, и подмножество α-дефенсинов регулируется активируемым бактериями толл-подобным рецептором или нуклеотидом. связывание с сигналом белка 2, содержащего домен олигомеризации (NOD2) (80). В-третьих, производные микробиома метаболиты или небольшие молекулы с микробицидными или микробиостатическими свойствами способствуют устойчивости к колонизации патогенными видами.Например, сообщалось, что полисахарид A, микробная молекула, синтезируемая B. fragilis , предотвращает колит, вызванный Helicobacter hepaticus , путем подавления продукции интерлейкина (IL) -17 и усиления продуцирующего IL-10 CD4 + Т-клеток (81). В-четвертых, когда комменсальные бактерии проникают в эпителиальные клетки кишечника, системы врожденного и адаптивного иммунитета могут активироваться для устранения микробиоты (38). Комбинация вышеупомянутых действий в эпителиальных клетках, секреторных и иммунных клетках обеспечивает состояние ограниченного ответа слизистой оболочки на комменсальные бактерии (38, 76).Важно отметить, что иммунные ответы, вызванные комменсальной флорой, могут регулировать состав кишечной микробиоты, тем самым поддерживая динамический баланс между комменсальными бактериями и иммунной системой хозяина и обеспечивая гомеостаз и здоровье кишечника (82).
Рисунок 1 . Иммунные ответы хозяина на кишечную микробиоту. Некоторые иммунные механизмы работают согласованно с кишечной микробиотой и способствуют гомеостазу кишечника. Бокаловидные клетки секретируют гликопротеины муцина, плазматические клетки секретируют IgA, а эпителиальные клетки секретируют антимикробные белки через toll-подобные рецепторы (TLR) или механизмы, зависимые от нуклеотид-связывающего домена олигомеризации, содержащего белок 2 (NOD2).Дендритные клетки (ДК), поглощающие бактерии, мигрируют в пейеровские бляшки и брыжеечные лимфатические узлы, где В-клетки дифференцируются в плазматические клетки, секретирующие IgA. Кроме того, отбор проб полисахарида A (PSA) из Bacteroides fragilis кишечными ДК приводит к индукции регуляторного T (Treg), который отвечает за продукцию IL-10. Кроме того, антимикробные белки, секретируемые клетками-хозяевами, могут изменять состав микробиоты. ИЛ-10, интерлейкин 10; М-клетка, микроскладчатая клетка; MYD88, белок первичного ответа миелоидной дифференцировки 88; REG3γ, лектин C-типа, регенерирующий островковый белок 3γ.
Нарушение регуляции взаимодействия между кишечной микробиотой и иммунным ответом хозяина при ВЗК
Несмотря на слизь, антимикробные белки и секреторный IgA являются критическими компонентами для поддержания гомеостаза кишечника, некоторые патогены ЖКТ могут проникать через эпителиальный барьер и вносить вклад в патогенез ВЗК, если они не устраняются посредством иммунных реакций хозяина (38). Используя неводный фиксатор Карнуа, Swidsinski et al. продемонстрировали повышенное прилипание бактерий к поверхности слизистой оболочки пациентов с ВЗК, что указывает на снижение способности ограничивать прямой контакт между эпителием и кишечной микробиотой и потенциальную чрезмерную активацию иммунного ответа хозяина (83) (рис. 2).На основании этого наблюдения ВЗК рассматривается как хроническое воспалительное заболевание, вызванное чрезмерным иммунным ответом на кишечную флору. Было выявлено, что многие гены восприимчивости и факторы окружающей среды препятствуют взаимодействиям между микробиотой и иммунной системой хозяина через различные сигнальные пути у пациентов с ВЗК (27, 28, 82, 84, 85).
Рисунок 2 . Взаимодействие между микробиотой и генетическими факторами хозяина и окружающей средой вносит свой вклад в патогенез ВЗК.В здоровых условиях (левая панель) патогены подавляются полезными комменсальными бактериями за счет индукции антимикробных белков, таких как IL-10 и REG3γ, таким образом поддерживая гомеостаз. При ВЗК (правая панель) сочетание генетических факторов и факторов окружающей среды (таких как стресс, диета и антибиотики) приводит к дисбактериозу, который, в свою очередь, влияет на целостность барьера, врожденный и адаптивный иммунитет, что приводит к неконтролируемому хроническому воспалению и гипер- активация T-хелперов 1 (Th2) и Th27 клеток, увеличение проницаемости плотных контактов, снижение регуляторных T (Treg) -клеток и снижение REG3γ и IL-10.ATG16L, связанный с аутофагией 16-подобный; CARD9, член семейства 9 домена рекрутирования caspase; FUT2, фукозилтрансфераза 2; ВЗК, воспалительное заболевание кишечника; ИЛ-10, интерлейкин 10; IRGM, связанная с иммунитетом GTPase M; NOD2, белок 2, содержащий нуклеотид-связывающий домен олигомеризации; REG3γ, лектин C-типа, регенерирующий островковый белок 3γ.
Генетические факторы, влияющие на взаимодействие между кишечной микробиотой и иммунным ответом хозяина при ВЗК
Нуклеотид-связывающий домен олигомеризации, содержащий белок 2, играет важную роль в гомеостазе кишечника, активируя ядерный фактор-κB или иммунный ответ, опосредованный митоген-активируемой протеинкиназой (MAPK), при обнаружении специфических бактериальных мотивов пептидогликана в цитозоле (86).Активация передачи сигналов NOD2 также увеличивает выработку антимикробных пептидов и муцина, двух критических компонентов слизистой оболочки кишечника, которые не позволяют бактериям колонизировать эпителиальные клетки (86). В качестве критического регулятора воспаления мутации NOD2 связаны с уменьшением Clostridium групп XIVa и IV (штаммы продуцирующих SCFA бактерий) и увеличением Actinobacteria и Proteobacteria , что приводит к сдвигу кишечной флоры у пациентов с CD и UC. и, таким образом, ведет к более высокой восприимчивости к воспалению (87–91).Соответственно, у мышей с дефицитом NOD2 нарушен эпителиальный барьер, уменьшено количество интраэпителиальных лимфоцитов, снижена продукция α-дефенсина и нарушены иммунные ответы на патогенные бактерии, что указывает на экспериментальный колит (92–94). Сообщалось, что помимо NOD2 другие гены восприимчивости к ВЗК, такие как ATG16L1, XBP1, IRGM, CARD9 и FUT2, влияют на врожденные и / или адаптивные иммунные функции, а также на состав и разнообразие кишечной флоры (95, 96 ). Варианты гена ATG16L1 или XBP1 связаны с нарушениями функции панетских и / или бокаловидных клеток (97–99) и повышенной продукции IL-1β в ответ на бактериальный пептидогликан-мурамилдипептид (95), что способствует фенотипу заболевания подвздошной кишки при БК.Недавно сообщалось, что фукозилтрансфераза 2 (FUT2), ген, который регулирует экспрессию H-антигенов (предшественников антигенов групп крови A и B) в слизистой оболочке желудочно-кишечного тракта, участвует в регуляции структуры и состава кишечной микробиоты, тем самым вносит значительный вклад в восприимчивость к CD (100). Полногеномные исследования ассоциации выявили более 163 однонуклеотидных полиморфизмов (SNP), связанных с различной восприимчивостью к CD или UC, и в будущем, несомненно, будет сообщено о большем количестве локусов (101–103).Большинство идентифицированных генов (110 из 163 генных локусов) являются общими для CD и UC, тогда как только 23 и 30 локусов специфически коррелируют с восприимчивостью к UC и CD соответственно (103, 104). Эти гены восприимчивости в первую очередь регулируют передачу сигналов иммунного ответа хозяина (101-103). Недавние исследования показали, что нарушение регуляции оси IL-23 / Th27 связано с множественными SNP генетической предрасположенности у пациентов с CD и UC из-за нарушения врожденного и адаптивного иммунного ответа (105, 106).Примечательно, что дисбактериоз кишечника связан с повышенным образованием активных форм кислорода (107), что, в свою очередь, может привести к изменениям в составе и разнообразии кишечной микробиоты (108), повышенной проницаемости слизистой оболочки (73) и усилению иммунной стимуляции, таким образом образуя порочный круг. Тем не менее, необходимы дополнительные исследования для выяснения механизма двунаправленной регуляции между микробиотой и иммунным ответом хозяина в определенных условиях (109, 110). Пример того, как определенные микробы вызывают воспаление кишечника и влияют на патогенез ВЗК, был описан Bloom et al.(111). В их исследовании комменсальные виды Bacteroides были выделены у мышей с дефицитом IL-10r2 и Tgfbr2 (111). Несмотря на колонизацию изолированных бактерий как у восприимчивых, так и у нечувствительных к ВЗК мышей, индукция ВЗК наблюдалась исключительно у восприимчивых животных, что дает важное представление о роли дисбактериоза кишечника в индукции ВЗК (112). Принимая во внимание, что комменсальные виды Bacteroides в изобилии присутствуют в кишечнике млекопитающих и оказывают положительное влияние на хозяина за счет расщепления сложных пищевых углеводов, модуляции глюкозилирования слизистой оболочки и созревания иммунной системы (46), классически полезные бактерии могут оказывать пагубное воздействие на организм человека. специфические условия и могут способствовать IBD (112).Эти данные также подтверждают критическую роль генетических факторов в развитии IBD посредством регуляции бактериального состава и разнообразия кишечника, а также иммунных ответов в желудочно-кишечном тракте. Следует иметь в виду, что аллели восприимчивости сами по себе недостаточны для запуска ВЗК. Имеющиеся на сегодняшний день данные указывают на то, что развитие ВЗК является комбинированным действием как генетических, так и негенетических факторов, которые действуют вместе и приводят к изменениям в структуре и функции кишечной микробиоты человека (113).
Факторы окружающей среды, влияющие на взаимодействие между кишечной микробиотой и иммунным ответом хозяина при ВЗК
На состав кишечной флоры влияют различные факторы окружающей среды, такие как диета, стресс, возраст и лечение антибиотиками (114). В этом разделе мы в основном сосредоточимся на диете и стрессе, а также на их влиянии на взаимодействие между кишечной микробиотой и иммунным ответом хозяина.
Диета
Хорошо известно, что диетические компоненты влияют на структуру и активность кишечных бактерий (115, 116).Западное потребление пищи (с высоким содержанием сахара / жира и низким содержанием пищевых волокон, фруктов и овощей) связано с измененной структурой и функцией комменсальной флоры в кишечнике (113, 117), что может способствовать увеличению заболеваемости ВЗК (6, 8). , 118). В недавнем исследовании Дэвид и соавт. сообщили, что кратковременное (5 дней) потребление продуктов животного происхождения связано с увеличением количества устойчивых к желчи микроорганизмов ( Alistipes, Bilophila и Bacteroides ) и уменьшенного количества Firmicutes , которые метаболизируют полисахариды пищевых растений, демонстрируя быстрое модулирующее действие пищевых питательных веществ на кишечные бактерии (116).Учитывая, что продукция H 2 S сульфитредуцирующей бактерией Bilophila wadsworthia может вызывать воспалительные реакции в кишечнике (119), эти данные дают правдоподобное объяснение более высокой распространенности ВЗК в западных популяциях. Аналогичные результаты наблюдались при переходе с растительной диеты на типичную западную диету на 1 день (115), что подчеркивает возможность восстановления кишечной микробиоты при ВЗК с помощью диетических вмешательств.
Пищевые волокна могут быть преобразованы в SCFA с помощью ферментации анаэробных бактерий ( Bacteroidetes и Firmicutes ) в кишечнике, что, в свою очередь, может регулировать экспрессию генов, участвующих в пролиферации, дифференцировке и апоптозе эпителиальных клеток кишечника, и влиять на состав микробиоты кишечника и воспалительный ответ хозяина (65).В различных исследованиях сообщалось о снижении продукции SCFA или бактерий, продуцирующих SCFA ( Roseburia hominis и Faecalibacterium prausnitzii ) у пациентов с ВЗК (64, 65, 120, 121), что указывает на роль SCFA в воспалительных реакциях при ВЗК. Благоприятные терапевтические эффекты SCFAs также наблюдались после введения SCFAs или пребиотиков на животных моделях или у пациентов с поражением UC (122–126). Эффект SCFAs на ВЗК преимущественно опосредуется регулированием как врожденного иммунного ответа, так и адаптивного иммунного ответа (127).Кроме того, было выявлено, что некоторые метаболиты, продуцируемые кишечными бактериями, обладают способностью влиять на метаболизм и иммунитет хозяина у экспериментальных пациентов с колитом или ВЗК (128). Арилуглеводородный рецептор (AhR) представляет собой фактор транскрипции, который находится в цитоплазме кишечного эпителия, макрофагах, В-клетках, Т-клетках и дендритных клетках (129). Кинуренин, продукт метаболизма, полученный из незаменимой аминокислоты триптофана, был идентифицирован как эндогенный лиганд AhR (130), который регулирует рост интраэпителиальных лимфоцитов, врожденных лимфоидных клеток, а также иммунные и воспалительные реакции, а также поддерживает нормальную функцию слизистой оболочки кишечника. (131).В желудочно-кишечном тракте лиганды AhR, полученные из диеты, способствуют местной продукции IL-22, что, в свою очередь, стимулирует выработку антимикробных пептидов и муцина (132), тем самым обеспечивая устойчивость к патогенам и защиту слизистых оболочек (132). Сообщалось, что у CARD9-нулевых мышей нарушен иммунный ответ на Citrobacter rodentium , о чем свидетельствует снижение продукции IL-6 и IL-17A в толстой кишке, а также меньшее количество врожденных лимфоидных клеток, продуцирующих IL-22, в собственной пластинке толстой кишки (133 ). В недавнем исследовании Lamas et al.показали, что дисфункция микробиоты и восприимчивость к IBD у мышей с нокаутом CARD9 в основном объясняются их неспособностью метаболизировать триптофан в метаболиты, которые действуют как лиганды AhR. Напротив, добавление штаммов Lactobacillus , метаболизирующих триптофан, может ослабить воспаление кишечника у мышей, нулевых по CARD9 (96). Эти данные предполагают, что метаболиты триптофана являются биоактивными медиаторами, которые регулируют перекрестное взаимодействие между иммунным ответом хозяина и экосистемой кишечной микробиоты (134).
Напряжение
Считается, что стресс является еще одним фактором риска развития ВЗК (135). Данные доклинических и клинических исследований показали, что снижение стресса связано с уменьшением рецидивов у пациентов с ЯК или БК (136, 137). Этот эффект стресса на ВЗК в основном опосредуется передачей сигналов кортикотропин-рилизинг-фактора (CRF) (138). В ответ на стресс CRF синтезируется и высвобождается из нескольких областей мозга, включая паравентрикулярное ядро и гипоталамус.Высвобожденный CRF стимулирует выработку адренокортикотропного гормона гипофизом, который транспортируется в кору надпочечников, чтобы вызвать синтез и секрецию кортизола в ответ на стресс (139). Передача сигналов CRF может действовать в периферических тканях, включая желудок, поджелудочную железу, тонкий кишечник и лимфоциты (139–142). Наше и другие исследования показали, что передача сигналов CRF может быть активирована стрессом в кишечнике грызунов и свиней (143, 144). Важно отметить, что активация кортикотропин-рилизинг-гормона, как сообщается, связана с воспалением слизистой оболочки толстой кишки и повышенной кишечной проницаемостью у пациентов с БК или ЯК (145–147), что предполагает участие стресса в патофизиологии ВЗК через несколько механизмы.Во-первых, активация CRF может привести к высвобождению TNF-α и секреции протеазы (отличительные признаки ВЗК) тучными клетками, которые, в свою очередь, действуют на эпителиальные клетки и приводят к бактериальной транслокации и сверхактивации иммунного ответа из-за повышенной проницаемости (11, 41, 148). Во-вторых, вызванная стрессом активация HPA, изменения нейротрансмиттеров и активация иммунной функции могут модулировать состав и метаболизм кишечной микробиоты, а также проницаемость (149–151). Учитывая влияние стресс-индуцированной дисфункции микробиоты на патофизиологию ВЗК, было обнаружено, что антагонисты CRF или агенты против TNF-α приводят к благоприятным исходам у пациентов с ВЗК (152).В нашем недавнем исследовании мы продемонстрировали, что добавление глютамина ослабляет вызванное стрессом подавление белков плотного соединения, увеличение проницаемости и высвобождение CRF в тканях кишечника (144, 153). Учитывая важную роль белков плотного соединения в поддержании кишечного барьера и предотвращении бактериальной транслокации, глутамин может быть многообещающим адъювантом в терапии ВЗК. Взятые вместе, факторы окружающей среды становятся решающими факторами развития ВЗК из-за сложных взаимодействий между кишечными бактериями и хозяином.Помимо диетических факторов, прием лекарств и антибиотиков, возраст и другие факторы окружающей среды могут влиять на кишечную микробиоту, взаимодействуя с комменсальными микроорганизмами (154–157).
Возможное терапевтическое использование путем воздействия на кишечную микробиоту
Становится все более очевидным, что тонкий баланс между микробиотой кишечника и кишечной иммунной системой необходим для защиты от патогенных бактерий и содействия гомеостазу и функциям кишечника (84).Недавние исследования как на животных моделях, так и на клинических пациентах подчеркнули критическую роль кишечной микробиоты в инициировании, поддержании и определении тяжести ВЗК (72). Восстановление разнообразия и состава комменсальной микробиоты становится новым терапевтическим вмешательством в отношении микробного дисбаланса, связанного с заболеваниями желудочно-кишечного тракта, включая ВЗК и СРК (72). Манипуляции с микробиотой кишечника можно достичь с помощью антибиотиков, трансплантации фекальной микробиоты (FMT) или пробиотиков.
Антибиотики
Обоснование антибиотикотерапии при ВЗК основано на доказательствах, показывающих, что кишечные микробы, включая бактерии просвета, играют важную роль в патогенезе ВЗК (27, 73, 158). Лечение антибиотиками может уменьшить количество патогенных бактерий, способствуя росту полезных бактерий (159, 160). Хотя антибиотики обычно используются в клинической практике для улучшения качества жизни пациентов, их преимущества не были четко установлены в тщательно спланированных клинических испытаниях с участием пациентов, страдающих ВЗК (159, 161).Кроме того, сообщалось, что лечение антибиотиками имеет неблагоприятные исходы по неизвестным в настоящее время причинам или приводит к различным побочным эффектам у плодов и детей, страдающих ВЗК (162). Метаанализ показал, что длительное воздействие антибиотиков связано с более высокой частотой возникновения БК из-за их мешающего действия на кишечную флору (163). Более того, введение антибиотиков в раннем возрасте может повлиять на развитие и созревание кишечной иммунной системы хозяина (164).Другой проблемой, связанной с лечением антибиотиками ВЗК, является развитие и распространение устойчивости бактерий к антибиотикам, а также возврат кишечных бактерий после прекращения терапии (162). Хотя антибиотики могут регулировать экологическое разнообразие микробиома, эти вопросы следует тщательно решать для лечения ВЗК в будущем.
Трансплантация фекальной микробиоты
Трансплантация фекальной микробиоты, также известная как «фекальная бактериотерапия» или «фекальная инфузия», представляет собой перенос кишечных бактерий от здорового донора для восстановления кишечной микробиоты больного человека (165, 166).FMT был адаптирован в клинической практике для лечения ИКД, которую нельзя устранить с помощью одних только антибиотиков, и было доказано, что он более эффективен, чем лечение антибиотиками (166, 167). После этого FMT был оценен при нескольких заболеваниях, вызванных микробиотой, включая IBD (168, 169) и метаболический синдром (170), и вызвал интерес как новый вариант терапии. В отличие от впечатляющих результатов лечения ИКД (92%) (171), сообщалось, что FMT уменьшает симптомы примерно у 20% пациентов с ВЗК (172).Столь огромная разница может быть объяснена несколькими причинами. Во-первых, тяжесть и продолжительность симптомов в клинических испытаниях могут повлиять на результат; таким образом, положительные результаты наблюдаются только у некоторых пациентов, включенных в клинические испытания (173). Во-вторых, ВЗК — это хроническое заболевание, связанное с различными факторами, такими как нарушение микробиоты кишечника и генетические факторы и / или факторы окружающей среды; Таким образом, развитие ВЗК — это синергетический эффект нескольких факторов, а не одного (4, 169). В-третьих, иммунная система пациентов с ВЗК активируется из-за хронического воспаления (174), что может повлиять на терапевтический эффект FMT.В-четвертых, состав кишечной микробиоты доноров отличается (175) и может повлиять на клинический результат. В-пятых, протокол FMT, используемый в каждом испытании (включая критерий выбора донора, подготовку пациента, количество и состав инфузионных бактерий и способ введения), различается для каждого пациента (172), что приводит к различным терапевтическим эффектам. Все эти факторы могут способствовать более низкому клиническому исходу по сравнению с ИКД. Тем не менее, пока рано делать выводы о возможностях FMT-терапии.Необходимы дополнительные клинические исследования с использованием стандартного протокола для оценки его эффективности и безопасности перед назначением его пациентам с ВЗК (173).
Пробиотики
Пробиотики — это живые микроорганизмы, которые оказывают благотворное влияние на хозяина, модулируя микрофлору кишечника (176, 177). Было обнаружено, что виды Lactobacillus и Bifidobacterium , две из наиболее распространенных пробиотических бактерий, не только улучшают ответы иммунной системы, но также оказывают положительное влияние на стабильность ранее существовавшей микрофлоры, подавляют колонизацию патогенов и повышают трофику слизистой оболочки. эффекты, стимулируя барьерные реакции кишечных эпителиальных клеток (178, 179).Тао и др. показали, что пробиотик Lactobacillus GG высвобождает растворимые факторы, которые, в свою очередь, стимулируют синтез белков теплового шока через путь p38 MAPK, оказывая тем самым цитопротекторный эффект на эпителиальные клетки кишечника (180). В рандомизированном исследовании 39 пациентов с ЯК получали L. rhamnosus GG ежедневно, в то время как остальные пациенты ( N = 78) не получали лечения; прогрессирование ЯК подавлялось введением пробиотиков, что свидетельствует о значительном клиническом преимуществе пробиотиков (181).В другом исследовании VSL # 3, высокоактивный пробиотический лечебный корм, содержащий восемь различных штаммов, мог вызвать ремиссию и предотвратить рецидив воспалительного заболевания у пациентов с легким или умеренно активным ЯК (182–184). Также сообщалось, что другие пробиотики, такие как Bifidobacterium bifidum, L. acidophilus (185) и L. reuteri ATCC 55730 (186), также имеют положительный эффект у пациентов с ВЗК.
Действие пробиотиков опосредуется модуляцией системы воспаления слизистой оболочки, усилением конкурентного исключения патогенных бактерий, регулированием секреции цитокинов, участвующих в развитии ВЗК, или модулированием проницаемости кишечника (109, 178) (рис. 3).Хорошо известно, что пробиотики выражают молекулярные паттерны, связанные с патогенами; они могут имитировать функцию комменсальных бактерий, задействуя и / или активируя рецепторы распознавания образов на эпителиальных поверхностях слизистой оболочки, таким образом регулируя экспрессию генов, участвующих в иммунном ответе хозяина (178). Кроме того, положительные эффекты пробиотиков связывают с восстановлением количества и функции бокаловидных клеток и стимуляцией иммунной системы слизистых оболочек для секреции защитных иммуноглобулинов, таких как секреторный IgA, защитные дефенсины и бактериоцидины в кишечном тракте ( 187).Хотя практическое применение пробиотиков было поддержано положительными результатами клинических испытаний с участием пациентов с ЯК, клинические испытания с участием пациентов с БК не вызвали особого энтузиазма (178, 188). Прежде чем пробиотики можно будет рекомендовать для лечения пациентов с ВЗК, необходимы дальнейшие исследования эффективности, безопасности и основных механизмов действия (188).
Рисунок 3 . Механизмы, участвующие в индуцированной пробиотиками защите от дисбактериоза кишечника.Пробиотики подавляют патогены посредством различных действий, включая снижение pH в просвете, производство антимикробных белков, ингибирование адгезии и транслокации флоры, конкурентное исключение патогенов, улучшение эпителиального барьера, усиление адгезии комменсальных бактерий к слизистой оболочке кишечника и модуляция желудочно-кишечного тракта. иммунная система слизистых оболочек.
Перспектива
Роль взаимодействия между кишечной микробиотой и иммунным ответом хозяина в патогенезе ВЗК привлекла большое внимание из-за применения технологии секвенирования следующего поколения и доступности генно-инженерных моделей животных.Дисбиоз кишечника становится фактором риска из-за его функциональной роли в поддержании гомеостаза кишечника, активации иммунного ответа эпителия кишечника и его взаимодействия с другими факторами через генетические или эпигенетические механизмы. Основываясь на достижениях в нашем понимании микробиоты в патогенезе ВЗК, было исследовано несколько терапевтических вмешательств для восстановления комменсальной микроэкологии, и некоторые из них показали впечатляющие результаты в клинических испытаниях или экспериментальных моделях на животных.Однако необходимо ответить на различные вопросы. Микробиота кишечника подвержена изменениям как хозяйских, так и экзогенных факторов, и в значительной степени неизвестно, как запускается дисбактериоз и приводит к хроническому воспалению. Кроме того, дисбаланс в популяциях бактерий связан с различными заболеваниями; патогенные последствия конкретных микробов при БК или ЯК, а также лежащие в основе механизмы еще предстоит определить. Несмотря на наличие дисбактериоза у пациентов с БК и ЯК, неясно, вносят ли изменения в кишечную флору вклад в развитие ВЗК или, наоборот, являются следствием этого расстройства.Лечение дисбактериоза с помощью FMT или введения пребиотиков дало положительные результаты в клинических испытаниях с участием пациентов с ВЗК; однако их безопасность и эффективность должны быть определены, прежде чем их можно будет рассматривать в качестве терапевтической стратегии. Дополнительные исследования взаимодействия микробиоты и кишечного эпителия имеют большое значение для углубления нашего понимания роли микробиоты в патогенезе ВЗК и определения потенциальных терапевтических стратегий путем манипулирования кишечной микробиотой.
Авторские взносы
YY и ZW разработали исследование; MZ и YW участвовали в поиске литературы; KS, YW и PT составили рисунки и обсудили их пересмотр; ZW отредактировал и доработал рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Работа поддержана Национальной программой фундаментальных исследований Китая (No.2013CB127302), Национальный фонд естественных наук Китая (№ 31572423, 31572410, 31625025, 31372327), Научный фонд китайских университетов (2015DK001), Программа для выдающихся талантов нового века в университетах (NCET-12-0522) и Проект «111» (Б16044). Мы также благодарны NIH за их щедрую поддержку Центру метаболического фенотипа мышей Цинциннати DK059630.
Список литературы
3. Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Эпидемиология и естественная история воспалительных заболеваний кишечника. Гастроэнтерология (2011) 140: 1785–94. DOI: 10.1053 / j.gastro.2011.01.055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Анантакришнан АН. Эпидемиология и факторы риска ВЗК. Nat Rev Gastroenterol Hepatol (2015) 12: 205–17. DOI: 10.1038 / nrgastro.2015.34
CrossRef Полный текст | Google Scholar
6. Молодецкий Н.А., Сун И.С., Раби Д.М., Гали В.А., Феррис М., Чернофф Г. и др. Согласно систематическим обзорам, заболеваемость и распространенность воспалительных заболеваний кишечника со временем увеличивается. Гастроэнтерология (2012) 142: 46–54.e42; викторина e30. DOI: 10.1053 / j.gastro.2011.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Хоу Дж. К., Абрахам Б., Эль-Сераг Х. Диетическое потребление и риск развития воспалительного заболевания кишечника: систематический обзор литературы. Am J Gastroenterol (2011) 106: 563–73. DOI: 10.1038 / ajg.2011.44
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Аль-Мофарре М.А., Аль-Мофлех И.А.Возникающее воспалительное заболевание кишечника у саудовских амбулаторных пациентов: отчет о 693 случаях. Saudi J Gastroenterol (2013) 19: 16–22. DOI: 10.4103 / 1319-3767.105915
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Клеверс Х. Воспалительное заболевание кишечника, стресс и эндоплазматический ретикулум. N Engl J Med (2009) 360: 726–7. DOI: 10.1056 / NEJMcibr0809591
CrossRef Полный текст | Google Scholar
15. Экбург П.Б., Бик Е.М., Бернштейн К.Н., Пурдом Э., Детлефсен Л., Сарджент М. и др.Разнообразие микробной флоры кишечника человека. Science (2005) 308: 1635–8. DOI: 10.1126 / science.1110591
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Яцуненко Т., Рей Ф. Э., Манари М. Дж., Трехан И., Домингес-Белло М. Г., Контрерас М. и др. Микробиом кишечника человека в зависимости от возраста и географии. Nature (2012) 486: 222–7. DOI: 10.1038 / nature11053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, et al.QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Nat Methods (2010) 7: 335–6. DOI: 10.1038 / nmeth.f.303
CrossRef Полный текст | Google Scholar
23. Экбург ПБ, Рельман Д.А. Роль микробов в болезни Крона. Clin Infect Dis (2007) 44: 256–62. DOI: 10.1086 / 510385
CrossRef Полный текст | Google Scholar
24. Франк Д.Н., Аманд А.Л.С., Фельдман Р.А., Бодекер Е.С., Харпаз Н., Пейс Н.Р. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci U S A (2007) 104: 13780–5. DOI: 10.1073 / pnas.0706625104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Цинь Дж. Дж., Ли Р. К., Раес Дж., Арумугам М., Бургдорф К. С., Маничан С. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Nature (2010) 464: 59–65. DOI: 10.1038 / nature08821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Kostic AD, Xavier RJ, Gevers D.Микробиом при воспалительном заболевании кишечника: текущее состояние и будущее. Гастроэнтерология (2014) 146: 1489–99. DOI: 10.1053 / j.gastro.2014.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Кобозиев И., Рейносо Уэбб С., Ферр К.Л., Гришем МБ. Роль кишечной микробиоты в кишечном гомеостазе и воспалении. Free Radic Biol Med (2014) 68: 122–33. DOI: 10.1016 / j.freeradbiomed.2013.11.008
CrossRef Полный текст | Google Scholar
30.Hamer HM, Jonkers DMAE, Bast A, Vanhoutvin SALW, Fischer MAJG, Kodde A, et al. Бутират модулирует окислительный стресс в слизистой оболочке толстой кишки здоровых людей. Clin Nutr (2009) 28: 88–93. DOI: 10.1016 / j.clnu.2008.11.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Пулл С.Л., Доэрти Дж. М., Миллс Дж. К., Гордон Дж. И., Стаппенбек Т. С.. Активированные макрофаги являются адаптивным элементом ниши предшественников эпителиального эпителия толстой кишки, необходимого для регенеративных реакций на повреждение. Proc Natl Acad Sci U S A (2005) 102: 99–104. DOI: 10.1073 / pnas.0405979102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Стаппенбек Т.С., Хупер Л.В., Гордон Дж. И.. Регуляция развития кишечного ангиогенеза аборигенными микробами через клетки Панета. Proc Natl Acad Sci U S A (2002) 99: 15451–5. DOI: 10.1073 / pnas.202604299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Zaneveld J, Turnbaugh PJ, Lozupone C, Ley RE, Hamady M, Gordon JI, et al.Коэволюция бактерий и хозяев и поиск новых мишеней для лекарств. Curr Opin Chem Biol (2008) 12: 109–14. DOI: 10.1016 / j.cbpa.2008.01.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Hooper LV. Вклад бактерий в развитие кишечника млекопитающих. Trends Microbiol (2004) 12: 129–34. DOI: 10.1016 / j.tim.2004.01.001
CrossRef Полный текст | Google Scholar
39. Кувахара Т., Ямасита А., Хиракава Х., Накаяма Х., Тох Х., Окада Н. и др.Геномный анализ Bacteroides fragilis показывает обширные инверсии ДНК, регулирующие адаптацию клеточной поверхности. Proc Natl Acad Sci U S. A (2004) 101: 14919–24. DOI: 10.1073 / pnas.0404172101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Хаттенхауэр К., Найт Р., Браун К. Т., Капорасо Дж. Г., Клементе Дж. К., Геверс Д. и др. Продвижение сообщества исследователей микробиома. Cell (2014) 159: 227–30. DOI: 10.1016 / j.cell.2014.09.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Рыцари Д., Лассен К.Г., Ксавье Р.Дж. Достижения в патогенезе воспалительных заболеваний кишечника: связь генетики хозяина и микробиома. Кишечник (2013) 62: 1505–10. DOI: 10.1136 / gutjnl-2012-303954
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Урселл Л.К., Клементе Дж. К., Ридеут Дж. Р., Геверс Д., Капорасо Дж. Г., Найт Р. Межличностное и внутриличностное разнообразие связанной с человеком микробиоты в ключевых участках тела. J Allergy Clin Immunol (2012) 129: 1204–8.DOI: 10.1016 / j.jaci.2012.03.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Chassaing B, Darfeuille-Michaud A. Комменсальная микробиота и энтеропатогены в патогенезе воспалительных заболеваний кишечника. Гастроэнтерология (2011) 140: 1720–8. DOI: 10.1053 / j.gastro.2011.01.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Франк Д.Н., Сент-Аманд А.Л., Фельдман Р.А., Бёдекер Э.С., Харпаз Н., Пейс Н.Р. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci U S A (2007) 104: 13780–5. DOI: 10.1073 / pnas.0706625104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Свидсински А., Ладхофф А., Пернталер А., Свидсински С., Ленинг-Бауке В., Ортнер М. и др. Флора слизистой оболочки при воспалительном заболевании кишечника. Гастроэнтерология (2002) 122: 44–54. DOI: 10.1053 / gast.2002.30294
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Латроп С.К., Блум С.М., Рао С.М., Натч К., Лио С.В., Сантакруз Н. и др.Периферическое образование иммунной системы комменсальной микробиотой толстой кишки. Nature (2011) 478: 250–4. DOI: 10.1038 / nature10434
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Хансен Р., Томсон Дж. М., Эль-Омар Е. М., Холд Г.Л. Роль инфекции в этиологии воспалительного заболевания кишечника. J Гастроэнтерол (2010) 45: 266–76. DOI: 10.1007 / s00535-009-0191-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53.Сокол Х., Лепаж П., Сексик П., Дор Дж., Марто П. Гель-электрофорез в температурном градиенте фекальной 16S рРНК выявляет активную Escherichia coli в микробиоте пациентов с язвенным колитом. J Clin Microbiol (2006) 44: 3172–7. DOI: 10.1128 / JCM.02600-05
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Петерсон Д.А., Франк Д.Н., Пейс Н.Р., Гордон Дж. Метагеномные подходы к определению патогенеза воспалительных заболеваний кишечника. Клеточный микроб-хозяин (2008) 3: 417–27.DOI: 10.1016 / j.chom.2008.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Мондот С., Кан С., Фурет Дж. П., де Карсер Д. А., МакСвини С., Моррисон М. и др. Выявление новых филогенетических особенностей микробиоты болезни Крона. Воспаление кишечника. Dis (2011) 17: 185–92. DOI: 10.1002 / ibd.21436
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Joossens M, Huys G, Cnockaert M, De Preter V, Verbeke K, Rutgeerts P, et al.Дисбиоз фекальной микробиоты у пациентов с болезнью Крона и их здоровых родственников. Кишечник (2011) 60: 631–7. DOI: 10.1136 / gut.2010.223263
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Будо Дж., Глассер А.Л., Массере Э., Жоли Б., Дарфей-Мишо А. Инвазивная способность штамма Escherichia coli , выделенного из слизистой оболочки подвздошной кишки пациента с болезнью Крона. Infect Immun (1999) 67: 4499–509.
PubMed Аннотация | Google Scholar
58.Баумгарт М., Доган Б., Ришнив М., Вайцман Г., Босворт Б., Янтисс Р. и др. Независимый от культуры анализ слизистой оболочки подвздошной кишки показывает избирательное увеличение инвазивной Escherichia coli новой филогении по сравнению с истощением Clostridiales при болезни Крона с поражением подвздошной кишки. ISME J (2007) 1: 403–18. DOI: 10.1038 / ismej.2007.52
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Darfeuille-Michaud A, Boudeau J, Bulois P, Neut C, Glasser AL, Barnich N, et al.Высокая распространенность адгезивно-инвазивной инфекции Escherichia coli , связанной со слизистой оболочкой подвздошной кишки, при болезни Крона. Гастроэнтерология (2004) 127: 412–21. DOI: 10.1053 / j.gastro.2004.04.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Ман С.М., Чжан Л., Дэй А.С., Лич С.Т., Лемберг Д.А., Митчелл Х. Campylobacter concisus и другие виды Campylobacter у детей с недавно диагностированной болезнью Крона. Воспаление кишечника. Dis (2010) 16: 1008–16.DOI: 10.1002 / ibd.21157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Чжан Л., Ман С.М., Дэй А.С., Лич С.Т., Лемберг Д.А., Датт С. и др. Обнаружение и выделение Campylobacter видов, отличных от C. jejuni , у детей с болезнью Крона. J Clin Microbiol (2009) 47: 453–5. DOI: 10.1128 / JCM.01949-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Ахмед I, Рой BC, Хан С.А., Септер С., Умар С.Микробиом, метаболом и воспалительное заболевание кишечника. Микроорганизмы (2016) 4:20. DOI: 10.3390 / микроорганизмы4020020
CrossRef Полный текст | Google Scholar
64. Тибо Р., Блахье Ф., Дарси-Вриллон Б., де Коппе П., Буррей А., Сегейн Дж. П.. Утилизация бутирата слизистой оболочкой толстой кишки при воспалительных заболеваниях кишечника: транспортный дефицит. Воспаление кишечника. Dis (2010) 16: 684–95. DOI: 10.1002 / ibd.21108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65.Риос-Ковиан Д., Руас-Мадиедо П., Марголлес А., Геймонд М., де Лос Рейес-Гавилан К. Г., Салазар Н. Жирные кислоты с короткой цепью кишечника и их связь с диетой и здоровьем человека. Front Microbiol (2016) 7: 185. DOI: 10.3389 / fmicb.2016.00185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Агус А., Денизот Дж., Тевено Дж., Массье С., Дени С., Берналье-Донадиль А. и др. Западная диета снижает выработку короткоцепочечных жирных кислот и экспрессию GPR43 рецептора, связанного с G-белком, способствуя воспалению кишечника и восприимчивости хозяина к E.Coli инфекция. Гастроэнтерология (2015) 148: S706–7. DOI: 10.1016 / S0016-5085 (15) 32398-2
CrossRef Полный текст | Google Scholar
67. Такаиси Х., Мацуки Т., Накадзава А., Такада Т., Кадо С., Асахара Т. и др. Дисбаланс в составе микрофлоры кишечника может быть вовлечен в патогенез воспалительного заболевания кишечника. Int J Med Microbiol (2008) 298: 463–72. DOI: 10.1016 / j.ijmm.2007.07.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68.Питчер М.С., Битти ER, Каммингс Дж. Х. Вклад сульфатредуцирующих бактерий и 5-аминосалициловой кислоты в сульфид фекалий у пациентов с язвенным колитом. Кишечник (2000) 46: 64–72. DOI: 10.1136 / gut.46.1.64
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Сексик П., Риготтье-Гойс Л., Грамет Г., Сутрен М., Почарт П., Марто П. и др. Изменения доминирующих фекальных бактериальных групп у пациентов с болезнью Крона толстой кишки. Кишечник (2003) 52: 237–42.DOI: 10.1136 / gut.52.2.237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Лупп С., Робертсон М.Л., Викхэм М.Э., Секиров И., Чемпион О.Л., Гейнор Е.С. и др. Опосредованное хозяином воспаление нарушает микробиоту кишечника и способствует чрезмерному росту энтеробактерий. Клеточный микроб-хозяин (2007) 2: 119–29. DOI: 10.1016 / j.chom.2007.06.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Gophna U, Sommerfeld K, Gophna S, Doolittle WF, Veldhuyzen van Zanten SJO.Различия между тканевой микрофлорой кишечника пациентов с болезнью Крона и язвенным колитом. J Clin Microbiol (2006) 44: 4136–41. DOI: 10.1128 / JCM.01004-06
CrossRef Полный текст | Google Scholar
73. Sartor RB. Влияние микробов при воспалительных заболеваниях кишечника. Гастроэнтерология (2008) 134: 577–94. DOI: 10.1053 / j.gastro.2007.11.059
CrossRef Полный текст | Google Scholar
75. Карио Э. Врожденная иммунная сигнализация на поверхности слизистой оболочки кишечника: тонкая грань между защитой хозяина и разрушением. Curr Opin Gastroenterol (2008) 24: 725–32. DOI: 10.1097 / MOG.0b013e32830c4341
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Хизлвуд С.К., Кук М.К., Эри Р., Прайс Г.Р., Тауро С.Б., Таупин Д. и др. Аберрантная сборка муцина у мышей вызывает стресс эндоплазматического ретикулума и спонтанное воспаление, напоминающее язвенный колит. PLoS Med (2008) 5: e54. DOI: 10.1371 / journal.pmed.0050054
CrossRef Полный текст | Google Scholar
79.Konrad A, Cong Y, Duck W., Borlaza R, Elson CO. Тесное разделение слизистой оболочки мышиного иммунного ответа на антигены кишечной микробиоты. Гастроэнтерология (2006) 130: 2050–9. DOI: 10.1053 / j.gastro.2006.02.055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Свидсински А., Вебер Дж, Лёнинг-Бауке В., Хейл Л.П., Лохс Х. Пространственная организация и состав флоры слизистой оболочки у пациентов с воспалительным заболеванием кишечника. J Clin Microbiol (2005) 43: 3380–9.DOI: 10.1128 / JCM.43.7.3380-3389.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Филпотт Д. Д., Сорбара М. Т., Робертсон С. Дж., Кроитору К., Жирардин С. Е.. Белки NOD: регуляторы воспаления при здоровье и болезни. Nat Rev Immunol (2014) 14: 9–23. DOI: 10.1038 / nri3565
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Wehkamp J, Harder J, Weichenthal M, Schwab M, Schaffeler E, Schlee M, et al. Мутации NOD2 (CARD15) при болезни Крона связаны со снижением экспрессии альфа-дефенсина слизистой оболочки. Кишечник (2004) 53: 1658–64. DOI: 10.1136 / gut.2003.032805
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Огура Ю., Бонен Д.К., Инохара Н., Николае Д.Л., Чен Ф.Ф., Рамос Р. и др. Мутация сдвига рамки считывания в NOD2, связанная с восприимчивостью к болезни Крона. Nature (2001) 411: 603–6. DOI: 10.1038 / 35079114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Hugot JP, Chamaillard M, Zouali H, Lesage S, Cezard JP, Belaiche J, et al.Ассоциация вариантов с высоким содержанием лейцина NOD2 с предрасположенностью к болезни Крона. Nature (2001) 411: 599–603. DOI: 10.1038 / 35079107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Франк Д. Н., Робертсон С. Е., Хамм С. М., Кпаде З., Чжан Т., Чен Х. и др. Фенотип и генотип заболевания связаны со сдвигами в кишечной микробиоте при воспалительных заболеваниях кишечника. Воспаление кишечника. Dis (2011) 17: 179–84. DOI: 10.1002 / ibd.21339
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91.Ли Э., Хамм С.М., Гулати А.С., Сартор Р.Б., Чен Х., Ву Х и др. Фенотип воспалительных заболеваний кишечника, C. difficile и генотип NOD2 связаны со сдвигами в микробном составе, ассоциированном с подвздошной кишкой человека. PLoS One (2012) 7: e26284. DOI: 10.1371 / journal.pone.0026284
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Петницки-Оквейя Т., Хрнцир Т., Лю Ю.Дж., Бисвас А., Худкович Т., Тласкалова-Хогенова Х. и др. NOD2 необходим для регуляции комменсальной микробиоты в кишечнике. Proc Natl Acad Sci U S A (2009) 106: 15813–8. DOI: 10.1073 / pnas.02106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Кутюрье-Майяр А., Секер Т., Рехман А., Норманд С., Де Арканджелис А., Хеслер Р. и др. NOD2-опосредованный дисбиоз предрасполагает мышей к трансмиссивному колиту и колоректальному раку. Дж. Клин Инвест (2013) 123: 700–11. DOI: 10.1172 / JCI62236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94.Цзян В., Ван Х, Цзэн Б., Лю Л., Тардивел А., Вэй Х и др. Распознавание кишечной микробиоты с помощью NOD2 необходимо для гомеостаза кишечных интраэпителиальных лимфоцитов. J Exp Med (2013) 210: 2465–76. DOI: 10.1084 / jem.20122490
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Паломино-Моралес Р.Дж., Оливер Дж., Гомес-Гарсия М., Лопес-Невот М.А., Родриго Л., Нието А. и др. Ассоциация полиморфизмов генов ATG16L1 и IRGM с воспалительным заболеванием кишечника: подход метаанализа. Genes Immun (2009) 10: 356–64. DOI: 10.1038 / gene.2009.25
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Ламас Б., Ричард М.Л., Ледук В., Фам Х.П., Мишель М.Л., Да Коста Дж. И др. CARD9 воздействует на колит, изменяя метаболизм триптофана в кишечной микробиоте до лигандов арилуглеводородных рецепторов. Нат Мед (2016) 22: 598–605. DOI: 10,1038 / нм 4102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Прескотт, штат Нью-Джерси, Фишер С.А., Франке А., Хампе Дж., Онни С.М., Соарс Д. и др.Несинонимичный SNP в ATG16L1 предрасполагает к болезни Крона подвздошной кишки и не зависит от CARD15 и IBD5. Гастроэнтерология (2007) 132: 1665–71. DOI: 10.1053 / j.gastro.2007.03.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Cadwell K, Patel KK, Maloney NS, Liu TC, Ng AC, Storer CE, et al. Взаимодействие вируса и гена восприимчивости определяет фенотипы гена болезни Крона Atg16L1 в кишечнике. Cell (2010) 141: 1135–45. DOI: 10.1016 / j.ячейка.2010.05.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Казер А., Ли А. Х., Франке А., Гликман Дж. Н., Цейссиг С., Тилг Х и др. XBP1 связывает стресс ER с воспалением кишечника и создает генетический риск воспалительного заболевания кишечника человека. Cell (2008) 134: 743–56. DOI: 10.1016 / j.cell.2008.07.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Рауш П., Рехман А., Кунцель С., Хаслер Р., Отт С.Дж., Шрайбер С. и др.На микробиоту слизистой оболочки толстой кишки влияет взаимодействие болезни Крона и генотипа FUT2 (Secretor). Proc Natl Acad Sci U S A (2011) 108: 19030–5. DOI: 10.1073 / pnas.1106408108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Андерсон К.А., Бушер Дж., Лис К.В., Франке А., Д’Амато М., Тейлор К.Д. и др. Мета-анализ идентифицирует 29 дополнительных локусов риска язвенного колита, увеличивая количество подтвержденных ассоциаций до 47. Nat Genet (2011) 43: 246–52.DOI: 10,1038 / нг.764
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Franke A., McGovern DP, Barrett JC, Wang K, Radford-Smith GL, Ahmad T. и др. Полногеномный метаанализ увеличивает до 71 числа подтвержденных локусов восприимчивости к болезни Крона. Нат Генет (2010) 42: 1118–25. DOI: 10,1038 / нг.717
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, et al.Взаимодействие микробов и хозяев сформировало генетическую архитектуру воспалительного заболевания кишечника. Nature (2012) 491: 119–24. DOI: 10.1038 / природа11582
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Ventham NT, Kennedy NA, Nimmo ER, Satsangi J. Помимо открытия генов при воспалительных заболеваниях кишечника: новая роль эпигенетики. Гастроэнтерология (2013) 145: 293–308. DOI: 10.1053 / j.gastro.2013.05.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105.Hue S, Ahern P, Buonocore S, Kullberg MC, Cua DJ, McKenzie BS и др. Интерлейкин-23 вызывает врожденное и опосредованное Т-клетками воспаление кишечника. J Exp Med (2006) 203: 2473–83. DOI: 10.1084 / jem.20061099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Йен Д., Чунг Дж., Шееренс Х., Пуле Ф., МакКланахан Т., Маккензи Б. и др. IL-23 необходим при Т-клеточном колите и способствует воспалению через IL-17 и IL-6. Дж. Клин Инвест (2006) 116: 1310–6.DOI: 10.1172 / JCI21404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Баумлер А.Дж., Сперандио В. Взаимодействие между микробиотой и патогенными бактериями в кишечнике. Nature (2016) 535: 85–93. DOI: 10.1038 / природа18849
CrossRef Полный текст | Google Scholar
108. Моллой MJ, Grainger JR, Bouladoux N, Hand TW, Koo LY, Naik S, et al. Внутрипросветное сдерживание комменсального разрастания в кишечнике при дисбактериозе, вызванном инфекцией. Клеточный микроб-хозяин (2013) 14: 318–28. DOI: 10.1016 / j.chom.2013.08.003
CrossRef Полный текст | Google Scholar
110. Ядав В., Варум Ф., Браво Р., Феррер Е., Бойич Д., Басит А.В. Воспалительное заболевание кишечника: изучение патофизиологии кишечника для новых терапевтических целей. Transl Res (2016) 176: 38–68. DOI: 10.1016 / j.trsl.2016.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Блум С.М., Биджанки В.Н., Нава Г.М., Сан Л., Малвин Н.П., Донермейер Д.Л. и др.Виды Commensal Bacteroides индуцируют колит специфическим для генотипа хозяина образом на мышиной модели воспалительного заболевания кишечника. Клеточный микроб-хозяин (2011) 9: 390–403. DOI: 10.1016 / j.chom.2011.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Альбенберг Л.Г., Льюис Дж. Д., Ву Г. Д.. Пища и микробиота кишечника при воспалительных заболеваниях кишечника: важная связь. Curr Opin Gastroenterol (2012) 28: 314–20. DOI: 10.1097 / MOG.0b013e328354586f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114.Каппельман MD. Факторы окружающей среды и воспалительные заболевания кишечника: неуловимо или не существует? Воспаление кишечника. Dis (2013) 19: 548–9. DOI: 10.1097 / MIB.0b013e318281ce99
CrossRef Полный текст | Google Scholar
115. Тернбо П.Дж., Ридаура В.К., Фейт Дж.Дж., Рей Ф.И., Найт Р., Гордон Джи. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных гнотобиотических мышах. Sci Transl Med (2009) 1: 6ra14. DOI: 10.1126 / scitranslmed.3000322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116.Дэвид Л.А., Морис К.Ф., Кармоди Р.Н., Гутенберг Д.Б., Баттон Дж. Э., Вулф Б. Е. и др. Диета быстро и воспроизводимо изменяет микробиом кишечника человека. Nature (2014) 505: 559–63. DOI: 10.1038 / природа12820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Кордайн Л., Итон С.Б., Себастьян А., Манн Н., Линдеберг С., Уоткинс Б.А. и др. Истоки и эволюция западной диеты: значение для здоровья в 21 веке. Am J Clin Nutr (2005) 81: 341–54.
PubMed Аннотация | Google Scholar
118.Ли Д., Альбенберг Л., Компер С., Бальдассано Р., Пикколи Д., Льюис Д. Д. и др. Диета в патогенезе и лечении воспалительных заболеваний кишечника. Гастроэнтерология (2015) 148: 1087–106. DOI: 10.1053 / j.gastro.2015.01.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Девкота С., Ван И, Муш М. В., Леоне В., Фелнер-Пич Х., Надимпалли А. и др. Таурохолевая кислота, индуцированная пищевым жиром, способствует размножению патобионтов и колиту у мышей IL10 — / -. Nature (2012) 487: 104–8.DOI: 10.1038 / nature11225
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Machiels K, Joossens M, Sabino J, De Preter V, Arijs I., Eeckhaut V, et al. Уменьшение количества видов, продуцирующих бутират, Roseburia hominis и Faecalibacterium prausnitzii определяет дисбактериоз у пациентов с язвенным колитом. Кишечник (2014) 63: 1275–83. DOI: 10.1136 / gutjnl-2013-304833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122.Брейер Р.И., Соргель К.Х., Лашнер Б.А., Крист М.Л., Ханауэр С.Б., Ванагунас А. и др. Ректальное орошение короткоцепочечных жирных кислот при левостороннем язвенном колите: рандомизированное плацебо-контролируемое исследование. Кишечник (1997) 40: 485–91. DOI: 10.1136 / gut.40.4.485
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Scheppach W. Лечение дистального язвенного колита клизмами с короткоцепочечными жирными кислотами. Плацебо-контролируемое испытание. Немецко-австрийская исследовательская группа SCFA. Dig Dis Sci (1996) 41: 2254–9.DOI: 10.1007 / BF02071409
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Vernia P, Marcheggiano A, Caprilli R, Frieri G, Corrao G, Valpiani D, et al. Местное лечение короткоцепочечных жирных кислот при дистальном язвенном колите. Aliment Pharmacol Ther (1995) 9: 309–13. DOI: 10.1111 / j.1365-2036.1995.tb00386.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Верния П., Аннезе В., Бреши Дж., Д’Альбасио Дж., Д’Инка Р., Джаккари С. и др.Местный бутират повышает эффективность 5-АСК при рефрактерном дистальном язвенном колите: результаты многоцентрового исследования. Eur J Clin Invest (2003) 33: 244–8. DOI: 10.1046 / j.1365-2362.2003.01130.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Scheppach W, Sommer H, Kirchner T., Paganelli GM, Bartram P, Christl S, et al. Влияние бутиратных клизм на слизистую толстой кишки при дистальном язвенном колите. Гастроэнтерология (1992) 103: 51–6. DOI: 10.1016 / 0016-5085 (92)
-К
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, et al. Метаболомический анализ показывает большое влияние микрофлоры кишечника на метаболиты крови млекопитающих. Proc Natl Acad Sci U S A (2009) 106: 3698–703. DOI: 10.1073 / pnas.0812874106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Хаббард Т.Д., Мюррей И.А., Пердью Г.Х. Метаболизм индола и триптофана: эндогенные и диетические пути активации рецепторов Ah. Drug Metab Dispos (2015) 43: 1522–35. DOI: 10.1124 / dmd.115.064246
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132. Ли Дж. С., Селла М., Макдональд К. Г., Гарланда С., Кеннеди Г. Д., Нукая М. и др. AHR управляет развитием клеток ILC22 кишечника и постнатальных лимфоидных тканей посредством путей, зависящих от notch и не зависящих от них. Nat Immunol (2011) 13: 144–51. DOI: 10.1038 / ni.2187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
133.Сокол Х., Конвей К.Л., Чжан М., Чой М., Морин Б., Цао З. и др. CARD9 опосредует реституцию кишечных эпителиальных клеток, ответы Т-хелперов 17 и контроль бактериальной инфекции у мышей. Гастроэнтерология (2013) 145: 591–601.e3. DOI: 10.1053 / j.gastro.2013.05.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Зеланте Т., Яннитти Р.Г., Кунья С., Де Лука А., Джованнини Дж., Пиераччини Дж. И др. Катаболиты триптофана из микробиоты взаимодействуют с рецепторами арилуглеводородов и уравновешивают реактивность слизистой оболочки через интерлейкин-22. Иммунитет (2013) 39: 372–85. DOI: 10.1016 / j.immuni.2013.08.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Абегунде А.Т., Мухаммад Б.Х., Бхатти О., Али Т. Факторы экологического риска воспалительных заболеваний кишечника: обзор литературы на основе фактических данных. World J Gastroenterol (2016) 22: 6296–317. DOI: 10.3748 / wjg.v22.i27.6296
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Гербарг П.Л., Якоб В.Е., Стивенс Л., Босуорт Б.П., Чабуни Ф., ДеФилиппис Е.М. и др.Влияние дыхания, движения и медитации на психологические и физические симптомы и воспалительные биомаркеры при воспалительном заболевании кишечника: рандомизированное контролируемое исследование. Воспаление кишечника. Dis (2015) 21: 2886–96. DOI: 10.1097 / MIB.0000000000000568
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Биттон А., Добкин П.Л., Эдвардс М.Д., Сьюитч М.Дж., Меддингс Дж.Б., Равал С. и др. Прогнозирование рецидива болезни Крона: биопсихосоциальная модель. Кишечник (2008) 57: 1386–92.DOI: 10.1136 / gut.2007.134817
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Финк Г. Синдром общей адаптации Селье: вызванные стрессом язвы желудочно-дуоденального тракта и воспалительные заболевания кишечника. J Endocrinol (2017) 232: F1–5. DOI: 10.1530 / JOE-16-0547
CrossRef Полный текст | Google Scholar
139. Tache Y, Brunnhuber S. От открытия Ганса Селье биологического стресса до идентификации сигнальных путей рилизинг-фактора кортикотропина: участие в связанных со стрессом функциональных заболеваниях кишечника. Ann N Y Acad Sci (2008) 1148: 29–41. DOI: 10.1196 / анналы.1410.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Bunnett NW. Подвергнутый стрессу кишечник: вклад пептидов кишечного стресса в воспаление и моторику. Proc Natl Acad Sci U S A (2005) 102: 7409–10. DOI: 10.1073 / pnas.05030
CrossRef Полный текст | Google Scholar
142. Tache Y, Larauche M, Yuan PQ, Million M. Передача сигналов CRF в мозге и кишечнике: биологические действия и роль в желудочно-кишечном тракте. Curr Mol Pharmacol (2017). DOI: 10.2174 / 1874467210666170224095741
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143. Smith F, Clark JE, Overman BL, Tozel CC, Huang JH, Rivier JE, et al. Стресс, вызванный ранним отлучением от груди, ухудшает развитие барьерной функции слизистой оболочки кишечника свиней. Am J Physiol Gastrointest Liver Physiol (2010) 298: G352–63. DOI: 10.1152 / ajpgi.00081.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144.Ван Х, Чжан Ц., Ву Г, Сунь Й, Ван Б, Хэ Б и др. Глютамин усиливает экспрессию белка плотного соединения и модулирует передачу сигналов фактора высвобождения кортикотропина в тощей кишке поросят-отъемышей. J Nutr (2015) 145: 25–31. DOI: 10.3945 / jn.114.202515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Мосс А.С., Антон П., Сэвидж Т., Ньюман П., Чейфец А.С., Гей Дж. И др. Урокортин II опосредует провоспалительные эффекты в колоноцитах человека через рецептор 2альфа кортикотропин-рилизинг-гормона. Кишечник (2007) 56: 1210–7. DOI: 10.1136 / gut.2006.110668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
146. Кавахито Ю., Сано Х., Мукаи С., Асаи К., Кимура С., Ямамура Ю. и др. Релизинг-гормон кортикотропина в слизистой оболочке толстой кишки у пациентов с язвенным колитом. Кишечник (1995) 37: 544–51. DOI: 10.1136 / gut.37.4.544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147. Сарута М., Такахаши К., Сузуки Т., Тории А., Каваками М., Сасано Х.Урокортин 1 слизистой оболочки толстой кишки у больных язвенным колитом. J Clin Endocrinol Metab (2004) 89: 5352–61. DOI: 10.1210 / jc.2004-0195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
148. Brzozowski B, Mazur-Bialy A, Pajdo R, Kwiecien S, Bilski J, Zwolinska-Wcislo M, et al. Механизмы воздействия стресса на экспериментальное и клиническое воспалительное заболевание кишечника (ВЗК): роль оси мозг-кишечник. Curr Neuropharmacol (2016) 14: 892–900. DOI: 10.2174 / 1570159X14666160404124127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Карл Дж. П., Марголис Л. М., Мадслиен Е. Х., Мерфи Н. Э., Кастеллани Дж. В., Гундерсен Ю. и др. Изменения в составе кишечной микробиоты и метаболизма совпадают с повышенной проницаемостью кишечника у молодых людей при длительном физиологическом стрессе. Am J Physiol Gastrointest Liver Physiol (2017) 312: G559–71. DOI: 10.1152 / ajpgi.00066.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
153.Wang B, Wu Z, Ji Y, Sun K, Dai Z, Wu G. l-глутамин усиливает целостность плотных контактов, активируя передачу сигналов протеинкиназы, активируемой CaMK-киназой 2-AMP, в эпителиальных клетках кишечника свиней. J Nutr (2016) 146: 501–8. DOI: 10.3945 / jn.115.224857
PubMed Аннотация | CrossRef Полный текст | Google Scholar
154. Хоффманн С., Хилл Д.А., Минка Н., Кирн Т., Трой А., Артис Д. и др. Ответ микробиоты кишечника в масштабах всего сообщества на энтеропатогенную инфекцию Citrobacter rodentium выявлен глубоким секвенированием. Infect Immun (2009) 77: 4668–78. DOI: 10.1128 / IAI.00493-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
155. Мортон Э.Р., Линч Дж., Фромент А., Лафосс С., Хейер Э., Пржеворски М. и др. Изменчивость микробиоты кишечника африканских сельских жителей сильно коррелирует с колонизацией Entamoeba и существованием. PLoS Genet (2015) 11: e1005658. DOI: 10.1371 / journal.pgen.1005658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
156.Морис К.Ф., Хайзер Х.Дж., Тернбо П.Дж. Ксенобиотики формируют физиологию и экспрессию генов активного микробиома кишечника человека. Cell (2013) 152: 39–50. DOI: 10.1016 / j.cell.2012.10.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
159. Sartor RB. Лечебные манипуляции с кишечной микрофлорой при воспалительных заболеваниях кишечника: антибиотики, пробиотики, пребиотики. Гастроэнтерология (2004) 126: 1620–33. DOI: 10.1053 / j.gastro.2004.03.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
160.Скотт К.П., Антуан Дж. М., Мидтведт Т., ван Хемерт С. Манипулирование микробиотой кишечника для поддержания здоровья и лечения болезней. Microb Ecol Health Dis (2015) 26: 25877. DOI: 10.3402 / mehd.v26.25877
PubMed Аннотация | CrossRef Полный текст | Google Scholar
161. Хан К.Дж., Ульман Т.А., Форд А.С., Абреу М.Т., Абадир А., Маршалл Дж. К. и др. Антибактериальная терапия при воспалительном заболевании кишечника: систематический обзор и метаанализ. Am J Gastroenterol (2011) 106: 661–73. DOI: 10.1038 / ajg.2011.72
PubMed Аннотация | CrossRef Полный текст | Google Scholar
163. Унгаро Р., Бернштейн С.Н., Гирри Р., Хвиид А., Колхо К.Л., Кронман М.П. и др. Антибиотики, связанные с повышенным риском впервые возникшей болезни Крона, но не язвенного колита: метаанализ. Am J Gastroenterol (2014) 109: 1728–38. DOI: 10.1038 / ajg.2014.246
PubMed Аннотация | CrossRef Полный текст | Google Scholar
167. van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, et al.Дуоденальная инфузия донорских фекалий при рецидиве Clostridium difficile . N Engl J Med (2013) 368: 407–15. DOI: 10.1056 / NEJMoa1205037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
168. Андерсон Дж. Л., Эдни Р. Дж., Уилан К. Систематический обзор: трансплантация фекальной микробиоты при лечении воспалительных заболеваний кишечника. Aliment Pharmacol Ther (2012) 36: 503–16. DOI: 10.1111 / j.1365-2036.2012.05220.x
CrossRef Полный текст | Google Scholar
169.Лопес Дж., Гринспан А. Трансплантация фекальной микробиоты при воспалительном заболевании кишечника. Гастроэнтерол Hepatol (N Y) (2016) 12: 374–9.
PubMed Аннотация | Google Scholar
170. Вризе А., Ван Нуд Е., Холлеман Ф., Салоярви Дж., Кутте Р.С., Бартельсман Дж. Ф. и др. Перенос кишечной микробиоты от худых доноров увеличивает чувствительность к инсулину у людей с метаболическим синдромом. Гастроэнтерология (2012) 143: 913–6.e7. DOI: 10.1053 / j.gastro.2012.06.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
171.Cammarota G, Ianiro G, Gasbarrini A. Трансплантация фекальной микробиоты для лечения инфекции Clostridium difficile : систематический обзор. J Clin Gastroenterol (2014) 48: 693–702. DOI: 10.1097 / MCG.0000000000000046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
172. Яниро Г., Биббо С., Скальдаферри Ф., Гасбаррини А., Каммарота Г. Трансплантация фекальной микробиоты при воспалительном заболевании кишечника: вне волнения. Медицина (Балтимор) (2014) 93: e97.DOI: 10.1097 / MD.0000000000000097
PubMed Аннотация | CrossRef Полный текст | Google Scholar
173. Колман Р.Дж., Рубин Д.Т. Трансплантация фекальной микробиоты как терапия воспалительного заболевания кишечника: систематический обзор и метаанализ. J Crohns Colitis (2014) 8: 1569–81. DOI: 10.1016 / j.crohns.2014.08.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
175. Ангелбергер С., Райниш В., Макристатис А., Лихтенбергер С., Дежако С., Папай П. и др.Динамика временного бактериального сообщества у пациентов с язвенным колитом после трансплантации фекальной микробиоты различается. Am J Gastroenterol (2013) 108: 1620–30. DOI: 10.1038 / ajg.2013.257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
176. Шрезенмейр Дж., Де Врезе М. Пробиотики, пребиотики и синбиотики — приближаясь к определению. Am J Clin Nutr (2001) 73: 361s – 4s.
Google Scholar
177. Tamboli CP, Caucheteux C, Cortot A, Colombel JF, Desreumaux P.Пробиотики при воспалительном заболевании кишечника: критический обзор. Best Practices Clin Gastroenterol (2003) 17: 805–20. DOI: 10.1016 / S1521-6918 (03) 00076-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
179. Шейл Б., Шанахан Ф., О’Махони Л. Пробиотические эффекты при воспалительном заболевании кишечника. J Nutr (2007) 137: 819S – 24S.
Google Scholar
180. Тао Й, Драбик К.А., Вайпа Т.С., Муш М.В., Алверди Дж. К., Шнеуинд О. и др. Растворимые факторы из Lactobacillus GG активируют MAPK и индуцируют цитопротективные белки теплового шока в эпителиальных клетках кишечника. Am J Physiol Cell Physiol (2006) 290: C1018–30. DOI: 10.1152 / ajpcell.00131.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
181. Госселинк М.П., Скоутен В.Р., ван Лисхаут Л.М., Хмель В.С., Ламан Д.Д., Руселер-ван Эмбден Дж.Г. Задержка первого начала поучита при пероральном приеме пробиотического штамма Lactobacillus rhamnosus GG. Dis Colon Rectum (2004) 47: 876–84. DOI: 10.1007 / s10350-004-0525-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
182.Суд А., Мидха V, Махария Г.К., Ахуджа В., Сингал Д., Госвами П. и др. Пробиотический препарат VSL # 3 вызывает ремиссию у пациентов с легким или умеренно активным язвенным колитом. Clin Gastroenterol Hepatol (2009) 7: 1202–9, 1209.e1. DOI: 10.1016 / j.cgh.2009.07.016
CrossRef Полный текст | Google Scholar
183. Tursi A, Brandimarte G, Papa A, Giglio A, Elisei W, Giorgetti GM, et al. Лечение рецидивирующего язвенного колита легкой и средней степени тяжести пробиотиком VSL # 3 в качестве дополнения к стандартному фармацевтическому лечению: двойное слепое рандомизированное плацебо-контролируемое исследование. Am J Gastroenterol (2010) 105: 2218–27. DOI: 10.1038 / ajg.2010.218
CrossRef Полный текст | Google Scholar
184. Шэнь Дж., Цзо Цзы, Мао А.П. Влияние пробиотиков на вызывание ремиссии и поддерживающую терапию при язвенном колите, болезни Крона и поучите: метаанализ рандомизированных контролируемых исследований. Воспаление кишечника. Dis (2014) 20: 21–35. DOI: 10.1097 / 01.MIB.0000437495.30052.be
PubMed Аннотация | CrossRef Полный текст | Google Scholar
185.Като К., Мидзуно С., Умесаки Ю., Исии Ю., Сугитани М., Имаока А. и др. Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Aliment Pharmacol Ther (2004) 20: 1133–41. DOI: 10.1111 / j.1365-2036.2004.02268.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
186. Олива С., Ди Нардо Дж., Феррари Ф, Маллардо С., Росси П., Патрици Дж. И др. Рандомизированное клиническое исследование: эффективность ректальной клизмы Lactobacillus reuteri ATCC 55730 у детей с активным дистальным язвенным колитом. Aliment Pharmacol Ther (2012) 35: 327–34. DOI: 10.1111 / j.1365-2036.2011.04939.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
187. Нами Й., Абдулла Н., Хагшенас Б., Радиа Д., Росли Р., Хосрушахи А.Ю. Оценка пробиотического потенциала и противоопухолевой активности недавно выделенной вагинальной бактерии Lactobacillus plantarum 5BL. Microbiol Immunol (2014) 58: 492–502. DOI: 10.1111 / 1348-0421.12175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
188.Гош С., Ван Хил Д., Плейфорд Р. Дж. Пробиотики при воспалительном заболевании кишечника: все ли связано с модуляцией кишечной флоры? Кишечник (2004) 53: 620–2. DOI: 10.1136 / gut.2003.034249
CrossRef Полный текст | Google Scholar
Макрофаги при кишечном воспалении и разрешении: потенциальная терапевтическая мишень при ВЗК
Шетт, Г. и Нейрат, М. Ф. Разрешение хронических воспалительных заболеваний: универсальные и тканеспецифичные концепции. Nat. Commun. 9 , 3261 (2018).
PubMed PubMed Central Google ученый
Хантер П. Воспалительная теория болезни. Растущее осознание того, что хроническое воспаление имеет решающее значение при многих заболеваниях, открывает новые возможности для лечения. EMBO Rep. 13 , 968–970 (2012).
CAS PubMed PubMed Central Google ученый
Гарретт, В. С., Гордон, Дж.И. и Глимчер, Л. Х. Гомеостаз и воспаление в кишечнике. Cell 140 , 859–870 (2010).
CAS PubMed PubMed Central Google ученый
Моват, А. М. Отвечать или не реагировать — личная точка зрения на кишечную толерантность. Nat. Rev. Immunol. 18 , 405–415 (2018).
CAS PubMed Google ученый
Эллиотт М. Р., Костер К. М. и Мерфи П. С. Передача сигналов эффероцитоза в регуляции воспалительных реакций макрофагов. J. Immunol. 198 , 1387–1394 (2017).
CAS PubMed PubMed Central Google ученый
Бейн, К. и Моват, А. М. Макрофаги в кишечном гомеостазе и воспалении. Immunol. Ред. 260 , 102–117 (2014).
CAS PubMed PubMed Central Google ученый
де Соуза, Х. С. и Фиокки, С. Иммунопатогенез ВЗК: современное состояние. Nat. Преподобный Гастроэнтерол. Гепатол. 13 , 13–27 (2016).
PubMed Google ученый
van Furth, R. et al. Система мононуклеарных фагоцитов: новая классификация макрофагов, моноцитов и их клеток-предшественников. Бык. Всемирный орган здравоохранения. 46 , 845–852 (1972).
PubMed PubMed Central Google ученый
Jakubzick, C. et al. Минимальная дифференциация классических моноцитов, поскольку они исследуют устойчивые ткани и транспортируют антиген к лимфатическим узлам. Иммунитет 39 , 599–610 (2013).
CAS PubMed Google ученый
Hashimoto, D. et al. Резидентные в тканях макрофаги самоподдерживаются локально на протяжении всей взрослой жизни с минимальным вкладом циркулирующих моноцитов. Иммунитет 38 , 792–804 (2013).
CAS Google ученый
Yona, S. et al. Картирование судьбы показывает происхождение и динамику моноцитов и тканевых макрофагов в условиях гомеостаза. Иммунитет 38 , 79–91 (2013).
CAS Статья Google ученый
Ginhoux, F. et al. Анализ картирования судьбы показывает, что взрослая микроглия происходит от примитивных макрофагов. Наука 330 , 841–845 (2010).
CAS PubMed PubMed Central Google ученый
Hoeffel, G. et al. Фетальные моноциты, происходящие из эритромиелоидных предшественников C-Myb + , дают начало взрослым тканевым макрофагам. Иммунитет 42 , 665–678 (2015).
CAS PubMed PubMed Central Google ученый
Ginhoux, F. & Guilliams, M.Онтогенез и гомеостаз тканерезидентных макрофагов. Иммунитет 44 , 439–449 (2016).
CAS PubMed Google ученый
Shaw, T. N. et al. Резидентные в тканях макрофаги в кишечнике являются долгоживущими и определяются экспрессией Tim-4 и CD4. J. Exp. Med. 215 , 1507–1518 (2018).
CAS PubMed PubMed Central Google ученый
De Schepper, S. et al. Самоподдерживающиеся макрофаги кишечника необходимы для гомеостаза кишечника. Cell 175 , 400–415 (2018).
PubMed Google ученый
Bujko, A. et al. Транскрипционное и функциональное профилирование определяет подмножества макрофагов тонкого кишечника человека. J. Exp. Med. 215 , 441–458 (2018).
CAS PubMed PubMed Central Google ученый
Guilliams, M. & Scott, C.L. Определяет ли нишевая конкуренция происхождение макрофагов, находящихся в тканях? Nat. Rev. Immunol. 17 , 451–460 (2017).
CAS PubMed Google ученый
Bain, C.C. et al. Постоянное пополнение циркулирующими моноцитами поддерживает пул макрофагов в кишечнике взрослых мышей. Nat. Иммунол. 15 , 929–937 (2014).
CAS PubMed PubMed Central Google ученый
Bain, C.C. et al. Резидентные и провоспалительные макрофаги в толстой кишке представляют собой альтернативные контекстно-зависимые судьбы одних и тех же предшественников моноцитов Ly6Chi. Mucosal Immunol. 6 , 498–510 (2013).
CAS PubMed Google ученый
Dai, XM, Zong, XH, Sylvestre, V. и Stanley, ER Неполное восстановление функции колониестимулирующего фактора 1 (CSF-1) у мышей с дефицитом CSF-1 по Csf1op / Csf1op путем трансгенной экспрессии клеточная поверхность CSF-1. Кровь 103 , 1114–1123 (2004).
CAS PubMed Google ученый
Райан, Г. Р. и др. Спасение фенотипа колониестимулирующего фактора 1 (CSF-1) -нуллизиготных мышей (Csf1 (op) / Csf1 (op)) трансгеном CSF-1 и идентификация сайтов локального синтеза CSF-1. Кровь 98 , 74–84 (2001).
CAS PubMed Google ученый
Muller, P.A. et al. Перекрестное взаимодействие между макрофагами muscularis и кишечными нейронами регулирует моторику желудочно-кишечного тракта. Cell 158 , 300–313 (2014).
CAS PubMed PubMed Central Google ученый
MacDonald, K. P. et al. Антитело против рецептора колониестимулирующего фактора 1 истощает резидентную субпопуляцию моноцитов и макрофагов, ассоциированных с тканями и опухолями, но не подавляет воспаление. Кровь 116 , 3955–3963 (2010).
CAS PubMed Google ученый
Arnold, I.C. et al. Моноциты / макрофаги CD11c + способствуют развитию хронического кишечного воспаления, индуцированного Helicobacter hepaticus , посредством продукции IL-23. Mucosal Immunol. 9 , 352–363 (2016).
CAS PubMed Google ученый
Jung, S. et al. Анализ функции рецептора фракталкина CX 3 CR1 путем целенаправленной делеции и вставки репортерного гена зеленого флуоресцентного белка. Mol. Клетка. Биол. 20 , 4106–4114 (2000).
CAS PubMed PubMed Central Google ученый
Sehgal, A. et al. Роль CSF1R-зависимых макрофагов в контроле ниши кишечных стволовых клеток. Nat. Commun. 9 , 1272 (2018).
PubMed PubMed Central Google ученый
Schridde, A. et al. Тканевая дифференцировка макрофагов толстой кишки требует передачи сигналов, опосредованной рецептором TGFbeta. Mucosal Immunol. 10 , 1387–1399 (2017).
CAS PubMed PubMed Central Google ученый
Rugtveit, J. et al. Профили цитокинов различаются у вновь набранных и резидентных подмножеств макрофагов слизистой оболочки от воспалительного заболевания кишечника. Гастроэнтерология 112 , 1493–1505 (1997).
CAS PubMed Google ученый
Smythies, L.E. et al. Макрофаги кишечника человека проявляют выраженную воспалительную анергию, несмотря на активную фагоцитарную и бактерицидную активность. J. Clin. Инвестировать. 115 , 66–75 (2005).
CAS PubMed PubMed Central Google ученый
Smythies, L.E. et al. Анергия воспаления в макрофагах кишечника человека возникает из-за индуцированной Smad экспрессии IkappaBalpha и инактивации NF-kappaB. J. Biol. Chem. 285 , 19593–19604 (2010).
CAS PubMed PubMed Central Google ученый
Ueda, Y. et al. Комменсальная микробиота вызывает гипореактивность ЛПС в макрофагах толстой кишки за счет продукции IL-10. Внутр. Иммунол. 22 , 953–962 (2010).
CAS PubMed Google ученый
Franchi, L. et al. Продукция IL-1beta, управляемая NLRC4, различает патогенные и комменсальные бактерии и способствует защите кишечника хозяина. Nat. Иммунол. 13 , 449–456 (2012).
CAS PubMed PubMed Central Google ученый
Maheshwari, A. et al. TGF-бета2 подавляет выработку цитокинов макрофагами и воспалительные реакции слизистых оболочек в развивающемся кишечнике. Гастроэнтерология 140 , 242–253 (2011).
CAS PubMed Google ученый
Schwarz, T. et al. Полученный из Т-клеток IL-10 определяет исход болезни лейшманиоза и подавляется вакциной на основе дендритных клеток. PLOS Pathog. 9 , e1003476 (2013).
CAS PubMed PubMed Central Google ученый
Zigmond, E. et al. Ограниченный макрофагами дефицит рецепторов интерлейкина-10, но не дефицит ИЛ-10, вызывает тяжелый спонтанный колит. Иммунитет 40 , 720–733 (2014).
CAS PubMed Google ученый
Kuhn, R., Lohler, J., Rennick, D., Rajewsky, K. & Muller, W.У мышей с дефицитом интерлейкина-10 развивается хронический энтероколит. Cell 75 , 263–274 (1993).
CAS PubMed Google ученый
Shouval, D. S. et al. Передача сигналов рецептора интерлейкина-10 в клетках врожденного иммунитета регулирует иммунную толерантность слизистых оболочек и противовоспалительную функцию макрофагов. Иммунитет 40 , 706–719 (2014).
CAS PubMed PubMed Central Google ученый
Girard-Madoux, M. J. et al. Контроль IL-10 миелоидных клеток CD11c + необходим для поддержания иммунного гомеостаза в тонком и толстом кишечнике. Oncotarget 7 , 32015–32030 (2016).
PubMed PubMed Central Google ученый
Glocker, E.O. et al. Воспалительное заболевание кишечника и мутации, влияющие на рецептор интерлейкина-10. N. Engl. J. Med. 361 , 2033–2045 (2009).
CAS PubMed PubMed Central Google ученый
Schenk, M., Bouchon, A., Birrer, S., Colonna, M. & Mueller, C. Макрофаги, экспрессирующие запускающий рецептор, экспрессируемый на миелоидных клетках-1, недостаточно представлены в кишечнике человека. J. Immunol. 174 , 517–524 (2005).
CAS PubMed Google ученый
Кобаяши Т.и другие. IL-10 регулирует экспрессию Il12b посредством деацетилирования гистонов: последствия для гомеостаза кишечных макрофагов. J. Immunol. 189 , 1792–1799 (2012).
CAS PubMed PubMed Central Google ученый
Simon, J. M. et al. Изменения хроматина в кишечных макрофагах связывают дефицит IL-10 с несоответствующими воспалительными реакциями. Eur. J. Immunol. 46 , 1912–1925 (2016).
CAS PubMed PubMed Central Google ученый
Hirotani, T. et al. Ядерный белок IkappaB IkappaBNS избирательно ингибирует индуцированное липополисахаридом производство IL-6 в макрофагах собственной пластинки толстой кишки. J. Immunol. 174 , 3650–3657 (2005).
CAS PubMed Google ученый
Ip, W. K. E., Hoshi, N., Shouval, D. S., Snapper, S. & Medzhitov, R. Противовоспалительный эффект IL-10, опосредованный метаболическим перепрограммированием макрофагов. Наука 356 , 513–519 (2017).
CAS PubMed PubMed Central Google ученый
Hadis, U. et al. Кишечная толерантность требует самонаведения в кишечнике и экспансии FoxP3 + регуляторных Т-клеток в собственной пластинке. Иммунитет 34 , 237–246 (2011).
CAS Google ученый
Mortha, A. et al. Зависимое от микробиоты перекрестное взаимодействие между макрофагами и ILC3 способствует гомеостазу кишечника. Наука 343 , 1249288 (2014).
PubMed PubMed Central Google ученый
Medina-Contreras, O. et al. CX3CR1 регулирует гомеостаз кишечных макрофагов, бактериальную транслокацию и колитогенные ответы Th27 у мышей. J. Clin. Инвестировать. 121 , 4787–4795 (2011).
CAS PubMed PubMed Central Google ученый
Kim, K. W. et al. Анализ структуры / функции и экспрессии фракталкина хемокина CX3C in vivo. Кровь 118 , e156–167 (2011).
CAS PubMed PubMed Central Google ученый
Rescigno, M.и другие. Дендритные клетки экспрессируют белки с плотными контактами и проникают в монослои эпителия кишечника, чтобы взять образцы бактерий. Nat. Иммунол. 2 , 361–367 (2001).
CAS PubMed Google ученый
Arques, J. L. et al. Salmonella индуцирует зависимую от флагеллина и MyD88 миграцию дендритных клеток, улавливающих бактерии, в просвет кишечника. Гастроэнтерология 137 , 579–587 (2009).
PubMed Google ученый
Man, A. L. et al. CX3CR1 + клеточно-опосредованное исключение Salmonella защищает слизистую оболочку кишечника на начальной стадии инфекции. J. Immunol. 198 , 335–343 (2017).
CAS PubMed Google ученый
Leonardi, I. et al. Мононуклеарные фагоциты CX3CR1 + контролируют иммунитет к кишечным грибам. Наука 359 , 232–236 (2018).
CAS PubMed PubMed Central Google ученый
Чанг, П. В., Хао, Л., Офферманнс, С. и Меджитов, Р. Микробный метаболит бутират регулирует функцию кишечных макрофагов посредством ингибирования гистондеацетилазы. Proc. Natl Acad. Sci. США 111 , 2247–2252 (2014).
CAS PubMed Google ученый
Scott, N.A. et al. Антибиотики вызывают устойчивую дисрегуляцию кишечного Т-клеточного иммунитета, нарушая гомеостаз макрофагов. Sci. Transl Med. 10 , eaao4755 (2018).
PubMed PubMed Central Google ученый
Chng, S.H. et al. Удаление арилуглеводородного рецептора (AhR) в клетках CD11c + нарушает развитие кишечного эпителия и кишечного иммунитета. Sci. Отчет 6 , 23820 (2016).
CAS PubMed PubMed Central Google ученый
Ishikawa, H. et al. Влияние кишечной микробиоты на индукцию регуляторных CD25 + CD4 + Т-клеток. Clin. Exp. Иммунол. 153 , 127–135 (2008).
CAS PubMed PubMed Central Google ученый
Atarashi, K. et al. Индукция регуляторных Т-клеток толстой кишки аборигенными видами Clostridium . Наука 331 , 337–341 (2011).
CAS PubMed Google ученый
Singh, R. et al. Повышение целостности кишечного барьера за счет микробного метаболита через путь Nrf2. Nat. Commun. 10 , 89 (2019).
PubMed PubMed Central Google ученый
Kim, M. et al. Критическая роль микробиоты в регуляции CX3CR1 + кишечных мононуклеарных фагоцитов ответов кишечных Т-клеток. Иммунитет 49 , 151–163 (2018).
CAS PubMed PubMed Central Google ученый
Anitha, M., Vijay-Kumar, M., Sitaraman, S. V., Gewirtz, A. T. & Srinivasan, S. Микробные продукты кишечника регулируют перистальтику желудочно-кишечного тракта мышей посредством передачи сигналов Toll-подобного рецептора 4. Гастроэнтерология 143 , 1006–1016 (2012).
CAS PubMed PubMed Central Google ученый
Густафссон Б. Э., Мидтведт Т. и Страндберг К. Влияние микробного загрязнения на увеличение слепой кишки у стерильных крыс. Сканд. J. Gastroenterol. 5 , 309–314 (1970).
CAS PubMed Google ученый
Аветисян М. и др. Развитие макрофагов Muscularis при отсутствии кишечной нервной системы. Proc. Natl Acad. Sci. США 115 , 4696–4701 (2018).
CAS PubMed Google ученый
Ортега-Гомес, А., Перретти, М. и Соенлейн, О. Разрешение воспаления: комплексный взгляд. EMBO Mol. Med. 5 , 661–674 (2013).
CAS PubMed PubMed Central Google ученый
Фуллертон, Дж. Н. и Гилрой, Д. В. Разрешение воспаления: новый терапевтический рубеж. Nat. Rev. Drug Discov. 15 , 551–567 (2016).
CAS PubMed Google ученый
Мантовани, А., Бонекки, Р. и Локати, М. Настройка воспаления и иммунитета с помощью секвестрации хемокинов: приманки и многое другое. Nat. Rev. Immunol. 6 , 907–918 (2006).
CAS PubMed Google ученый
Фокс, С., Leitch, A.E., Duffin, R., Haslett, C. & Rossi, A.G. Апоптоз нейтрофилов: значение для врожденного иммунного ответа и воспалительного заболевания. J. Врожденный иммунитет. 2 , 216–227 (2010).
CAS PubMed PubMed Central Google ученый
Lauber, K. et al. Апоптотические клетки индуцируют миграцию фагоцитов через опосредованное каспазой-3 высвобождение сигнала липидного притяжения. Cell 113 , 717–730 (2003).
CAS PubMed Google ученый
Gude, D. R. et al. Апоптоз индуцирует экспрессию сфингозинкиназы 1 для высвобождения сфингозин-1-фосфата в качестве сигнала «приди и возьми меня». FASEB J. 22 , 2629–2638 (2008).
CAS PubMed PubMed Central Google ученый
Truman, L.A. et al. CX3CL1 / фракталкин высвобождается из апоптотических лимфоцитов для стимуляции хемотаксиса макрофагов. Кровь 112 , 5026–5036 (2008).
CAS PubMed Google ученый
Elliott, M. R. et al. Нуклеотиды, высвобождаемые апоптотическими клетками, действуют как сигнал «найди меня», способствуя очищению от фагоцитов. Nature 461 , 282–286 (2009).
CAS PubMed PubMed Central Google ученый
Gordon, S. & Pluddemann, A.Клиренс макрофагов апоптотических клеток: критическая оценка. Фронт. Иммунол. 9 , 127 (2018).
PubMed PubMed Central Google ученый
A-Gonzalez, N. et al. Фагоцитоз указывает на неоднородность тканевых макрофагов. J. Exp. Med. 214 , 1281–1296 (2017).
CAS PubMed PubMed Central Google ученый
Casanova-Acebes, M. et al. Нейтрофилы определяют гомеостатические и патологические состояния в наивных тканях. J. Exp. Med. 215 , 2778–2795 (2018).
CAS PubMed PubMed Central Google ученый
Каммингс, Р. Дж. И др. Различные тканевые фагоциты отбирают апоптотические клетки для управления различными программами гомеостаза. Nature 539 , 565–569 (2016).
CAS PubMed PubMed Central Google ученый
Maddox, J. F. et al. Стабильные аналоги липоксина A4 являются мощными миметиками, которые стимулируют человеческие моноциты и клетки THP-1 через рецептор липоксина A4, связанный с G-белком. J. Biol. Chem. 272 , 6972–6978 (1997).
CAS PubMed Google ученый
Chiang, N. et al. Рецептор липоксина ALX: сильное лиганд-специфическое и стереоселективное действие in vivo. Pharmacol. Ред. 58 , 463–487 (2006).
CAS PubMed Google ученый
Godson, C. et al. Передний край: липоксины быстро стимулируют нефлогический фагоцитоз апоптотических нейтрофилов макрофагами, происходящими из моноцитов. J. Immunol. 164 , 1663–1667 (2000).
CAS PubMed Google ученый
Fiorucci, S. et al. Устойчивый к бета-окислению аналог липоксина A4 лечит гаптен-индуцированный колит, ослабляя воспаление и иммунную дисфункцию. Proc. Natl Acad. Sci. США 101 , 15736–15741 (2004).
CAS PubMed Google ученый
Gewirtz, A. T. et al. Аналоги липоксина а4 снижают индукцию экспрессии провоспалительных генов кишечного эпителия и снижают тяжесть колита, вызванного декстрансульфатом натрия. J. Immunol. 168 , 5260–5267 (2002).
CAS PubMed Google ученый
Мангино, М. Дж., Броунц, Л., Хармс, Б. и Хейз, С. Биосинтез липоксина при воспалительном заболевании кишечника. Простагландины Other Lipid Mediat. 79 , 84–92 (2006).
CAS PubMed Google ученый
Сугимото, М. А., Соуза, Л. П., Пинхо, В., Перретти, М. и Тейшейра, М. М. Разрешение воспаления: что контролирует его начало? Фронт. Иммунол. 7 , 160 (2016).
PubMed PubMed Central Google ученый
Серхан, К. Н., Чанг, Н. и Далли, Дж. Код разрешения острого воспаления: новые способствующие разрешению липидные медиаторы в разрешении. Семин. Иммунол. 27 , 200–215 (2015).
CAS PubMed PubMed Central Google ученый
Neurath, M. F. Новые мишени для заживления слизистых оболочек и терапии воспалительных заболеваний кишечника. Mucosal Immunol. 7 , 6–19 (2014).
CAS PubMed Google ученый
Леви, Б. Д., Клиш, К. Б., Шмидт, Б., Гронерт, К. и Серхан, С. Н. Переключение классов липидных медиаторов во время острого воспаления: сигналы в разрешении. Nat. Иммунол. 2 , 612–619 (2001).
CAS PubMed Google ученый
Vong, L., Ferraz, J. G., Panaccione, R., Beck, P. L. & Wallace, J. L. Медиатор, способствующий разрешению, простагландин D 2 , специфически активируется у людей в долгосрочной ремиссии язвенного колита. Proc. Natl Acad. Sci. США 107 , 12023–12027 (2010).
CAS PubMed Google ученый
Li, J. et al. Ниацин облегчает язвенный колит за счет активации простагландинового D2-опосредованного рецептора 1 простаноида D. EMBO Mol. Med. 9 , 571–588 (2017).
CAS PubMed PubMed Central Google ученый
Kong, D. et al. Регуляторная субъединица IIalpha PKA важна для PGD2-опосредованного разрешения воспаления. J. Exp. Med. 213 , 2209–2226 (2016).
CAS PubMed PubMed Central Google ученый
Bystrom, J. et al. Макрофаги в фазе разрешения обладают уникальным воспалительным фенотипом, который контролируется цАМФ. Кровь 112 , 4117–4127 (2008).
CAS PubMed PubMed Central Google ученый
Shiraishi, H. et al. Простагландин E2 является основным растворимым фактором, продуцируемым стромальными клетками, для предотвращения выработки воспалительных цитокинов дендритными клетками. Внутр. Иммунол. 20 , 1219–1229 (2008).
CAS PubMed Google ученый
Koga, K. et al. Циклический аденозинмонофосфат подавляет транскрипцию провоспалительных цитокинов через фосфорилированный белок c-Fos. Иммунитет 30 , 372–383 (2009).
CAS PubMed Google ученый
Brown, S. L. et al. Myd88-зависимое расположение Ptgs2-экспрессирующих стромальных клеток поддерживает пролиферацию эпителия толстой кишки во время повреждения. J. Clin. Инвестировать. 117 , 258–269 (2007).
CAS PubMed PubMed Central Google ученый
Tessner, T. G., Muhale, F., Riehl, T. E., Anant, S. & Stenson, W. F. Простагландин E2 снижает радиационно-индуцированный эпителиальный апоптоз посредством механизма, включающего активацию AKT и транслокацию bax. J. Clin. Инвестировать. 114 , 1676–1685 (2004).
CAS PubMed PubMed Central Google ученый
Castellone, M. D., Teramoto, H., Williams, B.O., Druey, K. M. & Gutkind, J. S. Простагландин E2 способствует росту раковых клеток толстой кишки посредством оси передачи сигналов Gs-аксин-бета-катенин. Наука 310 , 1504–1510 (2005).
CAS PubMed Google ученый
Chinen, T. et al. Простагландин E2 и SOCS1 играют роль в иммунной толерантности кишечника. Nat. Commun. 2 , 190 (2011).
PubMed PubMed Central Google ученый
Баума, Г. и Стробер, У. Иммунологические и генетические основы воспалительного заболевания кишечника. Nat. Rev. Immunol. 3 , 521–533 (2003).
CAS PubMed Google ученый
Libioulle, C. et al. Новый локус болезни Крона, идентифицированный с помощью полногеномной ассоциации, картирует генную пустыню на 5p13.1 и модулирует экспрессию PTGER4. PLOS Genet. 3 , e58 (2007).
PubMed PubMed Central Google ученый
Далли, Дж. И Серхан, С. Н. Про-разрешающие медиаторы в регуляции и обеспечении функции макрофагов. Фронт. Иммунол. 8 , 1400 (2017).
PubMed PubMed Central Google ученый
Бакли, К. Д., Гилрой, Д. В. и Серхан, С. Н. Прохождение липидных медиаторов и механизмы разрешения острого воспаления. Иммунитет 40 , 315–327 (2014).
CAS PubMed PubMed Central Google ученый
Gobbetti, T. et al. Protectin D1n-3 DPA и резольвин D5n-3 DPA являются эффекторами защиты кишечника. Proc. Natl Acad. Sci. США 114 , 3963–3968 (2017).
CAS PubMed Google ученый
Bento, AF, Claudino, RF, Dutra, RC, Marcon, R. & Calixto, JB Медиаторы, производные омега-3 жирных кислот, 17 (R) -гидроксидокозагексаеновая кислота, резольвин D1, вызываемый аспирином, и резолвин D2 предотвращает экспериментальный колит у мышей. J. Immunol. 187 , 1957–1969 (2011).
CAS PubMed Google ученый
Marcon, R. et al. Марезин 1, прорезиненный липидный медиатор, полученный из полиненасыщенных жирных кислот омега-3, оказывает защитное действие на мышиных моделях колита. J. Immunol. 191 , 4288–4298 (2013).
CAS PubMed Google ученый
Belluzzi, A. et al. Влияние препарата рыбьего жира с энтеросолюбильным покрытием на рецидивы болезни Крона. N. Engl. J. Med. 334 , 1557–1560 (1996).
CAS PubMed Google ученый
Barbosa, D. S. et al. Снижение окислительного стресса у пациентов с язвенным колитом с добавлением жирных кислот омега-3 рыбьего жира. Nutrition 19 , 837–842 (2003).
CAS PubMed Google ученый
Romano, C., Cucchiara, S., Barabino, A., Annese, V. & Sferlazzas, C.Полезность добавок омега-3 жирных кислот в дополнение к месалазину для поддержания ремиссии при болезни Крона у детей: двойное слепое рандомизированное плацебо-контролируемое исследование. World J. Gastroenterol. 11 , 7118–7121 (2005).
CAS PubMed PubMed Central Google ученый
Pull, S. L., Doherty, J. M., Mills, J. C., Gordon, J. I. & Stappenbeck, T. S. Активированные макрофаги являются адаптивным элементом ниши предшественников эпителия толстой кишки, необходимым для регенеративных реакций на повреждение. Proc. Natl Acad. Sci. США 102 , 99–104 (2005).
CAS PubMed Google ученый
Seno, H. et al. Для эффективного заживления ран слизистой оболочки толстой кишки требуется передача сигналов Trem2. Proc. Natl Acad. Sci. США 106 , 256–261 (2009).
CAS PubMed Google ученый
Leoni, G. et al. Аннексин A1, рецептор формилпептида и NOX1 управляют восстановлением эпителия. J. Clin. Инвестировать. 123 , 443–454 (2013).
CAS PubMed Google ученый
Quiros, M. et al. IL-10, происходящий из макрофагов, опосредует восстановление слизистых оболочек посредством эпителиальной передачи сигналов WISP-1. J. Clin. Инвестировать. 127 , 3510–3520 (2017).
PubMed PubMed Central Google ученый
Saha, S. et al. Полученные из макрофагов внеклеточные везикулы WNT спасают кишечные стволовые клетки и повышают выживаемость после лучевого поражения. Nat. Commun. 7 , 13096 (2016).
CAS PubMed PubMed Central Google ученый
Baillie, J. K. et al. Анализ транскриптома макрофагов, происходящих из моноцитов человека, и ответа на липополисахарид позволяет по-новому взглянуть на генетическую этиологию воспалительного заболевания кишечника. PLOS Genet. 13 , e1006641 (2017).
PubMed PubMed Central Google ученый
Jostins, L. et al. Взаимодействие микробов и хозяев сформировало генетическую архитектуру воспалительного заболевания кишечника. Nature 491 , 119–124 (2012).
CAS PubMed PubMed Central Google ученый
Schwerd, T. et al. Нарушение антибактериальной аутофагии связывает гранулематозное воспаление кишечника при болезни Ниманна-Пика типа C1 и дефицит XIAP с вариантами NOD2 при болезни Крона. Кишечник 66 , 1060–1073 (2017).
CAS PubMed Google ученый
Smith, A. M. et al. Нарушение секреции цитокинов макрофагами лежит в основе нарушения острого воспаления и бактериального клиренса при болезни Крона. J. Exp. Med. 206 , 1883–1897 (2009).
CAS PubMed PubMed Central Google ученый
Kamada, N. et al. Уникальные кишечные макрофаги CD14 вносят вклад в патогенез болезни Крона через ось IL-23 / IFN-гамма. J. Clin. Инвестировать. 118 , 2269–2280 (2008).
CAS PubMed PubMed Central Google ученый
Bernardo, D. et al. Провоспалительный CD11c кишечника человека высокий CCR2 + CX3CR1 + макрофаги, но не их толерогенные CD11c — CCR2 — аналоги CX3CR1 — , расширяются при воспалительном заболевании кишечника. Mucosal Immunol. 11 , 1114–1126 (2018).
CAS PubMed Google ученый
Огино Т. и др. Повышенная Th27-индуцирующая активность CD14 + CD163 низкомиелоидных клеток в собственной пластинке кишечника пациентов с болезнью Крона. Гастроэнтерология 145 , 1380–1391 (2013).
CAS PubMed Google ученый
Мазлам, М. З. и Ходжсон, Х. Дж. Производство цитокинов моноцитами периферической крови и острофазовый ответ при воспалительном заболевании кишечника. Кишечник 33 , 773–778 (1992).
CAS PubMed PubMed Central Google ученый
Schwarzmaier, D., Foell, D., Weinhage, T., Varga, G. & Dabritz, J. Функции периферических моноцитов и активация у пациентов с болезнью Крона в состоянии покоя. PLOS ONE 8 , e62761 (2013).
CAS PubMed PubMed Central Google ученый
Radwan, P., Radwan-Kwiatek, K., Tabarkiewicz, J., Radej, S. & Rolinski, J. Повышенное фенотипическое и функциональное созревание дендритных клеток, полученных из моноцитов, у пациентов с активной болезнью Крона и язвенный колит. J. Physiol. Pharmacol. 61 , 695–703 (2010).
CAS PubMed Google ученый
Глассер А. Л. и Дарфей-Мишо А. Нарушения обращения с внутриклеточными бактериями при болезни Крона: связь между инфекционной этиологией и генетической предрасположенностью хозяина. Arch. Иммунол. Ther. Exp. (Warsz.) 56 , 237–244 (2008).
CAS Google ученый
Dige, A. et al. Уменьшение количества макрофагов DR на слизистой оболочки и увеличение количества дендритных клеток CD103 + во время лечения анти-TNF-α у пациентов с болезнью Крона. Сканд. J. Gastroenterol. 51 , 692–699 (2016).
CAS PubMed Google ученый
Neurath, M. F. IL-23: главный регулятор при болезни Крона. Nat. Med. 13 , 26–28 (2007).
CAS PubMed Google ученый
Yen, D. et al. IL-23 необходим при Т-клеточном колите и способствует воспалению через IL-17 и IL-6. J. Clin. Инвестировать. 116 , 1310–1316 (2006).
CAS PubMed PubMed Central Google ученый
Duerr, R.H. et al. Полногеномное ассоциативное исследование идентифицирует IL23R как ген воспалительного заболевания кишечника. Science 314 , 1461–1463 (2006).
CAS PubMed PubMed Central Google ученый
Vos, A.C. et al. Антитела против фактора некроза опухоли альфа индуцируют регуляторные макрофаги зависимым от области Fc образом. Гастроэнтерология 140 , 221–230 (2011).
CAS PubMed Google ученый
Vos, A.C. et al. Регулирующие макрофаги, индуцируемые инфликсимабом, участвуют в заживлении in vivo и in vitro. Inflamm. Кишечник. 18 , 401–408 (2012).
PubMed Google ученый
Papamichael, K. et al. Роль терапевтического лекарственного мониторинга во время индукционной терапии антагонистами TNF при ВЗК: эволюция в определении и лечении первичного отсутствия ответа. Inflamm. Кишечник. 21 , 182–197 (2015).
PubMed Google ученый
Bantel, H. et al. Месалазин подавляет активацию фактора транскрипции NF-κB в воспаленной слизистой оболочке пациентов с язвенным колитом. Am.J. Gastroenterol. 95 , 3452–3457 (2000).
CAS PubMed Google ученый
Mowat, C. et al. Рекомендации по лечению воспалительных заболеваний кишечника у взрослых. Кишечник 60 , 571–607 (2011).
PubMed Google ученый
Окли Р. Х. и Сидловски Дж. А. Биология глюкокортикоидного рецептора: новые сигнальные механизмы в здоровье и болезни. J. Allergy Clin. Иммунол. 132 , 1033–1044 (2013).
CAS PubMed PubMed Central Google ученый
Ehrchen, J. et al. Глюкокортикоиды вызывают дифференцировку специфически активированного противовоспалительного подтипа человеческих моноцитов. Кровь 109 , 1265–1274 (2007).
CAS Google ученый
Giles, K. M. et al. Увеличение глюкокортикоидами способности макрофагов к фагоцитозу апоптотических клеток связано со снижением экспрессии p130Cas, потерей фосфорилирования паксиллина / pyk2 и высокими уровнями активного Rac. J. Immunol. 167 , 976–986 (2001).
CAS PubMed Google ученый
Allgayer, H. Обзорная статья: механизмы действия месалазина в предотвращении колоректальной карциномы при воспалительном заболевании кишечника.Алимент. Pharmacol. Ther. 18 (Приложение 2), 10–14 (2003).
CAS Google ученый
Atreya, I. et al. Дизайнерские аналоги тиопурина для оптимального подавления иммунитета при воспалительных заболеваниях кишечника. J. Crohns Colitis 10 , 1132–1143 (2016).
PubMed Google ученый
Feagan, B.G. et al.Сравнение метотрексата с плацебо для поддержания ремиссии при болезни Крона. Исследователи Североамериканской исследовательской группы Крона. N. Engl. J. Med. 342 , 1627–1632 (2000).
CAS PubMed Google ученый
Элион Г. Б. Пуриновый путь к химиотерапии. Science 244 , 41–47 (1989).
CAS PubMed Google ученый
Marinkovic, G., Hamers, A.A., de Vries, C.J. и de Waard, V. 6-Меркаптопурин снижает активацию макрофагов и пролиферацию кишечного эпителия за счет ингибирования GTPase Rac1. Inflamm. Кишечник. 20 , 1487–1495 (2014).
PubMed Google ученый
Municio, C. et al. Метотрексат избирательно воздействует на провоспалительные макрофаги человека через ось тимидилатсинтаза / р53. Ann.Реум. Дис. 75 , 2157–2165 (2016).
CAS PubMed Google ученый
Lucas, M., Zhang, X., Prasanna, V. & Mosser, D. M. Активация ERK после лигирования макрофага FcγR приводит к модификациям хроматина в локусе IL-10. J. Immunol. 175 , 469–477 (2005).
CAS PubMed Google ученый
Pander, J. et al. Активация опухолевых макрофагов 2 типа цетуксимабом антителом, нацеленным на EGFR. Clin. Cancer Res. 17 , 5668–5673 (2011).
CAS PubMed Google ученый
Boyer, J. F. et al. Цертолизумаб пегол против TNF индуцирует антиоксидантный ответ в моноцитах человека посредством обратной передачи сигналов. Arthritis Res. Ther. 18 , 56 (2016).
PubMed PubMed Central Google ученый
Парамзоти, С., Розенштейн, А. К., Механдру, С. и Коломбель, Дж. Ф. Текущее состояние дел в области биологической терапии и новых малых молекул при воспалительных заболеваниях кишечника. Mucosal Immunol. 11 , 1558–1570 (2018).
CAS PubMed PubMed Central Google ученый
Де Врис, Л. С., Вильденберг, М. Е., Де Йонге, В. Дж. И Д’Хэнс, Г. Р. Будущее ингибиторов янус-киназы при воспалительном заболевании кишечника. J. Crohns Colitis 11 , 885–893 (2017).
PubMed PubMed Central Google ученый
Machado, M. A. A. et al. Эффективность и безопасность тофацитиниба при ревматоидном артрите: когортное исследование. Arthritis Res. Ther. 20 , 60 (2018).
PubMed PubMed Central Google ученый
Сандборн, W.J. et al. Тофацитиниб в качестве индукционной и поддерживающей терапии язвенного колита. N. Engl. J. Med. 376 , 1723–1736 (2017).
CAS PubMed Google ученый
Panes, J. et al. Тофацитиниб для индукции и поддерживающей терапии болезни Крона: результаты двух рандомизированных плацебо-контролируемых исследований фазы IIb. Кишечник 66 , 1049–1059 (2017).
CAS PubMed PubMed Central Google ученый
Vermeire, S. et al. Клиническая ремиссия у пациентов с болезнью Крона от средней до тяжелой, получавших филготиниб (исследование FITZROY): результаты второго слепого рандомизированного плацебо-контролируемого исследования фазы 2. Ланцет 389 , 266–275 (2017).
CAS PubMed Google ученый
Паттисон, М. Дж., Маккензи, К. Ф. и Артур, Дж. С. Ингибирование JAK в макрофагах увеличивает индуцированную липополисахаридом продукцию цитокинов путем блокирования опосредованной ИЛ-10 обратной связи. J. Immunol. 189 , 2784–2792 (2012).
CAS PubMed PubMed Central Google ученый
Спадаччини, М., Д’Алессио, С., Пейрин-Бируле, Л. и Данезе, С. Ингибирование PDE4 и воспалительное заболевание кишечника: новый терапевтический путь. Внутр. J. Mol. Sci. 18 , E1276 (2017).
PubMed Google ученый
Мазур М., Карчевски Дж., Лодыга М., Заба Р. и Адамски З. Ингибиторы фосфодиэстеразы 4 (ФДЭ 4): новый терапевтический вариант в лечении вульгарного псориаза и псориатического артрита. J. Dermatolog. Относиться. 26 , 326–328 (2015).
PubMed Google ученый
Национальная медицинская библиотека США. ClinicalTrials.gov https://www.clinicaltrials.gov/ct2/show/NCT02289417 (2019).
Danese, S. et al. Апремиласт при активном язвенном колите: рандомизированное двойное слепое плацебо-контролируемое индукционное исследование фазы 2 [аннотация OP006]. Колит Дж. Крона 12 , S004 – S005 (2018).
Google ученый
Barrera, P. et al. Истощение синовиальных макрофагов липосомами, содержащими клодронат, при ревматоидном артрите. Arthritis Rheum. 43 , 1951–1959 (2000).
CAS PubMed PubMed Central Google ученый
Bu, L., Gao, M., Qu, S. & Liu, D. Внутрибрюшинное введение липосом клодроната устраняет макрофаги висцерального жира и блокирует увеличение веса, вызванное диетой с высоким содержанием жиров, и развитие инсулинорезистентности. AAPS J. 15 , 1001–1011 (2013).
CAS PubMed PubMed Central Google ученый
Piaggio, F. et al. Новый липосомальный клодронат истощает связанные с опухолью макрофаги при первичной и метастатической меланоме: антиангиогенный и противоопухолевый эффекты. J. Control. Выпуск 223 , 165–177 (2016).
CAS PubMed Google ученый
По, А. Р. и Эрнст, М. Нацеливание на макрофаги при раке: от скамьи до постели. Фронт. Онкол. 8 , 49 (2018).
PubMed PubMed Central Google ученый
Marra, M. et al. Новые самосборные наночастицы и скрытые липосомы для доставки золедроновой кислоты: сравнительное исследование. Biotechnol. Adv. 30 , 302–309 (2012).
CAS PubMed Google ученый
Mantovani, A., Marchesi, F., Malesci, A., Laghi, L. & Allavena, P. Макрофаги, связанные с опухолями, как мишени для лечения в онкологии. Nat. Преподобный Clin. Онкол. 14 , 399–416 (2017).
CAS PubMed PubMed Central Google ученый
Биннемарс-Постма, К., Сторм, Г. и Пракаш, Дж. Стратегии наномедицины, направленные на нацеливание на ассоциированные с опухолью макрофаги. Внутр. J. Mol. Sci. 18 , E979 (2017).
PubMed Google ученый
Singh, Y. et al. Нацеливание на ассоциированные с опухолью макрофаги (ТАМ) через наноносители. J. Control. Выпуск 254 , 92–106 (2017).
CAS PubMed Google ученый
Murray, P.J. et al. Активация и поляризация макрофагов: номенклатура и экспериментальные рекомендации. Иммунитет 41 , 14–20 (2014).
CAS PubMed PubMed Central Google ученый
Моссер, Д. М. и Эдвардс, Дж.П. Изучение полного спектра активации макрофагов. Nat. Rev. Immunol. 8 , 958–969 (2008).
CAS PubMed PubMed Central Google ученый
Shapouri-Moghaddam, A. et al. Пластичность, поляризация и функция макрофагов при здоровье и болезнях. J. Cell. Physiol. 233 , 6425–6440 (2018).
CAS PubMed Google ученый
Mantovani, A. et al. Система хемокинов в различных формах активации и поляризации макрофагов. Trends Immunol. 25 , 677–686 (2004).
CAS PubMed Google ученый
Мартинес, Ф. О., Сика, А., Мантовани, А. и Локати, М. Активация и поляризация макрофагов. Фронт. Biosci. 13 , 453–461 (2008).
CAS PubMed Google ученый
Арора, С., Дев, К., Агарвал, Б., Дас, П. и Сайед, М. А. Макрофаги: их роль, активация и поляризация при легочных заболеваниях. Иммунобиология 223 , 383–396 (2018).
CAS PubMed Google ученый
Бисвас, С. К. и Мантовани, А. Пластичность макрофагов и взаимодействие с субпопуляциями лимфоцитов: рак как парадигма. Nat. Иммунол. 11 , 889–896 (2010).
CAS PubMed PubMed Central Google ученый
Винн Т. и Ваннелла К. Макрофаги в восстановлении, регенерации и фиброзе тканей. Иммунитет 44 , 450–462 (2016).
CAS PubMed PubMed Central Google ученый
Колин С., Чинетти-Гбагиди Г. и Стейлс Б. Фенотипы макрофагов при атеросклерозе. Immunol. Ред. 262 , 153–166 (2014).
CAS PubMed Google ученый
Ambarus, C.A. et al. Растворимые иммунные комплексы сдвигают индуцированную TLR продукцию цитокинов отдельных поляризованных субпопуляций макрофагов человека в сторону IL-10. PLOS ONE 7 , e35994 (2012).
CAS PubMed PubMed Central Google ученый
Yue, Y. et al. Макрофаги M2b уменьшают раннее реперфузионное повреждение после ишемии миокарда у мышей: преобладающая роль в ингибировании апоптоза через A20. Внутр. J. Cardiol. 245 , 228–235 (2017).
PubMed Google ученый
Roszer, T. Понимание загадочного макрофага M2 с помощью маркеров активации и эффекторных механизмов. Медиаторы воспаления. 2015 , 816460 (2015).
PubMed PubMed Central Google ученый
Zizzo, G., Hilliard, B.A., Monestier, M. & Cohen, P.L. Эффективный клиренс ранних апоптотических клеток макрофагами человека требует поляризации M2c и индукции MerTK. J. Immunol. 189 , 3508–3520 (2012).
CAS PubMed PubMed Central Google ученый
Wang, Q.и другие. Протоонкоген Fra-1 регулирует экспрессию IL-6 в макрофагах и способствует образованию макрофагов M2d. Cell Res. 20 , 701–712 (2010).
CAS PubMed Google ученый
Wu, H. et al. Макрофаги, ассоциированные с опухолью, способствуют ангиогенезу и лимфангиогенезу рака желудка. J. Surg. Онкол. 106 , 462–468 (2012).
CAS PubMed Google ученый
Риволье, А., Хе, Дж., Коле, А., Валатас, В. и Келсалл, Б. Л. Воспаление переключает программу дифференцировки моноцитов Ly6Chi с противовоспалительных макрофагов на воспалительные дендритные клетки толстой кишки. J. Exp. Med. 209 , 139–155 (2012).
CAS PubMed PubMed Central Google ученый
Биомаркеры воспаления при воспалительном заболевании кишечника: сколько времени осталось до отказа от одномаркерных подходов? — FullText — Болезни пищеварения 2021, Vol.39, № 3
Аннотация
Справочная информация: Воспалительное заболевание кишечника (ВЗК) — хронически рецидивирующее заболевание, требующее постоянного упреждающего мониторинга для выбора подходящего лечения и стратегии последующего наблюдения. На сегодняшний день эндоскопия желудочно-кишечного тракта с гистологическим исследованием биопсий и визуализацией с контрастированием являются обязательными методами диагностики и оценки активности ВЗК. Резюме: В последние десятилетия многие исследования в области ВЗК были направлены на поиск неинвазивных и надежных биомаркеров бремени болезни, которые можно легко проверить в жидкостях организма, не влияя на качество жизни пациентов.К сожалению, идеальный биомаркер еще предстоит открыть, и недавние исследования изучали возможность повышения точности таких измерений путем комбинирования различных маркеров. В этом обзоре мы предоставляем обновленную информацию о биомаркерах кишечного воспаления при ВЗК, уделяя особое внимание диагностике заболевания, корреляции с результатами эндоскопии и прогнозированию рецидива. Мы также суммируем совокупные баллы клинических и лабораторных маркеров, которые были недавно предложены для различных сценариев активности заболевания. Ключевые сообщения: На сегодняшний день только С-реактивный белок и фекальный кальпротектин могут считаться надежными маркерами активности заболевания с продемонстрированной полезностью при ведении ВЗК. Комбинация различных параметров недавно показала более высокую точность и может заменить подходы с одним маркером в будущих исследованиях и клинической практике.
© 2020 S. Karger AG, Базель
Введение
Воспалительное заболевание кишечника (ВЗК) относится к 2 хроническим состояниям пищеварительного тракта, оказывающим сильное влияние на качество жизни пострадавших, а именно к язвенному колиту (ЯК) и болезни Крона (БК).Этиология и патогенез ВЗК до сих пор неясны, наиболее вероятным триггером является нарушение регуляции иммунного ответа на комменсальную кишечную флору и внешние инсульты у генетически предрасположенного человека [1-3].
Эндоскопия желудочно-кишечного тракта с последующей гистологической оценкой биопсии необходима для диагностики и оценки воспаления слизистой оболочки, а визуализация поперечного сечения дает дополнительную информацию о степени CD в тонкой кишке, которая технически недоступна для эндоскопа [4].Тем не менее, пациенты не хотят проходить инвазивное эндоскопическое наблюдение, и оба эти метода сильно влияют на финансы здравоохранения, если учесть необходимость регулярной повторной оценки заболевания с хроническим прерывистым поведением. Следовательно, актуальной темой исследования в последние десятилетия было изучение точных биомаркеров активности заболевания для снижения затрат и повышения приверженности пациентов.
Идеальный биомаркер
Возможность различать активное и неактивное заболевание с помощью неинвазивных инструментов является диагностической целью во многих областях медицины.При ВЗК исследования в основном были сосредоточены на выявлении надежных биомаркеров воспаления кишечника, которые помогают управлять лечением и прогнозировать течение заболевания.
Примерно 20 лет назад Национальный институт здравоохранения США определил биомаркер как «характеристику, которая объективно измеряется и оценивается как показатель нормальных биологических процессов, патогенных процессов или фармакологических реакций на терапевтическое вмешательство» [5]. Идеальный биомаркер должен удовлетворять трем различным областям: комплаентность пациента, надежность в отношении заболевания и кинетическая стабильность (рис.1). Исходя из этих предпосылок, в области исследования ВЗК было поднято несколько вопросов. Во-первых, ВЗК — это спектр двух различных состояний (ЯК и БК) с нечеткой «серой зоной» неклассифицированных пациентов и модификацией диагноза в 5–10% случаев [6, 7]. Во-вторых, совпадение воспаления и фиброза с различными возможными характеристиками заболевания (степень, активность, фенотип и связанные с ним осложнения) еще больше усложняет сценарий. Поэтому, хотя некоторые маркеры воспаления в настоящее время используются в клинической практике, открытие идеального биомаркера кажется недостижимым, и сочетание различных тестов становится все более чем альтернативой классическим маркерам воспаления.
Рис. 1.
Характеристики идеального биомаркера (адаптировано из работы Sands [11]). ВЗК, воспалительное заболевание кишечника.
Биомаркеры воспаления кишечника
Естественная история ВЗК включает вспышки острого воспаления и периоды покоя, связанные с заживлением слизистой оболочки, что в настоящее время является основной терапевтической целью [8]. К сожалению, эндоскопия желудочно-кишечного тракта с биопсией — единственный золотой стандарт для оценки глубокой гистологической ремиссии, но это инвазивный и дорогостоящий метод.Недавнее предложение ввести трансмуральное заживление БК в качестве дополнительной терапевтической конечной точки еще больше усложняет оценку ВЗК [9]. Как следствие, крайне важно найти суррогатные биомаркеры клинической, эндоскопической, гистологической и трансмуральной активности для повышения комплаентности пациента и экономической эффективности лечения ВЗК.
Клинические условия, в которых могут быть использованы биомаркеры воспаления, различны. В диагностической области маркер бремени воспаления должен уметь отличать ВЗК от функциональных нарушений, таких как синдром раздраженного кишечника (СРК), которые во многих случаях клинически неотличимы [10], и оценивать активность заболевания.Более того, способность контролировать эффективность медикаментозного лечения и прогнозировать результаты хирургического вмешательства (риск колэктомии при ЯК и послеоперационном рецидиве при БК) является дополнительными неудовлетворенными потребностями [11].
В целом маркеры стула с большей вероятностью, чем маркеры крови, отражают степень воспаления кишечника из-за прямого контакта со средой слизистой оболочки, тогда как маркеры крови часто увеличиваются по разным причинам, а местное воспаление не всегда соответствует обнаруживаемым системным воспалительным процессам. отклик.За последние годы накопилось много данных о потенциальных биомаркерах воспаления кишечника (таблица 1). Тем не менее, сывороточный С-реактивный белок (CRP) и калпротектин (FC) по-прежнему являются наиболее надежными и обычно используемыми маркерами активности заболевания.
Таблица 1.
Биомаркеры, коррелирующие с воспалением кишечника [79, 94, 120-148]
C-реактивный белок
СРБ в сыворотке — это острофазовый реагент, который широко используется в качестве общего воспалительного маркера в области ВЗК. .Поскольку это неспецифический биомаркер, СРБ может увеличиваться при нескольких медицинских состояниях, отличных от ВЗК, например, системных инфекциях и внекишечном воспалении [12]. С другой стороны, примерно 15% здорового населения [13, 14] и до 20-25% пациентов с БК [12] не имеют ответа на СРБ, что является причиной ложноотрицательных результатов.
CRP имеет высокую чувствительность для различения IBD и IBS, как сообщается в метаанализе 12 проспективных диагностических когортных исследований, где уровни CRP в диапазоне нормальных значений привели к ≤1% вероятности наличия IBD [15].Его уровни часто связаны с воспалительным бременем ЯК и БК [12, 16], хотя иногда сообщается о плохой корреляции для ЯК, особенно в условиях язвенного проктита легкой степени [16, 17]. Соответственно, многие исследования показали, что обширное трансмуральное воспаление при БК представляет более высокие уровни СРБ, чем легкое или умеренное воспаление слизистой оболочки при ЯК [18-20]. С другой стороны, уровень СРБ> 45 мг / л в сочетании с частотой стула от 3 до 8 в день на 3-й день (известный как Оксфордские критерии) предсказывает возникновение колэктомии у 85% пациентов с острым тяжелым ЯК во время госпитализации [21 ], несмотря на то, что последние данные частично пересмотрели эти результаты [22].
На эндоскопическом уровне было продемонстрировано, что CRP коррелирует с активностью заболевания, с уровнями в пределах нормы в случаях отрицательной илеоколоноскопии [16, 17]. Однако в недавнем проспективном исследовании 186 пациентов с ЯК Sonoyama et al. [17] сообщили, что уровень СРБ в сыворотке не был так сильно связан с эндоскопической шкалой Майо, как ФК, и никакой корреляции между СРБ и язвенным проктитом не наблюдалось.
Что касается мониторинга заболевания, было показано, что CRP предсказывает клинический рецидив и неэффективность терапии как при БК, так и при ЯК [23-25].В частности, было обнаружено, что уровень CRP в сыворотке> 5 мг / л на 22 неделе после начала приема инфликсимаба (IFX) является прогностическим фактором потери ответа у пациентов, которые находились в клинической ремиссии на 14 неделе (HR: 2,5; 95% CI: 1.16–5.26; p = 0,019) [25]. Кроме того, в большом ретроспективном исследовании с участием 1189 пациентов с БК было обнаружено, что высокий уровень СРБ в сыворотке является предиктором низкой продолжительности лечения адалимумабом в течение 4-летнего периода наблюдения [26].
С другой стороны, были опубликованы противоречивые данные относительно корреляции между СРБ и послеоперационным рецидивом (ПОР) БК.Рандомизированное контролируемое исследование с участием 24 пациентов показало низкую чувствительность (25%) для эндоскопической ПОР через 1 год [27]. Напротив, в небольшом исследовании ( n = 12) отмены IFX через 3 года клинической и эндоскопической ремиссии после операции, уровни CRP коррелировали с рецидивом POR и последующим ответом после возобновления терапии [28]. Более того, в другом исследовании сообщалось об очень слабой, но статистически значимой разнице между пациентами с ПОР и пациентами с эндоскопической ремиссией в среднем через 7 месяцев после операции [29].
Таким образом, параметры, при которых было продемонстрировано, что CRP является наиболее надежным, включают дифференциальный диагноз между IBS и IBD, трансмуральное воспаление CD, эндоскопическая активность обширного и левостороннего ЯК и мониторинг рецидива заболевания. И наоборот, точность CRP в контексте язвенного проктита и прогнозирование POR при CD довольно низки, и следует предпочтительно учитывать другие биомаркеры.
Калпротектин в фекалиях и сыворотке
FC — другой фундаментальный воспалительный биомаркер, который в настоящее время используется для оценки диагностики и мониторинга ответа на лечение при ВЗК [12, 30].Кальпротектин преимущественно присутствует в гранулах нейтрофилов и выполняет антимикробную функцию [31, 32]. Хотя он содержится в различных жидкостях организма, его концентрация в фекалиях в 6 раз выше, чем в крови у здоровых людей [33]. В частности, уровни FC повышаются у пациентов с активной ВЗК [34] и коррелируют с маргинализацией нейтрофилов в слизистой оболочке кишечника [35]. Несмотря на определенный уровень внутриличностной вариабельности, когда образцы собираются в разные моменты времени в течение одного дня [36], его использование широко применяется в клинической практике [4].
В большинстве лабораторий верхний предел нормы установлен на уровне 50 мкг / г, что согласуется с результатами метаанализа 1062 пациентов, в котором было обнаружено, что пациент с симптомами, подобными СРК, и уровнем ФК < При 40 мкг / г вероятность развития ВЗК составляла 1% или менее [15]. Однако в общей гастроэнтерологии этот маркер не обладает специфичностью, поскольку он может увеличиваться при многих других кишечных состояниях, таких как целиакия, рак толстой кишки, дивертикулит, прием противовоспалительных препаратов и кишечные инфекции [37].Кроме того, важно знать факторы, которые могут повлиять на тест и снизить его чувствительность и специфичность [38].
FC показал прочную корреляцию с эндоскопической активностью при ВЗК. В недавнем метаанализе 25 подходящих исследований, в которых изучалась эндоскопическая активность ВЗК в сочетании с ФК, авторы сообщили о совокупной чувствительности 85% и специфичности 75% при диагностике активного ВЗК [39]. Когда ЯК и БК рассматривались отдельно, один и тот же метаанализ показал лучшие результаты у пациентов с ЯК (совокупная чувствительность 87.3 против 82,4%; специфичность 77,1 против 72,1%). Возможное объяснение этих результатов заключается в противоречивых результатах точности ФК при рассмотрении пациентов с БК с изолированным заболеванием подвздошной кишки [40-43]. Соответственно, в исследовании 68 пациентов с ЯК сообщалось о сильной корреляции уровней ФК со степенью заболевания ( p = 0,006), эндоскопической оценкой Мэйо ( p = 0,001) и гистологическим индексом Нэнси ( p ). <0,001) [44].
Вышеупомянутый индекс Нэнси и оценка Гебоэса — это 2 подтвержденные гистологические оценки активности заболевания, разработанные для ЯК [45, 46].При определении гистологической ремиссии по шкале Гебоес <3,1 или по шкале Нэнси ≤1 была продемонстрирована корреляция между низкими уровнями ФК (<60–100 мкг / г) и гистологической ремиссией [44, 47]. Более того, Theede et al. [48] обнаружили, что уровни FC ниже 40,5 мкг / г могут предсказывать гистологическую ремиссию с чувствительностью и отрицательной прогностической ценностью 100%, несмотря на использование неутвержденной оценки. Аналогичным образом, повышенные значения FC (в диапазоне 72–250 мкг / г) показали, что они позволяют прогнозировать гистологическое воспаление у клинически «молчащих» пациентов в более поздних исследованиях [49-51].Недавно систематический обзор, включающий 12 исследований и 1168 пациентов, подтвердил корреляцию между ФК и гистологической активностью, хотя для преодоления неоднородности современной литературы необходимы подтвержденные пороговые значения и больше проспективных исследований с использованием подтвержденных оценок [52].
Что касается мониторинга заболевания, было продемонстрировано, что ФК предсказывает клинический рецидив как при ЯК, так и при БК [53-57]. Важно отметить, что жесткий контроль последовательных уровней FC, как и других воспалительных биомаркеров, превосходит только клиническую оценку, и его следует всегда рекомендовать [58].Кроме того, недавнее крупное проспективное исследование с участием 185 клинически спокойных пациентов с ЯК продемонстрировало, что пороговые значения ФК ≥170 мкг / г и ≥135 мкг / г позволяют прогнозировать эндоскопическую и гистологическую активность соответственно [50].
FC также играет роль в прогнозировании ответа на лечение. В 2006 году Kolho et al. [59] отметили, что у детей с ВЗК, получавших глюкокортикоиды, наблюдалось снижение уровня ФК, но часто не ниже 100 мкг / г. За последние несколько лет накопилось много данных о способности ФК прогнозировать ответ на мезаламин, иммунодепрессанты и биологические методы лечения.Например, увеличение дозы месаламина привело к значительному снижению уровня ФК у пациентов с ЯК в клинической ремиссии, несмотря на повышенный ФК [60]; в том же исследовании пациенты с исходным ФК ≥200 мкг / г показали более высокий риск рецидива [60]. В исследовании с участием 88 пациентов с БК, принимавших азатиоприн, было обнаружено, что уровни ФК тесно связаны с концентрацией метаболита тиопурина: у пациентов с концентрацией 6-тиогуанина в терапевтическом диапазоне (250–450 пмоль / 8 × 10 8 эритроцитов) , FC был достоверно ниже, чем у пациентов с разным уровнем концентрации метаболитов [61].Проспективное исследование с участием 53 пациентов с ЯК, прошедших цикл индукции инфликсимабом, показало, что пациенты со значительным снижением ФК на 2 неделе с большей вероятностью достигли эндоскопической ремиссии на 10 неделе [62]. В другом проспективном исследовании FC <82 мкг / г на 14 неделе прогнозировало клиническую ремиссию в течение 12 месяцев у пациентов с БК, получавших препараты против TNF (чувствительность 93%; специфичность 75%) [63]. Апостериорный анализ исследования GEMINI 1 (895 пациентов) показал, что уровни ФК у пациентов с ЯК, получавших ведолизумаб, снижались сильнее, чем плацебо; в частности, абсолютная концентрация ФК ≤150 мкг / г оказалась лучшим предиктором клинической и эндоскопической ремиссии на 6 неделе [64].Наконец, Дулай и др. [65] подтвердили потенциальную роль FC в мониторинге клинического и эндоскопического ответа у пациентов с ЯК, получавших цикл индукции биологическим агентом или тофацитинибом; исследование показало, что у пациентов, у которых отмечалось разрешение ректального кровотечения и нормализация частоты стула, ФК ≤50 мкг / г позволял исключить пациентов с умеренной или тяжелой эндоскопической активностью. Напротив, ФК ≥200 мкг / г позволял идентифицировать умеренную и тяжелую эндоскопическую активность у пациентов с ЯК с постоянным ректальным кровотечением и учащенным стулом [65].
В контексте мониторинга POR в CD за последние несколько лет были опубликованы противоречивые результаты. В когорте из 104 пациентов с CD, перенесших ранее операцию, Lamb et al. [66] сообщили об умеренной корреляции между ФК и послеоперационным индексом Харви-Брэдшоу ( r = 0,53, p <0,001), тогда как Yamamoto et al. [67] не обнаружили значимой корреляции между ФК и индексом активности болезни Крона в меньшей когорте ( r = 0,26, p = 0.28). Однако большинство данных показывает, что FC является более надежным маркером для этой цели, чем CRP, как на клиническом, так и на эндоскопическом уровнях [29, 68–70].
Кроме того, метаанализ 613 пациентов с БК, наблюдаемых с помощью ФК после резекции, продемонстрировал совокупную чувствительность и специфичность для прогноза ПОР 0,82 (95% ДИ: 0,73–0,89) и 0,61 (95% ДИ: 0,51–0,71), соответственно. [71]. В результате, в опросе европейских гастроэнтерологов, 90% респондентов сообщили о наблюдении за пациентами с БК с ФК после первой отрицательной колоноскопии [72].Уверенность в применении этого подхода является следствием данных, показывающих высокую отрицательную прогностическую ценность (> 90%) ФК в этих условиях для уровней <100 мкг / г [29, 68]. Интересно, что в недавнем систематическом обзоре изучалась способность ФК прогнозировать развитие ВЗК у пациентов с ревматологическими состояниями, включая анкилозирующий спондилит и спондилоартрит: эндоскопическое и гистологическое воспаление кишечника было обнаружено у 80 и 100% ревматологических пациентов с повышенной Уровни FC соответственно [73].
Таким образом, FC можно считать надежным суррогатным маркером эндоскопической активности при ВЗК (особенно при ЯК), предиктором клинических и эндоскопических рецидивов при ЯК, БК и ПОР, а также полезным инструментом для дифференциации СРК и ВЗК. С другой стороны, точность определения активности кишечника у пациентов с БК с изолированным заболеванием подвздошной кишки значительно ниже, как и его специфичность среди нескольких воспалительных состояний кишечника и между ЯК и БК в контексте новых диагнозов ВЗК.
Среди биологических жидкостей кальпротектин также особенно экспрессируется в крови. Кальпротектин сыворотки (СК) плохо изучен, но недавняя литература предполагает его потенциальную роль в качестве воспалительного биомаркера при ВЗК [74]. Например, в исследовании STORI SC был значительно выше у пациентов с БК, чем в контрольной группе ( p <0,0001), и даже выше у клинически активных CD, чем в состоянии покоя ( p <0,0001), тогда как корреляции не было. сообщили с эндоскопическими баллами [75].Следовательно, вероятно, что SC более точно указывает на системный воспалительный статус, а не на специфическое воспаление кишечника, что приводит к маргинальной роли при ВЗК.
Лактоферрин в фекалиях
Лактоферрин в фекалиях (FL) — еще один фекальный биомаркер, результаты которого аналогичны результатам FC [76]. Лактоферрин представляет собой железосвязывающий гликопротеин массой 80 кДа, который в основном выделяется нейтрофилами с фекалиями после выделения в воспаленном кишечнике [77].
В метаанализе 10 высококачественных исследований FL показал объединенные значения чувствительности и специфичности для оценки активности UC, равные 0.81 (95% ДИ: 0,64–0,92) и 0,82 (95% ДИ: 0,61–0,93), соответственно, и 0,82 (95% ДИ: 0,73–0,88) и 0,71 (95% ДИ: 0,63–0,78) для CD, соответственно [78]. В ретроспективном анализе немецкого клинического исследования у пациентов с ЯК легкой и средней степени тяжести пороговое значение 11,9 мкг / г для ФЛ показало площадь под кривой 0,734 (0,654–0,813, p <0,000), с диагностической точностью 70,2% для выявления стойкой клинической ремиссии и заживления слизистой оболочки [79].
В дополнительном метаанализе, сравнивающем CRP, FC и FL среди пациентов с симптомами ВЗК, FC и FL продемонстрировали более высокую надежность, чем CRP, как с точки зрения совокупной чувствительности (0.92 для FC, 0,88 для FL и 0,49 для CRP) и объединенной специфичности (0,82 для FC, 0,79 для FL и 0,73 для CRP) [76]. Опять же, недавнее исследование подтвердило превосходство FL по сравнению с CRP с точки зрения корреляции с эндоскопической активностью [80].
Тем не менее, эти представленные данные не отличаются от результатов, уже наблюдаемых с ФК, и не добавляют клинической полезности при отдельном рассмотрении. Потенциальным будущим использованием FL является комбинация этого маркера с другими измерениями сыворотки и фекалий для повышения общей точности.
MicroRNAs
MicroRNAs (miRNAs) представляют собой класс небольших некодирующих негативных регуляторов экспрессии генов с измененным биогенезом из-за воспалительной реакции [81]. Эти маркеры очень привлекательны из-за их стабильности во внеклеточной среде, а также простоты и специфичности их обнаружения. Данные по ВЗК начинают накапливаться, с идентификацией нескольких микроРНК в цельной крови [82], сыворотке [83-85], фекалиях [85, 86] и тканях кишечника [83, 87-89] пациентов с активной ВЗК. которые отличаются от таковых у пациентов с латентным заболеванием и контрольной группы.Интересно, что miRNAs были предложены в качестве потенциальных предикторов ответа на терапию, поскольку уровни let-7d и let-7e были значительно повышены на 6 неделе режима индукции IFX у пациентов, достигших клинической ремиссии [90].
Недавно было исследовано> 800 фекальных miRNAs в образцах стула пациентов с ЯК и БК и по сравнению с контрольной группой [86]. Полученные данные свидетельствуют о том, что пациенты с активным CD и UC имеют различные фекальные профили miRNA по сравнению с пациентами без IBD, особенно более высокие уровни miRNA-223 и miRNA-1246 [86].Для оценки реальной важности miRNA в оценке воспаления при ВЗК необходимы дополнительные исследования более крупных когорт с использованием метаанализов объединенных данных и сравнения с другими фекальными маркерами, такими как FC.
Glycoproteomics
Гликозилирование белков вовлечено в патофизиологию многих воспалительных заболеваний, и центральная роль также постулируется при ВЗК [91-93]. В частности, некоторые профили экспрессии общих N-гликомов в плазме недавно были связаны с локализацией заболевания, тяжестью, потребностью в мощном лечении и резекцией в большом многоцентровом исследовании [94].Способность этого профилирования отличать не ВЗК от случаев ВЗК и активное от неактивного заболевания может открыть новое поле исследований для ранней диагностики, оценки активности и прогнозирования ответа.
Другое
Помимо CRP, обострения ВЗК связаны с увеличением других положительных острофазовых реагентов и провоспалительных цитокинов, таких как скорость оседания эритроцитов, количество тромбоцитов, ферритин, гаптоглобин, фактор некроза опухоли α, а также коагуляция и фибринолиз факторов, среди прочего, и со снижением отрицательных реактантов острой фазы, таких как сывороточный альбумин, фактор XII и α2-макроглобулин [11, 95-97].Однако подавляющее большинство этих сывороточных биомаркеров продемонстрировали противоречивую связь с активностью заболевания и не продемонстрировали явного превосходства над CRP, вероятно, из-за их более длительного периода полувыведения.
Многие другие биомаркеры были протестированы в сыворотке, фекалиях и моче, но не вошли в клиническую практику в основном из-за неудовлетворительных подтверждающих данных или высокой стоимости воспроизводимости. Все биомаркеры, не обсуждаемые в тексте, сведены в Таблицу 1.
Композитные биомаркеры
На сегодняшний день FC определенно продемонстрировал наиболее убедительные доказательства в качестве надежного единственного биомаркера активности ВЗК, отражая лучше, чем CRP, степень воспаления слизистой оболочки в кишечник [70, 98].В последних европейских рекомендациях по диагностической оценке ВЗК [4] был предложен интервал в 3 месяца для мониторинга ФК у пациентов с отрицательным кальпротектином («целевой диапазон») и в 1 месяц при превышении порогового значения («диапазон действия»). Хотя этот подход очень полезен при ведении ясных дел, он порождает 2 проблемы. Во-первых, пороговое значение может варьироваться в зависимости от клинического контекста ВЗК и анализов, предоставляемых производителями [37, 99]. Во-вторых, несмотря на удовлетворительную точность, все еще существует серая зона («неопределенный диапазон»), которую трудно интерпретировать с помощью одного только FC.Следовательно, необходима другая и более эффективная стратегия, особенно у пациентов с субклиническим заболеванием.
Комбинированные биомаркеры представляют собой «комбинацию 2 или более биомаркеров, которые объединяются с использованием установленного алгоритма или подхода для получения единого интерпретирующего считывания» [100]. Если мы рассмотрим сложность и гетерогенность ВЗК, становится ясно, что один маркер не может предсказать активность заболевания в каждом отдельном случае, и что понятие «точная медицина» должно быть распространено также на эту область [101].Данные о совокупных оценках активности ВЗК начали накапливаться в последние несколько лет (таблица 2), и ожидается, что их будет опубликовано гораздо больше.
Таблица 2.
Большинство доказательств прибывает из комбинации биомаркеров с клиническими симптомами, которая может улучшить прогностическую ценность каждого элемента, взятого отдельно [102-108]. Например, сообщалось, что интеграция ФК с CRP и клиническими данными (индекс активности простого клинического колита для UC и оценка Харви-Брэдшоу для CD) увеличивает вероятность правильной классификации пациентов с ВЗК с «неопределенными» уровнями FC между 100. и 250 мкг / г [103].Аналогичным образом, в когорте пациентов с CD, получавших анти-TNF, снижение FC в сочетании с CRP <2,9 мг / дл и клинической ремиссией через 12 недель было лучшим предиктором ремиссии без кортикостероидов через 52 недели [104].
Другой предложенной оценкой был Индекс активности Утрехта, который объединял частоту жидкого стула в день с CRP, FC, количеством тромбоцитов и средним объемом тромбоцитов с оптимальными результатами с точки зрения прогнозирования эндоскопической активности у пациентов с CD [106]. Однако в недавнем систематическом обзоре опубликованных составных биомаркеров, основанных на клинических и лабораторных параметрах, Brand et al.[109] сообщили, что только 2 из 7 проанализированных индексов показывают ограниченное преимущество по сравнению с одним только FC или CRP в прогнозировании эндоскопической активности при БК. Возможное объяснение этих результатов заключается в том, что оценки с учетом симптомов, сообщаемых пациентом, часто могут иметь субъективные предубеждения.
Исключительная интеграция объективных биомаркеров, вероятно, обеспечит наиболее надежные результаты. Например, анализ сывороточных уровней 10 воспалительных маркеров, участвующих в патогенезе ВЗК, показал, что комбинация 4 наиболее прогностических биомаркеров (сывороточный амилоид А, ИЛ-6, ИЛ-8 и эотаксин-1) превосходит СРБ и ФК в прогнозировании наличия эндоскопической активности [110].Точно так же панель из 7 цитокинов (TNF-α, IL-12, IL-8, IL-2, IL-5, IL1-β и IFN-γ) продемонстрировала сильный предиктор клинического ответа на анти-TNF. индукционная терапия у пациентов с ЯК с чувствительностью 84,2% и специфичностью 93,3% [111]. Аналогичным образом, недавняя работа Бертани и др. [112] сообщили, что комбинированное снижение уровней ИЛ-6 и ИЛ-8 от исходного уровня до 6-й недели после введения ведолизумаба пациентам с ЯК было наиболее точным инструментом для прогнозирования заживления слизистой при эндоскопической оценке в течение 1 года.
В целом, наилучшая стратегия, вероятно, состоит в том, чтобы сохранить ФК в качестве краеугольного камня мониторинга ВЗК и повысить его диагностическую точность за счет интеграции других лабораторных параметров, как на уровне сыворотки, так и на уровне фекалий [113-117]. Например, комплексная оценка ФК с ИЛ-6 и ИФН-γ превзошла только ФК в прогнозировании послеоперационного рецидива Крона через 6 месяцев [113]. Кроме того, сочетание ФК с иммунохимическим анализом фекалий привело к более высокой точности идентификации пациентов с ЯК с риском рецидива, чем по одному из двух маркеров [114].Более того, объединение данных FC с минимальными уровнями лекарств может предсказать потерю ответа на лекарство с большей точностью, чем отдельные маркеры, как показано для минимальных уровней IFX <2 мкг / мл и FC> 250 мкг / г [117].
Что касается минимальных уровней лекарств, их комбинация с воспалительными биомаркерами, безусловно, является областью для расширения, поскольку у нас нет данных по этой конкретной теме. Обширное обсуждение изолированной значимости минимальных уровней и терапевтического мониторинга лекарственных средств выходит за рамки этого обзора.
Заключение
На сегодняшний день, за исключением CRP и FC, ни один из других представленных маркеров не тестируется и не используется в клинической практике. Эти результаты имеют две причины: во-первых, большинство биомаркеров были протестированы на небольших группах пациентов и не прошли валидацию на больших популяциях; во-вторых, технические проблемы и дорогостоящие процедуры приводят к низкой практичности и ограниченному доступу к предлагаемым тестам.
Доказательства показали, что FC в настоящее время является наиболее надежным биомаркером кишечного воспаления, особенно когда доступны исходные и последовательные измерения [118, 119].Поскольку он не идеален и его точность может варьироваться в зависимости от различных клинических сценариев и влияющих факторов, очень важно начать вводить новые параметры для достижения точности FC.
В нашей клинической практике мы рассматриваем ФК как краеугольный камень неинвазивной оценки воспаления кишечника. Как уже сообщалось, важно иметь много последовательных оценок, чтобы обеспечить правильную интерпретацию измерения и контролировать ситуацию. По этой причине мы всегда спрашиваем недавний уровень ФК при первом амбулаторном посещении нашей клиники ВЗК, даже у бессимптомных пациентов в стадии ремиссии.Кроме того, мы рекомендуем пациентам, переехавшим из других центров или проживающим в близлежащих провинциях Тосканы, регулярно выполнять тест в том же месте, чтобы исключить лабораторную переменную. Однако, несмотря на наше доверие к ФК, мы часто ищем подтверждения других биологических маркеров, таких как СРБ и гемоглобин, и, конечно, частоты стула, его консистенции и наличия крови. В связи с этим мы стараемся объяснить каждому пациенту все «красные флажки» его заболевания как на клиническом, так и на уровне биомаркеров, чтобы оперативно отреагировать и связаться с нами, чтобы при необходимости ускорить их последующий визит.
В конце концов, целью исследований в этой области должно быть устранение или, по крайней мере, уменьшение «серой зоны» каждого биомаркера (рис. 2), что может быть достигнуто либо путем повышения чувствительности анализов обнаружения, либо путем объединение различных маркеров. Поэтому мы считаем, что проверка неинвазивных составных биомаркеров для измерения активности заболевания является важной потребностью для нашей клинической практики, конечной целью которой является надежное управление ВЗК с помощью менее инвазивных процедур и более эмпирического принятия решений относительно корректировки лечения.
Рис. 2.
Улучшения, обеспечиваемые композитными биомаркерами. Тщательный выбор маркеров и их интеграция могут оптимизировать диагностическую точность отдельных биомаркеров активности заболевания и резко уменьшить слепое пятно, возникающее из «серой зоны».
Заявление о конфликте интересов
Авторам нечего раскрывать.
Источники финансирования
Эта работа не получала спонсорского финансирования.
Авторские взносы
г.Д. и Т. выполнил систематический обзор литературы и подготовил рукопись, таблицы и рисунки. A.G. внесла свой вклад в концепцию и дизайн обзора, предоставила интерпретацию текущих знаний и критически отредактировала рукопись. Все соавторы одобрили окончательную версию перед отправкой.
Список литературы
- Ксавье Р.Дж., Подольский ДК.Раскрытие патогенеза воспалительного заболевания кишечника. Природа. 2007. 448 (7152): 427–34.
- Хор Б., Гардет А., Ксавье Р.Дж. Генетика и патогенез воспалительных заболеваний кишечника. Природа. 2011. 474 (7351): 307–17.
- Де Соуза ХСП, Фиокки С., Илиопулос Д.Интерактом ВЗК: комплексный взгляд на этиологию, патогенез и терапию. Нат Рев Гастроэнтерол Гепатол. 2017; 14 (12): 739–49.
- Maaser C, Sturm A, Vavricka SR, Kucharzik T, Fiorino G, Annese V и др. Руководство ECCO-ESGAR по диагностической оценке ВЗК, часть 1: первоначальный диагноз, мониторинг известных ВЗК, выявление осложнений.Колит Дж. Крона. 2019; 13 (2): 144–64.
- Аронсон Дж. К., Фернер РЭ. Биомаркеры: общий обзор. Curr Protoc Pharmacol. 2017; 76: 9.23.1–17.
- Gomollón F, Dignass A, Annese V, Tilg H, Van Assche G, Lindsay JO и др.Европейский научно-обоснованный консенсус по диагностике и лечению болезни Крона 2016: часть 1: диагностика и лечение. Колит Дж. Крона. 2017; 11: 3–25.
- Мелмед Г.Ю., Елашофф Р., Чен Г.К., Настаскин И., Пападакис К.А., Василяускас Е.А. и др. Прогнозирование изменения диагноза от язвенного колита до болезни Крона: вложенное исследование случай-контроль.Clin Gastroenterol Hepatol. 2007; 5: 602–8.
- Peyrin-Biroulet L, Sandborn W., Sands BE, Reinisch W., Bemelman W., Bryant RV, et al. Выбор терапевтических целей при воспалительном заболевании кишечника (STRIDE): определение терапевтических целей для лечения от цели. Am J Gastroenterol. 2015; 110 (9): 1324–38.
- Аллен П.Б., Боновас С., Данезе С., Пейрин-Бируле Л. Развитие первичных и вторичных конечных точек в рандомизированных контролируемых испытаниях, ведущих к одобрению биопрепаратов и малых молекул при ВЗК: историческая перспектива. Экспертное мнение Biol Ther. 2020; 20 (2): 151–61.
- Ford AC, Лейси BE, Талли, штат Нью-Джерси.Синдром раздраженного кишечника. N Engl J Med. 2017; 376 (26): 2566–78.
- Песков БЫТЬ. Биомаркеры воспаления при воспалительном заболевании кишечника. Гастроэнтерология. 2015; 149 (5): 1275 – e2.
- Чанг С., Мальтер Л., Худесман Д.Мониторинг заболеваний при воспалительных заболеваниях кишечника. Мир Дж. Гастроэнтерол. 2015; 21 (40): 11246–59.
- Сук Даник Дж., Часман Д.И., Кэннон С.П., Миллер Д.Т., Зи Р.Й., Козловски П. и др. Влияние генетической изменчивости гена С-реактивного белка на воспалительную реакцию во время и после острой коронарной ишемии.Энн Хам Жене. 2006; 70 (Pt 6): 705–16.
- Хендерсон П., Кеннеди Н.А., Ван Лимберген Дж. Э., Кэмерон Флорида, Сатсанги Дж., Рассел Р. К. и др. С-реактивный белок сыворотки и генотип CRP при воспалительных заболеваниях кишечника у детей: влияние на фенотип, естественное течение и ответ на терапию.Воспаление кишечника. 2015; 21 (3): 596–605.
- Менес С.Б., Пауэлл С., Курландер Дж., Гоэль А., Чей В.Д. Метаанализ полезности С-реактивного белка, скорости оседания эритроцитов, фекального кальпротектина и фекального лактоферрина для исключения воспалительного заболевания кишечника у взрослых с СРК.Am J Gastroenterol. 2015; 110 (3): 444–54.
- Solem CA, Loftus EV, Tremaine WJ, Harmsen WS, Zinsmeister AR, Sandborn WJ. Корреляция С-реактивного белка с клинической, эндоскопической, гистологической и рентгенологической активностью при воспалительном заболевании кишечника. Воспаление кишечника. 2005. 11 (8): 707–12.
- Сонояма Х, Кавасима К., Исихара С., Котани С., Фукуба Н., Ока А. и др. Возможности фекального кальпротектина и биомаркеров крови в качестве суррогатных эндоскопических маркеров в зависимости от типа язвенного колита. J Clin Biochem Nutr. 2019; 64 (3): 265–70.
- Vermeire S, Van Assche G, Rutgeerts P.Роль С-реактивного белка как воспалительного маркера желудочно-кишечных заболеваний. Нат Клин Практ Гастроэнтерол Гепатол. 2005. 2 (12): 580–6.
- Saverymuttu SH, Hodgson HJ, Chadwick VS, Pepys MB. Различия в реакциях острой фазы при болезни Крона и язвенном колите. Кишечник.1986. 27 (7): 809–13.
- Хенриксен М., Янсен Дж., Лигрен И., Стрей Н., Сауар Дж., Ватн М. Х. и др. С-реактивный белок: прогностический фактор и маркер воспаления при воспалительном заболевании кишечника. Результаты проспективного популяционного исследования. Кишечник. 2008. 57 (11): 1518–23.
- Харборд М., Элиаким Р., Беттенворт Д., Кармирис К., Кацанос К., Копылов Ю. и др.Третий европейский консенсус по диагностике и лечению язвенного колита, основанный на фактических данных. Часть 2: текущее руководство. Колит Дж. Крона. 2017; 11 (7): 769–84.
- Moore AC, Bressler B. Острый тяжелый язвенный колит: оксфордские критерии больше не позволяют прогнозировать частоту внутрибольничной колэктомии.Dig Dis Sci. 2020; 65 (2): 576–80.
- Биттон А., Добкин П.Л., Эдвардс, доктор медицины, Сьюч М.Дж., Меддингс Дж.Б., Равал С. и др. Прогнозирование рецидива болезни Крона: биопсихосоциальная модель. Кишечник. 2008; 57: 1386–92.
- Грузоотправитель Y, Модильяни Р., Полковник Дж. Ф., Дупас Дж. Л., Леманн М., Мэри Дж. Я.Простая биологическая оценка для прогнозирования низкого риска кратковременного рецидива болезни Крона. Воспаление кишечника. 2006. 12 (7): 551–7.
- Роблин X, Маротт Х., Леклерк М., Дель Тедеско Э., Фелип Дж. М., Пейрин-Бируле Л. и др. Сочетание С-реактивного белка, минимальных уровней инфликсимаба и стабильных, но не преходящих антител к инфликсимабу связано с потерей ответа на инфликсимаб при воспалительном заболевании кишечника.Колит Дж. Крона. 2015; 9 (7): 525–31.
- Танака Х., Камата Н., Ямада А., Эндо К., Фуджи Т., Йошино Т. и др. Долгосрочное продолжение лечения адалимумабом и связанные с ним прогностические факторы для 1189 пациентов с болезнью Крона. J Gastroenterol Hepatol. 2018; 33 (5): 1031–8.
- Регейро М., Кип К.Е., Шраут В., Байду Л., Сепульведа А.Р., Пеши М. и др.Индекс активности болезни Крона не коррелирует с эндоскопическим рецидивом через год после илеоколонической резекции. Воспаление кишечника. 2011. 17 (1): 118–26.
- Соррентино Д., Павиотти А., Терросу Г., Авеллини С., Джерачи М., Зарифи Д. Поддерживающая терапия в низких дозах инфликсимабом предотвращает послеоперационные рецидивы болезни Крона.Clin Gastroenterol Hepatol. 2010. 8 (7): 591–9.
- Боскетти Дж., Лайдет М., Мусата Д., Стефанеску С., Роблин Х, Фелип Дж. И др. Уровни фекального кальпротектина связаны с тяжестью послеоперационного эндоскопического рецидива у бессимптомных пациентов с болезнью Крона. Am J Gastroenterol.2015; 110 (6): 865–72.
- Mumolo MG, Bertani L, Ceccarelli L, Laino G, Di Fluri G, Albano E, et al. От скамейки к постели: фекальный кальпротектин при воспалительных заболеваниях кишечника в клинических условиях. Мир Дж. Гастроэнтерол. 2018; 24 (33): 3681–94.
- Айлинг Р.М., Кок К.Фекальный кальпротектин. Adv Clin Chem. 2018; 87: 161–90.
- Накашиге Т.Г., Зигил Э.М., Дреннан К.Л., Нолан Э.М. Секвестрация никеля белком защиты хозяина кальпротектином человека. J Am Chem Soc. 2017; 139 (26): 8828–36.
- Røseth AG, Fagerhol MK, Aadland E, Schjønsby H.Оценка нейтрофилов, доминирующего белка кальпротектина в кале: методологическое исследование. Сканд Дж Гастроэнтерол. 1992; 27: 793–8.
- D’Haens G, Ferrante M, Vermeire S, Baert F, Noman M, Moortgat L и др. Фекальный кальпротектин является суррогатным маркером эндоскопических поражений при воспалительном заболевании кишечника.Воспаление кишечника. 2012; 18: 2218–24.
- Manceau H, Chicha-Cattoir V, Puy H, Peoc’h K. Фекальный кальпротектин при воспалительных заболеваниях кишечника: обновление и перспективы. Clin Chem Lab Med. 2017; 55 (4): 474–83.
- Лассон А., Стотцер П.О., Оман Л., Исакссон С., Сапнара М., Стрид Х.Внутрииндивидуальная изменчивость фекального кальпротектина: проспективное исследование у пациентов с активным язвенным колитом. Колит Дж. Крона. 2015; 9 (1): 26–32.
- Reenaers C, Bossuyt P, Hindryckx P, Vanpoucke H, Cremer A, Baert F. Экспертное мнение об использовании фекального кальпротектина в диагностике и мониторинге воспалительных заболеваний кишечника в повседневной клинической практике.United Eur Gastroenterol J. 2018; 6 (8): 1117–25.
- Д’Амико Ф., Нэнси С., Данезе С., Пейрин-Бируле Л. Практическое руководство по измерению фекального кальпротектина: мифы и реальность. Колит Дж. Крона. 2020; jjaa093.
- Роккас Т., Портинкаса П., Кутрубакис И.Е.Фекальный кальпротектин в оценке эндоскопической активности воспалительного заболевания кишечника: метаанализ диагностической точности. J Gastrointest Liver Dis. 2018; 27: 299–306.
- Gecse KB, Brandse JF, Van Wilpe S, Löwenberg M, Ponsioen C, Van Den Brink G и др. Влияние локализации заболевания на уровень кальпротектина в кале при болезни Крона.Сканд Дж Гастроэнтерол. 2015; 50 (7): 841–7.
- Копылов Ю., Юнг Д.Э., Энгель Т., Авни Т., Баттат Р., Бен-Хорин С. и др. Фекальный кальпротектин для прогнозирования болезни Крона тонкой кишки с помощью капсульной эндоскопии: систематический обзор и метаанализ. Eur J Gastroenterol Hepatol. 2016; 28: 1137–44.
- Райниш В., Паначчоне Р., Боссайт П., Баерт Ф., Армуцци А., Хебютерн Х и др. Связь отсечки биомаркеров и эндоскопических исходов при болезни Крона: апостериорный анализ исследования CALM. Воспаление кишечника. 2020 сентября 18; 26 (10): 1562–1571.
- Саймон Э. Г., Уордл Р., Тхи А. А., Элдридж Дж., Сэмюэл С., Моран Г. В..Фекальный кальпротектин одинаково и точно измеряет активность заболевания при болезни Крона в тонком и толстом кишечнике?: Систематический обзор. Intest Res. 2019; 17: 160–70.
- Патель А, Панчал Х, Дубинский MC. Уровни кальпротектина в кале предсказывают гистологическое заживление язвенного колита.Воспаление кишечника. 2017; 23 (9): 1600–4.
- Маршал-Брессенот А, Саллерон Дж., Буланьон-Ромби С, Бастьен С., Кан V, Кадио Дж. И др. Разработка и проверка гистологического индекса Нэнси для ЯК. Кишечник. 2017; 66 (1): 43–9.
- Гебоэс К., Ридделл Р., Ост А, Йенсфельт Б., Перссон Т., Лёфберг Р.Воспроизводимая шкала оценок для гистологической оценки воспаления при язвенном колите. Кишечник. 2000. 47 (3): 404–9.
- Зиттан Э., Келли О. Б., Кирш Р., Милгром Р., Бернс Дж., Нгуен Г. К. и др. Низкий уровень кальпротектина в кале коррелирует с гистологической ремиссией и заживлением слизистой оболочки при язвенном колите и болезни Крона толстой кишки.Воспаление кишечника. 2015; 22 (3): 623–30.
- Теде К., Холк С., Ибсен П., Каллемосе Т., Нордгаард-Лассен И., Нильсен А.М. Фекальный кальпротектин предсказывает рецидив и гистологическое заживление слизистой оболочки при язвенном колите. Воспаление кишечника. 2016; 22 (5): 1042–8.
- Магро Ф., Лопес Дж., Борральхо П., Лопес С., Коэльо Р., Коттер Дж. И др.Сравнение различных гистологических индексов при оценке активности ЯК и их точности относительно результатов эндоскопии и уровней кальпротектина в фекалиях. Кишечник. 2019; 68 (4): 594–603.
- Харт Л., Шаванн М., Херад О., Медлер С., Мурад Н., Маркус В. и др. Калпротектин в фекалиях предсказывает эндоскопическую и гистологическую активность при клинически неактивном язвенном колите.Колит Дж. Крона. 2019; 14 (1): 46–52.
- Walsh A, Kormilitzin A, Hinds C, Sexton V, Brain O, Keshav S и др. Определение пороговых значений калпротектина в качестве суррогата для эндоскопической и гистологической активности болезни при язвенном колите — проспективный анализ. Колит Дж. Крона.2019; 13 (4): 424–30.
- Д’Амико Ф., Боновас С., Данезе С., Пейрин-Бируле Л. Обзорная статья: фекальный кальпротектин и гистологическая ремиссия при язвенном колите. Алимент Pharmacol Ther. 2020; 51: 689–98.
- Naismith GD, Smith LA, Barry SJ, Munro JI, Laird S, Rankin K, et al.Проспективная оценка прогностической ценности фекального кальпротектина при болезни Крона в покое. Колит Дж. Крона. 2014; 8 (9): 1022–9.
- Де Вос М., Луи Э. Дж., Янсен Дж., Вандервурт Дж. Г., Номан М., Девит О. и др. Последовательные измерения кальпротектина в кале для прогнозирования рецидива у пациентов с язвенным колитом, получающих поддерживающую терапию инфликсимабом.Воспаление кишечника. 2013. 19 (10): 2111–7.
- Molander P, Färkkilä M, Ristimäki A, Salminen K, Kemppainen H, Blomster T. и др. Предсказывает ли калпротектин краткосрочный рецидив после прекращения приема TNFα-блокаторов у пациентов с воспалительным заболеванием кишечника в состоянии глубокой ремиссии? Колит Дж. Крона.2015; 9 (1): 33–40.
- Ямамото Т., Шимояма Т., Умегае С., Мацумото К. Серийный мониторинг фекального кальпротектина для оценки эндоскопического рецидива у бессимптомных пациентов после илеоколонической резекции по поводу болезни Крона: долгосрочное проспективное исследование. Therap Adv Гастроэнтерол.2016; 9: 664–70.
- Жулина Ю., Цао Ю., Амкофф К., Карлсон М., Тиск С., Халфварсон Дж. Прогностическое значение фекального кальпротектина у пациентов с неактивным воспалительным заболеванием кишечника. Алимент Pharmacol Ther. 2016; 44 (5): 495–504.
- Полковник JF, Panaccione R, Bossuyt P, Lukas M, Baert F, Vaásek T, et al.Влияние жесткого контроля на болезнь Крона (CALM): многоцентровое рандомизированное контролируемое исследование фазы 3. Ланцет. 2018; 390: 2779–89.
- Kolho KL, Raivio T, Lindahl H, Savilahti E. Фекальный кальпротектин остается высоким во время терапии глюкокортикоидами у детей с воспалительным заболеванием кишечника.Сканд Дж Гастроэнтерол. 2006. 41 (6): 720–5.
- Остерман М.Т., Аберра Ф.Н., Кросс Р., Лиакос С., МакКейб Р., Шафран И. и др. Повышение дозы месаламина снижает уровень кальпротектина в кале у пациентов с нездоровым язвенным колитом. Clin Gastroenterol Hepatol. 2014; 12 (11): 1887 – e3.
- Essmann J, Keil C, Unruh O, Otte A, Manns MP, Bachmann O.Фекальный кальпротектин в значительной степени связан с концентрацией метаболита азатиоприна при болезни Крона. Eur J Gastroenterol Hepatol. 2019; 31 (1): 99–108.
- Де Вос М., Девит О, Д’Хаенс Дж., Баерт Ф., Фонтен Ф., Вермейр С. и др. Быстрое и резкое снижение кальпротектина предсказывает ремиссию инфликсимаба у пациентов с язвенным колитом, ранее не получавших анти-TNF.Колит Дж. Крона. 2012. 6 (5): 557–62.
- Boschetti G, Garnero P, Moussata D, Cuerq C, Préaudat C, Duclaux-Loras R, et al. Точность сывороточных и фекальных белков S100 (кальпротектин и кальгранулин C) для прогнозирования ответа на антагонисты TNF у пациентов с болезнью Крона.Воспаление кишечника. 2015; 21: 331–6.
- Райниш В., Бресслер Б., Кертис Р., Парих А., Ян Х., Розарио М. и др. Фекальные реакции кальпротектина после индукционной терапии ведолизумабом при умеренном и тяжелом язвенном колите: апостериорный анализ GEMINI 1. Inflamm Bowel Dis.2019; 25 (4): 803–10.
- Дулай П.С., Баттат Р., Барский М., Нгуен Н.Х., Ма С., Нарула Н. и др. Включение калпротектина в клиническую практику для пациентов с активным язвенным колитом средней и тяжелой степени, получающих лечение биологическими препаратами или низкомолекулярными ингибиторами. Am J Gastroenterol.2020; 115 (6): 885–94.
- Lamb CA, Mohiuddin MK, Gicquel J, Neely D, Bergin FG, Hanson JM и др. Фекальный кальпротектин или лактоферрин могут выявить послеоперационный рецидив болезни Крона. Br J Surg. 2009. 96 (6): 663–74.
- Ямамото Т., Сираки М., Бамба Т., Умеги С., Мацумото К.Фекальный кальпротектин и лактоферрин в качестве маркеров для мониторинга активности заболевания и прогнозирования клинического рецидива у пациентов с болезнью Крона после илеоколонической резекции: проспективное пилотное исследование. United Eur Gastroenterol J. 2013; 1: 368–74.
- Райт Е.К., Камм М.А., Де Круз П., Гамильтон А.Л., Ричи К.Дж., Креджани Е.О. и др.Измерение фекального кальпротектина улучшает мониторинг и обнаружение рецидивов болезни Крона после операции. Гастроэнтерология. 2015; 148 (5): 938 – e1.
- Папамикл К., Арчавлис Э., Кириакос Н., Каланцис С., Другас I, Константопулос П. и др. P402 Кальпротектин в фекалиях, но не сывороточный СРБ, предсказывает послеоперационный эндоскопический рецидив болезни Крона.Колит Дж. Крона. 2012; 6 (Приложение 1): S169.
- Райт Е.К., Камм М.А., Де Круз П., Гамильтон А.Л., Ричи К.Дж., Кинан Д.И. и др. Сравнение фекальных воспалительных маркеров при болезни Крона. Воспаление кишечника. 2016; 22 (5): 1086–94.
- Цю И, Мао Р., Чен Б.Л., Хе И, Цзэн Ц.Р., Сюэ Л. и др.Фекальный кальпротектин для оценки послеоперационного рецидива болезни Крона: метаанализ проспективных исследований. Воспаление кишечника. 2015; 21 (2): 315–22.
- Dragoni G, Ding N, Gecse KB, Mansfield JC, Kopylov U, Beaugerie L, et al. Профилактика и лечение послеоперационных рецидивов болезни Крона: результаты исследования YECCO / ClinCom 2019.Eur J Gastroenterol Hepatol. 2020; 32: 1062–6.
- Фауни М., Д’Амико Ф., Боновас С., Неттер П., Данезе С., Лойилл Д. и др. Фекальный кальпротектин для диагностики воспаления кишечника у пациентов с ревматологическими заболеваниями: систематический обзор. Колит Дж. Крона. 2020; 14: 688–93.
- Копи Т.А., Шахрох С., Мирзаи А., Агдаей Х.А., Кадиджани А.А. Роль сывороточного кальпротектина как нового биомаркера воспалительных заболеваний кишечника: обзорное исследование. Gastroenterol Hepatol Bed Bench. 2019; 12: 183–9.
- Meuwis MA, Vernier-Massouille G, Grimaud JC, Bouhnik Y, Laharie D, Piver E, et al.Кальпротектин сыворотки как биомаркер болезни Крона. Колит Дж. Крона. 2013; 7 (12): e678–83.
- Mosli MH, Zou G, Garg SK, Feagan SG, MacDonald JK, Chande N, et al. С-реактивный белок, калпротектин и лактоферрин стула для определения эндоскопической активности у пациентов с симптоматическими воспалительными заболеваниями кишечника: систематический обзор и метаанализ.Am J Gastroenterol. 2015; 110 (6): 802–20.
- Райт Э.К. Кальпротектин или лактоферрин: помогают ли они. Dig Dis. 2016; 34 (1–2): 98–104.
- Дай К., Цзян М., Сунь М.Дж., Цао К.Фекальный лактоферрин для оценки активности воспалительного заболевания кишечника: систематический обзор и метаанализ. J Clin Gastroenterol. 2020; 54 (6): 545–53.
- Langhorst J, Boone J, Lauche R, Rueffer A, Dobos G. Лактоферрин в фекалиях, кальпротектин, pmn-эластаза, crp и количество лейкоцитов как индикаторы заживления слизистой оболочки и клинического течения заболевания у пациентов с язвенным колитом легкой и средней степени тяжести: апостериорный анализ проспективного клинического исследования.Колит Дж. Крона. 2016; 10 (7): 786–94.
- Rubio MG, Amo-Mensah K, Gray JM, Nguyen VQ, Nakat S, Grider D и др. Фекальный лактоферрин точно отражает воспаление слизистой оболочки при воспалительном заболевании кишечника. Мир J Gastrointest Pathophysiol. 2019; 10 (5): 54–63.
- Мехта А., Балтимор Д.МикроРНК как регуляторные элементы в логике иммунной системы. Nat Rev Immunol. 2016; 16 (5): 279–94.
- Wu F, Guo NJ, Tian H, Marohn M, Gearhart S, Bayless TM и др. МикроРНК периферической крови различают активный язвенный колит и болезнь Крона. Воспаление кишечника. 2011; 17 (1): 241–50.
- Иборра М., Бернуцци Ф., Корреале С., Ветрано С., Фиорино Дж., Бельтран Б. и др. Определение профилей экспрессии микро-РНК в сыворотке и тканях на разных стадиях воспалительного заболевания кишечника. Clin Exp Immunol. 2013. 173 (2): 250–8.
- Ойкономопулос А., Политарху С., Джоши С., Хоммес Д.В., Илиопулос Д.Идентификация циркулирующих сигнатур микроРНК при болезни Крона с использованием технологии наностринга nCounter. Воспаление кишечника. 2016; 22 (9): 2063–9.
- Schönauen K, Le N, Von Arnim U, Schulz C, Malfertheiner P, Link A. Циркулирующие и фекальные микроРНК как биомаркеры воспалительных заболеваний кишечника.Воспаление кишечника. 2018; 24 (7): 1547–57.
- Verdier J, Breunig IR, Ohse MC, Roubrocks S, Kleinfeld S, Roy S и др. Микро-РНК фекалий при воспалительных заболеваниях кишечника. Колит Дж. Крона. 2020; 14 (1): 110–7.
- Zahm AM, Hand NJ, Tsoucas DM, Le Guen CL, Baldassano RN, Friedman JR.Ректальные микроРНК нарушаются при воспалительном заболевании толстой кишки у детей. Колит Дж. Крона. 2014. 8 (9): 1108–17.
- Thorlacius-Ussing G, Schnack Nielsen B, Andersen V, Holmstrøm K, Pedersen AE. Экспрессия и локализация miR-21 и miR-126 в ткани слизистой оболочки пациентов с воспалительным заболеванием кишечника.Воспаление кишечника. 2017; 23 (5): 739–52.
- Wu LY, Ma XP, Shi Y, Bao CH, Jin XM, Lu Y и др. Изменения профилей экспрессии микроРНК в воспаленных и невоспаленных слизистых оболочках восходящей ободочной кишки пациентов с активной болезнью Крона. J Gastroenterol Hepatol. 2017; 32 (10): 1706–15.
- Фудзиока С., Накамичи И., Эсаки М., Асано К., Мацумото Т., Китазоно Т. Уровни микроРНК в сыворотке у пациентов с болезнью Крона во время индукционной терапии инфликсимабом. J Gastroenterol Hepatol. 2014. 29 (6): 1207–14.
- Синдзаки С., Иидзима Х., Накагава Т., Эгава С., Накадзима С., Исии С. и др.Изменения олигосахаридов IgG являются новым диагностическим маркером активности заболевания и клинического течения воспалительного заболевания кишечника. Am J Gastroenterol. 2008. 103 (5): 1173–81.
- Теодорату Э., Кэмпбелл Х., Вентам Н.Т., Коларич Д., Пучич-Бакович М., Золдош В. и др. Роль гликозилирования при ВЗК.Нат Рев Гастроэнтерол Гепатол. 2014. 11 (10): 588–600.
- Шимурина М., де Хаан Н., Вучкович Ф., Кеннеди Н.А., Штамбук Дж., Фальк Д. и др. Гликозилирование иммуноглобулина G связано с клиническими особенностями воспалительных заболеваний кишечника. Гастроэнтерология. 2018; 154: 1320–33.
- Клерк Ф., Новокмет М., Доц В., Рейдинг К.Р., де Хаан Н., Каммейер GSM и др.Сигнатуры N-гликанов в плазме связаны с особенностями воспалительных заболеваний кишечника. Гастроэнтерология. 2018; 155 (3): 829–43.
- Vermeire S, Van Assche G, Rutgeerts P. Лабораторные маркеры при ВЗК: полезные, волшебные или ненужные игрушки? Кишечник. 2006. 55 (3): 426–31.
- Габай Ц., Кушнер И.Белки острой фазы и другие системные реакции на воспаление. N Engl J Med. 1999. 340 (6): 448–54.
- Cioffi M, Rosa AD, Serao R, Picone I, Vietri MT. Лабораторные маркеры при язвенном колите: текущие идеи и будущие достижения. Мир J Gastrointest Pathophysiol. 2015; 6 (1): 13–22.
- Корниш Дж. С., Виртген Э., Дебриц Дж. Биомаркеры, предсказывающие ответ на терапию тиопурином при воспалительном заболевании кишечника. Front Med. 2020; 7: 8.
- Амкофф К., Стридсберг М., Лампинен М., Магнусон А., Карлсон М., Халфварсон Дж.Клинические последствия анализа специфических различий в f-кальпротектине при мониторинге активности воспалительного заболевания кишечника с течением времени. Сканд Дж Гастроэнтерол. 2017; 52 (3): 344–50.
- Dulai PS, Peyrin-Biroulet L, Danese S, Sands BE, Dignass A, Turner D, et al. Подходы к интеграции биомаркеров в клинические испытания и пути оказания помощи в качестве мишеней для лечения воспалительных заболеваний кишечника.Гастроэнтерология. 2019; 157 (4): 1032 – e1.
- Бояпати РК, Калла Р., Сатсанги Дж., Хо GT. Биомаркеры в поисках точной медицины при ВЗК. Am J Gastroenterol. 2016; 111 (12): 1682–90.
- Вердехо К., Эрвиас Д., Ронсеро О., Ариас А., Бухмиди А., Лоренте Р. и др.Фекальный кальпротектин не превосходит сывороточный С-реактивный белок или индекс Харви-Брэдшоу в прогнозировании послеоперационного эндоскопического рецидива болезни Крона. Eur J Gastroenterol Hepatol. 2018; 30 (12): 1521–7.
- Bodelier AG, Jonkers D, van den Heuvel T, de Boer E, Hameeteman W., Masclee AA, et al.Высокий процент пациентов с ВЗК с неопределенным уровнем кальпротектина в кале: дополнительная ценность комбинированного балла. Dig Dis Sci. 2017; 62 (2): 465–72.
- Sollelis E, Quinard RM, Bouguen G, Goutte M, Goutorbe F, Bouvier D, et al. Комбинированная оценка биомаркеров как предиктора сохраняющейся ремиссии при болезни Крона.Мир Дж. Гастроэнтерол. 2019; 25 (19): 2354–64.
- Puolanne AM, Kolho KL, Alfthan H, Ristimäki A, Mustonen H, Färkkilä M. Экспресс-тест фекального кальпротектина и индекс симптомов для мониторинга активности заболевания при воспалительном заболевании кишечника толстой кишки. Dig Dis Sci. 2017; 62 (11): 3123–30.
- Миндерхуд И.М., Штайерберг Е.В., Ван Бодегравен А.А., Ван Дер Вуде С.Дж., Хоммес Д.В., Дейкстра Г.и др. Прогнозирование активности эндоскопического заболевания при болезни Крона: новый и проверенный индекс активности неинвазивного заболевания (Индекс активности Утрехта). Воспаление кишечника. 2015; 21: 2453–9.
- Langhorst J, Elsenbruch S, Koelzer J, Rueffer A, Michalsen A, Dobos GJ. Неинвазивные маркеры в оценке воспаления кишечника при воспалительных заболеваниях кишечника: показатели фекального лактоферрина, кальпротектина и PMN-эластазы, СРБ и клинические показатели. Am J Gastroenterol.2008. 103 (1): 162–9.
- Cozijnsen MA, Ben Shoham A, Kang B, Choe BH, Choe YH, Jongsma MME и др. Разработка и проверка неинвазивного индекса воспаления слизистой оболочки при болезни Крона у детей. Clin Gastroenterol Hepatol. 2020; 18 (1): 133 – e1.
- Brand EC, Elias SG, Minderhoud IM, van der Veen JJ, Baert FJ, Laharie D, et al.Систематический обзор и внешняя проверка моделей прогнозирования на основе симптомов и биомаркеров для определения эндоскопической активности при болезни Крона. Clin Gastroenterol Hepatol. 2020; 18 (8): 1704–18.
- Bourgonje AR, von Martels JZH, Gabriëls RY, Blokzijl T, Buist-Homan M, Heegsma J, et al.Комбинированный набор из четырех сывороточных воспалительных биомаркеров надежно предсказывает эндоскопическую активность заболевания при воспалительном заболевании кишечника. Front Med. 2019; 6: 251.
- Образцов И.В., Широких К.Е., Образцова О.И., Шапина М.В., Ван М.Х., Халиф ИЛ. Множественное профилирование цитокинов: новая модель для прогнозирования ответа на антагонисты фактора некроза опухоли у пациентов с язвенным колитом.Воспаление кишечника. 2019; 25 (3): 524–31.
- Бертани Л., Бальетто Л., Антониоли Л., Форнаи М., Тапете Г., Альбано Е. и др. Оценка цитокинов сыворотки позволяет прогнозировать клинические и эндоскопические результаты применения ведолизумаба у пациентов с язвенным колитом. Br J Clin Pharmacol. 2020; 86 (7): 1296–305.
- Cerrillo E, Moret I, Iborra M, Pamies J, Hervás D, Tortosa L. и др. Номограмма, сочетающая уровни кальпротектина в кале и профили цитокинов в плазме для индивидуального прогнозирования послеоперационного рецидива болезни Крона. Воспаление кишечника. 2019; 25 (10): 1681–91.
- Наганума М., Кобаяши Т., Насуно М., Мотоя С., Като С., Мацуока К. и др.Значение проведения 2-х видов фекальных проб у больных язвенным колитом. Clin Gastroenterol Hepatol. 2020; 18 (5): 1102 – e5.
- Локтионов А., Чая В., Бандалетова Т., Пуллис А. Выявление и мониторинг воспалительных заболеваний кишечника путем измерения биомаркеров в неинвазивно собранной колоректальной слизи.J Gastroenterol Hepatol. 2017; 32 (5): 992–1002.
- Карлинг П., Лундгрен Д., Эклёф В., Палмквист Р., Халтдин Дж. Улучшенный мониторинг воспалительной активности у пациентов с язвенным колитом путем комбинации фекальных тестов на гемоглобин и кальпротектин. Сканд Дж. Клин Лаб Инвест.2019; 79 (5): 341–6.
- Роблин X, Дуру Дж., Виллиет Н., Дель Тедеско Э., Кюллерон М., Джарло С. и др. Разработка и внутренняя проверка модели с использованием калпротектина в сочетании с минимальными уровнями инфликсимаба для прогнозирования клинического рецидива болезни Крона. Воспаление кишечника.2017; 23 (1): 126–32.
- Ямамото Т., Шимояма Т., Мацумото К. Последовательный мониторинг фекального кальпротектина во время терапии суппозиториями месалазином для активного воспаления прямой кишки при язвенном колите. Алимент Pharmacol Ther. 2015; 42 (5): 549–58.
- Heida A, Park KT, Van Rheenen PF.Клиническая полезность мониторинга калпротектина у бессимптомных пациентов с воспалительным заболеванием кишечника: систематический обзор и практическое руководство. Воспаление кишечника. 2017; 23 (6): 894–902.
- Любега Дж, Дэвис Т.Дж. Сравнение мукопротеина сыворотки с анализами сывороточного альфа-кислотного гликопротеина, гаптоглобина и альфа-1-антитрипсина при мониторинге воспалительного заболевания кишечника.Clin Chim Acta. 1990. 188 (1): 59–69.
- Biancone L, Fantini M, Tosti C, Bozzi R, Vavassori P, Pallone F. Клиренс фекального альфа-1-антитрипсина как маркер клинического рецидива у пациентов с болезнью Крона дистального отдела подвздошной кишки. Eur J Gastroenterol Hepatol. 2003. 15 (3): 261–6.
- Йилмаз Б., Кёклю С., Юксель О, Арслан С.Бета 2-микроглобулин сыворотки как биомаркер воспалительного заболевания кишечника. Мир Дж. Гастроэнтерол. 2014; 20: 10916–20.
- Маор I, Райнис Т., Ланир А., Лави А. Активность аденозиндезаминазы у пациентов с болезнью Крона: различие между активным и неактивным заболеванием. Eur J Gastroenterol Hepatol.2011; 23: 598–602.
- Саджади М, Голамрезаи А, Дарьяни Н.Э. Нет связи между активностью аденозиндезаминазы в сыворотке и активностью болезни при болезни Крона. Dig Dis Sci. 2015; 60 (6): 1755–60.
- Беязит Ю., Коклу С., Тас А., Пурнак Т., Сайилир А., Курт М. и др.Активность аденозиндезаминазы в сыворотке как предиктор тяжести заболевания при язвенном колите. Колит Дж. Крона. 2012; 6 (1): 102–7.
- Buisson A, Vazeille E, Minet-Quinard R, Goutte M, Bouvier D, Goutorbe F и др. Фекальный хитиназа 3-подобный 1 является надежным маркером, столь же точным, как фекальный кальпротектин, для определения эндоскопической активности у взрослых пациентов с воспалительными заболеваниями кишечника.Алимент Pharmacol Ther. 2016; 43 (10): 1069–79.
- Аомацу Т., Имаеда Х., Мацумото К., Кимура Э., Йоден А., Тамай Х. и др. Фекальная хитиназа 3-like-1: новый биомаркер активности заболевания при воспалительных заболеваниях кишечника у детей. Алимент Pharmacol Ther. 2011; 34 (8): 941–8.
- Пинто-Лопес П., Афонсу Дж., Пинто-Лопес Р., Роша С., Лаго П., Гонсалвес Р. и др.Дипептидилпептидаза 4 в сыворотке: показатель активности заболевания и прогноз при воспалительном заболевании кишечника. Воспаление кишечника. 2020.
- Ли Т., Чен Р.Р., Гонг Х.П., Ван Б.Ф., Ву XX, Чен YQ и др. FGL2 регулирует передачу сигналов IKK / NF-κB в эпителиальных клетках кишечника и дендритных клетках собственной пластинки для ослабления колита, вызванного декстрансульфатом натрия.Мол Иммунол. 2020; 117: 84–93.
- Станке-Лабеск Ф., Пофельски Дж., Моро-Годри А., Бессар Дж., Боназ Б. Экскреция лейкотриена Е4 с мочой: биомаркер активности воспалительного заболевания кишечника. Воспаление кишечника. 2008. 14 (6): 769–74.
- День А.С., Джадд Т., Лемберг Д.А., Лич СТ.Фекальный M2-PK у детей с болезнью Крона: предварительное сообщение. Dig Dis Sci. 2012; 57: 2166–70.
- Czub E, Herzig KH, Szaflarska-Popawska A, Kiehne K, Socha P, Woś H и др. Фекальная пируваткиназа: новый потенциальный маркер воспаления кишечника у детей с воспалительным заболеванием кишечника.Сканд Дж Гастроэнтерол. 2007. 42 (10): 1147–50.
- Сайто С., Като Дж., Хираока С., Хории Дж., Сузуки Х., Хигаши Р. и др. Метилирование ДНК слизистой оболочки толстой кишки у больных язвенным колитом: корреляция с воспалительным статусом. Воспаление кишечника. 2011. 17 (9): 1955–65.
- Тахара Т., Хирата И., Накано Н., Нагасака М., Накагава Ю., Шибата Т. и др.Комплексное профилирование метилирования ДНК воспалительной слизистой оболочки при язвенном колите. Воспаление кишечника. 2017; 23 (1): 165–73.
- Somineni HK, Venkateswaran S, Kilaru V, Marigorta UM, Mo A, Okou DT, et al. Признаки метилирования ДНК крови при болезни Крона и тяжести воспаления кишечника.Гастроэнтерология. 2019; 156 (8): 2254 – e3.
- Петерсон К.Г., Эклунд Э., Таха Ю., Рааб Ю., Карлсон М. Новый метод количественного определения катионных белков нейтрофилов и эозинофилов в кале: установление нормальных уровней и клиническое применение у пациентов с воспалительными заболеваниями кишечника.Am J Gastroenterol. 2002. 97 (7): 1755–62.
- Husain N, Tokoro K, Popov JM, Naides SJ, Kwasny MJ, Buchman AL. Концентрация неоптерина как показатель активности болезни при болезни Крона и язвенном колите. J Clin Gastroenterol. 2013. 47 (3): 246–51.
- Нэнси С., Боскетти Дж., Мусата Д., Котт Э., Пейрас Дж., Куэрк С. и др.Неоптерин — новый надежный фекальный маркер, не менее точный, чем кальпротектин, для прогнозирования активности эндоскопических заболеваний у пациентов с воспалительными заболеваниями кишечника. Воспаление кишечника. 2013; 19 (5): 1043–52.
- Нэнси С., Перре-Лиоде А., Муссата Д., Грабер И., Боскетти Г., Рено Б. и др.Неоптерин в моче — ценный инструмент для мониторинга активности болезни Крона. Воспаление кишечника. 2008. 14 (11): 1548–54.
- Thorsvik S, Damås JK, Granlund AV, Flo TH, Bergh K, Østvik AE, et al. Липокалин, связанный с желатиназой фекальных нейтрофилов, как биомаркер воспалительного заболевания кишечника.J Gastroenterol Hepatol. 2017; 32 (1): 128–35.
- Ойкономоу К.А., Капсоритакис А.Н., Теодориду С., Карангелис Д., Герменис А., Стефанидис И. и др. Липокалин, связанный с желатиназой нейтрофилов (NGAL) при воспалительном заболевании кишечника: связь с патофизиологией воспаления, установленными маркерами и активностью заболевания.J Gastroenterol. 2012; 47 (5): 519–30.
- de Bruyn M, Arijs I., De Hertogh G, Ferrante M, Van Assche G, Rutgeerts P, et al. Комплекс липокалина, ассоциированного с желатиназой B, и матриксной металлопротеиназы-9 в сыворотке крови в качестве суррогатного маркера заживления слизистой оболочки у пациентов с болезнью Крона.Колит Дж. Крона. 2015; 9 (12): 1079–87.
- Липпи Г., Санчис-Гомар Ф. Прокальцитонин при воспалительном заболевании кишечника: недостатки и возможности. Мир Дж. Гастроэнтерол. 2017; 23 (47): 8283–90.
- Ярур AJ, Quintero MA, Jain A, Czul F, Barkin JS, Abreu MT.Сывороточный амилоид а как суррогатный маркер слизистых оболочек и гистологического воспаления у пациентов с болезнью Крона. Воспаление кишечника. 2017; 23 (1): 158–64.
- Баба Р., Яширо К., Нагасако К., Обата Х. Значение сывороточной сиаловой кислоты у пациентов с болезнью Крона. Gastroenterol Jpn.1992. 27 (5): 604–10.
- Teng X, Yang Y, Liu L, Yang L, Wu J, Sun M и др. Оценка активности воспалительного заболевания кишечника у детей с использованием сывороточного пептида фактора трилистника. Pediatr Res. 2020.
- Нинг Л., Ли С., Гао Дж., Дин Л., Ван С., Чен В. и др.Уровень тенасцина-C увеличивается при воспалительном заболевании кишечника и связан с ответом на терапию инфликсимабом. Biomed Res Int. 2019; 2019: 1475705.
- Николаус С., Шульте Б., Аль-Массад Н., Тим Ф., Шульте Д.М., Бетге Дж. И др. Повышенный метаболизм триптофана связан с активностью воспалительных заболеваний кишечника.Гастроэнтерология. 2017; 153: 1504–16.
- Ким DJ, Jeoun YM, Lee DW, Koo JS, Lee SW. Полезность иммунохимического анализа кала и калпротектина для выявления активного язвенного колита. Intest Res. 2018; 16 (4): 563–70.
Автор Контакты
Габриэле Драгони
Отдел экспериментальных и клинических биохимических наук «Марио Серио»
Университет Флоренции, Виале Пьераччини 6
IT – 50139 Фиренце (Италия)
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 25 мая 2020 г.
Дата принятия: 16 сентября 2020 г.
Опубликована онлайн: 17 сентября 2020 г.
Дата выпуска: май 2021 г.
Количество страниц для печати: 14
Количество рисунков: 2
Количество столов: 2
ISSN: 0257-2753 (печатный)
eISSN: 1421-9875 (онлайн)
Для дополнительной информации: https: // www.karger.com/DDI
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Недоедание и ВЗК | Crohn’s & Colitis Foundation
Управление диетой и питанием имеет решающее значение при болезни Крона или язвенном колите.Мы можем помочь вам начать путь к более здоровой жизни, понимая, как воспалительное заболевание кишечника (ВЗК) влияет на питание вашего организма.
Болезнь Крона и язвенный колит могут повлиять на способность вашего организма правильно переваривать пищу и усваивать питательные вещества, что может привести к серьезному дефициту витаминов и недоеданию .
Продолжительность видео 00:02:06
Недоедание и ВЗК Воспалительные заболевания кишечника могут вызывать множество симптомов и осложнений, которые, если их не устранить, могут привести к дефициту питательных веществ и недоеданию.Смотрите и слушайте, чтобы узнать больше.
Недоедание и желудочно-кишечный тракт
Воспаление кишечника, осложнения, связанные с ВЗК, и некоторые лекарства могут затруднить соблюдение здорового питания. Например:
Воспаление тонкого кишечника может вызывать проблемы с перевариванием пищи и усвоением питательных веществ.
Воспаление толстой кишки (включая толстую и прямую кишку) может вызвать проблемы с усвоением воды и электролитов.
Признаки недоедания
Даже легкие случаи недоедания могут затруднить восстановление вашего организма после болезни. Признаки недоедания включают:
Недоедание и / или строгое ограничение разнообразия и типов потребляемых продуктов
Похудание
Общая усталость и низкая энергия
Слабость
Потеря мышечной массы
Витаминно-минеральная недостаточность
Причины недоедания
Помимо воспаления кишечника, общие симптомы болезни Крона и язвенного колита могут способствовать истощению.
Тяжелая диарея может вызвать обезвоживание, что означает, что в вашем организме может быть истощено жидкости, питательные вещества и необходимые электролиты, такие как натрий, калий, магний, фосфор и цинк. Это также может привести к потере веса.
Боль в животе и тошнота могут снизить аппетит, что затрудняет потребление достаточного количества калорий и питательных веществ.
Ректальное кровотечение из язв в кишечнике может привести к дефициту железа и анемии.
Частые испражнения могут привести к сокращению приема пищи, чтобы избежать диареи или частых походов в туалет. Недостаточное питание подвергает вас риску истощения.
В то время как лекарства являются распространенным и полезным лечением ВЗК, некоторые лекарства могут повлиять на вашу способность поддерживать здоровый статус питания:
Кортикостероиды , такие как преднизон, могут вызвать увеличение веса и повысить риск диабета.Длительное употребление также может вызвать снижение здоровой мышечной массы, а также прочности костей и кожи.
Сульфасалазин и метотрексат могут препятствовать всасыванию фолиевой кислоты, витамина, который способствует здоровому росту клеток.
Осложнения недоедания
Недоедание, связанное с ВЗК, может вызвать серьезные осложнения, если его не лечить и не устранить. Если вы подозреваете, что вы или ваш близкий страдаете от недоедания из-за болезни Крона или язвенного колита, как можно скорее запишется на прием к врачу.
Мальабсорбция
Нарушение всасывания затрудняет всасывание в тонком кишечнике необходимых питательных веществ, таких как белки, жиры, сахара, витамины и минералы. Это может быть вызвано воспалением кишечника.
Степень мальабсорбции зависит от того, какая часть тонкого кишечника поражена. Нарушение всасывания и дефицит питательных веществ часто становятся более значительными, если большие участки тонкой кишки воспалены или были удалены хирургическим путем.Если значительная часть подвздошной кишки или концевой части тонкой кишки воспаляется или удаляется, это может повлиять на всасывание жирорастворимых витаминов A, D, E, K и B12.
Пациенты с язвенным колитом могут иметь менее значительный дефицит питательных веществ, хотя тяжелая диарея и потеря крови могут вызвать потерю веса и анемию.
Стриктура
Стриктура — это сужение кишечника, образовавшееся в результате образования рубцовой ткани после повторяющихся циклов воспаления и заживления слизистой оболочки кишечника.Стриктуры могут затруднить прохождение переваренной пищи через кишечник и в конечном итоге могут привести к закупорке.
Продукты с высоким содержанием клетчатки , такие как свежие фрукты и овощи, могут застревать в суженном кишечнике, вызывая боль, вздутие живота или тошноту. Продукты с низким содержанием клетчатки или жидкие диеты. может потребоваться для уменьшения симптомов, если стриктура носит преимущественно воспалительный характер. Ваш врач также может прописать лекарства для уменьшения воспаления или порекомендовать операцию по восстановлению или удалению стриктуры.
Снижение прочности костей
Снижение прочности костей — частое осложнение у людей с ВЗК. Это увеличивает риск переломов.
Причины снижения прочности костей включают:
Плохое усвоение кальция
Дефицит витамина D
Пониженная физическая активность
Воспаление
Долгосрочное употребление некоторых лекарств, включая кортикостероиды
Задержки роста
Это осложнение может возникнуть у некоторых детей с ВЗК, страдающих хроническим воспалением и недоеданием, или у которых длительно принимают кортикостероиды.Примерно у одной трети детей с болезнью Крона и у одной десятой детей с язвенным колитом их конечный взрослый рост меньше ожидаемого из-за ВЗК.
Хорошие пищевые привычки, адекватное потребление калорий и контроль основного заболевания необходимы для минимизации негативного воздействия ВЗК на рост вашего ребенка. Проконсультируйтесь с лечащим врачом или диетологом, если ваш ребенок не придерживается типичной кривой роста. Может потребоваться оценить количество калорий и питательных веществ, потребляемых вашим ребенком.
Как избежать недоедания
Есть шаги, которые вы можете предпринять для поддержания здорового питания, даже если ваш рацион ограничен ВЗК.
Пройдите тест на дефицит витаминов и минералов, даже если у вас нет симптомов недоедания.
Избегайте продуктов, которые ухудшают ваши симптомы.
Совместно со своим лечащим врачом составьте список продуктов, которые могут помочь вам поддерживать сбалансированное питание.

 Включают бактериологические тесты на определение шигел, сальмонел, иерсиний, кампилобактера, клостридий (Cl. Difficile), туберкулезной палочки, дизентерийной амебы, различных гельминтов и паразитов.
Включают бактериологические тесты на определение шигел, сальмонел, иерсиний, кампилобактера, клостридий (Cl. Difficile), туберкулезной палочки, дизентерийной амебы, различных гельминтов и паразитов.