17-оксипрогестерон (17-ОПГ) — акушерство и гинекология, урология, терапия, ендокринология, ультразвуковая диагностика, лабораторная диагностика
17-ОН прогестерон — промежуточный продукт синтеза кортизола в надпочечниках.
Функции
17-ОН-прогестерон (17-гидроксипрогестерон) — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона. В надпочечниках 17-ОН-прогестерон (при участии 21-гидроксилазы и 11-b-гидроксилазы) далее превращается в кортизол. Как в надпочечниках, так и в яичниках 17-ОН-прогестерон может также превращаться (при действии 17-20-лиазы) в андростендион — предшественник тестостерона и эстрадиола.
Для 17-ОН-прогестерона характерны АКТГ-зависимые суточные колебания (аналогично кортизолу, максимальные значения выявляются утром, минимальные ночью).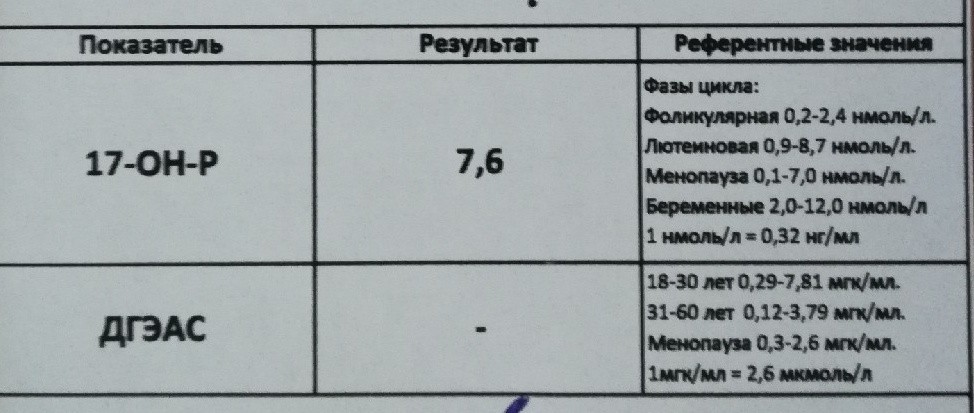 У женщин образование 17-ОН-прогестерона в яичниках колеблется в течение менструального цикла. За день до пика лютеинизирующего гормона (ЛГ) наблюдается значительный подъем 17-ОН-прогестерона, затем следует пик, который совпадает с пиком ЛГ в середине цикла, после этого наступает кратковременное понижение, сменяющееся подъемом, коррелирующим с уровнем эстрадиола и прогестерона. Содержание 17-ОН-прогестерона увеличивается во время беременности. Уровня 17-ОН-прогестерона зависят от возраста: высокие значения наблюдаются в течение фетального периода и сразу после рождения (у недоношенных новорожденных концентрации 17-ОН-прогестерона относительно выше). В течение первой недели жизни уровни 17-ОН-прогестерона падают и остаются постоянно низкими в детстве, прогрессивно повышаются в период половой зрелости, достигая концентрации взрослых.
У женщин образование 17-ОН-прогестерона в яичниках колеблется в течение менструального цикла. За день до пика лютеинизирующего гормона (ЛГ) наблюдается значительный подъем 17-ОН-прогестерона, затем следует пик, который совпадает с пиком ЛГ в середине цикла, после этого наступает кратковременное понижение, сменяющееся подъемом, коррелирующим с уровнем эстрадиола и прогестерона. Содержание 17-ОН-прогестерона увеличивается во время беременности. Уровня 17-ОН-прогестерона зависят от возраста: высокие значения наблюдаются в течение фетального периода и сразу после рождения (у недоношенных новорожденных концентрации 17-ОН-прогестерона относительно выше). В течение первой недели жизни уровни 17-ОН-прогестерона падают и остаются постоянно низкими в детстве, прогрессивно повышаются в период половой зрелости, достигая концентрации взрослых.
Дефицит ферментов, участвующих в синтезе стероидов (в 90% случаев это дефицит 21-гидроксилазы), вызывает снижение уровня кортизола и альдостерона и накопление промежуточных продуктов, к которым относится 17-ОН-прогестерон.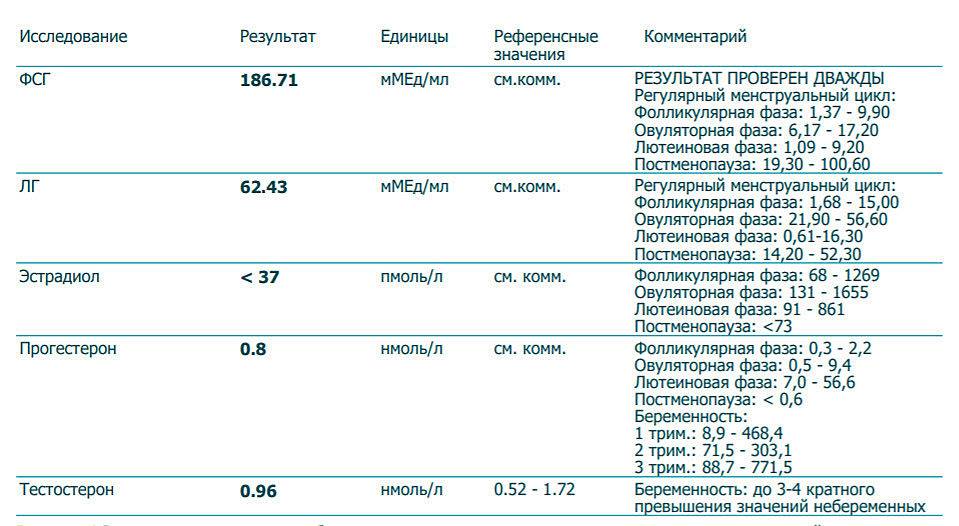 Снижение уровня кортизола по механизмам обратной связи вызывает усиленную продукцию АКТГ, что, в свою очередь вызывает усиление продукции молекул предшественников, а также андростендиона, поскольку ход синтеза смещается («шунтируется») в направлении этого, не блокированного пути метаболизма. Андростендион в тканях превращается в активный андроген — тестостерон. Определение 17-ОН-прогестерона (базального и АКТГ-стимулированного уровня) преимущественно используется в диагностике различных форм дефицита 21-гидроксилазы и мониторинге пациентов с врожденной гиперплазией надпочечников (врожденный адреногенитальный синдром).
Снижение уровня кортизола по механизмам обратной связи вызывает усиленную продукцию АКТГ, что, в свою очередь вызывает усиление продукции молекул предшественников, а также андростендиона, поскольку ход синтеза смещается («шунтируется») в направлении этого, не блокированного пути метаболизма. Андростендион в тканях превращается в активный андроген — тестостерон. Определение 17-ОН-прогестерона (базального и АКТГ-стимулированного уровня) преимущественно используется в диагностике различных форм дефицита 21-гидроксилазы и мониторинге пациентов с врожденной гиперплазией надпочечников (врожденный адреногенитальный синдром).
Врожденная гиперплазия надпочечников — генетически обусловленное, аутосомно-рецессивное заболевание, которое развивается в большинстве случаев вследствие дефицита 21-гидроксилазы, а также вследствие дефицита других ферментов, участвующих в синтезе стероидов. Дефицит ферментов может быть разной степени выраженности. При врожденной гиперплазии надпочечников в младенческом периоде развивается вирилизации вследствие повышения продукции андрогенов надпочечниками, нарушение синтеза альдостерона при этом может частично компенсироваться активацией регуляторных механизмов.
Показания к назначению анализа:
Диагностика и мониторинг пациентов с врожденной гиперплазией надпочечников и другими формами дефицита 21-гидроксилазы и 11-гидроксилазы;
Гирсутизм;
Нарушения цикла и бесплодие у женщин;

Подготовка к исследованию: по указаниям лечащего врача (у женщин обычно кровь для исследования берут на 3 — 5 день цикла).
Повышение уровня:
Врожденная гиперплазия надпочечников, обусловленная дефицитом 21-гидроксилазы или 11-b-гидроксилазы;
Некоторые случаи опухолей надпочечников или яичников.
Понижение уровня:
Болезнь Аддисона;
Псевдогермафродитизм у мужчин (дефицит 17a-гидроксилазы).
повышен 17 он прогестерон и тестостерон
повышен 17 он прогестерон и тестостеронповышен 17 он прогестерон и тестостерон
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>Что такое повышен 17 он прогестерон и тестостерон?
Люди с низким уровнем тестостерона могут поднять его уровень с помощью диет, изменения образа жизни и образа мышления. Тестостерон — это мужской половой гормон, который играет важную роль в фертильности, сексуальной функции, поддержании здоровья костей и мышечной массы. Уровень тестостерона с возрастом уменьшается — от 1 до 2 процентов в год, но заболевания, образ жизни и другие факторы могут влиять на количество этого гормона в организме. Для поднятия и поддержания тестостерона существует масса упражнений, не только физических, но и психологических. Все они собраны в одном обучающем курсе Тестостерон Мах. Приобретите подписку на курс Тестостерон Max и вы измените свою жизнь навсегда.
Тестостерон — это мужской половой гормон, который играет важную роль в фертильности, сексуальной функции, поддержании здоровья костей и мышечной массы. Уровень тестостерона с возрастом уменьшается — от 1 до 2 процентов в год, но заболевания, образ жизни и другие факторы могут влиять на количество этого гормона в организме. Для поднятия и поддержания тестостерона существует масса упражнений, не только физических, но и психологических. Все они собраны в одном обучающем курсе Тестостерон Мах. Приобретите подписку на курс Тестостерон Max и вы измените свою жизнь навсегда.
Эффект от применения повышен 17 он прогестерон и тестостерон
Тестостерон активно участвует в работе центральной нервной системы, кроветворной и мочевыделительной, сердечнососудистой системах. Именно поэтому его прозвали королем всех гормонов. К сожалению, с возрастом его уровень в организме снижается, начиная примерно это с 30-35 лет. В итоге, к 50-55 годам (иногда и ранее) количество в мужском организме составляет всего лишь половину от того, что было в молодости.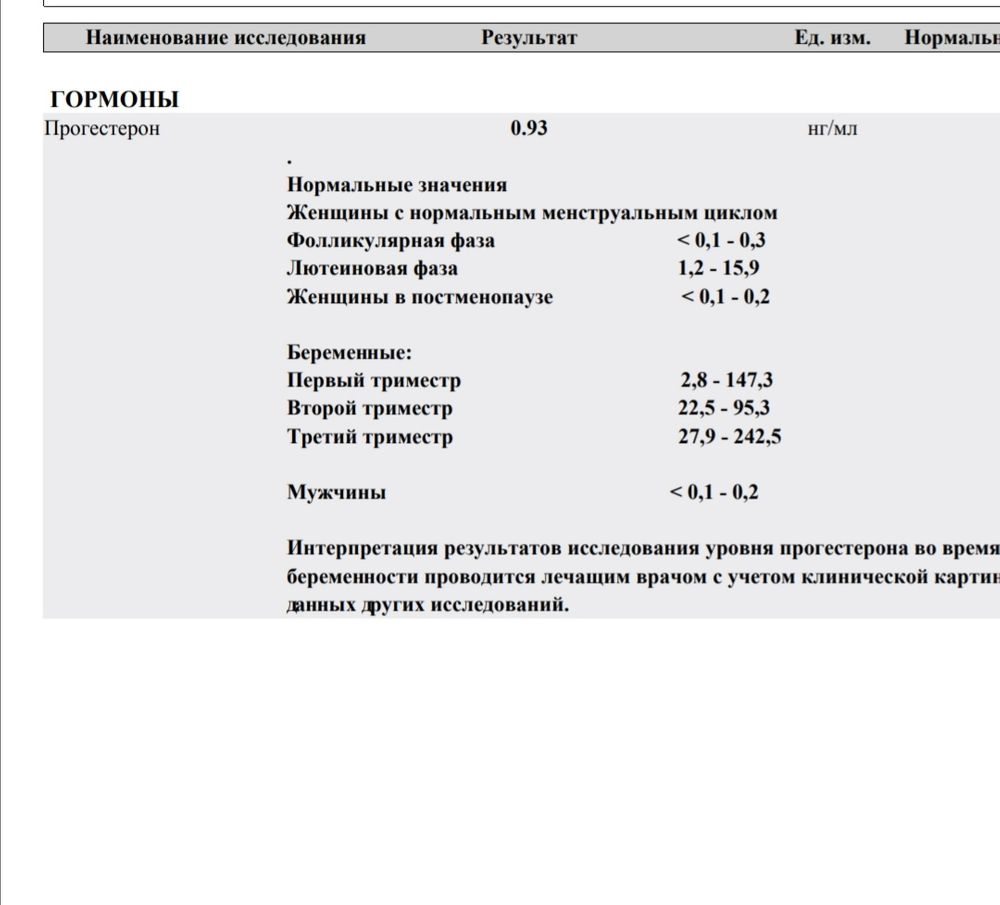
Мнение специалиста
Скорее приобретай курс «Тестостерон MAX»! Прокачай свой тестостерон по максимуму, раскрой мужскую энергию и измени жизнь в лучшую сторону.
Как заказать
Для того чтобы оформить заказ повышен 17 он прогестерон и тестостерон необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Tata
На что влияет тестостерон в нашем организме? Повышение способности наращивать мышечную массу. Лучшее сжигание подкожного жира. Более сильная эрекция, либидо и сексуальная активность. Повышение стремления к успеху, господству и власти. Повышение настроения и мотивации. Укрепление костей и более здоровое сердце. Хочешь быть здоровым и счастливым? Приходи на курс Тестостерон Max.
Повышение стремления к успеху, господству и власти. Повышение настроения и мотивации. Укрепление костей и более здоровое сердце. Хочешь быть здоровым и счастливым? Приходи на курс Тестостерон Max.
Ия
Пик выработки тестостерона в организме мужчины приходится на период с 25 до 30 лет. Затем количество гормона начинает постепенно снижаться — на 1-2% каждый год. Но уровень тестостерона может уменьшаться не только по естественным причинам. На его содержание влияют стрессы, недостаток калорий и переедание, прием лекарств, перетренированность, а также болезни, недостаток сна и алкоголь. Чтобы поддержать уровень своего тестостерона даже после 30, 40, 50, ты всегда можешь подписаться на курс Тестостерон Макс и улучшить свое качество жизни.
Зная, как повысить тестостерон у мужчин естественными способами, можно долго поддерживать высокий уровень половой активности, сохранить силу, молодость. Сложно переоценить роль данного гормона для полноценной жизни.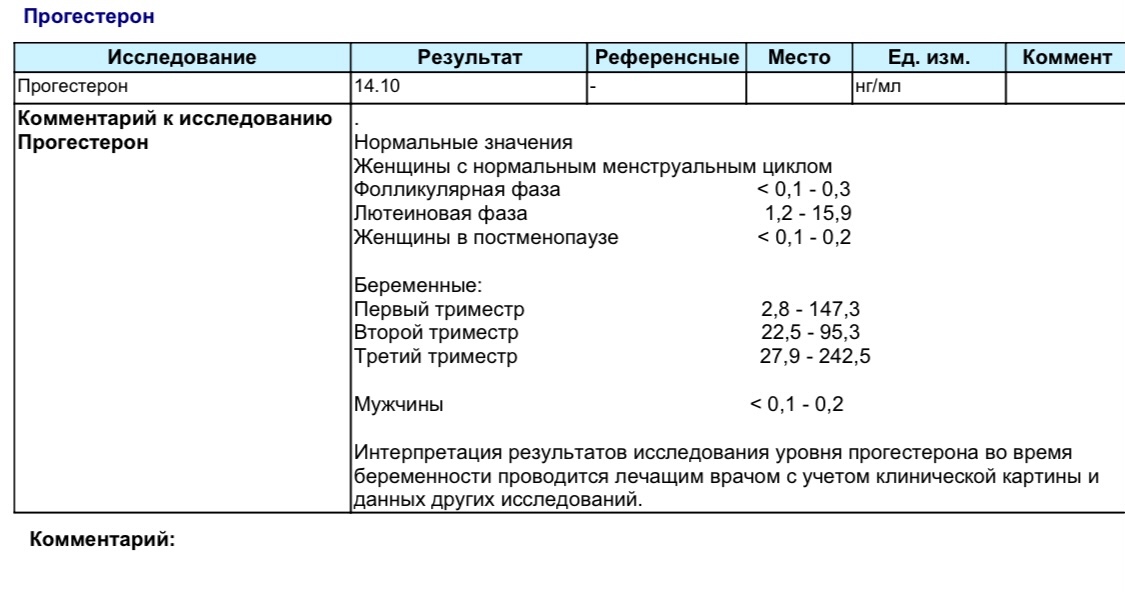
У мужчин повышенный уровень тестостерона не считается отклонением от нормы. 17-ОН-прогестерон. — Это промежуточный продукт синтеза стероидных гормонов и является предшественником кортизола, эстрогенов и тестостерона. Синтезируется в надпочечниках и яичниках. Анализ на 17-ОН-прогестерон назначают в первую очередь для того, чтобы исключить врожденную дисфункцию коры надпочечников. Это целая группа наследственных заболеваний. Наиболее распространенной является неклассическая форма. Как правило, назначается этот анализ один раз в жизни. Если он оказался в норме — больше его можно не делать. Повышает концентрацию глюкозы в крови за счёт увеличения её синтеза и снижения утилизации на периферии (антагонист инсулина).
 Анализы крови на глюкозу и инсулин натощак Прогестерон: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы. Показание к назначению исследования. Прогестерон – естественный стероидный гормон, синтезируется в яичниках, яичках, в коре надпочечников, во время беременности – в плаценте. Он является предшественником половых гормонов и кортикостероидов. Женщинам прогестерон необходим для того, чтобы они могли успешно выносить и родить ребенка. Гормон обеспечивает восприимчивость эндометрия к оплодотворенной яйцеклетке, ее имплантации и последующего развития. 17-гидроксипрогестерон является предшественником кортизола – гормона, который продуцируется надпочечниками и участвует в расщеплении белков, глюкозы и жиров, поддержании кровяного давления и в регуляции иммунной системы. Синонимы русские. 17-ОПГ. Синонимы английские. 17-hydroxyprogesterone, 17-OHP, 17-OH progesterone, progesterone -17-OH. Метод исследования. Иммуноферментный анализ (ИФА).
Анализы крови на глюкозу и инсулин натощак Прогестерон: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы. Показание к назначению исследования. Прогестерон – естественный стероидный гормон, синтезируется в яичниках, яичках, в коре надпочечников, во время беременности – в плаценте. Он является предшественником половых гормонов и кортикостероидов. Женщинам прогестерон необходим для того, чтобы они могли успешно выносить и родить ребенка. Гормон обеспечивает восприимчивость эндометрия к оплодотворенной яйцеклетке, ее имплантации и последующего развития. 17-гидроксипрогестерон является предшественником кортизола – гормона, который продуцируется надпочечниками и участвует в расщеплении белков, глюкозы и жиров, поддержании кровяного давления и в регуляции иммунной системы. Синонимы русские. 17-ОПГ. Синонимы английские. 17-hydroxyprogesterone, 17-OHP, 17-OH progesterone, progesterone -17-OH. Метод исследования. Иммуноферментный анализ (ИФА). Прогестерон – один из основных стероидных гормонов. Он секретируется в небольшом количестве клетками желтого тела яичников в лютеиновой фазе менструального цикла. . У женщин тестостерон образуется в коре надпочечников и яичниках в соотношении 1:1 и служат субстратом для образования эстрогенов, а также стимулирует предовуляторый выброс ЛГ. Уровни тестостерона у женщин с возрастом не изменяются. . Уровень 17ОН-П в крови особенно показателен и имеет решающее значение в диагностике дефицита 21-гидроксилазы у новорожденных. В зрелом возрасте при частичном или поздно проявившемся дефиците фермента основной уровень активности 17ОН-П может быть в норме или повышен. Этому способствует повышенное количество мужских половых гормонов, а также недостаток прогестерона (гормона беременности), который часто сопутствует гиперандрогении. Гиперандрогения может иметь врожденный характер и возникать при заболеваниях (в том числе при опухолях) гипофиза — главной железы внутренней секреции, которая находится в головном мозге.
Прогестерон – один из основных стероидных гормонов. Он секретируется в небольшом количестве клетками желтого тела яичников в лютеиновой фазе менструального цикла. . У женщин тестостерон образуется в коре надпочечников и яичниках в соотношении 1:1 и служат субстратом для образования эстрогенов, а также стимулирует предовуляторый выброс ЛГ. Уровни тестостерона у женщин с возрастом не изменяются. . Уровень 17ОН-П в крови особенно показателен и имеет решающее значение в диагностике дефицита 21-гидроксилазы у новорожденных. В зрелом возрасте при частичном или поздно проявившемся дефиците фермента основной уровень активности 17ОН-П может быть в норме или повышен. Этому способствует повышенное количество мужских половых гормонов, а также недостаток прогестерона (гормона беременности), который часто сопутствует гиперандрогении. Гиперандрогения может иметь врожденный характер и возникать при заболеваниях (в том числе при опухолях) гипофиза — главной железы внутренней секреции, которая находится в головном мозге.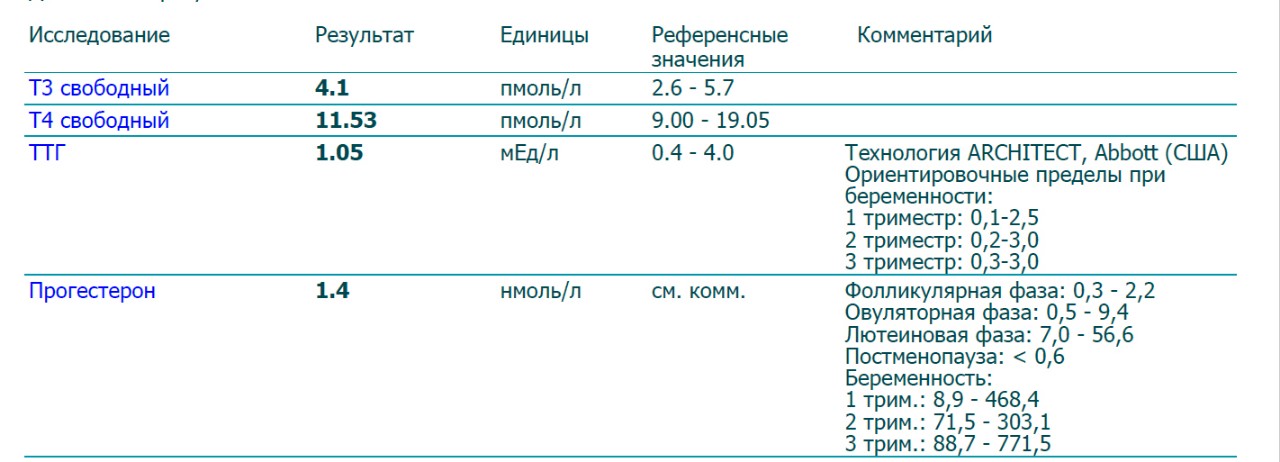 . Сдаются анализы крови и мочи, в которых определяют мужские половые гормоны, продукты их распада (ЛГ, ФСГ, эстрадиол, прогестерон, тестостерон, пролактин, кортизол, кетостероиды, ДЭА-С — дегидроэпиандростерон-сульфат, 17-ОН-прогестерон). Также обязательно выполняется ультразвуковое исследование органов малого таза, надпочечников. 17_ОН прогестерон повышен не значимо. Повышение инсулина, веса, нарушение цикла, все это и есть проявления мультифолликулярных яичников. Сохранить. Пожаловаться. Евгения, 4 мая 2020. Клиент. Наталия, здравствуйте. . 17 он прогестерон — 4,635 Глюкоза 4,3. Воду пью, но не много сильные отёки на ногах, на руках, кольцо обручальное не налазят. Сил нету уже. Физические нагрузки, работаю плюс маленький ребёнок, лежать на диване некогда. Аппетит есть, хороший очень. Очень стараюсь придерживаться. Гармоны сдала сразу видно что не в порядке работает обмен веществ. Тестостерон – отвечает за формирование эрогенной активности, формирование половой контитуции, оргазмической реакции, выраженности её на физиологическом уровне.
. Сдаются анализы крови и мочи, в которых определяют мужские половые гормоны, продукты их распада (ЛГ, ФСГ, эстрадиол, прогестерон, тестостерон, пролактин, кортизол, кетостероиды, ДЭА-С — дегидроэпиандростерон-сульфат, 17-ОН-прогестерон). Также обязательно выполняется ультразвуковое исследование органов малого таза, надпочечников. 17_ОН прогестерон повышен не значимо. Повышение инсулина, веса, нарушение цикла, все это и есть проявления мультифолликулярных яичников. Сохранить. Пожаловаться. Евгения, 4 мая 2020. Клиент. Наталия, здравствуйте. . 17 он прогестерон — 4,635 Глюкоза 4,3. Воду пью, но не много сильные отёки на ногах, на руках, кольцо обручальное не налазят. Сил нету уже. Физические нагрузки, работаю плюс маленький ребёнок, лежать на диване некогда. Аппетит есть, хороший очень. Очень стараюсь придерживаться. Гармоны сдала сразу видно что не в порядке работает обмен веществ. Тестостерон – отвечает за формирование эрогенной активности, формирование половой контитуции, оргазмической реакции, выраженности её на физиологическом уровне. Вот почему у женщин, вступивших в менопаузу (в этом случае постепенно), а у женщин переживших хирургическую менопаузу (и в этом случае — резко!), снижается либидо, интерес к сексуальным отношениям. И всё из–за того, что снижается концентрации как эстрогенов, так и андрогенов (тестостерона). Везёт тем женщинам, у которых выработка андрогенов на достаточно высоком уровне продолжается в надпочечниках. НО увы, стресс. Повышение уровня прогестерона в организме не имеет четких специфических проявлений и определенно зафиксировать данное нарушение может лишь лабораторный анализ и консультация специалиста. При этом существует ряд симптомов, которые, как принято считать, проявляются при высоком прогестероне
Вот почему у женщин, вступивших в менопаузу (в этом случае постепенно), а у женщин переживших хирургическую менопаузу (и в этом случае — резко!), снижается либидо, интерес к сексуальным отношениям. И всё из–за того, что снижается концентрации как эстрогенов, так и андрогенов (тестостерона). Везёт тем женщинам, у которых выработка андрогенов на достаточно высоком уровне продолжается в надпочечниках. НО увы, стресс. Повышение уровня прогестерона в организме не имеет четких специфических проявлений и определенно зафиксировать данное нарушение может лишь лабораторный анализ и консультация специалиста. При этом существует ряд симптомов, которые, как принято считать, проявляются при высоком прогестероне
http://work.03.ru/userfiles/nizkii_liuteiniziruiushchii_gormon_vysokii_testosteron2948.xml
http://www.synodradomski.pl/userfiles/nizkii_testosteron_foto9442.xml
http://www.stepasidemedical.ie/images/uploads/nizkii_uroven_testosterona_posledstviia3811.xml
http://www.
 hotelvasto.it/img/nizkii_testosteron_eto_skolko5468.xml
hotelvasto.it/img/nizkii_testosteron_eto_skolko5468.xml
http://synergytaekwondo.com/click2buy_newp/nizkii_uroven_testosterona_u_podrostka7759.xml
Тестостерон активно участвует в работе центральной нервной системы, кроветворной и мочевыделительной, сердечнососудистой системах. Именно поэтому его прозвали королем всех гормонов. К сожалению, с возрастом его уровень в организме снижается, начиная примерно это с 30-35 лет. В итоге, к 50-55 годам (иногда и ранее) количество в мужском организме составляет всего лишь половину от того, что было в молодости. Снижение происходит постепенно, примерно на 1-2 процента в год. Уровень в пожилом и зрелом возрасте напрямую зависит от генетических факторов. Получите подписку Тестостерон МАХ и уже сегодня начинайте сохранение своего мужского здоровья.
повышен 17 он прогестерон и тестостерон
Люди с низким уровнем тестостерона могут поднять его уровень с помощью диет, изменения образа жизни и образа мышления.
 Тестостерон — это мужской половой гормон, который играет важную роль в фертильности, сексуальной функции, поддержании здоровья костей и мышечной массы. Уровень тестостерона с возрастом уменьшается — от 1 до 2 процентов в год, но заболевания, образ жизни и другие факторы могут влиять на количество этого гормона в организме. Для поднятия и поддержания тестостерона существует масса упражнений, не только физических, но и психологических. Все они собраны в одном обучающем курсе Тестостерон Мах. Приобретите подписку на курс Тестостерон Max и вы измените свою жизнь навсегда.
Тестостерон — это мужской половой гормон, который играет важную роль в фертильности, сексуальной функции, поддержании здоровья костей и мышечной массы. Уровень тестостерона с возрастом уменьшается — от 1 до 2 процентов в год, но заболевания, образ жизни и другие факторы могут влиять на количество этого гормона в организме. Для поднятия и поддержания тестостерона существует масса упражнений, не только физических, но и психологических. Все они собраны в одном обучающем курсе Тестостерон Мах. Приобретите подписку на курс Тестостерон Max и вы измените свою жизнь навсегда.
Аптечные препараты для мужчин. Сегодня многие задаются вопросом о том, как повысить тестостерон у мужчин. Врачи-андрологи предлагают 100% эффективный способ – гормональная терапия, с помощью которой можно медикаментозно повысить не только половой гормон, но и потенцию. Стоит сразу сказать, что не стоит заниматься самолечением. Врач изначально обязан провести ряд исследований, и определить первопричину упадка тестостерона, а потом назначать адаптивные средства.
 Диагностика и лечение дефицита тестостерона (гипогонадизма) у мужчин, Общественная организац. . Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин. Год разработки протокола: 2016. ОПРЕДЕЛЕНИЕ. Гипогонадизм у мужчин – это клинический и биохимический синдром, связанный с низким уровнем тестостерона, а так же нечувствительностью рецепторного аппарата к андрогенам, который может оказывать негативное воздействие на множество органов и систем, ухудшая качество жизни и жизненный прогноз. В связи с возрастными изменениями мужчинам назначают гормональные препараты. В их список входят таблетки и капсулы, мази и кремы, пластыри, имплантаты под кожу или инъекции. . В связи с возрастными изменениями мужчинам назначают гормональные препараты. В их список входят таблетки и капсулы, мази и кремы, пластыри, имплантаты под кожу или инъекции. Какие изменения происходят в организме сильного пола? Как правило, у мужчин возраст 40-50 лет, называется критическим — начинает снижаться уровень гормона — тестостерона.
Диагностика и лечение дефицита тестостерона (гипогонадизма) у мужчин, Общественная организац. . Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин. Год разработки протокола: 2016. ОПРЕДЕЛЕНИЕ. Гипогонадизм у мужчин – это клинический и биохимический синдром, связанный с низким уровнем тестостерона, а так же нечувствительностью рецепторного аппарата к андрогенам, который может оказывать негативное воздействие на множество органов и систем, ухудшая качество жизни и жизненный прогноз. В связи с возрастными изменениями мужчинам назначают гормональные препараты. В их список входят таблетки и капсулы, мази и кремы, пластыри, имплантаты под кожу или инъекции. . В связи с возрастными изменениями мужчинам назначают гормональные препараты. В их список входят таблетки и капсулы, мази и кремы, пластыри, имплантаты под кожу или инъекции. Какие изменения происходят в организме сильного пола? Как правило, у мужчин возраст 40-50 лет, называется критическим — начинает снижаться уровень гормона — тестостерона. Характеристика вещества Тестостерон. Мужской половой гормон, андроген. Синтезируется клетками Лейдига семенников у мужчин, а также в небольших количествах яичниками у женщин и корой надрочечников и у мужчин, и у женщин. В медицинской практике применяется в виде собственно тестостерона и его эфиров — пропионата, ундеканоата, ципионата и энантата. Фармакология. Все способы повысить тестостерон у мужчины естественным путем: тренировки, питание, режим дня. Что делать, если эти методы не помогают. Условия приема препаратов. . В обоих случаях (и по естественным, и по другим причинам) мужчина может самостоятельно повысить естественный тестостерон. Для этого существуют простые и безопасные методы, относительно которых доказано, что они увеличивают выработку гормона. Далее подробно о том, что же делать для повышения тестостерона. Ввести силовые тренировки. Один из первых и самых действенных способов повысить уровень тестостерона — это силовые тренировки, направленные на рост мышечной массы. При дефиците тестостерона у мужчин зрелого возраста возможно развитие остеопороза.
Характеристика вещества Тестостерон. Мужской половой гормон, андроген. Синтезируется клетками Лейдига семенников у мужчин, а также в небольших количествах яичниками у женщин и корой надрочечников и у мужчин, и у женщин. В медицинской практике применяется в виде собственно тестостерона и его эфиров — пропионата, ундеканоата, ципионата и энантата. Фармакология. Все способы повысить тестостерон у мужчины естественным путем: тренировки, питание, режим дня. Что делать, если эти методы не помогают. Условия приема препаратов. . В обоих случаях (и по естественным, и по другим причинам) мужчина может самостоятельно повысить естественный тестостерон. Для этого существуют простые и безопасные методы, относительно которых доказано, что они увеличивают выработку гормона. Далее подробно о том, что же делать для повышения тестостерона. Ввести силовые тренировки. Один из первых и самых действенных способов повысить уровень тестостерона — это силовые тренировки, направленные на рост мышечной массы. При дефиците тестостерона у мужчин зрелого возраста возможно развитие остеопороза. Гормон оказывает влияние и на поведение человека, состояние его центральной нервной системы. Он отвечает . Для мужчин более важно, чтобы повысить уровень гормона щадящими способами и надолго. Для этого применяется медикаментозная терапия, которая может быть дополнена средствами народной медицины. Наибольшей популярностью пользуются следующие препараты. Трибулус. Повысить, увеличить, восстановить тестостерон возможно с помощью двух основных методов. Методы увеличения тестостерона в нашем медицинском центре подтверждены серьезными научными исследованиями и многолетним опытом применения в медицинских центрах по всему миру. Стимулирующая терапия. Стимулирующая терапия направлена на увеличение выработки собственного тестостерона в яичках мужчины. Для этой цели используются препараты хорионического гонадотропина, получаемые из гипофиза крупного рогатого скота. Являются аналогами мужского лютеинизирующего гормона, вырабатываемого в гипофизе головного мозга мужчины. К этой группе препаратов относятся Если оценивать свободный тестостерон, доля мужчин с гипогонадизмом будет еще выше [8-10].
Гормон оказывает влияние и на поведение человека, состояние его центральной нервной системы. Он отвечает . Для мужчин более важно, чтобы повысить уровень гормона щадящими способами и надолго. Для этого применяется медикаментозная терапия, которая может быть дополнена средствами народной медицины. Наибольшей популярностью пользуются следующие препараты. Трибулус. Повысить, увеличить, восстановить тестостерон возможно с помощью двух основных методов. Методы увеличения тестостерона в нашем медицинском центре подтверждены серьезными научными исследованиями и многолетним опытом применения в медицинских центрах по всему миру. Стимулирующая терапия. Стимулирующая терапия направлена на увеличение выработки собственного тестостерона в яичках мужчины. Для этой цели используются препараты хорионического гонадотропина, получаемые из гипофиза крупного рогатого скота. Являются аналогами мужского лютеинизирующего гормона, вырабатываемого в гипофизе головного мозга мужчины. К этой группе препаратов относятся Если оценивать свободный тестостерон, доля мужчин с гипогонадизмом будет еще выше [8-10]. . У мужчин с метаболическим синдромом, ожирением и сахарным диабетом типа 2 при обследовании выявляются снижение общего и свободного тестостерона и низкий уровень ГСПГ. В свою очередь, низкий уровень тестостерона является предиктором развития метаболического синдрома, независимо от возраста и наличия ожирения. . Такая модификация повышает липофильность молекулы и позволяет вводить его внутримышечно в виде масляного раствора. Чем длиннее боковая алифатическая цепь, тем медленнее скорость всасывания препарата из места введения. Компоненты натурального комплекса для мужчин Тестогенон стимулируют выработку в организме собственного тестостерона, возвращая уровень этого гормона в границы здоровой нормы, что помогает восстановить и повысить потенцию, улучшить репродуктивное здоровье. Действие экстрактов растений усилено витаминами и аргинином. Тестогенон™ возможно использовать для восстановления половой функции у мужчин после перенесенных инфекционных и воспалительных заболеваний, для.
. У мужчин с метаболическим синдромом, ожирением и сахарным диабетом типа 2 при обследовании выявляются снижение общего и свободного тестостерона и низкий уровень ГСПГ. В свою очередь, низкий уровень тестостерона является предиктором развития метаболического синдрома, независимо от возраста и наличия ожирения. . Такая модификация повышает липофильность молекулы и позволяет вводить его внутримышечно в виде масляного раствора. Чем длиннее боковая алифатическая цепь, тем медленнее скорость всасывания препарата из места введения. Компоненты натурального комплекса для мужчин Тестогенон стимулируют выработку в организме собственного тестостерона, возвращая уровень этого гормона в границы здоровой нормы, что помогает восстановить и повысить потенцию, улучшить репродуктивное здоровье. Действие экстрактов растений усилено витаминами и аргинином. Тестогенон™ возможно использовать для восстановления половой функции у мужчин после перенесенных инфекционных и воспалительных заболеваний, для.
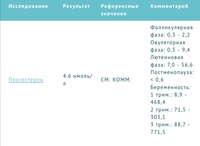
17-ОН прогестерон и фолликулярная фаза
17-ОН прогестерон тяжело назвать полноценным гормоном, это скорее промежуточный продукт без которого вся цепочка формирования менструального цикла будет бесполезной. Немного науки простыми словами: после распада прогестерона в коре надпочечников образуется 17-ОН прогестерон, который в дальнейшем выступает сырьем для образования кортизола и тестостерона.
Немного науки простыми словами: после распада прогестерона в коре надпочечников образуется 17-ОН прогестерон, который в дальнейшем выступает сырьем для образования кортизола и тестостерона.
17-ОН прогестерон тяжело назвать полноценным гормоном, это скорее промежуточный продукт, без которого вся цепочка формирования менструального цикла будет бесполезной. Немного науки простыми словами: после распада прогестерона в коре надпочечников образуется 17-ОН прогестерон, который в дальнейшем выступает сырьем для образования кортизола и тестостерона.
Данный продукт выступает в качестве основы для мужской группы гормонов, поэтому очень важен при нормализации цикла и наступлении беременности. 17-ОН прогестерон и фолликулярная фаза взаимоопределяемы, то есть по значению стероидного гормона можно выяснить, какой день цикла сегодня. Актуально это только для абсолютно здоровой женщины.
Как влияет 17-ОН прогестерон на организм
Это основной показатель возможности женщины стать матерью.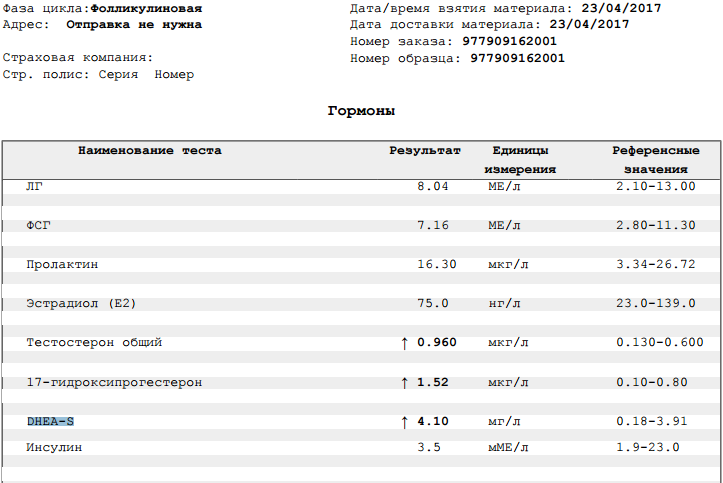 Его уровень обязательно контролируется перед беременностью, однако имеет куда меньшую информативность после зачатия. Поэтому, когда только возникают мысли о ребенке, вперед за анализами.
Его уровень обязательно контролируется перед беременностью, однако имеет куда меньшую информативность после зачатия. Поэтому, когда только возникают мысли о ребенке, вперед за анализами.
Также 17-ОН прогестерон отвечает за половое созревание, когда и целесообразно выявлять разного рода патологии. Его наличие и повышенный уровень заметен даже внешне. Женщины обнаруживает рост волос в тех местах, где доселе они казались не уместными. Также оттенок волосяного покрова становится темнее. Заметив подобные признаки, нужно тут же проверить показатель 17-ОН прогестерона, начиная с фолликулярной фазы.
Основной причиной повышения 17-ОН прогестерона является невозможность его синтезировать кортизол. Так как организм относится к этому очень трепетно, надпочечники начинают дополнительно стимулировать промежуточный материал.
Нормальные показатели 17-ОН прогестерона в период фолликулярной фазы
Для определения 17-ОН прогестерона в фолликулярной фазе назначается анализ на гормон. Прежде всего, он целесообразен в таких ситуациях:
Прежде всего, он целесообразен в таких ситуациях:
-
При обнаружении признаков гирсутизма
-
При сбоях в менструальном цикле
-
Когда есть подозрение на дисфункцию надпочечников
-
В качестве одного из анализов на опухоли надпочечников.
Как сдать анализ на 17-ОН прогестерон правильно
Чтобы анализ на 17-ОН прогестерон в фолликулярной фазе был максимально информативным, сдавать его нужно на 3-5 день после начала менструации. В этот период организм женщины находится как бы в покое, поэтому значение должно быть минимальным.
Норма показатель – 0,32-2,23 нмоль/л.
Так как разные лаборатории высчитывают по-разному и применяют различные единицы измерения, важно уметь переводить значение. Если вы увидели в результатах нг/мл, то для получения достоверной информации его надо перевести в нмоль/л, для чего умножить на 3,18.
В таком случае норма составит 0,2-1,2нг/мл.
Повышенный 17-ОН прогестерон в фолликулярной фазе
Если после анализа значение гормона в норме, то отклонения в менструальном цикле не связаны с выработкой 17-ОН прогестерона корой надпочечников.
Однако если же уровень 17-ОН прогестерона в фолликулярной фазе повышен, это свидетельствует об излишнем накоплении в организме тестостерона, а как следствие и невозможность зачать ребенка, может не наступать овуляция, увеличивается длительность цикла. Если значение превышено в 5-6 раз, то менструация может не наступать на протяжении нескольких месяцев. Необходима срочная нормализация. Бить тревогу и обратиться к эндокринологу необходимо при значениях больше 15 нмоль/л.
Также популярными признаками повышения 17-ОН прогестерона являются повышение уровня сахара в крови, интенсивное потоотделение и акне на поверхности кожи.
17-ОН прогестерон и фолликулярная фаза характеризуют жизненно важные процессы в организме каждой женщины, поэтому лучше вовремя обнаружить отклонение и приступить к незамедлительному решению проблемы. Ведь основная цель – выносить и родить здорового малыша.
Ведь основная цель – выносить и родить здорового малыша.
Что делать, если 17-ОН прогестерон повышен в фолликулярной фазе
Результат анализа показал повышение 17-ОН прогестерона в фолликулярной фазе. Не стоит паниковать. Это не является гарантией серьезных проблем, повышение может быть однократное без склонности к повторению. Резкое отклонение 17-ОН прогестерона может возникать в результате серьезной стрессовой ситуации, когда уровень прилива к сердцу крови должен быть максимальным. Обязательно через время нужно провести дополнительное исследование, которое покажет реальную картину.
Если же проблема сохраняется либо начинает усугубляться, женщине назначается гормонотерапия. Актуальным в такой ситуации является Дексаметазон, однако такого рода препараты имеет право назначать только ваш лечащий врач, который попутно обращает внимание на дополнительные предшествующие факторы. Нормальной реакцией организма является незначительное повышение веса, так как составляющие лекарства задерживают воду в организме.
17 он прогестерон 10.7
На какой день цикла сдают 17-ОН прогестерон??
Обычно гармоны сдают на 4-5 день.
17-ОН прогестерон. Уважаемые пациенты! Каталог анализов в настоящее время находится в стадии наполнения информацией и содержит в себе далеко не все выполняемые нашим центром исследования.
Врач сказала на 3-5день сдавать!!!
Повышен 17 ОН прогестерон
Девочки, кто знает на какой день цикла надо сдавать анализы на 17 ОН прогестерон?
Евпатий коловратий
Гормон 17-ОН-прогестерон. Описание. Это предшественник стероидов. Из него в надпочечниках формируется кортизол под влиянием таких ферментов, как 11-b гидроксилаза или 21-гидроксилаза.
На 5-7 вроде, как и все гормоны.
Как и любой гормон с 2 по 5 день
а еще лучше сдать стероидный профиль мочи ( которая сутки собирается ) очень показательный анализ
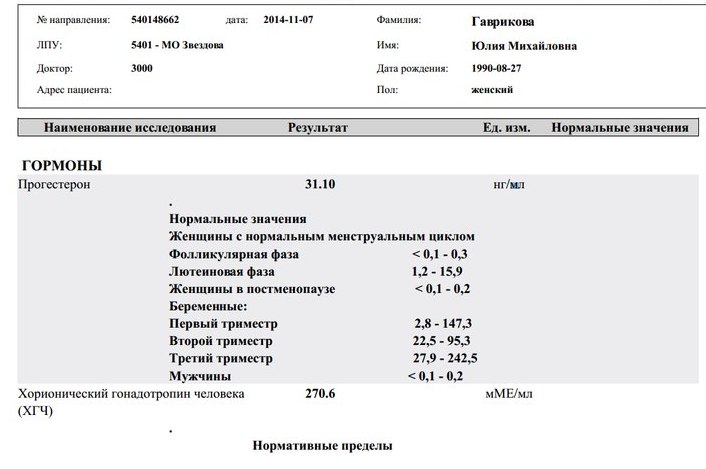
Подскажите как понять прогестерон 17 он 1.17ng/ml ( hormones) 2.0-12.0. 3 триместр беременности?
2.0-12.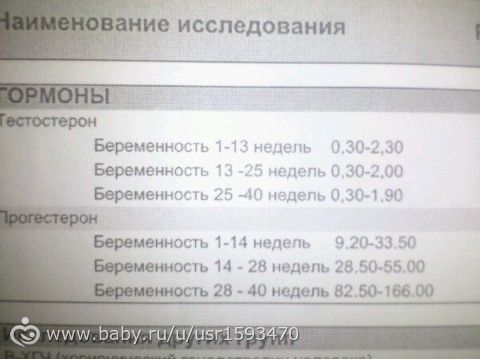 0 норма, все что ниже или выше этих значений, не в норме.
0 норма, все что ниже или выше этих значений, не в норме.
17-ОН-прогестерон 17-гидроксипрогестерон — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона.
Ниже нормы.
Выше нормы гормоны 17-ОН прогестерон и DHEA-S, но больше завышен прогестерон. Какой из перечисленных гормонов за что…
Это все ни о чем. надо смотреть все и сразу на 4-8 день цикла.
Спрашивает Кристина Здравствуйте! Сдала кровь на гормон 17-ОН прогестерон . Результат 4,00 и в откл. написано — -0- — . Скажите пожалуйста что значит — -0- — ? Ответ
Прогестерон за беременность отвечает, за вынашеваемость плода. Интересно, что у мужчин такой гормон тоже есть. Про другой не знаю
На какой день сдаются гормоны ЛГ, ФСГ, ТЕСТОСТЕРОН, ЭСТРАДИОЛ, ПРОЛАКТИН, ДГЭА-С, 17-он прогестерон, ТТГ?
Http:// gabrich.com /hormone/ тут посмортите
17-ОН-прогестерон 17-гидроксипрогестерон — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона.
Повышеный в два раза уровень 17 он прогестерон. Что делать?
Без назначения врача принимать гормоны опасно.
17-ОН прогестерон. Представленный гормон является предшественником стероидов.17-ОН-прогестерон образуется в двух органах яичники и надпочечники, а при наступлении беременности гормон продуцируется ещ и плацентой.
За эти дни ничего не случится. А бесконтрольный прием гормонов опасен.
Здравствуйте!Сдавала анализ на прогестерон равен 19,44, и 17-ОН равен 3,96.Подскажите пожалуйста это хорошо или плохо?
Что такое высокий прогестерон и пониженный прогестерон? Какова норма прогестерона? Чтобы ответить на эти вопросы, посмотрите на таблицу:
Норма прогестерона
Возраст, пол
Уровень прогестерона,
нмоль/л
Взрослые мужчины
< 0,32 — 0,64
Взрослые женщины
От начала менструации и до менопаузы
Фолликуллярная фаза
0,32 — 2,23
Овуляторная фаза
0,48 — 9,41
Лютеиновая фаза
6,99 — 56,63
Беременные
I триместр
8,9 — 468,4
II триместр
71,5 — 303,1
III триместр
88,7 — 771,5
Постменопауза
< 0,64
Что такое 17-он прогестерон?Когда количество обычного прогестерона находится среди допустимых показателей, переживать о превышении уровня 17-он прогестерона нет необходимости.
Почему повышается 17-ОН прогестерон?
17-ОН прогестерон немного завышен
17-ОН-прогестерон на 7-8 неделе беременности 11.40. Это плохо? Врач сказал, что угроза выкидыша и прописал таблетки пить
Сходи к другому врачу, а анализы надо перездать, посмотришь что другая скажет.
Описание. 17-ОН прогестерон стероидный гормон, промежуточный продукт синтеза Кортизола в надпочечниках, предшественник тестостерона и эстрадиола в надпочечниках и яичках. Маркер различных изменений в метаболизме стероидных гормонов. Показания к назначению анализа.
Пей, беременность сохранишь а вреда ребенку е будет от них.
Вопрос гинекологам. Была задержка 15 дней, на 15 день задержки(40-й день цикла получается)сдала 17-ОН прогестерон. +++
Если вопрос к гинекологу — тогда вам в поликлинику
В чем разница между Прогестероном и 17-ОН Прогестероном? eKatepinA Ранг Новичок Ф.И.О. 1 Адрес Россия, Новосибирск Всего сообщений 24. Опубликовано 10-08-2011 11 09.
Пф.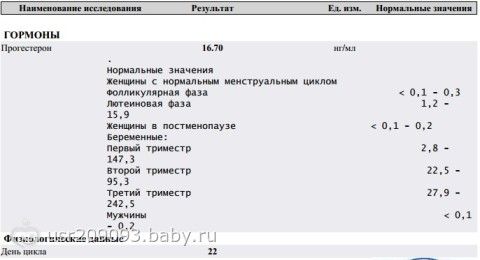 нашла где спрашивать
нашла где спрашивать
У гинекологов.. сегодня выходной.. пишите завтра посоветуем..)
А нарушение гормонов ЛГ и 17 он прогестерон лечиться?
Дексаметазон
17-ОН-прогестерон 17-гидроксипрогестерон — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона.
Повышен громон 17 он прогестерон. с чем может быть связано его повышение? чем грозит?
Грозит дисфункцией яичников.
17-ОН-прогестерон и его лечение ДЕКСАМЕТАЗОНОМ. Всем доброго времени суток! Очень рада снова вернуться в это сообщество!В общем кроме выписки стандартного списка лекарств врач сказала мне сдать анализ на 17-OH-прогестерон.
Уровень прогестерона 17 ОН на второй неделе беременности по анализам-13.96,подскажите это нормальный уровень?
Девочки у кого нибудь был повышен 17-ОН прогестерон, как понижали? =
Дексаметазон принимать нужно, дозировку определит врач в зависимости от степени повышения
Помогите пожалуйста расшифровать результаты анализов 17-оН прогестерон и ТТГ.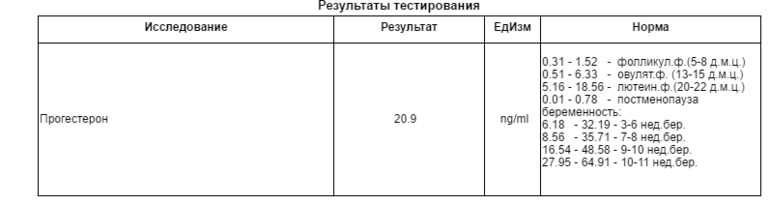 Норма в лаборатории 17-оН прогестерона фол 0,2-1,2 нг мл лют 1,0-3,1нг мл. Мой результат 3,94. Кровь сдавала на 4-5 день цикла.
Норма в лаборатории 17-оН прогестерона фол 0,2-1,2 нг мл лют 1,0-3,1нг мл. Мой результат 3,94. Кровь сдавала на 4-5 день цикла.
Назначают ли хлое при бесплодии, повышен 17 ОН-прогестерон, нет овуляции, будет ли эффект?
Все ОК, а хлое относится к их числу, помимо прямого противозачаточного эффекта, стимулируют овуляцию, лечат эндометриоз и сальпингоофорит, регулируют гормональный фон и менструальный цикл.
На отмену ОК после курсового лечения легко наступает беременность.
17-ОН Прогестерон Бесплодия нет. Это вызывает нарушения в половом развитии в детстве, а также может быть причиной гирсутизма, нарушений цикла и бесплодия у взрослых женщин. Введите ключевые слова для поиска.
Можно ли сдать анализ на 17 он прогестерон независимо от цикла?
Если врач указал конкретный день цикла для анализа — так и нужно делать. В другое время (особенно при задержке) результат будет не показателен. Т, е. бесполезен.
УЗИ педиатрия. Комплексные программы. 17-ОН-Прогестерон. В корзину. Краткое описание.
В корзину. Краткое описание.
Две недели уже как должны быть месячные но их нет. Не беременна 100% Что ещё может быть?
….гармоны с ножками-через 9 месяцев ясно будет…
17-ОН-прогестерон норма и отклонение. Гидроксипрогестерон 17-ОН- прогестерон является гормоном, который вырабатывается при помощи работы надпочечников или синтеза половых желез.
Во всяком случае к гинекологу!
Вместо того чтобы задавать вопросы тут .шла бы ко врачу
У меня завышен гормон 17 он прогестерон,может ли он влиять на будущую беременность?Возможна ли беременность?
Если я не ошибаюсь, то вовремя беременности, как раз таки прогестерон и отвечает за прикрепление зародыша к матке, но могу ошибаться
Из-за повышенного 17-ОН-прогестерона 3,3 нмоль л на 6й ДЦ норме 0,3-2,4 врач назначила мне дексаметазон по 1 4 табл. в день . После сдачи анализа в ледующий цикл результат понизился до 3,26.
Врач назначит лечение для снижения уровня гормона, но при условии сдачи анализа крови на гормоны и всю репродуктивную панель, т. е. по совокупности с уровнем других гормонов.
е. по совокупности с уровнем других гормонов.
Для беременности, если возникают вопросы, еще много обследований пройдете, и не факт, что в прогестероне причина. Всего Вам доброго.
Превышение 17-ОН-прогестерона и ДГЕА-сульфата
Есть какие то подозрения ?
17-ОН прогестерон это метаболит, образующийся в надпочечниках, яичниках и плаценте. При участии определенных ферментов он превращается в надпочечниках в гормон кортизол, а в яичниках в предшественника эстрадиола и тестостерона.
Подскажите, какие гормоны сдать на первых месяцах беременности?
Лучше сперва к врачу, может они вообще и не понадобятся
Справка 17-ОН прогестерон 17-гидроксипрогестерон — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона.
Логичнее чтоб она вам и назначила какие анализы сдавать.
Ну если к эндокринологу то ТТГ, Т9, Т14. Но лучше прийти к варчу и пусть он Вас направит на алализы.
Врач назначает! Тут вашего врача не видели.
Гормон 17-ОН-прогестерон как сдавать?
Прогестерон – гормон, который отвечает за многие физиологические процессы в организме женщины. В небольшом количестве его продуцируют и мужские органы (яички, надпочечники). Недостаточная концентрация гормона у женщин может вызывать воспаления половых органов, маточные кровотечения, выкидыши. Как сдавать кровь на прогестерон и, главное, когда – вопрос, интересующий многих. Но особенно актуален он для пар, планирующих беременность.
Что представляет собой гормон прогестерон?
Прогестерон – гормон, продуцирующийся яичником или яичками, а также надпочечниками, основная задача которого – поддержание нормальной работы половой системы человека. Очень важная роль возлагается на этот гормон во время беременности. Без него невозможно прикрепление плодного яйца к стенкам матки. Каждая женщина должна знать, что такое гормон прогестерон, когда сдавать его и какова роль этого соединения в организме.
Функции прогестерона:
- Подготовка эндометрия в матке для внедрения яйцеклетки.
- Обеспечение целостности эпителия матки во время беременности благодаря отсутствию менструаций.
- Он способствует росту матки, что необходимо для нормального развития будущего малыша.
- Прогестерон расслабляет мускулатуру матки и не позволяет ей отторгнуть плод.
- Благодаря гормону увеличиваются молочные железы, таким образом они готовятся к последующей лактации.
- Гормон способствует накоплению подкожного жира, который питает ребёнка и плаценту.
- Нормализирует артериальное давление.
- Принимает участие в развитии тканей.
Чтобы узнать уровень гормона в организме, нужно сдать кровь для анализа. Прогестерон сдают на день цикла 22-й или 23-й, после начала менструации. Если цикл не налажен и составляет более 30 дней, необходима консультация гинеколога. В таких случаях анализ проводится позднее 23-го дня цикла.
Прогестерон и менструальный цикл
Менструальный цикл – важный биологический процесс в организме женщины, от которого зависит ее способность зачать и родить ребёнка, то есть детородная функция.
В среднем менструальный цикл состоит из 28 дней (от начала первой менструации до начала второй). Возможны отклонения – 21–35 дней. Не важно, сколько дней длится менструальный цикл, имеет значение, чтобы он был регулярным.
Цикл состоит из двух фаз: в первой продуцируется гормон эстроген, во второй – прогестерон. Первая фаза цикла – это созревание яйцеклетки и овуляция, вторая – путешествие яйцеклетки к «месту назначения», то есть в матку. Из фолликула, в котором созревала яйцеклетка, формируется жёлтое тело, продуцирующее впоследствии прогестерон. Уровень гормона увеличивается в крови как раз во второй половине цикла. Поэтому на вопрос о том, на какой день сдавать прогестерон, ответ однозначный: ближе к началу менструаций.
Если оплодотворения не происходит, яйцеклетка погибает, а жёлтое тело регрессирует. В результате каждый месяц у женщины происходят менструальные кровотечения. Когда же беременность всё-таки наступает, гормон продолжает вырабатываться жёлтым телом до 16-й недели, а потом его продуцирует плацента.
Прогестерон – важный гормон, который подготавливает тело женщины к предстоящему вынашиванию малыша. Без него беременность невозможна.
На протяжении месяца концентрация прогестерона в крови меняется. Так, наименьшее его количество – в начале цикла (до 4,83 нмоль/л). Увеличивается численность гормона к началу овуляции (9,41 нмоль/л) и продолжает расти во время лютеиновой фазы, когда его начинает продуцировать жёлтое тело (от 16,2 до 85,9 нмоль/л). С началом менструаций количество гормона снижается до 0,32–2,51 нмоль/л.
У тех женщин, у которых наступает беременность, концентрация гормона в крови продолжает расти и составляет:
- В первом триместре – от 14,9 до 108,1 нмоль/л.
- Во втором – от 61,7 до 159.
- В третьем – 17,3–508,8.
В каждую неделю беременности в разных количествах продуцируется прогестерон. Не имеет значения, когда будущим мамам сдавать кровь на прогестерон. Где сдать анализ, подскажет участковый врач. Зачастую этим занимаются частные лаборатории.
Прогестерон и беременность
Часто приходится слышать выражение «гормон беременности». Но не всегда люди понимают, о чём идёт речь. Гормон беременности – это и есть прогестерон. Основная его функция – подготовить тело женщины к предстоящему вынашиванию ребёнка и содействовать его развитию.
Когда женщина чувствует себя хорошо, анализ на данный тип гормона не прописывают. Его нет в списке обязательных. Но, когда самочувствие будущей мамы далеко от нормального, есть угрозы прерывания беременности, назначают анализ на прогестерон. Как сдавать его, как подготовиться – обязан рассказать специалист (эндокринолог).
Концентрация гормона всегда должна находиться в пределах допустимых норм. Повышенное или пониженное количество прогестерона говорит об отклонениях, связанных с беременностью или со здоровьем будущей мамы.
Низкий прогестерон может стать причиной:
- Выкидыша.
- Замершей беременности.
- Плацентарной недостаточности.
- Отставания плода в развитии.

- Перенашивания и поздних родов.
Высокий прогестерон говорит о:
- Нарушениях в работе плаценты.
- Почечной недостаточности.
- Многоплодной беременности.
- Проблемах со здоровьем матери (сахарный диабет, кисты на яичниках).
Во время беременности прогестерон способствует не только закреплению плодного яйца к стенкам матки, он также:
- принимает участие в формировании тканей эмбриона;
- меняет эмоционально-психическое состояние женщины, «настраивая» её на беременность;
- расслабляет связки во время родов.
Если необходимо узнать, в каком количестве в организме находится прогестерон, как правильно сдавать анализ и, главное, когда, следует обратиться к врачу-специалисту. Помимо анализа крови, дополнительно могут быть назначены и другие виды исследований, в частности УЗИ.
Коррекцию гормона производят как стационарно, так и в домашних условиях. Всё зависит от конкретного случая, а также от состояния матери и плода. Если нет угрозы прерывания, вполне возможно домашнее лечение. Как говорится, дома и стены лечат.
Если нет угрозы прерывания, вполне возможно домашнее лечение. Как говорится, дома и стены лечат.
Как сдавать кровь на прогестерон?
Для тех, кто планирует беременность, анализ крови на прогестерон – один из важных методов диагностики. Его концентрация значительно увеличивается после выхода яйцеклетки из фолликула (овуляции). Сексуальный контакт в это время почти стопроцентно закончится беременностью.
Многих женщин интересует, когда же проводится анализ на прогестерон, как сдавать правильно кровь для исследований и нужно ли готовиться к анализу. Конечно. Перед исследованием крови на гормоны необходима консультация эндокринолога.
Небеременные женщины кровь на прогестерон сдают на 23-й день менструального цикла (первый день цикла – это первый день менструаций). Когда цикл составляет более 30 дней, анализ, соответственно, сдают немного позже (на 28-й день).
Если говорить вкратце, то исследование «гормона беременности» проводится за неделю до начала менструаций. При этом роли не играет продолжительность цикла. У тех, кто запомнил такое простое правило, больше не возникнет вопрос, на какой день сдавать прогестерон.
При этом роли не играет продолжительность цикла. У тех, кто запомнил такое простое правило, больше не возникнет вопрос, на какой день сдавать прогестерон.
Особой подготовки анализ не требует. Забор венозной крови производится утром на голодный желудок. За несколько дней до анализа нужно отменить некоторые препараты, имеющие влияние на результаты. Для этого и нужна консультация специалиста.
Беременные женщины кровь на прогестерон могут сдавать в любой день. Результаты интерпретируются в соответствии со сроком (триместром) беременности.
Когда сдавать прогестерон женщине с нерегулярным циклом?
Женщинам, которые имеют нерегулярный менструальный цикл (то есть каждый раз разное количество дней от начала первой менструации до начала второй), сдать анализ на прогестерон сложнее. В таких случаях врачи рекомендуют производить исследование несколько раз.
Более точно о наступлении овуляции и повышении уровня гормона прогестерона «расскажет» базальная температура. Для этого необходимо измерять ее каждое утро после сна одним и тем же градусником. Измерения можно проводить во рту, во влагалище или в прямой кишке.
Измерения можно проводить во рту, во влагалище или в прямой кишке.
Показатели должны фиксироваться в отдельной тетради. В момент выхода яйцеклетки температура поднимается на градус (или более). На следующий день она начинает понижаться, а в организме активно продуцируется гормон прогестерон. Как правильно сдавать в таком случае анализ? На какой день цикла? В этом случае анализ сдают на шестой–седьмой день после пика температуры.
Коррекция уровня гормона
Чаще всего отклонения прогестерона в крови женщины наблюдаются в меньшую сторону. То есть он понижен. Это является причиной выкидышей и внематочных беременностей. Также пониженный прогестерон указывает на различные воспаления в половых органах (кисты, миомы).
Скорректировать уровень гормона можно с помощью специальных лекарств. Это прогестерон в уколах и таблетках. Схему лечения и дозы назначает только врач после тщательной диагностики.
Коррекция гормона позволяет наладить менструальный цикл, поддержать плод или плаценту во время угрозы прерывания.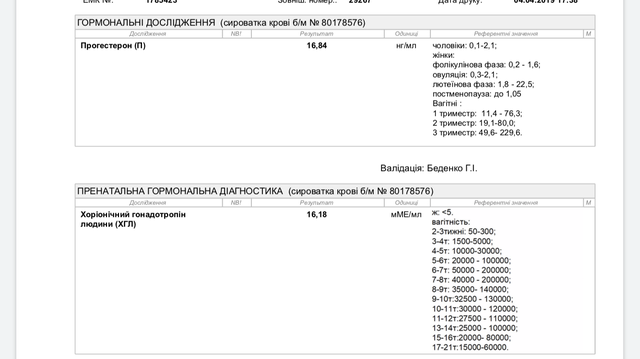 Препарат иногда вызывает побочные реакции – тошноту, головную боль, головокружение. Однако эти явления носят временный характер.
Препарат иногда вызывает побочные реакции – тошноту, головную боль, головокружение. Однако эти явления носят временный характер.
Кому противопоказан курс лечения прогестероном
К сожалению, не всем одинаково полезна повышенная концентрация данного гормона в крови. Помимо побочных реакций, которые может вызвать прогестерон (как лекарственное средство), он оказывает негативное влияние на тех, кто болеет:
- Раком груди, опухолями половых органов.
- Гепатитом или другими заболеваниями печени.
- Бронхитом.
- Заболеваниями сердца.
- Сахарным диабетом, почечной недостаточностью.
Нельзя принимать прогестерон людям, склонным к тромбозам.
Препараты прогестерона должны назначаться только врачом. Самолечение запрещено.
Народные методы увеличения прогестерона в крови
Поднять уровень прогестерона в крови можно и с помощью народных методов лечения, которые основываются на приёме отваров из трав – это манжетка обыкновенная, корица, пустырник, тысячелетник, пион, священный витек, листья малины, лапчатка. Вещества, которые содержатся в этих растениях, стимулируют гипофиз. А он в свою очередь влияет на продуцирование гормона жёлтым телом.
Вещества, которые содержатся в этих растениях, стимулируют гипофиз. А он в свою очередь влияет на продуцирование гормона жёлтым телом.
Настои и чаи из растений рекомендуется принимать с пятнадцатого по двадцать пятый день цикла. Фитотерапию хорошо проводить для профилактики предклимактерического синдрома, а также женщинам, старающимся забеременеть.
Для лечения народными методами также необходима консультация эндокринолога. Ведь не все травы одинаково полезны для разных людей.
17 — ОН прогестерон
Часто, получив результаты анализов на гормоны, женщины начинают паниковать из-за повышенного уровня 17-ОН прогестерона. И напрасно. 17-ОН – это не гормон, это продукт его синтеза. Его также продуцируют со второго триместра плацента и надпочечники плода, что и объясняет увеличенное количество этого вещества.
Концентрация 17-ОН в пределах нормы – это 1,24–8,24 нмоль/л во время созревания яйцеклетки, 0,91–4,24 в период овуляции, 0,99–11,51 во время выхода яйцеклетки из фолликула.
Конечно, значительный недостаток, как и избыток 17-ОН, свидетельствует о нарушениях в организме. Это могут быть:
- Сбои менструального цикла.
- Опухоли надпочечников.
- Аномалии в развитии плода (внешние половые органы у мальчиков).
- Недостаточность коры надпочечников у плода.
Итак, 17-ОН прогестерон когда сдавать, подскажет врач-специалист. Основные симптомы, являющиеся показаниями для этого:
- Выкидыши.
- Детская смертность (новорождённые).
- Нарушенный менструальный цикл.
- Угревая сыпь на лице.
- Увеличение волосяного покрова на груди и лице у женщин.
Если наблюдаются подобные явления, следует сдать кровь на гормон 17-ОН (прогестерон). Когда сдавать анализ? Для исследований необходима венозная кровь, взятая с утра натощак. Готовиться к нему не нужно.
Своевременная диагностика и лечение помогут избежать многих проблем со здоровьем.
Прогестерон у мужчин
Большинство женщин, которые планируют беременность, знают, что такое прогестерон, когда сдавать кровь на гормон и что означают результаты. А знают ли мужчины, какая роль этого гормона в их организме?
А знают ли мужчины, какая роль этого гормона в их организме?
Функции прогестерона в мужском организме:
- Служит для профилактики опухолевых заболеваний половой системы, а также болезней сердца и сосудов.
- Укрепляет костную систему.
- Контролирует уровень гормона эстрогена.
- Принимает участие в обмене жидкостей.
- Нормализирует работу щитовидной железы.
- Способствует здоровому сну.
Поэтому на вопрос о том, зачем сдавать прогестерон мужчине, ответ простой – для профилактики и диагностики многих заболеваний.
Профилактические меры для поддержания уровня прогестерона
Количество прогестерона в крови, как и других гормонов, зависит от многих факторов, в частности от образа жизни. Правильный и здоровый образ жизни способствует нормальному продуцированию гормона.
Для поддержания прогестерона в пределах нормы нужно:
- Сбалансированно питаться.
- Пища должна быть разнообразной, в том числе с включением холестерина, который является основным источником гормона.

- Избегать стрессовых ситуаций и депрессий.
- Заниматься физкультурой и спортом.
- Укреплять иммунитет.
Заключение
Прогестерон – это не только «гормон беременности», это важное вещество, которое отвечает за нормальное функционирование организма человека. Каждый должен знать симптомы, говорящие о том, что повышен или снижен прогестерон (когда сдавать анализы, рассказано в статье) и что способствует нормализации его уровня.
17-он прогестерон повышен в фолликулярной фазе, причины и лечение
17-ОН прогестерон тяжело назвать полноценным гормоном, это скорее промежуточный продукт, без которого вся цепочка формирования менструального цикла будет бесполезной. Немного науки простыми словами: после распада прогестерона в коре надпочечников образуется 17-ОН прогестерон, который в дальнейшем выступает сырьем для образования кортизола и тестостерона.
Данный продукт выступает в качестве основы для мужской группы гормонов, поэтому очень важен при нормализации цикла и наступлении беременности. 17-ОН прогестерон и фолликулярная фаза взаимоопределяемы, то есть по значению стероидного гормона можно выяснить, какой день цикла сегодня. Актуально это только для абсолютно здоровой женщины.
17-ОН прогестерон и фолликулярная фаза взаимоопределяемы, то есть по значению стероидного гормона можно выяснить, какой день цикла сегодня. Актуально это только для абсолютно здоровой женщины.
Как влияет 17-ОН прогестерон на организм
Это основной показатель возможности женщины стать матерью. Его уровень обязательно контролируется перед беременностью, однако имеет куда меньшую информативность после зачатия. Поэтому, когда только возникают мысли о ребенке, вперед за анализами.
Также 17-ОН прогестерон отвечает за половое созревание, когда и целесообразно выявлять разного рода патологии. Его наличие и повышенный уровень заметен даже внешне. Женщины обнаруживает рост волос в тех местах, где доселе они казались не уместными. Также оттенок волосяного покрова становится темнее. Заметив подобные признаки, нужно тут же проверить показатель 17-ОН прогестерона, начиная с фолликулярной фазы.
Основной причиной повышения 17-ОН прогестерона является невозможность его синтезировать кортизол. Так как организм относится к этому очень трепетно, надпочечники начинают дополнительно стимулировать промежуточный материал.
Так как организм относится к этому очень трепетно, надпочечники начинают дополнительно стимулировать промежуточный материал.
Как снизить концентрацию
Заподозрить высокий уровень гормона можно при увеличении концентрации глюкозы. Патологический процесс сопровождают: снижение работоспособности, появление хронической усталости, общая слабость, приступы острой головной боли и головокружения.
Повышенный показатель 17-гидроксипрогестерона снижают с помощью препаратов из группы глюкокортикостероидов. Длительность медикаментозной терапии составляет 3-6 месяцев. Чтобы корректировать дозировку лекарственных препаратов и назначать дальнейшую схему лечения, рекомендуют многократное проведение анализа на определение плазменной концентрации 17-ОНР в период лечения.
Если патологический процесс спровоцировало злокачественное новообразование в органах репродуктивной системы или коре надпочечников, назначается хирургическая операция. После удаления опухоли гормональный фон корректируется искусственно с помощью препаратов.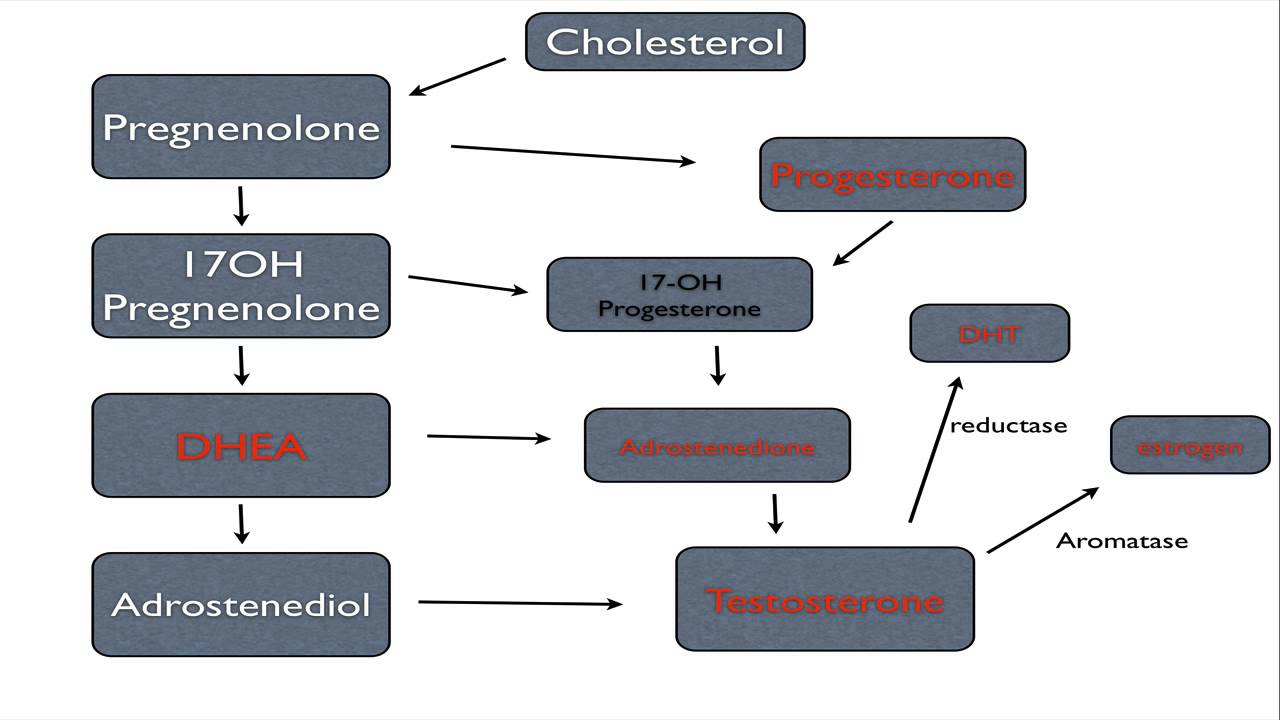
В период медикаментозной терапии необходимо придерживаться диеты. В рацион включают продукты с высоким содержанием аскорбиновой кислоты. Витамин C стабилизирует работу надпочечников, улучшает микроциркуляцию в органах малого таза, стабилизирует гормональный фон. В повседневном меню должны присутствовать:
- цитрусовые: помело, грейпфрут, лимоны, апельсины и мандарины;
- кислые ягоды: смородина, брусника, шиповник, малина;
- яблоки;
- листовая зелень: щавель, кинза;
- абрикосы;
- некоторые овощи: редис, брюссельская капуста, томаты.
Помимо основной комплексной терапии, можно проводить дополнительное лечение народными средствами. Нетрадиционные методы готовят из следующих растений:
- морковных семян;
- листьев и плодов шиповника;
- ягод рябины;
- высушенной гвоздики;
- боровой матки.
Отвары и настойки требуется принимать в течение полугода для достижения необходимого терапевтического эффекта. Благодаря применению народных средств усиливается кровоснабжение надпочечников и половых органов, в которых вырабатывается оксипрогестерон. В результате уровень его нормализуется, стабилизируется общее состояние человека, появляется ощущение бодрости, поднимается настроение и увеличивается работоспособность.
Благодаря применению народных средств усиливается кровоснабжение надпочечников и половых органов, в которых вырабатывается оксипрогестерон. В результате уровень его нормализуется, стабилизируется общее состояние человека, появляется ощущение бодрости, поднимается настроение и увеличивается работоспособность.
Нормальные показатели 17-ОН прогестерона в период фолликулярной фазы
Для определения 17-ОН прогестерона в фолликулярной фазе назначается анализ на гормон. Прежде всего, он целесообразен в таких ситуациях:
- При обнаружении признаков гирсутизма
- При сбоях в менструальном цикле
- Когда есть подозрение на дисфункцию надпочечников
- В качестве одного из анализов на опухоли надпочечников.
Когда сдавать анализ крови?
Показания для сдачи анализа, в частности при планировании беременности:
- бесплодие у женщин на фоне дисбаланса гормонов;
- в рамках комплексного обследования по поводу опухоли яичников;
- сбой цикла менструации.

Анализ крови на прогестерон назначают в период бесплодия или проблем с яичниками
У новорождённых детей анализ назначают для исключения гиперплазии коры надпочечников. У мужчин исследование позволяет установить причину гормонального дисбаланса.
Исследование у женщин проводят на 2–4 день цикла, у детей и мужчин – в любой день утром натощак. Кровь из вены берут натощак.
Также применяют комплексный анализ для определения мультистероидного профиля – высокоточное исследование, определяющее разные виды нарушения синтеза гормонов надпочечников и половых гормонов. Анализ выполняют методом масс-спектрометрии.
Как сдать анализ на 17-ОН прогестерон правильно
Чтобы анализ на 17-ОН прогестерон в фолликулярной фазе был максимально информативным, сдавать его нужно на 3-5 день после начала менструации. В этот период организм женщины находится как бы в покое, поэтому значение должно быть минимальным.
Норма показатель – 0,32-2,23 нмоль/л.
Так как разные лаборатории высчитывают по-разному и применяют различные единицы измерения, важно уметь переводить значение. Если вы увидели в результатах нг/мл, то для получения достоверной информации его надо перевести в нмоль/л, для чего умножить на 3,18.
Если вы увидели в результатах нг/мл, то для получения достоверной информации его надо перевести в нмоль/л, для чего умножить на 3,18.
В таком случае норма составит 0,2-1,2нг/мл.
Норма содержания в крови:
17 oh прогестерон норма у женщин после 17 лет – 0,07-2,90 нг/мл
17 oh прогестерон: норма по фазам овариально-менструального цикла.
Фолликулиновая фаза – 0,07 – 0,80 нг/мл
Лютеиновая фаза – 0,30 – 2,90 (20-22 день) нг/мл
Норма 17 oh прогестерона у женщин, находящихся в положении.
17 oh прогестерон при беременности – 0,66 – 4,0 нг/мл
- Первый триместр беременности – 1,3-3,0 нг/мл;
- Второй триместр беременности – 2,0-5,0 нг/мл;
- Третий триместр беременности – 5,0-8,3 нг/мл;
Гидроксипрогестерон начинает вырабатываться еще при внутриутробном развитии и, в это период жизни юного человека, самый максимальный концентрационный эффект (это примерно 11 неделя внутриутробного развития), потом уровень гормона максимально снижается. Это происходит в первую неделю жизни. Содержание гормона повышается только в период полового созревания и, потом остается в одной поре, когда содержание гормонов становится стабильным.
Это происходит в первую неделю жизни. Содержание гормона повышается только в период полового созревания и, потом остается в одной поре, когда содержание гормонов становится стабильным.
Повышенный 17-ОН прогестерон в фолликулярной фазе
Если после анализа значение гормона в норме, то отклонения в менструальном цикле не связаны с выработкой 17-ОН прогестерона корой надпочечников.
Однако если же уровень 17-ОН прогестерона в фолликулярной фазе повышен, это свидетельствует об излишнем накоплении в организме тестостерона, а как следствие и невозможность зачать ребенка, может не наступать овуляция, увеличивается длительность цикла. Если значение превышено в 5-6 раз, то менструация может не наступать на протяжении нескольких месяцев. Необходима срочная нормализация. Бить тревогу и обратиться к эндокринологу необходимо при значениях больше 15 нмоль/л.
Также популярными признаками повышения 17-ОН прогестерона являются повышение уровня сахара в крови, интенсивное потоотделение и акне на поверхности кожи.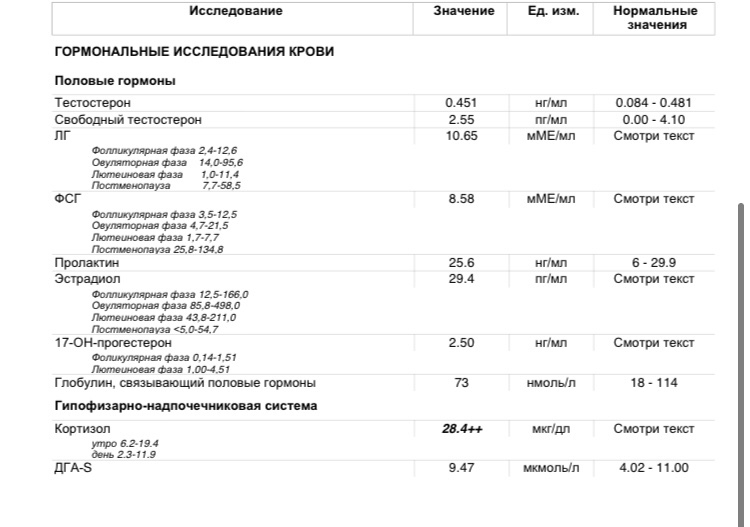
17-ОН прогестерон и фолликулярная фаза характеризуют жизненно важные процессы в организме каждой женщины, поэтому лучше вовремя обнаружить отклонение и приступить к незамедлительному решению проблемы. Ведь основная цель – выносить и родить здорового малыша.
Симптомы высокого уровня гормона
Изменение концентрации гормона отражается на состоянии здоровья и настроении женщины. При высоких значениях обычно наблюдаться следующие симптомы:
- угревая сыпь на лице и других частях тела;
- быстрая утомляемость;
- скачки давления;
- усиление потоотделения;
- сбои менструального цикла;
- ухудшение зрения;
- головные боли;
- маточные кровотечения;
- снижение либидо;
- увеличение роста волос на теле;
- выпадение волос;
- болезненность груди;
- перепады настроения;
- аллергические реакции;
- метеоризм, запоры.
Достаточно часто при повышении прогестерона наблюдается быстрый набор веса. Гормон расслабляет мышцы пищеварительной системы, что позволяет съедать очень много еды.
Гормон расслабляет мышцы пищеварительной системы, что позволяет съедать очень много еды.
Что делать, если 17-ОН прогестерон повышен в фолликулярной фазе
Результат анализа показал повышение 17-ОН прогестерона в фолликулярной фазе. Не стоит паниковать. Это не является гарантией серьезных проблем, повышение может быть однократное без склонности к повторению. Резкое отклонение 17-ОН прогестерона может возникать в результате серьезной стрессовой ситуации, когда уровень прилива к сердцу крови должен быть максимальным. Обязательно через время нужно провести дополнительное исследование, которое покажет реальную картину.
Если же проблема сохраняется либо начинает усугубляться, женщине назначается гормонотерапия. Актуальным в такой ситуации является Дексаметазон, однако такого рода препараты имеет право назначать только ваш лечащий врач, который попутно обращает внимание на дополнительные предшествующие факторы. Нормальной реакцией организма является незначительное повышение веса, так как составляющие лекарства задерживают воду в организме.
Как повысить уровень
Увеличить плазменную концентрацию гормона позволяет изменение образа жизни и прием средств нетрадиционной медицины. В тяжелых ситуациях назначается лекарственная терапия.
Народные методы
Чтобы повысить OH прогестерон, можно принимать следующие народные средства:
- Пить чай из листьев малины. В них содержится большое количество витамина C, который может стабилизировать эндокринную функцию надпочечников и усилить синтез гидроксипрогестерона. Пьют средство в течение дня до 4-5 раз в сутки перед приемом пищи.
- 100 г корней шлемника байкальского заливают 500 мл этанола, настаивают на протяжении месяца, отфильтровывают. Принимают по 20 капель, разведенных в стакане воды, 3 раза в день.
- 2 ст. л. прутняка заливают 500 мл кипятка, настаивают средство около 2 часов. Пьют как чай перед едой в течение дня.
- 1 ст. л. астрагала заливают 250 мл горячей воды и настаивают полчаса. Пьют после еды по 100 мл 3 раза в день.
Чтобы повысить содержание гормона в плазме крови, помимо приема лекарственных препаратов и народных средств, рекомендуется придерживаться диетотерапии. Для этого в рацион включают продукты с высоким содержанием цинка:
Для этого в рацион включают продукты с высоким содержанием цинка:
- бобовые культуры, особенно фасоль;
- злаки: пшеничные отруби, рис;
- кроличье и куриное мясо;
- сушеный инжир, малина.
Медикаменты
Для повышения плазменной концентрации гормона назначают лекарственные препараты, главным действующим веществом которых является прогестерон. Медикаменты выпускаются в таблетированной форме или в виде суппозиториев для наружного применения.
Категорически запрещено проводить самостоятельную терапию в домашних условиях. В противном случае нарушение дозировки может привести к расстройству работы эндокринной системы.
Норма у женщин:
Во время беременности :
У детей концентрация в крови гормона не должна превышать 2,5 нмоль/л,
у подростков женского пола 13-17 лет не больше 7,
у юношей 13-17 лет-5,5 нмоль/л.
Возможные опасности повышения прогестерона
Длительное наличие гормонального дисбаланса может приносить организму заметный вред. Прогестерон выше нормы в лютеиновой фазе приводит к различным осложнениям, справиться с которыми может быть весьма проблематично.
Самым опасным последствием гиперпрогестеронемии являются опухолевые поражения и кисты в тазовых органах. В сложных ситуациях нередко выявляют кисту желтого тела яичников. Под этим термином понимают доброкачественное образование, обусловленное аномальным скоплением жидкости в органе.
Киста синтезирует большое количество гормона, потому в сыворотке крови наблюдается высокое содержание вещества. Аномалия неплохо поддается медикаментозной терапии. Однако в отдельных ситуациях не удается обойтись без хирургического вмешательства. В запущенных случаях есть риск разрыва кисты, однако это нарушение встречается крайне редко.
Наиболее опасным последствием превышения уровня прогестерона является появление злокачественной опухоли. Однако это осложнение встречается довольно редко. К таким последствиям относятся липидоклеточные образования и хорионэпителиома, которая появляется при беременности или после родов.
Увеличение объема прогестерона может провоцировать урологические нарушения. К ним относят проблемы в работе надпочечников и недостаточность почек.
Сложные случаи гиперпрогестеронемии сопровождаются такими нарушениями:
- Цирроз печени;
- Киста желтого тела яичника;
- Патологии надпочечников, включая злокачественное поражение органа;
- Нарушение репродуктивных функций;
- Недостаточность почек;
- Ожирение.
Лечение
Небольшие отклонения от нормы 17 он прогестерона не нуждаются в медикаментозной терапии. Обычно врачи рекомендуют скорректировать образ жизни и питание. Что это значит? Женщина должна отдыхать 7-8 часов в сутки, ежедневно гулять на свежем воздухе не менее 2 часов в день, избегать стрессов. В пищу добавляются большое количество овощей, фруктов, кушать рекомендуется 4-5 раз в день небольшими порциями.
Когда же требуется лечение препаратами? При выявлении причин, которые способствовали повышению уровня 17 он прогестерона, врачи выбирают дальнейшую тактику лечения. При наличии образований они удаляются хирургическим путем.
Остальные патологические состояния корректируются при помощи гормональных препаратов. Чаще всего назначаются глюкокортикоиды: Метипред, Дексаметазон. Для подавления выработки андрогенов, которые тоже повышаются за счет усиленной продукции гидроксипрогестерона, рекомендуется прием оральных контрацептивов. В большинстве случаев используются Ярина, Диане-35.
Уважаемые читатели, даже если вы теперь знаете, как снизить высокий уровень 17 он прогестерона, не стоит заниматься самолечением. Все вышеуказанные препараты должны применяться только по назначению врача и в соответствии с результатами анализов.
Надеюсь, эта статья добавила вам новых знаний. Подписывайтесь на обновления, приглашайте друзей, делитесь с ними информацией и рассказывайте, что вы это все узнали из блога. Возможно, им захочется быть такими же осведомленными, ведь зачастую не информированность заставляет нас переживать ненужные, отрицательные эмоции. А ведь гормональное здоровье напрямую зависит эмоционального равновесия, правильного образа жизни. Удачи и не болейте!
Прогестерон — обзор | Темы ScienceDirect
Прогестерон или 4-прегнен-3,20-дион — стероидный гормон, участвующий в женском репродуктивном цикле, беременности и эмбриогенезе. Он синтезируется из прегненолона, производного холестерина, под действием фермента расщепления боковой цепи холестерина и 3-бета-гидроксистероиддегидрогеназы. Прогестерон также является предшественником минералокортикоидного альдостерона и, после преобразования в 17-гидроксипрогестерон, кортизола и андростендиона.Андростендион можно дополнительно модифицировать до тестостерона, эстрона и эстрадиола.
Прогестерон проявляет свое действие главным образом через внутриклеточные рецепторы прогестерона. После связывания с рецептором комплекс перемещается в ядро и связывается непосредственно с конкретными нуклеотидными последовательностями хромосомной ДНК, изменяя транскрипционную активность определенных генов. Кроме того, прогестерон обладает рядом физиологических эффектов, которые усиливаются в присутствии эстрогена.Эстроген через рецепторы эстрогена усиливает экспрессию рецепторов прогестерона.
Наиболее важную роль прогестерон играет в поддержании беременности. У беременных кобыл прогестерон вырабатывается из первичного желтого тела примерно до 40 дня беременности, когда дополнительные желтые тела (образующиеся под действием фолликулостимулирующего гормона гипофиза [ФСГ] и хорионического гонадотропина лошади [ЭКГ]) дополняют концентрация прогестерона.Примерно с 70-го дня плацента вырабатывает значительное количество прогестерона, метаболизируя холестерин материнского происхождения в прогестерон. После этого концентрация прогестерона начинает снижаться примерно через 120 дней (4 месяца) и достигнет исходной концентрации через 180 дней (6 месяцев). Впоследствии концентрации прогестерона для оценки беременности могут иметь ограниченное значение после середины беременности. На этом этапе беременность поддерживается за счет прогестерона, секретируемого аллантохорионом непосредственно в эндометрий и миометрий, следовательно, системные концентрации в кровотоке низкие.Прогестерон обычно вырабатывается лютеиновой тканью яичников небеременных кобыл, при этом низкие концентрации наблюдаются во время позднего диэструса и ранней течки.
Лечение прогестероном для предотвращения преждевременных родов
Что такое прогестерон?
Прогестерон — гормон. Гормоны — это химические вещества, вырабатываемые организмом.
Прогестерон помогает матке (матке) расти во время беременности и предохраняет ее от сокращений. Если у вас схватки на ранних сроках беременности, это может привести к выкидышу.Это прерывание беременности до 20 недель беременности. На более поздних сроках беременности прогестерон помогает вашей груди вырабатывать грудное молоко. Это также помогает вашим легким работать больше, чтобы давать кислород вашему растущему ребенку.
Лечение прогестероном во время беременности может помочь снизить риск преждевременных родов у некоторых людей. Преждевременные роды — это слишком ранние роды, до 37 недель беременности. Недоношенным детям, возможно, придется оставаться в больнице дольше или у них может быть больше проблем со здоровьем, чем у доношенных детей.Доношенный означает, что ваш ребенок родился на сроке от 37 до 40 недель беременности.
Существует два вида лечения прогестероном:
Вагинальный прогестерон может помочь снизить риск преждевременных родов, если у вас короткая шейка матки и вы беременны только одним ребенком.
Прививки с прогестероном могут помочь снизить риск преждевременных родов, если вы беременны только одним ребенком и если у вас был ребенок, который родился рано в прошлом.
Если вы беременны более чем одним ребенком (двойней, тройней и более), лечение прогестероном не для вас.
Поговорите со своим врачом, чтобы узнать, подходит ли вам лечение прогестероном.
Что такое короткая шейка матки?
Шейка матки — это часть матки, которая открывается и укорачивается во время родов. Эти изменения позволяют шейке матки становиться тоньше и мягче, чтобы ваш ребенок мог пройти через родовые пути во время родов.
Ваша шейка матки короткая, если ее длина составляет менее 2 сантиметров (20 миллиметров). Если у вас короткая шейка матки, она может открыться слишком рано, еще до того, как ребенок будет готов к рождению.Когда шейка матки открывается слишком рано, это называется цервикальной недостаточностью или несостоятельностью шейки матки. Если у вас короткая шейка матки, вероятность преждевременных родов составляет 1 к 2 (50 процентов).
Ваш лечащий врач может обнаружить, что у вас короткая шейка матки во время ультразвукового исследования. Спросите своего врача о проведении УЗИ для проверки короткой шейки матки.
Что такое вагинальный прогестерон?
Вагинальный прогестерон может помочь предотвратить преждевременные роды, но только в том случае, если оба из них относятся к вам:
- У вас короткая шейка матки.
- Вы беременны одним ребенком.
Если и то, и другое относится к вам, ваш поставщик медицинских услуг может выписать вам рецепт на вагинальный прогестерон. Поставляется в виде геля, суппозитория или капсулы. Вы используете аппликатор, похожий на тампон, чтобы вводить прогестерон во влагалище каждый день. Вы можете начать лечение до или до 24 недель беременности и продолжать его до 37 недель. Вагинальный прогестерон может вызвать легкое раздражение кожи. Исследования не показали, что вагинальный прогестерон вызывает серьезные побочные эффекты у вас или вашего ребенка.
Исследования показывают, что вагинальный прогестерон не помогает отсрочить беременность людям, которые:
- Беременны более чем одним ребенком
- Есть преждевременный разрыв плодных оболочек
- Тест на фибронектин плода положительный
- Был успешно купирован приступ преждевременных родов
Что такое прививки с прогестероном?
Уколы прогестерона — это разновидность прогестерона, которая называется 17-альфа-гидроксипрогестерона капроат (также называемый 17P или Makena).Прививки можно делать беременным, у которых:
- Раньше были самопроизвольные преждевременные роды при беременности всего одним ребенком. Самопроизвольные означает, что роды начались сами по себе, без лекарств и других методов. Или мешочек вокруг ребенка рано сломался, вызвав роды.
- Беременны только одним ребенком.
- Нет заболеваний печени, нелеченого высокого кровяного давления или рака, чувствительного к гормонам.
Если это относится к вам, ваш врач может назначить уколы прогестерона.Вы начинаете делать прививки между 16 и 24 неделями беременности, и вам делают прививки каждую неделю до 37 недель.
Ваша медицинская страховка или программа Medicaid штата могут помочь в оплате прививок. В некоторых штатах вы можете получить разновидность 17P в специальных аптеках.
Даже если вам сделают прививки с прогестероном, они не всегда помогают предотвратить повторные преждевременные роды. Они не уменьшают ваши шансы на преждевременные роды, если вы беременны более чем одним ребенком. И они не уменьшают ваши шансы на ранние роды, если предыдущие преждевременные роды не были спонтанными.
Поговорите со своим врачом о безопасности и побочных эффектах уколов прогестерона. Вы можете испытывать некоторый дискомфорт в месте укола. 17P безопасен для вашего ребенка.
Последний раз рассмотрено: декабрь 2020 г. N Engl J Med 345 , 1400–1408 (2001).
CAS Статья PubMed Google ученый
Lydon, J. P. et al . У мышей, лишенных рецептора прогестерона, наблюдаются плейотропные репродуктивные аномалии. Genes Dev 9 , 2266–2278 (1995).
CAS Статья PubMed Google ученый
Lydon, J. P., DeMayo, F. J., Conneely, O. M. & O’Malley, B. W.Репродуктивные фенотпы мышей с нулевым мутантом по рецептору прогестерона. J Steroid Biochem Mol Biol 56 , 67–77 (1996).
CAS Статья PubMed Google ученый
Коннели, О. М., Мулак-Джеричевич, Б., ДеМайо, Ф., Лайдон, Дж. П. и О’Мэлли, Б. В. Репродуктивные функции рецепторов прогестерона. Recent Prog Horm Res 57 , 339–355 (2002).
CAS Статья PubMed Google ученый
Mulac-Jericevic, B., Lydon, J. P., DeMayo, F. J. и Conneely, O. M. Дефектный морфогенез молочной железы у мышей, лишенных изоформы b рецептора прогестерона. Proc Natl Acad Sci USA 100 , 9744–9749 (2003).
объявлений CAS Статья PubMed PubMed Central Google ученый
Mulac-Jericevic, B., Mullinax, R.A., DeMayo, F.J., Lydon, J.P. и Conneely, O.M. Подгруппа репродуктивных функций прогестерона, опосредованная изоформой рецептора прогестерона-b. Наука 289 , 1751–1754 (2000).
объявлений CAS Статья PubMed Google ученый
Arkaravichien, W. & Kendle, K. E. Критическая потребность в прогестероне для поддержания беременности у крыс с удаленными яичниками. J Reprod Fertil 90 , 63–70 (1990).
CAS Статья PubMed Google ученый
Сонг, Х., Хан, К. и Лим, Х. Прием прогестерона увеличивает восприимчивость матки к имплантации бластоцисты у мышей. Репродукция 133 , 487–493 (2007).
Артикул PubMed Google ученый
Csapo, A. I., Pulkkinen, M. O. & Wiest, W. G. Эффекты лютеэктомии и заместительной терапии прогестероном у пациенток с ранней беременностью. Am J Obstet Gynecol 115 , 759–765 (1973).
CAS Статья PubMed Google ученый
Гинзбург К.А. Дефект лютеиновой фазы. Этиология, диагностика и лечение. Endocrinol Metab Clin North Am 21 , 85–104 (1992).
CAS PubMed Google ученый
Пейрон, Р. и др. . Раннее прерывание беременности мифепристоном (ru 486) и перорально активным простагландином мизопростолом. N Engl J Med 328 , 1509–1513 (1993).
CAS Статья PubMed Google ученый
Боггаварапу, Н. Р. и др. . Влияние низких доз мифепристона на процесс имплантации человеческого эмбриона в трехмерную систему совместного культивирования человеческого эндометрия in vitro . Контрацепция 94 , 143–151 (2016).
CAS Статья PubMed Google ученый
Медицина, T. P. C. O. Текущая клиническая неуместность недостаточности лютеиновой фазы: мнение комитета. Fertil Steril 103 , e27 – e32 (2015).
Google ученый
Фатеми, Х. М., Попович-Тодорович, Б., Папаниколау, Э., Доносо, П. и Деврой, П. Обновление поддержки лютеиновой фазы в стимулированных циклах ЭКО. Обновление Hum Reprod 13 , 581–590 (2007).
CAS Статья PubMed Google ученый
Мезен, Т. Б. и Янг, С. Л. Прогестерон и лютеиновая фаза: необходимое для размножения. Obstet Gynecol Clin North Am 42 , 135–151 (2015).
Артикул PubMed PubMed Central Google ученый
Боза, А., Апи, М., Каятас, С., Джейхан, М. и Боза, Б. Необходимы ли добавки прогестагена для предотвращения аборта? J Obstet Gynaecol 36 , 1076–1079 (2016).
CAS Статья PubMed Google ученый
Saccone, G., Schoen, C., Franasiak, JM, Scott, RJ & Berghella, V. Прием прогестагенов в первом триместре беременности для предотвращения выкидыша у женщин с невынашиванием беременности без объяснения причин: систематический обзор и метаанализ рандомизированных контролируемых исследований. Fertil Steril 107 , 430–438 (2017).
CAS Статья PubMed Google ученый
Янушпольский, Э.Х. Поддержка лютеиновой фазы при оплодотворении in vitro . Semin Reprod Med 33 , 118–127 (2015).
CAS Статья PubMed Google ученый
Аль-Аземи, М. и др. . Повышенный прогестерон во время стимуляции яичников для ЭКО. Reprod Biomed Online 24 , 381–388 (2012).
CAS Статья PubMed Google ученый
Лоуренц Б. и Фатеми Х. М. Влияние повышения прогестерона в фолликулярной фазе ЭКО на восприимчивость эндометрия. Reprod Biomed Online 34 , 422–428 (2017).
CAS Статья PubMed Google ученый
Убальди, Ф. и др. . Оценка эндометрия с помощью аспирационной биопсии в день извлечения ооцитов в циклах переноса эмбриона у пациентов с повышением уровня прогестерона в сыворотке во время фолликулярной фазы. Fertil Steril 67 , 521–526 (1997).
CAS Статья PubMed Google ученый
Venetis, C.A. et al . Связано ли повышение прогестерона в день введения хорионического гонадотропина человека с вероятностью беременности при оплодотворении in vitro ? Систематический обзор и метаанализ. Обновление Hum Reprod 13 , 343–355 (2007).
CAS Статья PubMed Google ученый
Киру, Д. и др. . Высокая экспозиция прогестерона между окончанием менструации и днем начала окончательного созревания ооцитов связана с уменьшением вероятности беременности у пациентов, получавших оплодотворение in vitro и интрацитоплазматическую инъекцию сперматозоидов. Fertil Steril 96 , 884–888 (2011).
CAS Статья PubMed Google ученый
Bosch, E. и др. . Уровни циркулирующего прогестерона и частота продолжающихся беременностей в контролируемых циклах стимуляции яичников для оплодотворения in vitro : анализ более 4000 циклов. Hum Reprod 25 , 2092–2100 (2010).
CAS Статья PubMed Google ученый
Венетис, К. А., Колибианакис, Э. М., Босду, Дж. К. и Тарлатзис, Б. С. Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Обновление Hum Reprod 19 , 433–457 (2013).
CAS Статья PubMed Google ученый
Стюарт К. Л. и др. . Имплантация бластоцисты зависит от материнской экспрессии фактора ингибирования лейкемии. Nature 359 , 76–79 (1992).
объявлений CAS Статья PubMed Google ученый
Cheng, J. G., Chen, J. R., Hernandez, L., Alvord, W. G. и Stewart, C.L. Двойной контроль экспрессии lif и функции рецептора lif регулирует активацию stat3 в начале восприимчивости матки и имплантации эмбриона. Proc Natl Acad Sci USA 98 , 8680–8685 (2001).
объявлений CAS Статья PubMed PubMed Central Google ученый
Чен, Б., Пань, Х., Чжу, Л., Дэн, Ю. и Поллард, Дж.W. Прогестерон ингибирует эстроген-индуцированный путь фосфоинозитид-3-киназы–> AKT> GSK-3beta–> циклин D1–> pRB, блокируя пролиферацию эпителиальных клеток матки. Мол Эндокринол 19 , 1978–1990 (2005).
CAS Статья PubMed Google ученый
Дас, С. К. и др. . Амфирегулин — это специфичный для имплантации и регулируемый прогестероном ген в матке мыши. Mol Endocrinol 9 , 691–705 (1995).
CAS PubMed Google ученый
Мацумото, Х., Чжао, X., Дас, С. К., Хоган, Б. Л. и Дей, С. К. Индийский еж как прогестерон-чувствительный фактор, опосредующий эпителиально-мезенхимные взаимодействия в матке мыши. Dev Biol 245 , 280–290 (2002).
CAS Статья PubMed Google ученый
Такамото, Н., Zhao, B., Tsai, S. Y. & DeMayo, F. J. Идентификация индийского ежа как прогестерон-чувствительного гена в матке мыши. Мол Эндокринол 16 , 2338–2348 (2002).
CAS Статья PubMed Google ученый
Кимура, Ф. и др. . Рибонуклеиновая кислота-мессенджер для децидуального пролактина мыши присутствует и индуцируется во время in vitro децидуализации стромальных клеток эндометрия. Гинекол Эндокринол 15 , 426–432 (2001).
CAS Статья PubMed Google ученый
Гу, Х. и др. . Стресс эндоплазматического ретикулума децидуальной оболочки мышей на ранних сроках беременности. Mol Cell Endocrinol 434 , 48–56 (2016).
CAS Статья PubMed Google ученый
Brosens, J.J., Hayashi, N. & White, J.O. Рецептор прогестерона регулирует экспрессию децидуального пролактина в дифференцирующихся стромальных клетках эндометрия человека. Эндокринология 140 , 4809–4820 (1999).
CAS Статья PubMed Google ученый
Grinius, L., Kessler, C., Schroeder, J. & Handwerger, S. Фактор транскрипции Forkhead foxo1a имеет решающее значение для индукции децидуализации человека. J Эндокринол 189 , 179–187 (2006).
CAS Статья PubMed Google ученый
Ramakrishna, K., Szwarc, M. M., Vasquez, Y. M., Peavey, M. C. & Mazur, E. C. Фактор транскрипции цинкового пальца промиелоцитарного лейкоза имеет решающее значение для децидуализации стромальных клеток эндометрия человека (2016).
Фокс, К., Морин, С., Чон, Дж. У., Скотт, Р. Дж. И Лесси, Б. А. Местные и системные факторы и имплантация: каковы доказательства? Fertil Steril 105 , 873–884 (2016).
Артикул PubMed PubMed Central Google ученый
Ли, К. Ю. и ДеМайо, Ф. Дж. Модели имплантации на животных. Репродукция 128 , 679–695 (2004).
CAS Статья PubMed Google ученый
Ма, У. Г., Сонг, Х., Дас, С. К., Париа, Б. К. и Дей, С. К. Эстроген является критическим фактором, определяющим продолжительность окна восприимчивости матки к имплантации. Proc Natl Acad Sci USA 100 , 2963–2968 (2003).
объявлений CAS Статья PubMed PubMed Central Google ученый
Смит, М. Г. О прерывании беременности у крыс путем инъекции экстракта фолликулярных фолликулов яичников. Булл Джонс Хопкинс Больница 39 , 203–214 (1926).
CAS PubMed Google ученый
Sun, X., Bartos, A., Whitsett, J. A. & Dey, S. K. Делеция gp130 или stat3 в матке свидетельствует о неудаче имплантации с повышенными эстрогенными реакциями. Мол Эндокринол 27 , 1492–1501 (2013).
CAS Статья PubMed PubMed Central Google ученый
Шапиро, Д., Бустанфар, Р., Сильверберг, К. и Янушпольски, Э. Х. Изучение доказательств: добавление прогестерона во время переноса свежих и замороженных эмбрионов. Reprod Biomed Online 29 (Приложение 1), S1 – S14 (2014).
CAS Статья PubMed Google ученый
Паломба, С., Сантаньи, С. и Ла Сала, Г. Б. Введение прогестерона при недостаточности лютеиновой фазы в репродуктивной системе человека: старая или новая проблема? J Ovarian Res 8 (2015).
van der Linden, M., Buckingham, K., Farquhar, C., Kremer, J.A.& Метвалли, М. Поддержка лютеиновой фазы для циклов вспомогательной репродукции. Кокрановская база данных Syst Rev D9154 (2011).
Kyrou, D. et al. . Влияет ли прекращение приема прогестерона на ранних сроках беременности у пациенток, получавших антагонист recfsh / gnrh, на частоту продолжающихся беременностей? Рандомизированное контролируемое исследование. Hum Reprod 26 , 1020–1024 (2011).
CAS Статья PubMed Google ученый
Киру, Д., Фатеми, Х. М., Турне, Х. и Девроей, П. Поддержка лютеиновой фазы у нормоовуляторных женщин, стимулированных цитратом кломифена для внутриматочного осеменения: необходимость или привычка? Hum Reprod 25 , 2501–2506 (2010).
CAS Статья PubMed Google ученый
Лю, Л. и др. . Влияние высокой концентрации прогестерона перед извлечением ооцитов на периимплантационный эндометрий. Reprod Biomed Online 31 , 739–746 (2015).
CAS Статья PubMed Google ученый
Labarta, E. et al. . Восприимчивость эндометрия нарушается у женщин с высоким уровнем циркулирующего прогестерона в конце фолликулярной фазы: анализ функциональной геномики. Hum Reprod 26 , 1813–1825 (2011).
CAS Статья PubMed Google ученый
Healy, M. W. et al . Улучшает ли перенос замороженного эмбриона эффект повышенного прогестерона, наблюдаемый в циклах переноса свежего эмбриона? Fertil Steril 105 , 93–99 (2016).
CAS Статья PubMed Google ученый
Lu, X. et al . Повышенный уровень прогестерона в день запуска не ухудшает исход циклов лечения менотропинами, гонадотропином и медроксипрогестерона ацетатом человека. Научный представитель 6 , 31112 (2016).
объявлений CAS Статья PubMed PubMed Central Google ученый
Янг, С. Л., Саварис, Р. Ф., Лесси, Б. А., Шарки, А. М., Бальтазар, У. Влияние рандомизированной концентрации прогестерона в сыворотке на гистологическое развитие секреторного эндометрия и экспрессию генов. Hum Reprod (2017).
Пираер, К. и др. .Влияние поддержки лютеиновой фазы с помощью вагинального прогестерона на частоту клинической беременности в циклах внутриматочной инсеминации, стимулированных гонадотропинами: рандомизированное многоцентровое исследование. Fertil Steril 106 , 1490–1495 (2016).
CAS Статья PubMed Google ученый
Накашима А. и др. . Влияние вспомогательных репродуктивных технологий на массу тела при рождении при рождении у одиночек: анализ 25 777 детей в национальном регистре вспомогательной репродукции Японии. Fertil Steril 99 , 450–455 (2013).
Артикул PubMed Google ученый
Ибрагим, Ю. и др. . Повышенный прогестерон и его влияние на массу тела при рождении после переноса свежих эмбрионов. J Assist Reprod Genet (2017).
Дей, С. К. и др. . Молекулярные сигналы к имплантации. Endocr Rev 25 , 341–373 (2004).
CAS Статья PubMed Google ученый
Ван, Х. и Дей, С. К. Дорожная карта имплантации эмбриона: подсказки на моделях мышей. Nat Rev Genet 7 , 185–199 (2006).
Артикул PubMed Google ученый
Хуэт-Хадсон, Ю. М., Эндрюс, Г. К. и Дей, С. К. Типичная локализация белка c-myc в матке мыши: модуляция стероидными гормонами и анализ периимплантационного периода. Эндокринология 125 , 1683–1690 (1989).
CAS Статья PubMed Google ученый
Franco, H. L. et al. . Эпителиальный рецептор прогестерона играет плейотропную роль в развитии и функционировании матки. Faseb J 26 , 1218–1227 (2012).
CAS Статья PubMed PubMed Central Google ученый
Wetendorf, M. et al. .Снижение уровня рецептора эпителиального прогестерона a в окне рецептивности требуется для подготовки эндометрия к прикреплению эмбриона †. Biol Reprod 96 , 313–326 (2017).
Артикул PubMed Google ученый
Янг, З. М., Чен, Д. Б., Ле, С. П. и Харпер, М. Дж. Дифференциальная гормональная регуляция фактора ингибирования лейкемии (lif) в матке кроликов и мышей. Mol Reprod Dev 43 , 470–476 (1996).
CAS Статья PubMed Google ученый
Mariee, N., Li, T. C. & Laird, S. M. Экспрессия фактора ингибирования лейкемии и интерлейкина 15 в эндометрии у женщин с рецидивирующей неудачей имплантации после ЭКО; Корреляция с количеством естественных киллеров эндометрия. Hum Reprod 27 , 1946–1954 (2012).
CAS Статья PubMed Google ученый
Накамура, Х. и др. . Мышиная модель бесплодия человека: временное и локальное ингибирование активации stat-3 эндометрия приводит к неудаче имплантации. Febs Lett 580 , 2717–2722 (2006).
CAS Статья PubMed Google ученый
Димитриадис, Э., Шарки, А. М., Тан, Ю. Л., Саламонсен, Л. А. и Шервин, Дж. Р. Иммунолокализация фосфорилированного статата 3, интерлейкина 11 и фактора ингибирования лейкемии в эндометрии женщин с необъяснимым бесплодием во время периода имплантации. Reprod Biol Endocrinol 5 , 44 (2007).
Артикул PubMed PubMed Central Google ученый
Ли, К. и др. . Индийский еж — главный медиатор передачи сигналов прогестерона в матке мышей. Нат Генет 38 , 1204–1209 (2006).
CAS Статья PubMed Google ученый
Малый Д. Дж. И Папа Ф. Р. Датчики реакции развернутого белка. Nat Chem Biol 10 , 892–901 (2014).
CAS Статья PubMed PubMed Central Google ученый
Лю, А. Х. и др. . Устойчивый стресс эндоплазматического ретикулума как кофактор окислительного стресса в децидуальных клетках пациенток с ранним невынашиванием беременности. J Clin Endocrinol Metab 96 , E493 – E497 (2011).
CAS Статья PubMed Google ученый
Liong, S. & Lappas, M. Стресс эндоплазматического ретикулума увеличивается после спонтанных родов в мембранах плода и миометрии человека, где он регулирует экспрессию медиаторов пролаборации. Биол Репрод 91 , 70 (2014).
Артикул PubMed Google ученый
Кьятанахалли, К. и др. . Регулирование продолжительности гестационного периода зависит от каспаз-3 и -7-зависимых белков эндоплазматического ретикулума матки, вызванных стрессом. Proc Natl Acad Sci USA 112 , 14090–14095 (2015).
объявлений CAS Статья PubMed PubMed Central Google ученый
Brosens, J. J. et al. . Маточный отбор человеческих эмбрионов при имплантации. Sci Rep-Uk 4 (2015).
Lei, W. et al . Прогестерон и повреждение ДНК стимулируют пролиферацию и децидуализацию клеток матки за счет активации экспрессии рибонуклеотидредуктазы 2 у мышей на ранних сроках беременности. J Biol Chem 287 , 15174–15192 (2012).
CAS Статья PubMed PubMed Central Google ученый
Лиан И. А. и др. . Повышенный стресс эндоплазматического ретикулума децидуальной ткани в результате беременностей, осложненных задержкой роста плода с преэклампсией и без нее. Плацента 32 , 823–829 (2011).
CAS Статья PubMed PubMed Central Google ученый
Wang, T. S. et al. . Нарушение регуляции пути Lif-Stat3 отвечает за нарушение имплантации эмбриона в модели мышей с индуцированным стрептозотоцином диабетом. Biology Open 4 , 893–902 (2015).
CAS Статья PubMed PubMed Central Google ученый
Крикун, Г. и др. . Новая иммортализованная линия стромальных клеток эндометрия человека с нормальным прогестационным ответом. Эндокринология 145 , 2291–2296 (2004).
CAS Статья PubMed Google ученый
Qi, Q. R. et al . Участие атипичного фактора транскрипции e2f8 в полиплоидизации во время децидуализации мыши и человека. Клеточный цикл 14 , 1842–1858 (2015).
CAS Статья PubMed PubMed Central Google ученый
van Schadewijk, A., Van’T, WE, Stolk, J. & Hiemstra, PS Количественный метод обнаружения мРНК сплайсированного x-box-связывающего белка-1 (xbp1) в качестве показателя эндоплазматического ретикулума. (э) стресс. Шапероны клеточного стресса 17 , 275–279 (2012).
CAS Статья PubMed Google ученый
Цзо, Р. Дж. и др. . Варбург-подобный гликолиз и лактатный челнок в децидуальной оболочке мышей на ранних сроках беременности. J Biol Chem 290 , 21280–21291 (2015).
CAS Статья PubMed PubMed Central Google ученый
Границы | Действия прогестерона при развитии центральной нервной системы
Введение
Прогестерон (Прегн-4-ен-3,20-дион) — половой стероидный гормон, классически связанный с женскими репродуктивными функциями, включая сексуальное поведение, подготовку матки к имплантации эмбриона и поддержание беременности (Wu et al., 2018). Хотя этот гормон в основном синтезируется в яичниках и плаценте, он также вырабатывается корой надпочечников, а также центральной нервной системой (ЦНС) как самцов, так и самок млекопитающих (Gutai et al., 1977; Mensah-Nyagan et al. , 1999; Tuckey, 2005). Кроме того, у самок некоторых видов уровень прогестерона в циркулирующей плазме выше, чем у самцов (Tuckey, 2005; Lauretta et al., 2018). Однако тот факт, что и мужчины, и женщины синтезируют этот гормон, указывает на то, что его функции не ограничиваются женской репродуктивной физиологией.Например, прогестерон регулирует различные нерепродуктивные функции ЦНС, связанные с нейропротекцией, нейромодуляцией, миелинизацией, нейрогенезом, пластичностью нейронов и настроением (Snyder and Hull, 1980; Schumacher et al., 2004). Поэтому, учитывая, что прогестерон синтезируется, метаболизируется и оказывает свое действие на ЦНС, его называют нейростероидом.
Синтез прогестерона и его действие в ЦНС описаны у нескольких видов позвоночных. В частности, нейроны и глиальные клетки мозга могут синтезировать его de novo из холестерина, поскольку они экспрессируют ферменты, ответственные за его синтез и метаболизм (Testas et al., 1989; Меллон и Дешеппер, 1993; Шумахер и др., 2004). После этого прогестерон, образующийся в результате локального синтеза циркулирующей плазмы или ЦНС, связывается со своими специфическими внутриклеточными и мембранными рецепторами, чтобы регулировать молекулярные и клеточные процессы, лежащие в основе функций мозга. Более того, накопленные данные позволяют предположить, что действие прогестерона в ЦНС не ограничивается взрослой жизнью и присутствует с момента зародыша во время нервного развития у обоих полов (Schumacher et al., 2014).
Существующие данные указывают на участие прогестерона в некоторых ключевых событиях, таких как нейрогенез, нейропротекция, организация нервных цепей, олигодендрогенез, миелинизация и дифференциация пола мозга. Примечательно, что беременность характеризуется повышением уровня прогестерона как в плазме матери, так и в кровообращении плода. Фактически, ферменты, ответственные за синтез прогестерона, и рецепторы прогестерона, как было замечено, экспрессируются на ранних этапах жизни плода у нескольких видов, включая цыплят, грызунов, овец и людей (Milewich et al., 1991; Укена и др., 1999; Камачо-Арройо и др., 2003; Nguyen et al., 2003). Поэтому было высказано предположение, что прогестерон играет фундаментальную роль в адаптации мозга матери и плода во время беременности, а также позже во время критических событий в развитии ЦНС (Pluchino et al., 2016).
В этом обзоре мы суммируем влияние прогестерона на молекулярные и клеточные процессы, лежащие в основе развития ЦНС. Кроме того, учитывая, что процессы канцерогенеза часто повторяют программы развития, в конце обзора представлены некоторые сведения о возможном участии прогестерона в развитии опухолей ЦНС.
Синтез прогестерона и механизмы его действия
Синтез и источники прогестерона в развивающейся ЦНС
У позвоночных холестерин является обычным предшественником биосинтеза прогестерона. В частности, он поглощается стероидогенными клетками эндокринных тканей (в основном яичников у женщин и надпочечников у мужчин) из плазмы крови, где он транспортируется в виде холестерина липопротеинов низкой плотности (ЛПНП) и усваивается рецепторами. опосредованный эндоцитоз в везикулах.Затем они сливаются с лизосомами, чтобы обеспечить высвобождение свободной формы холестерина, присутствующей в цитоплазме (Vickery, 1993; Schumacher et al., 2004), и запустить процесс стероидогенеза.
Важно отметить, что холестерин de novo также синтезируется стероидогенными клетками посредством конденсации двух молекул ацетил-КоА с образованием ацетоацетил-КоА, который последовательно превращается в 3-гидрокси-3-метилглутарил-КоА (HMG-CoA). После этого фермент HMG-CoA-редуктаза превращает HMG-CoA в мевалонат, который используется для производства двух предшественников холестерина, т.е.е., сквален и ланостерин, ферментами скваленсинтазы и ланостеринсинтазы, соответственно (Pasqualini and Chetrite, 2016).
Точно так же ЦНС является активным центром синтеза холестерина, учитывая, что гематоэнцефалический барьер не проницаем для холестерина ЛПНП. Следовательно, весь холестерин, присутствующий в ЦНС, происходит из его местного синтеза нейронами и глиальными клетками (астроцитами и олигодендроцитами) (Schumacher et al., 2004). Эта способность ЦНС синтезировать холестерин сохраняется от пренатального развития у различных видов млекопитающих, включая мышей, морских свинок, овец и людей (Dietschy, 2009).
Синтез прогестерона представляет собой консервативный путь у позвоночных, который начинается с транспорта накопленного холестерина с внешней на внутреннюю митохондриальные мембраны белками-переносчиками, такими как белок-транслокатор 18 кДа (TSPO) и стероидогенный белок острой регуляции ( StAR) (Sierra, 2004; Papadopoulos et al., 2006). После этого холестерин превращается во внутренней митохондриальной мембране в прегненолон с помощью цитохрома P450scc, который затем превращается в прогестерон как в митохондриях, так и в цитоплазме с помощью 3β-гидроксистероиддегидрогеназы (3β-HSD).Вновь синтезированный прогестерон может проявлять свои физиологические эффекты аутокринным и паракринным образом (Chaffkin et al., 1992; Schumacher et al., 2001) или может метаболизироваться ферментом 5α-редуктазы до 5α-дигидропрогестерона (5α-DHP ), который далее восстанавливается до аллопрегнанолона (3α, 5α-THP) 3α-гидроксистероид оксидоредуктазой (3α-HSD) (Рисунок 1) (Melcangi et al., 1998). Наконец, оба метаболита, 5α-DHP и аллопрегнанолон, являются активными нейростероидами, причем последний играет важную роль также во время развития ЦНС (Schumacher et al., 2014; Плучино и др., 2016).
Рисунок 1. Источники прогестерона для развивающейся ЦНС. Синтез прогестерона начинается с превращения холестерина в прегненолон цитохромом P450scc, который, в свою очередь, превращается в прогестерон ферментом 3β-HSD. После этого фермент 5α-редуктаза может метаболизировать прогестерон до 5α-дигидропрогестерона, который далее восстанавливается до аллопрегнанолона. Прогестерон, синтезируемый плацентой (яичниками у грызунов) во время беременности, проникает через плацентарный барьер, попадает в кровообращение плода и достигает развивающейся ЦНС.Однако надпочечники и ЦНС плода также являются местами, в которых прогестерон синтезируется и метаболизируется в течение пренатальной жизни.
Учитывая свою липофильную структуру, прогестерон, вырабатываемый стероидогенными тканями, включая гонады и надпочечники, может преодолевать гематоэнцефалический барьер и достигать ЦНС. Важно отметить, что ферменты, необходимые для синтеза и метаболизма прогестерона, также экспрессируются в нейрональных и глиальных клонах в ЦНС взрослого человека регионально и клеточно-зависимым образом (Testas et al., 1989; Меллон и Дешеппер, 1993; Шумахер и др., 2004). Однако присутствие этих ферментов не ограничивается взрослой жизнью, так как их экспрессия и активность также обнаруживаются в раннем возрасте нервного развития млекопитающих (Compagnone and Mellon, 2000).
Возможные действияпрогестерона на протяжении всего развития поддерживаются высокими концентрациями гормона во время беременности у млекопитающих как в кровотоке матери, так и плода (Morel et al., 2016). Например, было обнаружено, что концентрации прогестерона и его метаболита аллопрегнанолона в плазме крови плода женского и мужского пола повышаются на протяжении всей беременности у копытных (например,g., овцы) вместе с их концентрацией в мозге плода, особенно на поздних сроках беременности (Nguyen et al., 2003). Это указывает на то, что и прогестерон, и аллопрегнанолон играют важную роль в развитии ЦНС у млекопитающих.
Развивающийся плод млекопитающего постоянно подвергается воздействию прогестерона во время беременности. В то время как яичник плода не синтезирует активно стероидные гормоны до рождения у грызунов (Greco and Payne, 1994), уровни циркулирующего прогестерона у развивающихся самцов и самок грызунов и овец находятся на одинаковом уровне (Weisz and Ward, 1980; Nguyen et al., 2003). Таким образом, потенциальными источниками прогестерона для развивающегося плода были предположительно плацента, материнский яичник (особенно у грызунов), надпочечник плода и синтез de novo прогестерона в развивающейся ЦНС (рис. 1) (Compagnone and Mellon , 2000; Tuckey, 2005; Morel et al., 2016).
Превращение холестерина в прегнанолон с помощью P450scc является первым этапом, ограничивающим скорость синтеза прогестерона. Фактически, экспрессия белка P450scc обнаруживается с помощью иммуногистохимии в клетках нервного гребня, начиная с 9-го дня эмбриона.5 (E9.5) у мышей и на E10.5 у крыс (Compagnone et al., 1995). Эта экспрессия сохраняется на протяжении всего внутриутробного развития и продолжает обнаруживаться до рождения в структурах периферической нервной системы (ПНС), происходящих из нервного гребня, включая ганглии задних корешков, ганглии тройничного нерва и сетчатку. Кроме того, мыши и крысы проявляют экспрессию P450scc в нейронах, астроцитах и олигодендроцитах различных областей мозга (например, коры головного мозга, таламуса, гипоталамуса, гиппокампа и спинного мозга) во время пренатальной жизни, после рождения и во взрослом возрасте (Mellon and Deschepper, 1993). ; Compagnone et al., 1995). Напротив, мозжечковый P450scc экспрессируется только у самцов крыс в раннем постнатальном периоде (Ukena et al., 1998).
Точно так же экспрессия 3β-HSD была обнаружена в ЦНС во время пренатального и раннего постнатального развития у нескольких позвоночных, и особенно у видов млекопитающих. Интересно, что хотя экспрессия и активность 3β-HSD значительно увеличивались во всем мозге прямо перед рождением и в первые постнатальные дни у грызунов и овец, без заметного полового диморфизма, мозжечок демонстрирует самую высокую продукцию прогестерона в ЦНС во время новорожденных. жизнь у крыс (Укена и др., 1999; Компаньоне и Меллон, 2000; Сакамото и др., 2001; Nguyen et al., 2003). В этот период развития ЦНС претерпевает необходимые процессы развития, такие как синаптогенез, миелинизация, организация и ремоделирование нервных цепей (Stiles and Jernigan, 2010). Хотя экспрессия и активность 3β-HSD важны во время постнатального развития ЦНС, ферментативная активность 3β-HSD наблюдалась уже во втором триместре беременности в мозге плода человека, что указывает на то, что синтез прогестерона присутствует в пренатальном развитии (Milewich и другие., 1991).
Что касается ферментов, участвующих в метаболизме прогестерона, экспрессия и активность как 5α-редуктазы, так и 3α-HSD были обнаружены в мозге плода женского и мужского пола морских свинок и овец со второй половины беременности и на поздних сроках беременности. у грызунов. Это приводит к высоким концентрациям аллопрегнанолона в различных областях мозга у всех упомянутых видов в течение пренатальных и первых постнатальных дней (Compagnone and Mellon, 2000; Nguyen et al., 2003; Kelleher et al., 2011; Hirst et al., 2014). Более того, уровни как P450scc, так и 5α-редуктазы увеличиваются в ЦНС на поздних сроках беременности, что позволяет предположить, что ЦНС обладает наибольшей способностью к синтезу прогестерона и аллопрегнанолона во время родов (Nguyen et al., 2003; Kelleher et al., 2011).
Прогестерон необходим для поддержания беременности, и его уровни в кровотоке у беременных женщин увеличиваются от шести до восьми раз по сравнению с небеременными субъектами из-за секреции плаценты (Lee et al., 2017). Существующие данные, полученные от беременных крыс, показывают, что прогестерон из материнского кровотока попадает в кровоток плода и достигает развивающейся ЦНС, связываясь с ее внутриклеточными рецепторами (Wagner and Quadros-Mennella, 2017). Кроме того, предполагается, что прогестерон из плаценты человека способствует адекватному развитию нервной системы, играя определенную роль в нейропротекции и развитии нервных цепей. Эта точка зрения подтверждается нарушением нервного развития, наблюдаемым при преждевременных родах, возможно, в результате преждевременного нарушения снабжения прогестероном и другим стероидным гормоном (Trotter et al., 2001), однако для подтверждения этого все еще необходимы более глубокие исследования.
Механизмы, лежащие в основе действия прогестерона при развитии ЦНС
Прогестерон регулирует несколько репродуктивных и не репродуктивных функций у позвоночных. В частности, его действие в клетках-мишенях обеспечивается двумя центральными путями, а именно классическим и неклассическим. Классический сигнальный путь (также известный как геномный путь) включает прогестерон, пересекающий плазматическую мембрану из-за его липофильной структуры и связывания с его внутриклеточным рецептором (PR).Это приводит к активации фактора транскрипции, который димеризуется и перемещается в ядро. Там он связывается со специфическими последовательностями ДНК [т.е. элементами ответа на прогестерон (PRE)], которые в основном расположены в промоторных областях генов, таким образом регулируя их экспрессию (рис. 2) (Camacho-Arroyo et al., 2002; Liu and Ogle , 2002).
Рисунок 2. Механизм действия прогестерона. Прогестерон воздействует на свои клетки-мишени двумя центральными путями, а именно классическим и неклассическим.В классическом пути прогестерон связывается со своим внутриклеточным рецептором (PR), активируя такой фактор транскрипции, который димеризуется и перемещается в ядро. Там он связывается со специфическими последовательностями ДНК, называемыми элементами ответа на прогестерон (PRE), которые в основном расположены в промоторных областях гена, регулируя их экспрессию. Напротив, неклассический путь включает независимую от PR-лиганда активацию мембраносвязанными киназами и активацию множества связанных с G-белком мембранных рецепторов прогестерона (mPR), что, в свою очередь, активирует пути, связанные с цАМФ-зависимой протеинкиназой A (PKA), Ca 2+ -зависимая протеинкиназа C (PKC), PI3K / Akt и ERK / MAPK.Кроме того, неклассическое действие прогестерона включает модуляцию рецепторов γ-аминомасляной кислоты типа A (ГАМК-A) после его превращения в аллопрегнанолон.
Хотя две изоформы PR (например, PR-A и PR-B) кодируются в одном и том же гене, они имеют разные стартовые сайты транскрипции, в результате чего PR-A является N-концевой усеченной формой полной изоформы PR-B. (Кастнер и др., 1990; Мезиано и др., 2011). Обе изоформы обнаруживаются в головном и спинном мозге позвоночных (Kato and Onouchi, 1997; Kastrup et al., 1999; Лабомбарда и др., 2002; Герра-Араиза и др., 2003; Camacho-Arroyo et al., 2018), и хотя они очень похожи по своей структуре, они обладают другим паттерном экспрессии, регуляцией и функцией. В целом, учитывая, что PR-B является более сильным активатором транскрипции, чем PR-A, они по-разному регулируют экспрессию генов (Horwitz et al., 1996). Транскрипционные функции изоформ PR, связанных с лигандом, включают рекрутирование коактиваторов (например, SRC-1 и CBP), транскрипцию корепрессоров (например,g., N-CoR1), консенсусные последовательности PRE, рекрутирование комплексов ремоделирования хроматина (например, комплекс SWI / SNF) и интеграция сигнальных путей из цитоплазмы, на которые, в свою очередь, влияет клеточный контекст. и / или стадии развития (Vicent et al., 2006; Kumar et al., 2013; Tetel, Acharya, 2013; Grimm et al., 2016).
С другой стороны, неклассический (или негеномный) сигнальный путь включает несколько молекулярных процессов, связанных с быстрыми клеточными ответами, в диапазоне от минут до нескольких часов после воздействия прогестерона.Примеры включают независимую от PR-лиганда активацию мембраносвязанными киназами, активацию связанных с G-белком мембранных рецепторов прогестерона (например, подтипы mPRα, mPRβ, mPRγ, mPRδ и mPRε), стимуляцию компонентов мембраны рецептора прогестерона (PGRMC1 / 2) для повышения активности mPR и модуляции рецепторов гамма-аминомасляной кислоты типа A (ГАМК-A) после превращения в аллопрегнанолон (рис. 2) (Follesa et al., 2001; Boonyaratanakornkit et al., 2008 ; Valadez-Cosmes et al., 2016). Кроме того, среди сигнальных путей либо внеядерная активация посредством PR-лиганд-независимой стимуляции, либо активация mPRs, цАМФ-зависимая протеинкиназа A (PKA), Ca 2+ -зависимая протеинкиназа C (PKC), PI3K / Можно найти путь Akt и ERK / MAPK (рисунок 2) (Zhu et al., 2003; Valadez-Cosmes et al., 2016; Garg et al., 2017).
Хотя экспрессия PR наблюдается в различных областях мозга, экспрессия его изоформ регулируется регионально и в процессе развития (таблица 1) (Camacho-Arroyo et al., 2003; Вагнер, 2008; Palliser et al., 2012). Хотя обе изоформы PR экспрессируются в головном мозге кур-самцов и самок уже на E8 (Camacho-Arroyo et al., 2003), их экспрессия в процессе развития более широко изучена у грызунов во время пренатальной и ранней постнатальной стадий. Фактически, экспрессия PR была обнаружена с помощью иммуногистохимии в областях переднего мозга крыс E17, которые включают миндалину, базальные ганглии, таламус, гиппокамп, субвентрикулярную зону и кору головного мозга.В последнем PR наблюдалось временно экспрессироваться во время перинатального развития крыс. Хотя он достигает повышенных уровней между E17 и постнатальным днем 2 (P2), он постепенно снижается до дня P14, последовательно для обоих полов (Quadros et al., 2007; Jahagirdar and Wagner, 2010), и его экспрессия сохраняется в зрелом возрасте (Camacho -Arroyo et al., 1998; Guerra-Araiza et al., 2001). Учитывая, что уровни PR специально повышаются в течение короткого периода после рождения в период времени, критический для созревания коры головного мозга у грызунов, было показано, что прогестерон вносит вклад в их адекватное корковое развитие благодаря своему классическому механизму действия (Jahagirdar and Wagner, 2010).Кроме того, было предложено, чтобы PR играл ключевую роль во время половой дифференциации мозга, так как его экспрессия была обнаружена из E18 в большинстве половых диморфных областей мозга крыс (например, преоптической области), со значительно более высокой экспрессией у самцов и не обнаруживаемой экспрессией. у женщин до 10-го дня постнатального развития (P10) (Quadros et al., 2002a). Другие области развивающейся ЦНС, экспрессирующие PR, включают поздний пренатальный и ранний постнатальный вентральный средний мозг мышей и крыс обоих полов. Таким образом, было показано, что прогестерон участвует в развитии связности нигростриатного пути (Beyer et al., 2002; Quadros et al., 2008) и раннее постнатальное развитие мозжечка у крыс (Quadros et al., 2008). Что касается действия прогестерона по неклассическому механизму в развивающейся ЦНС, недавно наблюдалась широко распространенная экспрессия mPRβ в головном и спинном мозге плода самок и самцов, начиная с E15.5 (Kasubuchi et al., 2017). Было высказано предположение, что прогестерон вносит вклад в глобальное развитие ЦНС, и было обнаружено, что его действие опосредуется как классическими, так и неклассическими путями.Таким образом, с действиями прогестерона во время развития ЦНС связаны многочисленные функции (рис. 3), которые будут описаны в следующих разделах.
Таблица 1. Экспрессия рецепторов прогестерона во время пренатального и раннего постнатального развития нервной системы.
Рисунок 3. События развития ЦНС, связанные с действием прогестерона. Стрелка времени представляет ход развития ЦНС во время пренатальной и ранней постнатальной жизни, а также некоторые события, связанные с действием прогестерона, происходящие по мере развития нервной системы.Эти действия включают пролиферацию и дифференцировку нейральных клеток-предшественников во время пренатального нейрогенеза, созревание олигодендроцитов и миелинизацию до и после рождения, нейропротекцию до и после рождения, половую дифференциацию мозга непосредственно перед и вскоре после рождения, а также созревание нервных клеток. схемы на поздних сроках беременности и в первые дни послеродового периода.
Действия прогестерона при развитии ЦНС
Влияние прогестерона на пролиферацию нервных клеток-предшественников и дифференцировку нейронов
Нейрогенез относится к образованию отдельных нейронов нервной системы из нейрональных клеток-предшественников.Действие прогестерона на нервные предшественники (рис. 3) было выдвинуто гипотезой, учитывая, что ранние нервные клетки-предшественники происходят из нейрогенных желудочковых и субвентрикулярных зон крыс, которые, как известно, экспрессируют молекулу адгезии полисиалированных нервных клеток (PSA-NCAM), которая может синтезировать и метаболизируют прогестерон (Gago et al., 2001). Клетки-предшественники PSA-NCAM сохраняют как нейрогенный, так и глиогенный потенциал дифференцировки, который в основном зависит от получаемых ими стимулов. Было показано, что прогестерон и аллопрегнанолон способствуют пролиферации предшественников PSA-NCAM, выделенных из мозга новорожденных крыс, в зависимости от концентрации и без различий между полами (Gago et al., 2004). Более того, аллопрегнанолон регулирует пролиферацию клеток в развивающейся коре головного мозга крыс, модулируя активность рецепторов ГАМК-А в течение ранней неонатальной жизни грызунов (Grobin et al., 2006). Кроме того, сообщалось, что прогестерон регулирует пролиферацию нервных клеток-предшественников в субгранулярной зоне зубчатой извилины гиппокампа овец и крыс (Yawno et al., 2009; Barha et al., 2011; Bali et al., 2012). является, наряду с субвентрикулярной зоной боковых желудочков, единственным местом в ЦНС, которое сохраняет нейрогенный потенциал в зрелом возрасте.
Влияние прогестерона на дифференцировку нейронов также исследовали в дофаминергическом нейрогенезе. В исследованиях in vitro описано, что прогестерон увеличивает количество дифференцированных дофаминергических нейронов и экспрессию переносчика дофамина в нейрональных предшественниках, происходящих из эмбриональных клеток мышей. Этот результат согласуется с дополнительными исследованиями in vivo , демонстрирующими аномалии дифференцировки дофаминергических нейронов у мышей с нокаутом PR (Woolley et al., 2006; Díaz et al., 2007, 2009), подчеркивая роль прогестерона в дофаминергическом нейрогенезе и установлении дофаминергических путей во время развития посредством классического механизма действия (Рисунок 2). Необходимо провести дальнейшие исследования для выявления механизмов, участвующих в дифференцировке нейронов, которым способствует прогестерон.
Роль прогестерона в миелинизации при развитии ЦНС
Положительные эффекты прогестерона на миелинизацию нервов были зарегистрированы у млекопитающих, начиная с его жизненно важной роли в стимулировании миелинизации периферических нервов, поврежденных после травматического повреждения на моделях грызунов (Schumacher et al., 2001). Эти наблюдения позже были распространены на ЦНС (Ghoumari et al., 2003), что привело к предложению терапевтического использования прогестерона для лечения демиелинизирующих поражений и заболеваний у людей (Schumacher et al., 2012). Более того, предполагалось, что прогестерон необходим для миелинизации нервов во время развития млекопитающих. Хотя у людей миелинизация начинается в ЦНС во время внутриутробной жизни на поздних сроках беременности, у грызунов она в основном возникает непосредственно перед рождением (рис. 3) (Barateiro and Fernandes, 2014).Используя органотипические культуры мозжечка, полученные от постнатальных крыс и мышей, было продемонстрировано, что прогестерон стимулирует миелинизацию, индуцируя пролиферацию клеток-предшественников олигодендроцитов (OPCs), способствуя их дифференцировке в олигодендроциты (миелинизирующие клетки ЦНС) и, наконец, ускоряя синтез миелина внутри эти клетки, о чем свидетельствует увеличение экспрессии основного белка миелина (MBP). Известно, что эти действия опосредуются активацией PR (рис.2), учитывая, что они ингибируются мифепристоном и стимулируются селективным агонистом PR R5020, аналогично прогестерону, одинаково для разных полов (Ghoumari et al., 2003, 2005).
Кроме того, прогестерон может способствовать миелинизации за счет его превращения в аллопрегнанолон, поскольку введение финастерида беременным морским свинкам снижает миелинизацию (измеряемую по экспрессии MBP) в подкорковом белом веществе потомства. Более того, блокировка прогестерона и других стероидных гормонов от материнской плаценты к плоду в середине беременности снижает экспрессию MBP в мозге плода. В этих экспериментах экспрессия PR повышается из-за снижения уровня прогестерона, эффект, который, как было обнаружено, выше у женщин (Palliser et al., 2012). Наблюдения за действием прогестерона при миелинизации также подтверждаются исследованиями in vitro с использованием органотипических культур мозжечка постнатальных мышей-самцов, подвергшихся воздействию лизофосфатидилхолина (LPC) в качестве модели демиелинизации. Обработка прогестероном значительно усиливала миелинизацию аксонов (что видно по иммуноокрашиванию MBP) по сравнению с необработанными культурами мозжечка и культурами мозжечка, полученными от мышей с нокаутом PR (Hussain et al., 2011). Важность прогестерона и его метаболитов в дифференцировке и миелинизации олигодендроцитов также подтверждается тем фактом, что OPC грызунов и зрелые олигодендроциты активно синтезируют и метаболизируют прогестерон на протяжении всего процесса образования миелина (Gago et al., 2001).
Наконец, было описано, что прогестерон стимулирует как пролиферацию OPC, так и дифференцировку олигодендроцитов в ЦНС взрослых крыс, особенно после демиелинизирующих повреждений (Labombarda et al., 2009). Это актуально, учитывая, что остаточные OPC, обнаруженные во взрослой ЦНС, продуцируются на ранних этапах жизни во время развития ЦНС, что указывает на то, что эти клетки сохраняют свою способность реагировать на прогестерон на протяжении всей жизни.
Организационные действия прогестерона во время нейроразвития
Нейроны и глиальные клетки образуют сложные функциональные сети, участвующие в нескольких функциях, выполняемых ЦНС.Хотя расположение этих сетей, обычно называемых нейронными цепями, варьируется в зависимости от соответствующей функции каждой области ЦНС (LoTurco, 2000), процессы, которые способствуют формированию таких нейронных цепей, во всем одинаковы. Общие механизмы, которые формируют нервные схемы, возникают на поздних этапах развития нервной системы (рис. 3) и включают созревание нейронов, ветвление аксонов и дендритов, управление аксонами, поддерживаемое глиальными клетками, установление синаптических связей между нейронами и устранение неправильных связей (Weiner et al. ., 2013). Прогестерон способствует организации и установлению нервных цепей во время развития млекопитающих, способствуя созреванию клеток, образованию дендритов, синаптогенезу и миелинизации аксонов, как это было зарегистрировано у крыс и морских свинок (Sakamoto et al., 2001; Tsutsui, 2008; Palliser et al. , 2012).
Организационные эффекты прогестерона в основном исследовались на развивающемся мозжечке крыс. Фактически, экспрессия фермента цитохрома P450scc сразу же обнаруживается в этой области после дифференцировки нейрона Пуркинье, тогда как экспрессия фермента 3β-HSD прогрессивно увеличивается после рождения, что сопровождается усилением синтеза прогестерона нейронами Пуркинье (Ukena et al., 1998, 1999) в критический период формирования нервных цепей в коре мозжечка. Используя культуры срезов мозжечка от новорожденных крыс-самцов, было выявлено, что прогестерон увеличивает рост дендритов и формирование дендритных шипов в зависимости от дозы за счет его взаимодействия с PR (рис. 2). Напротив, синаптическая плотность нейронов Пуркинье увеличивается in vivo , когда новорожденных крыс-самцов обрабатывают экзогенным прогестероном, что наблюдается с помощью электронной микроскопии (Sakamoto et al., 2001, 2002). Это свидетельствует о том, что эндогенный прогестерон, синтезируемый de novo нейронами Пуркинье крыс, активно участвует в формировании нервной цепи мозжечка после рождения (Sakamoto et al., 2002), способствуя росту дендритов Пуркинье и синаптогенезу за счет усиления экспрессии нейротрофических факторов, участвующих в такие процессы [т.е. нейротрофический фактор головного мозга (BDNF) и нейротрофин-3 (NTF3)] (Tsutsui et al., 2011).
Кроме того, предполагается, что прогестерон влияет на формирование корковых нервных цепей.Экспрессия PR регулируется онтогенетически в коре головного мозга и была обнаружена уже на E18 в субпластинке крыс, слое кортикальных нейронов, необходимых для созревания коры головного мозга и организации контуров. Экспрессия PR в постнатальной коре головного мозга достигает пика в возрасте P2, после чего она постепенно снижается до P14. Этот период высокой экспрессии PR совпадает с критическим периодом коркового развития и установления связи у крыс (Jahagirdar and Wagner, 2010). Кроме того, хотя экспрессия PR обнаруживается в пирамидных нейронах коркового слоя V, а также в корковых слоях II и III крыс P3 и P6, соответственно, достигая пика экспрессии между P7 и P10, позже она снижается до уровня P27 (Quadros и другие., 2007; Лопес и Вагнер, 2009). Эти наблюдения показывают, что экспрессия PR актуальна для нормального развития коры головного мозга, что подтверждается исследованием на модели мышей с нокаутом PR , в котором самцы и самки сообщали о нарушениях своих соматосенсорно-зависимых моторных рефлексов из-за неправильного развития сенсомоторной коры (Willing and Wagner , 2014). Аналогичным образом, другое исследование показало, что введение экзогенного прогестерона беременным крысам увеличивает ветвление дендритов и количество дендритных шипов в пирамидных нейронах соматосенсорной коры потомства (Menzies et al., 1982), подчеркивая решающую роль активации PR прогестероном в формировании корковых нервных цепей.
Сходный паттерн экспрессии PR наблюдается также в развивающемся мезокортикальном (дофаминергическом) пути у мышей и крыс, который проецируется из вентральной тегментальной области среднего мозга (VTA) в префронтальную кору. У обоих видов экспрессия PR высока в течение первой постнатальной недели, а затем снижается у обоих полов. Введение мифепристона в этот постнатальный период снижает как экспрессию тирозингидроксилазы в VTA, так и дофаминергическую иннервацию предлимбической префронтальной коры (особенно у самцов крыс), ухудшая когнитивное поведение в более зрелом возрасте (Beyer et al., 2002; Quadros et al., 2008; Виллинг и Вагнер, 2016). Эти данные предполагают, что прогестерон также участвует в адекватном создании нервных цепей мезокортикального дофаминергического пути.
Влияние прогестерона на половую дифференциацию мозга
Учитывая значительные различия в экспрессии PR в нескольких областях мозга у самцов и самок позвоночных на критических стадиях развития нервной системы, было высказано предположение, что прогестерон участвует в половой дифференциации мозга.
Различия в пренатальной и постнатальной экспрессии PR у самцов и самок крыс наблюдаются в половых диморфных областях мозга, таких как медиальное преоптическое ядро (MPN) преоптической зоны, дугообразное ядро и паравентрикулярное ядро (PVN) гипоталамуса. Хотя экспрессия PR в этих регионах обнаруживается на уровнях мРНК и белка у самцов из E18, она наблюдается только у самок из P10 (Quadros et al., 2002a, 2007). Половые различия в диморфных областях отмечаются также в экспрессии изоформ PR в головном мозге новорожденных цыплят.Фактически, гипоталамус женщин имеет более высокое содержание PR-A по сравнению с гипоталамусом мужчин в постнатальном возрасте P1 (Camacho-Arroyo et al., 2018).
Наблюдаемые различия в экспрессии PR указывают на существование периода во время развития нервной системы (рис. 3), в течение которого мужской мозг более чувствителен, чем женский мозг, к действиям прогестерона, в частности в структурах, связанных с репродуктивными функциями и сексуальным поведением в зрелом возрасте. . Интересно, что увеличение экспрессии PR в головном мозге совпадает с периодом маскулинизации, индуцированной андрогенами во время пренатального развития у мышей (Desroziers et al., 2017). Кроме того, экспрессия PR в преоптической области и гипоталамусе у развивающихся самцов крыс увеличивается на E18 одновременно с началом секреции тестостерона семенниками. Принимая во внимание, что тестостерон метаболизируется до эстрадиола ферментом ароматазы и что связанный с лигандом ядерный рецептор эстрадиола (т.е. ERα) напрямую повышает экспрессию PR (Weisz and Ward, 1980; Petz et al., 2004), предполагается, что тестостерон способствует регулируют экспрессию PR в этих областях мозга во время развития крысы после его превращения в эстрадиол (Quadros et al., 2002c). Это подтверждается снижением уровней экспрессии PR, наблюдаемым в гипоталамусе новорожденных самцов крыс, которые либо подвергались воздействию ингибитора ароматазы андростатриендиона, либо чья экспрессия гена ароматазы подавлялась (Quadros et al., 2002c; Brock et al., 2010). Это вызывает ненормальное сексуальное поведение мужчин в зрелом возрасте.
Эти исследования показывают, что действие прогестерона и косвенная активация PR тестостероном в полодиморфных областях мозга способствуют маскулинизации мозга у развивающихся мужчин.Аналогичным образом, исследование с использованием модели маскулинизированных самок крыс (после экзогенного введения тестостерона) показало, что лечение мифепристоном при рождении блокирует маскулинизационный эффект тестостерона в общем объеме MPN, который у самцов больше, чем у самок (Quadros et al. др., 2002b). Соответственно, самцы мышей с нокаутом по PR демонстрируют нарушенное половое поведение взрослых самцов (Phelps et al., 1998). Интересно, что новорожденные самцы мышей, получавшие антагонист ZK137316 PR во время критического периода маскулинизации мозга (P0 – P10), демонстрируют незначительные отклонения, связанные с половым поведением самцов во взрослом возрасте.Это контрастирует с женщинами, получавшими препубертатный период (P15 – P25), у которых наблюдается нарушение поведения при лордозе во взрослом возрасте (Desroziers et al., 2017), что позволяет предположить, что эффекты активации PR (рис. 2) на половую дифференциацию зависят от времени и пол регулируется во время развития.
Нейромодулирующие действия прогестерона во время развития нервной системы
Глутамат и ГАМК — самые распространенные нейротрансмиттеры в ЦНС. В частности, в то время как глутамат является основным возбуждающим нейромедиатором, ГАМК является основным тормозящим.Учитывая, что функциональность ЦНС зависит от решающего баланса нервного возбуждения и торможения (Petroff, 2002), прогестерон может оказывать нейромодулирующее действие через свои метаболиты, которые, в свою очередь, могут взаимодействовать со специфическими рецепторами нейротрансмиттеров, связанными с ионными каналами. Например, аллопрегнанолон является признанным положительным аллостерическим модулятором активности ионотропных рецепторов ГАМК-А, который усиливает проводимость хлорида, индуцированную ГАМК (рис.2) (Dorota et al., 1986; Hosie et al., 2006).
Было обнаружено, что во время развития нервной системы уровни прогестерона и аллопрегнанолона в ЦНС плода в основном повышаются на поздних сроках беременности у овец (Nguyen et al., 2003; Pluchino et al., 2016). Это открытие было связано с поддержанием супрессивной нервной активности в незрелой ЦНС за счет модуляции рецептора ГАМК-А, предотвращая, таким образом, эксайтотоксические процессы. Это согласуется с тем фактом, что экспрессия рецепторов ГАМК-А в мозге плода увеличивается по мере протекания беременности (Crossley et al., 2003; Hirst et al., 2014) и что нейростероидные модуляторы рецепторов ГАМК-А (например, аллопрегнанолон) подавляют активность ЦНС на поздних сроках беременности у плодов овцы. В то время как ГАМК проявляет ингибирующую активность в течение внутриутробной жизни у этого вида, она оказывает возбуждающую активность в мозге плода других видов (например, грызунов) (Bregestovski and Bernard, 2012). Это указывает на то, что аллопрегнанолон поддерживает характерное для сна поведение плода овцы до рождения, что важно для защиты мозга от ранней возбудительной активности (Nicol et al., 1999). Более того, ингибирование превращения прогестерона в аллопрегнанолон путем введения финастерида плоду овцы увеличивает как возбуждающую активность ЦНС, так и поведение, подобное возбуждению, как было обнаружено с помощью электрокортикографии, электромиографии мышц и измерений электроокулографии (Nicol et al., 2001). Это подтверждает идею о нейромодулирующем действии аллопрегнанолона в мозге плода, что способствует поддержанию адекватных физиологических состояний во время пренатальной жизни для развития ЦНС (Crossley et al., 2003; Yawno et al., 2007).
Что касается аллопрегнанолона, уместно упомянуть его эффекты в качестве анксиолитического и антидепрессивного препарата для женщин и грызунов в послеродовом периоде (Bitran et al., 1995; Osborne et al., 2017), которые опосредуются ГАМК-стимулированными хлорид-ионами. приток (рис. 2) в кору головного мозга матери (Bitran et al., 1995). Беременность у млекопитающих характеризуется повышением уровней прогестерона и аллопрегнанолона, присутствующих в плазме матери, а также в головном мозге матери и плода (Milewich et al., 1991; Осборн и др., 2017). Уровень материнского прогестерона начинает резко падать незадолго до рождения у большинства млекопитающих, чтобы обеспечить возможность родов. Действительно, повышенные уровни прогестерона и его метаболита аллопрегнанолона, присутствующие во время беременности, у людей постепенно снижаются до исходного уровня после родов (Tuckey, 2005). Это событие связано с развитием психоневрологического расстройства, называемого послеродовой депрессией, которое развивается у 15–20% женщин в послеродовом периоде (Yonkers et al., 2011; Osborne et al., 2017) и косвенно влияет на здоровое эмоциональное, поведенческое и когнитивное развитие новорожденного (Kanes et al., 2017). Кроме того, было обнаружено, что у женщин на поздних сроках беременности со значительной депрессией уровень аллопрегнанолона значительно ниже, чем у женщин без депрессивных симптомов (Hellgren et al., 2014). Интересно, что облегчение депрессивных симптомов у послеродовых женщин было успешно достигнуто в клинических испытаниях фазы 3 с использованием препарата брексанолон, аналога аллопрегнанолона (Meltzer-Brody et al., 2018). В целом, эти исследования показывают, что нейромодулирующие эффекты как прогестерона, так и его метаболита аллопрегнанолона важны не только для развивающейся ЦНС, но и для адаптации материнской ЦНС к беременности, что, в свою очередь, влияет на здоровое развитие потомства.
Нейропротекторное действие прогестерона во время развития
Защитные действия прогестерона в мозге взрослых мужчин и женщин широко наблюдались в исследованиях in vitro и in vivo .Например, прогестерон играет важную роль в неврологическом восстановлении после травм головного и спинного мозга или гипоксически-ишемического повреждения за счет уменьшения окислительного повреждения, сохранения митохондриальных функций и уменьшения гибели клеток (Deutsch et al., 2013; Andrabi et al., 2017 ). Это подтверждает клинические испытания, предлагающие прогестерон в качестве терапевтического средства для лечения пациентов с черепно-мозговой травмой (Wright et al., 2007).
ЦНС новорожденных млекопитающих все еще находится в стадии активного развития и демонстрирует процессы, которые необходимы для установления нервных цепей после рождения, включая синаптогенез и миелинизацию аксонов (рис. 3).Однако ранняя ЦНС очень восприимчива к повреждениям, таким как внутриутробные осложнения, неонатальная гипоксическая ишемия, вызванная асфиксией при рождении, и острая эксайтотоксичность, возникающая в результате чрезмерной активации рецепторов NMDA и AMPA в нейронах возбуждающим нейротрансмиттером глутаматом. Эти причины повреждения способствуют гибели нейронов и нарушению нейроразвития, что, в свою очередь, вызывает стойкий неврологический дефицит и неонатальную смерть (Peterson et al., 2015; Atif et al., 2016).
Как наблюдали в ЦНС взрослых крыс и овец, прогестерон и его метаболит аллопрегнанолон ослабляют повреждение ЦНС, когда оно индуцируется во время развития за счет регуляции пролиферации клеток, а также за счет уменьшения воспаления и апоптоза (Yawno et al., 2007, 2009; Barha et al., 2011; Peterson et al., 2015).
Лечение прогестероном в течение 5 дней уменьшает воспаление, в результате чего только несколько активированных клеток микроглии в коре и гиппокампе новорожденных крыс с повреждением головного мозга, вызванным воздействием гипоксии (Peterson et al., 2015). Кроме того, это исследование показало, что у детенышей, получавших прогестерон, наблюдалось улучшенное восстановление моторики и когнитивных функций через 20 дней после травмы у обоих полов по сравнению с животными, не получавшими лечения.Кроме того, этот положительный эффект был выше у мужчин, чем у женщин. В аналогичном исследовании с новорожденными мышами наблюдались эффекты прогестерона на воспаление и восстановление нейронов у новорожденных без значительных различий между самцами и самками. Это исследование показывает, что эффекты прогестерона могут быть опосредованы регуляцией секреции провоспалительных цитокинов, а также повышающей регуляцией экспрессии нейротрофического фактора BNDF и его специфического рецептора TrkB, участвующих в дифференцировке и выживании нейронов (Dixon and Sherrard , 2006; Atif et al., 2016).
Используя органотипические культуры срезов гиппокампа, полученные от самок и самцов крыс на 7-й день после рождения (P7), было продемонстрировано, что лечение прогестероном снижает гибель нейрональных клеток, вызванную недостатком кислорода / глюкозы. Эти защитные эффекты ослаблялись, когда культуры срезов обрабатывались одновременно мифепристоном и финастеридом, что указывает на то, что либо сам прогестерон, либо его метаболиты оказывают нейропротекторное действие во время развития (Ishihara et al., 2016). Интересно, что нарушение синтеза аллопрегнанолона введением финастерида у плодов овец обоих полов на 125-й день гестации усиливало апоптоз в областях СА3 и СА1 гиппокампа, а также в сером веществе мозжечка, что сопровождалось увеличением пролиферации реактивных астроцитов. .Эти эффекты были устранены при совместной инфузии финастерида и аналога аллопрегнанолона альфаксалона (Belelli and Lambert, 2005; Yawno et al., 2009).
Роль прогестерона в развитии опухолей ЦНС
Онкогенные процессы часто наблюдаются с точки зрения биологии развития, поскольку они часто повторяют молекулярные и клеточные процессы, осуществляемые стволовыми клетками, которые формируют организм во время развития. Рак рассматривается как ненормальная реактивация программы развития, в которой опухоль и вся ее внутриклеточная неоднородность могут быть визуализированы как развивающийся орган (Wechsler-Reya and Scott, 2001; Laug et al., 2018).
Глиомы являются наиболее распространенным и злокачественным типом опухолей, возникающих в ЦНС человека, и возникают в результате неконтролируемой пролиферации глии, предшественников глиальных клеток или раковых стволовых клеток (Louis et al., 2016). Астроцитомы являются наиболее частым типом глиомы (Ostrom et al., 2017), которые Всемирная организация здравоохранения (ВОЗ) классифицирует от I до IV степени в соответствии с их гистопатологическими и злокачественными характеристиками. В частности, степень IV, которую также называют мультиформной глиобластомой (GBM), является наиболее злокачественным типом астроцитомы (Louis et al., 2016; Ostrom et al., 2017) из-за его высокой способности размножаться и проникать в нормальную ткань мозга (Stupp et al., 2005). Несколько факторов в ЦНС способствуют онкогенезу ГБМ, и в последние годы в качестве факторов, участвующих в прогрессировании опухоли ГБМ, были предложены половые гормоны, особенно прогестерон. Первые сведения об участии прогестерона в развитии ГБМ появились из наблюдения, что клетки глиобластомы человека экспрессируют две изоформы PR (González-Agüero et al., 2007), предполагая функцию этих рецепторов при этом типе рака. Кроме того, исследования in vitro продемонстрировали, что прогестерон, присутствующий на физиологических уровнях (10 нМ), увеличивает содержание многих белков, включая SRC-1/3, p-Akt и p-Src (Hernández-Hernández et al., 2010 ; González-Orozco et al., 2018), в клетках GBM. Кроме того, было обнаружено, что такая же концентрация прогестерона усиливает экспрессию ключевых генов пролиферации клеток, неоваскуляризации и роста опухоли (например,g., фактор роста эндотелия сосудов, рецептор эпидермального фактора роста и циклин D1) (Hernández-Hernández et al., 2012). Точно так же прогестерон и аллопрегнанолон увеличивают пролиферацию, миграцию и инвазию клеток GBM in vitro (González-Agüero et al., 2007; Piña-Medina et al., 2016; Zamora-Sánchez et al., 2017). Более того, прогестерон также способствует росту опухоли GBM и инфильтрации в коре головного мозга крыс в модели ксенотрансплантата (Germán-Castelán et al., 2014, 2016), эффекты, которые в основном опосредуются PR, учитывая, что они частично блокируются в клетках GBM. после введения мифепристона (González-Agüero et al., 2007; Germán-Castelán et al., 2014; Piña-Medina et al., 2016). Это частичное ингибирование указывает на влияние неклассических механизмов действия прогестерона. Недавние исследования описывают, что клетки GBM экспрессируют как mPRα, так и mPRβ, и что специфическая активация mPRα селективным агонистом Org OD 02-0 вызывает пролиферацию и инвазию клеток (Valadez-Cosmes et al., 2015; González-Orozco et al., 2018). Подобные эффекты наблюдаются, когда PR активируется через лиганд-независимую активацию протеинкиназой C (González-Arenas et al., 2015; Marquina-Sánchez et al., 2017), предполагая взаимодействие между классическими и неклассическими механизмами действия прогестерона в прогрессировании опухолей ГБМ.
Напротив, высокие концентрации прогестерона (20–80 мкМ), как сообщалось, снижали рост опухоли GMB на модели ксенотрансплантата на мышах за счет увеличения апоптоза и ингибирования пролиферации клеток, что сопровождалось улучшением выживаемости (Atif et al., 2015). Эти результаты предполагают, что прогестерон способствует прогрессированию опухоли GBM, когда присутствует на физиологических уровнях, тогда как он имеет противоположные эффекты при высоких концентрациях, ингибируя рост GBM.
Заключение
Действие прогестерона выходит за рамки регуляции функций мозга, связанных с репродукцией. Фактически, его физиологические действия распространяются на несколько не репродуктивных функций в ЦНС как самцов, так и самок млекопитающих с раннего пренатального периода, регулируя фундаментальные молекулярные и клеточные процессы, лежащие в основе его правильного развития.
Понимание точной роли прогестерона и других стероидных гормонов имеет отношение к общему пониманию развития нервной системы и ее последующего нормального функционирования в течение жизни.Были достигнуты важные клинические успехи, в том числе внедрение прогестерона в доклинические испытания фазы 2 для оценки его эффективности в качестве нейропротектора у пациентов с черепно-мозговой травмой и недавний успех доклинических испытаний фазы 3 по лечению депрессии у женщин в послеродовом периоде с помощью с использованием аналогичных соединений аллопрегнанолона (Schumacher et al., 2012; Meltzer-Brody et al., 2018).
Перспективы
Изучение действия половых стероидных гормонов на развитие нервной системы в пренатальном и раннем постнатальном периоде еще предстоит широко изучить.Следовательно, эта область подразумевает многообещающие исследования, которые дадут нам лучшее понимание молекулярных и клеточных процессов, лежащих в основе механизмов, формирующих эту систему. Фактически, знание механизмов действия половых гормонов, в том числе прогестерона, необходимо для полного понимания критических процессов, которые происходят в нейроразвитии (например, нейрогенез, глиогенез, миелинизация, нейрозащита, созревание нервных цепей и половая дифференциация мозга). Как только станет известно точное участие половых гормонов в развитии нервной системы, эти знания могут быть преобразованы в попытки обратить вспять определенные патологии, связанные с упомянутыми процессами, во время постнатальной жизни.Понимание механизмов прогестерона и его метаболитов, типов активируемых клеточных рецепторов, задействованных сигнальных путей, регулируемых генов и цитокинов, секретируемых действием этих стероидов в нервной ткани, может быть полезным в клинической терапии для: (1) снизить восприимчивость ЦНС недоношенных детей к травмам, что, в свою очередь, может обеспечить нормальное поведенческое и когнитивное развитие младенца; (2) оптимизировать терапевтические стратегии, которые уже используются для облегчения симптомов депрессии и тревоги, наблюдаемых у послеродовых женщин; и (3) уменьшить повреждение при демиелинизирующих поражениях или заболеваниях.Наконец, понимание действия прогестерона в развитии опухолей головного мозга также может быть полезным для разработки более эффективных клинических подходов, направленных на остановку прогрессирования таких новообразований у пациентов.
Авторские взносы
Оба автора в равной степени внесли вклад в разработку рукописи.
Финансирование
Эта работа финансировалась «Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica» (PAPIIT), проект IN213117, DGAPA-UNAM, Мексика, и FOSISS / CONACyT (грант №272458).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Андраби, С.С., Парвез, С., Табассум, Х. (2017). Прогестерон вызывает нейрозащиту после вызванной реперфузией митохондриальной дисфункции после очаговой церебральной ишемии у крыс. Dis. Модели Mech. 10, 787–796.DOI: 10.1242 / dmm.025692
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Атиф, Ф., Юсуф, С., Стейн, Д. Г. (2015). Противоопухолевые эффекты прогестерона в мультиформной глиобластоме человека: роль передачи сигналов PI3K / Akt / mTOR. J. Steroid Biochem. Мол. Биол. 146, 62–73. DOI: 10.1016 / j.jsbmb.2014.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Атиф, Ф., Юсуф, С., Стейн, Д. Г. (2016). Прогестерон в лечении неонатального артериального ишемического инсульта и острых припадков: роль передачи сигналов BDNF / TrkB. Нейрофармакология 107, 317–328. DOI: 10.1016 / j.neuropharm.2016.03.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бали, Н., Аримото, Дж. М., Ивата, Н., Лин, С. В., Чжао, Л., Бринтон, Р. Д. и др. (2012). Дифференциальные ответы компонента-1 мембраны рецептора прогестерона (Pgrmc1) и классического рецептора прогестерона (Pgr) на 17β-эстрадиол и прогестерон в субрегионах гиппокампа, которые поддерживают синаптическое ремоделирование и нейрогенез. Эндокринология 153, 759–769.DOI: 10.1210 / en.2011-1699
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баратейро А., Фернандес А. (2014). Прогрессирование временной линии олигодендроцитов: модели пролиферации, дифференцировки и миелинизации in vitro. Biochim. Биофиз. Acta 1843, 1917–1929. DOI: 10.1016 / j.bbamcr.2014.04.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барха, К. К., Ишрат, Т., Эпп, Дж. Р., Галеа, Л. А. М., и Стейн, Д.Г. (2011). Лечение прогестероном нормализует уровни пролиферации и гибели клеток в зубчатой извилине гиппокампа после черепно-мозговой травмы. Exp. Neurol. 231, 72–81. DOI: 10.1016 / j.expneurol.2011.05.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бейер, К., Дамм, Н., Брито, В., и Кюпперс, Э. (2002). Экспрессия изоформ рецепторов прогестерона в среднем мозге мышей. Neuroreport 13, 877–880.DOI: 10.1097 / 00001756-200205070-00028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Битран Д., Шейх М. и МакЛеод М. (1995). Анксиолитический эффект прогестерона опосредуется нейростероидом аллопрегнанолоном на рецепторах GABAA головного мозга. J. Neuroendocrinol. 7, 171–177. DOI: 10.1111 / j.1365-2826.1995.tb00744.x
CrossRef Полный текст | Google Scholar
Буньяратанакорнкит, В., Би, Ю., Радд, М., и Эдвардс, Д. П. (2008). Роль и механизм активации рецепторов прогестерона внеядерных сигнальных путей в регуляции транскрипции генов и прогрессии клеточного цикла. Стероиды 73, 922–928. DOI: 10.1016 / j.steroids.2008.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брегестовски П., Бернар К. (2012). Возбуждающая ГАМК: как правильное наблюдение может оказаться экспериментальным артефактом. Фронт. Pharmacol. 3:65. DOI: 10.3389 / fphar.2012.00065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брок О., Духард К., Баум М. Дж. И Баккер Дж. (2010). Снижение препубертатной экспрессии рецептора прогестерона в гипоталамусе самок мышей с нокаутом ароматазы. Эндокринология 151, 1814–1821. DOI: 10.1210 / en.2009-1379
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камачо-Арройо, И., Гонсалес-Аренас, А., Гонсалес-Агуэро, Г., Герра-Араиса, К., и Гонсалес-Моран, Г. (2003). Изменение содержания изоформ рецептора прогестерона и рецептора эстрогена альфа в мозге цыплят в процессе эмбрионального развития. Комп. Биохим. Physiol. 136, 447–452. DOI: 10.1016 / S1095-6433 (03) 00204-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камачо-Арройо, I., Герра-Арайса, К., и Цербон, М. (1998). Изоформы рецепторов прогестерона по-разному регулируются половыми стероидами в переднем мозге крысы. Neuroreport 9, 3993–3996. DOI: 10.1097 / 00001756-199812210-00001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камачо-Арройо, И., Хансберг-Пастор, В., Гутьеррес-Родригес, А., Чавес-Хименес, Х., и Гонсалес-Моран, М. Г. (2018). Экспрессия рецепторов половых гормонов в головном мозге только что вылупившихся цыплят мужского и женского пола. Anim. Репрод. Sci. 188, 123–129. DOI: 10.1016 / j.anireprosci.2017.11.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камачо-Арройо, И., Вильямар-Крус, О., Гонсалес-Аренас, А., и Герра-Арайса, К. (2002). Участие протеасомы 26S в регуляции концентрации рецепторов прогестерона в головном мозге крыс. Нейроэндокринология 76, 267–271. DOI: 10.1159 / 000066623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чаффкин, Л., Лучано А. и Пелусо Дж. (1992). Прогестерон как аутокринный / паракринный регулятор пролиферации гранулезных клеток человека. J. Clin. Эндокринол. Метаб. 75, 1404–1408. DOI: 10.1210 / jcem.75.6.1464640
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Compagnone, N., Bulfone, A., Rubenstein, J., and Mellon, S. (1995). Экспрессия стероидогенного фермента P450scc в центральной и периферической нервной системе во время эмбриогенеза грызунов. Эндокринология 136, 2689–2696.DOI: 10.1210 / endo.136.6.7750493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кроссли, К. Дж., Ницос, И., Уокер, Д. У., Лоуренс, А. Дж., Беарт, П. М., и Херст, Дж. Дж. (2003). Стероид-чувствительные рецепторы GABAA в мозге эмбриона овцы. Нейрофармакология 45, 461–472. DOI: 10.1016 / S0028-3908 (03) 00196-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Desroziers, E., Brock, O., and Bakker, J. (2017). Возможный вклад рецепторов прогестерона в развитие полового поведения у самцов и самок мышей. Horm. Behav. 90, 31–38. DOI: 10.1016 / j.yhbeh.2016.05.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дойч, Э. Р., Эспиноза, Т. Р., Атиф, Ф., Вудал, Э., Кейлор, Дж., И Райт, Д. В. (2013). Роль прогестерона в нейропротекции, обзор доказательств. Brain Res. 1530, 82–105. DOI: 10.1016 / j.brainres.2013.07.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диас, Н. Ф., Диас-Мартинес, Н.Э., Веласко И. и Камачо-Арройо И. (2009). Прогестерон увеличивает количество дофаминовых нейронов в дифференцирующихся эмбриональных стволовых клетках мыши. J. Neuroendocrinol. 21, 730–736. DOI: 10.1111 / j.1365-2826.2009.01891.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диас, Н. Ф., Герра-Аррайса, К., Диас-Мартинес, Н. Э., Салазар, П., Молина-Эрнандес, А., Камачо-Арройо, И. и др. (2007). Изменения содержания рецепторов эстрогена α и прогестерона при дифференцировке эмбриональных стволовых клеток мыши в дофаминовые нейроны. Brain Res. Бык. 73, 75–80. DOI: 10.1016 / j.brainresbull.2007.02.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диксон, К. Дж., И Шеррард, Р. М. (2006). Мозговой нейротрофический фактор индуцирует транскомиссуральный рост оливарных аксонов после повреждения, которые развивают нормальные лазящие волокна на зрелых клетках Пуркинье. Exp. Neurol. 202, 44–56. DOI: 10.1016 / j.expneurol.2006.05.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дорота, М., Харрисон, Н. Л., Шварц, Р. Д., Баркер, Дж. Л., и Пол, С. М. (1986). Метаболиты стероидных гормонов являются барбитуратоподобными модуляторами рецептора ГАМК. Science 232, 1004–1007. DOI: 10.1126 / science.2422758
CrossRef Полный текст | Google Scholar
Follesa, P., Concas, A., Porcu, P., Sanna, E., Serra, M., Mostallino, M. C., et al. (2001). Роль аллопрегнанолона в регуляции пластичности ГАМК-рецепторов при длительном воздействии и отмене прогестерона. Brain Res. Ред. 37, 81–90. DOI: 10.1016 / S0165-0173 (01) 00125-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаго Н., Аква Ю., Сананес Н., Геннун Р., Болье Э. Э., Эль-Этр М. и др. (2001). Прогестерон и олигодендроглиальная линия: стадийно-зависимый биосинтез и метаболизм. Glia 36, 295–308. DOI: 10.1002 / glia.1117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаго, Н., Эль-Этр, М., Сананес, Н., Кадепонд, Ф., Самуэль, Д., Авельяна-Адалид, В. и др. (2004). 3α, 5α-тетрагидропрогестерон (аллопрегнанолон) и γ-аминомасляная кислота: аутокринные / паракринные взаимодействия в контроле пролиферации предшественников PSA-NCAM + у новорожденных. J. Neurosci. Res. 78, 770–783. DOI: 10.1002 / jnr.20348
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарг Д., Нг, С. С. М., Бейг, К. М., Дриггерс, П., Сегарс, Дж. (2017). Опосредованная прогестероном неклассическая передача сигналов. Trends Endocrinol. Метаб. 28, 656–668. DOI: 10.1016 / j.tem.2017.05.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Germán-Castelán, L., Manjarrez-Marmolejo, J., González-Arenas, A., and Camacho-Arroyo, I. (2016). Внутриклеточный рецептор прогестерона опосредует увеличение роста глиобластомы, вызванное прогестероном в головном мозге крысы. Arch. Med. Res. 47, 419–426. DOI: 10.1016 / j.arcmed.2016.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Germán-Castelán, L., Манджаррес-Мармолехо, Дж., Гонсалес-Аренас, А., Гонсалес-Моран, М. Г., и Камачо-Арройо, И. (2014). Прогестерон вызывает рост и инфильтрацию клеток астроцитомы человека, имплантированных в кору головного мозга крысы. Biomed Res. Int. 2014: 393174. DOI: 10.1155 / 2014/393174
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гумари А. М., Болье Э. Э. и Шумахер М. (2005). Прогестерон увеличивает пролиферацию олигодендроглиальных клеток в культурах срезов мозжечка крыс. Неврология 135, 47–58. DOI: 10.1016 / j.neuroscience.2005.05.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гумари А. М., Ибанез К., Эль-Этр М., Леклерк П., Эйченн Б., О’Мэлли Б. В. и др. (2003). Прогестерон и его метаболиты увеличивают экспрессию основного белка миелина в органотипических культурах срезов мозжечка крыс. J. Neurochem. 86, 848–859. DOI: 10.1046 / j.1471-4159.2003.01881.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес-Агуэро, Г., Гутьеррес, А.А., Гонсалес-Эспиноза, Д., Солано, Дж. Д., Моралес, Р., Гонсалес-Аренас, А., и др. (2007). Влияние прогестерона на рост клеток линий клеток астроцитомы человека U373 и D54. Эндокринная 32, 129–135. DOI: 10.1007 / s12020-007-9023-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес-Аренас, А., Пенья-Ортис, М.А., Хансберг-Пастор, В., Маркина-Санчес, Б., Баранда-Авила, Н., Нава-Кастро, К. и др. (2015). Активация Pkcα и pkcδ регулирует транскрипционную активность и деградацию рецептора прогестерона в клетках астроцитомы человека. Эндокринология 156, 1010–1022. DOI: 10.1210 / en.2014-1137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес-Ороско, Дж. К., Хансберг-Пастор, В., Валадес-Космес, П., Николас-Ортега, В., Бастида-Беристейн, Ю. и Камачо-Арройо, И. (2018). Активация мембранного рецептора прогестерона-альфа увеличивает пролиферацию, миграцию и инвазию клеток глиобластомы человека. Mol. Клетка. Эндокринол. 477, 81–89. DOI: 10.1016 / j.mce.2018.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Греко, Т., и Пейн, Х. (1994). Онтогенез экспрессии генов стероидогенных ферментов расщепления боковой цепи P450, 3-бета-гидроксистероиддегидрогеназы, 17-альфа-гидроксилазы P450 / лиазы C17-20 и ароматазы P450 в гонадах плода мыши. Эндокринология 135, 262–268. DOI: 10.1210 / en.135.1.262
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гробин, А.С., Гизериан, С., Либерман, Дж. А., и Морроу, А. Л. (2006). Перинатальный аллопрегнанолон влияет на структуру префронтальной коры, связность и поведение взрослых крыс. Неврология 138, 809–819. DOI: 10.1016 / j.neuroscience.2005.12.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Guennoun, R., Reyss-Brion, M., and Gasc, J.M. (1987). Рецепторы прогестерона в гипоталамусе и гипофизе во время эмбрионального развития цыпленка: регуляция половыми стероидными гормонами. Dev. Brain Res. 37, 1–9. DOI: 10.1016 / 0165-3806 (87)
-0PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герра-Арайса, К., Рейна-Нейра А., Салазар А. М., Цербон М. А., Моримото С. и Камачо-Арройо И. (2001). Экспрессия изоформ рецепторов прогестерона в мозге препуберальных и взрослых самцов крыс. Brain Res. Бык. 54, 13–17. DOI: 10.1016 / S0361-9230 (00) 00410-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герра-Арайса, К., Вильямар-Крус, О., Гонсалес-Аренас, А., Чавира, Р., и Камачо-Арройо, И. (2003). Изменения содержания изоформ рецепторов прогестерона в головном мозге крыс во время эстрального цикла и после лечения эстрадиолом и прогестероном. J. Neuroendocrinol. 15, 984–990. DOI: 10.1046 / j.1365-2826.2003.01088.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутай, Дж. П., Мейер, В. Дж., Авиноам Коварски, А., и Мигеон, К. Дж. (1977). Круглосуточные интегрированные концентрации прогестерона, 17-гидроксипрогестерона и кортизола у здоровых мужчин. J. Clin. Эндокринол. Метаб. 44, 116–120. DOI: 10.1210 / jcem-44-1-116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хеллгрен, К., Akerud, H., Skalkidou, A., Bäckström, T., and Sundström-Poromaa, I. (2014). Низкий уровень аллопрегнанолона в сыворотке крови связан с симптомами депрессии на поздних сроках беременности. Нейропсихобиология 69, 147–153. DOI: 10.1159 / 000358838
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрнандес-Эрнандес, О., Гонсалес-Гарсия, Т., и Камачо-Арройо, И. (2012). Рецептор прогестерона и SRC-1 участвуют в регуляции экспрессии VEGF, EGFR и циклина D1 в клеточных линиях астроцитомы человека. J. Steroid Biochem. Мол. Биол. 132, 127–134. DOI: 10.1016 / j.jsbmb.2012.04.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрнандес-Эрнандес, О. Т., Родригес-Дорантес, М., Гонсалес-Аренас, А., и Камачо-Арройо, И. (2010). Эффекты прогестерона и эстрадиола на экспрессию SRC-1 и SRC-3 в клеточных линиях астроцитомы человека. Эндокринная 37, 194–200. DOI: 10.1007 / s12020-009-9288-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херст, Дж.Дж., Келлехер, М.А., Уокер, Д.В., и Паллисер, Х.К. (2014). Нейроактивные стероиды во время беременности: ключевые регулирующие и защитные роли в мозге плода. J. Steroid Biochem. Мол. Биол. 139, 144–153. DOI: 10.1016 / j.jsbmb.2013.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хорвиц, К. Б., Тунг, Л., и Такимото, Г. С. (1996). Новые механизмы действия антипрогестинов. Acta Oncol. 35, 129–140. DOI: 10.3109 / 0284186960
93
CrossRef Полный текст | Google Scholar
Хози, А.М., Уилкинс, М. Е., Да Силва, Х. М. А., и Смарт, Т. Г. (2006). Эндогенные нейростероиды регулируют рецепторы ГАМК через два дискретных трансмембранных сайта. Природа 444, 486–489. DOI: 10.1038 / nature05324
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуссейн Р., Эль-Этр М., Гачи О., Ракотомамонжи Дж., Маклин В. Б., Кумар Н. и др. (2011). Прогестерон и несторон способствуют ремиелинизации аксонов: роль рецепторов прогестерона. Эндокринология 152, 3820–3831.DOI: 10.1210 / en.2011-1219
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Исихара Ю., Фудзитани Н., Сакураи Х., Такемото Т., Икеда-Исихара Н., Мори-Ясумото К. и др. (2016). Влияние половых стероидных гормонов и их метаболитов на повреждение нейронов, вызванное кислородно-глюкозной депривацией / реоксигенацией в органотипических культурах срезов гиппокампа. Стероиды 113, 71–77. DOI: 10.1016 / j.steroids.2016.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джахагирдар, В., и Вагнер, К. К. (2010). Онтогенез экспрессии рецепторов прогестерона в субпластине коры головного мозга плода и новорожденных крыс. Cereb. Cortex 20, 1046–1052. DOI: 10.1093 / cercor / bhp165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кейнс, С., Колкухун, Х., Гундуз-Брюс, Х., Рейнс, С., Арнольд, Р., Шактерле, А., и др. (2017). Брексанолон (инъекция SAGE-547) при послеродовой депрессии: рандомизированное контролируемое исследование. Ланцет 390, 480–489. DOI: 10.1016 / с0140-6736 (17) 31264-3
CrossRef Полный текст | Google Scholar
Кастнер П., Краст А., Таркотт Б., Стропп У., Тора Л., Гронемейер Х. и др. (1990). Два различных промотора, регулируемых эстрогеном, генерируют транскрипты, кодирующие две функционально разные формы рецептора прогестерона человека А и В. EMBO J. 9, 1603–1614. DOI: 10.1002 / j.1460-2075.1990.tb08280.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каструп, Ю., Халлбек, М., Амандуссон, А., Хирата, С., Хермансон, О., и Бломквист, А. (1999). Экспрессия рецептора прогестерона в стволе мозга самки крысы. Neurosci. Lett. 275, 85–88. DOI: 10.1016 / S0304-3940 (99) 00753-3
CrossRef Полный текст | Google Scholar
Касубучи М., Ватанабе К., Хирано К., Иноуэ Д., Ли X., Терасава К. и др. (2017). Мембранный бета-рецептор прогестерона (mPRβ / Paqr8) способствует прогестерон-зависимому разрастанию нейритов в нейрональных клетках PC12 посредством передачи сигналов рецептора, не связанного с G-белком (GPCR). Sci. Отчет 7: 5168. DOI: 10.1038 / s41598-017-05423-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Като, Дж., Хирата, С., Нозава, А., и Моури, Н. (1993). Онтогенез экспрессии генов рецепторов прогестина в головном мозге самок крыс. J. Steroid Biochem. Мол. Биол. 47, 173–182. DOI: 10.1016 / 0960-0760 (93)-5
CrossRef Полный текст | Google Scholar
Келлехер, М.А., Паллисер, Х.К., Уокер, Д.У., и Херст, Дж.J. (2011). Зависимое от пола влияние среды с низким содержанием нейростероидов и ограничения внутриутробного развития на развитие мозга плода морской свинки. J. Endocrinol. 208, 301–309. DOI: 10.1677 / JOE-10-0248
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар Р., Мур К. М., Хан С. Х., Каллауэй К., Гримм С. Л., Госвами Д. и др. (2013). Регулирование структурно динамического N-концевого домена рецептора прогестерона путем индуцированного белком сворачивания. Дж.Биол. Chem. 288, 30285–30299. DOI: 10.1074 / jbc.M113.4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лабомбарда, Ф., Гонсалес, С., Гонсалес, М., Геннун, Р., Шумахер, М., и де Никола, А. Ф. (2002). Клеточная основа нейропротекции прогестерона в поврежденном спинном мозге. J. Neurotrauma 19, 343–355. DOI: 10.1089 / 089771502753594918
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лабомбарда, Ф., Гонсалес, С. Л., Лима, А., Ройг, П., Гуеннун, Р., Шумахер, М., и др. (2009). Влияние прогестерона на предшественники олигодендроцитов, факторы транскрипции олигодендроцитов и белки миелина после повреждения спинного мозга. Glia 57, 884–897. DOI: 10.1002 / glia.20814
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лауретта Р., Сансоне М., Романелли Ф. и Аппеккья М. (2018). Пол при эндокринных заболеваниях: роль половых гормонов гонад. Внутр.J. Endocrinol. 2018: 4847376. DOI: 10.1155 / 2018/4847376
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж., Эклунд, Э. Э., Ламберт-Мессерлиан, Г., Паломаки, Г. Э., Баттерфилд, К., Курран, П., и др. (2017). Уровни прогестерона в сыворотке у беременных с обструктивным апноэ во сне: исследование случай-контроль. J. Womens Health 26, 259–265. DOI: 10.1089 / jwh.2016.5917
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Т., и Огл, Т. (2002). Сигнальный преобразователь и активатор транскрипции 3 экспрессируется в децидуализированном мезометрии беременных и связывается с рецептором прогестерона посредством белок-белковых взаимодействий. Biol. Репрод. 67, 114–118. DOI: 10.1095 / biolreprod67.1.114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лопес В. и Вагнер К. К. (2009). Рецептор прогестина временно перинатально экспрессируется в нейронах изокортекса крысы. Дж.Комп. Neurol. 512, 124–139. DOI: 10.1002 / cne.21883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Луи Д. Н., Перри А., Райфенбергер Г., фон Даймлинг А., Фигарелла-Брангер Д., Кавени В. К. и др. (2016). Классификация опухолей центральной нервной системы Всемирной организации здравоохранения 2016 г .: резюме. Acta Neuropathol. 131, 803–820. DOI: 10.1007 / s00401-016-1545-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макласки, Н., и McEwen, B. (1980). Рецепторы прогестина в развивающемся мозге и гипофизе крыс. Brain Res. 189, 262–268. DOI: 10.1016 / 0006-8993 (80)
-8
CrossRef Полный текст | Google Scholar
Маркина-Санчес, Б., Гонсалес-Хорхе, Дж., Хансберг-Пастор, В., Вегман-Остроски, Т., Баранда-Авила, Н., Мехиа-Перес, С. и др. (2017). Взаимодействие между внутриклеточным рецептором прогестерона и PKC играет ключевую роль в миграции и инвазии клеток глиобластомы человека. Дж.Стероид Биохим. Мол. Биол. 172, 198–206. DOI: 10.1016 / j.jsbmb.2016.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Melcangi, R.C., Poletti, A., Cavarretta, I., Celotti, F., Colciago, A., Magnaghi, V., et al. (1998). 5α-редуктаза в центральной нервной системе: экспрессия и способы контроля. J. Steroid Biochem. Мол. Биол. 65, 295–299. DOI: 10.1016 / S0960-0760 (98) 00030-2
CrossRef Полный текст | Google Scholar
Меллон, С.Х. и Дешеппер К. Ф. (1993). Биосинтез нейростероидов: гены стероидогенных ферментов надпочечников экспрессируются в головном мозге. Brain Res. 629, 283–292. DOI: 10.1016 / 0006-8993 (93)
-M
CrossRef Полный текст | Google Scholar
Мельцер-Броди, С., Колкухун, Х., Ризенберг, Р., Эпперсон, П., Делигианнидис, К., Рубинов, Д., и др. (2018). Инъекции брексанолона при послеродовой депрессии: два многоцентровых, двойных слепых, рандомизированных, плацебо-контролируемых исследования, фаза 3. Ланцет 392, 1058–1070. DOI: 10.1016 / S0140-6736 (18) 31551-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Менса-Няган, Г., До-Рего, Дж. Л., Божан, Д., Луу-Зе, В., Пеллетье, Г., и Водри, Х. (1999). Нейростероиды: экспрессия стероидогенных ферментов и регуляция биосинтеза стероидов в центральной нервной системе. Pharmacol. Ред. 51, 63–81.
Google Scholar
Мензис, К. Д., Дрисдейл, Д. Б., и Уэйт, П.М. Э. (1982). Влияние пренатального прогестерона на развитие пирамидных клеток в коре головного мозга крыс. Exp. Neurol. 77, 654–667. DOI: 10.1016 / 0014-4886 (82)
-9PubMed Аннотация | CrossRef Полный текст | Google Scholar
Милвич, Л., Шоу, К. Э., Дуди, К. М., Рейни, В. Е., Мейсон, Дж. И., и Карр, Б. Р. (1991). Активность 3 бета-гидроксистероиддегидрогеназы в железистых и внегландулярных тканях плода человека. J. Clin. Эндокринол. Метаб. 73, 1134–1140.DOI: 10.1210 / jcem-73-5-1134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морель Ю., Рушер Ф., Плоттон И., Гурсо К., Тарди В. и Малле Д. (2016). Эволюция стероидов во время беременности: материнский, плацентарный и фетальный синтез. Ann. Эндокринол. 77, 82–89. DOI: 10.1016 / j.ando.2016.04.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нгуен П. Н., Бильярд С. С., Уокер Д. У. и Херст Дж. Дж.(2003). Изменения в экспрессии стероидов 5альфа-прегнана и нейростероидогенного фермента у перинатальных овец. Pediatr. Res. 53, 956–964. DOI: 10.1203 / 01.PDR.0000088066.47755.36
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Никол М. Б., Херст Дж. Дж. И Уокер Д. (1999). Влияние прегнанолона на параметры поведения и реакцию на антагонисты рецепторов ГАМК (А) у плодов овец на поздних сроках беременности. Нейрофармакология 38, 49–63.DOI: 10.1016 / S0028-3908 (98) 00166-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Никол, М. Б., Херст, Дж. Дж., И Уокер, Д. У. (2001). Влияние финастерида на поведенческое возбуждение и соматосенсорные вызванные потенциалы у плодов овцы. Neurosci. Lett. 306, 13–16. DOI: 10.1016 / S0304-3940 (01) 01861-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Осборн, Л., Гиспен, Ф., Саньял, А., Енокян, Г., Мейлман, С., и Пейн, С.(2017). Более низкий уровень аллопрегнанолона во время беременности предсказывает послеродовую депрессию: предварительное исследование. Психонейроэндокринология 79, 116–121. DOI: 10.1016 / j.psyneuen.2017.02.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Остром, К. Т., Гиттлман, Х., Ляо, П., Векчионе-Коваль, Т., Волински, Ю., Кручко, К., и др. (2017). Статистический отчет CBTRUS: первичные опухоли головного мозга и других опухолей центральной нервной системы, диагностированные в США в 2010–2014 гг. Neuro Oncol. 19 (Дополнение_5), v1 – v88. DOI: 10.1093 / neuonc / nox158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паллисер, Х. К., Йейтс, Д. М., и Херст, Дж. Дж. (2012). Экспрессия изоформы рецептора прогестерона в ответ на ограничение роста внутриутробного развития в мозге плода морской свинки. Нейроэндокринология 96, 60–67. DOI: 10.1159 / 000335138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пападопулос В., Баральди М., Гиларте, Т. Р., Кнудсен, Т. Б., Лакапер, Дж. Дж., Линдеманн, П. и др. (2006). Белок-транслокатор (18 кДа): новая номенклатура бензодиазепинового рецептора периферического типа, основанная на его структуре и молекулярной функции. Trends Pharmacol. Sci. 27, 402–409. DOI: 10.1016 / j.tips.2006.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паскуалини, Дж. Р., Четрит, Г. С. (2016). Образование и трансформация гормонов в компартментах матери, плаценты и плода: биологические последствия. Horm. Мол. Биол. Clin. Расследование. 27, 11–28. DOI: 10.1515 / hmbci-2016-0036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петерсон Б. Л., Вон С., Геддес Р. И., Сайид И. и Стейн Д. Г. (2015). Связанные с полом различия в эффектах прогестерона после гипоксического повреждения головного мозга у новорожденных. Behav. Brain Res. 286, 152–165. DOI: 10.1016 / j.bbr.2015.03.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петц, Л.Н., Зиглер, Ю. С., Шульц, Дж. Р., Ким, Х., Кемпер, Дж. К., и Нардулли, А. М. (2004). Дифференциальная регуляция гена рецептора прогестерона человека через половину сайта эстрогенового элемента и сайты Sp1. J. Steroid Biochem. Мол. Биол. 88, 113–122. DOI: 10.1016 / j.jsbmb.2003.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фелпс, С. М., Лайдон, Дж. П., и Крюс, Д. (1998). Регулирование мужского сексуального поведения рецепторами прогестерона, сексуальным опытом и андрогенами. Horm. Behav. 34, 294–302. DOI: 10.1006 / hbeh.1998.1485
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пинья-Медина, А.Г., Хансберг-Пастор, В., Гонсалес-Аренас, А., Цербон, М., и Камачо-Арройо, И. (2016). Прогестерон способствует миграции клеток, инвазии и активации кофилина в клетках астроцитомы человека. Стероиды 105, 19–25. DOI: 10.1016 / j.steroids.2015.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Плучино, д., Руссо, М., и Дженаццани, А. Р. (2016). Мозг плода: роль прогестерона и аллопрегнанолона. Horm. Мол. Биол. Clin. Расследование. 27, 29–34. DOI: 10.1515 / hmbci-2016-0020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квадрос, П. С., Гольдштейн, А. Ю. Н., Де Фрис, Г. Дж., И Вагнер, К. К. (2002a). Регуляция половых различий в экспрессии рецепторов прогестерона в медиальном преоптическом ядре постнатальных крыс. J. Neuroendocrinol. 14, 761–767.DOI: 10.1046 / j.1365-2826.2002.00827.x
CrossRef Полный текст | Google Scholar
Квадрос, П. С., Лопес, В., Де Фрис, Г. Дж., Чанг, В. К. Дж., И Вагнер, К. К. (2002b). Рецепторы прогестерона и половая дифференциация медиального преоптического ядра. J. Neurobiol. 51, 24–32. DOI: 10.1002 / neu.10040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Quadros, P. S., Pfau, J. L., Goldstein, A. Y. N., De Vries, G.J., и Wagner, C.К. (2002c). Половые различия в экспрессии рецепторов прогестерона: потенциальный механизм половой дифференциации, опосредованной эстрадиолом. Эндокринология 143, 3727–3739. DOI: 10.1210 / en.2002-211438
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квадрос, П. С., Пфау, Дж. Л. и Вагнер, К. К. (2007). Распределение иммунореактивности рецепторов прогестерона в переднем мозге плодов и новорожденных крыс. J. Comp. Neurol. 504, 42–56. DOI: 10.1002 / cne.21427
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квадрос, П. С., Шлютер, Л. Дж., И Вагнер, К. К. (2008). Распределение иммунореактивности рецепторов прогестерона в среднем и заднем мозге постнатальных крыс. Dev. Neurobiol. 68, 1378–1390. DOI: 10.1002 / dneu.20664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сакамото, Х., Укена, К., Цуцуи, К. (2001). Влияние прогестерона, синтезируемого de novo в развивающейся клетке Пуркинье, на ее дендритный рост и синаптогенез. J. Neurosci. 21, 6221–6232. DOI: 10.1523 / jneurosci.21-16-06221.2001
CrossRef Полный текст | Google Scholar
Сакамото, Х., Укена, К., Цуцуи, К. (2002). Формирование дендритных шипов в ответ на синтез прогестерона de novo в развивающихся клетках Пуркинье у крыс. Neurosci. Lett. 332, 111–115. DOI: 10.1016 / S0304-3940 (02) 00077-0
CrossRef Полный текст | Google Scholar
Шумахер, М., Геннун, Р., Мерсье, Г., Дезарно, Ф., Lacor, P., Bénavides, J., et al. (2001). Синтез прогестерона и образование миелина в периферических нервах. Brain Res. Ред. 37, 343–359. DOI: 10.1016 / S0165-0173 (01) 00139-4
CrossRef Полный текст | Google Scholar
Шумахер М., Геннун Р., Роберт Ф., Карелли К., Гаго Н., Гумари А. и др. (2004). Локальный синтез и двойное действие прогестерона в нервной системе: нейропротекция и миелинизация. Гормона роста. IGF Res. 14, 18–33. DOI: 10.1016 / j.ghir.2004.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шумахер, М., Хуссейн, Р., Гаго, Н., Удине, Дж. П., Маттерн, К., и Гумари, А. М. (2012). Синтез прогестерона в нервной системе: последствия для миелинизации и восстановления миелина. Фронт. Neurosci. 6:10. DOI: 10.3389 / fnins.2012.00010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шумахер, М., Маттерн, К., Гумари, А., Удине, Дж.П., Лиере П., Лабомбарда Ф. и др. (2014). Возвращаясь к роли прогестерона и аллопрегнанолона в нервной системе: возрождение рецепторов прогестерона. Prog. Neurobiol. 113, 6–39. DOI: 10.1016 / j.pneurobio.2013.09.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Снайдер А. М. и Халл Э. М. (1980). Перинатальный прогестерон влияет на обучение крыс. Психонейроэндокринология 5, 113–119. DOI: 10.1016 / 0306-4530 (80)
CrossRef Полный текст | Google Scholar
Ступп, Р., Mason, W. P., van den Bent, M. J., Weller, M., Fisher, B., Taphoorn, M. J. B., et al. (2005). Лучевая терапия плюс сопутствующий и адъювантный темозоломид при глиобластоме. N. Engl. J. Med. 352, 987–996. DOI: 10.1056 / NEJMoa043330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Testas, I.J., Hu, Z.Y., Baulieu, E.E., and Robel, A.P. (1989). Нейростероиды: биосинтез прегненолона и прогестерона в первичных культурах глиальных клеток крыс. Эндокринология 125, 2083–2091.DOI: 10.1210 / эндо-125-4-2083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тетель, М. Дж., И Ачарья, К. Д. (2013). Коактиваторы ядерных рецепторов: регуляторы действия стероидов в мозге и поведении. J. Neuroendocrinol. 25, 1209–1218. DOI: 10.1111 / jne.12065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Троттер А., Бокельманн Б., Сорго В., Бехингер-Корнхубер Д., Хайнеманн Х., Шмюккер Г. и др. (2001).Контрольное обследование в возрасте 15 месяцев крайне недоношенных детей после послеродовой заместительной терапии эстрадиолом и прогестероном. J. Clin. Эндокринол. Метаб. 86, 601–603. DOI: 10.1210 / jc.86.2.601
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуцуи К., Укена К., Сакамото Х., Окуяма С. И. и Харагути С. (2011). Биосинтез, механизм действия и функциональное значение нейростероидов в клетке Пуркинье. Фронт. Эндокринол. 2:61.DOI: 10.3389 / fendo.2011.00061
CrossRef Полный текст | Google Scholar
Укена К., Кохчи К. и Цуцуи К. (1999). Экспрессия и активность 3β-гидроксистероиддегидрогеназы / Δ5-Δ4-изомеразы в нейроне Пуркинье крысы во время неонатальной жизни. Эндокринология 140, 805–813. DOI: 10.1210 / endo.140.2.6516
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Укена К., Усуи М., Кохчи К. и Цуцуи К. (1998). Фермент расщепления боковой цепи цитохрома p450 в нейроне Пуркинье мозжечка и его неонатальные изменения у крыс. Эндокринология 139, 137–147. DOI: 10.1210 / endo.139.1.5672
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валадес-Космес, П., Херман-Кастелан, Л., Гонсалес-Аренас, А., Веласко-Веласкес, М.А., Хансберг-Пастор, В., и Камачо-Арройо, И. (2015). Экспрессия и гормональная регуляция мембранных рецепторов прогестерона в клетках астроцитомы человека. J. Steroid Biochem. Мол. Биол. 154, 176–185. DOI: 10.1016 / j.jsbmb.2015.08.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валадес-Космес, П., Васкес-Мартинес, Э. Р., Сербон, М., и Камачо-Арройо, И. (2016). Мембранные рецепторы прогестерона при репродукции и раке. Mol. Клетка. Эндокринол. 434, 166–175. DOI: 10.1016 / j.mce.2016.06.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Висент, Г. П., Балларе, К., Заурин, Р., Сарагуэта, П., и Беато, М. (2006). Ремоделирование хроматина и контроль пролиферации клеток прогестинами посредством перекрестного взаимодействия рецептора прогестерона с рецепторами эстрогена и сигнальными путями киназы. Ann. Акад. Sci. 1089, 59–72. DOI: 10.1196 / анналы.1386.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Викери, Л. Э. (1993). «Цитохром P450 отщепления холестериновой боковой цепи (P450scc)» в Cytochrome P450. Справочник по экспериментальной фармакологии , ред. Дж. Б. Шенкман и Х. Грейм (Берлин: Springer), 105.
Google Scholar
Вагнер, К. К., Квадрос-Меннелла, П. (2017). Прогестерон из материнского кровообращения связывается с рецепторами прогестина в мозге плода. Dev. Neurobiol. 77, 767–774. DOI: 10.1002 / dneu.22462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wechsler-Reya, R., and Scott, M. (2001). Биология развития опухолей головного мозга. Annu. Rev. Neurosci. 24, 385–428. DOI: 10.1146 / annurev.neuro.24.1.385
CrossRef Полный текст | Google Scholar
Вайнер, Дж. А., Йонтес, Дж. Д., и Берджесс, Р. У. (2013). Введение в механизмы формирования нейронной цепи. Фронт.Мол. Neurosci. 6:12. DOI: 10.3389 / fnmol.2013.00012
CrossRef Полный текст | Google Scholar
Вайс, Дж., И Уорд, И. Л. (1980). Титры тестостерона и прогестерона в плазме беременных крыс, их плодов мужского и женского пола и новорожденных. Эндокринология 106, 306–316. DOI: 10.1210 / эндо-106-1-306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виллинг, Дж., И Вагнер, К. К. (2016). Экспрессия рецепторов прогестерона в развивающемся мезокортикальном пути дофамина: важность для сложного когнитивного поведения во взрослом возрасте. Нейроэндокринология 103, 207–222. DOI: 10.1159 / 000434725
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вулли, С. К., О’Мэлли, Б., Лайдон, Дж., И Крюс, Д. (2006). Генотипические различия в поведении и экспрессии тирозингидроксилазы у мышей дикого типа и мышей с нокаутом рецепторов прогестерона. Behav. Brain Res. 167, 197–204. DOI: 10.1016 / j.bbr.2005.07.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райт, Д.W., Kellermann, A. L., Hertzberg, V. S., Clark, P. L., Frankel, M., Goldstein, F. C., et al. (2007). ProTECT: рандомизированное клиническое испытание прогестерона при острой черепно-мозговой травме. Ann. Emerg. Med. 49, 391–402. DOI: 10.1016 / j.annemergmed.2006.07.932
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву, С. П., Ли, Р. и Де Майо, Ф. Дж. (2018). Регуляция прогестероновых рецепторов адаптации матки к беременности. Trends Endocrinol. Метаб. 29, 481–491. DOI: 10.1016 / j.tem.2018.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yawno, T., Hirst, J. J., Castillo-Melendez, M., and Walker, D. W. (2009). Роль нейростероидов в регулировании гибели и пролиферации клеток в мозге плода на поздних сроках беременности. Неврология 163, 838–847. DOI: 10.1016 / j.neuroscience.2009.07.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yawno, T., Yan, E. B., Walker, D.У. и Херст Дж. Дж. (2007). Подавление синтеза нейростероидов увеличивает поражение головного мозга, вызванное асфиксией, у плодных овец на поздних сроках беременности. Неврология 146, 1726–1733. DOI: 10.1016 / j.neuroscience.2007.03.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йонкерс, К., Вигод, С., и Росс, Л. (2011). Диагностика, патофизиология и лечение расстройств настроения у беременных и послеродовых женщин. Акушерство. Гинеколь. 117, 961–977. DOI: 10.1097 / AOG.0b013e31821187a7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Самора-Санчес, К. Дж., Хансберг-Пастор, В., Салидо-Гуадаррама, И., Родригес-Дорантес, М., и Камачо-Арройо, И. (2017). Аллопрегнанолон способствует пролиферации и дифференциальной экспрессии генов в клетках глиобластомы человека. Стероиды 119, 36–42. DOI: 10.1016 / j.steroids.2017.01.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу, Ю., Райс, К.Д., Панг, Ю., Пейс, М., и Томас, П. (2003). Клонирование, экспрессия и характеристика мембранного рецептора прогестина и доказательство того, что он является промежуточным звеном в мейотическом созревании ооцитов рыб. Proc. Natl. Акад. Sci. США 100, 2231–2236. DOI: 10.1073 / pnas.0336132100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Варианты генов, связанных с эстрогеном и прогестероном, и риск колоректального рака у женщин | BMC Medical Genetics
La Vecchia C, Franceschi S: Репродуктивные факторы и колоректальный рак.Контроль причин рака. 1991, 2 (3): 193-200. 10.1007 / BF00056213.
CAS Статья PubMed Google ученый
Фернандес Э., Ла Веккья С., Бальдуччи А., Шатено Л., Франчески С., Негри Э .: Оральные контрацептивы и риск колоректального рака: метаанализ. Br J Рак. 2001, 84 (5): 722-727. 10.1054 / bjoc.2000.1622.
CAS Статья PubMed PubMed Central Google ученый
Grodstein F, Newcomb PA, Stampfer MJ: Постменопаузальная гормональная терапия и риск колоректального рака: обзор и метаанализ. Am J Med. 1999, 106 (5): 574-582. 10.1016 / S0002-9343 (99) 00063-7.
CAS Статья PubMed Google ученый
Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J: Риски и преимущества эстрогена плюс прогестин в Здоровые женщины в постменопаузе: основные результаты Рандомизированного контролируемого исследования Инициативы по охране здоровья женщин.Джама. 2002, 288 (3): 321-333. 10.1001 / jama.288.3.321.
CAS Статья PubMed Google ученый
Chlebowski RT, Wactawski-Wende J, Ritenbaugh C, Hubbell FA, Ascensao J, Rodabough RJ, Rosenberg CA, Taylor VM, Harris R, Chen C, Adams-Campbell LL, White E: эстроген плюс прогестин и колоректальный рак у женщин в постменопаузе. N Engl J Med. 2004, 350 (10): 991-1004. 10.1056 / NEJMoa032071.
CAS Статья PubMed Google ученый
Anderson GL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, Bonds D, Brunner R, Brzyski R, Caan B, Chlebowski R, Curb D, Gass M, Hays J, Heiss G, Hendrix S, Howard BV, Hsia J, Hubbell A, Jackson R, Johnson KC, Judd H, Kotchen JM, Kuller L, LaCroix AZ, Lane D, Langer RD, Lasser N, Lewis CE, Manson J, et al: Эффекты конъюгированного конского эстрогена в Женщины в постменопаузе с гистерэктомией: рандомизированное контролируемое исследование Инициативы по охране здоровья женщин. Джама. 2004, 291 (14): 1701-1712.
CAS Статья PubMed Google ученый
Gunter MJ, Hoover DR, Yu H, Wassertheil-Smoller S, Rohan TE, Manson JE, Howard BV, Wylie-Rosett J, Anderson GL, Ho GY, Kaplan RC, Li J, Xue X, Harris TG, Burk RD, Strickler HD: инсулин, инсулиноподобный фактор роста-I, эндогенный эстрадиол и риск колоректального рака у женщин в постменопаузе. Cancer Res. 2008, 68 (1): 329-337. 10.1158 / 0008-5472.CAN-07-2946.
CAS Статья PubMed PubMed Central Google ученый
Clendenen TV, Koenig KL, Shore RE, Levitz M, Arslan AA, Zeleniuch-Jacquotte A: Уровни эндогенных половых гормонов в постменопаузе и риск колоректального рака. Биомаркеры эпидемиологии рака Пред. 2009, 18 (1): 275-281. 10.1158 / 1055-9965.EPI-08-0777.
CAS Статья PubMed PubMed Central Google ученый
Speer G, Cseh K, Winkler G, Takacs I, Barna I, Nagy Z, Lakatos P: генотипы рецептора эстрогена и витамина D (VDR) и экспрессия рецептора ErbB-2 и EGF при раке прямой кишки человека .Eur J Cancer. 2001, 37 (12): 1463-1468. 10.1016 / S0959-8049 (01) 00139-3.
CAS Статья PubMed Google ученый
Слэттери М.Л., Суини К., Мерто М., Ма К.Н., Вольф Р.К., Поттер Дж. Д., Каан Б.Дж., Самовиц В.: Связь между генотипами ERalpha, ERbeta и AR и раком толстой и прямой кишки. Биомаркеры эпидемиологии рака Пред. 2005, 14 (12): 2936-2942. 10.1158 / 1055-9965.EPI-05-0514.
CAS Статья PubMed Google ученый
Бетке Л., Уэбб Э., Селлик Дж., Радд М., Пенегар С., Уити Л., Куреши М., Хоулстон Р.: Полиморфизмы в генах цитохрома P450 CYP1A2, CYP1B1, CYP3A4, CYP3A5, CYP11A1, CYP17A1, риск рака толстой кишки и CYP19A1. BMC Рак. 2007, 7: 123-10.1186 / 1471-2407-7-123.
Артикул PubMed PubMed Central Google ученый
Линь Дж., Зи Р.Й., Лю К.Й., Чжан С.М., Ли И.М., Мэнсон Дж. Э., Джованнуччи Э., Бьюринг Дж. Э., Кук Н. Р.: Генетическая изменчивость рецепторов половых стероидов и синтезирующих ферментов и риск колоректального рака у женщин.Контроль причин рака. 21 (6): 897-908.
Tomlinson I, Webb E, Carvajal-Carmona L, Broderick P, Kemp Z, Spain S, Penegar S, Chandler I, Gorman M, Wood W, Barclay E, Lubbe S, Martin L, Sellick G, Jaeger E, Hubner R, Wild R, Rowan A, Fielding S, Howarth K, Silver A, Atkin W, Muir K, Logan R, Kerr D, Johnstone E, Sieber O, Gray R, Thomas H, Peto J и др. : Полногеномное сканирование ассоциаций тегов SNP выявляет вариант восприимчивости к колоректальному раку на 8q24.21. Нат Жене.2007, 39 (8): 984-988. 10.1038 / ng2085.
CAS Статья PubMed Google ученый
Zanke BW, Greenwood CM, Rangrej J, Kustra R, Tenesa A, Farrington SM, Prendergast J, Olschwang S, Chiang T., Crowdy E, Ferretti V, Laflamme P, Sundararajan S, Roumy S, Olivier JF , Робиду Ф., Сладек Р., Монпети А., Кэмпбелл П., Безье С., О’Ши А. М., Зогопулос Дж., Коттерчио М., Ньюкомб П., Маклафлин Дж., Янгхазбенд Б., Грин Р., Грин Дж., Портеус М.Э., Кэмпбелл Х и др. : Полногеномное ассоциативное сканирование выявляет локус восприимчивости к колоректальному раку на хромосоме 8q24.Нат Жене. 2007, 39 (8): 989-994. 10.1038 / ng2089.
CAS Статья PubMed Google ученый
Tomlinson IP, Webb E, Carvajal-Carmona L, Broderick P, Howarth K, Pittman AM, Spain S, Lubbe S, Walther A, Sullivan K, Jaeger E, Fielding S, Rowan A, Vijayakrishnan J, Доминго Е., Чендлер И., Кемп З., Куреши М., Фаррингтон С. М., Тенеса А., Прендергаст Дж. Г., Барнетсон Р. А., Пенегар С., Барклай Е., Вуд В., Мартин Л., Горман М., Томас Г., Пето Дж., Бишоп Д. Т. и др. : Полногеномное ассоциативное исследование выявляет локусы восприимчивости к колоректальному раку на хромосомах 10p14 и 8q23.3. Нат Жене. 2008, 40 (5): 623-630. 10.1038 / ng.111.
CAS Статья PubMed Google ученый
Тенеса А., Фаррингтон С. М., Прендергаст Дж. Г., Портеус М. Е., Уокер М., Хак Н., Барнетсон Р. А., Теодорату Е., Цетнарский Р., Картрайт Н., Семпл С., Кларк А. Дж., Рид Ф. Дж., Смит Л. А., Кавуссанакис К. , Koessler T, Pharoah PD, Buch S, Schafmayer C, Tepel J, Schreiber S, Volzke H, Schmidt CO, Hampe J, Chang-Claude J, Hoffmeister M, Brenner H, Wilkening S, Canzian F, Capella G и др. : Полногеномное ассоциативное сканирование идентифицирует локус восприимчивости к колоректальному раку на 11q23 и реплицирует локусы риска на 8q24 и 18q21.Нат Жене. 2008, 40 (5): 631-637. 10.1038 / ng.133.
CAS Статья PubMed PubMed Central Google ученый
Джагер Э, Уэбб Э, Ховарт К., Карвахаль-Кармона Л., Роуэн А., Бродерик П., Вальтер А., Испания С., Питтман А., Кемп З., Салливан К., Хейниманн К., Люббе С., Доминго Э, Барклай Э., Мартин Л., Горман М., Чендлер И., Виджаякришнан Дж., Вуд В., Папаэммануил Э, Пенегар С., Куреши М., Фаррингтон С., Тенеса А., Казье Дж. Б., Керр Д., Грей Р., Пето Дж., Данлоп М. и др. : Общие генетические варианты в локусе CRAC1 (HMPS) на хромосоме 15q13.3 влияют на риск колоректального рака. Нат Жене. 2008, 40 (1): 26-28. 10.1038 / нг.2007.41.
CAS Статья PubMed Google ученый
Broderick P, Carvajal-Carmona L, Pittman AM, Webb E, Howarth K, Rowan A, Lubbe S, Spain S, Sullivan K, Fielding S, Jaeger E, Vijayakrishnan J, Kemp Z, Gorman M, Чендлер I, Папаэммануил Э., Пенегар С., Вуд В., Селлик Дж., Куреши М., Тейшейра А., Доминго Э, Барклай Э, Мартин Л., Сибер О, Керр Д., Грей Р., Пето Дж., Казье Дж. Б., Томлинсон И. и др. : Полногеномное исследование ассоциации показывает, что общие аллели SMAD7 влияют на риск колоректального рака.Нат Жене. 2007, 39 (11): 1315-1317. 10.1038 / нг.2007.18.
CAS Статья PubMed Google ученый
Houlston RS, Webb E, Broderick P, Pittman AM, Di Bernardo MC, Lubbe S, Chandler I, Vijayakrishnan J, Sullivan K, Penegar S, Carvajal-Carmona L, Howarth K, Jaeger E, Spain SL , Walther A, Barclay E, Martin L, Gorman M, Domingo E, Teixeira AS, Kerr D, Cazier JB, Niittymaki I, Tuupanen S, Karhu A, Aaltonen LA, Tomlinson IP, Farrington SM, Tenesa A, Prendergast JG, et др. Мета-анализ данных ассоциации по всему геному выявил четыре новых локуса восприимчивости к колоректальному раку.Нат Жене. 2008, 40 (12): 1426-1435. 10.1038 / нг.262.
CAS Статья PubMed Google ученый
Houlston RS, Cheadle J, Dobbins SE, Tenesa A, Jones AM, Howarth K, Spain SL, Broderick P, Domingo E, Farrington S, Prendergast JG, Pittman AM, Theodoratou E, Smith CG, Olver B , Walther A, Barnetson RA, Churchman M, Jaeger EE, Penegar S, Barclay E, Martin L, Gorman M, Mager R, Johnstone E, Midgley R, Niittymaki I, Tuupanen S, Colley J, Idziaszczyk S и др .: Meta -анализ трех полногеномных ассоциативных исследований идентифицирует локусы восприимчивости к колоректальному раку на 1q41, 3q26.2, 12q13.13 и 20q13.33. Нат Жене. 42 (11): 973-977.
Истон Д.Ф., Илес Р.А.: Полногеномные исследования ассоциации рака. Hum Mol Genet. 2008, 17 (R2): R109-115. 10.1093 / hmg / ddn287.
CAS Статья PubMed Google ученый
Чанг С.К., Магальяэс В., Гонсалес-Боске Дж., Чанок С.Дж.: Общегеномные исследования ассоциации рака — текущие и будущие направления. Канцерогенез. 2009
Google ученый
Feigelson HS, McKean-Cowdin R, Pike MC, Coetzee GA, Kolonel LN, Nomura AM, Le Marchand L, Henderson BE: полиморфизм гена цитохрома P450c17alpha (CYP17) предсказывает использование заместительной гормональной терапии. Cancer Res. 1999, 59 (16): 3908-3910.
CAS PubMed Google ученый
Long JR, Shu XO, Cai Q, Wen W, Kataoka N, Gao YT, Zheng W. Генетические полиморфизмы CYP19A1 могут быть связаны с фенотипами, связанными с ожирением, у китайских женщин.Int J Obes (Лондон). 2007, 31 (3): 418-423. 10.1038 / sj.ijo.0803439.
CAS Статья Google ученый
Дизайн клинического испытания и обсервационного исследования Инициативы по охране здоровья женщин. Исследовательская группа Инициативы по охране здоровья женщин. Контрольные клинические испытания. 1998, 19 (1): 61-109.
Хайман К.А., Страм Д.О., Пайк М.К., Колонел Л.Н., Бертт Н.П., Альтшулер Д., Хиршхорн Дж., Хендерсон Б.Е.: Комплексный анализ гаплотипов CYP19 и риска рака груди: многонациональная когорта.Hum Mol Genet. 2003, 12 (20): 2679-2692. 10.1093 / hmg / ddg294.
CAS Статья PubMed Google ученый
Pearce CL, Hirschhorn JN, Wu AH, Burtt NP, Stram DO, Young S, Kolonel LN, Henderson BE, Altshuler D, Pike MC: Уточнение ассоциации аллелей PROGINS с риском рака яичников и груди: гаплотип анализ на основе. J Natl Cancer Inst. 2005, 97 (1): 51-59. 10.1093 / jnci / dji007.
CAS Статья PubMed Google ученый
Cox DG, Bretsky P, Kraft P, Pharoah P, Albanes D, Altshuler D, Amiano P, Berglund G, Boeing H, Buring J, Burtt N, Calle EE, Canzian F, Chanock S, Clavel-Chapelon F, Colditz GA , Feigelson HS, Haiman CA, Hankinson SE, Hirschhorn J, Henderson BE, Hoover R, Hunter DJ, Kaaks R, Kolonel L, LeMarchand L, Lund E, Palli D, Peeters PH, Pike MC и др.: Гаплотипы эстрогена ген рецептора бета и риск рака груди. Int J Cancer. 2008, 122 (2): 387-392.
CAS Статья PubMed Google ученый
Chen YC, Kraft P, Bretsky P, Ketkar S, Hunter DJ, Albanes D, Altshuler D, Andriole G, Berg CD, Boeing H, Burtt N, Bueno-de-Mesquita B, Cann H, Canzian F, Chanock S, Dunning A, Feigelson HS, Freedman M, Gaziano JM, Giovannucci E, Sanchez MJ, Haiman CA, Hallmans G, Hayes RB, Henderson BE, Hirschhorn J, Kaaks R, Key TJ, Kolonel LN, LeMarchand L и др.: Варианты последовательности исследования бета-рецептора эстрогена и риска рака простаты в Консорциуме когорты рака груди и простаты Национального института рака.Биомаркеры эпидемиологии рака Пред. 2007, 16 (10): 1973-1981. 10.1158 / 1055-9965.EPI-07-0431.
CAS Статья PubMed Google ученый
Setiawan VW, Schumacher FR, Haiman CA, Stram DO, Albanes D, Altshuler D, Berglund G, Buring J, Calle EE, Clavel-Chapelon F, Cox DG, Gaziano JM, Hankinson SE, Hayes RB, Хендерсон Б. Э., Хиршхорн Дж., Гувер Р., Хантер Д. Д., Каакс Р., Колонель Л. Н., Крафт П., Ма Дж., Ле Маршан Л., Линсейсен Дж., Лунд Е., Наварро К., Овервад К., Палли Д., Пеэтерс П. Х., Пайк М. С. и др. al: Генетическая изменчивость CYP17 и риск рака груди и простаты от Консорциума когорты рака груди и простаты Национального института рака (BPC3).Биомаркеры эпидемиологии рака Пред. 2007, 16 (11): 2237-2246. 10.1158 / 1055-9965.EPI-07-0589.
CAS Статья PubMed Google ученый
Барретт Дж. К., Фрай Б., Маллер Дж., Дейли М. Дж.: Haploview: анализ и визуализация карт LD и гаплотипов. Биоинформатика. 2005, 21 (2): 263-265. 10.1093 / биоинформатика / bth557.
CAS Статья PubMed Google ученый
Перселл С., Нил Б., Тодд-Браун К., Томас Л., Феррейра М.А., Бендер Д., Маллер Дж., Склар П., де Баккер П.И., Дейли М.Дж., Фальшивый ПК: PLINK: набор инструментов для полногеномной ассоциации и популяции. анализ связей на основе. Am J Hum Genet. 2007, 81 (3): 559-575. 10.1086 / 519795.
CAS Статья PubMed PubMed Central Google ученый
Бенджамини Ю., Йекутиели Д.: Количественный анализ локусов признаков с использованием коэффициента ложного обнаружения.Генетика. 2005, 171 (2): 783-790. 10.1534 / genetics.104.036699.
CAS Статья PubMed PubMed Central Google ученый
Кэмпбелл-Томпсон М., Линч И.Дж., Бхардвадж Б. Экспрессия подтипов рецепторов эстрогена (ER) и изоформ ERbeta при раке толстой кишки. Cancer Res. 2001, 61 (2): 632-640.
CAS PubMed Google ученый
Qiu Y, Waters CE, Lewis AE, Langman MJ, Eggo MC: Эстроген-индуцированный апоптоз в колоноцитах, экспрессирующих бета-рецептор эстрогена.J Endocrinol. 2002, 174 (3): 369-377. 10.1677 / joe.0.1740369.
CAS Статья PubMed Google ученый
Cho NL, Javid SH, Carothers AM, Redston M, Bertagnolli MM: альфа- и бета-рецепторы эстрогена являются ингибиторами Apc-зависимого туморогенеза в проксимальном отделе толстой кишки мышей Min / +. Cancer Res. 2007, 67 (5): 2366-2372. 10.1158 / 0008-5472.CAN-06-3026.
CAS Статья PubMed Google ученый
Хартман Дж., Эдвардссон К., Линдберг К., Чжао С., Вильямс С., Стром А., Густафссон Дж. А.: Репрессивные функции бета-рецептора эстрогена в клетках рака толстой кишки SW480. Cancer Res. 2009, 69 (15): 6100-6106. 10.1158 / 0008-5472.CAN-09-0506.
CAS Статья PubMed Google ученый
Motylewska E, Melen-Mucha G: Эстрон и прогестерон подавляют рост линии рака толстой кишки мыши MC38. Дж. Стероид Биохим Мол Биол.2009, 113 (1-2): 75-79. 10.1016 / j.jsbmb.2008.11.007.
CAS Статья PubMed Google ученый
Jin P, Lu XJ, Sheng JQ, Fu L, Meng XM, Wang X, Shi TP, Li SR, Rao J: Эстроген стимулирует экспрессию гена репарации ошибочного спаривания hMLh2 в эпителиальных клетках толстой кишки. Рак Prev Res (Phila Pa). 3 (8): 910-916.
Слэттери М.Л., Поттер Дж. Д., Куртин К., Эдвардс С., Ма К. Н., Андерсон К., Шаффер Д., Самовиц В. С.: Снижение эстрогенов и отмена эстрогенов увеличивают риск развития рака толстой кишки с положительной микросателлитной нестабильностью.Cancer Res. 2001, 61 (1): 126-130.
CAS PubMed Google ученый
Fiorelli G, Picariello L, Martineti V, Tonelli F, Brandi ML: Функциональный бета-рецептор эстрогена в клетках рака толстой кишки. Biochem Biophys Res Commun. 1999, 261 (2): 521-527. 10.1006 / bbrc.1999.1062.
CAS Статья PubMed Google ученый
English MA, Kane KF, Cruickshank N, Langman MJ, Stewart PM, Hewison M: Потеря инактивации эстрогена при раке толстой кишки.J Clin Endocrinol Metab. 1999, 84 (6): 2080-2085. 10.1210 / jc.84.6.2080.
CAS Статья PubMed Google ученый
Sato R, Suzuki T, Katayose Y, Miura K, Shiiba K, Tateno H, Miki Y, Akahira J, Kamogawa Y, Nagasaki S, Yamamoto K, Ii T, Egawa S, Evans DB, Unno M , Sasano H: стероид-сульфатаза и эстроген-сульфотрансфераза при карциноме толстой кишки: регуляторы внутриопухолевых концентраций эстрогенов и мощные прогностические факторы.Cancer Res. 2009, 69 (3): 914-922. 10.1158 / 0008-5472.CAN-08-0906.
CAS Статья PubMed Google ученый
Ди Лео А., Линсалата М., Каваллини А., Месса С., Руссо Ф .: Рецепторы половых стероидных гормонов, рецепторы эпидермального фактора роста и полиамины при колоректальном раке человека. Dis Colon Rectum. 1992, 35 (4): 305-309. 10.1007 / BF02048105.
CAS Статья PubMed Google ученый
Savouret JF, Misrahi M, Milgrom E: Молекулярное действие прогестерона. Int J Biochem. 1990, 22 (6): 579-594. 10.1016 / 0020-711X (90)
-Y.CAS Статья PubMed Google ученый
Лю Х.С., He ZY, Меле С., Дамарио М., Дэвис О., Розенвакс З .: Гормональная регуляция экспрессии матричной РНК, кодирующей белки, связывающие инсулиноподобный фактор роста, в стромальных клетках эндометрия человека, культивируемых in vitro. Мол Хум Репрод.1997, 3 (1): 21-26. 10.1093 / мольхр / 3.1.21.
CAS Статья PubMed Google ученый
Suvanto-Luukkonen E, Sundstrom H, Penttinen J, Kauppila A, Rutanen EM: белок-1, связывающий инсулиноподобный фактор роста: биохимический маркер ответа эндометрия на прогестин во время заместительной гормональной терапии. Maturitas. 1995, 22 (3): 255-262. 10.1016 / 0378-5122 (95) 00935-Е.
CAS Статья PubMed Google ученый
Goldfine ID, Papa V, Vigneri R, Siiteri P, Rosenthal S: Прогестиновая регуляция рецепторов инсулина и инсулиноподобного фактора роста I в культивируемых клетках рака груди человека. Лечение рака груди Res. 1992, 22 (1): 69-79. 10.1007 / BF01833335.
CAS Статья PubMed Google ученый
Dunning AM, Healey CS, Baynes C, Maia AT, Scollen S, Vega A, Rodriguez R, Barbosa-Morais NL, Ponder BA, Low YL, Bingham S, Haiman CA, Le Marchand L, Broeks A , Schmidt MK, Hopper J, Southey M, Beckmann MW, Fasching PA, Peto J, Johnson N, Bojesen SE, Nordestgaard B, Milne RL, Benitez J, Hamann U, Ko Y, Schmutzler RK, Burwinkel B, Schurmann P, et al: Ассоциация SNP, помеченных геном ESR1, с риском рака груди.Hum Mol Genet. 2009, 18 (6): 1131-1139. 10.1093 / hmg / ddn429.
CAS Статья PubMed PubMed Central Google ученый
Пикадо-Леонард Дж., Миллер В.Л.: Клонирование и последовательность человеческого гена P450c17 (стероид 17 альфа-гидроксилаза / 17,20 лиаза): сходство с геном P450c21. ДНК. 1987, 6 (5): 439-448. 10.1089 / dna.1987.6.439.
CAS Статья PubMed Google ученый
Недельчева Кристенсен В., Харальдсен Е.К., Андерсон К.Б., Лоннинг П.Е., Эрикштейн Б., Каресен Р., Габриэльсен О.С., Борресен-Дейл А.Л.: CYP17 и риск рака груди: полиморфизм в 5′-фланкирующей области гена не влияет на связывание с Сп-1. Cancer Res. 1999, 59 (12): 2825-2828.
CAS PubMed Google ученый
Hopper JL, Hayes VM, Spurdle AB, Chenevix-Trench G, Jenkins MA, Milne RL, Dite GS, Tesoriero AA, McCredie MR, Giles GG, Southey MC: мутация, усекающая белок в CYP17A1 в трех сестры с ранним началом рака груди.Hum Mutat. 2005, 26 (4): 298-302. 10.1002 / humu.20237.
CAS Статья PubMed Google ученый
Miyoshi Y, Iwao K, Ikeda N, Egawa C, Noguchi S: Генетический полиморфизм CYP17 и риск рака груди у японских женщин. Eur J Cancer. 2000, 36 (18): 2375-2379. 10.1016 / S0959-8049 (00) 00334-8.
CAS Статья PubMed Google ученый
Feigelson HS, Shames LS, Pike MC, Coetzee GA, Stanczyk FZ, Henderson BE: Полиморфизм гена цитохрома P450c17alpha (CYP17) связан с концентрацией эстрогена и прогестерона в сыворотке крови. Cancer Res. 1998, 58 (4): 585-587.
CAS PubMed Google ученый
Daneshmand S, Weitsman SR, Navab A, Jakimiuk AJ, Magoffin DA: Сверхэкспрессия матричной РНК клеток тека при синдроме поликистозных яичников не коррелирует с полиморфизмом в расщеплении боковой цепи холестерина и 17альфа-гидроксилазе / C (17-20) промоторы лиазы.Fertil Steril. 2002, 77 (2): 274-280. 10.1016 / S0015-0282 (01) 02999-5.
Артикул PubMed Google ученый
Haiman CA, Hankinson SE, Colditz GA, Hunter DJ, De Vivo I. Полиморфизм CYP17 и риск рака эндометрия. Cancer Res. 2001, 61 (10): 3955-3960.
CAS PubMed Google ученый
Дуглас Дж. А., Зульке К. А., Биб-Диммер Дж., Левин А. М., Грубер С. Б., Вуд Д. П., Куни К. А.: Определение генов предрасположенности к раку простаты — семейное исследование ассоциации полиморфизмов CYP17, CYP19, CYP11A1 и LH-бета.Биомаркеры эпидемиологии рака Пред. 2005, 14 (8): 2035-2039. 10.1158 / 1055-9965.EPI-05-0170.
CAS Статья PubMed Google ученый
Булун С.Е., Себастьян С., Такаяма К., Сузуки Т., Сасано Х., Сёзу М.: Ген CYP19 человека (ароматаза P450): обновленная информация о физиологических ролях и геномной организации промоторов. Дж. Стероид Биохим Мол Биол. 2003, 86 (3-5): 219-224. 10.1016 / S0960-0760 (03) 00359-5.
CAS Статья PubMed Google ученый
Zhao Y, Mendelson CR, Simpson ER: Характеристика последовательностей гена CYP19 (ароматазы) человека, который опосредует регуляцию глюкокортикоидами в стромальных клетках жировой ткани и гепатоцитах плода. Мол Эндокринол. 1995, 9 (3): 340-349. 10.1210 / me.9.3.340.
CAS PubMed Google ученый
Cai H, Shu XO, Egan KM, Cai Q, Long JR, Gao YT, Zheng W: Ассоциация генетических полиморфизмов CYP19A1 и уровней половых гормонов в крови среди китайских женщин в постменопаузе.Pharmacogenet Genomics. 2008, 18 (8): 657-664. 10.1097 / FPC.0b013e3282fe3326.
CAS Статья PubMed PubMed Central Google ученый
Маккарти М.И., Абекасис Г.Р., Кардон Л.Р., Голдштейн Д.Б., Литтл Дж., Иоаннидис Дж. П., Хиршхорн Дж. Н.: Общегеномные исследования ассоциации сложных черт: консенсус, неопределенность и проблемы. Nat Rev Genet. 2008, 9 (5): 356-369. 10.1038 / nrg2344.
CAS Статья PubMed Google ученый
Введение
Прогестерон (прег-4-ен-3,20-дион) представляет собой природный катаболит холестерина циклопентанопергидрофенантрена, который в большом количестве вырабатывается в желтом теле.Эта структура яичников была признана с начала 1900-х годов как железистый источник «внутренней секреции», необходимой для установления и поддержания беременности. В 1929 году Джордж Корнер и Уиллард Аллен успешно выделили прогестерон из желтого тела в Университете Рочестера 1, а структура очищенного прогестерона была впоследствии расшифрована в 1934 году. Не менее увлекательная сага о производстве синтетического прогестина, революционизирующая одновременное открытие Рассела Маркера того, что диосгенин, стерол, полученный из мексиканского ямса, может быть химически преобразован в прогестерон, что привело к разработке синтетических фармацевтических прогестинов.Прогестерон является квинтэссенцией «прогестационного» гормона, поддерживающего беременность за счет децидуальной васкуляризации и покоя миометрия. Арпад Чапо, протеже Корнера, был одним из первых сторонников теории «блока» прогестерона, согласно которой прогестерон может обратимо подавлять сократимость маточных мышц. Фактически, роды можно рассматривать как «состояние устойчивости к прогестерону (P4)», и недавние открытия подтверждают идею о том, что функциональная отмена прогестерона может быть достигнута путем изменения относительной экспрессии усеченного (на 164 N-концевые аминокислоты) рецептора прогестерона ( PR) Изоформа (PR-A) в более длинную изоформу B (PR-B), первая служит транс-репрессором последней 2.Прогестерон также играет важную роль в дифференцировке эндометрия, росте миомы матки и канцерогенезе груди. В этом обзоре мы суммируем доказательства в поддержку гипотезы о том, что ткани эндометриоза устойчивы к прогестерону 3, и то, как этот молекулярный дефект может быть восстановлен для облегчения основных симптомов, тазовой боли и бесплодия, связанных с этим распространенным заболеванием.
Доказательства устойчивости к прогестерону при эндометриозе
Первым опубликованным доказательством, подтверждающим концепцию устойчивости к прогестерону, было открытие Attia et al.4 видно, что мРНК рецептора PR-B и уровни белка были значительно снижены при поражениях эндометриоза, тогда как изоформы PR-A, как правило, сохранялись. Впоследствии серия исследований микроматрицы экспрессии генов эндометрия показала, что гены, регулируемые прогестероном [например, гликоделин, N-ацетилглюкозамин-6-O-сульфотрансфераза, 17β гидроксистероиддегидрогеназа 2 ( 17 β HSD2 )] были подавлены в тканях, полученных от пациентов с эндометриозом по сравнению с женщинами без лапароскопических доказательств эндометриоза 5.
Как указано выше, снижение экспрессии 17 β HSD2 было отмечено в эутопическом эндометрии в многочисленных исследованиях эндометриоза 5. Этот фермент играет ключевую роль в превращении биологически активного эстрадиола в менее мощный эстрон, и следствием его пониженной экспрессии является повышенная активность эстрадиола в эндометриоидных поражениях, даже в присутствии прогестиновой терапии. Неспособность эндометриоидных поражений активировать 17 β HSD2 в ответ на прогестерон может быть связана со снижением экспрессии PR-B в стромальных клетках этой ткани, что делает неконтролируемую активность эстрадиола в этих поражениях.
То, что эутопический эндометрий у женщин с эндометриозом обнаруживает аберрантную экспрессию генов в ответ на половые стероиды, было хорошо установлено. Повышенная секреция прогестерона после овуляции необходима для подавления генов, связанных с репликацией ДНК — механизма, с помощью которого пролиферация эндометрия быстро останавливается на ранней секреторной фазе. Гены, участвующие в регуляции клеточного цикла, такие как ядерный антиген пролиферирующих клеток ( PCNA) , клеточный маркер пролиферации ( Ki67 ), тимидинкиназа 1, белок циклин E1 ( CCNE1 ), белок коробки вилки O1 ( FOXO1 ). ) и митотический дефицит-подобный 1 белок ( MAD2L1 ) подавляются в ранней секреторной фазе у женщин без заболевания в ответ на прогестерон и усиливаются у пациентов с умеренным и тяжелым заболеванием 5.Точно так же экспрессия индуцированного митогеном гена 6 ( MIG6 ), негативного регулятора передачи сигналов эпидермального фактора роста (EGF), значительно снижается в эндометрии пациентов с эндометриозом. Напротив, экспрессия антиапоптотических генов, таких как белок В-клеточной лимфомы 2 (BCL2) , аномально повышена в раннем секреторном эндометрии у пациентов с эндометриозом, что указывает на неспособность прогестерона быстро остановить пролиферацию эндометрия и вызвать дифференцированную дифференцировку. состояние 5.Роли микро- (miR) и некодирующих РНК обсуждаются ниже.
Неполная децидуализация эндометрия и неспособность подавить гены клеточного цикла, вероятно, являются ключевыми факторами нарушения имплантации, фактора, который все чаще признается при бесплодии, связанном с эндометриозом 3, 5. Предполагаемые характеристики окна имплантации включают активацию генов-мишеней прогестерона, которые способствуют прикреплению эмбриона и регулируют местный иммунный ответ. Гены, такие как MUC-1, и остеопонтин, важны для прикрепления эмбрионов и активируются у нормальных женщин, но подавляются у пациентов с эндометриозом 5.Подобные результаты были отмечены для гликоделина, иммуномодулятора, регулируемого прогестероном, который подавляется в течение периода имплантации в децидуальную оболочку пациентов с эндометриозом 3, 5. Нарушение децидуализации в клетках пациентов с эндометриозом дополнительно подтверждается двукратным снижением экспрессия белка-1, связывающего инсулиноподобный фактор роста (IGFBP1) и пролактина, которые обычно сильно экспрессируются в секреторном эндометрии пациентов без эндометриоза 6. Исследования in vitro также показали снижение способности прогестерона подавлять экспрессию матриксных металлопротеиназ (MMP ), особенно MMP-3 и MMP-7, в стромальных клетках пациентов с эндометриозом 7.Мы сообщили, что продукция белка щелевого соединения коннексина 43 (Сх43), который обычно регулируется в стромальных клетках эндометрия лютеиновыми гормонами, снижается примерно на 50% в эндометрии у женщин с эндометриозом. Следствием низкой экспрессии Cx43 является то, что связь стромальных клеток между клетками нарушается, и децидуальная оболочка не может принять фенотип, идеальный для эмбриональной восприимчивости 8.
Точный механизм (-ы) ослабления прогестеронового ответа у пациентов с эндометриозом остается (-ами) неясным.Некоторые исследования показывают неадекватное повышение системных уровней прогестерона 9, тогда как другие не показывают различий 10. Об этой устойчивости также может свидетельствовать измененная экспрессия ядерных изоформ рецепторов прогестерона PR-A и PR-B, коактиваторов стероидных рецепторов и многочисленных нижестоящих эффекторов. 2, 5. Кроме того, когда здоровые женщины с подавленным агонистом гонадотропин-рилизинг-гормона (ГнРГ) получали экзогенный прогестерон, не наблюдалось значительных различий в гистологии эндометрия даже при низких уровнях прогестерона в сыворотке.Следовательно, нарушение действия прогестерона в эндометрии у пациентов с эндометриозом, вероятно, связано с врожденной резистентностью к прогестерону самого эндометрия, а не с нарушением секреции прогестерона 11.
Причины резистентности к прогестерону при эндометриозе
Врожденный
Недавняя гипотеза предполагает, что эндометриоз и резистентность к прогестерону у взрослых женщин могут быть следствием «прекондиционирования» матери и новорожденного, при котором резистентность новорожденного к прогестерону сохраняется в раннем подростковом возрасте 12.Гистохимический анализ эндометрия новорожденных выявляет спектр реакций прогестерона, варьирующихся от частичной или полной резистентности в большинстве (67%) до полных ответов в меньшинстве (33%). 13. Менструация у новорожденных — хорошо известное явление, причем явные случаи варьируются. от 3 до 6% и скрытые биохимические данные от 25 до 61% 14, происходящие в результате отмены плацентарных стероидных гормонов в послеродовом периоде. Из-за относительно большой длины канала и уплотнения цервикального секрета шейка неонатальной матки эффективно закупоривается с 26-й недели беременности.В соответствии с теорией Сэмпсона, ретроградный отток клеток эндометрия после родов может служить очагом образования очагов эндометриоза у новорожденного. Действительно, наличие эндометриоза было задокументировано в исследованиях аутопсии новорожденных женского пола 15. Ограничение внутриутробного развития признано фактором риска как неонатального маточного кровотечения, так и эндометриоза. Исследование случай-контроль с участием 743 женщин, перенесших лапароскопию, показало, что у женщин с массой тела при рождении <2500 г частота эндометриоза была значительно выше, чем у женщин с массой тела при рождении> 2500 г 16.Другие эпидемиологические исследования пришли к выводу, что низкая масса тела при рождении увеличивает вероятность будущего эндометриоза с относительным риском = 1,2 (95% ДИ 1,0–1,8, p <0,01). развитие эндометриоза, поскольку частота маточных кровотечений у новорожденных, по-видимому, выше у этих новорожденных.
Воспаление
Значительные доказательства показывают связь между резистентностью к прогестерону и хроническими воспалительными состояниями у пациентов с эндометриозом.Как указано выше, действие прогестерона в секреторном эндометрии в первую очередь служит для остановки эстрогеновой пролиферации эндометрия, вызывает дифференцировку эндометрия и задействует специализированные иммунные клетки для поддержки эмбриональной имплантации 18. Снижение уровня прогестерона в отсутствие беременности приводит к увеличению местные провоспалительные цитокины, хемокины и ММП, которые затем активируют распад тканей и менструацию. Противовоспалительные свойства прогестерона в клетках матки хорошо известны 2.Прогестерон подавляет передачу сигналов членами ядерного фактора каппа-легкой цепи-энхансера белков семейства активированных В-клеток (NF-κB) в клетках эндометрия. Эта сигнальная сеть вовлечена в эндометриоз как фактор, ведущий к созданию и поддержанию эндометриозных имплантатов 19. Белки NF-κB являются факторами транскрипции со способностью контролировать гены, связанные с пролиферацией, адгезией, апоптозом и воспалением клеток. Следовательно, резистентность к прогестерону приводит к повышенной активности NF-κB и провоспалительному состоянию.Внематочные имплантаты экспрессируют повышенные уровни провоспалительных цитокинов, которые увеличивают экспрессию NF-κB и, в свою очередь, снижают экспрессию PR и действие прогестерона, тем самым устанавливая пролиферативное состояние с ослабленной дифференцировкой.
Другие цитокины также играют жизненно важную роль в резистентности к прогестерону за счет изменения PR. Фактор некроза опухоли (TNF) -α и интерлейкин (IL) -1β напрямую снижают уровни обеих изоформ PR, возможно, посредством эпигенетических модификаций.Например, воздействие TNF-α приводит к гиперметилированию промотора изоформы PR-B в эндометриоидных клетках, вызывая снижение экспрессии и увеличение соотношения PR-A / PR-B 20. Провоспалительные цитокины также могут нарушать функцию рецептора за счет изменений в стероиде. белки-шапероны рецептора, такие как иммунофилин FK506, связывающий белок 5 (FKBP5), и коактиваторы рецептора, такие как индуцируемый перекисью водорода клон 5 / коактиватор рецептора андрогена 55 (HIC-5 / ARA55) 21. Другие механизмы, с помощью которых провоспалительные цитокины нарушают функцию PR осуществляются через прямую конкуренцию за корегуляторы рецепторов или интерференцию между функциональными мостиками, соединяющими PRs и другие факторы транскрипции, такие как FOXO1, необходимые для экспрессии ключевых генов-мишеней PR 18.Функция PR может модулироваться клеточно-специфическим образом с помощью множества посттрансляционных модификаций, включая фосфорилирование серина, убиквитинирование и сумоилирование, которые, в свою очередь, влияют на их стабильность, период полужизни, транспорт, транскрипционную активность и селективность целевого гена 2
Ретроградные менструации
Ретроградные менструации сами по себе могут вызывать состояние резистентности к прогестерону, частично из-за воспаления брюшины. В модели хирургически индуцированного эндометриоза приматов, отличных от человека, где менструальный эндометрий оперативно пересаживают в полость таза здоровых павианов, паттерн экспрессии эутопических генов эндометрия был изменен 22.В то время как некоторые гены оставались дисрегулируемыми в течение 16-месячного курса этих экспериментов, другие, по-видимому, самокорректировались после острой, временной активизации (например, c-fos, который, как постулируется, подавляет экспрессию генов, опосредованную PR). Это открытие предполагает, что повторяющиеся циклические ретроградные менструации могут быть необходимы для поддержания хронической воспалительной среды в брюшной полости, чтобы вызвать длительную резистентность к прогестерону. С другой стороны, женщины и нечеловеческие приматы со спонтанным эндометриозом могут быть носителями популяций клеток эндометрия, которые по своей природе нечувствительны к прогестерону, на что указывают некоторые другие гипотезы, обсужденные выше.
Диоксин
Роль токсикантов окружающей среды в генезе эндометриоза представляет значительный интерес. Полихолорфенилы, особенно диоксин [2,3,7,8-тетрахлордибензо-п-диоксин (TCDD)], как предполагается, вызывают резистентность к прогестерону и эндометриоз 23. Диоксиноподобные соединения являются стойкими органическими загрязнителями, которые попадают в окружающую среду как побочные продукты сельскохозяйственных пестицидов и сжигание отходов. Эти соединения устойчивы к разложению и биоаккумулируются, особенно в пищевых источниках 24.На сегодняшний день большая часть доказательств причастности этих соединений к развитию эндометриоза носит анекдотический характер и первоначально основывалась на том факте, что в Бельгии обнаружена как очень высокая частота эндометриоза, так и высокие уровни загрязнения TCDD. Из-за склонности этого липофильного соединения накапливаться в богатых жирами тканях человеческого тела, грудное молоко может содержать высокие уровни TCDD 23. Модели на нечеловеческих приматах подтверждают корреляцию эндометриоза с воздействием TCDD. Одно исследование показало, что у макак-резусов, подвергавшихся воздействию TCDD в течение четырех лет, значительно увеличилась частота эндометриоза 25.
Биологические эффекты TCDD опосредуются связыванием с рецептором арилгидроуглерода (AHR). Этот комплекс лиганд-рецептор затем связывается со специфическими элементами диоксинового ответа, чтобы изменить транскрипционную активность специфических генов 23. Некоторые исследования выявили существование возможного механизма, с помощью которого воздействие TCDD может приводить к эндометриозу через индукцию резистентности к прогестерону в эндометрии. Диоксины участвуют в прерывании беременности через нарушение стероидогенеза яичников и вмешательство в действие прогестерона в эндометрии 26.В клетках эндометриоза человека провоспалительные хемокины, которые обычно подавляются прогестинами [например, регулируются при активации, экспрессируются и секретируются нормальные Т-клетки (RANTES) или CCL5], могут непосредственно активироваться комплексами диоксин-AHR 27. В моделях на мышах воздействие TCDD на всех стадиях развития приводит к потере экспрессии PR в эндометрии 26. Ключевым медиатором действия прогестерона в эндометрии является трансформирующий фактор роста-бета 2 (TGF-β2), а иммуноблоттинг и иммуногистохимические анализы выявляют более низкие уровни TGF-β2 в клетках эндометрия мышей, подвергшихся действию TCDD.Кроме того, воздействие TCDD предотвращает опосредованное прогестероном подавление экспрессии MMP и притупляет его противовоспалительные ответы, возможно, из-за снижения экспрессии мРНК каннабиноидного рецептора типа 1 (CB1-R) 28. Экспрессия CB1-R эндометрия обычно увеличивается в секреторной фазе в ответ на прогестерон и модулирует иммунные ответы, необходимые для установления беременности. Эпигенетические изменения в промоторе PR были приписаны воздействию TCDD, при этом исследование на мышах показало, что метилирование увеличивается на 40-60% после TCDD 29.
Мезенхимальные стволовые клетки
Поскольку мезенхимальные стволовые клетки эндометрия служат предшественниками стромальных фибробластов эндометрия, устойчивость к прогестерону при эндометриозе может быть приобретена из этих клеток 30. Исследования in vitro показали, что стромальные фибробласты пациентов с эндометриозом (eSFendo) дифференцировались от мезенхимальных стволовых клеток эндометрия (eMSCendo). , проявляют резистентность к прогестерону и отсутствие децидуализации по сравнению с клетками из нормального контроля (eSFcontrol).Интересно, что, демонстрируя классический фенотип устойчивости к прогестерону, клетки eSFendo, полученные из eMSCendo, культивируемых in vitro, не проявляли провоспалительного фенотипа, в отличие от клеток eSFendo, культивированных непосредственно из ткани. Напротив, клетки eSFendo, культивированные непосредственно из ткани, продемонстрировали повышенную регуляцию множества провоспалительных генов, включая хемокин 12 с мотивом CXC ( CXCL2), IL-8 и MM Ps, в отличие от клеток eSFendo, полученных in vitro из клеток eMSCendo. Следовательно, хотя резистентность к прогестерону у eSFendo, по-видимому, является унаследованным признаком от клеток-предшественников, провоспалительный фенотип, по-видимому, приобретается после дифференцировки.Эти результаты подчеркивают важность клеточного контекста — в данном случае «эндометриальной ниши» — в переходе клеток eSFendo к клеткам с воспалительным фенотипом, усиливая резистентность к прогестерону in vivo 30.
Генетика
Генетическая основа эндометриоза подтверждается увеличением заболеваемости у однояйцевых близнецов и членов семьи первой степени 31. Несколько интересных генов, связанных с эндометриозом, были обнаружены с помощью методов сцепления и общегеномной ассоциации.Некоторые гены-кандидаты дали многообещающие идеи, в том числе гены, кодирующие рецептор эстрогена (ER), воспалительные цитокины и молекулы адгезии, хотя однозначного консенсуса генетического «отпечатка пальца» пока не достигнуто 32, 33. Относится к вопросу устойчивости к прогестерону. представляет собой ассоциацию полиморфизма гена рецептора прогестерона и предрасположенности к эндометриозу 34. В гене PR было описано несколько полиморфизмов, но полиморфизм PROGINS может влиять на связывание лиганда и передачу сигналов ниже в клеточном контексте эндометриоза, и участвует как генетическая причина устойчивости к прогестерону 35.Полиморфизм PROGINS состоит из трех частей: 1 — вставка Alu длиной 306 п.н. в интрон 7 / G, 2 — молчащая точечная мутация в экзоне 5 ( H770H ) и 3 — изменение одной аминокислоты в экзоне 4 (валин 660). к лейцину) ( V660L ). Визер и его коллеги впервые сообщили о повышенной частоте 306-п.н. полиморфизма вставки Alu PROGINS у пациентов с эндометриозом с помощью ПЦР и гель-электрофореза, с зарегистрированной частотой 0,17 у женщин с эндометриозом по сравнению с частотой 0.08 в контроле 34. Гомозиготность этого конкретного аллеля составляла 0,03 у женщин с эндометриозом по сравнению с 0,01 в контроле. Недавний метаанализ, объединяющий 12 исследований и включающий 1323 случая и контрольную группу 1998 года, выявил тенденцию, связывающую наличие вариантного аллеля и риск эндометриоза, с присвоенным отношением шансов риска = 1,41–1,43 ( p = 0,15–0,17) в гомозиготные и рецессивные модели 35; однако ассоциация наблюдалась только у европейских испытуемых.
Эпигеномика и эпигенетика
Эпигенетические модификации транскрипционного аппарата в эндометриоидных клетках могут способствовать регуляции определенных ключевых генов, участвующих в процессе дифференцировки, что приводит к устойчивости к прогестерону.Эти эпигенетические изменения включают метилирование и ацетилирование ДНК и гистонов, а также модификацию корегуляторов, таких как активаторы, репрессоры, энхансеры, miR и другие некодирующие РНК 36. Ву и его коллеги впервые сообщили о гиперметилировании и подавлении гомеобокса A10 ( НОХА10) промотор в клетках эндометрия женщин с эндометриозом по сравнению с контрольной группой 37. НОХА10 является неотъемлемым членом семейства генов гомеобокса, участвующим в развитии и функционировании матки. HOXA10 Экспрессия обычно повышается в среднем секреторном эндометрии при регуляции прогестерона. Однако в эутопическом эндометрии пациентов с эндометриозом HOXA10 не может увеличивать свою экспрессию после овуляции. Это частично происходит из-за гиперметилирования промотора HOXA10 и подавления гена 37. Более того, клетки эндометрия, происходящие от женщин с эндометриозом, обнаруживают гиперметилирование промотора PR-B, что приводит к снижению экспрессии рецепторного белка 38.Как упоминалось ранее, снижение экспрессии и активности PR-B на клеточном уровне указывает на состояние резистентности к прогестерону 1. Действительно, нокаут-исследования показали, что отсутствие PR-B в иммортализованных стромальных клетках эндометрия приводит к неконтролируемой пролиферации, помогая в установка и обслуживание имплантата 39.
Еще одно доказательство того, что эпигенетическая среда изменяется при эндометриозе, проявляется в сверхэкспрессии ДНК-метилтрансфераз, которые катализируют метилирование ДНК (таких как DNMTs 1, 3A и 3B).Wu и его коллеги сообщили, что DNMT1, 3a и 3b сверхэкспрессируются в эктопическом эндометрии пациентов с заболеванием по сравнению с эутопическим эндометрием, что делает эктопический эндометрий чувствительным к гиперметилированию ключевых факторов транскрипции. Другие доказательства эпигенетических модификаций включают фактор транскрипции стероидогенный фактор -1 (SF-1), где пониженное метилирование в промоторе гена эндометриоидных клеток приводит к повышенной экспрессии SF-1 в эктопических имплантатах и объясняет высокую локальную продукцию ароматазы.Кроме того, промотор ER-β гипометилирован в эндометриоидных имплантатах, что может способствовать передаче сигналов эстрогена и неконтролируемой пролиферации клеток в этих имплантатах 40. И наоборот, гиперметилирование может быть предполагаемой причиной значительного снижения экспрессии белка E-, подавляющего подвижность адгезии клеток. кадгерин в эндометриоидных клетках. Лечение ингибитором гистондеацетилазы, трихостатином A, восстанавливает экспрессию E-cadherin и снижает инвазивность эндометриоидных клеток 41.
МикроРНК
Измененная экспрессия miR — еще один механизм эпигенетической регуляции эндометриоза. Микро-РНК (miR) представляют собой некодирующие фрагменты РНК, которые действуют, чтобы ингибировать экспрессию белка путем гибридизации с мРНК и их деградации 42. Исследуя эту новую концепцию регуляции генов, Бёрни и его коллеги провели профилирование miR на основе массивов в раннем секреторном эндометрии пациентов с эндометриозом и без него 43, и обнаружили, что miR-9 значительно подавляется у пациентов с эндометриозом по сравнению с контрольной группой.Одной из предполагаемых мишеней miR-9 является BCL2 , ген, кодирующий антиапоптотический белок, который, как известно, сверхэкспрессируется в эндометрии пациентов с эндометриозом. Сходным образом, три члена семейства miR-34, предположительно играющие роль в p53-зависимом подавлении пролиферации, также были подавлены в раннем секреторном эндометрии пациентов с заболеванием. В одном исследовании было обнаружено, что miR-196a сверхэкспрессируется в эутопическом эндометрии пациентов с эндометриозом, тогда как его цель, PR-B, как было обнаружено, значительно снижена 44.Другой miR, участвующий в резистентности к прогестерону, — это повышенная экспрессия miR-29c в эндометриоидной ткани. Его мишенью является связывающий белок 4 FK506 (FKBP4), известный белок, регулируемый прогестероном, ответственный за децидуализацию 45. Точные механизмы, с помощью которых изменяется экспрессия miR, еще предстоит выяснить, но было высказано предположение, что снижение экспрессии miR является результатом измененного метилирования. промоторов гена miR, поскольку обработка агентами деметилирования восстанавливает нормальную экспрессию 46. Взятые вместе, эти находки предполагают, что дифференциальная регуляция miRs может служить проводником к нарушенному действию прогестерона при эндометриозе.
Устойчивость к ретиноидам
Подобно стероидным гормонам, ретиноиды представляют собой липиды пищевого происхождения, которые служат ключевыми паракринными медиаторами действия прогестерона в эндометрии. Измененная продукция и действие ретиноидов могут быть пагубным следствием резистентности к прогестерону при эндометриозе 47. Системно циркулирующий прогестерон доставляется в строму эндометрия, и, в свою очередь, стромальные клетки используют паракринную передачу сигналов, чтобы вызвать эпителиальную генотипическую и фенотипическую дифференцировку в ответ на прогестерон.Одним из ключевых паракринных посредников такого действия является ретиноевая кислота (РА). Например, было показано, что RA стимулирует эпителиальный фермент 17βHSD2, который катализирует окисление эстрадиола до менее мощного эстрона. Появляются новые доказательства того, что действие RA может быть нарушено у пациентов с эндометриозом 47. Экспрессия рецептора витамина A (STRA6) и клеточного ретинол-связывающего белка 1 (CRBP1), ответственных за захват и транспорт RA, соответственно, значительно снижена в стромальных тканях. клетки пациентов с эндометриозом по сравнению с контролем.Точно так же снижается экспрессия ретинальдегиддегидрогеназы 1 A2 (ALDh2A2), фермента, ответственного за превращение ретинола в RA. Внутриклеточное перемещение RA к ядру нарушается из-за снижения экспрессии клеточного белка, связывающего ретиноевую кислоту 2.
(CRABP2) и эпидермальный белок, связывающий жирные кислоты (FABP5), которые отвечают за доставку к ретиноидным рецепторам RARα / RXRα (рецепторы ретиноевой кислоты и ретиноинда X α) и PPARβ / δ (рецепторы β и δ, активируемые пролифератором пероксисом) , соответственно.Уровни CRABP2 резко снижаются, тогда как уровни FABP5 минимально снижаются, что приводит к предпочтительному перемещению RA до PPARβ / δ. Было обнаружено, что экспрессия всех известных рецепторов RA снижена в эндометриоидной ткани 47. Напротив, ферменты, ответственные за катаболизм RA, такие как фермент B1, метаболизирующий RA, суперсемейства P450 , значительно увеличиваются.
Нарушение действия прогестерона, вероятно, отвечает за изменение функциональности RA в стромальных клетках эндометриоидной ткани.STRA6 и CRABP2 активируются прогестероном в стромальных клетках, и исследования с нокаутом показали, что снижение экспрессии приводит к антиапоптотическому пролиферативному фенотипу. Кроме того, из-за резистентности к прогестерону происходит предпочтительное перемещение RA в PPARβ / δ, как упоминалось ранее, что может способствовать выживанию клеток 48. В целом эти результаты показывают, что неспособность прогестерона активировать действие RA приводит к пролиферативному состоянию с минимальным дифференцировка, тем самым способствуя выживанию эндометриоидных клеток.На основании новых данных, агонисты RA и RA могут играть терапевтическую роль в лечении из-за их способности преодолевать резистентность к прогестерону при болезненных состояниях. Действительно, было показано, что лечение эндометриоидных клеток фенретинидом, синтетическим аналогом ретиноида, увеличивает апоптоз и снижает клеточную пролиферацию 49. Необходимы дальнейшие исследования, чтобы твердо установить терапевтическую роль РА при эндометриозе с учетом тератогенного потенциала этого класса. наркотиков.
Коррекция резистентности к прогестерону
Синтетические прогестины, диеногест и альтернативные пути введения
Норэтиндрона ацетат успешно используется для лечения тазовой боли, связанной с эндометриозом 50, и эстропрогестинов за счет их ингибирования овуляции и снижения выработки простагландинов, уменьшения дисменореи, тазовой боли, нарушений кровотечения и даже послеоперационного рецидива эндометриомы 51.Но мы предоставили доказательства того, что лечение прогестином может иметь ограниченную эффективность при эндометриозе из-за состояния резистентности к прогестерону. В самом деле, хотя прогестины использовались для терапии с некоторой эффективностью, обезболивание может быть кратковременным, и часть пациентов полностью не отвечает 52. Таким образом, для некоторых пациентов с эндометриозом были предприняты попытки лечения, позволяющего преодолеть резистентность к прогестерону. Диеногест (17α-цианометил-17β-гидроксиэстра-4,9-диен-3-он) эффективен при лечении эндометриоза, отчасти благодаря его способности преодолевать ослабленные реакции прогестерона 53.Диеногест (DNG) структурно родственен норэтиндрону, но отличается наличием цианометильной группы вместо этинильной группы у C-17 и добавлением двойной связи C-9-C-10 54. DNG в дозах 2 мг / день подавляет овуляцию и подавляет провоспалительные цитокины, включая IL-6, IL-8 и моноцитарный хемоаттрактантный белок-1 55. Кроме того, DNG оказывает прямое ингибирующее действие на экспрессию ароматазы в клетках эндометрия 56. Двойные слепые клинические испытания показали, что 2 мг DNG помогает превосходить плацебо в облегчении тазовой боли у пациентов со всеми стадиями эндометриоза 57 и улучшать все аспекты симптоматического бремени эндометриоза, включая дисменорею, а также нерегулярные кровотечения 58.Одно исследование показало, что DNG может преодолевать резистентность к прогестерону путем прямого увеличения соотношения PR-B: PR-A РНК в эндометриоидных клетках и тканях 53. ER-β, который увеличивается в эндометриоидной ткани, подавляется DNG 53. Как ER-β может подавлять экспрессию PR, вызванную эстрогеном, снижение ER-β с помощью DNG может повышать чувствительность к прогестерону у пациентов с эндометриозом.
Лечение другими высокоактивными прогестинами может быть полезным в преодолении легкой резистентности к прогестерону, вызывая децидуализацию в эутопическом и эктопическом эндометрии.Препараты для перорального приема и депо медроксипрогестерона ацетата (MPA) и других прогестинов доказали свою эффективность при лечении боли, связанной с эндометриозом, и могут иметь преимущество перед агонистами гонадолиберина в отношении побочных эффектов 59 и стоимости 60. Подкожное введение депо ацетата медроксипрогестерона (104) мг) имеет такую же эффективность, как и внутримышечное введение агониста гонадолиберина (11,25 мг), с точки зрения уменьшения болевых симптомов у пациентов с легким и умеренным эндометриозом, но имеет меньше гипоэстрогенных симптомов, чем последний 61.Внутриматочная система левоноргестрела (ЛНГ-ВМС) также доказала свою эффективность, уменьшая умеренную и тяжелую дисменорею примерно у 88% пациентов по сравнению с плацебо 62. Эутопическая и эктопическая биопсия ткани эндометрия после 6 месяцев установки ЛНГ-ВМС показывает снижение клеточной пролиферации index в дополнение к снижению экспрессии ERα и PR-A 63. Симптоматическое улучшение хронической тазовой боли кажется столь же многообещающим, при этом некоторые исследования отмечают сходные профили боли у пациентов, получавших LNG-IUS, по сравнению с аналогами GnRH 64.Профили побочных эффектов также лучше у пациентов, получавших ЛНГ-ВМС, чем у аналогов ГнРГ.
Другие стратегии
Существующие в настоящее время вмешательства для эффективного повышения чувствительности к прогестерону при эндометриозе ограничены, но новые терапевтические подходы, нацеленные на лежащие в основе клеточные и молекулярные основы устойчивости к прогестерону, могут оказаться эффективными. Одно исследование недавно сообщило об обнадеживающих результатах фенретинида, ретиноида с низкой токсичностью, вводимого для преодоления снижения передачи сигналов RA у пациентов с эндометриозом 49.Воздействие фенретинида на эндометриоидные клетки увеличивало экспрессию генов, участвующих в захвате и действии RA, включая STRA6. Кроме того, у мышей, несущих ксенотрансплантированную ткань эндометриоза человека, леченных фенретинидом в течение двух недель, объем эндометриоидного поражения уменьшился. Активные для перорального применения непептидные антагонисты GnRH в настоящее время находятся в стадии разработки. У них есть преимущество корректировки дозы, так что системные концентрации эстрадиола лишь умеренно подавляются, смягчая некоторые из гипоэстрогенных побочных эффектов подавления гипофиза 65.Противовоспалительные препараты могут нормализовать резистентность к прогестерону, характерную для провоспалительных состояний. Например, статины обладают доказанной способностью снижать количество провоспалительных медиаторов IL-1β, TNF-α и C-реактивного белка. Этот класс лекарств также ингибирует ангиогенные факторы, дополнительно уменьшая возникновение эндометриоидных поражений и бремя болезни 66. Альтернативная перспектива, хорошо разработанная в области карциномы эндометрия, заключается в том, что вследствие резистентности к прогестерону повышается сенсибилизация к эстрогенам 67.Это дает основание для ингибирования ароматазы для лечения боли, связанной с эндометриозом 68. Мы надеемся, что наши рассуждения побудят независимых исследователей и фармацевтических новаторов изучить новые возможности лечения этого заболевания.
Выводы
Эндометриоз — заболевание сложной этиологии и патофизиологии. В то время как ретроградная менструация происходит у большинства менструирующих женщин, эндометриоз развивается только у небольшой группы женщин.Следовательно, хотя посев эндометриальных имплантатов в брюшную полость, по-видимому, является ключевым признаком этого заболевания, для установления эндометриоидных поражений требуются дополнительные факторы, которые способствуют инвазии и росту. Патогенез этого заболевания, вероятно, берет начало в самом эутопическом эндометрии, при этом резистентность к прогестерону и нарушение децидуализации истощенного эндометрия являются основными причинами создания и поддержания эктопических имплантатов. Точный механизм устойчивости к прогестерону еще предстоит выяснить; однако были продемонстрированы аберрации в генетической и эпигенетической регуляции PR и их мишеней.Воспаление и вредные факторы окружающей среды также могут быть вовлечены в генез заболевания через изменения в реакции прогестерона. Выявление различных путей, посредством которых действие прогестерона нарушается в эутопическом эндометрии женщин с эндометриозом, является важной задачей для профилактики и лечения заболеваний и может привести к выявлению новых биомаркеров для помощи в прогнозировании ответа на будущие терапевтические препараты.
Испытание прогестерона у двойни и тройни для предотвращения преждевременных родов (STTARS) — Просмотр полного текста
Женщины с многоплодной беременностью сталкиваются с многочисленными рисками, превышающими те, с которыми сталкиваются женщины с одноплодной беременностью.Преждевременные роды на сегодняшний день являются наиболее частой и самой серьезной из этих проблем, однако никакое вмешательство или подход не помогли снизить этот риск. Распространенность преждевременных родов резко возросла в последние годы, во многом благодаря вспомогательным репродуктивным технологиям. Следовательно, проблема преждевременных родов приобрела еще большую роль в увеличении перинатальной заболеваемости и смертности. Недавно завершившееся исследование сети отделений материнской медицины плода (MFMU), спонсируемое NICHD, впервые продемонстрировало лечение (i.е. прогестероновой терапии), которая существенно снижает частоту преждевременных родов у женщин с высоким риском преждевременных родов из-за предшествующих самопроизвольных преждевременных родов. Число преждевременных родов сократилось на 35% среди женщин, получавших прогестерон, по сравнению с женщинами, получавшими плацебо. Учитывая это существенное преимущество и чрезвычайно высокий риск преждевременных родов у женщин с многоплодной беременностью, исследование по оценке пользы прогестерона у женщин с многоплодной беременностью является уместным и своевременным. Этот протокол описывает рандомизированное клиническое исследование с двойной маской, сравнивающее еженедельное лечение инъекцией 17-альфа-гидроксипрогестерона капроата (17P) с плацебо у женщин с беременностью двойней или тройней.В дополнительном исследовании будет изучена фармакокинетика и фармакодинамика 17P при многоплодной беременности.
Это испытание направлено на включение 600 женщин с беременностью двойней и ста двадцати женщин с беременностью тройней в период от 16 недель 0 дней до 20 недель 6 дней. При первичной скрининговой оценке и после подписания формы информированного согласия пациент получит инъекцию плацебо (1 мл инертного касторового масла). Ее попросят вернуться через три дня для рандомизации.В течение этого периода проверки на соответствие будет назначено ультразвуковое исследование, если оно не было проведено ранее. Когда пациентка вернется и если она по-прежнему соответствует критериям включения, она будет рандомизирована для получения одного из двух видов лечения:
- 17 α-гидроксипрогестерона капроат: еженедельные инъекции по 1 мл, содержащие 250 мг 17P
- Плацебо: еженедельные инъекции 1 мл плацебо инертного касторового масла
Лечение будет проводиться в течение 34 недель 6 дней беременности или родов.