Лечение рака легких 4 стадии
«У меня диагностировали рак легкого 4 стадии: что это означает?»
Четвертую стадию рака легких делят на две подстадии: 4A и 4B.
Если диагностирована подстадия 4A, это означает, что соблюдается одно из следующих условий:
- Очаги опухолевой ткани присутствуют в обоих легких.
- Раковые клетки распространились в серозную оболочку легкого (плевру) или сердца (перикард).
- Вокруг сердца или легких скапливается жидкость, в которой присутствуют опухолевые клетки.
- Имеется отдаленный метастаз – вторичный очаг в органах или лимфатических узлах, которые находятся за пределами грудной клетки.
Подстадию 4B диагностируют, если обнаружено несколько отдаленных метастазов в одном или нескольких органах.
Методы лечения рака легких 4 стадиис метастазами
Врач ориентируется на подстадию, количество, размеры и локализацию метастазов, возраст и состояние здоровья пациента.
В зависимости от микроскопического строения опухолевой ткани, выделяют два типа рака легкого:
- Немелкоклеточный – наиболее распространенный. На его долю приходится 80–85% случаев.
- Мелкоклеточный встречается в 10–15% случаев.
Эти типы по-разному реагируют на те или иные виды лечения.
Опухолевые клетки могут обладать разными молекулярно-генетическими характеристиками: они используют разные вещества, которые помогают им бесконтрольно размножаться, выживать, защищаться от агрессии иммунной системы. Зная молекулярно-генетические характеристики опухоли у конкретного пациента, врач может подобрать оптимальное, персонализированное лечение. В настоящее время такие анализы доступны для пациентов в России.
Лечение немелкоклеточного рака легких 4 стадии
Очень редко встречается ситуация, когда у пациента обнаружены единичные метастазы, которые можно
удалить хирургическим путем или с помощью стереотаксической радиохирургии («гамма-нож»).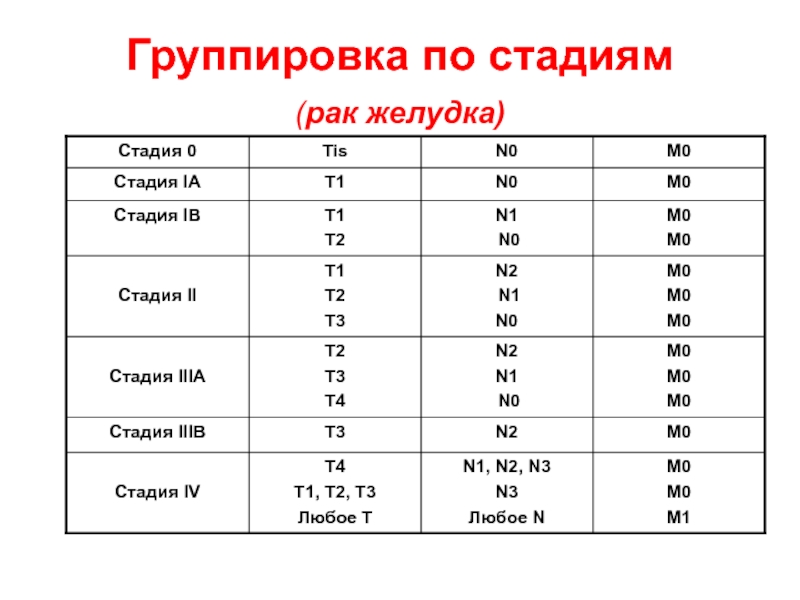 В таких случаях иногда даже удается добиться ремиссии.
В таких случаях иногда даже удается добиться ремиссии.
Например, если обнаружен один небольшой метастаз в головном мозге, используют «гамма-нож». Специальный аппарат генерирует около 200 пучков гамма-излучения, которые сходятся в одной точке – там, где находится опухоль. По отдельности каждый луч очень слаб и не может повредить ткани, но в месте, где они фокусируются, создается большая доза, которая уничтожает раковые клетки. После удаления опухоли проводят курс лучевой терапии головы. С первичной опухолью в легких, в зависимости от размеров и расположения, борются с помощью хирургии, лучевой терапии, химиотерапии.
Если метастазов много, и их нельзя удалить, основным методом лечения будет химиотерапия. Обычно назначают 2 химиопрепарата, но это зависит от состояния больного. Некоторые пациенты чувствуют себя настолько плохо, что им приходится назначать лишь один химиопрепарат из-за риска побочных эффектов.
- При изменениях в гене ALK назначают таргетные препараты: алектиниб (Алеценза), церитиниб (Зикадиа), кризотиниб (Ксалкори).
 Если эти препараты плохо переносятся, врач может назначить другой блокатор ALK – бригатиниб (Алунбриг).
Если эти препараты плохо переносятся, врач может назначить другой блокатор ALK – бригатиниб (Алунбриг). - При изменениях в гене EGFR назначают таргетные препараты: эрлотиниб (Тарцева), афатиниб (Гилотриф), гефитиниб (Иресса).
- При изменениях в гене ROS1 применяют ингибитор ALKкризотиниб.
- При изменениях в гене BRAF применяют таргетные препараты: дабрафениб (Тафинлар) и траметиниб (Мекинист).
- Некоторые раковые клетки используют белок PD-L1, чтобы блокировать активность иммунной системы. В таких случаях применяют иммунопрепарат пембролизумаб (Кейтруда).
Также применяют лучевую терапию.
Лечение мелкоклеточного рака легких 4 стадии
При четвертой стадии мелкоклеточного рака легких лечение обычно начинают с химиотерапии. Как правило, применяют комбинацию химиопрепарата этопозида с карбоплатином или цисплатином. Иногда после курса лечения в легких больше не обнаруживаются опухоли. К сожалению, как правило, это не говорит о том, что рак побежден.
После курса химиотерапии назначают лучевую терапию грудной клетки. Затем может последовать курс профилактической химиотерапии головы. Мелкоклеточный рак легкого часто метастазирует в головной мозг.
Борьба с болью
Современный подход к борьбе с болью у онкологических больных базируется на трехступенчатой схеме. Сначала назначают ненаркотические обезболивающие препараты. Если они не помогают, переходят на следующую ступень – применяют слабые наркотические анальгетики. Третья ступень предусматривает применение наиболее сильных наркотических анальгетиков.
Боль при раке легкого можно держать под контролем. В России есть клиники, в которых доступны все необходимые препараты.
Лечение осложнений
При 4 стадии легких нередко образуется плевральный выпот: внутри грудной клетки скапливается жидкость. Из-за этого нарушается дыхание, ухудшается состояние пациента, снижается эффективность лечения. С плевральным выпотом борются следующими способами:
Из-за этого нарушается дыхание, ухудшается состояние пациента, снижается эффективность лечения. С плевральным выпотом борются следующими способами:
- Плевроцентез – процедура, во время которой в грудной клетке с помощью специального инструмента делают прокол и выводят избыток жидкости.
- Для постоянного оттока жидкости устанавливают плевральный катетер, один конец которого находится в грудной клетке, а другой соединен со специальной емкостью.
- Плевродез – процедура, во время которой в плевральную полость вводят препарат (например, доксициклин или блеомицин), приводящий к склеиванию листков плевры, в итоге жидкость перестает накапливаться.
Если жидкость скапливается вокруг сердца, выполняют пункцию перикарда или операцию по созданию «перикардиального окна». Удаляют часть околосердечной сумки, это способствует оттоку жидкости.
Иногда опухоль перекрывает дыхательные пути. В таких случаях выполняют стентирование: в дыхательные пути помещают 
Рак 4 стадии, лечение | Клиника НАКФФ в Москве
4 стадия рака с метастазами и сильными болями — последняя, терминальная. На этом этапе опухоль не просто разрастается, вызывая нарушения в работе пораженного и соседних органов — раковые клетки по лимфатической системе и кровеносным сосудам разносятся по всему организму, создавая вторичные злокачественные образования в самых разных местах. Поэтому справиться с онкологией на 4 стадии полностью не удастся, даже если уничтожить обнаруженные новообразования. Зато можно улучшить самочувствие больного, уменьшить боль и продлить жизнь.
Госпитализация онкологических больных. Ежедневно. Круглосуточно
Нам доверяют 9500 пациентов ежегодно.
Некоторые виды рака относят к терминальной стадии даже без диагностированного метастазирования в отдаленные органы. В основном это касается агрессивных низкодифференцированных опухолей, либо при поражении большого количества лимфоузлов, то есть в случаях, когда прогноз для больного крайне неблагоприятен.
Симптомы и диагностика
На I–II стадиях онкологические заболевания довольно часто принимают за другие, менее пугающие. К сожалению, люди нередко забывают о регулярных профилактических осмотрах и диспансеризации, не обращаются к врачам с ранними признаками болезни. В результате по мере роста новообразования и захвата болезнью «новых территорий» симптомы становятся все более выраженными, и их уже нельзя игнорировать:
- сильная слабость, утомляемость;
- повышенная температура;
- резкая потеря массы тела, снижение аппетита;
- нарушения в работе органа с первичным очагом и соседних, а также тех, в которых развивается вторичный рак в результате метастазирования, кровь в мокроте, кале, моче, кровотечения и т.д.
Онкология 4 стадии с метастазами негативно влияет на весь организм, затрагивая все системы. При диагностике определяют количество, расположение, границы уже имеющихся злокачественных новообразований, для чего проводятся МРТ, КТ, УЗИ, гистологические исследования, берется биопсия и т.
Наш эксперт в этой сфере:
Иванов Антон Александрович
Что можно предпринять
К сожалению, победить болезнь на этом этапе уже не получится, однако паллиативная помощь больным раком 4 стадии позволяет значительно улучшить их состояние и продлить жизнь. Для этого необходимо удалить или уменьшить размеры имеющихся опухолей, чтобы по возможности восстановить функционирование органов. С этой целью используются те же методы, что и при лечении: хирургия, лучевая и химиотерапия, в качестве дополнительных — иммунная и гормональная терапия. ,
,
Отправьте документы на почту [email protected]. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, кмн
Существуют стандартные протоколы проведения лечебных мероприятий. Но для конкретного пациента методики, дозировки, продолжительность курсов определяются в зависимости от разновидности, местоположения, размеров, четкости границ новообразования, его реакции на ранее проводившееся лечение, состояния и анамнеза больного.
При раке 4 стадии прогнозы неблагоприятны, а шансы на пятилетнюю выживаемость, по статистике, около 5% — точные цифры варьируются в зависимости от разновидности заболевания. И это в случаях, когда больной использовал возможности современной медицины, а при отказе от лечения летальный исход чаще всего наступает через месяцы, а иногда и недели.
Оперативная помощь при онкологии
- Если вам отказали в проведении химиотерапии и операции
- Если лечение не приносит результата
- Если отправили под наблюдение онколога по месту жительства
Лечение и паллиативную помощь вы и ваши близкие можете получить в медицинской клинике НАКФФ. Высокотехнологичное оборудование, современные препараты, опытный и внимательный персонал позволят улучшить самочувствие и уменьшить влияние болезни. Для записи на консультацию позвоните по тел. +7 (495) 259-44-44.
Высокотехнологичное оборудование, современные препараты, опытный и внимательный персонал позволят улучшить самочувствие и уменьшить влияние болезни. Для записи на консультацию позвоните по тел. +7 (495) 259-44-44.
4 стадия рака: последняя стадия рака, можно ли вылечить, сколько живут, симптомы перед смертью
Что можно сделать при 4-й стадии рака?
Чтобы облегчить общее состояние пациента на поздних стадиях рака, используются основные методы поддержания жизненно важных функций, включая интенсифицированную внутривенную терапию, плазмаферез, гемосорбцию, переливание крови и кровекомпонентов.
В отделении интервенционной онкологии мы проводим такие паллиативные и вспомогательные операции, как:
На четвертой стадии рака важна современная обезболивающая терапия.
Что такое рак на 4-й стадии?
Четвёртая стадия рака – это необратимый бесконтрольный процесс разрастания и распространения опухолевых клеток по организму, при котором происходит повреждение соседних здоровых органов и тканей, формирование отдаленных (метастатических) очагов опухоли в далеко расположенных органах. При раке четвёртой стадии первичный очаг может быть любых размеров: от 5-6 мм при нейроэндокринной опухоли желудочно-кишечного тракта или меланоме и до 10-30 см в диаметре при опухоли Юинга.
При раке четвёртой стадии первичный очаг может быть любых размеров: от 5-6 мм при нейроэндокринной опухоли желудочно-кишечного тракта или меланоме и до 10-30 см в диаметре при опухоли Юинга.
Критерии постановки диагноза четвертой стадии онкологического заболевания включают:
- прогрессирующее поражение раком с распространением в кости, лёгкие, печень, поджелудочную железу и (или) в мозг, или
- быстрорастущие раковые образования (быстрорастущая опухоль), или
- любой тип рака кости, или
- чрезвычайно-фатальные раковые образования (например, рак легкого, панкреатический рак, многократная миелома, squamous cell carcinoma, меланома и т.д.)
Как определяют стадию рака?
Стадия рака показывает, насколько сильно злокачественная опухоль проросла в соседние ткани, успела ли дать метастазы в лимфатические узлы и в различные части тела. Это очень важная информация, потому что она помогает врачу разработать оптимальную тактику лечения, выстроить достоверный прогноз.
Чтобы определить стадию рака, врачи опираются на общепринятую TNM-классификацию. Буква T обозначает размер и локализацию первичной опухоли, N — метастазы в близлежащих лимфатических узлах, M — отдаленные метастазы. Возле каждой буквы указывают числовой индекс.
Комбинации различных значений T, N и M объединяют в четыре стадии (есть еще дополнительная – нулевая):
Стадии рака – это комплекс признаков, которые позволяют описать течение опухолевого процесса. Выделяют следующие стадии рака:
- Нулевая стадия. Так называемый рак in situ. Опухоль находится в пределах тканей, из которых развилась, и не прорастает в соседние структуры. Новообразование можно полностью удалить хирургическим путем.
- Первая стадия. Опухоль относительно небольшая и не успела глубоко прорасти в окружающие ткани.
- Вторая стадия. Опухоль по-прежнему не распространяется в соседние ткани, но больше по размерам. Могут обнаруживаться единичные метастазы в близлежащих лимфатических узлах.

- Третья стадия. Раковые клетки распространились в окружающие ткани и ближайшие лимфатические узлы.
- Четвертая стадия. Метастатический рак: опухолевые клетки распространились в разные части тела.
Иногда к цифрам приписывают латинские буквы — А, В, С, если в стадии нужно выделить подстадию.
Симптомы рака 4-й стадии
Пока рак не достиг IV стадии, больной человек может не испытывать никаких симптомов. Это одна из главных причин поздней диагностики онкологических заболеваний. Если опухоль обнаружена на ранней стадии, как правило, это произошло случайно, или благодаря регулярному скринингу.
Симптоматика рака IV стадии зависит от типа и размеров опухоли, наличия метастазов, степени прорастания раковых клеток в различные ткани и органы.
Среди общих симптомов можно выделить следующие:
- повышенная утомляемость, постоянное чувство усталости;
- снижение аппетита;
- одышка;
- потеря веса, вплоть до истощения — кахексии;
- тошнота и рвота;
- желтуха.

Метастазы в кости приводят к болям в конечностях и патологическим переломам; в головной мозг – к головным болям, головокружениям, судорогам; в легкие – к одышке; в печень – к увеличению живота и желтухе.
У некоторых пациентов развивается паранеопластический синдром — реакция на опухоль и биологически активные вещества, которые она выделяет. Он проявляется разными симптомами — со стороны кожи, эндокринной, нервной, сердечно-сосудистой, пищеварительной систем, опорно-двигательного аппарата, крови.
Какие лечебные мероприятия проводятся на 4-й стадии рака?
Лечение четвертой стадии рака любой локализации при обширном опухолевом поражении и наличии отдаленных метастазов носит преимущественно паллиативный и симптоматический характер. Основные задачи врача в лечении таких пациентов следующие:
- Ограничение распространенности опухоли.
- Уменьшение темпов роста опухоли, задержка прогрессирования опухолевого процесса.
- Сохранение функционирования органов и систем.

- Профилактика угрожающих жизни осложнений – тромбоэмболии, инсультов, инфарктов.
Основные методы лечения рака 4-й стадии включают в себя паллиативные хирургические операции, химиотерапию, лучевую терапию, гормонотерапию, иммунотерапию и другие методы, используемые изолированно и совместно, в зависимости от типа злокачественной опухоли.
Совершенствование методов лечения онкологических заболеваний на поздних стадиях привело к внедрению процедур, позволяющих существенно улучшить качество жизни пациентов, а также продлить жизнь до года и более. При этом часть пациентов сохраняет трудоспособность и возможность общения с родными и близкими.
Новые методы лечения онкологических заболеваний отличаются эффективностью и минимальными побочными эффектами и включают:
Индивидуальные противоопухолевые вакцины готовят параллельно с хирургическим вмешательством, при котором удаляют большой объём опухоли. Из удалённой опухоли выращивают клеточную культуру, а из лейкоцитов крови пациента выделяют лимфатические дендритные клетки. В специальных лабораторных условиях иммунные клетки обучают реагировать на антигены удалённой опухоли. В результате получается индивидуальная вакцина от рака, которая дополнительно защищает пациента от рецидивов и метастазирования.
В специальных лабораторных условиях иммунные клетки обучают реагировать на антигены удалённой опухоли. В результате получается индивидуальная вакцина от рака, которая дополнительно защищает пациента от рецидивов и метастазирования.
Моноклональные антитела , в том числе препараты типа имутерана, Erlotinib, назначаемого при раке толстой кишки, препарата SU11248, применяемый при лечении рака желудка, избирательно воздействуют на злокачественные клетки и вызывают их изолированную гибель после внутривенного введения. В лечении меланомы используют препараты Опдиво, Китруду, Тафинлар.
Радиоэмболизация метастазов печени проводится при различных онкологических заболеваниях на поздних стадиях. Включает в себя проводимую под контролем ангиографа внутрисосудистую селективную катеризацию сосудов печени и введение эмболизирующих частиц с радиоактивным изотопом иттрий-90. Изотопы сохраняют активность и борются с опухолевыми клетками в течение 64 часов.
Химиоэмболизация микросферами – эндоваскулярная операция, во время которой непосредственно в артерию, питающую метастаз, вводят микросферы с иммобилизованными химиопрепаратами. Химиоэмболизация проводится при неоперабельных новообразованиях, при выраженном объёмном поражении печени, тяжёлых сопутствующих соматических заболеваниях. Применение цифровых рентгеновских хирургических аппаратов, высокотехнологичных внутрисосудистых инструментов позволяет проводить данную операцию неоднократно без побочных эффектов и осложнений. Методика химиоэмболизации может комбинироваться с другими методами лечения опухолей.
Радиочастотная RF-аблация опухолей печени проводится при первичных опухолях печени и при метастатическом поражении печени диаметром до 5 см. Является мировым стандартом в комплексном лечении поздних стадий и метастазов колоректального рака.
РЧА противопоказана при расположении опухолевого очага в непосредственной близости к портальной вене, желчному пузырю, крупным жёлчным протокам.
- При чрескожной чреспеченочной радиочастотной RF-аблации под ультразвуковым контролем и общим обезболиванием сквозь кожу и паренхиму печени вводят полую иглу, через которую затем вводится монополярный радиоволновой электрод.
- Электрод локально разогревает участок паренхимы печени, вызывая коагуляцию тканей опухоли и локальный некроз.
- В ряде случаев радиочастотная RF-аблация опухолей печени выполняется во время лапаротомии, во время ликвидации кишечной непроходимости с наложением анастомозов или при удалении опухолевого инфильтрата.
- Выполнение радиочастотной RF-аблации печени существенно расширяет показания к хирургическому лечению пациентов с множественным полисегментарным поражением печени.
В целом, даже паллиативное и симптоматическое лечение рака 4 стадии любой локализации продлевает жизнь пациента и улучшает её качество.
Прогноз жизни при 4-й стадии онкологического заболевания
Ключевой показатель прогноза при четвертой стадии рака – пятилетняя выживаемость, процент пациентов, которые продолжают жить по истечении 5-ти лет от момента постановки диагноза 4-й стадии рака.
На ранних стадиях рака пятилетняя выживаемость наиболее высока и в некоторых случаях приближается к 100%. На 4 стадии она наиболее низкая, но это не означает, что шансов нет совсем. Показатель пятилетней выживаемости носит статистический характер. Его рассчитывают, исходя из наблюдения за большим количеством больных. Но каждый пациент уникален. Нужно делать поправку на возраст, сопутствующие заболевания, общее состояние здоровья.
Кроме того, показатели пятилетней выживаемости рассчитывают на основании наблюдения за пациентами, у которых рак был диагностирован, как минимум, 5 лет назад. С тех пор появились новые препараты, изменились подходы к лечению. У современных онкобольных есть повод рассчитывать на несколько лучшие прогнозы.
Наиболее точный прогноз для вас сможет дать только ваш лечащий врач. Даже если выживаемость при данном типе рака очень низкая, и прогноз, скорее всего, неблагоприятен, врач всегда может назначить поддерживающее лечение, которое поможет продлить жизнь и избавит от мучительных симптомов.
Прогноз выживаемости при 4-й стадии рака: статистика России и других стран
В Японии, США, Германии, Швейцарии, Израиле и ряде других стран, терминальная стадия рака диагностируется гораздо реже, чем в России. Это связано с особенностями организации медицинского обслуживания. Граждане этих стран с детства знают о преимуществах профилактики перед лечением.
В России диагностированный рак на 4-й стадии встречается нередко, а выживаемость при таком диагнозе составляет от полугода до двух с половиной лет. Для сравнения, в Германии и США прогноз выживаемости составляет не менее 5 лет. Такая же статистика и в «Евроонко», на счету наших клиник есть несколько случаев дестадирования. В чем причина такой разницы?
Во-первых, как уже отмечалось – разные принципы организации медицинской помощи. К сожалению, Минздрав, до недавнего времени не обозначал предельных сроков начала лечения обнаруженного рака. Больные могли ждать начала терапии по нескольку месяцев, что, конечно, пагубно сказывается на прогнозах.
Во-вторых – лекарства, их цена и качество. Практически все по-настоящему эффективные препараты производятся в Европе или США. Большинство из них очень дороги и приобрести их могут далеко не все. Аналоги, имеющиеся в России, как правило сильно уступают в качестве зарубежным.
В-третьих – протоколы лечения. Существуют международные предписания по лечению того или иного вида опухоли, которые постоянно пополняются и совершенствуется. Однако, в России по большей части лечат по собственным протоколам, многие из которых устарели и показывают куда меньшую эффективность по сравнению с зарубежными.
В клиниках «Евроонко» знают, как помочь и добиться наилучшего прогноза:
- Организация оказания медицинской помощи построена по «золотому стандарту» клиник США и Европы.
- Используются препараты зарубежного производства, доказавшие свою эффективность. Подлинность проверяется на каждом этапе от закупки у официального представительства фирмы-производителя до доставки препарата.

- Специалисты клиники руководствуются международными протоколами лечения.
- Мы умеем лечить рак, и делаем это так же, как лучшие клиники мира.
Рак легких 4-й стадии
При раке лёгких 4-й стадии средний показатель пятилетней выживаемости в среднем составляет около 10%. При мелкоклеточном раке легких этот показатель составляет около 1 %, а при немелкоклеточном раке легких выживаемость существенно выше и варьирует от 2 до 13%, в зависимости от степени метастазирования в другие органы и ткани, а также поражения плевры и перикарда. Если ранее пациенту была выполнена радикальная операция – резекция легкого или его доли — этот показатель существенно выше.
При четвертой стадии рака лёгкого проводится лучевая терапия с целью уменьшения размеров опухоли и облегчения симптомов заболевания. У некоторых пациентов лучевая терапия дополняется курсом химиотерапии, что существенно облегчает общее состояние пациента. При метастатическом поражении плевры и развитии плеврита активно используется торакоцентез для уменьшения объёма жидкости в легких.
Рак печени 4-я стадия
При раке печени 4-й стадии прогноз наименее благоприятен – более 5-ти лет проживет только 6% больных. 4-я стадия рака печени характеризуется множественными опухолевыми очагами в обеих долях печени, а также поражением основных ветвей печеночной или портальной вены. Рак печени является быстро прогрессирующим заболеванием, когда между 1 и 4 стадиями рака печени проходит, как правило, 3-4 месяца.
К сожалению, при 4 стадии рака печени классическое химиотерапевтическое лечение малоэффективно. В настоящее время применяются новые медицинские технологии – радиочастотная абляция очагов рака в печени и химиоэмболизация. Ранее проводилось преимущественно обезболивающее лечение для устранения болевого синдрома и лапароцентез для уменьшения асцита и облегчения состояния пациента.
Рак желудка 4-й стадии
Рак желудка на 4-й стадии имеет наиболее высокий благоприятный прогноз. Показатель 5-летней выживаемости составляет около 15-20%. Более благоприятные результаты отмечены у больных раком кардиальной части желудка, особенно при плоскоклеточном раке желудка после лучевой терапии. Диагноз четвертой стадии рака желудка устанавливается при поражении соседних органов и не менее одного регионарного лимфатического узла, или при поражении желудка и более 15-ти близлежащих лимфатических узлов, или при наличии метастазов в отдаленные органы и ткани. Паллиативная химиотерапия позволяет добиться относительно стойкой стабилизации течения заболевания в 40-45% случаев. Хирургическое лечение при раке желудка на 4 стадии применяется преимущественно для паллиативного лечения жизнеугрожающих состояний – кровотечения из опухоли и других.
Более благоприятные результаты отмечены у больных раком кардиальной части желудка, особенно при плоскоклеточном раке желудка после лучевой терапии. Диагноз четвертой стадии рака желудка устанавливается при поражении соседних органов и не менее одного регионарного лимфатического узла, или при поражении желудка и более 15-ти близлежащих лимфатических узлов, или при наличии метастазов в отдаленные органы и ткани. Паллиативная химиотерапия позволяет добиться относительно стойкой стабилизации течения заболевания в 40-45% случаев. Хирургическое лечение при раке желудка на 4 стадии применяется преимущественно для паллиативного лечения жизнеугрожающих состояний – кровотечения из опухоли и других.
При неоперабельном раке проксимального (кардиального) отдела желудка с переходом на пищевод при нарушении прохождения пищи выполняется эндоскопическая установка стента в пищевод и желудок.
Из паллиативных операций при 4-й стадии рака желудка у 10-15% пациентов проводят гастроэнтеростомию с целью восстановления прохождения пищи по желудочно-кишечному тракту, коррекции и профилактики водно-электролитных нарушений. Эта операция показана при неоперабельном раке желудка со стенозом выходного (пилорического отдела) желудка. В отдельных случаях выполняется гастростомия для последующего энтерального питания больного через зонд.
Эта операция показана при неоперабельном раке желудка со стенозом выходного (пилорического отдела) желудка. В отдельных случаях выполняется гастростомия для последующего энтерального питания больного через зонд.
Рак поджелудочной железы 4-й стадии
При 4-й стадии рака поджелудочной железы пятилетняя выживаемость пациентов составляет менее 2% при отсутствии лечения и до 10% при проведении активных лечебных мероприятий. Для облегчения состояния пациента применяют комбинацию хирургического вмешательства и химиотерапии.
Наиболее распространенным методом хирургического лечения рака поджелудочной железы является операция Уиппла – панкреатодуоденальная резекция. Операция включает удаление головки поджелудочной железы с опухолью, части двенадцатиперстной кишки, части желудка, жёлчного пузыря, а также ближайших лимфатических узлов. Хирургическое лечение рака не показано, если раковое поражение поджелудочной железы распространилось на крупные прилежащие сосуды или имеются удалённые метастазы.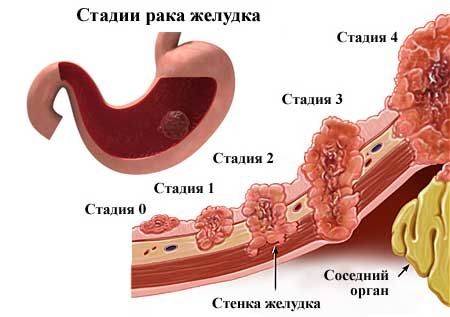
При сдавлении массивной раковой опухолью жёлчных протоков в области ворот печени и невозможности проведения панкреатодуоденальнальной резекции выполняется чрескожное чреспеченочное дренирование и стентирование жёлчного протока с целью нормализации оттока жёлчи.
Химиотерапевтическое лечение при поздних стадиях рака включает применение таких современных препаратов, как гемцитабин (гемзар), иринотекан (кампто), а также карбоплатина, 5-фторурацила и др.
Рак кишечника 4-й стадии
При четвертой стадии рака кишечника пятилетняя выживаемость составляет менее 5%. Паллиативное хирургическое лечение рака включает восстановление проходимости кишечника при стенозах. В нашей клинике проводятся как операции наложения колостомы, так и стентирование кишечника во время проведения колоноскопии.
Рак молочной железы 4-й стадии
При раке молочной железы четвертой стадии пятилетняя выживаемость составляет около 10-15%. Активная терапия рака молочной железы включает хирургическую санацию рака (радикальную мастэктомию), что позволяет избежать массивной интоксикации организма и кровотечения из распадающейся опухоли. При отсутствии существенных нарушений свёртывающей системы крови и декомпенсации функции печени и почек, проведенная химиотерапия рака молочной железы позволяет существенно повысить качество жизни.
При отсутствии существенных нарушений свёртывающей системы крови и декомпенсации функции печени и почек, проведенная химиотерапия рака молочной железы позволяет существенно повысить качество жизни.
Смотрите подробнее о лечении рака молочной железы на 4-й стадии.
Рак предстательной железы 4-й стадии
Прогноз пятилетней выживаемости при 4 стадии рака предстательной железы составляет около 30%. Основной причиной смерти при раке простаты являются сопутствующие нарушения функции печени, легких, почек. Основные варианты лечения 4-й стадии рака простаты:
- гормональная терапия;
- внешняя лучевая терапия в сочетании с гормональной терапией;
- хирургическая операция: трансуретральная резекция предстательной железы с целью облегчения симптомов онкологического заболевания и профилактики кровотечения из поражённого мочевого пузыря или непроходимости мочевых путей, и, следовательно, развития острой почечной недостаточности.
Рак матки 4-й стадии
При раке тела матки на 4 стадии опухолевый процесс распространяется за пределы таза, вовлекая мочевой пузырь, прямую кишку. 5-летняя выживаемость при четвертой стадии рака матки не превышает 3-9%. Лечение таким пациентам назначают индивидуально, в основном оно является комплексным, включающим химиотерапию, гормонотерапию, паллиативное хирургическое лечение.
5-летняя выживаемость при четвертой стадии рака матки не превышает 3-9%. Лечение таким пациентам назначают индивидуально, в основном оно является комплексным, включающим химиотерапию, гормонотерапию, паллиативное хирургическое лечение.
При 4-й стадии рака шейки матки прогноз пятилетней выживаемости не превышает 8-9%. Переход преинвазивного рака шейки матки в микроинвазивный с последующим быстрым ростом опухоли и переходом в 4-ю стадию может наблюдаться в течение 1-2 лет. Рак шейки матки в настоящее время является одним из быстропрогрессирующих раков. В опухолевый процесс вовлечены все тазовые органы, в том числе влагалище, мочевой пузырь, прямая кишка.
Могли ли ошибиться врачи, поставив диагноз рака на 4-й стадии, если за 2-3 месяца до этого пациент ничем не болел?
Мы наблюдаем устойчивую тенденцию последних десяти лет по росту поздней обращаемости пациентов с онкологическими заболеваниями. Утрата системы регулярной диспансеризации и невнимательность пациентов по отношению к собственному здоровью, игнорирование начальных симптомов со стороны жизненно важных органов (сердца, печени, легких), приводят к тому, что при первичном расширенном диагностическом обследовании по поводу какого-либо недомогания устанавливается диагноз четвертой стадии рака.
Мы встречаем рак шейки матки, развившийся на фоне беременности за 10-12 месяцев из предраковых изменений шейки матки сразу в 4-ю стадию рака. В нашей практике много случаев рака кишечника у мужчин и женщин в возрасте 30-40 лет, которые ранее не обращались к врачу. Во время диагностической колоноскопии по поводу неясных расстройств кишечника у них обнаруживают онкологическое заболевание (рак сигмовидной кишки, рак прямой кишки) на поздней стадии.
Излечим ли рак на 4-й стадии?
Широко распространен миф, что человек с последней стадией рака очень быстро умирает. Однако, правильно подобранная схема лечения позволит продлить жизнь и существенно повысить её качество на срок до 5 лет, в зависимости от вида опухоли и степени поражения жизненно важных органов, а также наличия сопутствующих заболеваний.
Что ухудшает качество жизни на 4-й стадии рака?
Самыми частыми состояниями, существенно ухудшающими качество жизни при четвертой стадии рака, являются:
- нарушение функции печени в результате блокировки желчевыводящих путей и развитие механической желтухи;
- нарушения свертывания крови и развитие тромбоэмболии легочной артерии, пневмонии или инсульта;
- угнетение кроветворной функции костного мозга и развитие анемии, тромбоцитопении и лейкопении;
- патологические переломы позвонков, вызывающие паралич нижних конечностей;
- выраженные боли, особенно сильные при метастазировании в кости;
- артериальный тромбоз с развитием острой ишемии и гангрены нижней конечности и ряд других заболеваний.

Выявлены метастазы в кости и позвоночник. Что делать?
При выявлении метастатического поражения костей скелета и позвонков проводится комплексное лечение:
- Противоопухолевая терапия, подавляющая рост опухолевых клеток.
- Лучевая терапия, которая выполняется как для уменьшения болевого синдрома, так и с лечебной целью, вплоть до полного исчезновения одиночных метастазов.
- Радиоизотопное лечение метастазов в кости (с паллиативной целью) для уменьшения боли или с лечебной целью.
- Хирургическое лечение метастазов в кости для предупреждения и лечения переломов.
- Лекарственная терапия костной ткани.
- Эмболизация артерий позвоночника в качестве паллиативной операции, чтобы уменьшить боль и замедлить рост опухоли.
- Радиочастотная аблация (удаление) метастазов в костях и позвоночнике.
- Эпидуральные инъекции при болевых синдромах в позвоночнике, установка помпы.
Лучевая терапия при метастазах в кости скелета в стандартной дозе 15—20 Гр у половины больных приводит к полному исчезновению боли, а при увеличении дозы излучения до 30—40 Гр значительное улучшение состояния наступает у 80—90% пациентов уже в течение первых 2-3 недель.
Лечение метастазов в кости проводится также с помощью радиофармпрепаратов стронция 89Sr и самария 153Sm. Внутривенное введение стронция 89Sr, обладающего высоким сродством к костной ткани, позволяет дать высокую лучевую нагрузку только на костные ткани. Около 10–20 % больных отмечают полное исчезновение боли и примерно 50—60% сообщают о значительном уменьшении выраженности симптомов.
Хирургическое лечение метастазов в кости может проводиться несколькими способами. При наличии значительного количества костного вещества в области патологического перелома длинную трубчатую кость можно стабилизировать с помощью внутрикостного стержня или штифта. Выраженный лизис костного вещества может потребовать укрепления путём заполнения интрамедуллярного канала и кортикальных дефектов трубчатых костей метил-метакрилатным цементом.
При патологических переломах тел позвонков, если ожидаемая продолжительность жизни пациента превышает 3 месяца, проводят открытые или минимально инвазивные операции, например, кифопластику и вертебропластику, которые значительно уменьшают боль и снижают риск компрессии спинного мозга и спинальных нервов.
Лекарственное лечение метастатического поражения костей проводится с помощью бисфосфонатов (Этиндронат, Бонефос, Бондронат, Аредия, Зомета). Препараты этой группы действуют непосредственно на костную ткань и блокируют действие опухолевых клеток на остеокласты, что прекращает разрушение костей остеокластами, уменьшает болевой синдром, предотвращает возникновение патологических переломов, снижает риск развития гиперкальциемии.
Онкология не стоит на месте, и наши возможности в лечении рака постоянно расширяются. В клиниках «Евроонко» применяются наиболее современные препараты для лечения онкологических заболеваний, зарегистрированные в России. Это позволяет нам существенно продлевать жизнь онкологических больных и улучшать её качество даже на последней стадии. Узнайте больше – позвоните и запишитесь на консультацию к нашим онкологам.
Метастазы Печени: Лечение, Продолжительность Жизни, Специалисты
Безусловно, наиболее распространенными злокачественными новообразованиями в печени являются метастазы. Это раковые поражения, образующиеся из отдаленных опухолей.
Это раковые поражения, образующиеся из отдаленных опухолей.
Чаще всего в печень метастазируют следующие опухоли (в порядке убывания):
Метастазы в печени называются злокачественными вторичными опухолями, поскольку они удалены от первичных опухолей. Опухоли, которые происходят непосредственно из клеток печени, являются первичными опухолями печени, например, рак печени (гепатоцеллюлярная карцинома). Рассеяние опухолевых клеток происходит частично через кровоток (гематогенное рассеяние), частично через лимфатическую систему (лимфогенное рассеяние).
Опухоли органов пищеварения, такие как рак толстой кишки, желудка или поджелудочной железы, в основном распространяются гематогенно (через кровоток) через воротную вену в печень, главный орган, отвечающий за обмен веществ. При постановке диагноза метастазы в печени обычно уже множественные. Количество, внешний вид, размер и положение опухолевых образований имеют решающее значение, прежде всего, для планирования дальнейшего лечения.
Лечение опухолей печени обычно проводится междисциплинарной командой специалистов. К ним относятся абдоминальные хирурги (висцеральные хирурги), специализирующиеся на хирургии печени, радиологи , онкологи и патологи.
Злокачественные новообразования печени, как правило, подвергают хирургии печени с полным удалением опухолевой ткани. Зачастую, особенно при метастазах, что связано с запущенной стадией болезни, операция уже не вполне возможна. Но существуют различные терапевтические подходы, которые можно использовать для улучшения качества и продолжительности жизни пациента.
Особенно при метастазах прежде чем проводить хирургическое удаление, следует убедиться, что первичная опухоль, например, рак толстой кишки, вылечена и в организме нет других метастазов.
При метастазах в печени, например, при колоректальном раке (рак толстой кишки), у пациентов, у которых нет других проблем со здоровьем, может быть предпринята попытка хирургического удаления даже большого количества метастазов. Поскольку печень обладает очень быстрой способностью к регенерации, такое удаление опухолевых образований может быть выполнено в несколько этапов в случае сильного поражения органа (стадия резекции).
Поскольку печень обладает очень быстрой способностью к регенерации, такое удаление опухолевых образований может быть выполнено в несколько этапов в случае сильного поражения органа (стадия резекции).
Если метастазы не могут быть полностью удалены в первую очередь из-за их большого количества или размера, можно восстановить резектабельность (полное удаление опухоли) с помощью химиотерапии или частичного удаления. Химиотерапия, которая проводится перед удалением опухоли, чтобы уменьшить новообразование, сделать его более операбельным, называется «неоадъювантной химиотерапией».
Метастазы, которые не удаляются хирургическим путем, обычно подвергают паллиативной химиотерапии (не лечит). Кроме того, существуют методы термоабляции, такие как радиочастотная абляция (РЧА) , при которой локальное повышение тепла уменьшает новообразования.
При так называемой «трансартериальной химиоэмболизации» (TACE) химиотерапевтическое средство вводится непосредственно в опухолевую ткань через катетерную систему в кровеносных сосудах. Это позволяет получить максимальное прямое действие с минимальными побочными эффектами для окружающих тканей и пациента.
Это позволяет получить максимальное прямое действие с минимальными побочными эффектами для окружающих тканей и пациента.
Другим методом лечения, которое непосредственно воздействует на печень через катетер является селективная внутренняя лучевая терапия (SIRT). В этом случае радиоактивные частицы специально вводят в опухолевую ткань, чтобы действовать как можно более локально с наименьшим сопутствующим ущербом.
Современным методом уменьшения метастазов в печени является HIFU-терапия (фокусированный ультразвук высокой интенсивности). При таком методе опухолевые клетки нагреваются так сильно, что они «спекаются» и опухоль сжимается. Этот процесс все еще находится в состоянии развития, но многочисленные исследования показали, что терапия HIFU является успешным вариантом лечения с небольшим количеством побочных эффектов.
Согласно современному уровню знаний, особенно многообещающими являются концепции мультимодальной терапии, в которых хирургия печени, химиотерапия и тепловая терапия используются в сочетании.
Без хирургического удаления средний срок жизни при постановке диагноза зависит от первичной опухоли (источника метастазирования) и составляет около 4–8 месяцев. При полном хирургическом удалении метастазов в печени при раке толстой кишки, статистика показывает, что 5-летняя выживаемость достигается у 45 %, т.е. через 5 лет после операции живы 45 % онкологических больных.
Источники :
- Внутренняя медицина, Герд Герольд и сотрудники, 2014 (Innere Medizin, Gerd Herold und Mitarbeiter, 2014)
- Хирургия, Зиверт/Штайн, 9-е издание, Springer Verlag (Chirurgie, Siewert/Stein, 9. Auflage, Springer Verlag)
Лечится ли рак 4 стадии?
Злокачественные образования проходят 4 этапа развития. Четвертая стадия является заключительной. На этом этапе образование захватывает весь организм, распространяясь не только на окружающие, но и на далекие органы.
Для последней стадии характерно:
- Метастазирование по крови.
 Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам.
Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам. - Образование отдаленных очагов в других органах. Изначально рак поражает только ткани, в которых образуется, постепенно захватывая окружающие участки. На последней стадии он дает дочерние опухоли в разных органах.
В зависимости от типа опухоли до развития четвертой стадии может пройти от нескольких недель (меланома), до нескольких лет (рак желудка, периферический НМРЛ).
Симптомы и изменения в организме на 4 стадии
Рак диагностируется на последней стадии в 45% случаев. Причина в том, что некоторые опухоли совсем не дают о себе знать (мезотелиома, меланома, рак щитовидки). Они не вызывают болезненности, а незначительные изменения не привлекают внимания пациента. Поэтому имеет место позднее обращение.
В этом случае о развитии онкологического процесса дают знать именно метастазы, которые чаще всего развиваются в печени, легких и костях. Они болезненны и вызывают яркую симптоматику. Метастазы в печени дают желтуху и увеличение размеров живота. Легочные – одышку, а костные – сильные боли и частые переломы.
Однако в большинстве случаев опухоли обнаруживаются раньше.
К четвертой стадии больной страдает от:
- сильной интоксикации;
- повышений температуры тела;
- чрезмерной слабости, потливости;
- тошноты и рвоты;
- сильного похудения.
Наблюдаются нарушения в анализах крови: чрезмерное повышение лейкоцитов, анемия, большой уровень кальция.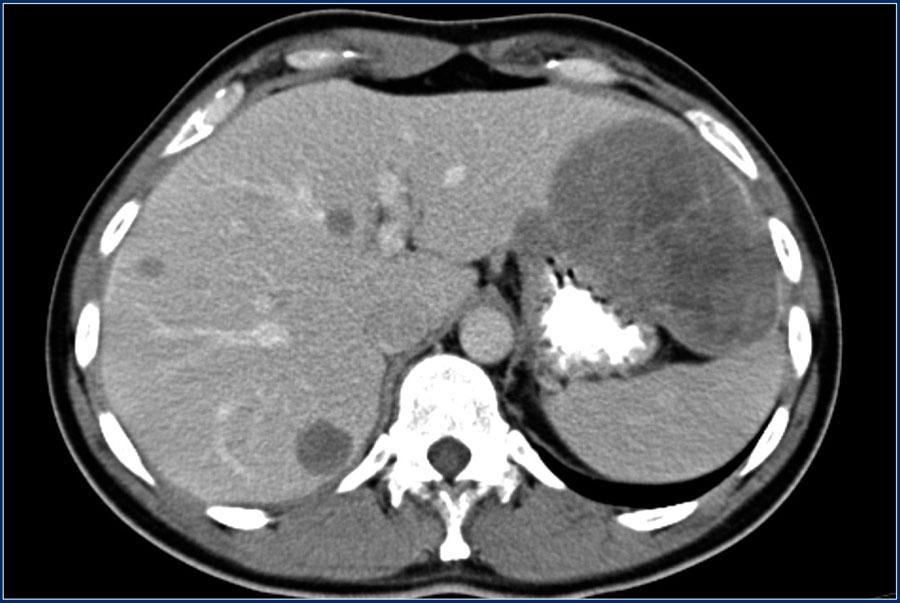
Разросшиеся образования могут препятствовать нормальному току крови, оттоку мочи, выходу кала. Могут развиться свищи в соседние полости, граничащие с пораженным органом. Как правило на этом этапе рак уже пророс во все окружающие структуры. Поэтому начинается гниение и разложение. Больного преследуют сильные боли, гнилостный запах, разнообразные нарушения в работе организма.
Конкретные симптомы очень отличаются в зависимости от размера и вида опухоли. При раке мозга наблюдаются головные боли, потери сознания, эпилептические приступы, а при раке прямой кишки – недержание кала и кровь в испражнениях.
Диагностика и классификация
При подозрении на рак всегда проводятся обследования на наличие метастазов, что и позволяет окончательно определить стадию процесса.
Для этого проводят:
- Проверку крови на наличие онкомаркеров.
 В зависимости от распространенности опухоли их количество бывает разным.
В зависимости от распространенности опухоли их количество бывает разным. - ПЭТ. Позитронно-эмиссионная томография позволяет визуализировать опухоли в любом месте организма.
- Рентген. С его помощью можно обнаружить метастазы в костях.
- УЗИ. Покажет образования в органах и мягких тканях.
Для подтверждения метастатической природы опухолей могут брать биопсию для сравнения вида клеток с первичным образованием.
Обозначается стадия, исходя из общепринятой международной классификации, которая сокращается аббревиатурой TNM, где Т показывает размер опухоли, N – число пораженных лимфатических узлов и М – наличие отдаленных дочерних опухолей.
На четвертом этапе показатели Т и N не имеют значения. Исходная опухоль может быть меньше сантиметра и совсем не затронуть лимфоузлы. Образование отнесут к заключительной стадии, как только возле буквы М будет стоять цифра от 1 и более. Однако к 4 этапу все же большинство опухолей больше 6 сантиметров и затрагивает как близлежащие, так и отдаленные регионарные лимфоузлы.
Однако к 4 этапу все же большинство опухолей больше 6 сантиметров и затрагивает как близлежащие, так и отдаленные регионарные лимфоузлы.
Каким путем была определена стадия образования, указывает буква С. К ней добавляют цифровое обозначение:
- Установлена путем стандартного обследования – визуального осмотра (например, при образованиях половых органов, кожи, полости рта), эндоскопии или рентгена.
- Были применены специальные методы исследования (КТ, МРТ, биопсия).
- Болезнь определена в ходе диагностической операции с взятием на исследование зараженных тканей.
- Диагноз поставлен после полноценной операции.
Диагноз, поставленный путем С1, не считается достаточно достоверным и может быть оспорен. Наиболее надежное определение стадии происходит во время операций.
Лечение
Прогноз на четвертой стадии неутешителен. Большинство больных неоперабельны и им предлагается только паллиативное лечение. Многие погибают в первый год после постановки диагноза.
Многие погибают в первый год после постановки диагноза.
Даже проведенная операция ненамного продлевает жизнь. Удаление образования возможно либо частично, либо вмешательство настолько масштабно, что дает серьезные осложнения.
Для лечения и облегчения состояния используются химиотерапия и облучение. Они помогают уменьшить размер образования, убрать метастазы и замедлить рост опухоли. Однако полностью уничтожить рак удается редко. Часто организм больного очень ослаблен, а борьба с распространенной опухолью требует высоких доз радиации и цитотоксических препаратов, что дает множество осложнений. Для части пациентов они являются губительными.
Предлагают сейчас и современные более эффективные и менее инвазивные методы.
- Таргетную терапию – нацеленное воздействие на клетки опухоли химиопрепаратами.
- Химиоэмболизацию – прекращение кровоснабжения опухоли.
- Протонную терапию – это высокоточное лучевое лечение. Метод является щадящим и может применяться для неоперабельных больных и людей, имеющих различные сопутствующие заболевания (сахарный диабет).
- Стереотаксическую радиочастотную электрохирургию – ее применение дает полный регресс дочерних образований у 26% пациентов благодаря использованию высоких доз, точному попаданию в область опухоли и метастазов.
Любые методы лечения в основном помогают убрать мучительные симптомы и продлить жизнь на 1-3 года. Выздоравливает небольшой процент больных. Дольше пяти лет живет 5-35% пациентов (в зависимости от пораженного органа).
Примечание!
Информация, размещенная в этом материале, предоставляется в ознакомительных целях. Установление показаний к лечению и назначение противоопухолевых препаратов может делать исключительно лечащий врач. Обязательно проконсультируйтесь с врачом!
Установление показаний к лечению и назначение противоопухолевых препаратов может делать исключительно лечащий врач. Обязательно проконсультируйтесь с врачом!
Автор: Оксана Спивакова, врач рентгенолог, менеджер направления «Онкология», Центр персонализированной фармации «Хемотека»
Новые эффективные методы лечения рака (онкологии) на 4-й стадии
В настоящее время, в связи со сложностями, связанными с организацией лечения в Турции, Швейцарии, Южной Корее и Индии, мы приостановили обработку заявок по этим направлениям.
Если вас интересует организация лечения в Германии, оставьте, пожалуйста, заявку, и наши специалисты свяжутся с вами в ближайшее время.
По официальной статистике ВОЗ в 2020 году онкологическая патология стала причиной каждой 6й смерти в мировом масштабе. Это стимулирует международное врачебное сообщество разрабатывать новые методики лечения рака и повышать эффективность уже существующих. В частности, это касается пациентов с поздними стадиями заболевания, когда за счет метастазирования опухоли поражается практически весь организм.
Это стимулирует международное врачебное сообщество разрабатывать новые методики лечения рака и повышать эффективность уже существующих. В частности, это касается пациентов с поздними стадиями заболевания, когда за счет метастазирования опухоли поражается практически весь организм.
Так, в 2018 году Нобелевской премией по медицине было отмечено исследование работы иммунной системы у пациентов со злокачественными новообразованиями. Активация собственного иммунитета пациента и обучение его иммунных клеток распознаванию опухоли – основа безопасной для здоровых тканей терапии, которая может применяться даже на поздних стадиях болезни. Это возможно при персонализированном лечении, адаптированном к особенностям протекания болезни у конкретного пациента.
Содержание
- Принципы лечения рака четвертой стадии в классической медицине
- Недостатки и ограничения классической терапии онкологических заболеваний на 4 стадии
- Принципы лечения рака последней стадии иммунологическими методами (иммунотерапия)
- Лечебная гипертермия при лечении рака
- Инфузионная терапия для активации иммунной системы
- Химиоэмболизация при лечении рака 4 стадии
- Лечение поздних стадий онкологических заболеваний в специализированных европейских клиниках
- Показания к комплексной терапии лечения рака 4-й стадии
- Организация лечения за рубежом для международных пациентов
Принципы лечения рака четвертой стадии в классической медицине
Классическая медицина предлагает ряд возможностей, которые воздействуют на злокачественное новообразование напрямую или через модификацию микроокружения опухоли:
- Хирургическое лечение – включает полное или частичное удаление опухоли, а также забор ее ткани для гистологического исследования.
 На поздних стадиях рака операции проводятся редко, поскольку полностью удалить все метастазы и крупную, проросшую в соседние органы опухоль невозможно.
На поздних стадиях рака операции проводятся редко, поскольку полностью удалить все метастазы и крупную, проросшую в соседние органы опухоль невозможно. - Лучевая терапия – выполняется для уменьшения злокачественного новообразования в размерах или профилактики рецидива после операции. В современных клиниках также проводится стереотаксическая лучевая терапия при помощи системы Гамма нож или Кибернож. Это прицельное удаление опухоли, не требующее хирургического вмешательства – направленный поток ионизирующего излучения достигает опухоли через интактную кожу.
- Химиотерапия – включает назначение препаратов, блокирующих размножение раковых клеток. К сожалению, помимо этого химиотерапевтические препараты воздействуют также и на здоровые ткани.
- Симптоматическое лечение – включает обезболивающую терапию, противорвотные препараты, богатое протеинами или парентеральное питание. Симптоматическое лечение не устраняет причину болезни, но до определенного предела повышает качество жизни пациента.

В зависимости от типа опухоли и стадии процесса, методики могут применяться в монотерапии или в комбинации (например, лучевая терапия дополняется симптоматическим лечением, химиотерапия следует за операцией и т.п.).
Недостатки и ограничения классической терапии онкологических заболеваний на 4 стадии
Несмотря на обширный арсенал классических методик и продолжительный практический опыт их применения, классический подход к лечению рака имеет ряд ограничений:
- Травматичность – для обеспечения хирургического доступа к опухоли неизбежно разрушаются здоровые ткани. Это представляет опасность, поскольку процессы регенерации у раковых больных ослаблены, такие пациенты подвержены инфекциям.
- Токсичность – химиопрепараты подавляют базовые процессы клеточного метаболизма, разрушая не только раковые, но и здоровые клетки. Также при химиотерапии в кровоток попадают токсичные продукты распада опухоли, провоцирующие повреждение печени и почек.

- Невозможность полного излечения – на 4-й стадии онкопатологии применяется ограниченный спектр методик лечения. Все из них направлены на сдерживание роста опухоли и продление жизни, но не на полное излечение.
- Подавление иммунной системы пациента – происходит угнетение T-клеточного и B-клеточного звена иммунитета.
- Высокая стоимость – зачастую химиотерапия проводится в течение нескольких месяцев или даже лет. Для пациента, который оплачивает лечение самостоятельно, это становится довольно затратным. Хирургические вмешательства, особенно операции на головном мозге, также сопряжены с высокими расходами.
Учитывая результаты классических схем лечения онкопатологии, ученые разрабатывают новые, более эффективные и менее травматичные для организма терапевтические подходы.
Принципы лечения рака последней стадии иммунологическими методами (иммунотерапия)
Основным принципом данной методики лечения является восстановление собственных защитных сил организма – иммунной системы и неспецифических противоопухолевых механизмов. Это обеспечивает долгосрочный результат терапии и полную элиминацию раковых клеток. В классической медицине опухоль и ее метастазы удаляются искусственно, в то время как альтернативные методики активизируют «внутреннюю защиту», выявляющую даже невидимые для самой точной медицинской аппаратуры метастазы и группы атипичных клеток.
Это обеспечивает долгосрочный результат терапии и полную элиминацию раковых клеток. В классической медицине опухоль и ее метастазы удаляются искусственно, в то время как альтернативные методики активизируют «внутреннюю защиту», выявляющую даже невидимые для самой точной медицинской аппаратуры метастазы и группы атипичных клеток.
Концепция интегративной медицины характеризуется:
- Хорошей переносимостью, минимальными побочными эффектами
- Направленным воздействием на опухолевые очаги без воздействия на здоровые ткани
- Возможностью применения у пациентов в тяжелом состоянии (например, со снижением функции почек или печени, аллергиями)
- Достижением хорошего результата даже на поздних стадиях онкопатологии, при метастазировании в отдаленные от первичной опухоли участки тела
- Активацией противоопухолевого иммунитета пациента, восстановлением способности T и B клеток распознавать и уничтожать атипичные клетки опухоли
- Стойким результатом без необходимости постоянного проведения повторных курсов лечения
В ведущих европейских онкологических центрах практикуется комплексный подход к терапии поздних стадий рака. Интегративный подход включает потенциально полезные для пациента методики классической медицины (например, хирургическое удаление части опухоли) и дополняет их альтернативными методами. Доказано, что индивидуальная концепция комплексного лечения дает наилучший клинический результат.
Интегративный подход включает потенциально полезные для пациента методики классической медицины (например, хирургическое удаление части опухоли) и дополняет их альтернативными методами. Доказано, что индивидуальная концепция комплексного лечения дает наилучший клинический результат.
Отправить запрос на лечение
Лечебная гипертермия при лечении рака
Гипертермия – это нагревание части тела, анатомической области или всего тела до эффективной температуры в 38-42°С. В быстро растущих злокачественных новообразованиях не успевают формироваться нормальные сосуды и капиллярная сеть, поэтому при повышении температуры тела кровоток в них снижается практически до нуля. Без адекватного кровоснабжения опухоль и метастазы не получают необходимые питательные вещества и быстро разрушаются под воздействием собственных токсических продуктов обмена. В ходе процедуры чередуются периоды нагревания и охлаждения тела, поэтому она хорошо переносится пациентами.
Одним из инновационных видов термотерапии является лазерно-индуцированная интерстициальная термотерапия (LITT). Процедура выполняется при помощи специализированного оборудования – Nd:YAG-лазера, который состоит из лазерного кристалла иттрий-алюминиевого граната, легированного неодимом. При помощи миниатюрного стекловолоконного аппликатора доктор подает лазерное излучение непосредственно на опухоль. В процессе лечения температура в целевой области достигает 60-110°C, что приводит к разрушению опухоли.
Процедура LITT успешно применяется при неоперабельных опухолях печени, почек, легких, молочной железы, простаты и других органов. Также LITT позволяет прицельно и бережно разрушить метастазы в паренхиматозных органах и лимфатических узлах. Данная процедура является лечением выбора у пациентов с метастазами в печени и легких, которые могут не перенести операцию.
Инфузионная терапия для активации иммунной системы
Инфузионная терапия включает введение ряда веществ:
- Регенерезен – группа инъекционных препаратов, которые восстанавливают нарушенный за счет формирования опухоли биосинтез белка.
 Высокая избирательность РНК в составе препарата позволяет ему прицельно действовать на пораженные раком органы.
Высокая избирательность РНК в составе препарата позволяет ему прицельно действовать на пораженные раком органы. - Артесунат – натуральный препарат на основе компонента полыни (артемизина), создание которого было отмечено Нобелевской премией в 2015 году. Под действием препарата разрушаются раковые клетки и питающие опухоль кровеносные сосуды.
- Куркумин – натуральный растительный пигмент, который вызывает апоптоз опухолевых клеток и ингибирует метастазирование опухоли. Отчеты о клинических исследованиях куркумина в лечении рака были опубликованы в журналах Clinical Gastroenterology Hepatology и Molecules, а также на австралийском сайте Science Network.
- GcMAF – модифицированный белок человека, участвующий в активации макрофагов – клеток иммунной системы, отвечающих за распознавание и разрушение атипичных раковых клеток.
- Гиперицин – красный растительный пигмент, который является эффективным натуральным фотосенсибилизатором.
 Гиперицин применяется при фотодинамической терапии рака – разрушении предварительно обработанных атипичных клеток при помощи лазерного излучения.
Гиперицин применяется при фотодинамической терапии рака – разрушении предварительно обработанных атипичных клеток при помощи лазерного излучения.
В зависимости от типа злокачественного образования и результатов гистологической диагностики, могут применяться и другие, более редкие и специализированные методики.
Химиоэмболизация при лечении рака 4 стадии
Трансартериальная химиоэмболизация (TACE) – это локальное воздействие на опухоль высокими дозировками химиопрепаратов. Эмболизация успешно применяется в лечении опухолей с активным кровоснабжением, например, рака печени или молочной железы, колоректальных новообразований. В отличие от классической системной химиотерапии, химиоэмболизация:
- Оказывает прицельное воздействие на опухоль и является менее токсичной для окружающих здоровых тканей.
- Обеспечивает более высокую концентрацию химиопрепарата в целевой области.
- Имеет более продолжительное действие, поскольку ток крови по артериям блокируется, и медикаменты не поступают в системный кровоток.

- Стимулирует некроз и распад опухоли за счет блокировки кровоснабжения и лишения опухоли необходимых для жизнедеятельности питательных веществ.
Ввиду отличной переносимости, TACE проводится в амбулаторном режиме и требует лишь непродолжительного пребывания в стационаре. На этапе подготовки проводится ангиография – это рентгеноконтрастное исследование, позволяющее доктору отчетливо визуализировать сосуды опухоли. В ведущих онкологических клиниках используются исключительно ангиографы с высокой точностью изображений, поскольку важно выявить все источники кровоснабжения. Также обязательно учитываются данные КТ, МРТ и ПЭТ-КТ.
В ходе процедуры в бедренную артерию вводится тонкий катетер, который продвигается по кровеносным сосудам и достигает целевой области (например, печеночной артерии). После этого в опухоль вводится химиопрепарат, а артерия «закупоривается» при помощи эмбола. Также используются микросферы с лекарственным покрытием (DEM), например, микросферы LifePearl или HepaSphere.
После завершения TACE катетер извлекается, а на бедренную артерию на 3 часа накладывается давящая повязка. Первые несколько часов пациенту следует соблюдать постельный режим, после чего он может вернуться к обычному образу жизни. На следующий день после вмешательства проводится контрольная КТ для оценки эффективности лечения. При необходимости TACE повторяется несколько раз, для полной блокировки самых мелких сосудов опухоли.
Ориентировочная стоимость химиоэмболизации при разных заболеваниях:
Лечение поздних стадий онкологических заболеваний в специализированных европейских клиниках
Лишь ограниченное число специализированных онкологических центров может предложить пациентам с 4-й стадией онкопатологии медицинское оборудование и услуги квалифицированных специалистов для проведения альтернативной терапии. Наиболее значимые результаты в этой сфере демонстрирует Клиника расширенной биологической медицины, Франкфурт-на-Майне и ее руководитель – доктор медицины Герхард Зибенхюнер. В свою очередь Отделение взрослой и детской диагностической, интервенционной радиологии при Университетской клинике им. Гёте, Франкфурт-на-Майне, лидирует в области проведения LITT и TACE.
Эффективная комплексная схема лечения поздних стадий рака состоит из нескольких этапов: иммунной терапии у доктора Г. Зибенхюнера и трансартериальной химиоэмболизации у профессора, доктора медицины Т.Фогеля (руководителя Отделения взрослой и детской диагностической, интервенционной радиологии при Университетской клинике им. Гёте). Для обеспечения максимальной эффективности, терапевтические методики применяются в такой последовательности:
- Консультация и иммунная терапия у доктора Г.Зибенхюнера, продолжительность курса – 5 дней
- Консультация с профессором Фогелем, планирование процедуры TACE
- Контрольная МРТ и определение объема химиоэмболизации
- Проведение процедуры TACE (до 25 минут на одну область)
- Наблюдение в условиях стационара в течение 3 часов, контрольная КТ
- Повторный осмотр профессора Фогеля, после чего пациент может покинуть клинику
- После восстановления в течение 1 дня процедура TACE повторяется в другой области (при необходимости)
В среднем рекомендуется проводить 3 курса эмболизации с промежутком 4-5 недель. Схема терапии обязательно адаптируется к клиническому состоянию пациента и корректируется в соответствии с его изменениями.
Отправить запрос на лечение
Показания к комплексной терапии лечения рака 4-й стадии
Данный подход хорошо зарекомендовал себя при следующих заболеваниях:
Организация лечения за рубежом для международных пациентов
Пройти комплексное лечение рака 4-й стадии в Германии могут как граждане страны, так и международные пациенты. Если вы впервые обращаетесь за медицинской помощью в зарубежную клинику, то будет безопаснее и эффективнее поручить организацию лечения Booking Health. Booking Health – это сертифицированный оператор медицинского туризма, который помогает пройти лечение за рубежом пациентам из 75 стран.
Принимая во внимание все тонкости оказания помощи пациентам с 4-й стадией онкопатологии, специалисты Booking Health помогут вам в таких важных моментах:
- Подтверждение корректности выбора клиники и прямая коммуникация с лечащим врачом
- Предварительная подготовка программы лечения без повторения ранее проведенных обследований
- Обеспечение выгодной стоимости услуг клиники, без надбавок и коэффициентов для иностранных пациентов (экономия до 50%)
- Запись на прием на нужную дату
- Контроль медицинской программы на всех этапах
- Помощь в приобретении и пересылке медикаментов
- Коммуникация с клиникой после завершения лечения
- Контроль счетов и возврат неизрасходованных средств
- Организация дополнительных обследований
- Сервис высочайшего уровня: бронирование отелей, билетов на самолет, трансфера, организация услуг переводчика
Для того чтобы получить профессиональную помощь в планировании лечения за рубежом, оставьте запрос на официальном сайте Booking Health. Компетентный врач-консультант обсудит с вами все медицинские детали и поможет грамотно подготовиться к перелету на лечение.
Выбирайте лечение за рубежом и Вы, несомненно, получите отличный результат!
Авторы: Доктор Надежда Иванисова, Доктор Вадим Жилюк
Источники:
National Center for Biotechnology Information
National Library of Medicine
National Cancer Institute
American Cancer Society
Читайте:
Почему Booking Health – Вопросы и ответы
Как не ошибиться в выборе клиники и специалиста
7 причин доверять рейтингу клиник на сайте Booking Health
Booking Health – Стандарты качества
Отправить запрос на лечение
1, 2, 3 и 4 стадия
Заведующая онкологическим отделением в клинике Ихилов.
Онколог с 20-летним стажем.
Задать вопрос
Содержание
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
Наиболее вероятный исход заболевания зависит от степени распространенности рака на момент постановки диагноза. Ниже приведены общие статистические данные, основанные на наблюдениях за большими группами пациентов. Они ни в коем случае не определяют исход борьбы с раком в ваших индивидуальных обстоятельствах.
Никто не может с точностью определить, сколько вам осталось жить с раком печени. Все зависит от конкретной ситуации и лечения. Одинаковых пациентов не существует, и организм каждого человека по-своему реагирует на один и тот же метод лечения.
Ваш врач может рассказать вам подробнее о вашем персональном прогнозе.
Выживаемость при раке печени по стадиям
Нижеприведенные цифры опубликованы в Европейских методических рекомендациях по клинической практике в лечении рака печени. В этой системе оценки выживаемости учитывается размер и локализация злокачественной опухоли, а также функция печени и общее состояние здоровья пациента.
Для каждой стадии вычисляются следующие статистические показатели:
- средняя выживаемость – длительность периода от постановки диагноза до момента, когда половина пациентов все еще живы;
- 5-летняя выживаемость – число людей, проживших 5 и более лет после постановки диагноза.
Стадия 0
В отсутствие лечения средняя выживаемость при раке печени этой стадии составляет более 3 лет.
При условии лечения от 70 до 90 из 100 пациентов (между 70 и 90%) живут 5 лет и более.
Лечение рака печени 0 стадии подразумевает пересадку органа, абляцию (процедуру уничтожения опухоли) или хирургическую операцию по удалению злокачественных тканей.
Стадия A
В отсутствие лечения средняя выживаемость при раке печени стадии A составляет 3 года.
При условии лечения от 50 до 70 из 100 пациентов (от 50 до 70%) живут 5 лет и более.
Лечение рака печени стадии A подразумевает трансплантацию органа, абляцию (процедуру уничтожения патологического новообразования) или хирургическую операцию по удалению злокачественных тканей.
Уточнить цену у специалиста
Стадия B
В отсутствие лечения средняя выживаемость при раке печени стадии B составляет 16 месяцев.
При условии лечения средняя выживаемость при раке печени стадии B составляет 20 месяцев.
В целях лечения рака печени стадии B врач может назначить введение химиотерапевтических препаратов в печень через крупную артерию в верхней части вашей ноги (трансартериальная химиоэмболизация).
Стадия C
В отсутствие лечения средняя выживаемость при раке печени стадии C составляет от 4 до 8 месяцев.
При условии лечения средняя выживаемость при раке печени стадии C составляет от 6 до 11 месяцев.
В целях лечения рака печени стадии C вам, скорее всего, назначат препарат сорафениб. Врач также может предложить вам участие в клиническом испытании.
Стадия D
В отсутствие лечения средняя выживаемость при раке печени стадии D составляет менее 4 месяцев.
Эффективных методов терапии рака печени стадии D не существует. Тем не менее ваши врачи и медсестры продолжат лечить любые возникающие у вас симптомы заболевания.
Выживаемость в отношении всех стадий рака печени
Что касается взрослых пациентов с раком печени:
- почти 35 из 100 человек (почти 35%) проживут 1 год или более после постановки диагноза;
- свыше 10 из 100 человек (свыше 10%) проживут 5 лет и более после постановки диагноза.
Обратите внимание: эти цифры относятся только к первичному раку печени у взрослых. Первичный рак печени у детей встречается крайне редко, и прогноз таких пациентов благоприятнее, чем прогноз взрослых.
Какие факторы влияют на выживаемость?
На прогноз в первую очередь влияет доступная методика лечения. Она зависит от стадии рака при постановке диагноза, то есть от размера опухоли и факта ее распространения.
Назначения врача также будут зависеть от состояния здоровой ткани органа.
Кроме того, на выживаемость влияет общее состояние вашего здоровья.
Как качество препаратов влияет на излечение от рака печени
Клинические испытания доказали, что при раке печени эффективна таргетная терапия: препараты бевацизумаб, сунитиниб, ингибиторы MTOR, ингибиторы EGFR. При этом важное значение имеет высокое качество данных препаратов. В Израиле вы сможете приобрести все эти лекарства с гарантированным качеством.
- Подделка лекарств в Израиле исключена. Подлинность всех медикаментов в этой стране строго контролируется Минздравом. Аптека и фармацевт, продавший пациенту препарат, несут ответственность (вплють до уголовной) за его качество.
- В Израиле лицензирование новых препаратов проходит быстрее, чем в большинстве стран мира. Например, для внедрения таргетных препаратов, которые применяются при раке печени, здесь не нужна длительная бюрократическая процедура.
- Главный производитель лекарств в Израиле – всемирно известный фармацевтический гигант TEVA. Препараты, произведенные в этой компании, выписывают в 60 странах мира.
Где приобрести лекарства?
- В Израиле. Пройдя обследование в онкоцентре Ихилов, вы получите рецепты на необходимые препараты и сможете купить их в израильской аптеке.
- В любом населенном пункте любой страны мира. Воспользовавшись услугой телемедицины, вы получите дистанционную консультацию израильского специалиста. В этом случае вы сможете заказать на дом выписанные вам израильские лекарства.
5 советов израильского онколога по лечению рака печени
- Убедитесь, что вам правильно поставлен диагноз. Примерно в 32% случаев врачи онкоцентра Ихилов не подтверждают диагноз «рак печени» у пациентов с постсоветского пространства. Чтобы израильские специалисты могли проверить правильность диагноза, возьмите с собой на обследование блоки и стекла с материалами выполненной вами биопсии.
- Узнайте, показана ли вам таргетная терапия. Это касается прежде всего больных с продвинутыми стадиями гепатоцеллюлярного рака. Израильский специалист на очной или дистанционной консультации расскажет вам об инновационных таргетных препаратах, которые могут помочь в вашем случае. В последние 5-10 лет новые препараты для лечения рака печени внедряются в Израиле почти ежегодно.
- Поинтересуйтесь, можно ли в вашем случае заменить открытую операцию малоинвазивной процедурой. В Израиле при некоторых видах первичных или метастатических опухолях печени выполняется радиочастотная абляция (РЧА). Опухоли уничтожаются без разрезов – через проколы кожи живота.
- Выясните, какие инновационные методы лечения рака печени применяются в клинике, где вы лечитесь. Например, в онкоцентре Ихилов имеется уникальная возможность пройти селективную внутреннюю радиотерапию (SIRT) – малоинвазивную процедуру, при которой для разрушения опухоли используются гранулы с радиоактивным материалом.
- Получите «второе мнение» профессора с мировым именем по поводу прогноза и лечения вашего заболевания. В онкоцентре Ихилов вы сможете проконсультироваться с авторитетным специалистом как очно, так и дистанционно.
Узнать правильно ли назначено лечение
История Марины из Челябинска, пациентки онкоцентра Ихилов
Когда врач проводила ежегодный медицинский осмотр, она задела мою грудину, и мне стало очень больно. Когда пришли результаты анализов крови, оказалось, что у меня повышен билирубин. Тем не менее прошло еще, наверно, полтора месяца, прежде чем мне поставили окончательный диагноз. Узнав, что у меня злокачественная опухоль печени (холангиокарцинома), я решила пройти лечение в Израиле, в онкоцентре Ихилов.
Израильские врачи подтвердили диагноз: у меня оказалась 1-я стадия рака. Они провели мне резекцию – удаление части печени с опухолью. Лечение длилось 6 месяцев, затем началась ремиссия, которая продолжается уже 14 месяцев. Врачи говорят, что у меня хорошие шансы на полное излечение, т.к. операция была проведена вовремя.
Меня приятно поразило отношение персонала к пациентам. Все понимали, что мне страшно, и оказывали поддержку и заботу. Я знала, что в этом учреждении я в полной безопасности.
Почему стоит пройти лечение рака печени в Израиле, в онкоцентре Ихилов?
- Точный диагноз. Диагностика рака печени очень сложна. У израильских врачей есть большой опыт раннего обнаружения этого вида опухолей. Для выявления метастазов в печени израильские специалисты используют ПЭТ-КТ – современный метод визуализации, позволяющий увидеть все очаги рака.
- Врачи с мировым именем и персонализированный подход. В онкоцентре Ихилов лечение рака печени проводит мультидисциплинарная команда специалистов, в которую входят онколог с 40-летним стажем – профессор Моше Инбар, гепатолог – профессор Орен Шиболет и другие известные врачи. Они разрабатывают индивидуальную стратегию лечения для каждого пациента.
- Новейшее оборудование. Для диагностики и лечения рака печени в онкоцентре Ихилов применяется современное оборудование, в том числе прибор для оценки фиброза печени Фиброскан, томографы ПЭТ-КТ и т.п.
Стоимость диагностики и лечения рака печени в Израиле
Для вашего удобства приведем официально утвержденные расценки на диагностику и лечение рака печени в израильском онкоцентре Ихилов. Все цены приводятся в долларах.
| Процедуры лечения рака печени | Стоимость |
|---|---|
| Абляция опухоли печени | $7043 |
| Биопсия печени под контролем УЗИ | $4465 |
| Консультация абдоминального хирурга | $562 |
| МРТ органов брюшной полости | $723 |
Первый шаг к выздоровлению вы можете сделать прямо сейчас. Для этого заполните заявку – и в течение 2 часов с вами свяжется один из наших врачей.
Либо позвоните по телефону:+972-3-376-03-58 в Израиле и +7-495-777-6953 в России.
Эта консультация ни к чему вас не обязывает и является совершенно бесплатной. Мы гарантируем вам полную конфиденциальность и сохранение медицинской тайны. Мы поможем вам, как помогли и другим пациентам.
факторов прогноза рака желудка IV стадии
Int Surg. 2013 апрель-июнь; 98 (2): 181–187.
Хироюки Баба
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Коки Кувабара
Отделение хирургии пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ , Сайтама, Япония
Тору Исигуро
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кенсуке Кумамото
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Сайтама Медицинский университет, Кавагоэ, Сайтама, Япония
Йоичи Кумагаи
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кейитиро Ишибаши
Отделение пищеварительной и общей хирургии Сайтамы Медицинский центр, Медицинский университет Сайтамы, Кавагоэ, Сай тама, Япония
Норихиро Хага
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Хидеюки Исида
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Saitama Medical Университет, Кавагоэ, Сайтама, Япония
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Запросы на перепечатку: Хироюки Баба, доктор медицины, доктор философии, Отделение пищеварительного тракта и общей хирургии, Сайтама Медицинский центр, Медицинский университет Сайтамы, 1981 г. Камода, Кавагоэ, Сайтама, 350-8550, Япония.Тел .: +81 49 228 3619; Факс: +81 49 222 8865; Электронная почта: pj.ca.dem-amatias@ababorih Авторские права, 2013 г., Международный колледж хирургов. Эта статья цитируется в других статьях в PMC.Рак желудка является четвертой ведущей причиной рака в мире с частотой около 1 миллиона случаев (7,8% от общего числа). В региональном масштабе половина случаев заболевания в мире приходится на Восточную Азию. Это вторая ведущая причина смерти от рака во всем мире (738 000 смертей, 9,7% от общего числа). 1 Хотя ранняя диагностика и стандартизованные стратегии лечения способствовали увеличению выживаемости, пациенты со стадией IV по-прежнему имеют плохой прогноз.Предыдущие отчеты из Японии и Кореи показали, что 5-летняя выживаемость составляет 15,3% и 18% соответственно. 2,3
Рекомендации, опубликованные Японской ассоциацией рака желудка (JGCA) 4,5 , рекомендуют выбор из 5 методов лечения пациентов на стадии IV в клинической практике: хирургия (расширенная или паллиативная), химиотерапия, лучевая терапия или паллиативная уход. Принципы по-прежнему остаются спорными, и рекомендуется проведение клинических исследований. Характер заболевания не позволяет проводить проспективные исследования; однако ретроспективное исследование играет важную роль посредством клинических исследований.
Это ретроспективное исследование, основанное на клинической практике, направлено на выяснение благоприятных факторов, способствующих лучшему прогнозу пациентов с раком желудка IV стадии. Кроме того, мы стремимся оценить оптимальные стратегии лечения.
Пациенты и методы
В период с апреля 2005 г. по март 2011 г. в Медицинском центре Сайтама было обследовано в общей сложности 123 пациента с патологически подтвержденным раком желудка IV стадии в соответствии с данными, собранными из диаграммы.Клинико-патологическими факторами, оцениваемыми в этом исследовании, были возраст, пол, работоспособность (PS), расположение опухоли, общий вид опухоли, гистологический тип, карциноэмбриональный антиген (CEA), углеводный антиген 19-9 (CA19-9), глубина опухоли (T), метастазы в регионарные лимфатические узлы (N), метастазы в печень (H), перитонеальную диссеминацию (P) и цитологию перитонеального лаважа (CY). Отдаленные метастазы, помимо H, P и CY, относительно редки, за исключением метастазов в лимфатические узлы за пределами региональных узлов [M (LYM)]. Мы отнесли эти редкие факторы M к категории «другие M» и включили их в качестве одной из переменных в это исследование.Удаление первичной опухоли или нет и введение системной химиотерапии или нет также были включены в качестве одной из переменных для статистического анализа.
Процесс определения стадии основан на системе стадирования опухолевого узла-метастаза (TNM), принятой Союзом по борьбе с раком (UICC; 7-е издание, 2010 г.). 6 Чтобы избежать ненужной терминологической путаницы, мы следовали терминологии, определенной в английской версии руководств по диагностике и лечению рака желудка, 7 , опубликованных JGCA.PS оценивался при поступлении у каждого пациента с использованием метода, предложенного Восточной кооперативной онкологической группой (ECOG). 8 Диагноз стадии IV был поставлен на основании предоперационных рентгенологических данных, таких как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ультразвуковое исследование (УЗИ), в противном случае — при лапаротомии или ступенчатой лапароскопии. Цитологическое исследование перитонеального лаважа (CY) было выполнено во время лапаротомии, а диагностическая информация была предоставлена из патологического отделения во время операции.Патологические отчеты образцов были исследованы сертифицированными патологоанатомами в нашем учреждении.
JGCS определяет пациентов со стадией IV как не имеющих абсолютной стратегии лечения в лечебных рекомендациях. 2 Таким образом, в настоящее время у нас нет конкретного алгоритма лечения пациентов со стадией IV. Однако для принятия решения мы взвешиваем клинические симптомы пациентов. Синдром выхода из желудка (GOS) является наиболее тревожным и раздражающим симптомом для пациентов, и в случае его выявления хирургическое вмешательство, как правило, является нашим первым выбором.В противном случае можно использовать химиотерапию. Если плохой статус пациента является значительным, рассматривается лучший поддерживающий уход. Пациенты могут начать химиотерапию и перейти к операции при появлении GOS или кровотечении. Каким бы ни был порядок лечения, все пациенты в этом ретроспективном исследовании дали письменное информированное согласие, прежде чем начинать что-либо.
Вопрос о том, вводить ли химиотерапию в первую очередь или нет, и наиболее эффективная хирургическая процедура кратко обсуждались с пациентами и членами их семей.Принятие решения основывалось на пожеланиях пациентов и объективном суждении лечащего врача. Попытки провести расширенную операцию в конце концов часто заканчивались удалением первичной опухоли, добиваясь только операции R1. Особенно, когда ожидалось паллиативное хирургическое вмешательство, пациенту было дано достаточное информированное согласие, и операция проводилась на месте. Режим химиотерапии был основан на комбинированном противоопухолевом препарате тегафура, гимерацила и отерацила калия (S-1), производном пиримидина для приема внутрь, который на сегодняшний день является основным средством против рака желудка. 9–11 Комбинация с цисплатином (CDDP) сегодня считается схемой первого выбора. 12 Однако другие агенты использовались на практике ежедневно, такие как иринотекан (СРТ-11) и таксаны (паклитаксел и доцетаксел), и эти пациенты также были включены в исследование. 13–15
Статистический анализ
Статистический анализ проводился между группами с использованием тестов χ 2 или Манна-Уитни U , где это было необходимо.Кривые выживаемости анализировали с использованием метода Каплана-Мейера, а различия определяли с помощью лог-рангового критерия. Для выявления независимых прогностических факторов использовалась многомерная модель пропорциональных рисков Кокса. Для определения независимых прогностических факторов фактор со значением P <0,1 с помощью одномерного анализа был введен в многомерный анализ с прямым пошаговым выбором. Общая выживаемость определялась как период от начального лечения (химиотерапия, операция или наилучшая поддерживающая терапия) до смерти по любой причине.Тесты считались значимыми при значении P <0,05.
Результаты
Демографические и клинико-патологические характеристики представлены в. Был 91 мужчина и 32 женщины, средний возраст 69 лет (диапазон 26–88). В совокупности PS 0 и 1 насчитали 102 пациента (82,9%). Число пациентов, у которых опухоль локализовалась в проксимальном отделе желудка, составило 55 (44,7%). У 68 пациентов (55,3%) опухоль была локализована в дистальной части желудка. Общий вид опухоли варьировал от типа 0 по Борману до 5 типа, насчитывая 1, 6, 18, 57, 33 и 18 соответственно.Все опухоли были патологически диагностированы как аденокарцинома. Тридцать пять (28,5%) из них относились к тубулярному типу, а 88 (71,5%) — к нетубулярному типу, что позволяет предположить, что аденокарцинома, которая была потенциально инвазивной по своей природе, была доминирующей на стадии IV. Число пациентов Т4 составило 82 (66,7%), пациентов N3 — 67 (54,5%). Отдаленные метастазы, определяемые с помощью H, P и CY, насчитывали 46 (37,4%), 62 (50,4%) и 39 (45,3%) пациентов соответственно. Число пациентов с CY1 меньше, чем P1, кажется странным, но этот феномен можно объяснить, если понять фактическую цитологию перитонеального лаважа (CY), проводимую после операции.Согласно обзору диаграммы, CY был рутинным для пациентов P0 (n = 61), и среди них 14 были CY1. Остальные пациенты (n = 62) были P1, CY не был рутинной процедурой. Общее количество пациентов с CY составило 86, 25 пациентов были P1 и, естественно, достаточно CY1. Таким образом, сумма 14 пациентов (P0CY1) и 25 пациентов (P1CY1) составила общее количество пациентов с CY1 (n = 39). Если мы рассмотрим всех пациентов P1 как CY1, количество CY1 будет в сумме до 76 вместо 39, причем CY1 будет больше, чем P1. Остальные M насчитали 55 (44.7%) пациентов, и все они были результатом обширного поражения лимфатических узлов, которое можно классифицировать как M (LYM). Медиана CEA и CA19-9 составляла 6,05 нг / мл и 15,5 нг / мл соответственно.
Таблица 1
Клинико-патологические особенности пациентов с раком желудка IV стадии.
показывает блок-схему лечения, проводимого пациентам с IV стадией. Оперативное вмешательство выполнено 78 пациентам. Из них 37 пациентам была проведена редукционная операция, а 41 пациенту — паллиативная операция.Решение о резекции первичной опухоли было поручено хирургической бригаде по лапаротомии. Тринадцать пациентов не получали послеоперационную химиотерапию в основном из-за ухудшения их работоспособности. Другие все-таки хотели получить наилучшую поддерживающую терапию. Тридцать восемь пациентов не подвергались хирургическому вмешательству, получали только химиотерапию или получали наилучшую поддерживающую терапию (n = 7). Химиотерапия проводилась по схеме S-1 (n = 99). Среди них пациенты только с S-1 или в комбинации с CDDP, таксанами и CPT11 были 45, 45, 8 и 1 соответственно ().
Блок-схема 123 пациентов.
Таблица 2
Данные лечения пациентов
Одномерный анализ прогностических факторов общей выживаемости приведен в. Возраст (70 или больше по сравнению с младше 70; P = 0,03), работоспособность (PS2 или больше по сравнению с PS0 или 1; P < 0,01), метастазы в печень (h2 по сравнению с H0; P = 0,02), другие M (положительный результат против отрицательного; P < 0,01), CA19-9 (37 нг / мл или более по сравнению с менее чем 37 нг / мл; P < 0.01), редукционная операция (нерезекция по сравнению с резекцией; P < 0,01), химиотерапия (Нет против Да; P < 0,01) оказались значимыми прогностическими факторами для общей выживаемости. Как также указано в, PS, другие M, восстановительная хирургия и химиотерапия были рассчитаны как независимые прогностические факторы. Принимая во внимание эти результаты, кривая выживаемости подгруппы пациентов со стадией IV (, т. Е. , лучшие пациенты с PS без других M), перенесших операцию по уменьшению хирургии плюс системная химиотерапия, показала значительно лучшую кривую выживаемости, чем те, у которых отсутствует какая-либо из этих 4 благоприятных переменных. ().
Кривые выживаемости пациентов с раком желудка IV стадии, перенесших как редукционную операцию, так и химиотерапию. Сплошная линия представляет пациентов с определенными M (H, P и CY). Пунктирная линия представляет пациентов с другими М, как описано в тексте.
Таблица 3
Одномерный и многофакторный анализ
Обсуждение
В этом исследовании мы ясно продемонстрировали, что в условиях проведения как редукционной хирургии, так и системной химиотерапии пациенты стадии IV с хорошими факторами PS и M, ограниченными в пределах h2, P1, и CY1 может значительно продлить выживаемость.Проведение редукционной хирургии и системной химиотерапии для пациентов с плохим прогнозом кажется слишком агрессивным, когда комплексная стратегия лечения еще не определена. Таким образом, стратегия лечения пациентов с раком желудка IV стадии всегда является спорным вопросом в клинической практике из-за их плохого прогноза. Однако наши результаты могут быть хорошей новостью для этих пациентов. Более того, это может быть краеугольным камнем для оптимальной стратегии лечения будущих пациентов с раком желудка IV стадии. Насколько нам известно, мы первые пришли к выводу, что определенная подгруппа пациентов со стадией IV может получить пользу от проведения как редукционной хирургии, так и химиотерапии.
Варианты лечения пациентов с раком желудка IV стадии ограничены, поскольку распространение болезни далеко выходит за пределы ее происхождения. Согласно данным JGCA, кумулятивная 5-летняя выживаемость пациентов со стадией IV составила 15,3%, 2 и корейские данные также показали аналогичные результаты с 18%. 3 Более того, среди всех пациентов со стадией IV от 4% до 9% из них считаются слишком продвинутыми и не имеют шансов на излечивающую операцию, и их прогноз абсолютно плохой: менее 10% через 3 года после постановки диагноза. 16
JGCA предлагает расширенное хирургическое или паллиативное хирургическое вмешательство в качестве клинической практики и восстановительное хирургическое вмешательство в качестве клинического исследования для пациентов со стадией IV (пациенты T4 и N3 классифицируются как стадия IV в этом предложении). В предшествующих литературных источниках было доказано, что, когда стадия IV диагностируется только по одному М-фактору, выполнение резекции может продлить выживаемость. 17–22 Таким образом, удаление первичной опухоли возможно, даже если сегодня доступна химиотерапия.
S-1 занял лидирующую позицию в качестве стандартного противоопухолевого средства для лечения рака желудка.Вместе с другими агентами, такими как CDDP, CPT-11 и таксаны (паклитаксел и доцетаксел), скорость ответа на химиотерапию резко улучшилась. Они обеспечили лучший прогноз для пациентов со стадией IV. 9–11 S-1 с CDDP, как было доказано, имеет высокую частоту ответа и выбран в качестве химиотерапии первой линии. 12
Испытания адъювантной химиотерапии против распространенного рака желудка показали многообещающие результаты. 23,24 С другой стороны, химиотерапия не влияет на выживаемость пожилых людей. 25 Тем не менее, только S-1 можно безопасно использовать для пожилых и бедных пациентов с PS, каковыми являются большинство пациентов с IV стадией. 26,27 В последнее время обсуждались параметры неоадъювантной химиотерапии, чтобы дать адекватное количество противоопухолевого агента и, если возможно, снизить уровень неизлечимой опухоли для выполнения операции R0. Европейская группа недавно сообщила, что хирургическое вмешательство R0 увеличилось, но не повлияло на общую выживаемость. 28 Кочи и его коллеги сообщили об эффективности неоадъювантного S-1 + CDDP. 29 Прежде чем какие-либо окончательные результаты будут получены в результате хорошо организованных исследований, мы должны быть осторожны при внедрении неоадъювантной химиотерапии в клинических условиях.
В этом исследовании наша стратегия лечения пациентов была не чем иным, как основанной на практике, и решение о том, сначала оперировать или начинать химиотерапию, не было выбрано случайным образом. Мы всегда старались обеспечить хирургическое лечение не только для улучшения онкологического исхода, но и для устранения дискомфортных желудочно-кишечных симптомов, вызванных опухолью, часто описываемой как GOS.Более того, обеспечение прохождения хирургическим путем может способствовать достижению лучшего соответствия лечению S-1 наряду с увеличением пероральной диеты. Если у пациентов была сильная воля начать химиотерапию, а не операцию, мы уважали их решение и без промедления выполняли его.
Тем не менее, 13 пациентов, перенесших операцию в качестве начального лечения, не смогли перейти на химиотерапию. Некоторые потеряли желание продолжать лечение, некоторым не удалось улучшить или сохранить свой статус, а некоторым пришлось перейти на лучшую поддерживающую терапию.В некотором смысле, эти 13 пациентов могли воспользоваться только преимуществом уменьшения неблагоприятных желудочно-кишечных симптомов, вызванных опухолью. Но с точки зрения качества жизни это можно считать правильным выбором для них. Состояние пациентов и их воля могут измениться во время курса лечения, и мы должны проявлять гибкость при любых обстоятельствах при принятии решений.
Как показано на кривой выживаемости в, мы ясно продемонстрировали, что независимо от порядка лечения, если проводятся как восстановительная операция, так и химиотерапия, мы можем улучшить прогноз для определенных пациентов стадии IV, то есть пациентов с диагнозом IV стадии с диагнозом H, P и CY (с резервированием).Следовательно, мы не должны медлить с проведением как редукционной хирургии, так и системной химиотерапии, если пациент PS чувствует себя достаточно хорошо. Более того, для достижения этого результата не требовалось специальной стратегии лечения метастазов. Наше исследование исключило M (LYM) из благоприятного фактора, согласно которому метастазирование в расширенные лимфатические узлы действительно является неблагоприятным фактором для пациентов со стадией IV.
Настоящее исследование было основано на небольшом количестве данных, полученных ретроспективно в одном учреждении в Японии. Хотя степень заболевания не позволяет нам проводить проспективные исследования, наши результаты могут быть рационализированы и подтверждены в более крупном рандомизированном контрольном исследовании.Это выходит за рамки цели данного исследования, но с клинической точки зрения очень интересно выяснить порядок лечения или когда переходить к хирургическому вмешательству после неоадъювантной химиотерапии. Эти вопросы могут быть прояснены в будущем рандомизированном контрольном исследовании.
Благодарности
Авторы хотели бы поблагодарить профессора Томоюки Кавада из Медицинской школы Ниппон за его помощь в проведении статистического анализа.
Ссылки
1. Ферлей Дж., Шин Х. Р., Брей Ф., Форман Д., Мазерс С., Паркин Д. М..Оценки мирового бремени онкологических заболеваний в 2008 г .: GLOBOCAN 2008. Int J Cancer . 2010. 127 (12): 2893–2917. [PubMed] [Google Scholar] 2. Нашимото А., Акадзава К., Исобе Ю., Мияширо И., Катай Х., Кодера Ю. и др. Лечение рака желудка в 2002 году в Японии: годовой отчет общенационального реестра JGCA за 2009 год. Рак желудка . 2013; 16 (1): 1-27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Ли ХК, Ян ХК, Ким У.Х., Ли КЮ, Чхве К.Дж., Ким ДжП. Влияние количества исследованных лимфатических узлов на стадию рака желудка. руб. J Surg . 2001. 88 (10): 1408–1412. [PubMed] [Google Scholar] 4. Сано Т., Айко Т. Новые японские классификации и рекомендации по лечению рака желудка: пересмотренные концепции и основные пересмотренные положения. Рак желудка . 2011; 14 (2): 97–100. [PubMed] [Google Scholar] 5. Японская ассоциация рака желудка. Японское руководство по лечению рака желудка, 2010 г. (версия 3) Рак желудка . 2011. 14 (2): 113–123. [PubMed] [Google Scholar] 6. Собин LH, Gospodarowicz M, Wittelkind C, редакторы.Международный союз борьбы с раком. TNM Классификация злокачественных опухолей . 7-е изд. Нью-Йорк, Нью-Йорк: Уайли-Блэквелл; 1516 Н. Лейк-Шор Драйв, Чикаго, Иллинойс 60610 США: 2009. С. 84–95. В. ред. [Google Scholar] 7. Японская ассоциация рака желудка. Японская классификация рака желудка, 2-е английское издание. Рак желудка . 1998. 1 (1): 10–24. [PubMed] [Google Scholar] 8. Окен М.М., Крич Р.Х., Торми Д.К., Хортон Дж., Дэвис Т.Э., Макфадден Е.Т. и др. Критерии токсичности и ответа Восточной совместной онкологической группы. Ам Дж. Клин Онкол . 1982. 5 (6): 649–655. [PubMed] [Google Scholar] 9. Sakata Y, Ohtsu A, Horikoshi N, Sugimachi K, Mitachi Y, Taguchi T. Исследование поздней фазы II нового перорального противоракового препарата фторпиримидина S-1 (1 M тегафур-0,4 M гиместат-1 M отастат калия) у пациентов с запущенным раком желудка . евро J Рак . 1998. 34 (11): 1715–1720. [PubMed] [Google Scholar] 10. Коидзуми В., Курихара М., Накано С., Хасегава К. Исследование фазы II S-1, нового перорального производного 5-фторурацила, при распространенном раке желудка. Онкология . 2000. 58 (8): 191–197. [PubMed] [Google Scholar] 11. Maehara Y. S-1 при раке желудка: всесторонний обзор. Рак желудка . 2003; 6 ((приложение 1)): 2–8. [PubMed] [Google Scholar] 12. Коидзуми В., Нарахара Х., Хара Т., Такагане А., Акия Т., Такаги М. и др. Рандомизированное исследование фазы III одного S-1 в сравнении с S-1 + цисплатином в лечении распространенного рака желудка (исследование SPIRITS). SPIRITS: S-1 плюс цисплатин против S-1 в РКИ по лечению рака желудка. Ланцет Онкол .2008. 9 (3): 215–221. [PubMed] [Google Scholar] 13. Такиучи Х., Нарахара Х., Цудзинака Т., Гото М, Кавабе С., Катсу К. и др. Фаза I исследования S-1 в сочетании с иринотеканом (CPT-11) у пациентов с распространенным раком желудка (OGSG 0002) Jpn J Clin Oncol . 2005. 35 (1): 520–525. [PubMed] [Google Scholar] 14. Фудзитани К., Нарахара Х., Такиучи Х., Цудзинака Т., Сатоми Э., Гото М. и др. Фаза I и фармакокинетическое исследование S1 в сочетании с еженедельным введением паклитаксела у пациентов с распространенным раком желудка. Онкология .2005. 69 (5): 414–420. [PubMed] [Google Scholar] 15. Ёсида К., Ниномия М., Такакура Н., Хирабаяси Н., Такияма В., Сато Ю. и др. Фаза II исследования комбинированной терапии доцетакселом и S-1 при запущенном или рецидивирующем раке желудка. Clin Cancer Res . 2006. 12 (11): 3402–3407. [PubMed] [Google Scholar] 16. Регистрационный комитет Японской ассоциации рака желудка. Рак желудка лечили в 1991 году в Японии: анализ данных общенационального регистра. Рак желудка . 2006. 9 (2): 51–66. [PubMed] [Google Scholar] 17.Bozzetti F, Bonfanti G, Audisio RA, Doci R, Dossena G, Gennari L и др. Прогноз пациентов после паллиативных хирургических вмешательств по поводу рака желудка. Хирургический гинекологический акушерский аппарат . 1987. 164 (2): 151–154. [PubMed] [Google Scholar] 18. Кикучи С., Араи Й., Морисе М., Кобаяши Н., Цукамото Х., Симао Х. и др. Рак желудка с метастазами в отдаленную брюшину: хирургический стаж 20 лет. Гепатогастроэнтерология . 1998. 45 (22): 1183–1188. [PubMed] [Google Scholar] 19. Кога С., Кавагути Х., Кисимото Х., Танака К., Мияно Й., Кимура О. и др.Терапевтическое значение неоперационной гастрэктомии при раке желудка с метастазами в печень. Am J Surg . 1980. 140 (3): 356–359. [PubMed] [Google Scholar] 20. Хартгринк Х. Х., Путтер Х., Кляйн Краненбарг Э., Боненкамп Дж. Дж., Ван де Вельде С. Джей. Голландская группа рака желудка. Значение паллиативной резекции при раке желудка. руб. J Surg . 2002. 89 (11): 1438–1443. [PubMed] [Google Scholar] 21. Боненкамп Дж. Дж., Сасако М., Херманс Дж., Ван де Вельде С. Дж.. Опухолевая нагрузка и паллиативное хирургическое вмешательство при раке желудка. Гепатогастроэнтерология . 2001. 48 (44): 1219–1221. [PubMed] [Google Scholar] 22. Maekawa S, Saku M, Maehara Y, Sadanaga N, Ikejiri K, Anai H и др. Хирургическое лечение распространенного рака желудка. Гепатогастроэнтерология . 1996. 43 (7): 178–186. [PubMed] [Google Scholar] 23. Сакурамото С., Сасако М., Ямагути Т., Киношита Т., Фуджи М., Нашимото А. и др. Адъювантная химиотерапия рака желудка с S-1, пероральным фторпиримидином. N Engl J Med . 2007. 357 (18): 1810–1820.[PubMed] [Google Scholar] 24. Макдональд Дж. С., Смолли С. Р., Бенедетти Дж., Хундал С. А., Эстес Н. С., Стеммерманн Г. Н. и др. Химиолучевая терапия после хирургического вмешательства по сравнению с хирургическим вмешательством при аденокарциноме желудка или пищеводно-желудочного перехода. N Engl J Med . 2001. 345 (10): 725–730. [PubMed] [Google Scholar] 25. Эндо С., Йошикава Ю., Хатанака Н., Томинага Х., Симидзу Й., Хираока К. и др. Лечение рака желудка у пожилых пациентов. Рак желудка . 2011. 14 (2): 139–143.[PubMed] [Google Scholar] 26. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Безопасность и эффективность монотерапии S-1 у пожилых пациентов с распространенным раком желудка. Рак желудка . 2010. 13 (4): 245–250. [PubMed] [Google Scholar] 27. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Сравнение безопасности и эффективности монотерапии S-1 и терапии S-1 плюс цисплатин у пожилых пациентов с распространенным раком желудка. Инт Дж. Клин Онкол .2013; 18 (1): 10–16. [PubMed] [Google Scholar] 28. Schuhmacher C, Gretschel S, Lordick F, Reichardt P, Hohenberger W, Eisenberger CF и др. Неоадъювантная химиотерапия в сравнении с хирургией только при местнораспространенном раке желудка и кардии: рандомизированное исследование Европейской организации по исследованию и лечению рака, 40954. J Clin Oncol . 2010. 28 (35): 5210–5218. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Кочи М., Фудзи М., Канамори Н., Кайга Т., Такахаши Т., Кобаяши М. и др. Неоадъювантная химиотерапия с S-1 и CDDP при распространенном раке желудка. J Cancer Res Clin Oncol . 2006. 132 (12): 781–785. [PubMed] [Google Scholar] 30. Японская классификация рака желудка. Японская ассоциация рака желудка. 2011. 14 (2): 101–112. 3-е английское издание. Рак желудка . [PubMed] [Google Scholar]факторов прогноза рака желудка стадии IV
Int Surg. 2013 апрель-июнь; 98 (2): 181–187.
Хироюки Баба
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Коки Кувабара
Отделение хирургии пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ , Сайтама, Япония
Тору Исигуро
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кенсуке Кумамото
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Сайтама Медицинский университет, Кавагоэ, Сайтама, Япония
Йоичи Кумагаи
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кейитиро Ишибаши
Отделение пищеварительной и общей хирургии Сайтамы Медицинский центр, Медицинский университет Сайтамы, Кавагоэ, Сай тама, Япония
Норихиро Хага
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Хидеюки Исида
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Saitama Medical Университет, Кавагоэ, Сайтама, Япония
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Запросы на перепечатку: Хироюки Баба, доктор медицины, доктор философии, Отделение пищеварительного тракта и общей хирургии, Сайтама Медицинский центр, Медицинский университет Сайтамы, 1981 г. Камода, Кавагоэ, Сайтама, 350-8550, Япония.Тел .: +81 49 228 3619; Факс: +81 49 222 8865; Электронная почта: pj.ca.dem-amatias@ababorih Авторские права, 2013 г., Международный колледж хирургов. Эта статья цитируется в других статьях в PMC.Рак желудка является четвертой ведущей причиной рака в мире с частотой около 1 миллиона случаев (7,8% от общего числа). В региональном масштабе половина случаев заболевания в мире приходится на Восточную Азию. Это вторая ведущая причина смерти от рака во всем мире (738 000 смертей, 9,7% от общего числа). 1 Хотя ранняя диагностика и стандартизованные стратегии лечения способствовали увеличению выживаемости, пациенты со стадией IV по-прежнему имеют плохой прогноз.Предыдущие отчеты из Японии и Кореи показали, что 5-летняя выживаемость составляет 15,3% и 18% соответственно. 2,3
Рекомендации, опубликованные Японской ассоциацией рака желудка (JGCA) 4,5 , рекомендуют выбор из 5 методов лечения пациентов на стадии IV в клинической практике: хирургия (расширенная или паллиативная), химиотерапия, лучевая терапия или паллиативная уход. Принципы по-прежнему остаются спорными, и рекомендуется проведение клинических исследований. Характер заболевания не позволяет проводить проспективные исследования; однако ретроспективное исследование играет важную роль посредством клинических исследований.
Это ретроспективное исследование, основанное на клинической практике, направлено на выяснение благоприятных факторов, способствующих лучшему прогнозу пациентов с раком желудка IV стадии. Кроме того, мы стремимся оценить оптимальные стратегии лечения.
Пациенты и методы
В период с апреля 2005 г. по март 2011 г. в Медицинском центре Сайтама было обследовано в общей сложности 123 пациента с патологически подтвержденным раком желудка IV стадии в соответствии с данными, собранными из диаграммы.Клинико-патологическими факторами, оцениваемыми в этом исследовании, были возраст, пол, работоспособность (PS), расположение опухоли, общий вид опухоли, гистологический тип, карциноэмбриональный антиген (CEA), углеводный антиген 19-9 (CA19-9), глубина опухоли (T), метастазы в регионарные лимфатические узлы (N), метастазы в печень (H), перитонеальную диссеминацию (P) и цитологию перитонеального лаважа (CY). Отдаленные метастазы, помимо H, P и CY, относительно редки, за исключением метастазов в лимфатические узлы за пределами региональных узлов [M (LYM)]. Мы отнесли эти редкие факторы M к категории «другие M» и включили их в качестве одной из переменных в это исследование.Удаление первичной опухоли или нет и введение системной химиотерапии или нет также были включены в качестве одной из переменных для статистического анализа.
Процесс определения стадии основан на системе стадирования опухолевого узла-метастаза (TNM), принятой Союзом по борьбе с раком (UICC; 7-е издание, 2010 г.). 6 Чтобы избежать ненужной терминологической путаницы, мы следовали терминологии, определенной в английской версии руководств по диагностике и лечению рака желудка, 7 , опубликованных JGCA.PS оценивался при поступлении у каждого пациента с использованием метода, предложенного Восточной кооперативной онкологической группой (ECOG). 8 Диагноз стадии IV был поставлен на основании предоперационных рентгенологических данных, таких как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ультразвуковое исследование (УЗИ), в противном случае — при лапаротомии или ступенчатой лапароскопии. Цитологическое исследование перитонеального лаважа (CY) было выполнено во время лапаротомии, а диагностическая информация была предоставлена из патологического отделения во время операции.Патологические отчеты образцов были исследованы сертифицированными патологоанатомами в нашем учреждении.
JGCS определяет пациентов со стадией IV как не имеющих абсолютной стратегии лечения в лечебных рекомендациях. 2 Таким образом, в настоящее время у нас нет конкретного алгоритма лечения пациентов со стадией IV. Однако для принятия решения мы взвешиваем клинические симптомы пациентов. Синдром выхода из желудка (GOS) является наиболее тревожным и раздражающим симптомом для пациентов, и в случае его выявления хирургическое вмешательство, как правило, является нашим первым выбором.В противном случае можно использовать химиотерапию. Если плохой статус пациента является значительным, рассматривается лучший поддерживающий уход. Пациенты могут начать химиотерапию и перейти к операции при появлении GOS или кровотечении. Каким бы ни был порядок лечения, все пациенты в этом ретроспективном исследовании дали письменное информированное согласие, прежде чем начинать что-либо.
Вопрос о том, вводить ли химиотерапию в первую очередь или нет, и наиболее эффективная хирургическая процедура кратко обсуждались с пациентами и членами их семей.Принятие решения основывалось на пожеланиях пациентов и объективном суждении лечащего врача. Попытки провести расширенную операцию в конце концов часто заканчивались удалением первичной опухоли, добиваясь только операции R1. Особенно, когда ожидалось паллиативное хирургическое вмешательство, пациенту было дано достаточное информированное согласие, и операция проводилась на месте. Режим химиотерапии был основан на комбинированном противоопухолевом препарате тегафура, гимерацила и отерацила калия (S-1), производном пиримидина для приема внутрь, который на сегодняшний день является основным средством против рака желудка. 9–11 Комбинация с цисплатином (CDDP) сегодня считается схемой первого выбора. 12 Однако другие агенты использовались на практике ежедневно, такие как иринотекан (СРТ-11) и таксаны (паклитаксел и доцетаксел), и эти пациенты также были включены в исследование. 13–15
Статистический анализ
Статистический анализ проводился между группами с использованием тестов χ 2 или Манна-Уитни U , где это было необходимо.Кривые выживаемости анализировали с использованием метода Каплана-Мейера, а различия определяли с помощью лог-рангового критерия. Для выявления независимых прогностических факторов использовалась многомерная модель пропорциональных рисков Кокса. Для определения независимых прогностических факторов фактор со значением P <0,1 с помощью одномерного анализа был введен в многомерный анализ с прямым пошаговым выбором. Общая выживаемость определялась как период от начального лечения (химиотерапия, операция или наилучшая поддерживающая терапия) до смерти по любой причине.Тесты считались значимыми при значении P <0,05.
Результаты
Демографические и клинико-патологические характеристики представлены в. Был 91 мужчина и 32 женщины, средний возраст 69 лет (диапазон 26–88). В совокупности PS 0 и 1 насчитали 102 пациента (82,9%). Число пациентов, у которых опухоль локализовалась в проксимальном отделе желудка, составило 55 (44,7%). У 68 пациентов (55,3%) опухоль была локализована в дистальной части желудка. Общий вид опухоли варьировал от типа 0 по Борману до 5 типа, насчитывая 1, 6, 18, 57, 33 и 18 соответственно.Все опухоли были патологически диагностированы как аденокарцинома. Тридцать пять (28,5%) из них относились к тубулярному типу, а 88 (71,5%) — к нетубулярному типу, что позволяет предположить, что аденокарцинома, которая была потенциально инвазивной по своей природе, была доминирующей на стадии IV. Число пациентов Т4 составило 82 (66,7%), пациентов N3 — 67 (54,5%). Отдаленные метастазы, определяемые с помощью H, P и CY, насчитывали 46 (37,4%), 62 (50,4%) и 39 (45,3%) пациентов соответственно. Число пациентов с CY1 меньше, чем P1, кажется странным, но этот феномен можно объяснить, если понять фактическую цитологию перитонеального лаважа (CY), проводимую после операции.Согласно обзору диаграммы, CY был рутинным для пациентов P0 (n = 61), и среди них 14 были CY1. Остальные пациенты (n = 62) были P1, CY не был рутинной процедурой. Общее количество пациентов с CY составило 86, 25 пациентов были P1 и, естественно, достаточно CY1. Таким образом, сумма 14 пациентов (P0CY1) и 25 пациентов (P1CY1) составила общее количество пациентов с CY1 (n = 39). Если мы рассмотрим всех пациентов P1 как CY1, количество CY1 будет в сумме до 76 вместо 39, причем CY1 будет больше, чем P1. Остальные M насчитали 55 (44.7%) пациентов, и все они были результатом обширного поражения лимфатических узлов, которое можно классифицировать как M (LYM). Медиана CEA и CA19-9 составляла 6,05 нг / мл и 15,5 нг / мл соответственно.
Таблица 1
Клинико-патологические особенности пациентов с раком желудка IV стадии.
показывает блок-схему лечения, проводимого пациентам с IV стадией. Оперативное вмешательство выполнено 78 пациентам. Из них 37 пациентам была проведена редукционная операция, а 41 пациенту — паллиативная операция.Решение о резекции первичной опухоли было поручено хирургической бригаде по лапаротомии. Тринадцать пациентов не получали послеоперационную химиотерапию в основном из-за ухудшения их работоспособности. Другие все-таки хотели получить наилучшую поддерживающую терапию. Тридцать восемь пациентов не подвергались хирургическому вмешательству, получали только химиотерапию или получали наилучшую поддерживающую терапию (n = 7). Химиотерапия проводилась по схеме S-1 (n = 99). Среди них пациенты только с S-1 или в комбинации с CDDP, таксанами и CPT11 были 45, 45, 8 и 1 соответственно ().
Блок-схема 123 пациентов.
Таблица 2
Данные лечения пациентов
Одномерный анализ прогностических факторов общей выживаемости приведен в. Возраст (70 или больше по сравнению с младше 70; P = 0,03), работоспособность (PS2 или больше по сравнению с PS0 или 1; P < 0,01), метастазы в печень (h2 по сравнению с H0; P = 0,02), другие M (положительный результат против отрицательного; P < 0,01), CA19-9 (37 нг / мл или более по сравнению с менее чем 37 нг / мл; P < 0.01), редукционная операция (нерезекция по сравнению с резекцией; P < 0,01), химиотерапия (Нет против Да; P < 0,01) оказались значимыми прогностическими факторами для общей выживаемости. Как также указано в, PS, другие M, восстановительная хирургия и химиотерапия были рассчитаны как независимые прогностические факторы. Принимая во внимание эти результаты, кривая выживаемости подгруппы пациентов со стадией IV (, т. Е. , лучшие пациенты с PS без других M), перенесших операцию по уменьшению хирургии плюс системная химиотерапия, показала значительно лучшую кривую выживаемости, чем те, у которых отсутствует какая-либо из этих 4 благоприятных переменных. ().
Кривые выживаемости пациентов с раком желудка IV стадии, перенесших как редукционную операцию, так и химиотерапию. Сплошная линия представляет пациентов с определенными M (H, P и CY). Пунктирная линия представляет пациентов с другими М, как описано в тексте.
Таблица 3
Одномерный и многофакторный анализ
Обсуждение
В этом исследовании мы ясно продемонстрировали, что в условиях проведения как редукционной хирургии, так и системной химиотерапии пациенты стадии IV с хорошими факторами PS и M, ограниченными в пределах h2, P1, и CY1 может значительно продлить выживаемость.Проведение редукционной хирургии и системной химиотерапии для пациентов с плохим прогнозом кажется слишком агрессивным, когда комплексная стратегия лечения еще не определена. Таким образом, стратегия лечения пациентов с раком желудка IV стадии всегда является спорным вопросом в клинической практике из-за их плохого прогноза. Однако наши результаты могут быть хорошей новостью для этих пациентов. Более того, это может быть краеугольным камнем для оптимальной стратегии лечения будущих пациентов с раком желудка IV стадии. Насколько нам известно, мы первые пришли к выводу, что определенная подгруппа пациентов со стадией IV может получить пользу от проведения как редукционной хирургии, так и химиотерапии.
Варианты лечения пациентов с раком желудка IV стадии ограничены, поскольку распространение болезни далеко выходит за пределы ее происхождения. Согласно данным JGCA, кумулятивная 5-летняя выживаемость пациентов со стадией IV составила 15,3%, 2 и корейские данные также показали аналогичные результаты с 18%. 3 Более того, среди всех пациентов со стадией IV от 4% до 9% из них считаются слишком продвинутыми и не имеют шансов на излечивающую операцию, и их прогноз абсолютно плохой: менее 10% через 3 года после постановки диагноза. 16
JGCA предлагает расширенное хирургическое или паллиативное хирургическое вмешательство в качестве клинической практики и восстановительное хирургическое вмешательство в качестве клинического исследования для пациентов со стадией IV (пациенты T4 и N3 классифицируются как стадия IV в этом предложении). В предшествующих литературных источниках было доказано, что, когда стадия IV диагностируется только по одному М-фактору, выполнение резекции может продлить выживаемость. 17–22 Таким образом, удаление первичной опухоли возможно, даже если сегодня доступна химиотерапия.
S-1 занял лидирующую позицию в качестве стандартного противоопухолевого средства для лечения рака желудка.Вместе с другими агентами, такими как CDDP, CPT-11 и таксаны (паклитаксел и доцетаксел), скорость ответа на химиотерапию резко улучшилась. Они обеспечили лучший прогноз для пациентов со стадией IV. 9–11 S-1 с CDDP, как было доказано, имеет высокую частоту ответа и выбран в качестве химиотерапии первой линии. 12
Испытания адъювантной химиотерапии против распространенного рака желудка показали многообещающие результаты. 23,24 С другой стороны, химиотерапия не влияет на выживаемость пожилых людей. 25 Тем не менее, только S-1 можно безопасно использовать для пожилых и бедных пациентов с PS, каковыми являются большинство пациентов с IV стадией. 26,27 В последнее время обсуждались параметры неоадъювантной химиотерапии, чтобы дать адекватное количество противоопухолевого агента и, если возможно, снизить уровень неизлечимой опухоли для выполнения операции R0. Европейская группа недавно сообщила, что хирургическое вмешательство R0 увеличилось, но не повлияло на общую выживаемость. 28 Кочи и его коллеги сообщили об эффективности неоадъювантного S-1 + CDDP. 29 Прежде чем какие-либо окончательные результаты будут получены в результате хорошо организованных исследований, мы должны быть осторожны при внедрении неоадъювантной химиотерапии в клинических условиях.
В этом исследовании наша стратегия лечения пациентов была не чем иным, как основанной на практике, и решение о том, сначала оперировать или начинать химиотерапию, не было выбрано случайным образом. Мы всегда старались обеспечить хирургическое лечение не только для улучшения онкологического исхода, но и для устранения дискомфортных желудочно-кишечных симптомов, вызванных опухолью, часто описываемой как GOS.Более того, обеспечение прохождения хирургическим путем может способствовать достижению лучшего соответствия лечению S-1 наряду с увеличением пероральной диеты. Если у пациентов была сильная воля начать химиотерапию, а не операцию, мы уважали их решение и без промедления выполняли его.
Тем не менее, 13 пациентов, перенесших операцию в качестве начального лечения, не смогли перейти на химиотерапию. Некоторые потеряли желание продолжать лечение, некоторым не удалось улучшить или сохранить свой статус, а некоторым пришлось перейти на лучшую поддерживающую терапию.В некотором смысле, эти 13 пациентов могли воспользоваться только преимуществом уменьшения неблагоприятных желудочно-кишечных симптомов, вызванных опухолью. Но с точки зрения качества жизни это можно считать правильным выбором для них. Состояние пациентов и их воля могут измениться во время курса лечения, и мы должны проявлять гибкость при любых обстоятельствах при принятии решений.
Как показано на кривой выживаемости в, мы ясно продемонстрировали, что независимо от порядка лечения, если проводятся как восстановительная операция, так и химиотерапия, мы можем улучшить прогноз для определенных пациентов стадии IV, то есть пациентов с диагнозом IV стадии с диагнозом H, P и CY (с резервированием).Следовательно, мы не должны медлить с проведением как редукционной хирургии, так и системной химиотерапии, если пациент PS чувствует себя достаточно хорошо. Более того, для достижения этого результата не требовалось специальной стратегии лечения метастазов. Наше исследование исключило M (LYM) из благоприятного фактора, согласно которому метастазирование в расширенные лимфатические узлы действительно является неблагоприятным фактором для пациентов со стадией IV.
Настоящее исследование было основано на небольшом количестве данных, полученных ретроспективно в одном учреждении в Японии. Хотя степень заболевания не позволяет нам проводить проспективные исследования, наши результаты могут быть рационализированы и подтверждены в более крупном рандомизированном контрольном исследовании.Это выходит за рамки цели данного исследования, но с клинической точки зрения очень интересно выяснить порядок лечения или когда переходить к хирургическому вмешательству после неоадъювантной химиотерапии. Эти вопросы могут быть прояснены в будущем рандомизированном контрольном исследовании.
Благодарности
Авторы хотели бы поблагодарить профессора Томоюки Кавада из Медицинской школы Ниппон за его помощь в проведении статистического анализа.
Ссылки
1. Ферлей Дж., Шин Х. Р., Брей Ф., Форман Д., Мазерс С., Паркин Д. М..Оценки мирового бремени онкологических заболеваний в 2008 г .: GLOBOCAN 2008. Int J Cancer . 2010. 127 (12): 2893–2917. [PubMed] [Google Scholar] 2. Нашимото А., Акадзава К., Исобе Ю., Мияширо И., Катай Х., Кодера Ю. и др. Лечение рака желудка в 2002 году в Японии: годовой отчет общенационального реестра JGCA за 2009 год. Рак желудка . 2013; 16 (1): 1-27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Ли ХК, Ян ХК, Ким У.Х., Ли КЮ, Чхве К.Дж., Ким ДжП. Влияние количества исследованных лимфатических узлов на стадию рака желудка. руб. J Surg . 2001. 88 (10): 1408–1412. [PubMed] [Google Scholar] 4. Сано Т., Айко Т. Новые японские классификации и рекомендации по лечению рака желудка: пересмотренные концепции и основные пересмотренные положения. Рак желудка . 2011; 14 (2): 97–100. [PubMed] [Google Scholar] 5. Японская ассоциация рака желудка. Японское руководство по лечению рака желудка, 2010 г. (версия 3) Рак желудка . 2011. 14 (2): 113–123. [PubMed] [Google Scholar] 6. Собин LH, Gospodarowicz M, Wittelkind C, редакторы.Международный союз борьбы с раком. TNM Классификация злокачественных опухолей . 7-е изд. Нью-Йорк, Нью-Йорк: Уайли-Блэквелл; 1516 Н. Лейк-Шор Драйв, Чикаго, Иллинойс 60610 США: 2009. С. 84–95. В. ред. [Google Scholar] 7. Японская ассоциация рака желудка. Японская классификация рака желудка, 2-е английское издание. Рак желудка . 1998. 1 (1): 10–24. [PubMed] [Google Scholar] 8. Окен М.М., Крич Р.Х., Торми Д.К., Хортон Дж., Дэвис Т.Э., Макфадден Е.Т. и др. Критерии токсичности и ответа Восточной совместной онкологической группы. Ам Дж. Клин Онкол . 1982. 5 (6): 649–655. [PubMed] [Google Scholar] 9. Sakata Y, Ohtsu A, Horikoshi N, Sugimachi K, Mitachi Y, Taguchi T. Исследование поздней фазы II нового перорального противоракового препарата фторпиримидина S-1 (1 M тегафур-0,4 M гиместат-1 M отастат калия) у пациентов с запущенным раком желудка . евро J Рак . 1998. 34 (11): 1715–1720. [PubMed] [Google Scholar] 10. Коидзуми В., Курихара М., Накано С., Хасегава К. Исследование фазы II S-1, нового перорального производного 5-фторурацила, при распространенном раке желудка. Онкология . 2000. 58 (8): 191–197. [PubMed] [Google Scholar] 11. Maehara Y. S-1 при раке желудка: всесторонний обзор. Рак желудка . 2003; 6 ((приложение 1)): 2–8. [PubMed] [Google Scholar] 12. Коидзуми В., Нарахара Х., Хара Т., Такагане А., Акия Т., Такаги М. и др. Рандомизированное исследование фазы III одного S-1 в сравнении с S-1 + цисплатином в лечении распространенного рака желудка (исследование SPIRITS). SPIRITS: S-1 плюс цисплатин против S-1 в РКИ по лечению рака желудка. Ланцет Онкол .2008. 9 (3): 215–221. [PubMed] [Google Scholar] 13. Такиучи Х., Нарахара Х., Цудзинака Т., Гото М, Кавабе С., Катсу К. и др. Фаза I исследования S-1 в сочетании с иринотеканом (CPT-11) у пациентов с распространенным раком желудка (OGSG 0002) Jpn J Clin Oncol . 2005. 35 (1): 520–525. [PubMed] [Google Scholar] 14. Фудзитани К., Нарахара Х., Такиучи Х., Цудзинака Т., Сатоми Э., Гото М. и др. Фаза I и фармакокинетическое исследование S1 в сочетании с еженедельным введением паклитаксела у пациентов с распространенным раком желудка. Онкология .2005. 69 (5): 414–420. [PubMed] [Google Scholar] 15. Ёсида К., Ниномия М., Такакура Н., Хирабаяси Н., Такияма В., Сато Ю. и др. Фаза II исследования комбинированной терапии доцетакселом и S-1 при запущенном или рецидивирующем раке желудка. Clin Cancer Res . 2006. 12 (11): 3402–3407. [PubMed] [Google Scholar] 16. Регистрационный комитет Японской ассоциации рака желудка. Рак желудка лечили в 1991 году в Японии: анализ данных общенационального регистра. Рак желудка . 2006. 9 (2): 51–66. [PubMed] [Google Scholar] 17.Bozzetti F, Bonfanti G, Audisio RA, Doci R, Dossena G, Gennari L и др. Прогноз пациентов после паллиативных хирургических вмешательств по поводу рака желудка. Хирургический гинекологический акушерский аппарат . 1987. 164 (2): 151–154. [PubMed] [Google Scholar] 18. Кикучи С., Араи Й., Морисе М., Кобаяши Н., Цукамото Х., Симао Х. и др. Рак желудка с метастазами в отдаленную брюшину: хирургический стаж 20 лет. Гепатогастроэнтерология . 1998. 45 (22): 1183–1188. [PubMed] [Google Scholar] 19. Кога С., Кавагути Х., Кисимото Х., Танака К., Мияно Й., Кимура О. и др.Терапевтическое значение неоперационной гастрэктомии при раке желудка с метастазами в печень. Am J Surg . 1980. 140 (3): 356–359. [PubMed] [Google Scholar] 20. Хартгринк Х. Х., Путтер Х., Кляйн Краненбарг Э., Боненкамп Дж. Дж., Ван де Вельде С. Джей. Голландская группа рака желудка. Значение паллиативной резекции при раке желудка. руб. J Surg . 2002. 89 (11): 1438–1443. [PubMed] [Google Scholar] 21. Боненкамп Дж. Дж., Сасако М., Херманс Дж., Ван де Вельде С. Дж.. Опухолевая нагрузка и паллиативное хирургическое вмешательство при раке желудка. Гепатогастроэнтерология . 2001. 48 (44): 1219–1221. [PubMed] [Google Scholar] 22. Maekawa S, Saku M, Maehara Y, Sadanaga N, Ikejiri K, Anai H и др. Хирургическое лечение распространенного рака желудка. Гепатогастроэнтерология . 1996. 43 (7): 178–186. [PubMed] [Google Scholar] 23. Сакурамото С., Сасако М., Ямагути Т., Киношита Т., Фуджи М., Нашимото А. и др. Адъювантная химиотерапия рака желудка с S-1, пероральным фторпиримидином. N Engl J Med . 2007. 357 (18): 1810–1820.[PubMed] [Google Scholar] 24. Макдональд Дж. С., Смолли С. Р., Бенедетти Дж., Хундал С. А., Эстес Н. С., Стеммерманн Г. Н. и др. Химиолучевая терапия после хирургического вмешательства по сравнению с хирургическим вмешательством при аденокарциноме желудка или пищеводно-желудочного перехода. N Engl J Med . 2001. 345 (10): 725–730. [PubMed] [Google Scholar] 25. Эндо С., Йошикава Ю., Хатанака Н., Томинага Х., Симидзу Й., Хираока К. и др. Лечение рака желудка у пожилых пациентов. Рак желудка . 2011. 14 (2): 139–143.[PubMed] [Google Scholar] 26. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Безопасность и эффективность монотерапии S-1 у пожилых пациентов с распространенным раком желудка. Рак желудка . 2010. 13 (4): 245–250. [PubMed] [Google Scholar] 27. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Сравнение безопасности и эффективности монотерапии S-1 и терапии S-1 плюс цисплатин у пожилых пациентов с распространенным раком желудка. Инт Дж. Клин Онкол .2013; 18 (1): 10–16. [PubMed] [Google Scholar] 28. Schuhmacher C, Gretschel S, Lordick F, Reichardt P, Hohenberger W, Eisenberger CF и др. Неоадъювантная химиотерапия в сравнении с хирургией только при местнораспространенном раке желудка и кардии: рандомизированное исследование Европейской организации по исследованию и лечению рака, 40954. J Clin Oncol . 2010. 28 (35): 5210–5218. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Кочи М., Фудзи М., Канамори Н., Кайга Т., Такахаши Т., Кобаяши М. и др. Неоадъювантная химиотерапия с S-1 и CDDP при распространенном раке желудка. J Cancer Res Clin Oncol . 2006. 132 (12): 781–785. [PubMed] [Google Scholar] 30. Японская классификация рака желудка. Японская ассоциация рака желудка. 2011. 14 (2): 101–112. 3-е английское издание. Рак желудка . [PubMed] [Google Scholar]факторов прогноза рака желудка стадии IV
Int Surg. 2013 апрель-июнь; 98 (2): 181–187.
Хироюки Баба
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Коки Кувабара
Отделение хирургии пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ , Сайтама, Япония
Тору Исигуро
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кенсуке Кумамото
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Сайтама Медицинский университет, Кавагоэ, Сайтама, Япония
Йоичи Кумагаи
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кейитиро Ишибаши
Отделение пищеварительной и общей хирургии Сайтамы Медицинский центр, Медицинский университет Сайтамы, Кавагоэ, Сай тама, Япония
Норихиро Хага
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Хидеюки Исида
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Saitama Medical Университет, Кавагоэ, Сайтама, Япония
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Запросы на перепечатку: Хироюки Баба, доктор медицины, доктор философии, Отделение пищеварительного тракта и общей хирургии, Сайтама Медицинский центр, Медицинский университет Сайтамы, 1981 г. Камода, Кавагоэ, Сайтама, 350-8550, Япония.Тел .: +81 49 228 3619; Факс: +81 49 222 8865; Электронная почта: pj.ca.dem-amatias@ababorih Авторские права, 2013 г., Международный колледж хирургов. Эта статья цитируется в других статьях в PMC.Рак желудка является четвертой ведущей причиной рака в мире с частотой около 1 миллиона случаев (7,8% от общего числа). В региональном масштабе половина случаев заболевания в мире приходится на Восточную Азию. Это вторая ведущая причина смерти от рака во всем мире (738 000 смертей, 9,7% от общего числа). 1 Хотя ранняя диагностика и стандартизованные стратегии лечения способствовали увеличению выживаемости, пациенты со стадией IV по-прежнему имеют плохой прогноз.Предыдущие отчеты из Японии и Кореи показали, что 5-летняя выживаемость составляет 15,3% и 18% соответственно. 2,3
Рекомендации, опубликованные Японской ассоциацией рака желудка (JGCA) 4,5 , рекомендуют выбор из 5 методов лечения пациентов на стадии IV в клинической практике: хирургия (расширенная или паллиативная), химиотерапия, лучевая терапия или паллиативная уход. Принципы по-прежнему остаются спорными, и рекомендуется проведение клинических исследований. Характер заболевания не позволяет проводить проспективные исследования; однако ретроспективное исследование играет важную роль посредством клинических исследований.
Это ретроспективное исследование, основанное на клинической практике, направлено на выяснение благоприятных факторов, способствующих лучшему прогнозу пациентов с раком желудка IV стадии. Кроме того, мы стремимся оценить оптимальные стратегии лечения.
Пациенты и методы
В период с апреля 2005 г. по март 2011 г. в Медицинском центре Сайтама было обследовано в общей сложности 123 пациента с патологически подтвержденным раком желудка IV стадии в соответствии с данными, собранными из диаграммы.Клинико-патологическими факторами, оцениваемыми в этом исследовании, были возраст, пол, работоспособность (PS), расположение опухоли, общий вид опухоли, гистологический тип, карциноэмбриональный антиген (CEA), углеводный антиген 19-9 (CA19-9), глубина опухоли (T), метастазы в регионарные лимфатические узлы (N), метастазы в печень (H), перитонеальную диссеминацию (P) и цитологию перитонеального лаважа (CY). Отдаленные метастазы, помимо H, P и CY, относительно редки, за исключением метастазов в лимфатические узлы за пределами региональных узлов [M (LYM)]. Мы отнесли эти редкие факторы M к категории «другие M» и включили их в качестве одной из переменных в это исследование.Удаление первичной опухоли или нет и введение системной химиотерапии или нет также были включены в качестве одной из переменных для статистического анализа.
Процесс определения стадии основан на системе стадирования опухолевого узла-метастаза (TNM), принятой Союзом по борьбе с раком (UICC; 7-е издание, 2010 г.). 6 Чтобы избежать ненужной терминологической путаницы, мы следовали терминологии, определенной в английской версии руководств по диагностике и лечению рака желудка, 7 , опубликованных JGCA.PS оценивался при поступлении у каждого пациента с использованием метода, предложенного Восточной кооперативной онкологической группой (ECOG). 8 Диагноз стадии IV был поставлен на основании предоперационных рентгенологических данных, таких как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ультразвуковое исследование (УЗИ), в противном случае — при лапаротомии или ступенчатой лапароскопии. Цитологическое исследование перитонеального лаважа (CY) было выполнено во время лапаротомии, а диагностическая информация была предоставлена из патологического отделения во время операции.Патологические отчеты образцов были исследованы сертифицированными патологоанатомами в нашем учреждении.
JGCS определяет пациентов со стадией IV как не имеющих абсолютной стратегии лечения в лечебных рекомендациях. 2 Таким образом, в настоящее время у нас нет конкретного алгоритма лечения пациентов со стадией IV. Однако для принятия решения мы взвешиваем клинические симптомы пациентов. Синдром выхода из желудка (GOS) является наиболее тревожным и раздражающим симптомом для пациентов, и в случае его выявления хирургическое вмешательство, как правило, является нашим первым выбором.В противном случае можно использовать химиотерапию. Если плохой статус пациента является значительным, рассматривается лучший поддерживающий уход. Пациенты могут начать химиотерапию и перейти к операции при появлении GOS или кровотечении. Каким бы ни был порядок лечения, все пациенты в этом ретроспективном исследовании дали письменное информированное согласие, прежде чем начинать что-либо.
Вопрос о том, вводить ли химиотерапию в первую очередь или нет, и наиболее эффективная хирургическая процедура кратко обсуждались с пациентами и членами их семей.Принятие решения основывалось на пожеланиях пациентов и объективном суждении лечащего врача. Попытки провести расширенную операцию в конце концов часто заканчивались удалением первичной опухоли, добиваясь только операции R1. Особенно, когда ожидалось паллиативное хирургическое вмешательство, пациенту было дано достаточное информированное согласие, и операция проводилась на месте. Режим химиотерапии был основан на комбинированном противоопухолевом препарате тегафура, гимерацила и отерацила калия (S-1), производном пиримидина для приема внутрь, который на сегодняшний день является основным средством против рака желудка. 9–11 Комбинация с цисплатином (CDDP) сегодня считается схемой первого выбора. 12 Однако другие агенты использовались на практике ежедневно, такие как иринотекан (СРТ-11) и таксаны (паклитаксел и доцетаксел), и эти пациенты также были включены в исследование. 13–15
Статистический анализ
Статистический анализ проводился между группами с использованием тестов χ 2 или Манна-Уитни U , где это было необходимо.Кривые выживаемости анализировали с использованием метода Каплана-Мейера, а различия определяли с помощью лог-рангового критерия. Для выявления независимых прогностических факторов использовалась многомерная модель пропорциональных рисков Кокса. Для определения независимых прогностических факторов фактор со значением P <0,1 с помощью одномерного анализа был введен в многомерный анализ с прямым пошаговым выбором. Общая выживаемость определялась как период от начального лечения (химиотерапия, операция или наилучшая поддерживающая терапия) до смерти по любой причине.Тесты считались значимыми при значении P <0,05.
Результаты
Демографические и клинико-патологические характеристики представлены в. Был 91 мужчина и 32 женщины, средний возраст 69 лет (диапазон 26–88). В совокупности PS 0 и 1 насчитали 102 пациента (82,9%). Число пациентов, у которых опухоль локализовалась в проксимальном отделе желудка, составило 55 (44,7%). У 68 пациентов (55,3%) опухоль была локализована в дистальной части желудка. Общий вид опухоли варьировал от типа 0 по Борману до 5 типа, насчитывая 1, 6, 18, 57, 33 и 18 соответственно.Все опухоли были патологически диагностированы как аденокарцинома. Тридцать пять (28,5%) из них относились к тубулярному типу, а 88 (71,5%) — к нетубулярному типу, что позволяет предположить, что аденокарцинома, которая была потенциально инвазивной по своей природе, была доминирующей на стадии IV. Число пациентов Т4 составило 82 (66,7%), пациентов N3 — 67 (54,5%). Отдаленные метастазы, определяемые с помощью H, P и CY, насчитывали 46 (37,4%), 62 (50,4%) и 39 (45,3%) пациентов соответственно. Число пациентов с CY1 меньше, чем P1, кажется странным, но этот феномен можно объяснить, если понять фактическую цитологию перитонеального лаважа (CY), проводимую после операции.Согласно обзору диаграммы, CY был рутинным для пациентов P0 (n = 61), и среди них 14 были CY1. Остальные пациенты (n = 62) были P1, CY не был рутинной процедурой. Общее количество пациентов с CY составило 86, 25 пациентов были P1 и, естественно, достаточно CY1. Таким образом, сумма 14 пациентов (P0CY1) и 25 пациентов (P1CY1) составила общее количество пациентов с CY1 (n = 39). Если мы рассмотрим всех пациентов P1 как CY1, количество CY1 будет в сумме до 76 вместо 39, причем CY1 будет больше, чем P1. Остальные M насчитали 55 (44.7%) пациентов, и все они были результатом обширного поражения лимфатических узлов, которое можно классифицировать как M (LYM). Медиана CEA и CA19-9 составляла 6,05 нг / мл и 15,5 нг / мл соответственно.
Таблица 1
Клинико-патологические особенности пациентов с раком желудка IV стадии.
показывает блок-схему лечения, проводимого пациентам с IV стадией. Оперативное вмешательство выполнено 78 пациентам. Из них 37 пациентам была проведена редукционная операция, а 41 пациенту — паллиативная операция.Решение о резекции первичной опухоли было поручено хирургической бригаде по лапаротомии. Тринадцать пациентов не получали послеоперационную химиотерапию в основном из-за ухудшения их работоспособности. Другие все-таки хотели получить наилучшую поддерживающую терапию. Тридцать восемь пациентов не подвергались хирургическому вмешательству, получали только химиотерапию или получали наилучшую поддерживающую терапию (n = 7). Химиотерапия проводилась по схеме S-1 (n = 99). Среди них пациенты только с S-1 или в комбинации с CDDP, таксанами и CPT11 были 45, 45, 8 и 1 соответственно ().
Блок-схема 123 пациентов.
Таблица 2
Данные лечения пациентов
Одномерный анализ прогностических факторов общей выживаемости приведен в. Возраст (70 или больше по сравнению с младше 70; P = 0,03), работоспособность (PS2 или больше по сравнению с PS0 или 1; P < 0,01), метастазы в печень (h2 по сравнению с H0; P = 0,02), другие M (положительный результат против отрицательного; P < 0,01), CA19-9 (37 нг / мл или более по сравнению с менее чем 37 нг / мл; P < 0.01), редукционная операция (нерезекция по сравнению с резекцией; P < 0,01), химиотерапия (Нет против Да; P < 0,01) оказались значимыми прогностическими факторами для общей выживаемости. Как также указано в, PS, другие M, восстановительная хирургия и химиотерапия были рассчитаны как независимые прогностические факторы. Принимая во внимание эти результаты, кривая выживаемости подгруппы пациентов со стадией IV (, т. Е. , лучшие пациенты с PS без других M), перенесших операцию по уменьшению хирургии плюс системная химиотерапия, показала значительно лучшую кривую выживаемости, чем те, у которых отсутствует какая-либо из этих 4 благоприятных переменных. ().
Кривые выживаемости пациентов с раком желудка IV стадии, перенесших как редукционную операцию, так и химиотерапию. Сплошная линия представляет пациентов с определенными M (H, P и CY). Пунктирная линия представляет пациентов с другими М, как описано в тексте.
Таблица 3
Одномерный и многофакторный анализ
Обсуждение
В этом исследовании мы ясно продемонстрировали, что в условиях проведения как редукционной хирургии, так и системной химиотерапии пациенты стадии IV с хорошими факторами PS и M, ограниченными в пределах h2, P1, и CY1 может значительно продлить выживаемость.Проведение редукционной хирургии и системной химиотерапии для пациентов с плохим прогнозом кажется слишком агрессивным, когда комплексная стратегия лечения еще не определена. Таким образом, стратегия лечения пациентов с раком желудка IV стадии всегда является спорным вопросом в клинической практике из-за их плохого прогноза. Однако наши результаты могут быть хорошей новостью для этих пациентов. Более того, это может быть краеугольным камнем для оптимальной стратегии лечения будущих пациентов с раком желудка IV стадии. Насколько нам известно, мы первые пришли к выводу, что определенная подгруппа пациентов со стадией IV может получить пользу от проведения как редукционной хирургии, так и химиотерапии.
Варианты лечения пациентов с раком желудка IV стадии ограничены, поскольку распространение болезни далеко выходит за пределы ее происхождения. Согласно данным JGCA, кумулятивная 5-летняя выживаемость пациентов со стадией IV составила 15,3%, 2 и корейские данные также показали аналогичные результаты с 18%. 3 Более того, среди всех пациентов со стадией IV от 4% до 9% из них считаются слишком продвинутыми и не имеют шансов на излечивающую операцию, и их прогноз абсолютно плохой: менее 10% через 3 года после постановки диагноза. 16
JGCA предлагает расширенное хирургическое или паллиативное хирургическое вмешательство в качестве клинической практики и восстановительное хирургическое вмешательство в качестве клинического исследования для пациентов со стадией IV (пациенты T4 и N3 классифицируются как стадия IV в этом предложении). В предшествующих литературных источниках было доказано, что, когда стадия IV диагностируется только по одному М-фактору, выполнение резекции может продлить выживаемость. 17–22 Таким образом, удаление первичной опухоли возможно, даже если сегодня доступна химиотерапия.
S-1 занял лидирующую позицию в качестве стандартного противоопухолевого средства для лечения рака желудка.Вместе с другими агентами, такими как CDDP, CPT-11 и таксаны (паклитаксел и доцетаксел), скорость ответа на химиотерапию резко улучшилась. Они обеспечили лучший прогноз для пациентов со стадией IV. 9–11 S-1 с CDDP, как было доказано, имеет высокую частоту ответа и выбран в качестве химиотерапии первой линии. 12
Испытания адъювантной химиотерапии против распространенного рака желудка показали многообещающие результаты. 23,24 С другой стороны, химиотерапия не влияет на выживаемость пожилых людей. 25 Тем не менее, только S-1 можно безопасно использовать для пожилых и бедных пациентов с PS, каковыми являются большинство пациентов с IV стадией. 26,27 В последнее время обсуждались параметры неоадъювантной химиотерапии, чтобы дать адекватное количество противоопухолевого агента и, если возможно, снизить уровень неизлечимой опухоли для выполнения операции R0. Европейская группа недавно сообщила, что хирургическое вмешательство R0 увеличилось, но не повлияло на общую выживаемость. 28 Кочи и его коллеги сообщили об эффективности неоадъювантного S-1 + CDDP. 29 Прежде чем какие-либо окончательные результаты будут получены в результате хорошо организованных исследований, мы должны быть осторожны при внедрении неоадъювантной химиотерапии в клинических условиях.
В этом исследовании наша стратегия лечения пациентов была не чем иным, как основанной на практике, и решение о том, сначала оперировать или начинать химиотерапию, не было выбрано случайным образом. Мы всегда старались обеспечить хирургическое лечение не только для улучшения онкологического исхода, но и для устранения дискомфортных желудочно-кишечных симптомов, вызванных опухолью, часто описываемой как GOS.Более того, обеспечение прохождения хирургическим путем может способствовать достижению лучшего соответствия лечению S-1 наряду с увеличением пероральной диеты. Если у пациентов была сильная воля начать химиотерапию, а не операцию, мы уважали их решение и без промедления выполняли его.
Тем не менее, 13 пациентов, перенесших операцию в качестве начального лечения, не смогли перейти на химиотерапию. Некоторые потеряли желание продолжать лечение, некоторым не удалось улучшить или сохранить свой статус, а некоторым пришлось перейти на лучшую поддерживающую терапию.В некотором смысле, эти 13 пациентов могли воспользоваться только преимуществом уменьшения неблагоприятных желудочно-кишечных симптомов, вызванных опухолью. Но с точки зрения качества жизни это можно считать правильным выбором для них. Состояние пациентов и их воля могут измениться во время курса лечения, и мы должны проявлять гибкость при любых обстоятельствах при принятии решений.
Как показано на кривой выживаемости в, мы ясно продемонстрировали, что независимо от порядка лечения, если проводятся как восстановительная операция, так и химиотерапия, мы можем улучшить прогноз для определенных пациентов стадии IV, то есть пациентов с диагнозом IV стадии с диагнозом H, P и CY (с резервированием).Следовательно, мы не должны медлить с проведением как редукционной хирургии, так и системной химиотерапии, если пациент PS чувствует себя достаточно хорошо. Более того, для достижения этого результата не требовалось специальной стратегии лечения метастазов. Наше исследование исключило M (LYM) из благоприятного фактора, согласно которому метастазирование в расширенные лимфатические узлы действительно является неблагоприятным фактором для пациентов со стадией IV.
Настоящее исследование было основано на небольшом количестве данных, полученных ретроспективно в одном учреждении в Японии. Хотя степень заболевания не позволяет нам проводить проспективные исследования, наши результаты могут быть рационализированы и подтверждены в более крупном рандомизированном контрольном исследовании.Это выходит за рамки цели данного исследования, но с клинической точки зрения очень интересно выяснить порядок лечения или когда переходить к хирургическому вмешательству после неоадъювантной химиотерапии. Эти вопросы могут быть прояснены в будущем рандомизированном контрольном исследовании.
Благодарности
Авторы хотели бы поблагодарить профессора Томоюки Кавада из Медицинской школы Ниппон за его помощь в проведении статистического анализа.
Ссылки
1. Ферлей Дж., Шин Х. Р., Брей Ф., Форман Д., Мазерс С., Паркин Д. М..Оценки мирового бремени онкологических заболеваний в 2008 г .: GLOBOCAN 2008. Int J Cancer . 2010. 127 (12): 2893–2917. [PubMed] [Google Scholar] 2. Нашимото А., Акадзава К., Исобе Ю., Мияширо И., Катай Х., Кодера Ю. и др. Лечение рака желудка в 2002 году в Японии: годовой отчет общенационального реестра JGCA за 2009 год. Рак желудка . 2013; 16 (1): 1-27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Ли ХК, Ян ХК, Ким У.Х., Ли КЮ, Чхве К.Дж., Ким ДжП. Влияние количества исследованных лимфатических узлов на стадию рака желудка. руб. J Surg . 2001. 88 (10): 1408–1412. [PubMed] [Google Scholar] 4. Сано Т., Айко Т. Новые японские классификации и рекомендации по лечению рака желудка: пересмотренные концепции и основные пересмотренные положения. Рак желудка . 2011; 14 (2): 97–100. [PubMed] [Google Scholar] 5. Японская ассоциация рака желудка. Японское руководство по лечению рака желудка, 2010 г. (версия 3) Рак желудка . 2011. 14 (2): 113–123. [PubMed] [Google Scholar] 6. Собин LH, Gospodarowicz M, Wittelkind C, редакторы.Международный союз борьбы с раком. TNM Классификация злокачественных опухолей . 7-е изд. Нью-Йорк, Нью-Йорк: Уайли-Блэквелл; 1516 Н. Лейк-Шор Драйв, Чикаго, Иллинойс 60610 США: 2009. С. 84–95. В. ред. [Google Scholar] 7. Японская ассоциация рака желудка. Японская классификация рака желудка, 2-е английское издание. Рак желудка . 1998. 1 (1): 10–24. [PubMed] [Google Scholar] 8. Окен М.М., Крич Р.Х., Торми Д.К., Хортон Дж., Дэвис Т.Э., Макфадден Е.Т. и др. Критерии токсичности и ответа Восточной совместной онкологической группы. Ам Дж. Клин Онкол . 1982. 5 (6): 649–655. [PubMed] [Google Scholar] 9. Sakata Y, Ohtsu A, Horikoshi N, Sugimachi K, Mitachi Y, Taguchi T. Исследование поздней фазы II нового перорального противоракового препарата фторпиримидина S-1 (1 M тегафур-0,4 M гиместат-1 M отастат калия) у пациентов с запущенным раком желудка . евро J Рак . 1998. 34 (11): 1715–1720. [PubMed] [Google Scholar] 10. Коидзуми В., Курихара М., Накано С., Хасегава К. Исследование фазы II S-1, нового перорального производного 5-фторурацила, при распространенном раке желудка. Онкология . 2000. 58 (8): 191–197. [PubMed] [Google Scholar] 11. Maehara Y. S-1 при раке желудка: всесторонний обзор. Рак желудка . 2003; 6 ((приложение 1)): 2–8. [PubMed] [Google Scholar] 12. Коидзуми В., Нарахара Х., Хара Т., Такагане А., Акия Т., Такаги М. и др. Рандомизированное исследование фазы III одного S-1 в сравнении с S-1 + цисплатином в лечении распространенного рака желудка (исследование SPIRITS). SPIRITS: S-1 плюс цисплатин против S-1 в РКИ по лечению рака желудка. Ланцет Онкол .2008. 9 (3): 215–221. [PubMed] [Google Scholar] 13. Такиучи Х., Нарахара Х., Цудзинака Т., Гото М, Кавабе С., Катсу К. и др. Фаза I исследования S-1 в сочетании с иринотеканом (CPT-11) у пациентов с распространенным раком желудка (OGSG 0002) Jpn J Clin Oncol . 2005. 35 (1): 520–525. [PubMed] [Google Scholar] 14. Фудзитани К., Нарахара Х., Такиучи Х., Цудзинака Т., Сатоми Э., Гото М. и др. Фаза I и фармакокинетическое исследование S1 в сочетании с еженедельным введением паклитаксела у пациентов с распространенным раком желудка. Онкология .2005. 69 (5): 414–420. [PubMed] [Google Scholar] 15. Ёсида К., Ниномия М., Такакура Н., Хирабаяси Н., Такияма В., Сато Ю. и др. Фаза II исследования комбинированной терапии доцетакселом и S-1 при запущенном или рецидивирующем раке желудка. Clin Cancer Res . 2006. 12 (11): 3402–3407. [PubMed] [Google Scholar] 16. Регистрационный комитет Японской ассоциации рака желудка. Рак желудка лечили в 1991 году в Японии: анализ данных общенационального регистра. Рак желудка . 2006. 9 (2): 51–66. [PubMed] [Google Scholar] 17.Bozzetti F, Bonfanti G, Audisio RA, Doci R, Dossena G, Gennari L и др. Прогноз пациентов после паллиативных хирургических вмешательств по поводу рака желудка. Хирургический гинекологический акушерский аппарат . 1987. 164 (2): 151–154. [PubMed] [Google Scholar] 18. Кикучи С., Араи Й., Морисе М., Кобаяши Н., Цукамото Х., Симао Х. и др. Рак желудка с метастазами в отдаленную брюшину: хирургический стаж 20 лет. Гепатогастроэнтерология . 1998. 45 (22): 1183–1188. [PubMed] [Google Scholar] 19. Кога С., Кавагути Х., Кисимото Х., Танака К., Мияно Й., Кимура О. и др.Терапевтическое значение неоперационной гастрэктомии при раке желудка с метастазами в печень. Am J Surg . 1980. 140 (3): 356–359. [PubMed] [Google Scholar] 20. Хартгринк Х. Х., Путтер Х., Кляйн Краненбарг Э., Боненкамп Дж. Дж., Ван де Вельде С. Джей. Голландская группа рака желудка. Значение паллиативной резекции при раке желудка. руб. J Surg . 2002. 89 (11): 1438–1443. [PubMed] [Google Scholar] 21. Боненкамп Дж. Дж., Сасако М., Херманс Дж., Ван де Вельде С. Дж.. Опухолевая нагрузка и паллиативное хирургическое вмешательство при раке желудка. Гепатогастроэнтерология . 2001. 48 (44): 1219–1221. [PubMed] [Google Scholar] 22. Maekawa S, Saku M, Maehara Y, Sadanaga N, Ikejiri K, Anai H и др. Хирургическое лечение распространенного рака желудка. Гепатогастроэнтерология . 1996. 43 (7): 178–186. [PubMed] [Google Scholar] 23. Сакурамото С., Сасако М., Ямагути Т., Киношита Т., Фуджи М., Нашимото А. и др. Адъювантная химиотерапия рака желудка с S-1, пероральным фторпиримидином. N Engl J Med . 2007. 357 (18): 1810–1820.[PubMed] [Google Scholar] 24. Макдональд Дж. С., Смолли С. Р., Бенедетти Дж., Хундал С. А., Эстес Н. С., Стеммерманн Г. Н. и др. Химиолучевая терапия после хирургического вмешательства по сравнению с хирургическим вмешательством при аденокарциноме желудка или пищеводно-желудочного перехода. N Engl J Med . 2001. 345 (10): 725–730. [PubMed] [Google Scholar] 25. Эндо С., Йошикава Ю., Хатанака Н., Томинага Х., Симидзу Й., Хираока К. и др. Лечение рака желудка у пожилых пациентов. Рак желудка . 2011. 14 (2): 139–143.[PubMed] [Google Scholar] 26. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Безопасность и эффективность монотерапии S-1 у пожилых пациентов с распространенным раком желудка. Рак желудка . 2010. 13 (4): 245–250. [PubMed] [Google Scholar] 27. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Сравнение безопасности и эффективности монотерапии S-1 и терапии S-1 плюс цисплатин у пожилых пациентов с распространенным раком желудка. Инт Дж. Клин Онкол .2013; 18 (1): 10–16. [PubMed] [Google Scholar] 28. Schuhmacher C, Gretschel S, Lordick F, Reichardt P, Hohenberger W, Eisenberger CF и др. Неоадъювантная химиотерапия в сравнении с хирургией только при местнораспространенном раке желудка и кардии: рандомизированное исследование Европейской организации по исследованию и лечению рака, 40954. J Clin Oncol . 2010. 28 (35): 5210–5218. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Кочи М., Фудзи М., Канамори Н., Кайга Т., Такахаши Т., Кобаяши М. и др. Неоадъювантная химиотерапия с S-1 и CDDP при распространенном раке желудка. J Cancer Res Clin Oncol . 2006. 132 (12): 781–785. [PubMed] [Google Scholar] 30. Японская классификация рака желудка. Японская ассоциация рака желудка. 2011. 14 (2): 101–112. 3-е английское издание. Рак желудка . [PubMed] [Google Scholar]факторов прогноза рака желудка стадии IV
Int Surg. 2013 апрель-июнь; 98 (2): 181–187.
Хироюки Баба
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Коки Кувабара
Отделение хирургии пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ , Сайтама, Япония
Тору Исигуро
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кенсуке Кумамото
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Сайтама Медицинский университет, Кавагоэ, Сайтама, Япония
Йоичи Кумагаи
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Кейитиро Ишибаши
Отделение пищеварительной и общей хирургии Сайтамы Медицинский центр, Медицинский университет Сайтамы, Кавагоэ, Сай тама, Япония
Норихиро Хага
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Хидеюки Исида
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Saitama Medical Университет, Кавагоэ, Сайтама, Япония
Отделение пищеварительного тракта и общей хирургии, Медицинский центр Сайтама, Медицинский университет Сайтама, Кавагоэ, Сайтама, Япония
Запросы на перепечатку: Хироюки Баба, доктор медицины, доктор философии, Отделение пищеварительного тракта и общей хирургии, Сайтама Медицинский центр, Медицинский университет Сайтамы, 1981 г. Камода, Кавагоэ, Сайтама, 350-8550, Япония.Тел .: +81 49 228 3619; Факс: +81 49 222 8865; Электронная почта: pj.ca.dem-amatias@ababorih Авторские права, 2013 г., Международный колледж хирургов. Эта статья цитируется в других статьях в PMC.Рак желудка является четвертой ведущей причиной рака в мире с частотой около 1 миллиона случаев (7,8% от общего числа). В региональном масштабе половина случаев заболевания в мире приходится на Восточную Азию. Это вторая ведущая причина смерти от рака во всем мире (738 000 смертей, 9,7% от общего числа). 1 Хотя ранняя диагностика и стандартизованные стратегии лечения способствовали увеличению выживаемости, пациенты со стадией IV по-прежнему имеют плохой прогноз.Предыдущие отчеты из Японии и Кореи показали, что 5-летняя выживаемость составляет 15,3% и 18% соответственно. 2,3
Рекомендации, опубликованные Японской ассоциацией рака желудка (JGCA) 4,5 , рекомендуют выбор из 5 методов лечения пациентов на стадии IV в клинической практике: хирургия (расширенная или паллиативная), химиотерапия, лучевая терапия или паллиативная уход. Принципы по-прежнему остаются спорными, и рекомендуется проведение клинических исследований. Характер заболевания не позволяет проводить проспективные исследования; однако ретроспективное исследование играет важную роль посредством клинических исследований.
Это ретроспективное исследование, основанное на клинической практике, направлено на выяснение благоприятных факторов, способствующих лучшему прогнозу пациентов с раком желудка IV стадии. Кроме того, мы стремимся оценить оптимальные стратегии лечения.
Пациенты и методы
В период с апреля 2005 г. по март 2011 г. в Медицинском центре Сайтама было обследовано в общей сложности 123 пациента с патологически подтвержденным раком желудка IV стадии в соответствии с данными, собранными из диаграммы.Клинико-патологическими факторами, оцениваемыми в этом исследовании, были возраст, пол, работоспособность (PS), расположение опухоли, общий вид опухоли, гистологический тип, карциноэмбриональный антиген (CEA), углеводный антиген 19-9 (CA19-9), глубина опухоли (T), метастазы в регионарные лимфатические узлы (N), метастазы в печень (H), перитонеальную диссеминацию (P) и цитологию перитонеального лаважа (CY). Отдаленные метастазы, помимо H, P и CY, относительно редки, за исключением метастазов в лимфатические узлы за пределами региональных узлов [M (LYM)]. Мы отнесли эти редкие факторы M к категории «другие M» и включили их в качестве одной из переменных в это исследование.Удаление первичной опухоли или нет и введение системной химиотерапии или нет также были включены в качестве одной из переменных для статистического анализа.
Процесс определения стадии основан на системе стадирования опухолевого узла-метастаза (TNM), принятой Союзом по борьбе с раком (UICC; 7-е издание, 2010 г.). 6 Чтобы избежать ненужной терминологической путаницы, мы следовали терминологии, определенной в английской версии руководств по диагностике и лечению рака желудка, 7 , опубликованных JGCA.PS оценивался при поступлении у каждого пациента с использованием метода, предложенного Восточной кооперативной онкологической группой (ECOG). 8 Диагноз стадии IV был поставлен на основании предоперационных рентгенологических данных, таких как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ультразвуковое исследование (УЗИ), в противном случае — при лапаротомии или ступенчатой лапароскопии. Цитологическое исследование перитонеального лаважа (CY) было выполнено во время лапаротомии, а диагностическая информация была предоставлена из патологического отделения во время операции.Патологические отчеты образцов были исследованы сертифицированными патологоанатомами в нашем учреждении.
JGCS определяет пациентов со стадией IV как не имеющих абсолютной стратегии лечения в лечебных рекомендациях. 2 Таким образом, в настоящее время у нас нет конкретного алгоритма лечения пациентов со стадией IV. Однако для принятия решения мы взвешиваем клинические симптомы пациентов. Синдром выхода из желудка (GOS) является наиболее тревожным и раздражающим симптомом для пациентов, и в случае его выявления хирургическое вмешательство, как правило, является нашим первым выбором.В противном случае можно использовать химиотерапию. Если плохой статус пациента является значительным, рассматривается лучший поддерживающий уход. Пациенты могут начать химиотерапию и перейти к операции при появлении GOS или кровотечении. Каким бы ни был порядок лечения, все пациенты в этом ретроспективном исследовании дали письменное информированное согласие, прежде чем начинать что-либо.
Вопрос о том, вводить ли химиотерапию в первую очередь или нет, и наиболее эффективная хирургическая процедура кратко обсуждались с пациентами и членами их семей.Принятие решения основывалось на пожеланиях пациентов и объективном суждении лечащего врача. Попытки провести расширенную операцию в конце концов часто заканчивались удалением первичной опухоли, добиваясь только операции R1. Особенно, когда ожидалось паллиативное хирургическое вмешательство, пациенту было дано достаточное информированное согласие, и операция проводилась на месте. Режим химиотерапии был основан на комбинированном противоопухолевом препарате тегафура, гимерацила и отерацила калия (S-1), производном пиримидина для приема внутрь, который на сегодняшний день является основным средством против рака желудка. 9–11 Комбинация с цисплатином (CDDP) сегодня считается схемой первого выбора. 12 Однако другие агенты использовались на практике ежедневно, такие как иринотекан (СРТ-11) и таксаны (паклитаксел и доцетаксел), и эти пациенты также были включены в исследование. 13–15
Статистический анализ
Статистический анализ проводился между группами с использованием тестов χ 2 или Манна-Уитни U , где это было необходимо.Кривые выживаемости анализировали с использованием метода Каплана-Мейера, а различия определяли с помощью лог-рангового критерия. Для выявления независимых прогностических факторов использовалась многомерная модель пропорциональных рисков Кокса. Для определения независимых прогностических факторов фактор со значением P <0,1 с помощью одномерного анализа был введен в многомерный анализ с прямым пошаговым выбором. Общая выживаемость определялась как период от начального лечения (химиотерапия, операция или наилучшая поддерживающая терапия) до смерти по любой причине.Тесты считались значимыми при значении P <0,05.
Результаты
Демографические и клинико-патологические характеристики представлены в. Был 91 мужчина и 32 женщины, средний возраст 69 лет (диапазон 26–88). В совокупности PS 0 и 1 насчитали 102 пациента (82,9%). Число пациентов, у которых опухоль локализовалась в проксимальном отделе желудка, составило 55 (44,7%). У 68 пациентов (55,3%) опухоль была локализована в дистальной части желудка. Общий вид опухоли варьировал от типа 0 по Борману до 5 типа, насчитывая 1, 6, 18, 57, 33 и 18 соответственно.Все опухоли были патологически диагностированы как аденокарцинома. Тридцать пять (28,5%) из них относились к тубулярному типу, а 88 (71,5%) — к нетубулярному типу, что позволяет предположить, что аденокарцинома, которая была потенциально инвазивной по своей природе, была доминирующей на стадии IV. Число пациентов Т4 составило 82 (66,7%), пациентов N3 — 67 (54,5%). Отдаленные метастазы, определяемые с помощью H, P и CY, насчитывали 46 (37,4%), 62 (50,4%) и 39 (45,3%) пациентов соответственно. Число пациентов с CY1 меньше, чем P1, кажется странным, но этот феномен можно объяснить, если понять фактическую цитологию перитонеального лаважа (CY), проводимую после операции.Согласно обзору диаграммы, CY был рутинным для пациентов P0 (n = 61), и среди них 14 были CY1. Остальные пациенты (n = 62) были P1, CY не был рутинной процедурой. Общее количество пациентов с CY составило 86, 25 пациентов были P1 и, естественно, достаточно CY1. Таким образом, сумма 14 пациентов (P0CY1) и 25 пациентов (P1CY1) составила общее количество пациентов с CY1 (n = 39). Если мы рассмотрим всех пациентов P1 как CY1, количество CY1 будет в сумме до 76 вместо 39, причем CY1 будет больше, чем P1. Остальные M насчитали 55 (44.7%) пациентов, и все они были результатом обширного поражения лимфатических узлов, которое можно классифицировать как M (LYM). Медиана CEA и CA19-9 составляла 6,05 нг / мл и 15,5 нг / мл соответственно.
Таблица 1
Клинико-патологические особенности пациентов с раком желудка IV стадии.
показывает блок-схему лечения, проводимого пациентам с IV стадией. Оперативное вмешательство выполнено 78 пациентам. Из них 37 пациентам была проведена редукционная операция, а 41 пациенту — паллиативная операция.Решение о резекции первичной опухоли было поручено хирургической бригаде по лапаротомии. Тринадцать пациентов не получали послеоперационную химиотерапию в основном из-за ухудшения их работоспособности. Другие все-таки хотели получить наилучшую поддерживающую терапию. Тридцать восемь пациентов не подвергались хирургическому вмешательству, получали только химиотерапию или получали наилучшую поддерживающую терапию (n = 7). Химиотерапия проводилась по схеме S-1 (n = 99). Среди них пациенты только с S-1 или в комбинации с CDDP, таксанами и CPT11 были 45, 45, 8 и 1 соответственно ().
Блок-схема 123 пациентов.
Таблица 2
Данные лечения пациентов
Одномерный анализ прогностических факторов общей выживаемости приведен в. Возраст (70 или больше по сравнению с младше 70; P = 0,03), работоспособность (PS2 или больше по сравнению с PS0 или 1; P < 0,01), метастазы в печень (h2 по сравнению с H0; P = 0,02), другие M (положительный результат против отрицательного; P < 0,01), CA19-9 (37 нг / мл или более по сравнению с менее чем 37 нг / мл; P < 0.01), редукционная операция (нерезекция по сравнению с резекцией; P < 0,01), химиотерапия (Нет против Да; P < 0,01) оказались значимыми прогностическими факторами для общей выживаемости. Как также указано в, PS, другие M, восстановительная хирургия и химиотерапия были рассчитаны как независимые прогностические факторы. Принимая во внимание эти результаты, кривая выживаемости подгруппы пациентов со стадией IV (, т. Е. , лучшие пациенты с PS без других M), перенесших операцию по уменьшению хирургии плюс системная химиотерапия, показала значительно лучшую кривую выживаемости, чем те, у которых отсутствует какая-либо из этих 4 благоприятных переменных. ().
Кривые выживаемости пациентов с раком желудка IV стадии, перенесших как редукционную операцию, так и химиотерапию. Сплошная линия представляет пациентов с определенными M (H, P и CY). Пунктирная линия представляет пациентов с другими М, как описано в тексте.
Таблица 3
Одномерный и многофакторный анализ
Обсуждение
В этом исследовании мы ясно продемонстрировали, что в условиях проведения как редукционной хирургии, так и системной химиотерапии пациенты стадии IV с хорошими факторами PS и M, ограниченными в пределах h2, P1, и CY1 может значительно продлить выживаемость.Проведение редукционной хирургии и системной химиотерапии для пациентов с плохим прогнозом кажется слишком агрессивным, когда комплексная стратегия лечения еще не определена. Таким образом, стратегия лечения пациентов с раком желудка IV стадии всегда является спорным вопросом в клинической практике из-за их плохого прогноза. Однако наши результаты могут быть хорошей новостью для этих пациентов. Более того, это может быть краеугольным камнем для оптимальной стратегии лечения будущих пациентов с раком желудка IV стадии. Насколько нам известно, мы первые пришли к выводу, что определенная подгруппа пациентов со стадией IV может получить пользу от проведения как редукционной хирургии, так и химиотерапии.
Варианты лечения пациентов с раком желудка IV стадии ограничены, поскольку распространение болезни далеко выходит за пределы ее происхождения. Согласно данным JGCA, кумулятивная 5-летняя выживаемость пациентов со стадией IV составила 15,3%, 2 и корейские данные также показали аналогичные результаты с 18%. 3 Более того, среди всех пациентов со стадией IV от 4% до 9% из них считаются слишком продвинутыми и не имеют шансов на излечивающую операцию, и их прогноз абсолютно плохой: менее 10% через 3 года после постановки диагноза. 16
JGCA предлагает расширенное хирургическое или паллиативное хирургическое вмешательство в качестве клинической практики и восстановительное хирургическое вмешательство в качестве клинического исследования для пациентов со стадией IV (пациенты T4 и N3 классифицируются как стадия IV в этом предложении). В предшествующих литературных источниках было доказано, что, когда стадия IV диагностируется только по одному М-фактору, выполнение резекции может продлить выживаемость. 17–22 Таким образом, удаление первичной опухоли возможно, даже если сегодня доступна химиотерапия.
S-1 занял лидирующую позицию в качестве стандартного противоопухолевого средства для лечения рака желудка.Вместе с другими агентами, такими как CDDP, CPT-11 и таксаны (паклитаксел и доцетаксел), скорость ответа на химиотерапию резко улучшилась. Они обеспечили лучший прогноз для пациентов со стадией IV. 9–11 S-1 с CDDP, как было доказано, имеет высокую частоту ответа и выбран в качестве химиотерапии первой линии. 12
Испытания адъювантной химиотерапии против распространенного рака желудка показали многообещающие результаты. 23,24 С другой стороны, химиотерапия не влияет на выживаемость пожилых людей. 25 Тем не менее, только S-1 можно безопасно использовать для пожилых и бедных пациентов с PS, каковыми являются большинство пациентов с IV стадией. 26,27 В последнее время обсуждались параметры неоадъювантной химиотерапии, чтобы дать адекватное количество противоопухолевого агента и, если возможно, снизить уровень неизлечимой опухоли для выполнения операции R0. Европейская группа недавно сообщила, что хирургическое вмешательство R0 увеличилось, но не повлияло на общую выживаемость. 28 Кочи и его коллеги сообщили об эффективности неоадъювантного S-1 + CDDP. 29 Прежде чем какие-либо окончательные результаты будут получены в результате хорошо организованных исследований, мы должны быть осторожны при внедрении неоадъювантной химиотерапии в клинических условиях.
В этом исследовании наша стратегия лечения пациентов была не чем иным, как основанной на практике, и решение о том, сначала оперировать или начинать химиотерапию, не было выбрано случайным образом. Мы всегда старались обеспечить хирургическое лечение не только для улучшения онкологического исхода, но и для устранения дискомфортных желудочно-кишечных симптомов, вызванных опухолью, часто описываемой как GOS.Более того, обеспечение прохождения хирургическим путем может способствовать достижению лучшего соответствия лечению S-1 наряду с увеличением пероральной диеты. Если у пациентов была сильная воля начать химиотерапию, а не операцию, мы уважали их решение и без промедления выполняли его.
Тем не менее, 13 пациентов, перенесших операцию в качестве начального лечения, не смогли перейти на химиотерапию. Некоторые потеряли желание продолжать лечение, некоторым не удалось улучшить или сохранить свой статус, а некоторым пришлось перейти на лучшую поддерживающую терапию.В некотором смысле, эти 13 пациентов могли воспользоваться только преимуществом уменьшения неблагоприятных желудочно-кишечных симптомов, вызванных опухолью. Но с точки зрения качества жизни это можно считать правильным выбором для них. Состояние пациентов и их воля могут измениться во время курса лечения, и мы должны проявлять гибкость при любых обстоятельствах при принятии решений.
Как показано на кривой выживаемости в, мы ясно продемонстрировали, что независимо от порядка лечения, если проводятся как восстановительная операция, так и химиотерапия, мы можем улучшить прогноз для определенных пациентов стадии IV, то есть пациентов с диагнозом IV стадии с диагнозом H, P и CY (с резервированием).Следовательно, мы не должны медлить с проведением как редукционной хирургии, так и системной химиотерапии, если пациент PS чувствует себя достаточно хорошо. Более того, для достижения этого результата не требовалось специальной стратегии лечения метастазов. Наше исследование исключило M (LYM) из благоприятного фактора, согласно которому метастазирование в расширенные лимфатические узлы действительно является неблагоприятным фактором для пациентов со стадией IV.
Настоящее исследование было основано на небольшом количестве данных, полученных ретроспективно в одном учреждении в Японии. Хотя степень заболевания не позволяет нам проводить проспективные исследования, наши результаты могут быть рационализированы и подтверждены в более крупном рандомизированном контрольном исследовании.Это выходит за рамки цели данного исследования, но с клинической точки зрения очень интересно выяснить порядок лечения или когда переходить к хирургическому вмешательству после неоадъювантной химиотерапии. Эти вопросы могут быть прояснены в будущем рандомизированном контрольном исследовании.
Благодарности
Авторы хотели бы поблагодарить профессора Томоюки Кавада из Медицинской школы Ниппон за его помощь в проведении статистического анализа.
Ссылки
1. Ферлей Дж., Шин Х. Р., Брей Ф., Форман Д., Мазерс С., Паркин Д. М..Оценки мирового бремени онкологических заболеваний в 2008 г .: GLOBOCAN 2008. Int J Cancer . 2010. 127 (12): 2893–2917. [PubMed] [Google Scholar] 2. Нашимото А., Акадзава К., Исобе Ю., Мияширо И., Катай Х., Кодера Ю. и др. Лечение рака желудка в 2002 году в Японии: годовой отчет общенационального реестра JGCA за 2009 год. Рак желудка . 2013; 16 (1): 1-27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Ли ХК, Ян ХК, Ким У.Х., Ли КЮ, Чхве К.Дж., Ким ДжП. Влияние количества исследованных лимфатических узлов на стадию рака желудка. руб. J Surg . 2001. 88 (10): 1408–1412. [PubMed] [Google Scholar] 4. Сано Т., Айко Т. Новые японские классификации и рекомендации по лечению рака желудка: пересмотренные концепции и основные пересмотренные положения. Рак желудка . 2011; 14 (2): 97–100. [PubMed] [Google Scholar] 5. Японская ассоциация рака желудка. Японское руководство по лечению рака желудка, 2010 г. (версия 3) Рак желудка . 2011. 14 (2): 113–123. [PubMed] [Google Scholar] 6. Собин LH, Gospodarowicz M, Wittelkind C, редакторы.Международный союз борьбы с раком. TNM Классификация злокачественных опухолей . 7-е изд. Нью-Йорк, Нью-Йорк: Уайли-Блэквелл; 1516 Н. Лейк-Шор Драйв, Чикаго, Иллинойс 60610 США: 2009. С. 84–95. В. ред. [Google Scholar] 7. Японская ассоциация рака желудка. Японская классификация рака желудка, 2-е английское издание. Рак желудка . 1998. 1 (1): 10–24. [PubMed] [Google Scholar] 8. Окен М.М., Крич Р.Х., Торми Д.К., Хортон Дж., Дэвис Т.Э., Макфадден Е.Т. и др. Критерии токсичности и ответа Восточной совместной онкологической группы. Ам Дж. Клин Онкол . 1982. 5 (6): 649–655. [PubMed] [Google Scholar] 9. Sakata Y, Ohtsu A, Horikoshi N, Sugimachi K, Mitachi Y, Taguchi T. Исследование поздней фазы II нового перорального противоракового препарата фторпиримидина S-1 (1 M тегафур-0,4 M гиместат-1 M отастат калия) у пациентов с запущенным раком желудка . евро J Рак . 1998. 34 (11): 1715–1720. [PubMed] [Google Scholar] 10. Коидзуми В., Курихара М., Накано С., Хасегава К. Исследование фазы II S-1, нового перорального производного 5-фторурацила, при распространенном раке желудка. Онкология . 2000. 58 (8): 191–197. [PubMed] [Google Scholar] 11. Maehara Y. S-1 при раке желудка: всесторонний обзор. Рак желудка . 2003; 6 ((приложение 1)): 2–8. [PubMed] [Google Scholar] 12. Коидзуми В., Нарахара Х., Хара Т., Такагане А., Акия Т., Такаги М. и др. Рандомизированное исследование фазы III одного S-1 в сравнении с S-1 + цисплатином в лечении распространенного рака желудка (исследование SPIRITS). SPIRITS: S-1 плюс цисплатин против S-1 в РКИ по лечению рака желудка. Ланцет Онкол .2008. 9 (3): 215–221. [PubMed] [Google Scholar] 13. Такиучи Х., Нарахара Х., Цудзинака Т., Гото М, Кавабе С., Катсу К. и др. Фаза I исследования S-1 в сочетании с иринотеканом (CPT-11) у пациентов с распространенным раком желудка (OGSG 0002) Jpn J Clin Oncol . 2005. 35 (1): 520–525. [PubMed] [Google Scholar] 14. Фудзитани К., Нарахара Х., Такиучи Х., Цудзинака Т., Сатоми Э., Гото М. и др. Фаза I и фармакокинетическое исследование S1 в сочетании с еженедельным введением паклитаксела у пациентов с распространенным раком желудка. Онкология .2005. 69 (5): 414–420. [PubMed] [Google Scholar] 15. Ёсида К., Ниномия М., Такакура Н., Хирабаяси Н., Такияма В., Сато Ю. и др. Фаза II исследования комбинированной терапии доцетакселом и S-1 при запущенном или рецидивирующем раке желудка. Clin Cancer Res . 2006. 12 (11): 3402–3407. [PubMed] [Google Scholar] 16. Регистрационный комитет Японской ассоциации рака желудка. Рак желудка лечили в 1991 году в Японии: анализ данных общенационального регистра. Рак желудка . 2006. 9 (2): 51–66. [PubMed] [Google Scholar] 17.Bozzetti F, Bonfanti G, Audisio RA, Doci R, Dossena G, Gennari L и др. Прогноз пациентов после паллиативных хирургических вмешательств по поводу рака желудка. Хирургический гинекологический акушерский аппарат . 1987. 164 (2): 151–154. [PubMed] [Google Scholar] 18. Кикучи С., Араи Й., Морисе М., Кобаяши Н., Цукамото Х., Симао Х. и др. Рак желудка с метастазами в отдаленную брюшину: хирургический стаж 20 лет. Гепатогастроэнтерология . 1998. 45 (22): 1183–1188. [PubMed] [Google Scholar] 19. Кога С., Кавагути Х., Кисимото Х., Танака К., Мияно Й., Кимура О. и др.Терапевтическое значение неоперационной гастрэктомии при раке желудка с метастазами в печень. Am J Surg . 1980. 140 (3): 356–359. [PubMed] [Google Scholar] 20. Хартгринк Х. Х., Путтер Х., Кляйн Краненбарг Э., Боненкамп Дж. Дж., Ван де Вельде С. Джей. Голландская группа рака желудка. Значение паллиативной резекции при раке желудка. руб. J Surg . 2002. 89 (11): 1438–1443. [PubMed] [Google Scholar] 21. Боненкамп Дж. Дж., Сасако М., Херманс Дж., Ван де Вельде С. Дж.. Опухолевая нагрузка и паллиативное хирургическое вмешательство при раке желудка. Гепатогастроэнтерология . 2001. 48 (44): 1219–1221. [PubMed] [Google Scholar] 22. Maekawa S, Saku M, Maehara Y, Sadanaga N, Ikejiri K, Anai H и др. Хирургическое лечение распространенного рака желудка. Гепатогастроэнтерология . 1996. 43 (7): 178–186. [PubMed] [Google Scholar] 23. Сакурамото С., Сасако М., Ямагути Т., Киношита Т., Фуджи М., Нашимото А. и др. Адъювантная химиотерапия рака желудка с S-1, пероральным фторпиримидином. N Engl J Med . 2007. 357 (18): 1810–1820.[PubMed] [Google Scholar] 24. Макдональд Дж. С., Смолли С. Р., Бенедетти Дж., Хундал С. А., Эстес Н. С., Стеммерманн Г. Н. и др. Химиолучевая терапия после хирургического вмешательства по сравнению с хирургическим вмешательством при аденокарциноме желудка или пищеводно-желудочного перехода. N Engl J Med . 2001. 345 (10): 725–730. [PubMed] [Google Scholar] 25. Эндо С., Йошикава Ю., Хатанака Н., Томинага Х., Симидзу Й., Хираока К. и др. Лечение рака желудка у пожилых пациентов. Рак желудка . 2011. 14 (2): 139–143.[PubMed] [Google Scholar] 26. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Безопасность и эффективность монотерапии S-1 у пожилых пациентов с распространенным раком желудка. Рак желудка . 2010. 13 (4): 245–250. [PubMed] [Google Scholar] 27. Цусима Т., Хиронака С., Боку Н., Мачида Н., Ямадзаки К., Ясуи Х. и др. Сравнение безопасности и эффективности монотерапии S-1 и терапии S-1 плюс цисплатин у пожилых пациентов с распространенным раком желудка. Инт Дж. Клин Онкол .2013; 18 (1): 10–16. [PubMed] [Google Scholar] 28. Schuhmacher C, Gretschel S, Lordick F, Reichardt P, Hohenberger W, Eisenberger CF и др. Неоадъювантная химиотерапия в сравнении с хирургией только при местнораспространенном раке желудка и кардии: рандомизированное исследование Европейской организации по исследованию и лечению рака, 40954. J Clin Oncol . 2010. 28 (35): 5210–5218. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Кочи М., Фудзи М., Канамори Н., Кайга Т., Такахаши Т., Кобаяши М. и др. Неоадъювантная химиотерапия с S-1 и CDDP при распространенном раке желудка. J Cancer Res Clin Oncol . 2006. 132 (12): 781–785. [PubMed] [Google Scholar] 30. Японская классификация рака желудка. Японская ассоциация рака желудка. 2011. 14 (2): 101–112. 3-е английское издание. Рак желудка . [PubMed] [Google Scholar]выживших при раке желудка | Исследования рака, Великобритания
Выживание зависит от многих факторов. Никто не может сказать вам точно, как долго вы проживете.
Это общая статистика, основанная на больших группах людей.Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам дополнительную информацию о вашем собственном прогнозе. Вы также можете поговорить об этом с медсестрами отдела исследования рака Великобритании по бесплатному телефону 0808 800 4040 с 9 до 17 часов с понедельника по пятницу.
Выживаемость по стадиям
В Великобритании нет доступных статистических данных по выживаемости при раке желудка по стадиям.
Статистика выживаемости доступна для каждой стадии рака желудка в Англии.Эти цифры относятся к людям, диагностированным в период с 2013 по 2017 год.
Имейте в виду, что в этой статистике не учитывается, какое лечение получали люди.
1 этап
65 из 100 человек (65%) с раком желудка 1 стадии переживут рак в течение 5 или более лет после постановки диагноза.
2 этап
Около 35 из 100 человек (около 35%) с раком желудка 2 стадии переживут рак в течение 5 или более лет после постановки диагноза.
3 этап
Около 25 из 100 человек (около 25%) с раком желудка 3 стадии переживут рак в течение 5 или более лет после постановки диагноза.
4 этап
Статистические данные о 5-летней выживаемости при раке 4 стадии отсутствуют. Это связано с тем, что, к сожалению, большинство людей не живут так долго после постановки диагноза.
Управление национальной статистики предоставляет статистические данные о годовой выживаемости людей с раком желудка 4 стадии.
( Пожалуйста, запомните , это не означает, что вы проживете только 1 год. Это относится к количеству людей, которые еще живы через 1 год после того, как им поставили диагноз рака. Некоторые из этих людей могут жить дольше 1 года.)
Около 20 из 100 человек (около 20%) с раком желудка 4 стадии переживут рак в течение 1 года или более после постановки диагноза.
Выживаемость рака по стадиям на момент диагностики для Англии, 2019
Управление национальной статистики
Эти статистические данные относятся к чистой выживаемости.Чистая выживаемость оценивает количество людей, переживших рак, а не подсчитывает количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость онкологических больных с учетом фоновой смертности, которую они испытали бы, если бы у них не было рака.
Выживаемость при раке желудка на всех стадиях
Для людей с раком желудка в Англии:
- более 45 человек из 100 (более 45%) переживут рак в течение 1 года или более
- более 20 человек из 100 (более 20%) переживут рак в течение 5 лет или более
- более 15 из 100 человек (более 15%) переживут рак в течение 10 и более лет
Выживаемость рака по стадиям на момент диагностики для Англии, 2019
Управление национальной статистики
Эти статистические данные относятся к чистой выживаемости.Чистая выживаемость оценивает количество людей, переживших рак, а не подсчитывает количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
Что влияет на выживаемость
Ваш прогноз зависит от стадии рака, когда он был диагностирован. Это означает, насколько он велик и распространился ли он.
Тип рака и степень злокачественности раковых клеток также могут повлиять на вашу выживаемость. Степень означает, насколько ненормально клетки выглядят под микроскопом.
Ваше общее состояние здоровья и физическая форма также влияют на выживаемость. Чем лучше вы станете, тем лучше вы сможете справиться с раком и лечиться.
Об этой статистике
Термины 1 год выживания и 5 лет не означают, что вы проживете только 1 или 5 лет.
Информацию собирают Управление национальной статистики (УНС) и исследователи.Они наблюдают, что происходит с людьми, больными раком, через годы после постановки диагноза. 5 лет — это обычная временная точка для измерения выживаемости. Но некоторые люди живут намного дольше этого.
5-летняя выживаемость — это количество людей, которые не умерли от рака в течение 5 лет после постановки диагноза.
Дополнительная статистика
Для получения более подробной информации о выживаемости и раке желудка перейдите в раздел «Статистика рака».
Хирургическое лечение рака желудка IV стадии: стоит ли?
1.Блот WJ, Девеса SS, Кнеллер RW FJJ. Рост заболеваемости аденокарциномой пищевода и кардии желудка. JAMA 1991; 265: 1287-9.
DOIPubMed2. Сигель Р., Миллер К., Джемаль А. Статистика рака, 2017. CA Cancer J Clin 2017; 67: 7-30.
DOIPubMed3. Национальный институт рака — Программа надзора, эпидемиологии и конечных результатов. SEER * Stat Databases: ноябрь 2015 г. Доступно по адресу: https://seer.cancer.gov/data/seerstat/nov2015/. [Последний доступ 27 февраля 2018 г.].
4. Шин А., Ким Дж., Пак С. Эпидемиология рака желудка в Корее. J Рак желудка 2011; 11: 135-40.
DOIPubMedPMC5. Кемп С.Д., Китано М., Керкар С., Рипли Р.Т., Марквардт Ю.Ю., Шрамп Д.С., Авиталь И. Резекция легочной артерии при метастатическом раке желудка. Дж. Торак Онкол 2010; 5: 1796-805.
DOIPubMed6. Спольверато Дж., Эджаз А., Ким Й., Сквайрз М. Х., Поултсайдс Г. А., Филдс Р. К., Шмидт С., Вебер С. М., Вотанопулос К., Майтель С. К., Павлик Т. М.. Частота и характер рецидивов после резекции с целью лечения рака желудка: мультиинституциональный анализ США.J Am Coll Surg 2014; 219: 664-75.
DOIPubMed7. Deng J, Liang H, Wang D, Sun D, Pan Y, Liu Y. Исследование рецидивов рака желудка после лечебной резекции. Surg Today 2011; 41: 210-5.
DOIPubMed8. Nio Y, Koike M, Omori H, Hashimoto K, Itakura M, Yano S, Higami T., Maruyama R. Рандомизированное согласованное исследование неоадъювантной химиотерапии тегафуром плюс урацилом (UFT) при раке желудка — единое исследование института. Anticancer Res 2004; 24: 1879-87.
PubMed9. Кодера Ю., Сано Т. Японское руководство по лечению рака желудка, 2014 г. (вер. 4). Рак желудка 2017; 20: 1-19.
DOIPubMedPMC10. Ajani JA, D’Amico TA, Almhanna K, Bentrem DJ, Chao J, Das P, Denlinger CS, Fanta P, Farjah F, Fuchs CS, Gerdes H, Gibson M, Glasgow RE, Hayman JA , Hochwald S, Hofstetter WL, Ilson DH, Jaroszewski D, Johung KL, Keswani RN, Kleinberg LR, Korn WM, Leong S, Linn C, Lockhart AC, Ly QP, Mulcahy MF, Orringer MB, Perry KA, Poultsides GA, Scott WJ, Strong VE, Вашингтон MK, Weksler B, Willett CG, Wright CD, Zelman D, McMillian N, Sundar H.Рак желудка, версия 3.2016, Руководство NCCN по клинической практике в онкологии. J Natl Compr Canc Netw 2016; 14: 1286-312.
DOIPubMed11. Кодера Ю., Фудзитани К., Фукусима Н., Ито С., Муро К., Охаши Н., Йошикава Т., Кобаяси Д., Танака С., Фудзивара М. Хирургическая резекция метастазов в печень от рака желудка: обзор и новое рекомендация в японских рекомендациях по лечению рака желудка. Рак желудка 2014; 17: 206-12.
DOIPubMed12. AJCC. Руководство по стадированию рака, 7-е издание.Нью-Йорк: Спрингер-Верлаг; 2010.
13. AJCC. Руководство по стадированию рака, 8-е издание. Нью-Йорк: Спрингер-Верлаг; 2016.
14. AJCC. Руководство по стадированию рака, 6-е издание. Нью-Йорк: Спрингер-Верлаг; 2003.
15. Сано Т., Кодера Ю. Японская классификация рака желудка: 3-е английское издание. Рак желудка 2011; 14: 101-12.
DOIPubMed16. Bosman FT, Carneiro F, Hruban RH, Theise ND. Классификация ВОЗ опухолей пищеварительной системы.Лион: IARC Press; 2010.
17. Ху Б., Эль-Хадж Н., Ситтлер С., Ламмерт Н., Барнс Р., Мелони-Эриг А. Рак желудка: классификация, гистология и применение молекулярной патологии. Журнал Гастроинтест Онкол 2012; 3: 251-61.
PubMedPMC18. Пэк Х.Ю., Ким С.Б., Чо Э.Х., Джин Ш., Ю ХДЖ, Ли Джи, Бан Х.Й., Лим К.С. Резекция печени при метастазах аденокарциномы желудка в печень. J Рак желудка 2013; 13: 86-92.
DOIPubMedPMC19. Чен Л., Сун М.К., Линь Х.З., Хао Л.Х., Цзян XJ, Ли Цзы, Чен YX.Химиотерапия и резекция рака желудка с синхронными метастазами в печень. Мировой журнал J Gastroenterol 2013; 19: 2097-103.
DOIPubMedPMC20. Cheon SH, Rha SY, Jeung HC, Im CK, Kim SH, Kim HR, Ahn JB, Roh JK, Noh SH, Chung HC. Выживаемость комбинированной лечебной резекции желудка (резекция D2) и печени у пациентов с раком желудка с метастазами в печень. Энн Онкол 2008; 19: 1146-53.
DOIPubMed21. Dittmar Y, Altendorf-Hofmann A, Rauchfuss F, Götz M, Scheuerlein H, Jandt K, Settmacher U.Резекция метастазов в печени полезна для пациентов с раком желудка: отчет о 15 случаях и обзор литературы. Рак желудка 2012; 15: 131-6.
DOIPubMed22. Гаранчини М., Уггери Ф., Деграте Л., Несполи Л., Джанотти Л., Несполи А., Уггери Ф., Романо Ф. Хирургическое лечение метастазов рака желудка в печень: стоит ли местное лечение системного заболевания? Е.П.Б. 2012; 14: 209-15.
DOIPubMedPMC23. Киношита Т., Киношита Т., Сайура А., Эсаки М., Сакамото Х., Яманака Т.Многоцентровый анализ отдаленных результатов хирургической резекции метастазов рака желудка в печень. Br J Surg 2015; 102: 102-7.
DOIPubMed24. Koga R, Yamamoto J, Ohyama S, Saiura A, Seki M, Seto Y, Yamaguchi T. Резекция печени при метастатическом раке желудка: опыт с 42 пациентами, включая восемь выживших в течение длительного периода времени. Jpn J Clin Oncol 2007; 37: 836-42.
DOIPubMed25. Комеда К., Хаяси М., Кубо С., Нагано Х., Накай Т., Кайбори М., Вада Х, Такемура С., Киношита М., Кога С., Мацумото М., Сакагути Т., Иноуэ Y, Хирокава Ф., Квон. AH, Учияма К.Высокая выживаемость у пациентов, прооперированных по поводу небольших изолированных метастазов рака желудка в печени: мультиинституциональное исследование. World J Surg 2014; 38: 2692-7.
DOIPubMed26. Li S, Lee C, Hung C., Wu J, Chen J. Хирургическая резекция метахронных метастазов в печень при раке желудка улучшает долгосрочную выживаемость: популяционное исследование. PLoS One 2017; 12: 1-10.
DOI27. Лю Дж., Ли Дж. Х., Чжай Р. Дж., Вэй Б., Шао М. З., Чен Л. Прогностические факторы, улучшающие выживаемость после хирургического лечения желудка и печени у пациентов с раком желудка с синхронными метастазами в печень.Чин Мед Ж. 2012; 125: 165-71.
28. Макино Х., Кунисаки С., Изумисава Ю., Токухиса М., Осима Т., Нагано И., Фуджи С., Кимура Дж., Такагава Р., Косака Т., Оно Х.А., Акияма Х., Танака К., Эндо I. Показания для резекция печени при лечении метастазов в печень при раке желудка. Anticancer Res 2010; 30: 2367-76.
PubMed29. Мики Ю., Фудзитани К., Хирао М., Курокава Ю., Мано М., Цуджи М., Миямото А., Накамори С., Цудзинака Т. Значение хирургического лечения метастазов в печень от рака желудка.Anticancer Res 2012; 32: 665-70.
PubMed30. Мориз З, Сугиока А., Хошимото С., Като Т., Икеда М., Уяма И., Хоригучи А., Миякава С. Роль гепатэктомии у пациентов с метастазами рака желудка в печень. Гепатогастроэнтерология 2008; 55: 1238-4.
PubMed31. Номура Т., Камио Ю., Такасу Н., Мория Т., Такешита А., Мизутани М., Хачия О., Хираи И., Кимура В. Внутрипеченочные микрометастазы вокруг метастазов рака желудка в печень. J. Hepatobilary Pancreat Surg 2009; 16: 493-501.
DOIPubMed32. Цю Дж.Л., Дэн М.Г., Ли В., Цзоу Р.Х., Ли Б.К., Чжэн И, Лаосский М., Чжоу К., Юань Ю.Ф. Резекция печени при синхронном метастазировании в печень при раке желудка. Eur J Surg Oncol 2013; 39: 694-700.
DOIPubMed33. Roh H, Suh K, Lee H, Yang H, Choe K, Lee K. Результат резекции печени по поводу метастатического рака желудка. Am Surg 2005; 71: 95-9.
PubMed34. Сакамото Ю., Охьяма С., Ямамото Дж., Ямада К., Секи М., Охта К.И., Кокудо Н., Ямагути Т., Муто Т., Макуучи М.Хирургическая резекция метастазов рака желудка в печень: анализ 17-летнего опыта с 22 пациентами. Хирургия 2003; 133: 507-11.
DOIPubMed35. Сакамото Ю., Сано Т., Шимада К., Эсаки М., Сака М., Фукагава Т., Катай Н., Косуге Т., Сасако М. Благоприятные показания для гепатэктомии у пациентов с метастазами в печень из-за рака желудка. J Surg Oncol 2007; 95: 534-9.
DOIPubMed36. Такемура Н., Сайура А., Кога Р., Арита Дж., Йошиока Р., Оно Y, Хики Н., Сано Т., Ямамото Дж., Кокудо Н., Ямагути Т.Отдаленные результаты хирургической резекции метастазов рака желудка в печень: анализ 64 макроскопически полных резекций. Langenbecks Arch Surg 2012; 397: 951-7.
DOIPubMed37. Телен А., Йонас С., Бенкерт С., Лопес-Ханнинен Э, Нойман У., Рудольф Б., Шумахер Г., Нойхаус П. Резекция печени при метастатическом раке желудка. Eur J Surg Oncol 2008; 34: 1328-34.
DOIPubMed38. Tiberio GAM, Baiocchi GL, Morgagni P, Marrelli D, Marchet A, Cipollari C, Graziosi L, Ministrini S, Vittimberga G, Donini A, Nitti D, Roviello F, Coniglio A., de ManzoniРак желудка и синхронные метастазы в печень: можно ли распознать кандидатов на резекцию R0? Энн Сург Онкол 2015; 22: 589-96.
DOIPubMed39. Цудзимото Х., Ичикура Т., Оно С., Сугасава Х., Хираки С., Сакамото Н., Ягути Ю., Хацусе К., Ямамото Дж., Хасе К. Результаты для пациентов после резекции печени метастатических опухолей рака желудка. Hepatol Int 2010; 4: 406-13.
DOIPubMedPMC40. Вигано Л., Веллоне М., Ферреро А., Джулианте Ф., Нуццо Дж., Капуссотти Л.Резекция печени при метастазах рака желудка. Гепатогастроэнтерология 2013; 60: 557-62.
PubMed41. Ван Ян, Шен К.Т., Лин JQ, Гао XD, Хоу YY, Ван XF, Цинь Дж, Сунь YH, Цинь XY. Прогностический анализ комбинированной лечебной резекции поражений желудка и печени у 30 больных раком желудка с синхронными метастазами в печень. BMC Surg 2012; 12:20.
DOIPubMedPMC42. Wang W, Liang H, Zhang H, Wang X, Xue Q, Zhang R. Прогностическое значение радикального хирургического лечения пациентов с раком желудка с синхронными метастазами в печень.Мед Онкол 2014; 31: 1-8.
DOIPubMed43. Zacherl J, Zacherl M, Scheuba C., Steininger R, Wenzl E, Mühlbacher F, Jakesz R, Längle F. Анализ резекции печени метастазов, происходящих от аденокарциномы желудка. J Gastrointest Surg 2002; 6: 682-9.
DOI44. Шионо С., Сато Т., Хорио Х., Чида М., Мацугума Х., Озеки Й., Накадзима Дж., Окумура С. Результаты и прогностические факторы выживаемости после резекции легкого по поводу метастатического рака желудка. Eur J Cardiothorac Surg 2013; 43: e13-6.
DOIPubMed45. Йошида Ю., Имакиире Т., Йонеда С., Обучи Т., Инада К., Ивасаки А. Десять случаев резецированных одиночных метастазов в легкие, вызванных раком желудка. Asian Cardiovasc Thorac Ann 2013; 22: 578-82.
DOIPubMed46. Иидзима Й., Акияма Х., Атари М., Фукухара М., Накадзима Й., Киносита Х., Урамото Х. Резекция легочной артерии при метастатическом раке желудка. Ann Thorac Cardiovasc Surg 2016; 22: 230-6.
DOIPubMedPMC47. Кобаяши Ю., Фукуи Т., Ито С., Шитара К., Ито С., Хатука С., Мицудоми Т.Легочная метастазэктомия при раке желудка: 13-летний опыт работы в одном учреждении. Surg Today 2013; 43: 1382-9.
DOIPubMed48. Ли Ц, Ян М., Чен Дж, Сян М., Чжу З. Г., Инь Х. Р., Линь Ю. З. Выживаемость неизлечимой гастрэктомии у пациентов с раком желудка с синхронными отдаленными метастазами. Журнал Gastrointest Surg 2010; 14: 282-8.
DOIPubMed49. Ко KJ, Шим JH, Yoo HM, Il SO, Jeon HM, Park CH, Jeon DJ, Song KY. Клиническая ценность неизлечимой резекции желудка с последующей химиотерапией.Мировой журнал J Surg 2012; 36: 1800-5.
DOIPubMed50. Хартгринк Х. Х., Путтер Х., Кляйн Краненбарг Э., Боненкамп Дж. Дж., Ван де Вельде С. Дж. Х. Значение паллиативной резекции при раке желудка. Br J Surg 2002; 89: 1438-43.
DOIPubMed51. Саиди Р.Ф., Ремайн С.Г., Дудрик П.С., Ханна Н.Н. Есть ли роль паллиативной гастрэктомии у пациентов с раком желудка IV стадии? World J Surg 2006; 30: 21-7.
DOIPubMed52. Коккола А., Лоухимо Дж., Пуолаккайнен П. Улучшает ли немедикаментозная гастрэктомия выживаемость пациентов с метастатическим раком желудка? Журнал J Surg Oncol 2012; 106: 193-6.
DOIPubMed53. Самарасам I, Чандран Б.С., Ситарам В., Перакат Б., Наир А., Мэтью Г. Паллиативная гастрэктомия при распространенном раке желудка: стоит ли это? ANZ J Surg 2006; 76: 60-3.
DOIPubMed54. Лин С.З., Тонг Х.Ф., Ю Т, Ю ЙДж, Ву В.Дж., Чен С., Чжан В., Е Б, Ли СМ, Чжэнь Ц.К., Сюй Дж.Р., Чжоу Дж.Л. Паллиативная гастрэктомия и химиотерапия при раке желудка IV стадии. J Cancer Res Clin Oncol 2008; 134: 187-92.
DOIPubMed55. Sougioultzis S, Syrios J, Xynos ID, Bovaretos N, Kosmas C, Sarantonis J, Dokou A, Tzivras D, Zografos G, Felekouras E, Papalambros E, Tsavaris N.Паллиативная гастрэктомия и другие факторы, влияющие на общую выживаемость у пациентов с аденокарциномой желудка стадии IV, получающих химиотерапию: ретроспективный анализ. Eur J Surg Oncol 2011; 37: 312-8.
DOIPubMed56. Funakoshi T, Yasui H, Boku N, Fukutomi A, Yamazaki K, Machida N, Todaka A, Tsushima T, Yokota T, Onozawa Y, Kenmotsu H, Endo M. Клинико-патологические особенности и исходы рака желудка Пациенты с карциноматозным лимфангитом легких. Jpn J Clin Oncol 2014; 44: 792-8.
DOIPubMed57. Томфорд Н.Р., Вулнер Л.Б., Клагетт О.Т. Хирургическое лечение метастатических опухолей в легкие. J Thorac Cardiovasc Surg 1965; 49: 357-63.
PubMed58. Fujitani K, Yang HK, Mizusawa J, Kim YW, Terashima M, Han SU, Iwasaki Y, Hyung WJ, Takagane A, Park DJ, Yoshikawa T, Hahn S, Nakamura K, Park CH, Kurokawa Y, Банг YJ, Пак Би Джей, Sasako M, Tsujinaka T16; Исследователи исследования REGATTA. Гастрэктомия плюс химиотерапия по сравнению с одной химиотерапией при распространенном раке желудка с одним неизлечимым фактором (REGATTA): рандомизированное контролируемое исследование фазы 3.Ланцет Онкол 2016; 17: 309-18.
DOI59. Уодделл Т., Чау И., Каннингем Д., Гонсалес Д., Фрэнсис А., Окинс С., Уотерспун А., Сафф С., Миддлтон Дж., Уодсли Дж., Ферри Д., Мансур В., Кросби Т., Коксон Ф., Смит D, Waters J, Iveson T, Falk S, Slater S, Peckitt C, Barbachano Y. Эпирубицин, оксалиплатин и капецитабин с панитумумабом или без него для пациентов с ранее нелеченным распространенным раком пищевода (REAL3): рандомизированная открытая фаза 3 испытание. Ланцет Онкол 2013; 14: 481-9.
DOI60. Банг Ю.Дж., Ван Катсем Э., Фейереислова А., Чунг Х.С., Шен Л., Саваки А., Лордик Ф., Оцу А., Омуро Ю., Сато Т., Априле Г., Куликов Э., Хилл Дж., Лехле М., Рюшофф Дж., Канг Ю.К .; Следователи ToGA. Трастузумаб в сочетании с химиотерапией по сравнению с одной химиотерапией для лечения HER2-положительного распространенного рака желудка или желудочно-пищеводного перехода (ToGA): открытое рандомизированное контролируемое исследование фазы 3. Ланцет 2010; 376: 687-97.
DOI61. Ляо Й.Й., Пэн Н.Ф., Лонг Д., Ю. П.С., Чжан С., Чжун Дж. Х., Ли LQ.Гепатэктомия при метастазах рака желудка в печень: систематический обзор. BMC Surg 2017; 17:14.
DOIPubMedPMC62. Sun J, Song Y, Wang Z, Chen X, Gao P, Xu Y, Zhou B, Xu H. Клиническое значение паллиативной гастрэктомии для выживаемости пациентов с неизлечимым распространенным раком желудка: систематический обзор и метаанализ. BMC Рак 2013; 13: 577.
DOIPubMedPMC63. Krasniqi E, Pellicori S, Formica V. Возникающая роль S-1 при раке желудка. Индийский журнал J Med Paediatr Oncol 2015; 36: 219-28.
DOIPubMedPMCГраницы | Эффективность гастрэктомии с химиолучевой терапией при аденокарциноме желудка IV стадии: популяционный анализ
Введение
Рак желудка (РЖ) — это агрессивный рак и третья по значимости причина смерти от рака во всем мире (1). Поскольку его обычно диагностируют, когда опухоль является местнораспространенной или метастатической, прогноз неблагоприятный. Однако стандартная стратегия лечения метастатического рака желудка остается спорной.Многие клинические испытания доказали, что комбинированная химиотерапия улучшает общую выживаемость (ОВ) и качество жизни при метастатическом раке желудка по сравнению с пациентами, получающими поддерживающую терапию (2, 3). Для пациентов с хорошим общим состоянием текущие практические руководства рекомендуют паллиативную химиотерапию в рекомендациях Европейского общества медицинской онкологии (ESMO) (4) и химиолучевую или системную терапию в рекомендациях Национальной комплексной сети рака (NCCN) (5). Из-за плохого прогноза крайне важно искать инновационные методы или подходящую комбинацию методов лечения.
Значение хирургического вмешательства при метастатическом РЖ остается спорным. Недавно рандомизированное контролируемое исследование REGATTA отрицало эффективность паллиативной гастрэктомии при метастатическом ГК (6). Однако некоторые исследования показали, что многие пациенты с неоперабельными опухолями выживали в течение длительного периода после радикальной резекции после химиотерапии. Лечебная операция после химиотерапии называется конверсионной хирургией. Он определяется как хирургическое лечение, направленное на резекцию R0 после системной терапии изначально неоперабельных опухолей (7).Было показано, что этот подход является потенциальным вариантом для некоторых пациентов с метастатическим GC.
Целью этого популяционного когортного исследования было определение эффективности химиолучевой терапии с резекцией желудка и возможность увеличения выживаемости у пациентов с раком желудка IV стадии.
Материалы и методы
Источник данных
Ретроспективное когортное исследование было проведено с использованием базы данных эпиднадзора, эпидемиологии и конечных результатов (SEER), которая представляет собой популяционный регистр рака, охватывающий ~ 34 человека.6% населения США. В базе данных SEER собраны данные о заболеваемости, распространенности и выживаемости рака из 18 регистров США с 1973 г. (www.seer.cancer.gov). База данных SEER включает данные о демографических характеристиках пациентов, локализации рака, гистологическом типе, стадии, датах постановки диагноза и выживаемости. SEER * Stat версии 8.3.5 использовался для извлечения данных о пациентах. Статус химиотерапии и лучевой терапии (ЛТ) был получен после дополнительной авторизации и сообщил о потенциальной предвзятости, связанной с этими данными (8).
Выбор пациентов
В исследование были включеныпациентов с аденокарциномой желудка, диагностированной в 2010–2015 гг. Гистологически диагностированные случаи были идентифицированы по специальным кодам Международной классификации онкологических заболеваний, 3-е издание (МКБ-О-3), включая 8140/3, 8144/3, 8145/3, 8255/3, 8260/3, 8480. / 3, 8481/3 и 8490/3. В этом исследовании использовались первичные участки с кодами топографии ICD-O-3 от C16.0 до C16.9. Рабочий процесс выбора пациента показан на рисунке 1.Мы выявили 32 008 пациентов 18 лет и старше с раком желудка. Из них 6215 пациентов были исключены, потому что GC не был первоначальным диагнозом, и впоследствии мы также удалили пациентов, которым был поставлен диагноз при вскрытии или в свидетельстве о смерти или у которых отсутствовала исходная информация. Чтобы не допустить ограничения отсутствия записей о лечении, мы включали только пациентов, прошедших как химиотерапию, так и лучевую терапию. Наконец, 249 случаев были включены для дальнейшего анализа.
Рисунок 1 .Блок-схема извлечения данных из базы данных SEER.
Статистический анализ
Для сравнения категориальных переменных использовалоськритериев хи-квадрат. В наблюдательном исследовании можно использовать анализ соответствия баллов склонности, чтобы сбалансировать распределение наблюдаемых исходных ковариат между леченными и нелеченными субъектами и уменьшить систематическую ошибку отбора (9, 10). Применяя сопоставление оценок предрасположенности для корректировки групповых различий в этой когорте, мы сначала использовали демографические параметры, включая возраст, пол, расу, местоположение опухоли, глубину инвазии первичного очага, вовлеченные региональные лимфатические узлы, классификацию Лорен и семейное положение, чтобы создать логистическую схему. регрессионная модель.Затем у каждого пациента был показатель предрасположенности, который использовался для сопоставления между группой CRT с хирургическим вмешательством и группой только CRT (соответствие 1: 1). Средняя продолжительность общей выживаемости измерялась методом Каплана-Мейера. Продолжительность выживания в группе CRT и группе CRT с хирургическим вмешательством сравнивалась с помощью лог-рангового теста. Многовариантные регрессионные модели пропорциональных рисков Кокса были оценены для определения факторов, связанных с выживаемостью. Статистический анализ был выполнен с помощью SPSS, версия 23 (IBM Corporation, Армонк, Нью-Йорк, США) и R, версия 3.5.1 (Фонд R для статистических вычислений, Вена, Австрия. Https://www.R-project.org/). Все статистические тесты были двусторонними, и p <0,05 считалось статистически значимым.
Результаты
Демографические и клинические параметры когорты
С 2010 по 2015 год из базы данных SEER было извлечено 32 008 пациентов с аденокарциномой желудка. Наконец, мы идентифицировали 249 пациентов, которые соответствовали критериям включения (рис. 1). Среди непревзойденной когорты 103 перенесли только CRT, а 146 — CRT с гастрэктомией.Тесты хи-квадрат выявили значительную разницу между двумя группами. По сравнению с группой CRT, в группе CRT с гастрэктомией была более высокая доля пациентов с большим количеством метастазов в лимфатические узлы, особенно для степени N3 (30,82 против 3,88%; p <0,001). Первичный участок поражения был более вероятно расположен в нижней трети желудка в группе CRT с гастрэктомией (22,6 против 5,83; p <0,001) (Таблица 1). Среднее количество регионарных лимфатических узлов, исследованных в группе CRT с гастрэктомией, составило 18.40 ± 13.08. Примерно у 43% пациентов обследовано более 15 лимфатических узлов. По данным о хирургических методах, объем гастрэктомии был классифицирован как полная или частичная / субтотальная гастрэктомия. Информация о отдаленных метастазах представлена в таблице 2. Причины диагностики рака желудка IV стадии разнообразны, включая поражение печени (23,29%), удаленных лимфатических узлов (22,49%), поражение мозга (11,24%), поражение костей (13,65%). и поражение легких (12,05%). Для частичного уменьшения базового дисбаланса между группами был использован анализ с сопоставлением оценок предрасположенности.Наконец, 81 пара пациентов была сгенерирована индивидуальным сопоставлением PSM. Из пациентов, перенесших операцию, 39 (48,15%) и 42 (51,85%) пациентов подверглись тотальной и частичной / субтотальной гастрэктомии соответственно. Подробное сравнение демографических и клинических характеристик несопоставленных и согласованных пациентов показано в Таблице 1.
Таблица 1 . Клинические характеристики пациентов, у которых был диагностирован рак желудка IV стадии, участвовавших в исследовании.
Таблица 2 .Тип отдаленных метастазов в когорте до сопоставления.
Результаты выживания
В непревзойденной когорте средняя общая выживаемость составила 10 месяцев для пациентов в группе CRT по сравнению с 17 месяцами для пациентов в группе CRT с гастрэктомией. Кривые Каплана-Мейера для общей выживаемости показаны на рисунке 2А. Лог-ранговый тест показал, что группа CRT с гастрэктомией имела лучшую общую выживаемость, чем группа только CRT ( p <0,0001). После сопоставления результаты были одинаковыми для двух групп (рис. 2В).В группе CRT с гастрэктомией средняя общая выживаемость была на 13 месяцев больше, чем в группе, получавшей только CRT (22 против 9 месяцев для OS, p <0,0001 лог-ранговый тест).
Рис. 2. (A) Общая выживаемость в соответствии с методами лечения у всех пациентов. (B) Общая выживаемость в соответствии с методами лечения у согласованных пациентов. CRT, химиолучевая терапия.
Оценка факторов прогноза
Многофакторный анализ всех пациентов показал, что операция (HR = 0.23, 95% ДИ 0,14–0,36, p <0,0001) и первичный участок, расположенный в антральном отделе и пилорусе (HR = 1,82, 95% ДИ 1,00–3,30, p = 0,05), были связаны со снижением смертности (Таблица 3) . В 81 парном случае модель пропорциональных рисков Кокса использовалась для оценки прогностических факторов общей выживаемости. Хирургия была единственным независимым прогностическим фактором для OS (HR = 0,31, 95% ДИ 0,21–0,46, p <0,001). Влияние хирургического вмешательства на смертность оставалось значительным с поправкой на возраст, пол, расу, глубину инвазии опухоли, метастазирование в лимфатические узлы и локализацию первичного очага поражения.Подробности показаны на Рисунке 3.
Таблица 3 . Многовариантный регрессионный анализ Кокса, прогнозирующий риск смерти от метастатического GC как в несопоставленных, так и в согласованных когортах.
Рисунок 3 . Лесной график стратифицированного анализа общей выживаемости в подобранной когорте.
Обсуждение
Рак желудка стадии IV остается смертельным заболеванием, а средняя общая выживаемость при метастатическом или неоперабельном ГК составляет ~ 4,6–13,1 месяца, как сообщалось в предыдущих исследованиях (11–13).В этом популяционном анализе средний ОВ составил 14 месяцев, что аналогично тому, что было в предыдущем отчете. Интересно, что наше исследование предоставляет доказательства тесной связи между хирургическим вмешательством и снижением общей смертности у пациентов с метастатическим раком желудка, получавших химиолучевую терапию, в крупном популяционном исследовании. Анализ чувствительности показал, что операция была прогностическим фактором для общей выживаемости как в несопоставленных, так и в согласованных когортах. Рак желудка распространяется главным образом через кровоток или перитонеальное распространение.Чаще всего метастазы попадают в печень и поверхность брюшины. В предыдущих отчетах общая частота метастазов в печень и брюшину составляла 9,9–18,7% и 12,3% соответственно (14, 15). В нашем исследовании частота метастазов в печень составила 15,52%, что аналогично предыдущему исследованию. Однако в базе данных SEER мало информации о других метастазах, особенно о перитонеальных метастазах.
Основная цель лечения стадии IV GC — задержать прогрессирование заболевания и облегчить такие симптомы, как кровоизлияние или непроходимость, связанное с опухолью.Системная терапия является основным методом лечения метастатического рака желудка. Операция проводится только при кровотечении или непроходимости (16). Однако вопрос о том, увеличивает ли добавление гастрэктомии к химиотерапии к выживаемости при метастатическом РЖ, остается спорным. Голландская группа по лечению рака желудка сообщила, что паллиативная резекция может увеличить выживаемость (8,1 против 5,4 месяцев, p <0,001) у пациентов с неизлечимым РЖ, особенно у пациентов моложе 70 лет с одним местом метастазирования (17). .Ретроспективное исследование с участием 288 пациентов также показало, что медиана общей выживаемости составила 12 месяцев и 7,8 месяцев для пациентов с резекцией первичной опухоли и без нее, соответственно ( p <0,001) (18). Леонардо и др. использовали базу данных GIRGC и проанализировали неоперабельные опухоли IV стадии. Эти опухоли стали операбельными после химиотерапии. Дальнейший анализ показал, что этим пациентам может помочь радикальная гастрэктомия. Основным прогностическим фактором у этих пациентов было более одного типа метастатического поражения (HR 4.41, 95% ДИ 1,72–11,3, p = 0,002) (19).
Эти результаты указывают на то, что снижение опухолевой нагрузки коррелировало с пролонгированным ОВ у пациентов с метастатическими ГК. Более того, циркулирующие опухолевые клетки (ЦКО) — это опухолевые клетки, оставшиеся от первичного очага, и они попадают в кровоток. Недавно это стало предметом интереса в клинических исследованиях рака (20). При других солидных опухолях, таких как колоректальный рак (21) и рак яичников (22), уменьшение опухолевой нагрузки было связано с более длительной выживаемостью.Недавние исследования ЦОК при раке желудка предоставляют некоторые доказательства положительного эффекта резекции опухоли, поскольку ОС значительно ниже у пациентов, у которых выявлены ЦОК, чем у пациентов без них (23).
Исследование REGATTA, открытое рандомизированное исследование фазы 3, было разработано для определения значимости гастрэктомии при неоперабельной поздней стадии РЖ, обеспечивая высочайший уровень доказательности по этому вопросу (6). Это исследование продемонстрировало, что резекция желудка с последующей химиотерапией не показала никакого улучшения выживаемости по сравнению с одной химиотерапией.Этот вывод был принят в новой версии японских рекомендаций по лечению рака желудка (16). Редукционная операция не рекомендуется при ГК с одним неизлечимым фактором. Хотя это исследование представляет собой самый высокий уровень доказательности гастрэктомии при метастатическом GC, остаются некоторые ограничения, которые заслуживают обсуждения. Во-первых, это исследование началось в 2008 году. В этом исследовании использовалась схема химиотерапии S-1 плюс цисплатин, которая является стандартным лечением для поздних стадий ГК в Восточной Азии (24).Однако с развитием химиотерапии было показано, что SOX (S-1 плюс оксалиплатин) является предпочтительной схемой с точки зрения профиля безопасности (13). Во-вторых, в группе гастрэктомии в этом исследовании не проводилась ни лимфаденэктомия D2, ни резекция соседнего органа, что свидетельствует о том, что резекция R0 не была достигнута. Лимфаденэктомия D2 долгое время была стандартной процедурой для хирургической операции на поздних стадиях ГК (25). В то же время предыдущие исследования показали, что резекция R0 была значимым независимым предиктором общей выживаемости у пациентов, перенесших конверсионную операцию (26, 27).D2-лимфаденэктомия связана с более высокой послеоперационной смертностью и заболеваемостью, что может иметь негативные последствия для пациентов с IV стадией GC. Тем не менее, резекция R0 важна для продления ОС. Кроме того, при анализе общей выживаемости в подгруппах среднее количество циклов химиотерапии было уменьшено в группе гастрэктомии с химиотерапией по сравнению с группой, получавшей только химиотерапию, у пациентов с опухолью верхней трети (3 против 6 циклов). Все вышеперечисленные пункты оказали побочное действие на достижение положительных результатов испытания.Кроме того, в группе только химиотерапии 5 пациентов перенесли излечимую гастрэктомию и получили долгосрочную выживаемость с момента полного исчезновения неизлечимых факторов после химиотерапии. Следовательно, нельзя полностью отрицать ценность гастрэктомии у пациентов с метастатическим РЖ.
Конверсионная хирургия определяется как хирургическое лечение, направленное на резекцию R0 после системной терапии опухолей, которые изначально были неизлечимыми (28). В последние годы в клинических испытаниях были достигнуты положительные результаты в области конверсионной хирургии.AIO-FLOT3 — это клиническое исследование II фазы, которое предназначено для изучения эффективности химиотерапии и хирургии у пациентов с распространенным раком желудка (29). Исследование состояло из 3-х рук. В группу А был включен в общей сложности 51 пациент с операбельным раком желудка, которым была проведена радикальная операция после 4 циклов неоадъювантной химиотерапии FLOT и после операции было проведено 4 цикла химиотерапии FLOT. В группу B было включено 60 пациентов с локализованным метастатическим раком желудка.Локализованные метастазы относятся к метастазам в один орган с метастазами в забрюшинные лимфатические узлы или без них. Пациенты в группе B прошли по крайней мере 4 цикла химиотерапии FLOT и перешли к операции, если после повторной оценки удалось добиться резекции R0 первичной опухоли и метастатических поражений. В противном случае будет продолжена системная химиотерапия (всего 8 курсов). В группу C было включено 127 пациентов с обширными метастазами, которые прошли не менее 8 циклов паллиативной химиотерапии FLOT.Конечной точкой исследования была общая выживаемость (ОВ). Наконец, при среднем времени наблюдения 28,6 месяца более половины пациентов в группе А были все еще живы. 36 (60%) пациентов в группе B перенесли операцию, и их общая выживаемость была значительно дольше, чем в группе C (22,9 против 10,7 месяцев, p <0,001). Даже в группе B общая выживаемость пациентов, перенесших операцию, была значительно дольше, чем у пациентов, которым операция была невозможна (31,3 против 15,9 месяцев, p <0.001). Результаты исследования показали, что долгосрочная выживаемость может быть получена для пациентов с распространенным раком желудка за счет полного курса комплексного лечения и радикальной резекции опухоли. В нашей когорте группа CRT с резекцией желудка имела значительно более длительную медианную общую выживаемость, чем группа, получавшая только CRT (22 месяца по сравнению с 9 месяцами).
С точки зрения ценности лучевой терапии, она обычно используется пациентами со стадией IB – IIIB GC для уменьшения или уменьшения первичного участка, увеличивая возможность радикальной резекции (30).Однако у пациентов с IV стадией ГК поражение отдаленных органов не подходит для лучевой терапии. Следовательно, основной целью было остановить кровотечение и улучшить качество жизни (QoL) (31). Однако одновременная химиолучевая терапия показывает превосходство над химиотерапией или лучевой терапией только в продлении выживаемости пациентов с метастатическим ГК (32, 33).
Мы признаем, что наше исследование все еще имеет некоторые ограничения. Во-первых, в качестве ретроспективного когортного исследования, хотя PSM использовался для минимизации эффекта различий между группами, систематическая ошибка отбора по-прежнему является потенциальным ограничением этого исследования.Пациенты, перенесшие операцию, вероятно, имели потенциально операбельное заболевание на момент постановки диагноза, что также могло быть одним из источников систематической ошибки отбора. Кроме того, из-за ограничений базы данных SEER некоторая информация была недоступна для доступа, такая как: удаление метастатических участков, состояние хирургического края, расслоение узла D1 / D2, режим химиотерапии и доза / поле / цель лучевая терапия. В этом исследовании в группе CRT с гастрэктомией выполнялась полная или частичная гастрэктомия, что означает удаление первичного участка.Однако неизвестно, были ли удалены метастатические участки, что также является прогностическим фактором при IV стадии GC. Что касается степени расслоения лимфатических узлов, среди 146 пациентов, перенесших операцию, среднее количество исследованных региональных лимфатических узлов составило 18,40, что составляет минимум 15 лимфатических узлов, как рекомендовано в рекомендациях NCCN по раку желудка, чтобы избежать миграции стадии (5). ). Следовательно, учитывая важность этих факторов, длительную выживаемость в группе CRT с гастрэктомией, которая наблюдалась в текущих результатах, следует интерпретировать с осторожностью.
Выводы
Таким образом, рак желудка IV стадии остается смертельным заболеванием. Это исследование было популяционным, которое показало, что по сравнению с одной только CRT, CRT с гастрэктомией может улучшить выживаемость у пациентов с метастатическим GC. Это указывает на то, что отдельные пациенты с метастатическим раком желудка могут иметь более длительную выживаемость при удалении первичной опухоли. Хотя его характеристики в настоящее время не могут быть описаны, требуется дальнейшее хорошо спланированное исследование, чтобы определить лучшую стратегию лечения.Конверсионная терапия может дать направление для лечения пациентов с раком желудка IV стадии.
Заявление о доступности данныхВ данном исследовании были проанализированы общедоступные наборы данных. Эти данные можно найти здесь: https://seer.cancer.gov/data/access.html.
Авторские взносы
Все перечисленные авторы внесли большой вклад в работу. ЛЗ: придумал концепцию / гипотезу, разработал исследование и отредактировал рукопись. SL: собрал и проанализировал данные, составил рукопись.Наконец, все авторы взяли на себя ответственность за окончательную рукопись и одобрили ее к публикации.
Финансирование
Эта работа была поддержана грантами: Проект продвижения передовых и соответствующих технологий Шанхайской комиссии здравоохранения (2019SY030).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы признают и искренне ценят усилия реестров опухолей Программы надзора, эпидемиологии и конечных результатов (SEER) по созданию базы данных SEER.
Сноски
Список литературы
1. Глобальное бремя заболевания раком, Фицморис С., Аллен С., Барбер Р.М., Баррегард Л., Бхутта З.А. и др. Глобальная, региональная и национальная заболеваемость раком, смертность, потерянные годы жизни, годы, прожитые с инвалидностью, и годы жизни с поправкой на инвалидность для 32 онкологических групп, 1990–2015 годы: систематический анализ исследования глобального бремени болезней. JAMA Oncol. (2017) 3: 524–48. DOI: 10.1001 / jamaoncol.2016.5688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Глимелиус Б., Экстром К., Хоффман К., Граф В., Сьёден П.О., Хаглунд У. и др. Рандомизированное сравнение химиотерапии плюс наилучшая поддерживающая терапия с наилучшей поддерживающей терапией при распространенном раке желудка. Ann Oncol. (1997) 8: 163–8. DOI: 10.1023 / A: 1008243606668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Кан Дж. Х., Ли С. И., Лим Д. Х., Пак К. В., О С. Ю., Квон Х. С. и др. Спасательная химиотерапия при предварительно вылеченном раке желудка: рандомизированное испытание фазы III, в котором сравниваются химиотерапия плюс лучший поддерживающий уход с лучшим поддерживающим лечением. J Clin Oncol. (2012) 30: 1513–8. DOI: 10.1200 / JCO.2011.39.4585
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Смит Е.К., Верхей М., Аллум В., Каннингем Д., Сервантес А., Арнольд Д. и др. Рак желудка: клинические рекомендации ESMO по диагностике, лечению и последующему наблюдению. Ann Oncol. (2016) 27 (Дополнение 5): v38–49. DOI: 10.1093 / annonc / mdw350
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Fujitani K, Yang HK, Mizusawa J, Kim YW, Terashima M, Han SU и др.Гастрэктомия плюс химиотерапия по сравнению с одной химиотерапией при распространенном раке желудка с одним неизлечимым фактором (REGATTA): рандомизированное контролируемое исследование фазы 3. Ланцет Онкол. (2016) 17: 309–18. DOI: 10.1016 / S1470-2045 (15) 00553-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Йошида К., Ямагути К., Окумура Н., Танахаши Т., Кодера Ю. Возможна ли конверсионная терапия при раке желудка IV стадии: предложение новых биологических категорий классификации. Рак желудка. (2016) 19: 329–38. DOI: 10.1007 / s10120-015-0575-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Ноун А.М., Лунд Дж. Л., Мариотто А., Кронин К., МакНил Т., Дипен Д. и др. Сравнение данных лечения SEER с заявками на получение медицинской помощи. Med Care. (2016) 54: e55–64. DOI: 10.1097 / MLR.0000000000000073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Рубин ДБ. Оценка причинно-следственных связей из больших наборов данных с использованием оценок склонности. Ann Intern Med. (1997) 127 (8 Pt 2): 757–63. DOI: 10.7326 / 0003-4819-127-8_Part_2-199710151-00064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Остин ПК. Введение в методы оценки склонности для уменьшения эффекта искажения в обсервационных исследованиях. Multivariate Behav Res. (2011) 46: 399–424. DOI: 10.1080 / 00273171.2011.568786
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Chang YR, Han DS, Kong SH, Lee HJ, Kim SH, Kim WH, et al.Значение паллиативной гастрэктомии при раке желудка с отдаленными метастазами. Ann Surg Oncol. (2012) 19: 1231–9. DOI: 10.1245 / s10434-011-2056-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Коидзуми В., Ким Ю. Х., Фуджи М., Ким Х. К., Имамура Х., Ли К. Х. и др. Добавление доцетаксела к S-1 без платины продлевает выживаемость пациентов с распространенным раком желудка: рандомизированное исследование (START). J Cancer Res Clin Oncol. (2014) 140: 319–28.DOI: 10.1007 / s00432-013-1563-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Ямада Ю., Хигучи К., Нисикава К., Гото М., Фьюз Н., Сугимото Н. и др. Исследование фазы III, сравнивающее оксалиплатин плюс S-1 с цисплатином плюс S-1 у пациентов с распространенным раком желудка, ранее не получавших химиотерапию. Ann Oncol. (2015) 26: 141–8. DOI: 10.1093 / annonc / mdu472
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Cheon SH, Rha SY, Jeung HC, Im CK, Kim SH, Kim HR, et al.Выживаемость комбинированной лечебной резекции желудка (резекция D2) и печени у пациентов с раком желудка с метастазами в печень. Ann Oncol. (2008) 19: 1146–53. DOI: 10.1093 / annonc / mdn026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Риихимаки М., Хемминки А., Сандквист К., Сандквист Дж., Хемминки К. Распространение метастазов у пациентов с раком желудка. Oncotarget. (2016) 7: 52307–16. DOI: 10.18632 / oncotarget.10740
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Ассоциация JGC. Японское руководство по лечению рака желудка, 2014 г. (вер. 4). Рак желудка. (2017) 20: 1–19. DOI: 10.1007 / s10120-016-0622-4
CrossRef Полный текст | Google Scholar
17. Hartgrink HH, Putter H, Klein Kranenbarg E, Bonenkamp JJ, van de Velde CJ, Dutch Gastric Cancer G. Значение паллиативной резекции при раке желудка. Br J Surg. (2002) 89: 1438–43. DOI: 10.1046 / j.1365-2168.2002.02220.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Musri FY, Mutlu H, Karaagac M, Eryilmaz MK, Gunduz S, Artac M. Первичная резекция опухоли и выживаемость у пациентов с раком желудка IV стадии. J Рак желудка. (2016) 16: 78–84. DOI: 10.5230 / jgc.2016.16.2.78
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Солаини Л., Министрини С., Бенчивенга М., Д’Игнацио А., Марино Е., Чиполлари С. и др. Конверсионная гастрэктомия при неоперабельном раке желудка IV стадии: ретроспективное когортное исследование GIRCG. Рак желудка. (2019) 22: 1285–93. DOI: 10.1007 / s10120-019-00968-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Nordgard O, Tjensvoll K, Gilje B, Soreide K. Циркулирующие опухолевые клетки и ДНК в виде жидких биопсий при раке желудочно-кишечного тракта. Br J Surg. (2018) 105: e110–20. DOI: 10.1002 / bjs.10782
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Розен С.А., Буэлл Дж. Ф., Йошида А., Казсуба С., Херст Р., Мичеласси Ф. и др.Первоначальное обращение с колоректальным раком IV стадии: насколько агрессивными мы должны быть? Arch Surg. (2000) 135: 530–4; обсуждение 4–5. DOI: 10.1001 / archsurg.135.5.530
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Dauplat J, Le Bouedec G, Pomel C, Scherer C. Циторедуктивная хирургия поздних стадий рака яичников. Semin Surg Oncol. (2000) 19: 42–8. DOI: 10.1002 / 1098-2388 (200007/08) 19: 1 <42 :: AID-SSU7> 3.0.CO; 2-M
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Уэносоно Ю., Аригами Т., Козоно Т., Янагита С., Хагихара Т., Харагути Н. и др. Клиническое значение циркулирующих опухолевых клеток в периферической крови больных раком желудка. Cancer-Am Cancer Soc. (2013) 119: 3984–91. DOI: 10.1002 / cncr.28309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Коидзуми В., Нарахара Х., Хара Т., Такагане А., Акия Т., Такаги М. и др. S-1 плюс цисплатин по сравнению с одним только S-1 для лечения первой линии распространенного рака желудка (исследование SPIRITS): исследование III фазы. Ланцет Онкол. (2008) 9: 215–21. DOI: 10.1016 / S1470-2045 (08) 70035-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Сонгун И., Путтер Х., Краненбарг Е.М., Сасако М., ван де Велде С.Дж. Хирургическое лечение рака желудка: 15-летние результаты рандомизированного общенационального голландского исследования D1D2. Ланцет Онкол. (2010) 11: 439–49. DOI: 10.1016 / S1470-2045 (10) 70070-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Фукути М., Исигуро Т., Огата К., Судзуки О, Кумагаи Ю., Исибаши К. и др. Прогностическая роль конверсионной хирургии при неоперабельном раке желудка. Ann Surg Oncol. (2015) 22: 3618–24. DOI: 10.1245 / s10434-015-4422-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ябусаки Х., Нашимото А., Мацуки А., Айзава М. Значение хирургического лечения в мультимодальной терапии высокоразвитого рака желудка стадии IV. Гепатогастроэнтерология. (2013) 60: 377–81.DOI: 10,5754 / hge12653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Аль-Батран С.Е., Хоманн Н., Полигк С., Иллерхаус Г., Мартенс Ю.М., Штольмахер Дж. И др. Влияние неоадъювантной химиотерапии с последующей хирургической резекцией на выживаемость у пациентов с ограниченным метастатическим раком желудка или желудочно-пищеводного перехода: исследование AIO-FLOT3. JAMA Oncol. (2017) 3: 1237–44. DOI: 10.1001 / jamaoncol.2017.0515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Мин С., Бангалор С., Джавар С., Го Й., Николсон Дж., Форменти С.К. и др. Химиолучевая терапия по сравнению с одной химиотерапией при раке желудка после хирургической резекции R0: метаанализ рандомизированных исследований. Онкология. (2014) 86: 79–85. DOI: 10.1159 / 000354641
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Изуиси К., Мори Х. Последние стратегии лечения рака желудка стадии IV: роль паллиативной гастрэктомии, химиотерапии и лучевой терапии. J Gastrointestin Liver Dis. (2016) 25: 87–94. DOI: 10.15403 / jgld.2014.1121.251.rv2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Группа ГТС. Сравнение комбинированной химиотерапии и комбинированной терапии при местнораспространенной карциноме желудка. Группа исследования опухолей желудочно-кишечного тракта. Cancer Am Cancer Soc. (1982) 49: 1771–7. DOI: 10.1002 / 1097-0142 (19820501) 49: 9 <1771 :: AID-CNCR28204> 3.0.CO; 2-M
CrossRef Полный текст | Google Scholar
33.Смолли С. Р., Бенедетти Дж. К., Халлер Д. Г., Хундаль С. А., Эстес Н. С., Аджани Дж. А. и др. Обновленный анализ межгруппового исследования под руководством SWOG 0116: исследование фазы III адъювантной радиохимиотерапии по сравнению с наблюдением после радикальной резекции рака желудка.

 Если эти препараты плохо переносятся, врач может назначить другой блокатор ALK – бригатиниб (Алунбриг).
Если эти препараты плохо переносятся, врач может назначить другой блокатор ALK – бригатиниб (Алунбриг).
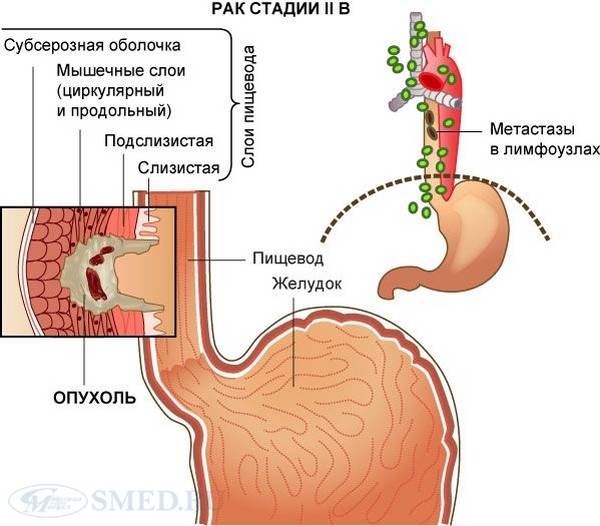




 Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам.
Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам. В зависимости от распространенности опухоли их количество бывает разным.
В зависимости от распространенности опухоли их количество бывает разным. На поздних стадиях рака операции проводятся редко, поскольку полностью удалить все метастазы и крупную, проросшую в соседние органы опухоль невозможно.
На поздних стадиях рака операции проводятся редко, поскольку полностью удалить все метастазы и крупную, проросшую в соседние органы опухоль невозможно.

 Высокая избирательность РНК в составе препарата позволяет ему прицельно действовать на пораженные раком органы.
Высокая избирательность РНК в составе препарата позволяет ему прицельно действовать на пораженные раком органы. Гиперицин применяется при фотодинамической терапии рака – разрушении предварительно обработанных атипичных клеток при помощи лазерного излучения.
Гиперицин применяется при фотодинамической терапии рака – разрушении предварительно обработанных атипичных клеток при помощи лазерного излучения.