Рак желудка
Одним из важных аспектов работы любого врача является проявление онкологической настороженности, так как существует ряд опухолей, который на ранних стадиях развития не дает выраженной клиники, но остается при этом достаточно распространенным в популяции явлением. Одним из таких новообразований является рак желудка, который в структуре смертности от злокачественных новообразований у мужчин стоит на втором месте, а у женщин на третьем.
Грибовидная карцинома желудка с изъязвлением, располагающаяся в антральном отделе.
Рак желудка — злокачественная опухоль, исходящая из слизистой желудка. Слизистая оболочка представлена однослойным цилиндрическим эпителием, собственной пластинкой и мышечной, образующей складки, желудочные поля и желудочные ямки, в которые выходят выводные протоки желудочных желез. Рак желудка в 90 % случаев представлен аденокарциномой.
Папиллярная аденокарцинома гастроэзофагеального перехода с инфильтрацией опухоли в подслизистую оболочку.
Этиология
На данный момент нет однозначного ответа на вопрос об этиологии развития заболевания. Главенствующее значение отводится хроническому инфицированию Helicobacter pylori. Среди других причин упоминается инфицирование вирусом Эпштейна-Барр, генетические мутации, ожирение и влияние факторов среды. Среди средовых факторов наибольшее влияние имеет курение, содержащая нитраты и маринованная пища.
Поэтому большое внимание в практике врача уделяется лечению фоновых для развития рака заболеваний, таких как хронический атрофический гиперпластический гастрит, ассоциированный с Helicobacter pylori, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие (гипертрофическая гастропатия, гиперпластический гигантоскладочный гастрит), а также лечению предраковых изменений слизистой оболочки: кишечной метаплазии и дисплазии.
Тубулярная аденокарцинома
Патогенез
Среди теорий канцерогенеза рака желудка доминирует теория каскада Р. Соrrеа, предложенная автором еще в 1988 г. На тот момент эта модель не включала H. pylori, ее включили лишь на два года позднее. Сведений, достоверно подтверждающих синтез или секрецию бактерией мутагенных или канцерогенных субстанций нет. Поэтому согласно теории хроническая персистенция H. pylori вызывает только нарушение клеточного обновления слизистой оболочки желудка, заключающееся в ускоренном перемещении клеток из генеративной зоны без полноценной дифференциации в зоны расположения зрелых специализированных эпителиоцитов. Это происходит вследствие продукции цитокинов и кислородных метаболитов клетками воспалительного инфильтрата. Развивается неспособность желудочных желез к полноценной функции и как следствие атрофия, метаплазия, дисплазия и карцинома.
Соrrеа, предложенная автором еще в 1988 г. На тот момент эта модель не включала H. pylori, ее включили лишь на два года позднее. Сведений, достоверно подтверждающих синтез или секрецию бактерией мутагенных или канцерогенных субстанций нет. Поэтому согласно теории хроническая персистенция H. pylori вызывает только нарушение клеточного обновления слизистой оболочки желудка, заключающееся в ускоренном перемещении клеток из генеративной зоны без полноценной дифференциации в зоны расположения зрелых специализированных эпителиоцитов. Это происходит вследствие продукции цитокинов и кислородных метаболитов клетками воспалительного инфильтрата. Развивается неспособность желудочных желез к полноценной функции и как следствие атрофия, метаплазия, дисплазия и карцинома.
Среди причин, вызывающих диффузный рак, отмечаются генетические мутации в генах 
Диффузно-инфильтративный рак желудка (linitis plastica)
Клиническая картина и симптоматика
Опухоль на ранних стадиях не имеет патогномоничных симптомов. С развитием заболевания присоединяются следующие симптомы:
- Местные могут быть представлены болью в эпигастральной области

- К общим проявлениям относятся: потеря аппетита, отвращение к пище или отсутствие чувства насыщения, снижение веса, нарастающая слабость, повышенная утомляемость. Данный симптомокомплекс А.И. Савицким объединен в «синдром малых признаков».
- Опухоль, осложнившаяся кровотечением, проявляется слабостью, головокружением, сердцебиением, утомляемостью, обморочными состояниями, рвотой неизмененной кровью, или, «кофейной гущей», меленой (дегтеобразным калом). При возникновении перфорации возникают «кинжальные» боли, усиливающиеся при движении, возникает выраженная слабость, холодный пот, иногда потеря сознания. Лихорадка с интоксикационным синдромом возникают при инфицировании опухоли.
- При появлении метастазов в печени, сдавлении внепеченочных желчных протоков, возникает желтуха, присоединяется кожный зуд. Карциноматоз брюшины или сдавление воротной вены проявляется асцитом, непроходимостью. При значительном росте метастаза Шницлера в параректальной клетчатке возникает нарушение дефекации.
 Нарушение функций яичников возникает при двустороннем поражении яичников (Крукенберговский рак). Пальпаторно определяются метастазы Айриша в подмышечные лимфатические узлы, Вирхова в левый надключичный узел и метастаз сестры Марии Джозеф в пупок по ходу круглой связки печени.
Нарушение функций яичников возникает при двустороннем поражении яичников (Крукенберговский рак). Пальпаторно определяются метастазы Айриша в подмышечные лимфатические узлы, Вирхова в левый надключичный узел и метастаз сестры Марии Джозеф в пупок по ходу круглой связки печени.
Инфильтративно-язвенный тип рака желудка, расположенный в теле желудка по малой кривизне.
Лечение
Выполняется с использованием хирургических технологий (в том числе эндоскопических), комбинированной химиотерапии, и лучевых методов.
Эндоскопически оперируется:
- ранний рак у пациентов с высоким риском хирургического вмешательства;
- карцинома, располагающаяся в пределах слизистой оболочки;
- размер опухоли не превышающий 2 см и без изъязвления;
- новообразование с отсутствием метастатического поражения регионарных и отдаленных лимфатических узлов;
- рак с отсутствием лимфоваскулярной инвазии.

Существует два варианта эндоскопических операций: резекция слизистой и резекция слизистой с диссекцией подслизистого слоя. Если после планового гистологического исследования удаленной части выявляется инвазия опухолевых клеток в подслизистый слой, низкодифференцированная форма рака или лимфовенозная инвазия, пациент подлежит хирургическому лечению.
Если у пациента обнаруживается подслизистая инвазия, большая протяженность, низкодифференцированные формы, изъязвленные опухоли, то проводится субтотальная резекция желудка или гастрэктомия с лимфаденэктомией.
Ранний рак желудка. А: тип I (возвышенный). В: тип IIа (приподнятый). С: IIc (углубленный). D: IIb+IIc (плоский, углубленный)
Планирование и реализация хирургического лечения включает несколько этапов: выбор оперативного доступа, выбор объема операции на органе, лимфодиссекция, выбор способа реконструкции:
Выбор оперативного доступа зависит от уровня распространения опухоли.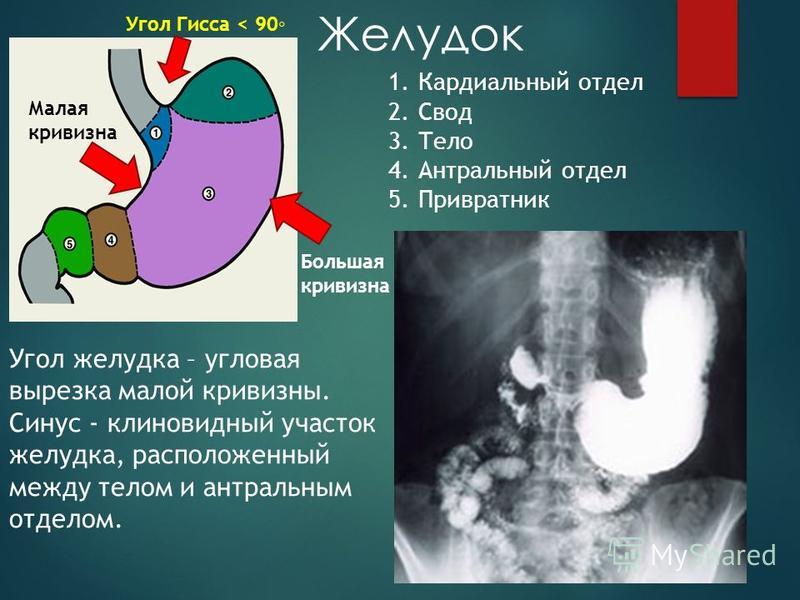 Если нет вовлечения кардиоэзофагеального перехода и пищевода, то доступ срединный лапаратомный. При ограниченном поражении дистального отдела пищевода и кардии — тораколапаратомный доступ слева либо широкая диафрагмотомия из лапоротомного доступа. При тотальном поражении желудка с переходом на пищевод или раке тела с проксимальным распространением на пищевод — абдоминомедиастинальный (в ряде случаев, при высоком пересечении пищевода, с целью безопасного формирования пищеводно-кишечного соустья, возможно применение торакотомии слева по VI межреберью).
Если нет вовлечения кардиоэзофагеального перехода и пищевода, то доступ срединный лапаратомный. При ограниченном поражении дистального отдела пищевода и кардии — тораколапаратомный доступ слева либо широкая диафрагмотомия из лапоротомного доступа. При тотальном поражении желудка с переходом на пищевод или раке тела с проксимальным распространением на пищевод — абдоминомедиастинальный (в ряде случаев, при высоком пересечении пищевода, с целью безопасного формирования пищеводно-кишечного соустья, возможно применение торакотомии слева по VI межреберью).
Выбор объема операции включает в себя такие варианты как гастрэктомию, субтотальную дистальную и субтотальную проксимальную резекции желудка:
Радикальная операция включает единовременное удаление пораженного участка желудка с двумя сальниками, клетчаткой, лимфатическими узлами регионарных зон; орган пересекается на расстоянии не менее 5 см от видимого края опухоли с ограниченным типом роста и не менее 6–7 см при раке язвенно-инфильтративного и диффузного типов.
- Дистальная субтотальная резекция желудка проводится при раке антрального отдела желудка без очагов тяжелой дисплазии и рака in situ в проксимальной части желудка либо у больных с низкими функциональными резервами при распространении экзофитной или опухолью со смешанной формой роста на нижнюю треть тела желудка. Левые паракардиальные лимфатические узлы и узлы в воротах селезенки не удаляются, так как поражаются при этом типе рака редко.
- Проксимальная субтотальная резекция желудка показана при раке кардиоэзофагеального перехода, при небольших опухолях верхней трети желудка экзофитной или смешанной формы роста.
- Гастрэктомия с удалением всех регионарных лимфоузлов проводится во всех остальных случаях. При резектабельном раке желудка типа linitis plastica (диффузный рак), недифференцированных формах рака, синдроме наследственного рака желудка диффузного типа выполняют только гастрэктомию.

- Лимфодиссекция. Лимфогенное метастазирование при раке желудка происходит в 47,7 % случаев и зависит от глубины инвазии опухоли. Стандартно производят удаление лимфатических узлов 1 и 2 порядка. При наличии отдаленных метастазов выполняются паллиативные вмешательства.
Комбинированная адъювантная химиотерапия проводится по схемам XELOX (CAPOX) через 4–6 недель после операции при отсутствии тяжелых осложнений и после нормализации клинико-лабораторных показателей. В схемы включены препараты капецитабин и оксалиплатин.
Неоадъювантная химиотерапия проводится 3 курсами режимами CF (Цисплатин, 5-ФУ), ECF (Эпирубицин, Доксорубицин, Цисплатин, 5-ФУ), ECX (Эпирубицин, Доксорубицин, Цисплатин, Капецитабин) или EОХ (Эпирубицин, Доксорубицин Оксалиплатин), затем если опухоль резектабельна, то выполняют операцию, после которой назначают дополнительно 3 цикла аналогичной химиотерапии. Периоперационная химиотерапия является альтернативой послеоперационной химиолучевой терапии при операбельном раке желудка при лимфодиссекции по результатам проведенных исследований, так как способствует увеличению пятилетней выживаемости.
При местно-распространенном нерезектабельном и диссеминированном раке желудка и пищеводно-желудочного соустья назначается системная химиотерапия. Выбор конкретной комбинации зависит от состояния пациента, характера и тяжести сопутствующих заболеваний. В частности, режимы CF, CX, XELOX, IF (1a), FOLFOX продемонстрировали статистически достоверное увеличение выживаемости больных, в отличие от монокомпонентного лечения.
Симптоматическая терапия направлена на купирование осложнений. При кровотечении выполняется эндоскопическая остановка кровотечения.
Опухолевый стеноз устраняется путем бужирования или реканализации, баллонной дилатацией, установкой саморасправляющегося стента в зону стеноза. При невозможности проведения данных процедур выполняются гастроеюностомия, паллиативная гастрэктомия, чрезкожная эндоскопическая или интервенционная гастростомия у пациентов с дисфагией, эндоскопическая или хирургическая еюностомия у пациентов со стенозами на уровне средней и нижней трети желудка. Боль купируется дистанционной лучевой или медикаментозной терапией. Также возможно применение регионарной анестезии. Асцит купируется с помощью диуретиков, лапароцентеза, внутрибрюшным введением цисплатина.
Боль купируется дистанционной лучевой или медикаментозной терапией. Также возможно применение регионарной анестезии. Асцит купируется с помощью диуретиков, лапароцентеза, внутрибрюшным введением цисплатина.
Наиболее высокая пятилетняя выживаемость наблюдается после радикальных операций по поводу неинвазивных опухолей высокой степени дифференцировки и не затрагивающих метастазами региональные лимфоузлы.
Таким образом отсутствие патогномоничных симптомов для ранних форм и широкая распространенность H. pylori в популяции позволяют раку желудка оставаться на лидирующих позициях по заболеваемости и смертности в России, несмотря на появление более современных методов лечения.
Полиповидный рак желудка с кровоизлиянием в центре опухоли. Рак расположен в антральном отделе по малой кривизне желудка.
Источники
- Чиссов В. И. и др. Злокачественные новообразования в России в 2010 году (заболеваемость и смертность) //М.: ФГБУ «МНИОИ им.
 ПА Герцена» Минздравсоцразвития России. – 2012. – С. 12.
ПА Герцена» Минздравсоцразвития России. – 2012. – С. 12. - Маев И. В., Зайратьянц О. В., Кучерявый Ю. А. Кишечная метаплазия слизистой оболочки желудка в практике гастроэнтеролога: современный взгляд на проблему //Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2006. – Т. 16. – №. 4. – С. 38-47.
- Харнас С. С., Левкин В. В., Мусаев Г. Х. Рак желудка (клиника, диагностика, лечение): Учеб. пос. для студентов //М.: Изд. дом “Русский врач. – 2006.
- https://vk-cc.com/FPDGQC
- https://vk-cc.com/pDw45jl
- https://vk-cc.com/Pnyovkr
- https://vk-cc.com/skU7LdXw
- https://vk-cc.com/Pfu36JGn
Гастропанель
Комплексный анализ крови, включающий специфические белки пищеварительного тракта (гастрин-17, пепсиноген I и II) и IgG-антитела к H. pylori, который используется для неинвазивной оценки состояния слизистой оболочки желудка и скрининга атрофического гастрита.
Синонимы русские
Биомаркеры состояния слизистой желудка;
IgG-антитела к H. pylori, гастрин-17, пепсиногены 1 и 2.
pylori, гастрин-17, пепсиногены 1 и 2.
Синонимы английские
GastroPanel;
H. pylori IgG, Gastrin-17, Pepsinogen I and II.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
Пмоль/л (пикомоль на литр), мкг/л (микрограмм на литр), EIU (иммуноферментная единица).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- За неделю до исследования исключить прием препаратов, влияющих на желудочную секрецию (по согласованию с врачом).
- За сутки до исследования исключить прием препаратов, нейтрализующих соляную кислоту.
- Исключить физическое и эмоциональное перенапряжение в течение 12 часов до исследования.
- Не курить в течение 3 часов до исследования.

Общая информация об исследовании
Боль в области желудка (диспепсия) является одной из самых частых причин обращения пациентов к врачу. Следует отметить, что при обследовании у большей части этих пациентов не удается выявить никаких органических заболеваний желудка (в этом случае говорят о функциональной диспепсии). С другой стороны, в некоторых случаях диспепсия может быть признаком серьезных заболеваний, в том числе атрофического гастрита, который, в свою очередь, является фактором риска рака желудка. Можно сказать, что диагностика при диспепсии направлена на то, чтобы исключить эти серьезные заболевания.
На сегодняшний день единственным методом, с помощью которого возможна точная диагностика заболеваний желудка, является гастроскопия с биопсией. Этот метод, однако, инвазивный и достаточно сложный в исполнении и не удобен в качестве скринингового теста при обследовании большого количества пациентов с диспепсией. В качестве такого скринингового теста, позволяющего точно и при этом неинвазивно получить информацию о состоянии слизистой оболочки желудка, был разработан комплексный анализ крови, который получил название «Гастропанель».
В состав «Гастропанели» входят четыре биомаркера: специфические белки пищеварительного тракта пепсиноген I и II, гастрин-17 и антитела класса IgG к H. pylori.
Пепсиноген является неактивным предшественником фермента пепсина и существует в двух биохимически и иммунологически различных вариантах – пепсиноген I и II. Пепсиноген Iсекретируется только клетками желез тела желудка и поэтому является специфическим индикатором состояния слизистой оболочки тела желудка. Секреция пепсиногена II происходит в клетках желез тела, кардиального и пилорического отделов желудка, а также в бруннеровых железах двенадцатиперстной кишки. В норме небольшое количество пепсиногена I и II поступает в кровь и может быть измерено. При атрофическом гастрите тела желудка количество париетальных клеток, секретирующих соляную кислоту, снижается. При этом также уменьшается концентрация пепсиногена Iв крови. Считается, что снижение соотношения пепсиноген I / пепсиноген II более точно отражает степень тяжести и распространения атрофического гастрита тела желудка.
Гастрин – это гормон пищеварительного тракта, необходимый для нормального процесса пищеварения. Он стимулирует выработку соляной кислоты и пепсина специализированными клетками желудка и увеличивает моторику пищеварительного тракта. Гастрин-17 – одна из разновидностей гастрина, синтезируется преимущественно G-клетками антрального отдела желудка и поэтому является специфическим индикатором состояния слизистой оболочки антрального отдела желудка. Некоторое количество гастрина всасывается в кровь и может быть измерено. При атрофическом гастрите антрального отдела желудка снижается количество G-клеток, а также концентрация гастрина-17 в крови.
Примерно у половины пациентов с инфекцией H. pylori на определенном этапе возникает атрофический гастрит, причем у 10 % инфицированных он принимает тяжелое или средней тяжести течение и у 2,5-5 % может возникнуть рак желудка. Поэтому идентификация H. pylori – это неотъемлемая часть скрининга атрофического гастрита и рака желудка. Для идентификации H. pylori в состав «Гастропанели» был включен тест на IgG-антитела к этому микроорганизму, который имеет ряд преимуществ по сравнению с другими методами определения H. pylori. Во-первых, IgG-антитела к H. pylori могут быть обнаружены у 95-100 % пациентов с геликобактериозом, что позволяет считать этот серологический тест одним из самых чувствительных тестов для диагностики этого состояния. Высокая чувствительность теста означает, что отрицательный результат позволяет практически исключить наличие геликобактериоза. Во-вторых, в отличие от уреазного дыхательного теста или определения антигена H. pyloriв кале, на результат серологических тестов не влияет степень колонизации слизистой оболочки микроорганизмом, наличие кровоточащей язвы, атрофического гастрита, ахлоргидрии желудка на фоне приема ингибиторов протонной помпы и применение антибиотиков.
pylori в состав «Гастропанели» был включен тест на IgG-антитела к этому микроорганизму, который имеет ряд преимуществ по сравнению с другими методами определения H. pylori. Во-первых, IgG-антитела к H. pylori могут быть обнаружены у 95-100 % пациентов с геликобактериозом, что позволяет считать этот серологический тест одним из самых чувствительных тестов для диагностики этого состояния. Высокая чувствительность теста означает, что отрицательный результат позволяет практически исключить наличие геликобактериоза. Во-вторых, в отличие от уреазного дыхательного теста или определения антигена H. pyloriв кале, на результат серологических тестов не влияет степень колонизации слизистой оболочки микроорганизмом, наличие кровоточащей язвы, атрофического гастрита, ахлоргидрии желудка на фоне приема ингибиторов протонной помпы и применение антибиотиков.
Совместное измерение концентраций этих четырех биомаркеров позволяет произвести косвенную оценку состояния слизистой желудка и выработать дальнейший план действий.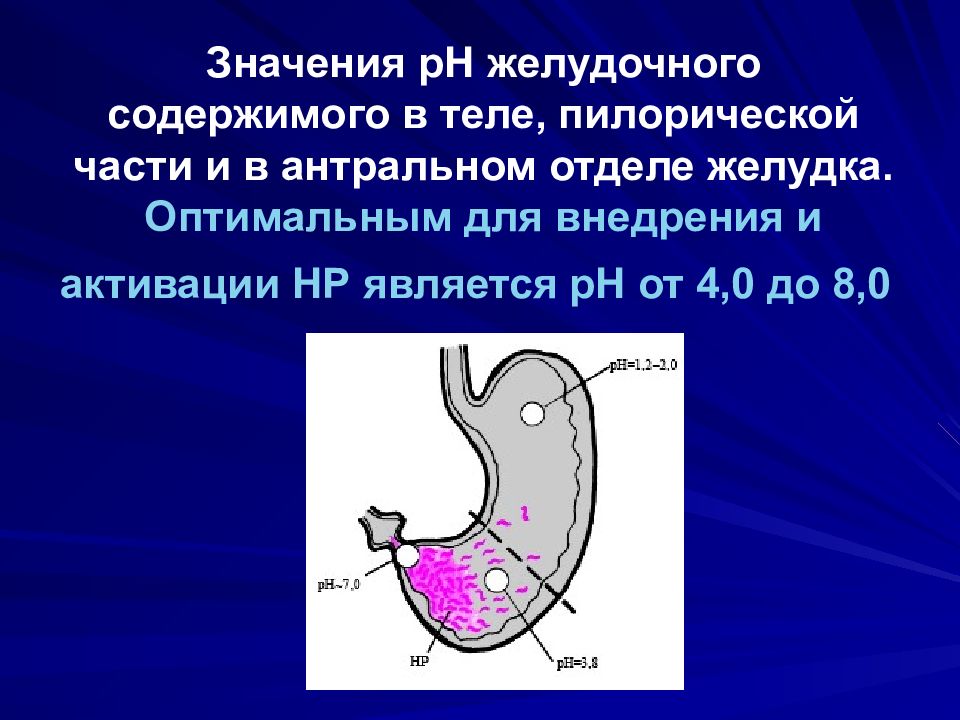 На основании результатов «Гастропанели» всех пациентов с диспепсией можно разделить на три группы:
На основании результатов «Гастропанели» всех пациентов с диспепсией можно разделить на три группы:
- Пациенты с нормальной слизистой оболочкой желудка: IgG-антитела к H. pylori – отрицательный результат, пепсиноген I и II и гастрин-17 – в пределах нормы. При этом риск серьезных заболеваний желудка (рака желудка и язвы желудка) очень низкий. Гастроскопия не показана. Две трети пациентов с диспепсией относятся именно к этой группе.
- Пациенты с геликобактериозом без атрофического гастрита: IgG-антитела к H. pylori – положительный результат, пепсиноген I и II и гастрин-17 – в пределах нормы. Такой результат исследования свидетельствует о наличии хронического неатрофического (поверхностного, гиперацидного) H.pylori-ассоциированного гастрита. Риск рака желудка низкий, но все же существует. Риск язвы желудка или двенадцатиперстной кишки повышен. Вопрос о гастроскопии решается в индивидуальном порядке. Также может быть рекомендована антибиотикотерапия против H. pylori.
- Пациенты с атрофическим гастритом.
 Детальный анализ результата теста позволит определить, какой отдел желудка поражен.
Детальный анализ результата теста позволит определить, какой отдел желудка поражен. - Пепсиноген I и соотношение пепсиноген I / пепсиноген II – снижены, гастрин-17 – повышен, IgG-антитела к H. pylori– отрицательный или положительный результат. Такой результат свидетельствует об атрофическом гастрите тела желудка. Риск рака желудка, а также дефицита витамина B12, кальция и железа существенно повышен. Рекомендуется проведение гастроскопии.
- Пепсиноген Iи соотношение пепсиноген I / пепсиноген II – в пределах нормы, гастрин-17 – снижен, IgG-антитела к H. pylori – положительный результат. Такой результат свидетельствует об атрофическом гастрите антрального отдела желудка. Риск рака желудка повышен. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
- Пепсиноген I и соотношение пепсиноген I / пепсиноген II– снижены, гастрин-17 – снижен, IgG-антитела к H.
 pylori – положительный результат. Такой результат свидетельствует об атрофическом пангастрите – состоянии, которое является самым значимым фактором риска рака желудка. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
pylori – положительный результат. Такой результат свидетельствует об атрофическом пангастрите – состоянии, которое является самым значимым фактором риска рака желудка. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
В третью группу относится всего лишь 2,5 % пациентов с диспепсией, однако именно эти пациенты как раз и нуждаются в наиболее тщательном обследовании и наблюдении.
«Гастропанель» особенно удобна в условиях оказания медицинской помощи терапевтами или врачами общей практики. Этот комплексный анализ позволяет выявить пациентов с диспепсией с нормальной структурой и функцией слизистой желудка и избежать таким образом ненужного инвазивного эндоскопического вмешательства. С другой стороны, этот анализ позволяет выявить пациентов с атрофическим гастритом и, следовательно, высоким риском рака желудка и вовремя направить их к гастроэнтерологу для проведения тщательного обследования, в том числе гастроскопии с биопсией.
Во многих исследованиях показано, что результаты «Гастропанели» хорошо согласуются с данными гастроскопии и биопсии слизистой желудка. Следует все же отметить, что это непрямой тест, который не может полностью заменить гастроскопию. Результат анализа следует оценивать с учетом дополнительных анамнестических и клинических данных.
Для чего используется исследование?
- Для неинвазивной оценки состояния слизистой оболочки желудка;
- для скрининга атрофического гастрита.
Когда назначается исследование?
- При обследовании пациента с признаками диспепсии: дискомфорт или боль в эпигастральной области, тошнота, рвота, быстрая насыщаемость, чувство тяжести в желудке, нарушение аппетита.
Что означают результаты?
Референсные значения
- Гастрин 17: 1 — 10 пмоль/л.
- Пепсиноген I: 30 — 165 мкг/л.
- Пепсиноген II: 3 — 15 мкг/л.
- Антитела (Ig G) к Helicobacter pylori: 0,0 — 29,9 EIU.

|
Норма |
IgG-антитела к H. pylori – отрицательный результат, пепсиноген I и II и гастрин-17 – в пределах нормы |
|
Хронический неатрофический (поверхностный, гиперацидный) H.pylori-ассоциированный гастрит |
IgG-антитела к H. pylori – положительный результат, пепсиноген I и II и гастрин-17 – в пределах нормы |
|
Атрофический гастрит тела желудка
|
Пепсиноген I и соотношение пепсиноген I / пепсиноген II – снижены, гастрин-17 – повышен, IgG-антитела к H. pylori– отрицательный или положительный результат |
|
Атрофический гастрит антрального отдела желудка
|
Пепсиноген I и соотношение пепсиноген I / пепсиноген II – в пределах нормы, гастрин-17 – снижен, IgG-антитела к H. |
|
Атрофический пангастрит |
Пепсиноген I и соотношение пепсиноген I / пепсиноген II – снижены, гастрин-17 – снижен, IgG-антитела к H. pylori – положительный результат |
Что может влиять на результат?
- Применение ингибиторов протонной помпы приводят к увеличению концентрации гастрина-17 в 2-5 раз, при длительном их применении также наблюдается 2-кратное увеличение концентрации пепсиногенов I и II.
Ультразвуковая томография в комплексной дооперационной диагностике распространенности рака желудка
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
В настоящее время, несмотря на современные возможности диагностики, рак желудка сохраняет лидирующие позиции в структуре злокачественных новообразований во всем мире. На долю рака желудка приходится половина опухолей желудочно- кишечного тракта. Частота рака желудка у лиц 20-30 лет составляет 3%, возраст большинства больных превышает 50 лет, при этом заболеваемость удваивается с каждым следующим десятилетием. Рак желудка является второй по частоте формой злокачественных новообразований. Ежегодно в мире регистрируются 876,3 тыс. новых случаев (8,7% среди всех злокачественных новообразований, без учета немеланомных новообразований кожи) и 646,6 тыс. случаев смерти от этого заболевания (10,4% в структуре умерших от рака). Не вызывает сомнения тот факт, что неудовлетворительные результаты лечения рака желудка в значительной степени связаны с его поздней диагностикой.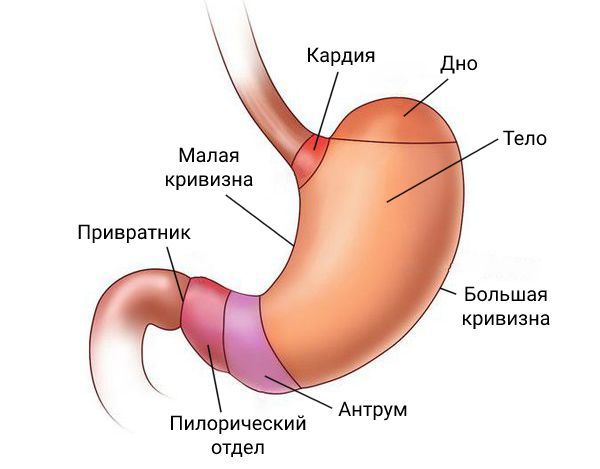 Усовершенствование методов диагностики, в частности их сочетание, по-прежнему является актуальной проблемой, требующей решения.
Усовершенствование методов диагностики, в частности их сочетание, по-прежнему является актуальной проблемой, требующей решения.
Цель исследования — показать возможности трансабдоминальной ультразвуковой томографии в оценке распространенности опухолевого процесса при раке желудка. В исследование были включены 68 пациентов с новообразованиями желудка, находившихся на лечении в Российском онкологическом научном центре им. Н.Н. Блохина РАМН с 2004 по 2006 г. Возраст пациентов варьировал от 30 до 83 лет. У всех больных в процессе обследования диагноз был подтвержден морфологически. У 60 человек был выявлен рак желудка (у 42 — аденокарцинома, у 18 — перстневидноклеточный рак), у 5 — лимфома желудка, у 2 — гастроинтестинальная стромальная опухоль желудка (GIST) и у 1 — рак желчного пузыря с распространением на поперечноободочную кишку и антральный отдел желудка.
Ультразвуковое исследование (УЗИ) проводилось на первых этапах обследования и имело следующие задачи: определить пораженный отдел желудка, оценить глубину инвазии стенки и протяженность поражения, выявить наличие метастазов. У всех пациентов проводился осмотр надключичных областей, органов брюшной полости и забрюшинного пространства, у женщин — органов малого таза. Исследование выполнялось натощак.
У всех пациентов проводился осмотр надключичных областей, органов брюшной полости и забрюшинного пространства, у женщин — органов малого таза. Исследование выполнялось натощак.
Для осмотра абдоминального сегмента пищевода применялось полипозиционное сканирование из эпигастральной области, правого подреберья и межреберных промежутков. При продольном, поперечном и косом положениях датчика под мечевидным отростком грудины, используя левую долю печени как акустическое окно, на глубоком вдохе хорошо визуализировались абдоминальный сегмент пищевода и область кардиоэзофагиального перехода. При этом оценивались толщина стенки, наличие анатомической дифференциации слоев стенки, протяженность поражения, наличие увеличенных паракардиальных лимфатических узлов.
Трансабдоминальное УЗИ проводилось стандартно. Для получения изображения желудка осуществляли множественные поперечные, косые и продольные сечения в эпигастральной и околопупочной областях, в левом подреберье в положении на спине, на левом боку, на правом боку, сидя. УЗИ проводилось с использованием технологии панорамного сканирования, высокочастотных датчиков и контрастирования желудка жидкостью. Полипозиционное УЗИ желудка выполнялось при трасабдоминальном сканировании датчиком на разных частотах (2-7 МГц) в два этапа: натощак и при контрастировании желудка жидкостью.
УЗИ проводилось с использованием технологии панорамного сканирования, высокочастотных датчиков и контрастирования желудка жидкостью. Полипозиционное УЗИ желудка выполнялось при трасабдоминальном сканировании датчиком на разных частотах (2-7 МГц) в два этапа: натощак и при контрастировании желудка жидкостью.
В норме незаполненный желудок на поперечном сечении определяется как овальная структура с гипоэхогенным ободком (соответствует стенке желудка) и эхогенным просветом (складки слизистой оболочки). При использовании современной высокоразрешающей ультразвуковой аппаратуры у 56% пациентов удавалось визуализировать пятислойную структуру стенки не заполненного жидкостью желудка. Особое внимание уделялось толщине и равномерности стенок желудка. Толщина его стенок в норме не превышала 5 мм.
При выявлении патологических изменений в стенке желудка исследование дополнялось сканированием на высоких частотах (7-9 МГц), которое позволяло более детально изучить стенку органа, однако его применение (даже при использовании режима тканевой гармоники) ограничено у пациентов с избыточной массой тела. Прицельное сканирование высокочастотным датчиком дало также возможность с большей вероятностью диагностировать метастатическое поражение регионарных лимфатических узлов. Методика панорамного сканирования позволила определить протяженность опухолевого поражения стенки желудка.
Прицельное сканирование высокочастотным датчиком дало также возможность с большей вероятностью диагностировать метастатическое поражение регионарных лимфатических узлов. Методика панорамного сканирования позволила определить протяженность опухолевого поражения стенки желудка.
При этом оценивались: 1) наличие жидкого содержимого в полости желудка натощак и симптома «поражения полого органа»; 2) контуры желудка; 3) толщина и анатомическая дифференциация слоев стенки; 4) соотношение стенки желудка с прилежащими тканями и органами; 5) состояние регионарных лимфатических коллекторов.
Наличие жидкого содержимого в полости желудка натощак указывало на явления стеноза просвета выходного отдела желудка. При поражении стенки желудка на всю глубину и выходе опухолевого процесса на серозную оболочку отмечались бугристость контура органа и неравномерность ее утолщения. Характер утолщения стенки непостоянен (по нашим наблюдениям, оно составляет около 18 мм при инфильтративной форме роста), стенка может быть утолщена неравномерно. Анатомическая дифференциация слоев стенки нарушена, стенка представляет собой гипоэхогенную структуру. При распространенном раке желудка опухолевая инфильтрация может распространяться на прилежащие ткани, а также на поджелудочную железу и двенадцатиперстную кишку.
Анатомическая дифференциация слоев стенки нарушена, стенка представляет собой гипоэхогенную структуру. При распространенном раке желудка опухолевая инфильтрация может распространяться на прилежащие ткани, а также на поджелудочную железу и двенадцатиперстную кишку.
Для рака желудка являются регионарными лимфатические узлы, расположенные перигастрально и в области печеночно-двенадцатиперстной связки, а также лимфатические узлы вдоль сосудов — левой желудочной, общей печеночной, селезеночной и чревной артерий. Вовлечение в процесс ретропанкреатических, мезентериальных и парааортальных лимфатических узлов расценивается как наличие отдаленных метастазов. Метастатическое поражение сальника может проявляться в виде диффузной инфильтрации или очагового процесса.
Карциноматоз брюшины может иметь несколько типов ультразвуковых изображений: наиболее часто очаги карциноматоза визуализируются на фоне асцита в виде гиперэхогенных образований с ровными или неровными контурами, расположенных на париетальной и/или висцеральной брюшине. При другом типе поражения наблюдается прерывистость контура париетальной брюшины или ее локальное утолщение.
При другом типе поражения наблюдается прерывистость контура париетальной брюшины или ее локальное утолщение.
Контролем в оценке распространенности опухолевого процесса послужили результаты эндоскопических способов диагностики, включая эндоскопическое УЗИ, данные хирургического вмешательства и патоморфологических исследований.
При инфильтративной форме роста опухоли наличие жидкого содержимого определялось в 29 случаях (при сужении выходного отдела желудка менее 2,2 см), наружный контур желудка на уровне поражения был неровым, бугристым у 26 пациентов, причем в 24 случаях отмечен выход опухолевого процесса за пределы стенки. Утолщение стенки и нарушение дифференциации слоев на участке поражения имели место во всех наблюдениях. У 5 пациентов выявлено распространение опухоли на абдоминальный сегмент пищевода. Метастатическое поражение парагастральных лимфатических узлов обнаружено в 19 случаях. При экзофитной форме роста жидкое содержимое определялось в 6 наблюдениях. У 27 пациентов в просвете желудка или вне его определялось опухолевое образование, выходившее за пределы стенки.
У 27 пациентов в просвете желудка или вне его определялось опухолевое образование, выходившее за пределы стенки.
Анализ показал, что наиболее доступными для трансабдоминального УЗИ являются тело желудка, антральный отдел и малая кривизна, наиболее трудными — дно и большая кривизна желудка.
УЗИ желудка нельзя рассматривать как основной и самостоятельный метод диагностики у данной категории пациентов. Оно является дополнительным методом в комплексе мероприятий, связанных с предоперационной диагностикой рака желудка. Ультразвуковая томография уже на первом этапе обследования больного позволяет оперативно оценить глубину опухолевой инвазии стенки желудка, протяженность опухолевой инфильтрации при инфильтративной форме рака желудка, выявить метастазы в парагастральные, паракардиальные лимфатические узлы, в большой сальник, что имеет большое значении при определении тактики лечения конкретного больного. Рентгенологическое исследование желудка позволяет установить локализацию опухоли в желудке и оценить протяженность поражения.
Интересной и малоизученной является проблема дифференциальной диагностики рака и лимфом желудка. Ультразвуковая дифференциальная диагностика рака и лимфомы желудка при использовании трансабдоминального сканирования весьма сложна из-за отсутствия специфических ультразвуковых признаков опухолевой инфильтрации стенки желудка различного генеза. Основным отличием можно считать то, что при лимфоме стенка имеет неодинаковую толщину и неравномерно сниженную эхогенность стенки. У всех пациентов этой группы диагноз был подтвержден иммуногистохимически при повторных биопсиях.
Предоставленные эхограммы (рис. 1-8) наглядно демонстрируют возможности УЗИ в комплексной дооперационной диагностике рака желудка.
Рис. 1. Стенки желудка без контрастирования жидкостью (панорамное сканирование).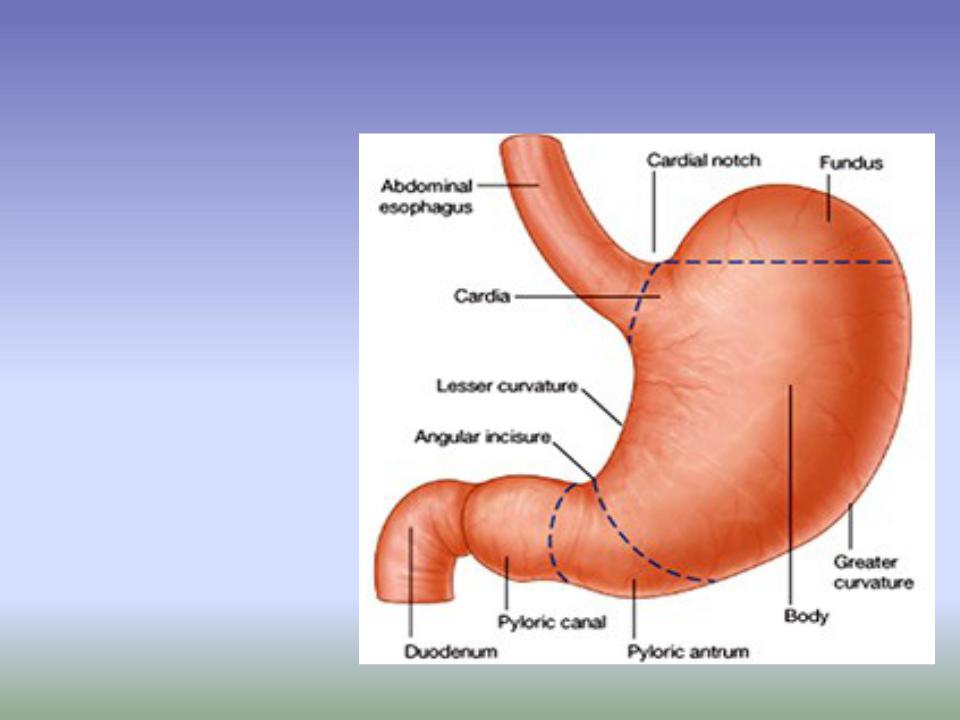
Рис. 2. Стенки неизмененного желудка при контрастировании жидкостью (панорамное сканирование).
Рис. 3. Складки слизистой оболочки желудка в норме.
Рис. 4. Стеноз выходного отдела желудка, полость желудка переполнена содержимым (панорамное сканирование).
Рис.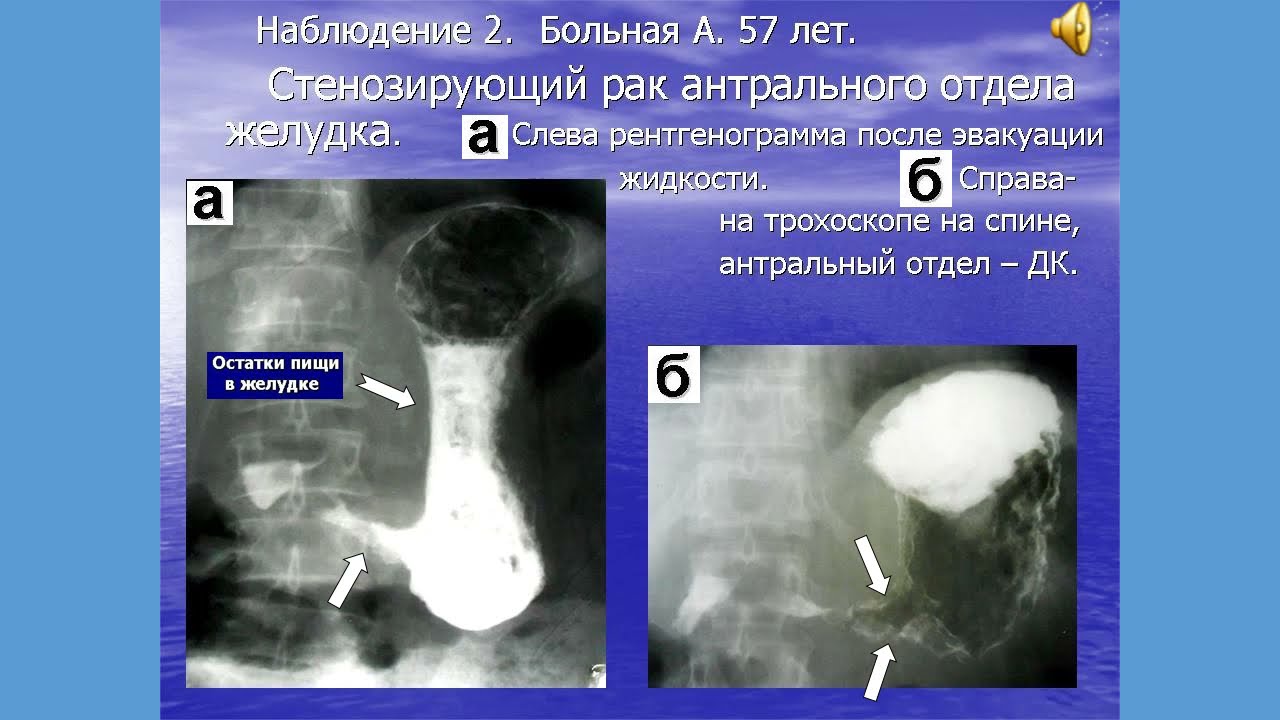 5. Рак антрального отдела желудка.
5. Рак антрального отдела желудка.
а) Эхография (панорамное сканирование).
б) Рентгенография.
Рис. 6. Рак проксимального отдела желудка с переходом на пищевод./> а) Эхография.
б) Рентгенография.
Рис.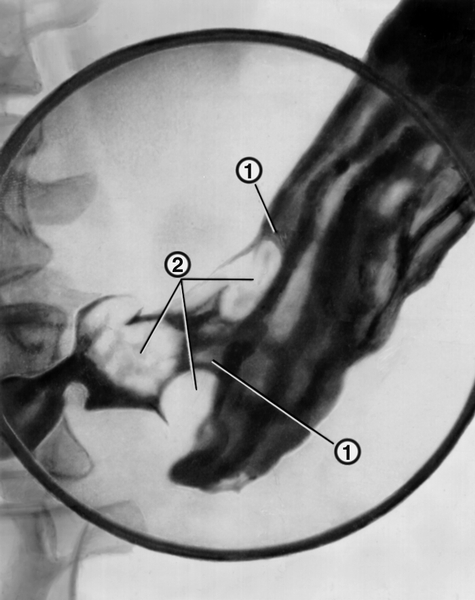 7. Эхография — метастазы в лимфатические узлы паракардиальной зоны.
7. Эхография — метастазы в лимфатические узлы паракардиальной зоны.
Рис. 8. Ультразвуковая картина — метастазы в парагастральные лимфатические узлы.
Выводы
Анализ показал целесообразность использования трансабдоминального исследования желудка, лимфатических коллекторов и других зон возможного метастазирования на первом этапе обследования пациентов с предполагаемой злокачественной опухолью желудка. Полученная информация позволяет более рационально планировать проведение комплекса диагностических процедур во время предоперационной подготовки пациента.
УЗИ сканер HS50
Доступная эффективность.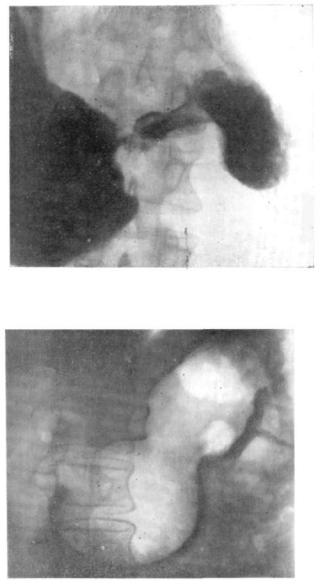 Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Атрофический гастрит: прогнозы и перспективы
Авторы: О.Я. Бабак, д.м.н., профессор, директор Института терапии им. Л.Т. Малой АМН Украины, г. Харьков
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.
Что сегодня известно об атрофическом гастрите?
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter pylori (Н. pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов.
Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите.
Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Другие методы исследования – рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография – в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни?
Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый – длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант – в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем – к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия – это неоплазия, другими словами – опухоль.
Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака – до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии
TGF-β1, частичный полиморфизм кластера гена IL-1
(IL-1β).
В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori – это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека.
В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора – каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез – многоэтапный процесс, характеризующийся развитием хронического гастрита – первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге – к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка?
Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних.
При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка – первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии.
Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии – прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка.
Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка.
Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования.
Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) – неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрита-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток).
Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот.
Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Совокупная точность тестовой панели в диагностике атрофического гастрита – около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного.
Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия.
В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода.
В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта – исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг.
Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori – Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут.
Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка.
Главная цель первичной профилактики атрофического гастрита – своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований.
Мониторирование – постоянное наблюдение с периодическим повторным обследованием – абсолютно обязательно для пациентов с атрофическим гастритом
Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования – эндоскопического, морфологического, гематологического (тестовой панели) и других – способствует его точной диагностике.
Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература
1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11.
2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32.
3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19.
4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт – 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91.
5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal metaplasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. – 2000. – Vol. 45. – 1754-1762.
6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection – The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P. 167-180.
СТАТТІ ЗА ТЕМОЮ
30.11.2021 Кардіологія Особливості переведення підлітків із вродженою вадою серця у дорослу категорію пацієнтівВроджені вади серця (ВВС) є найпоширенішими вродженими аномаліями розвитку. Близько 90% дітей, що мають ВВС, у розвинених країнах досягають зрілого віку. Хоча виживаність при ВВС у країнах із низьким рівнем доходів залишається низькою, розширення доступу до дитячої кардіохірургії у країнах із середнім рівнем доходів привело до незначного зростання виживаності серед підлітків та дорослих із помірною та тяжкою ВВС. Таким хворим необхідне надання кваліфікованої медичної допомоги протягом усього життя. Під егідою відомих світових спільнот 2021 р. було розроблено глобальний консенсусний документ, в якому описані аспекти переходу підлітків із ВВС у дорослу категорію пацієнтів з урахуванням доступних можливостей у країнах із різним ступенем розвитку. …
30.11.2021 Кардіологія Територія правильного ритму: безпека, доведена практикоюОднією із найпоширеніших стійких аритмій є фібриляція передсердь (ФП), що пов’язана з розвитком небезпечних ускладнень та погіршенням якості життя хворих. Відновлення та підтримка нормального синусового ритму – бажана мета для багатьох пацієнтів із ФП, однак ця стратегія обмежена відносно невеликою кількістю антиаритмічних препаратів (ААП), доступних для контролю ритму при ФП. Тож як обрати ефективний і безпечний шлях розв’язання цієї проблеми? Та що насамперед контролювати при ФП – частоту серцевих скорочень (ЧСС) чи ритм? Провідний науковий співробітник відділу реанімації та інтенсивної терапії, д. мед. н. Олег Ігорович Іркін та старша наукова співробітниця відділу аритмій серця (ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», м. Київ), к. мед. н. Олена Миколаївна Романова детально розглянули ці питання в межах ХІІ Національного конгресу кардіологів України, що відбувся цьогоріч у вересні. …
30.11.2021 Кардіологія Порівняльна ефективність сартанів та інгібіторів АПФ у пацієнтів із перенесеним інфарктом міокардаДля лікування пацієнтів з інфарктом міокарда (ІМ) зазвичай рекомендовані препарати, що пригнічують ренін-ангіотензин-альдостеронову систему, такі як інгібітори ангіотензинперетворювального ферменту (іАПФ) та блокатори рецепторів ангіотензину ІІ (БРА). Однак чи однаково ефективні ці ліки для широкого кола пацієнтів із серцево-судинними захворюваннями (ССЗ), досі є предметом дискусій. Метою D. Ko et al. було порівняти клінічну ефективність іАПФ та БРА в осіб із перенесеним ІМ. Пропонуємо до вашої уваги огляд цього дослідження, результати якого опубліковані у виданні Open Heart (2019; 6: e001010). …
30.11.2021 Кардіологія Артеріальна гіпертензія як причина хвороби дрібних церебральних судинАртеріальна гіпертензія (АГ) є одним з основних факторів ризику церебральної хвороби дрібних судин (ХДС). На цю підступну патологію страждають пацієнти незалежно від віку і статусу, але до найбільш уразливої групи ризику належать особи похилого віку. В межах ХХІІ Національного конгресу кардіологів України, що відбувся у вересні, лікарка-неврологиня, к. мед. н. Іванна Леонідівна Ревенько та старша наукова співробітниця експертного консультативно-діагностичного й лікувального центру злоякісної та резистентної артеріальної гіпертензії, д. мед. н. Лариса Анатоліївна Міщенко (ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», м. Київ) акцентували увагу на перебігу, ускладненнях, терапевтичних та профілактичних стратегіях при АГ для запобігання розвитку когнітивних порушень, серцево-судинних ризиків і деменції. …
Доброкачественные опухоли желудка – лечение и операция
Доброкачественная опухоль желудка – это новообразование, которое не имеет признаков злокачественного процесса. В некоторых случаях остается небольшой риск перерождения при отсутствии соответствующего лечения. Доброкачественные новообразования желудка составляют до 5% от числа всех опухолевых заболеваний желудка, могут развиваться из эпителия, нервной ткани, жировых структур или сосудистых. Рост может быть быстрый или замедленный. По направлению роста выделяют опухоли, движущиеся в сторону просвета желудка, в сторону органов брюшной полости и новообразования, которые разрастаются внутри стенки. По локализации они с одинаковой частотой возникают в теле желудка, антральном отделе или в других местах.
В ЦЭЛТ вы можете получить консультацию хирурга.
- Первичная консультация — 3 000
- Повторная консультация — 2 000
Разновидности и особенности желудочных опухолей
По происхождению все новообразования, локализованные в области желудка, разделяют на две большие группы: эпителиальные и неэпителиальные.
Среди первой группы встречаются аденомы и полипы (одиночные или группами). Разница в том, что полипы – это выросты в просвет органа, они обычно округлой формы и имеют широкое основание, могут располагаться на ножке. Развитие полипов ассоциировано с возрастными изменениями – чаще встречаются в возрасте после 40 лет, болезнь поражает мужчин чаще, чем женщин. Гистологически полип представляет собой разросшиеся железистые и эпителиальные ткани с соединительнотканными элементами и развитой сетью сосудов.
Аденомы – это истинные доброкачественные новообразования, состоящие преимущественно из железистой ткани. В отличие от полипов, аденома может чаще перерождаться. Но встречаются реже, чем полипы.
Неэпителиальные опухоли встречаются редко. Они формируются в стенке желудка и могут состоять из самых разных тканей.
К неэпителиальным новообразованиям относят:
- Миому – формируется из мышечной ткани.
- Невриному – формируется из клеток, составляющих миелиновую оболочку нервных волокон.
- Фиброму – развивается из соединительной ткани.
- Липому – состоит из жировой ткани.
- Лимфангиомы – клетки опухоли происходят из стенок лимфатических сосудов.
- Гемангиомы – из клеток, выстилающих кровеносные или лимфатические сосуды.
- и другие варианты, в том числе опухоли смешанной природы.
В отличие от полипов, которые чаще встречаются у мужчин, опухоли неэпителиальной природы чаще диагностируют у женщин. У всех подобных новообразований есть отличительные особенности: как правило, они имеют четкий контур, гладкую поверхность, округлую форму. Могут разрастаться до значительных размеров.
Особо выделяют неэпителиальную опухоль лейомиому – она встречается с более высокой частотой, чем другие новообразования из этой группы. Эта опухоль может вызывать желудочные кровотечения или потенцировать образование язв за счет прорастания в слизистую оболочку желудка. Все неэпителиальные новообразования отличаются достаточно высоким риском онкологического перерождения – малигнизации.
Симптомы
Симптомы опухоли желудка, как правило, слабо выражены. Если новообразование не растет, то практически не проявляется и никак не наблюдается. Очень часто доброкачественные опухоли определяют по косвенным признакам или выявляют случайно при эндоскопическом обследовании.
Клиническая картина включает в себя:
- Проявления, характерные для гастрита, но без достаточных диагностических признаков для постановки диагноза гастрит.
- Кровоизлияние в желудок.
- Снижение аппетита, утомляемость, колебания веса – общие нарушения, которые можно ассоциировать с болезнями пищеварительной системы.
- Диспепсия.
- При частых кровоизлияниях – анемия.
При абсолютно спокойном течении могут наблюдаться боли тупого и ноющего характера, локализованные, как правило, в эпигастрии. Боль нередко возникает после приема пищи. Достаточно часто больные ассоциируют эти симптомы с гастритом.
При опухолях достаточно большого размера могут наблюдаться более выраженные проявления. Появляется тяжесть, возникают приступы тошноты, появляется частая отрыжка. В рвотных массах и стуле больные обнаруживают примеси крови. В лабораторных анализах определяют пониженный гемоглобин. Пациенты испытывают слабость и головокружения. Вне зависимости от сохранности нормального аппетита начинается потеря веса. Всего различают более сотни видов доброкачественных новообразований – с разным течением и клинической картиной. Выраженность симптомов зависит от локализации, размера и скорости роста опухоли. Классической клинической картиной, позволяющей заподозрить опухоль, считается кровотечение, сопровождаемое общими нарушениями работы ЖКТ.
Причины
На сегодняшний день все причины образования доброкачественных опухолей желудка неизвестны. Поэтому правильно говорить о факторах риска – факторах, которые провоцируют патологические процессы, приводящие к появлению новообразований. В их числе наличие других заболеваний ЖКТ.
Наиболее актуальная теория гласит, что полипы появляются в результате нарушений естественной регенерации слизистой желудка. Поэтому полипы часто развиваются на фоне гастрита. Аденомы чаще сопровождаются атрофическим гастритом. При этом отмечено, что более 70% всех новообразований развивается в нижней трети желудка – то есть в зоне с пониженной концентрацией соляной кислоты.
Причиной развития неэпителиальной опухоли могут быть эмбриональные нарушения или наличие хронических заболеваний. Так как конкретных причин выявить не удается, не существует и специфической профилактики доброкачественных опухолей. Нельзя забывать и о наследственной предрасположенности – пациентам, чьи родственники имели новообразования желудка, необходимо даже при отсутствии каких-либо симптомов заболевания желудка выполнять эндоскопическое исследование. В любом случае, при подозрении на наличие полипа или полиповидного образования желудка следует обратиться к хирургу.
Наши врачи
Главный хирург ЦЭЛТ, заслуженный врач РФ, главный специалист ДЗ г. Москвы по эндохирургии и эндоскопии, членкор РАН, заведующий кафедрой факультетской хирургии № 1 ГБОУ БПО МГМСУ, доктор медицинских наук, врач высшей категории, профессор
Стаж 42 года
Записаться на приемВрач-хирург, заведующий хирургической службой ЦЭЛТ, кандидат медицинских наук, врач высшей категории
Стаж 32 года
Записаться на приемДиагностика
Диагностика опухолей желудка состоит из трех основных этапов: сбор анамнеза, осмотр, рентгенографическое и эндоскопическое исследование. Также назначают анализ крови, который позволяет выявить снижение уровня гемоглобина, то есть анемию, характерную для опухолей, вызывающих кровотечение. Доброкачественность новообразования определяют по таким признакам: размер, наличие перистальтики (при инструментальном исследовании), форма. Нечеткие контуры, быстрый рост и отсутствие перистальтики свидетельствуют о том, что полип малигнизируется.
Для уточнения диагноза используют ЭГДС – эзофагогастродуоденоскопию, которая позволяет визуально оценить состояние слизистой и в режиме реального времени увидеть форму и размер опухолей, локализованных на слизистой. Этот метод позволяет оценить риск малигнизации – визуально невозможно отличить злокачественную опухоль ранней стадии от доброкачественной, требуется биопсия. При подозрении на онкологию при проведении ФГДС берут пробу для гистологического исследования в лаборатории – биопсия позволяет точно определить характер новообразования.
Так как неэпителиальные опухоли бывают самые разнообразные, то нередко поставить окончательный диагноз удается только после операции.
Исследование опухолей, расположенных вне слизистой, возможно теми же средствами: на рентгенографии видны контуры, а эндоскопическое исследование в сочетании с ультразвуковым метолом (эндо-УЗИ) позволяет определить зоны сдавливания, которые появляются при росте опухолей внутри стенок желудка или в сторону внутренних органов.
Лечение
Лечение доброкачественной опухоли желудка бывает только хирургическое. Консервативные методы неэффективны. Операцию могут отложить при небольшом размере опухоли и отсутствии опасности озлокачествления. Но в большинстве случаев показано хирургическое удаление – с помощью современных технологий операция безопасна. Раннее удаление особенно важно провести в случае, когда не удается достоверно определить характер опухоли – злокачественные новообразования необходимо убрать на ранней стадии.
Существует несколько методов удаления доброкачественной опухоли, которые применяются в настоящее время:
- Эндоскопическая электроэксцизия – так называется малоинвазивная операция, которая подразумевает электрокоагуляцию через эндоскопический доступ. Таким способом удаляют полипы.
- Энуклеация – позволяет снизить кровопотерю, выполняется через эндоскопический или лапароскопический доступ (в зависимости от локализации образования).
- Лапароскопическая резекция желудка – операция с доступом через проколы передней брюшной стенки и разрез стенки желудка, при которой часть желудка удаляют, а затем восстанавливают непрерывный пищеварительный тракт с помощью аппаратного шва.
- Гастрэктомия – полное удаление желудка. Практически не применяют при доброкачественных опухолях.
Эндоскопическая операция показана при обнаружении полипов, которые видны при диагностике и расположены одиночно. Если полип небольшой, достаточно коагуляции. Для новообразований размером более 5 мм применяют электроэксцизию – полип затягивают за ножку, а затем удаляют электрокоагулятором. При полипах более крупного размера проводят подслизистую резекцию образования (через эндоскоп).
Резекцию желудка проводят при множественных полипах или при высоком риске озлокачествления. Гастрэктомию проводят при некоторых случаях диффузного полипоза.
В клинике ЦЭЛТ можно пройти обследование и начать лечение – современные технологии на страже крепкого здоровья.
Наши услуги
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7 (495) 788 33 88
Обзор исследований в эпоху эндоскопической расслоения подслизистой оболочки
J Korean Med Sci. 2019 сентябрь 9; 34 (35): e231.
иСу Джин Ким
Кафедра внутренней медицины, Медицинский факультет Пусанского национального университета и научно-исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, Янсан, Корея.
Cheol Woong Choi
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Автор, ответственный за переписку: Cheol Woong Choi, MD, PhD. Отделение внутренней медицины, Медицинский научно-исследовательский институт, Медицинский факультет Пусанского национального университета и Исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, 20 Геумо-ро, Мулгым-уп, Янсан 50612, Республика Корея.ten.liamnah@ecaykculПоступила 01.04.2019; Принято 2 августа 2019 г. 4.0 /), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.
Abstract
Выявление рака желудка на ранней стадии улучшает прогноз пациентов.Эндоскопическая подслизистая диссекция (ESD) — это лечебное и сохраняющее желудок лечение раннего рака желудка (EGC), связанное с низким риском метастазирования в лимфатические узлы. Однако в нескольких исследованиях сообщалось о пропущенном диагнозе рака желудка. Следовательно, эндоскописты должны обладать точными диагностическими навыками для устранения эндоскопических слепых пятен. Систематический протокол скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений. Знание особенностей EGC или дисплазии важно для выявления подозрительного поражения.Информация об общих местах возникновения EGC также может позволить провести подробное эндоскопическое обследование для повышения частоты выявления. Предыдущие отчеты об исследовании локализации рака желудка, удаленного с помощью ESD или хирургического вмешательства, показали, что преимущественно поражались антральный отдел и меньшая кривизна желудка. Helicobacter pylori -индуцированные атрофические изменения распространяются от антрального отдела к телу по малой кривизне, преимущественно затрагивая эти области. Рак желудка в антральном отделе и нижнем теле также часто пропускается во время скринингового обследования.Поэтому необходимо тщательное обследование нижней трети желудка, чтобы не пропустить синхронные и метахронные поражения желудка. Знание местоположения EGC позволяет проводить точное эндоскопическое обследование и обнаруживать EGC на ранней стадии.
Ключевые слова: Рак желудка, расположение, эндоскопия
Графическое резюме
ВВЕДЕНИЕ
Рак желудка является серьезной проблемой глобального здравоохранения, особенно в азиатских странах, включая Корею, Японию и Китай.1 Несмотря на достижения в области эндоскопического и хирургического оборудования и методов резекции, рак желудка является третьей по значимости причиной смертности от рака во всем мире. Обнаружение рака желудка на ранних стадиях и своевременное лечение связаны с благоприятным прогнозом.2,3 Пациенты, у которых диагностирован ранний рак желудка (EGC) во время скрининг-эндоскопии, демонстрируют низкий риск метастазирования лимфатических узлов и могут пройти эндоскопическую диссекцию подслизистой оболочки (ESD) в качестве лечебного средства. местное лечение для сохранения желудка. Однако у большинства пациентов с ЭГК наблюдаются неспецифические симптомы.Предыдущие исследования показали, что распространенность запущенного рака желудка была выше у пациентов, проходящих диагностическое обследование без предварительной эндоскопии для изучения причин желудочно-кишечных симптомов.4 Таким образом, программа массового скрининга на рак желудка была принята в Корее и Японии. В недавнем исследовании оценивали влияние скрининга на рак желудка с помощью двухгодичной эндоскопии верхних отделов желудка или гастрографии у взрослых в возрасте ≥ 40 лет, что является Корейской национальной программой скрининга рака.В этом исследовании сообщается об эффективности такой оценки в снижении риска смертности от рака желудка.4 Однако есть отчет о частоте интервального рака желудка (IGC) у пациентов, которые проходили периодическое эндоскопическое обследование в Корее. эндоскопическое обследование обязательно для снижения количества ложноотрицательных результатов.
Для оптимизации диагностической эффективности эндоскопии следует учитывать несколько факторов. Во-первых, введение спазмолитиков и муколитиков, таких как проназа, облегчает тщательное обследование перед началом лечения.6 Во-вторых, адекватная инсуффляция воздуха и удаление слизи для оптимальной визуализации поверхности слизистой оболочки имеют важное значение для точного определения EGC как технического аспекта обследования. В-третьих, протокол систематического скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений в качестве процедуры наблюдения.7 В дополнение к технически точной эндоскопической процедуре, знание особенностей подозрительных поражений важно для обнаружения EGC. Ключевыми признаками EGC являются поражения с неровной поверхностью (приподнятые или вдавленные поражения) и изменения цвета (красноватый или обесцвеченный), а также спонтанное кровотечение ().При подозрении на EGC или дисплазию хромоэндоскопия с использованием индигокармина может быть полезной для определения морфологии поверхности подозрительных поражений. Наконец, передовые методы визуализации, такие как увеличительная эндоскопия с узкополосным изображением, предоставляют подробную информацию о небольших поражениях желудка. В этом обзоре обсуждаются местоположения EGC, обнаруженные при эндоскопии скрининга и эпиднадзора, особенно в Корее. Эта статья внесет значительный вклад в литературу, предоставив лучшее понимание EGC, и послужит руководством для эндоскопистов в проведении тщательного эндоскопического обследования и наблюдения.
Изображения верхней эндоскопии при раннем раке желудка. ( A ) Возвышенное красноватое поражение размером 1,5 см со спонтанным кровотечением (стрелка) находится на большой кривизне антрального отдела. ( B ) На нижней части тела малой кривизны обнаруживается вдавленное и обесцвеченное поражение размером 1,0 см (стрелка). ( C ) На кардии обнаружено плоское поражение размером 0,8 см с неоднородной эритемой (стрелка).
ВНУТРИГАСТИЧЕСКОЕ РАСПОЛОЖЕНИЕ EGC INDICATIVE ESD
Рак слизистой оболочки, размер которого при гистопатологическом исследовании составляет <2 см и показывает хорошо дифференцированные признаки без изъязвления, можно эффективно лечить с помощью ESD из-за низкого риска метастазирования в лимфатические узлы.8 Недавнее многоцентровое подтверждающее исследование (JCOG0607), проведенное Японской клинической онкологической группой, показало, что ЭСД должно быть стандартным лечением (предпочтительнее, чем гастрэктомия) для ЭГК кишечного типа, удовлетворяющего расширенным показаниям. 2 см без язвы, метаанализ, включающий 972 EGC недифференцированного типа из 14 ретроспективных исследований, показал, что ESD показал благоприятный краткосрочный результат.10 Хотя для подтверждения безопасности и эффективности необходимы дальнейшие данные после ESD, эндоскопическая резекция был выполнен с лечебной целью в клинической практике.11 Тем не менее, эндоскописты должны учитывать, что частота лечебной резекции ниже, чем при ESD для дифференцированного типа EGC.12
Раннее обнаружение EGC важно для достижения лечебной резекции с помощью ESD.
Несколько ретроспективных исследований, проведенных в Корее, продемонстрировали, что нижняя часть является наиболее частым местом для выполнения ESD для лечения EGC (). Одно исследование, в котором 647 последовательных поражений EGC были резецированы с помощью ESD, также показало, что наиболее частым местом возникновения EGC была нижняя часть желудка (89.6%). Это исследование показало, что меньшая кривизна была наиболее частым участком поражения (43,6%). 13
Таблица 1
Места раннего рака желудка, подвергшегося эндоскопической резекции
| Автор | Год | Нет | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Мин и др. 36 | 2015 | 1,497 | Единый центр | Тело (21,8) |
| Глазное дно (21.8) | ||||
| Кардия (21,8) | ||||
| Антрум (78,2) | ||||
| Угол (78,2) | ||||
| Ким и др. 3 | 2015 | 165 | Единый центр | Верхний (6,1 ) |
| Средний (14,5) | ||||
| Нижний (79,4) | ||||
| Чой и др. 37 | 2015 | 961 | Единый центр | Верхний (6,0) |
| Средний (21,2) | ||||
| Нижняя (72.8) | ||||
| Ан и др. 38 | 2011 | 1370 | Единый центр | Верхний (7,1) |
| Средний (32,3) | ||||
| Нижний (60,6) | ||||
| Шин и др. .39 | 2015 | 1,105 | Мультицентр | Верхний (4,3) |
| Средний (28,5) | ||||
| Нижний (67,2) |
Нижняя часть желудка включает антрально-пилорический отдел и нижняя треть тела желудка, включая угол.Средняя и верхняя часть относится к средней и верхней третям тела желудка, включая кардию и глазное дно. Инфекция H. pylori вызывает воспаление слизистой оболочки желудка. Раку желудка кишечного типа предшествует индуцированный воспалением каскад предраковых поражений, вызванных воспалением (последовательность атрофия-метаплазия-дисплазия-аденокарцинома) .14 Атрофические изменения слизистой оболочки продвигаются от антрального отдела к телу по меньшей кривизне.15 Распределение Характер атрофии объясняет более высокую частоту EGC в нижних отделах и меньшую кривизну желудка.Хотя вызванный воспалением каскад канцерогенеза инфекцией H. pylori не является основной причиной недифференцированного рака желудка, предполагается, что воспаление само по себе способствует развитию этих видов рака желудка. Таким образом, ЭГК недифференцированного типа обычно встречается в нижних отделах желудка.13,16
ХАРАКТЕРИСТИКИ ХИРУРГИЧЕСКОГО ИЗОБРЕТЕНИЯ РАКА ЖЕЛУДКА НА ОСНОВЕ ЕГО МЕСТОПОЛОЖЕНИЯ
Различные исследования, проведенные в Корее, показали, что нижняя часть является наиболее частым местом поражения. выявлять EGC у пациентов, перенесших хирургическую резекцию ().В одном исследовании оценивали 313 последовательных хирургически удаленных мелких раковых опухолей желудка размером <2 см, чтобы получить информацию об общих местах происхождения этого типа рака желудка.17 EGC в основном были обнаружены в антральном углу (42,2%) и кардии. (26,2%). Большинство (68%) мелких раковых образований желудка возникло по малой кривизне. Этот результат согласуется с исследованием, показывающим резекцию EGC с помощью ESD. Недифференцированные EGC чаще встречаются в дистальном отделе желудка, чем в проксимальном участке.18,19
Таблица 2
Локализация раннего рака желудка, подвергшегося хирургической резекции
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Jeon et al. 40 | 2018 | 275 | Единый центр | Верхний (4,4) |
| Средний (33,1) | ||||
| Нижний (62,5) | ||||
| Kim et al.3 | 2015 | 292 | Единый центр | Верхний (7,2) |
| Средний (14,4) | ||||
| Нижний (78,4) | ||||
| Ryu et al.41 | 2016 | 144 | Мультицентр | Верхний (4,9) |
| Средний (32,9) | ||||
| Нижний (62,2) | ||||
| Хан и др. 42 | 2018 | 1,206 | Мультицентр | Верхний (8.3) |
| Средний (32,8) | ||||
| Нижний (58,9) |
Клинико-патологические исследования по сравнению ранней аденокарциномы кардии желудка и ранней аденокарциномы дистального отдела желудка показали, что проксимальный рак желудка имеет следующие характеристики: 1) преобладание пожилых мужчин, 2) большая тенденция к подслизистой инвазии и 2) лучшая гистопатологическая дифференциация.20,21 В этих исследованиях проксимальный рак желудка определялся как опухоль, эпицентр которой расположен в пределах 3 см ниже желудочно-пищеводного перехода (во избежание ошибочная классификация рака пищевода как рака желудка).Эти отчеты помогут эндоскопистам более интенсивно исследовать угловой антральный отдел и малую кривизну, а также более тщательно оценить кардию у пожилых мужчин в географических районах с высокой распространенностью инфекции H. pylori . Примечательно, что при эндоскопическом обследовании молодых женщин с семейным анамнезом рака желудка необходимо сосредоточить внимание на теле желудка, особенно на участке около большой кривизны.22
ХАРАКТЕРИСТИКИ ОТСУТСТВУЮЩИХ СИНХРОННЫХ ПОВРЕЖДЕНИЙ ЖКТ ЭСД или гастрэктомия.23,24 Отсроченное обнаружение синхронных поражений может привести к дополнительному лечению, включая ЭСД или хирургическое вмешательство, что может вызвать дискомфорт у пациента и увеличить медицинские расходы.
Раннее обнаружение синхронных поражений желудка до того, как они перерастут в инвазивный рак, важно для улучшения прогноза пациентов. Метаанализ, включающий 22 исследования (шесть исследований, проведенных в Корее), показал, что частота пропуска синхронных поражений после ЭСД составляла 9,0% 25. Чрезмерное внимание первичным новообразованиям желудка во время эндоскопии может привести к тому, что другие синхронные поражения могут быть пропущены.26 В одном исследовании сообщалось, что более чем в половине случаев пропущенных синхронных поражений были зафиксированы изображения пропущенных поражений во время предыдущего эндоскопического обследования. 27 Нижние части желудка являются наиболее частым местом для обнаружения пропущенных синхронных поражений (). Факторами, связанными с пропущенными синхронными поражениями, были их небольшой размер и неглубокая морфология. 23,28 Невысокие и небольшие синхронные поражения, вероятно, будут пропущены, поскольку их трудно обнаружить при эндоскопии. Поэтому эндоскописты должны учитывать возможность синхронных новообразований желудка и тщательно обследовать весь желудок, чтобы оценить не только первичные поражения, но и проверить наличие синхронных поражений.
Таблица 3
Расположение пропущенных синхронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Nam и др. 26 | 2018 | 77 | Единый центр | Верхний (5,9) |
| Средний (21,3) | ||||
| Нижний (72,7) | ||||
| Yoo et al.28 | 2013 | 29 | Одноцентровое | Верхнее (6,9) |
| Среднее (31,0) | ||||
| Нижнее (62,1) | ||||
| Ли и др. 24 | 2010 | 12 | Единый центр | Верхний (6,3) |
| Средний (43,8) | ||||
| Нижний (50,0) | ||||
| Ким и др. 43 | 2017 | 141 | Многоцентровый | Верхний (7,1) |
| Средний (32.6) | ||||
| Нижняя (60,3) |
ХАРАКТЕРИСТИКИ МЕТАХРОННОГО РАКА ЖЕЛУДКА (MGC)
MGC обычно определяется как рак желудка, который развился в месте, удаленном от места первичной резекции во время контрольной эндоскопии после эндоскопии. index ESD.29 Ретроспективные исследования показали, что частота метахронных поражений колеблется от 3,6% до 6,1% .30,31 Таким образом, эндоскопическое наблюдение должно быть продолжено после желудочного ESD. В ретроспективном исследовании с участием 2779 пациентов, получавших ESD для EGC и эндоскопического наблюдения в Корее, кумулятивная частота MGC или дисплазии высокой степени за 5 и 10 лет составила 4.7% и 11,3% .30 Нижняя треть желудка была наиболее частой локализацией метахронных поражений (). Другими особенностями MGC являются небольшие дифференцированные внутрислизистые раковые образования размером менее 2 см.29 Таким образом, регулярное эндоскопическое наблюдение может позволить повторную эндоскопическую резекцию по поводу MGC.
Таблица 4
Расположение метахронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Cho et al.30 | 2017 | 96 | Одноцентровое | Верхнее (10,4) |
| Среднее (18,8) | ||||
| Нижнее (70,8) | ||||
| Ли и др. 44 | 2018 | 100 | Мультицентр | Верхний (7) |
| Средний (37) | ||||
| Нижний (56) |
ХАРАКТЕРИСТИКИ IGC
Высокий уровень обнаружения EGC в Корее и Японии объясняется регулярным выполнением скрининговых эндоскопий в этих странах4; однако в нескольких исследованиях сообщалось о случаях IGC.25,32 Понятие IGC происходит от рака толстой кишки и относится к раку, который диагностируется между моментом скрининга и следующей запланированной скрининговой эндоскопией. Следовательно, этот термин применим только в таких странах, как Корея и Япония, где действует национальная программа скрининга на рак желудка. Корейское исследование, в котором оценивались клинико-патологические характеристики IGC, показало, что частота IGC, диагностированная между моментом скрининга и пост-скрининговой эндоскопией, составляла 2.0% (16/81 762 пациента) .5 Характеристиками IGC были рак, обнаруженный в нижнем теле желудка (70,6%) и гистопатологические доказательства недифференцированных поражений (70,6%). Время удвоения рака желудка составляет примерно 2–3 года. 33 Таким образом, большинство поражений IGC в этом исследовании могли быть поражениями, которые прогрессировали из-за пропущенных аномалий слизистой оболочки желудка. Мета-анализ, изучающий частоту пропущенного рака желудка во время эндоскопии верхних отделов желудка, показал, что частота пропущенного рака желудка составляет 9,4%.Выявление рака в интервале от 6 месяцев до 3,5 лет после отрицательного результата эндоскопии считалось пропущенным раком. Таким образом, частота пропущенных поражений может быть выше.25 Большинство пропущенных раковых опухолей желудка представляли собой плохо дифференцированные поражения, расположенные в антральном отделе желудка и нижней части тела.34 Этот результат согласуется с предыдущим исследованием, описывающим IGC. Анатомические различия в различных частях желудка способствуют пропущенному раку желудка. Небольшие очаги рака желудка, возникающие в теле, могут быть скрыты внутри желудочных складок.Частая отрыжка связана с трудным исследованием тела желудка.35
ЗАКЛЮЧЕНИЕ
Раннее обнаружение улучшает прогноз и снижает экономическое бремя рака желудка. Кроме того, ESD — это лечебное средство для сохранения желудка у таких пациентов, когда EGC не прогрессирует до стадии, когда ESD неосуществим. Хорошие знания стандартных эндоскопических методов и эндоскопических особенностей EGC важны для повышения скорости обнаружения EGC. Поэтому эндоскопистам необходимо соответствующее обучение, чтобы улучшить свои технические навыки и знания о различных поражениях желудка.В этой статье основное внимание уделяется важности понимания общих мест возникновения EGC как ключа к точному выявлению рака желудка на ранних стадиях. Было замечено, что меньшая кривизна и нижняя часть желудка являются преобладающими местами, пораженными EGC, которые могут быть резектабельны с помощью ESD или гастрэктомии. Заболеваемость раком желудка с поражением кардии была выше у пожилых мужчин. Большинство IGC были плохо дифференцированы при гистопатологическом исследовании и располагались в антральном отделе желудка и нижней части тела.Эндоскописты должны помнить о возможности возникновения синхронных поражений без приподнятого уровня. Наконец, недавно обнаруженные EGC и MGC часто обнаруживаются в нижней трети, и большинство MGC, обнаруженных во время эндоскопического наблюдения, представляют собой небольшой дифференцированный внутрислизистый рак. В заключение, знание местоположения EGC полезно для точного эндоскопического обследования для скрининга и наблюдения.
Сноски
Раскрытие информации: У авторов нет потенциальных конфликтов интересов для раскрытия.
АвторАвторские взносы:
Концептуализация: Choi CW.
Написание — первоначальный черновик: Kim SJ.
Написание — просмотр и редактирование: Choi CW.
Список литературы
1. Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире.CA Cancer J Clin. 2018; 68 (6): 394–424. [PubMed] [Google Scholar] 2. Кикучи С., Катада Н., Сакурамото С., Кобаяси Н., Симао Х., Ватанабе М. и др. Выживаемость после хирургического лечения раннего рака желудка: хирургические методы и долгосрочное выживание. Langenbecks Arch Surg. 2004. 389 (2): 69–74. [PubMed] [Google Scholar] 3. Ким Й.И., Ким Ю.В., Чой И.Дж., Ким К.Г., Ли Дж.Й., Чо С.Дж. и др. Долгосрочная выживаемость после эндоскопической резекции по сравнению с хирургическим вмешательством при раннем раке желудка. Эндоскопия. 2015; 47 (4): 293–301. [PubMed] [Google Scholar] 4.Jun JK, Choi KS, Lee HY, Suh M, Park B, Song SH и др. Эффективность Корейской национальной программы скрининга рака в снижении смертности от рака желудка. Гастроэнтерология. 2017; 152 (6): 1319–1328.e7. [PubMed] [Google Scholar] 5. Пак М.С., Юн Дж.Й., Чанг Х.С., Ли Х., Пак Джей Си, Шин С.К. и др. Клинико-патологические характеристики интервального рака желудка в Корее. Кишечная печень. 2015; 9 (2): 166–173. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Kim GH, Cho YK, Cha JM, Lee SY, Chung I.K. Попытки повысить качество изображения при эндоскопии: роль проназы.Мир J Gastrointest Endosc. 2016; 8 (5): 267–272. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Японская ассоциация рака желудка. Японская классификация рака желудка: 3-е английское издание. Рак желудка. 2011. 14 (2): 101–112. [PubMed] [Google Scholar] 9. Хасуике Н., Оно Х., Боку Н., Мизусава Дж., Такидзава К., Фукуда Х. и др. Нерандомизированное подтверждающее исследование расширенного показания к эндоскопическому расслоению подслизистой оболочки при раке желудка кишечного типа (cT1a): исследование Японской группы клинической онкологии (JCOG0607) Рак желудка.2018; 21 (1): 114–123. [PubMed] [Google Scholar] 10. Bang CS, Baik GH, Shin IS, Kim JB, Suk KT, Yoon JH и др. Эндоскопическая диссекция подслизистой оболочки при раннем раке желудка с гистологией недифференцированного типа: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21 (19): 6032–6043. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Ким Дж. Важные соображения при рассмотрении возможности эндоскопической резекции недифференцированного рака желудка на ранней стадии. Мир Дж. Гастроэнтерол. 2016; 22 (3): 1172–1178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Jeon HK, Lee SJ, Kim GH, Park DY, Lee BE, Song GA. Эндоскопическая диссекция подслизистой оболочки при недифференцированном раке желудка на ранней стадии: краткосрочные и отдаленные результаты. Surg Endosc. 2018; 32 (4): 1963–1970. [PubMed] [Google Scholar] 13. Канг Д.Х., Чой С.В., Ким Х.В., Пак С.Б., Ким С.Дж., Нам Х.С. и др. Характеристики локализации раннего рака желудка, леченного с помощью эндоскопической диссекции подслизистой оболочки. Surg Endosc. 2017; 31 (11): 4673–4679. [PubMed] [Google Scholar] 14. Корреа П. Человеческая модель канцерогенеза желудка. Cancer Res.1988. 48 (13): 3554–3560. [PubMed] [Google Scholar] 15. Кимура К., Сато К., Идо К., Танигучи Ю., Такимото Т., Такемото Т. Гастрит в желудке японцев. Scand J Gastroenterol Suppl. 1996; 214: 17–20. [PubMed] [Google Scholar] 16. Кан Х.Й., Ким С.Г., Ким Дж.С., Юнг Х.С., Сон И.С. Клинические результаты эндоскопической диссекции подслизистой оболочки при недифференцированном раке желудка на ранней стадии. Surg Endosc. 2010. 24 (3): 509–516. [PubMed] [Google Scholar] 17. Хуанг Кью, Ши Дж., Сун Кью, Голд Дж. С., Чен Дж., Ву Х и др. Клинико-патологическая характеристика небольших (2 см или меньше) проксимальных и дистальных карцином желудка у населения Китая.Патология. 2015. 47 (6): 526–532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Е Б.Д., Ким С.Г., Ли Дж.Й., Ким Дж. С., Ян Х. К., Ким У. и др. Факторы прогнозирования метастазов в лимфатические узлы и стратегии эндоскопического лечения недифференцированного рака желудка на ранней стадии. J Gastroenterol Hepatol. 2008. 23 (1): 46–50. [PubMed] [Google Scholar] 19. Пак Й.Д., Чунг Й.Дж., Чунг Х.Й., Ю В., Пэ Х.И., Чон С.В. и др. Факторы, связанные с метастазированием лимфатических узлов и возможностью эндоскопической резекции слизистой оболочки для лечения низкодифференцированной аденокарциномы желудка.Эндоскопия. 2008. 40 (1): 7–10. [PubMed] [Google Scholar] 20. Хуан Ц., Фанг Ц., Ши Дж., Сунь Ц., Ву Х, Голд Дж. С. и др. Различия в клинико-патологии ранней карциномы желудка между проксимальной и дистальной локализацией у 438 китайских пациентов. Научный доклад 2015; 5 (1): 13439. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Tajima Y, Nakanishi Y, Yoshino T., Kokawa A, Kusano M, Shimoda T. Клинико-патологическое исследование ранней аденокарциномы кардии желудка: сравнение с ранней аденокарциномой дистального отдела желудка и пищевода.Онкология. 2001; 61 (1): 1–9. [PubMed] [Google Scholar] 22. Бай И, Ли З.С. Эндоскопические, клинико-патологические особенности и прогноз очень молодых пациентов с раком желудка. J Gastroenterol Hepatol. 2011. 26 (11): 1626–1629. [PubMed] [Google Scholar] 23. Като М., Нисида Т., Ямамото К., Хаяси С., Китамура С., Ябута Т. и др. Плановое эндоскопическое наблюдение контролирует вторичный рак после радикальной эндоскопической резекции по поводу раннего рака желудка: многоцентровое ретроспективное когортное исследование, проведенное исследовательской группой ESD Университета Осаки.Кишечник. 2013. 62 (10): 1425–1432. [PubMed] [Google Scholar] 24. Ли Х.Л., Ын С.С., Ли О.Й., Хан Д.С., Юн Б.К., Чой Х.С. и др. Когда мы пропускаем синхронные новообразования желудка при эндоскопии? Gastrointest Endosc. 2010. 71 (7): 1159–1165. [PubMed] [Google Scholar] 25. Пимента-Мело А.Р., Монтейро-Соарес М., Либаниу Д., Динис-Рибейро М. Частота отсутствия рака желудка во время эндоскопии верхних отделов желудочно-кишечного тракта: систематический обзор и метаанализ. Eur J Gastroenterol Hepatol. 2016; 28 (9): 1041–1049. [PubMed] [Google Scholar] 26.Нам Х.С., Ким Х.В., Чой С.В., Канг Д.Х., Пак С.Б., Ким С.Дж. и др. Характеристики упущенной синхронной неоплазии эпителия желудка после эндоскопической диссекции подслизистой оболочки. Медицина (Балтимор) 2018; 97 (39): e12536. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Gong EJ, Lee JH, Jung K, Cho CJ, Na HK, Ahn JY и др. Характеристики пропущенных одновременных поражений желудка на основе повторного анализа эндоскопического изображения. Clin Endosc. 2017; 50 (3): 261–269. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Ю Дж.Х., Шин С.Дж., Ли К.М., Чхве Дж.М., Ви Джо, Ким Д.Х. и др. Как мы можем предсказать наличие пропущенных синхронных поражений после эндоскопической диссекции подслизистой оболочки при раннем раке желудка или аденоме желудка? J Clin Gastroenterol. 2013; 47 (2): e17–22. [PubMed] [Google Scholar] 29. Абэ С., Ода И., Минагава Т., Секигучи М., Нонака С., Сузуки Х. и др. Метахронный рак желудка после радикальной эндоскопической резекции раннего рака желудка. Clin Endosc. 2018; 51 (3): 253–259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Cho CJ, Ahn JY, Jung HY, Jung K, Oh HY, Na HK и др. Заболеваемость и локальная предрасположенность метахронных опухолей после эндоскопической резекции дисплазии высокой степени и раннего рака желудка. Surg Endosc. 2017; 31 (1): 389–397. [PubMed] [Google Scholar] 31. Хосокава О, Кайдзаки Ю., Ватанабэ К., Хаттори М., Доден К., Хаяси Х. и др. Эндоскопическое наблюдение за остаточным раком желудка после ранней онкологической хирургии. Эндоскопия. 2002. 34 (6): 469–473. [PubMed] [Google Scholar] 32. Чедвик Дж., Гроен О, Райли С., Хардвик Р., Кросби Т., Хоар Дж и др.Рак желудка, пропущенный во время эндоскопии в Англии. Clin Gastroenterol Hepatol. 2015; 13 (7): 1264–1270.e1. [PubMed] [Google Scholar] 33. Фуджита С. Биология ранней карциномы желудка. Pathol Res Pract. 1978. 163 (4): 297–309. [PubMed] [Google Scholar] 34. Чо Й.С., Чунг И.К., Ким Дж.Х., Юнг Й, Ли TH, Пак Ш. и др. Факторы риска развития интервального раннего рака желудка после отрицательной эндоскопии. Dig Dis Sci. 2015; 60 (4): 936–943. [PubMed] [Google Scholar] 35. Ли С.П., Сун И.К., Ким Дж.Х., Ли С.И., Пак Х.С., Шим С.С.Факторы, влияющие на сотрудничество пациента во время плановой гастроскопии. Korean J Intern Med (Korean Assoc Intern Med) 2017; 32 (5): 819–826. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Мин Б. Х., Ким Э. Р., Ким К. М., Пак С. К., Ли Дж. Х., Ри П. Л. и др. Стратегия наблюдения, основанная на частоте и характере рецидивов после радикальной эндоскопической диссекции подслизистой оболочки при раннем раке желудка. Эндоскопия. 2015; 47 (9): 784–793. [PubMed] [Google Scholar] 37. Чой Дж., Ким С.Г., Им Дж. П., Ким Дж. С., Юнг Х.С. Отдаленные клинические результаты эндоскопической резекции при раннем раке желудка.Surg Endosc. 2015; 29 (5): 1223–1230. [PubMed] [Google Scholar] 38. Ahn JY, Jung HY, Choi KD, Choi JY, Kim MY, Lee JH и др. Эндоскопические и онкологические исходы после эндоскопической резекции по поводу раннего рака желудка: 1370 случаев абсолютных и расширенных показаний. Gastrointest Endosc. 2011. 74 (3): 485–493. [PubMed] [Google Scholar] 39. Shin KY, Jeon SW, Cho KB, Park KS, Kim ES, Park CK и др. Клинические результаты эндоскопической диссекции подслизистой оболочки раннего рака желудка сопоставимы между абсолютными и новыми расширенными критериями.Кишечная печень. 2015; 9 (2): 181–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Jeon HK, Kim GH, Lee BE, Park DY, Song GA, Kim DH и др. Отдаленный результат эндоскопического расслоения подслизистой оболочки сравним с таковым после операции по поводу рака желудка на ранней стадии: анализ с учетом предрасположенности. Рак желудка. 2018; 21 (1): 133–143. [PubMed] [Google Scholar] 41. Ryu SJ, Kim BW, Kim BG, Kim JH, Kim JS, Kim JI и др. Эндоскопическая диссекция подслизистой оболочки в сравнении с хирургической резекцией при раннем раке желудка: ретроспективное многоцентровое исследование немедленных и отдаленных результатов в течение 5 лет.Surg Endosc. 2016; 30 (12): 5283–5289. [PubMed] [Google Scholar] 42. Хан К.Ю., Пак СН, Ли Ю.К., Чанг Х., Пак Джей Си, Шин С.К. и др. Сравнительное исследование между эндоскопической диссекцией подслизистой оболочки и хирургическим вмешательством у пациентов с ранним раком желудка. Surg Endosc. 2018; 32 (1): 73–86. [PubMed] [Google Scholar] 43. Ким Х.Х., Ким Дж.Х., Ким Г.Х., Чой М.Г., Джи С.Р., Сон Г.А. Причины пропущенных синхронных новообразований эпителия желудка при эндоскопической диссекции подслизистой оболочки: многоцентровое исследование. Сканд Дж Гастроэнтерол. 2013. 48 (11): 1339–1346.[PubMed] [Google Scholar] 44. Ли HJ, Ли YJ, Lee JY, Kim ES, Chung WJ, Jang BK и др. Характеристики синхронных и метахронных множественных опухолей желудка после эндоскопической подслизистой диссекции раннего новообразования желудка. Clin Endosc. 2018; 51 (3): 266–273. [Бесплатная статья PMC] [PubMed] [Google Scholar]Обзор исследований в эпоху эндоскопической расслоения подслизистой оболочки
J Korean Med Sci. 2019 сентябрь 9; 34 (35): e231.
иСу Джин Ким
Кафедра внутренней медицины, Медицинский факультет Пусанского национального университета и научно-исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, Янсан, Корея.
Cheol Woong Choi
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Автор, ответственный за переписку.Адрес для переписки: Cheol Woong Choi, MD, PhD. Отделение внутренней медицины, Медицинский научно-исследовательский институт, Медицинский факультет Пусанского национального университета и Исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, 20 Геумо-ро, Мулгым-уп, Янсан 50612, Республика Корея. ten.liamnah@ecaykculПоступила 01.04.2019; Принято 2 августа 2019 г.org / licenses / by-nc / 4.0 /), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.
Abstract
Выявление рака желудка на ранней стадии улучшает прогноз пациентов. Эндоскопическая подслизистая диссекция (ESD) — это лечебное и сохраняющее желудок лечение раннего рака желудка (EGC), связанное с низким риском метастазирования в лимфатические узлы. Однако в нескольких исследованиях сообщалось о пропущенном диагнозе рака желудка.Следовательно, эндоскописты должны обладать точными диагностическими навыками для устранения эндоскопических слепых пятен. Систематический протокол скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений. Знание особенностей EGC или дисплазии важно для выявления подозрительного поражения. Информация об общих местах возникновения EGC также может позволить провести подробное эндоскопическое обследование для повышения частоты выявления. Предыдущие отчеты об исследовании локализации рака желудка, удаленного с помощью ESD или хирургического вмешательства, показали, что преимущественно поражались антральный отдел и меньшая кривизна желудка. Helicobacter pylori -индуцированные атрофические изменения распространяются от антрального отдела к телу по малой кривизне, преимущественно затрагивая эти области. Рак желудка в антральном отделе и нижнем теле также часто пропускается во время скринингового обследования. Поэтому необходимо тщательное обследование нижней трети желудка, чтобы не пропустить синхронные и метахронные поражения желудка. Знание местоположения EGC позволяет проводить точное эндоскопическое обследование и обнаруживать EGC на ранней стадии.
Ключевые слова: Рак желудка, локализация, эндоскопия
Графическое резюме
ВВЕДЕНИЕ
Рак желудка является серьезной глобальной проблемой здравоохранения, особенно в азиатских странах, включая Корею, Японию и Китай.1 Несмотря на достижения в эндоскопической и хирургической резекции оборудование и методы, рак желудка является третьей по значимости причиной смертности от рака во всем мире. Выявление рака желудка на ранних стадиях и своевременное лечение связаны с благоприятным прогнозом.2,3 Пациенты, у которых диагностирован ранний рак желудка (EGC) во время скрининг-эндоскопии, демонстрируют низкий риск метастазирования лимфатических узлов и могут подвергнуться эндоскопической подслизистой диссекции (ESD) в качестве лечебного местного лечения для сохранения желудка. Однако у большинства пациентов с ЭГК наблюдаются неспецифические симптомы. Предыдущие исследования показали, что распространенность распространенного рака желудка была выше у пациентов, проходящих диагностическое обследование без предварительной эндоскопии для исследования причин желудочно-кишечных симптомов.4 Таким образом, программа массового обследования на рак желудка была принята в Корее и Японии. В недавнем исследовании оценивали влияние скрининга на рак желудка с помощью двухгодичной эндоскопии верхних отделов желудка или гастрографии у взрослых в возрасте ≥ 40 лет, что является Корейской национальной программой скрининга рака. В этом исследовании сообщается об эффективности такой оценки в снижении риска смертности, связанной с раком желудка. 4 Однако есть отчет о заболеваемости интервальным раком желудка (IGC) у пациентов, которые проходили периодическое эндоскопическое обследование в Корее.5 Следовательно, тщательное эндоскопическое обследование является обязательным для снижения количества ложноотрицательных результатов.
Для оптимизации диагностической эффективности эндоскопии следует учитывать несколько факторов. Во-первых, введение спазмолитиков и муколитиков, таких как проназа, облегчает тщательное обследование в качестве предварительной обработки.6 Во-вторых, адекватное вдыхание воздуха и удаление слизи для оптимальной визуализации поверхности слизистой оболочки имеют важное значение для точного обнаружения EGC как технического аспекта обследования.В-третьих, протокол систематического скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений в качестве процедуры наблюдения.7 В дополнение к технически точной эндоскопической процедуре, знание особенностей подозрительных поражений важно для обнаружения EGC. Ключевыми признаками EGC являются поражения с неровной поверхностью (приподнятые или вдавленные поражения) и изменения цвета (красноватый или обесцвеченный), а также спонтанное кровотечение (). При подозрении на EGC или дисплазию хромоэндоскопия с использованием индигокармина может быть полезной для определения морфологии поверхности подозрительных поражений.Наконец, передовые методы визуализации, такие как увеличительная эндоскопия с узкополосным изображением, предоставляют подробную информацию о небольших поражениях желудка. В этом обзоре обсуждаются местоположения EGC, обнаруженные при эндоскопии скрининга и эпиднадзора, особенно в Корее. Эта статья внесет значительный вклад в литературу, предоставив лучшее понимание EGC, и послужит руководством для эндоскопистов в проведении тщательного эндоскопического обследования и наблюдения.
Изображения верхней эндоскопии при раннем раке желудка.( A ) Возвышенное красноватое поражение размером 1,5 см со спонтанным кровотечением (стрелка) находится на большой кривизне антрального отдела. ( B ) На нижней части тела малой кривизны обнаруживается вдавленное и обесцвеченное поражение размером 1,0 см (стрелка). ( C ) На кардии обнаружено плоское поражение размером 0,8 см с неоднородной эритемой (стрелка).
ВНУТРИГАСТИЧЕСКОЕ РАСПОЛОЖЕНИЕ EGC INDICATIVE ESD
Рак слизистой оболочки, размер которого при гистопатологическом исследовании составляет <2 см и показывает хорошо дифференцированные признаки без изъязвления, можно эффективно лечить с помощью ESD из-за низкого риска метастазирования в лимфатические узлы.8 Недавнее многоцентровое подтверждающее исследование (JCOG0607), проведенное Японской клинической онкологической группой, показало, что ЭСД должно быть стандартным лечением (предпочтительнее, чем гастрэктомия) для ЭГК кишечного типа, удовлетворяющего расширенным показаниям. 2 см без язвы, метаанализ, включающий 972 EGC недифференцированного типа из 14 ретроспективных исследований, показал, что ESD показал благоприятный краткосрочный результат.10 Хотя для подтверждения безопасности и эффективности необходимы дальнейшие данные после ESD, эндоскопическая резекция был выполнен с лечебной целью в клинической практике.11 Тем не менее, эндоскописты должны учитывать, что частота лечебной резекции ниже, чем при ESD для дифференцированного типа EGC.12
Раннее обнаружение EGC важно для достижения лечебной резекции с помощью ESD.
Несколько ретроспективных исследований, проведенных в Корее, продемонстрировали, что нижняя часть является наиболее частым местом для выполнения ESD для лечения EGC (). Одно исследование, в котором 647 последовательных поражений EGC были резецированы с помощью ESD, также показало, что наиболее частым местом возникновения EGC была нижняя часть желудка (89.6%). Это исследование показало, что меньшая кривизна была наиболее частым участком поражения (43,6%). 13
Таблица 1
Места раннего рака желудка, подвергшегося эндоскопической резекции
| Автор | Год | Нет | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Мин и др. 36 | 2015 | 1,497 | Единый центр | Тело (21,8) |
| Глазное дно (21.8) | ||||
| Кардия (21,8) | ||||
| Антрум (78,2) | ||||
| Угол (78,2) | ||||
| Ким и др. 3 | 2015 | 165 | Единый центр | Верхний (6,1 ) |
| Средний (14,5) | ||||
| Нижний (79,4) | ||||
| Чой и др. 37 | 2015 | 961 | Единый центр | Верхний (6,0) |
| Средний (21,2) | ||||
| Нижняя (72.8) | ||||
| Ан и др. 38 | 2011 | 1370 | Единый центр | Верхний (7,1) |
| Средний (32,3) | ||||
| Нижний (60,6) | ||||
| Шин и др. .39 | 2015 | 1,105 | Мультицентр | Верхний (4,3) |
| Средний (28,5) | ||||
| Нижний (67,2) |
Нижняя часть желудка включает антрально-пилорический отдел и нижняя треть тела желудка, включая угол.Средняя и верхняя часть относится к средней и верхней третям тела желудка, включая кардию и глазное дно. Инфекция H. pylori вызывает воспаление слизистой оболочки желудка. Раку желудка кишечного типа предшествует индуцированный воспалением каскад предраковых поражений, вызванных воспалением (последовательность атрофия-метаплазия-дисплазия-аденокарцинома) .14 Атрофические изменения слизистой оболочки продвигаются от антрального отдела к телу по меньшей кривизне.15 Распределение Характер атрофии объясняет более высокую частоту EGC в нижних отделах и меньшую кривизну желудка.Хотя вызванный воспалением каскад канцерогенеза инфекцией H. pylori не является основной причиной недифференцированного рака желудка, предполагается, что воспаление само по себе способствует развитию этих видов рака желудка. Таким образом, ЭГК недифференцированного типа обычно встречается в нижних отделах желудка.13,16
ХАРАКТЕРИСТИКИ ХИРУРГИЧЕСКОГО ИЗОБРЕТЕНИЯ РАКА ЖЕЛУДКА НА ОСНОВЕ ЕГО МЕСТОПОЛОЖЕНИЯ
Различные исследования, проведенные в Корее, показали, что нижняя часть является наиболее частым местом поражения. выявлять EGC у пациентов, перенесших хирургическую резекцию ().В одном исследовании оценивали 313 последовательных хирургически удаленных мелких раковых опухолей желудка размером <2 см, чтобы получить информацию об общих местах происхождения этого типа рака желудка.17 EGC в основном были обнаружены в антральном углу (42,2%) и кардии. (26,2%). Большинство (68%) мелких раковых образований желудка возникло по малой кривизне. Этот результат согласуется с исследованием, показывающим резекцию EGC с помощью ESD. Недифференцированные EGC чаще встречаются в дистальном отделе желудка, чем в проксимальном участке.18,19
Таблица 2
Локализация раннего рака желудка, подвергшегося хирургической резекции
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Jeon et al. 40 | 2018 | 275 | Единый центр | Верхний (4,4) |
| Средний (33,1) | ||||
| Нижний (62,5) | ||||
| Kim et al.3 | 2015 | 292 | Единый центр | Верхний (7,2) |
| Средний (14,4) | ||||
| Нижний (78,4) | ||||
| Ryu et al.41 | 2016 | 144 | Мультицентр | Верхний (4,9) |
| Средний (32,9) | ||||
| Нижний (62,2) | ||||
| Хан и др. 42 | 2018 | 1,206 | Мультицентр | Верхний (8.3) |
| Средний (32,8) | ||||
| Нижний (58,9) |
Клинико-патологические исследования по сравнению ранней аденокарциномы кардии желудка и ранней аденокарциномы дистального отдела желудка показали, что проксимальный рак желудка имеет следующие характеристики: 1) преобладание пожилых мужчин, 2) большая тенденция к подслизистой инвазии и 2) лучшая гистопатологическая дифференциация.20,21 В этих исследованиях проксимальный рак желудка определялся как опухоль, эпицентр которой расположен в пределах 3 см ниже желудочно-пищеводного перехода (во избежание ошибочная классификация рака пищевода как рака желудка).Эти отчеты помогут эндоскопистам более интенсивно исследовать угловой антральный отдел и малую кривизну, а также более тщательно оценить кардию у пожилых мужчин в географических районах с высокой распространенностью инфекции H. pylori . Примечательно, что при эндоскопическом обследовании молодых женщин с семейным анамнезом рака желудка необходимо сосредоточить внимание на теле желудка, особенно на участке около большой кривизны.22
ХАРАКТЕРИСТИКИ ОТСУТСТВУЮЩИХ СИНХРОННЫХ ПОВРЕЖДЕНИЙ ЖКТ ЭСД или гастрэктомия.23,24 Отсроченное обнаружение синхронных поражений может привести к дополнительному лечению, включая ЭСД или хирургическое вмешательство, что может вызвать дискомфорт у пациента и увеличить медицинские расходы.
Раннее обнаружение синхронных поражений желудка до того, как они перерастут в инвазивный рак, важно для улучшения прогноза пациентов. Метаанализ, включающий 22 исследования (шесть исследований, проведенных в Корее), показал, что частота пропуска синхронных поражений после ЭСД составляла 9,0% 25. Чрезмерное внимание первичным новообразованиям желудка во время эндоскопии может привести к тому, что другие синхронные поражения могут быть пропущены.26 В одном исследовании сообщалось, что более чем в половине случаев пропущенных синхронных поражений были зафиксированы изображения пропущенных поражений во время предыдущего эндоскопического обследования. 27 Нижние части желудка являются наиболее частым местом для обнаружения пропущенных синхронных поражений (). Факторами, связанными с пропущенными синхронными поражениями, были их небольшой размер и неглубокая морфология. 23,28 Невысокие и небольшие синхронные поражения, вероятно, будут пропущены, поскольку их трудно обнаружить при эндоскопии. Поэтому эндоскописты должны учитывать возможность синхронных новообразований желудка и тщательно обследовать весь желудок, чтобы оценить не только первичные поражения, но и проверить наличие синхронных поражений.
Таблица 3
Расположение пропущенных синхронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Nam и др. 26 | 2018 | 77 | Единый центр | Верхний (5,9) |
| Средний (21,3) | ||||
| Нижний (72,7) | ||||
| Yoo et al.28 | 2013 | 29 | Одноцентровое | Верхнее (6,9) |
| Среднее (31,0) | ||||
| Нижнее (62,1) | ||||
| Ли и др. 24 | 2010 | 12 | Единый центр | Верхний (6,3) |
| Средний (43,8) | ||||
| Нижний (50,0) | ||||
| Ким и др. 43 | 2017 | 141 | Многоцентровый | Верхний (7,1) |
| Средний (32.6) | ||||
| Нижняя (60,3) |
ХАРАКТЕРИСТИКИ МЕТАХРОННОГО РАКА ЖЕЛУДКА (MGC)
MGC обычно определяется как рак желудка, который развился в месте, удаленном от места первичной резекции во время контрольной эндоскопии после эндоскопии. index ESD.29 Ретроспективные исследования показали, что частота метахронных поражений колеблется от 3,6% до 6,1% .30,31 Таким образом, эндоскопическое наблюдение должно быть продолжено после желудочного ESD. В ретроспективном исследовании с участием 2779 пациентов, получавших ESD для EGC и эндоскопического наблюдения в Корее, кумулятивная частота MGC или дисплазии высокой степени за 5 и 10 лет составила 4.7% и 11,3% .30 Нижняя треть желудка была наиболее частой локализацией метахронных поражений (). Другими особенностями MGC являются небольшие дифференцированные внутрислизистые раковые образования размером менее 2 см.29 Таким образом, регулярное эндоскопическое наблюдение может позволить повторную эндоскопическую резекцию по поводу MGC.
Таблица 4
Расположение метахронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Cho et al.30 | 2017 | 96 | Одноцентровое | Верхнее (10,4) |
| Среднее (18,8) | ||||
| Нижнее (70,8) | ||||
| Ли и др. 44 | 2018 | 100 | Мультицентр | Верхний (7) |
| Средний (37) | ||||
| Нижний (56) |
ХАРАКТЕРИСТИКИ IGC
Высокий уровень обнаружения EGC в Корее и Японии объясняется регулярным выполнением скрининговых эндоскопий в этих странах4; однако в нескольких исследованиях сообщалось о случаях IGC.25,32 Понятие IGC происходит от рака толстой кишки и относится к раку, который диагностируется между моментом скрининга и следующей запланированной скрининговой эндоскопией. Следовательно, этот термин применим только в таких странах, как Корея и Япония, где действует национальная программа скрининга на рак желудка. Корейское исследование, в котором оценивались клинико-патологические характеристики IGC, показало, что частота IGC, диагностированная между моментом скрининга и пост-скрининговой эндоскопией, составляла 2.0% (16/81 762 пациента) .5 Характеристиками IGC были рак, обнаруженный в нижнем теле желудка (70,6%) и гистопатологические доказательства недифференцированных поражений (70,6%). Время удвоения рака желудка составляет примерно 2–3 года. 33 Таким образом, большинство поражений IGC в этом исследовании могли быть поражениями, которые прогрессировали из-за пропущенных аномалий слизистой оболочки желудка. Мета-анализ, изучающий частоту пропущенного рака желудка во время эндоскопии верхних отделов желудка, показал, что частота пропущенного рака желудка составляет 9,4%.Выявление рака в интервале от 6 месяцев до 3,5 лет после отрицательного результата эндоскопии считалось пропущенным раком. Таким образом, частота пропущенных поражений может быть выше.25 Большинство пропущенных раковых опухолей желудка представляли собой плохо дифференцированные поражения, расположенные в антральном отделе желудка и нижней части тела.34 Этот результат согласуется с предыдущим исследованием, описывающим IGC. Анатомические различия в различных частях желудка способствуют пропущенному раку желудка. Небольшие очаги рака желудка, возникающие в теле, могут быть скрыты внутри желудочных складок.Частая отрыжка связана с трудным исследованием тела желудка.35
ЗАКЛЮЧЕНИЕ
Раннее обнаружение улучшает прогноз и снижает экономическое бремя рака желудка. Кроме того, ESD — это лечебное средство для сохранения желудка у таких пациентов, когда EGC не прогрессирует до стадии, когда ESD неосуществим. Хорошие знания стандартных эндоскопических методов и эндоскопических особенностей EGC важны для повышения скорости обнаружения EGC. Поэтому эндоскопистам необходимо соответствующее обучение, чтобы улучшить свои технические навыки и знания о различных поражениях желудка.В этой статье основное внимание уделяется важности понимания общих мест возникновения EGC как ключа к точному выявлению рака желудка на ранних стадиях. Было замечено, что меньшая кривизна и нижняя часть желудка являются преобладающими местами, пораженными EGC, которые могут быть резектабельны с помощью ESD или гастрэктомии. Заболеваемость раком желудка с поражением кардии была выше у пожилых мужчин. Большинство IGC были плохо дифференцированы при гистопатологическом исследовании и располагались в антральном отделе желудка и нижней части тела.Эндоскописты должны помнить о возможности возникновения синхронных поражений без приподнятого уровня. Наконец, недавно обнаруженные EGC и MGC часто обнаруживаются в нижней трети, и большинство MGC, обнаруженных во время эндоскопического наблюдения, представляют собой небольшой дифференцированный внутрислизистый рак. В заключение, знание местоположения EGC полезно для точного эндоскопического обследования для скрининга и наблюдения.
Сноски
Раскрытие информации: У авторов нет потенциальных конфликтов интересов для раскрытия.
АвторАвторские взносы:
Концептуализация: Choi CW.
Написание — первоначальный черновик: Kim SJ.
Написание — просмотр и редактирование: Choi CW.
Список литературы
1. Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире.CA Cancer J Clin. 2018; 68 (6): 394–424. [PubMed] [Google Scholar] 2. Кикучи С., Катада Н., Сакурамото С., Кобаяси Н., Симао Х., Ватанабе М. и др. Выживаемость после хирургического лечения раннего рака желудка: хирургические методы и долгосрочное выживание. Langenbecks Arch Surg. 2004. 389 (2): 69–74. [PubMed] [Google Scholar] 3. Ким Й.И., Ким Ю.В., Чой И.Дж., Ким К.Г., Ли Дж.Й., Чо С.Дж. и др. Долгосрочная выживаемость после эндоскопической резекции по сравнению с хирургическим вмешательством при раннем раке желудка. Эндоскопия. 2015; 47 (4): 293–301. [PubMed] [Google Scholar] 4.Jun JK, Choi KS, Lee HY, Suh M, Park B, Song SH и др. Эффективность Корейской национальной программы скрининга рака в снижении смертности от рака желудка. Гастроэнтерология. 2017; 152 (6): 1319–1328.e7. [PubMed] [Google Scholar] 5. Пак М.С., Юн Дж.Й., Чанг Х.С., Ли Х., Пак Джей Си, Шин С.К. и др. Клинико-патологические характеристики интервального рака желудка в Корее. Кишечная печень. 2015; 9 (2): 166–173. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Kim GH, Cho YK, Cha JM, Lee SY, Chung I.K. Попытки повысить качество изображения при эндоскопии: роль проназы.Мир J Gastrointest Endosc. 2016; 8 (5): 267–272. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Японская ассоциация рака желудка. Японская классификация рака желудка: 3-е английское издание. Рак желудка. 2011. 14 (2): 101–112. [PubMed] [Google Scholar] 9. Хасуике Н., Оно Х., Боку Н., Мизусава Дж., Такидзава К., Фукуда Х. и др. Нерандомизированное подтверждающее исследование расширенного показания к эндоскопическому расслоению подслизистой оболочки при раке желудка кишечного типа (cT1a): исследование Японской группы клинической онкологии (JCOG0607) Рак желудка.2018; 21 (1): 114–123. [PubMed] [Google Scholar] 10. Bang CS, Baik GH, Shin IS, Kim JB, Suk KT, Yoon JH и др. Эндоскопическая диссекция подслизистой оболочки при раннем раке желудка с гистологией недифференцированного типа: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21 (19): 6032–6043. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Ким Дж. Важные соображения при рассмотрении возможности эндоскопической резекции недифференцированного рака желудка на ранней стадии. Мир Дж. Гастроэнтерол. 2016; 22 (3): 1172–1178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Jeon HK, Lee SJ, Kim GH, Park DY, Lee BE, Song GA. Эндоскопическая диссекция подслизистой оболочки при недифференцированном раке желудка на ранней стадии: краткосрочные и отдаленные результаты. Surg Endosc. 2018; 32 (4): 1963–1970. [PubMed] [Google Scholar] 13. Канг Д.Х., Чой С.В., Ким Х.В., Пак С.Б., Ким С.Дж., Нам Х.С. и др. Характеристики локализации раннего рака желудка, леченного с помощью эндоскопической диссекции подслизистой оболочки. Surg Endosc. 2017; 31 (11): 4673–4679. [PubMed] [Google Scholar] 14. Корреа П. Человеческая модель канцерогенеза желудка. Cancer Res.1988. 48 (13): 3554–3560. [PubMed] [Google Scholar] 15. Кимура К., Сато К., Идо К., Танигучи Ю., Такимото Т., Такемото Т. Гастрит в желудке японцев. Scand J Gastroenterol Suppl. 1996; 214: 17–20. [PubMed] [Google Scholar] 16. Кан Х.Й., Ким С.Г., Ким Дж.С., Юнг Х.С., Сон И.С. Клинические результаты эндоскопической диссекции подслизистой оболочки при недифференцированном раке желудка на ранней стадии. Surg Endosc. 2010. 24 (3): 509–516. [PubMed] [Google Scholar] 17. Хуанг Кью, Ши Дж., Сун Кью, Голд Дж. С., Чен Дж., Ву Х и др. Клинико-патологическая характеристика небольших (2 см или меньше) проксимальных и дистальных карцином желудка у населения Китая.Патология. 2015. 47 (6): 526–532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Е Б.Д., Ким С.Г., Ли Дж.Й., Ким Дж. С., Ян Х. К., Ким У. и др. Факторы прогнозирования метастазов в лимфатические узлы и стратегии эндоскопического лечения недифференцированного рака желудка на ранней стадии. J Gastroenterol Hepatol. 2008. 23 (1): 46–50. [PubMed] [Google Scholar] 19. Пак Й.Д., Чунг Й.Дж., Чунг Х.Й., Ю В., Пэ Х.И., Чон С.В. и др. Факторы, связанные с метастазированием лимфатических узлов и возможностью эндоскопической резекции слизистой оболочки для лечения низкодифференцированной аденокарциномы желудка.Эндоскопия. 2008. 40 (1): 7–10. [PubMed] [Google Scholar] 20. Хуан Ц., Фанг Ц., Ши Дж., Сунь Ц., Ву Х, Голд Дж. С. и др. Различия в клинико-патологии ранней карциномы желудка между проксимальной и дистальной локализацией у 438 китайских пациентов. Научный доклад 2015; 5 (1): 13439. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Tajima Y, Nakanishi Y, Yoshino T., Kokawa A, Kusano M, Shimoda T. Клинико-патологическое исследование ранней аденокарциномы кардии желудка: сравнение с ранней аденокарциномой дистального отдела желудка и пищевода.Онкология. 2001; 61 (1): 1–9. [PubMed] [Google Scholar] 22. Бай И, Ли З.С. Эндоскопические, клинико-патологические особенности и прогноз очень молодых пациентов с раком желудка. J Gastroenterol Hepatol. 2011. 26 (11): 1626–1629. [PubMed] [Google Scholar] 23. Като М., Нисида Т., Ямамото К., Хаяси С., Китамура С., Ябута Т. и др. Плановое эндоскопическое наблюдение контролирует вторичный рак после радикальной эндоскопической резекции по поводу раннего рака желудка: многоцентровое ретроспективное когортное исследование, проведенное исследовательской группой ESD Университета Осаки.Кишечник. 2013. 62 (10): 1425–1432. [PubMed] [Google Scholar] 24. Ли Х.Л., Ын С.С., Ли О.Й., Хан Д.С., Юн Б.К., Чой Х.С. и др. Когда мы пропускаем синхронные новообразования желудка при эндоскопии? Gastrointest Endosc. 2010. 71 (7): 1159–1165. [PubMed] [Google Scholar] 25. Пимента-Мело А.Р., Монтейро-Соарес М., Либаниу Д., Динис-Рибейро М. Частота отсутствия рака желудка во время эндоскопии верхних отделов желудочно-кишечного тракта: систематический обзор и метаанализ. Eur J Gastroenterol Hepatol. 2016; 28 (9): 1041–1049. [PubMed] [Google Scholar] 26.Нам Х.С., Ким Х.В., Чой С.В., Канг Д.Х., Пак С.Б., Ким С.Дж. и др. Характеристики упущенной синхронной неоплазии эпителия желудка после эндоскопической диссекции подслизистой оболочки. Медицина (Балтимор) 2018; 97 (39): e12536. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Gong EJ, Lee JH, Jung K, Cho CJ, Na HK, Ahn JY и др. Характеристики пропущенных одновременных поражений желудка на основе повторного анализа эндоскопического изображения. Clin Endosc. 2017; 50 (3): 261–269. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Ю Дж.Х., Шин С.Дж., Ли К.М., Чхве Дж.М., Ви Джо, Ким Д.Х. и др. Как мы можем предсказать наличие пропущенных синхронных поражений после эндоскопической диссекции подслизистой оболочки при раннем раке желудка или аденоме желудка? J Clin Gastroenterol. 2013; 47 (2): e17–22. [PubMed] [Google Scholar] 29. Абэ С., Ода И., Минагава Т., Секигучи М., Нонака С., Сузуки Х. и др. Метахронный рак желудка после радикальной эндоскопической резекции раннего рака желудка. Clin Endosc. 2018; 51 (3): 253–259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Cho CJ, Ahn JY, Jung HY, Jung K, Oh HY, Na HK и др. Заболеваемость и локальная предрасположенность метахронных опухолей после эндоскопической резекции дисплазии высокой степени и раннего рака желудка. Surg Endosc. 2017; 31 (1): 389–397. [PubMed] [Google Scholar] 31. Хосокава О, Кайдзаки Ю., Ватанабэ К., Хаттори М., Доден К., Хаяси Х. и др. Эндоскопическое наблюдение за остаточным раком желудка после ранней онкологической хирургии. Эндоскопия. 2002. 34 (6): 469–473. [PubMed] [Google Scholar] 32. Чедвик Дж., Гроен О, Райли С., Хардвик Р., Кросби Т., Хоар Дж и др.Рак желудка, пропущенный во время эндоскопии в Англии. Clin Gastroenterol Hepatol. 2015; 13 (7): 1264–1270.e1. [PubMed] [Google Scholar] 33. Фуджита С. Биология ранней карциномы желудка. Pathol Res Pract. 1978. 163 (4): 297–309. [PubMed] [Google Scholar] 34. Чо Й.С., Чунг И.К., Ким Дж.Х., Юнг Й, Ли TH, Пак Ш. и др. Факторы риска развития интервального раннего рака желудка после отрицательной эндоскопии. Dig Dis Sci. 2015; 60 (4): 936–943. [PubMed] [Google Scholar] 35. Ли С.П., Сун И.К., Ким Дж.Х., Ли С.И., Пак Х.С., Шим С.С.Факторы, влияющие на сотрудничество пациента во время плановой гастроскопии. Korean J Intern Med (Korean Assoc Intern Med) 2017; 32 (5): 819–826. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Мин Б. Х., Ким Э. Р., Ким К. М., Пак С. К., Ли Дж. Х., Ри П. Л. и др. Стратегия наблюдения, основанная на частоте и характере рецидивов после радикальной эндоскопической диссекции подслизистой оболочки при раннем раке желудка. Эндоскопия. 2015; 47 (9): 784–793. [PubMed] [Google Scholar] 37. Чой Дж., Ким С.Г., Им Дж. П., Ким Дж. С., Юнг Х.С. Отдаленные клинические результаты эндоскопической резекции при раннем раке желудка.Surg Endosc. 2015; 29 (5): 1223–1230. [PubMed] [Google Scholar] 38. Ahn JY, Jung HY, Choi KD, Choi JY, Kim MY, Lee JH и др. Эндоскопические и онкологические исходы после эндоскопической резекции по поводу раннего рака желудка: 1370 случаев абсолютных и расширенных показаний. Gastrointest Endosc. 2011. 74 (3): 485–493. [PubMed] [Google Scholar] 39. Shin KY, Jeon SW, Cho KB, Park KS, Kim ES, Park CK и др. Клинические результаты эндоскопической диссекции подслизистой оболочки раннего рака желудка сопоставимы между абсолютными и новыми расширенными критериями.Кишечная печень. 2015; 9 (2): 181–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Jeon HK, Kim GH, Lee BE, Park DY, Song GA, Kim DH и др. Отдаленный результат эндоскопического расслоения подслизистой оболочки сравним с таковым после операции по поводу рака желудка на ранней стадии: анализ с учетом предрасположенности. Рак желудка. 2018; 21 (1): 133–143. [PubMed] [Google Scholar] 41. Ryu SJ, Kim BW, Kim BG, Kim JH, Kim JS, Kim JI и др. Эндоскопическая диссекция подслизистой оболочки в сравнении с хирургической резекцией при раннем раке желудка: ретроспективное многоцентровое исследование немедленных и отдаленных результатов в течение 5 лет.Surg Endosc. 2016; 30 (12): 5283–5289. [PubMed] [Google Scholar] 42. Хан К.Ю., Пак СН, Ли Ю.К., Чанг Х., Пак Джей Си, Шин С.К. и др. Сравнительное исследование между эндоскопической диссекцией подслизистой оболочки и хирургическим вмешательством у пациентов с ранним раком желудка. Surg Endosc. 2018; 32 (1): 73–86. [PubMed] [Google Scholar] 43. Ким Х.Х., Ким Дж.Х., Ким Г.Х., Чой М.Г., Джи С.Р., Сон Г.А. Причины пропущенных синхронных новообразований эпителия желудка при эндоскопической диссекции подслизистой оболочки: многоцентровое исследование. Сканд Дж Гастроэнтерол. 2013. 48 (11): 1339–1346.[PubMed] [Google Scholar] 44. Ли HJ, Ли YJ, Lee JY, Kim ES, Chung WJ, Jang BK и др. Характеристики синхронных и метахронных множественных опухолей желудка после эндоскопической подслизистой диссекции раннего новообразования желудка. Clin Endosc. 2018; 51 (3): 266–273. [Бесплатная статья PMC] [PubMed] [Google Scholar]Обзор исследований в эпоху эндоскопической расслоения подслизистой оболочки
J Korean Med Sci. 2019 сентябрь 9; 34 (35): e231.
иСу Джин Ким
Кафедра внутренней медицины, Медицинский факультет Пусанского национального университета и научно-исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, Янсан, Корея.
Cheol Woong Choi
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Автор, ответственный за переписку.Адрес для переписки: Cheol Woong Choi, MD, PhD. Отделение внутренней медицины, Медицинский научно-исследовательский институт, Медицинский факультет Пусанского национального университета и Исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, 20 Геумо-ро, Мулгым-уп, Янсан 50612, Республика Корея. ten.liamnah@ecaykculПоступила 01.04.2019; Принято 2 августа 2019 г.org / licenses / by-nc / 4.0 /), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.
Abstract
Выявление рака желудка на ранней стадии улучшает прогноз пациентов. Эндоскопическая подслизистая диссекция (ESD) — это лечебное и сохраняющее желудок лечение раннего рака желудка (EGC), связанное с низким риском метастазирования в лимфатические узлы. Однако в нескольких исследованиях сообщалось о пропущенном диагнозе рака желудка.Следовательно, эндоскописты должны обладать точными диагностическими навыками для устранения эндоскопических слепых пятен. Систематический протокол скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений. Знание особенностей EGC или дисплазии важно для выявления подозрительного поражения. Информация об общих местах возникновения EGC также может позволить провести подробное эндоскопическое обследование для повышения частоты выявления. Предыдущие отчеты об исследовании локализации рака желудка, удаленного с помощью ESD или хирургического вмешательства, показали, что преимущественно поражались антральный отдел и меньшая кривизна желудка. Helicobacter pylori -индуцированные атрофические изменения распространяются от антрального отдела к телу по малой кривизне, преимущественно затрагивая эти области. Рак желудка в антральном отделе и нижнем теле также часто пропускается во время скринингового обследования. Поэтому необходимо тщательное обследование нижней трети желудка, чтобы не пропустить синхронные и метахронные поражения желудка. Знание местоположения EGC позволяет проводить точное эндоскопическое обследование и обнаруживать EGC на ранней стадии.
Ключевые слова: Рак желудка, локализация, эндоскопия
Графическое резюме
ВВЕДЕНИЕ
Рак желудка является серьезной глобальной проблемой здравоохранения, особенно в азиатских странах, включая Корею, Японию и Китай.1 Несмотря на достижения в эндоскопической и хирургической резекции оборудование и методы, рак желудка является третьей по значимости причиной смертности от рака во всем мире. Выявление рака желудка на ранних стадиях и своевременное лечение связаны с благоприятным прогнозом.2,3 Пациенты, у которых диагностирован ранний рак желудка (EGC) во время скрининг-эндоскопии, демонстрируют низкий риск метастазирования лимфатических узлов и могут подвергнуться эндоскопической подслизистой диссекции (ESD) в качестве лечебного местного лечения для сохранения желудка. Однако у большинства пациентов с ЭГК наблюдаются неспецифические симптомы. Предыдущие исследования показали, что распространенность распространенного рака желудка была выше у пациентов, проходящих диагностическое обследование без предварительной эндоскопии для исследования причин желудочно-кишечных симптомов.4 Таким образом, программа массового обследования на рак желудка была принята в Корее и Японии. В недавнем исследовании оценивали влияние скрининга на рак желудка с помощью двухгодичной эндоскопии верхних отделов желудка или гастрографии у взрослых в возрасте ≥ 40 лет, что является Корейской национальной программой скрининга рака. В этом исследовании сообщается об эффективности такой оценки в снижении риска смертности, связанной с раком желудка. 4 Однако есть отчет о заболеваемости интервальным раком желудка (IGC) у пациентов, которые проходили периодическое эндоскопическое обследование в Корее.5 Следовательно, тщательное эндоскопическое обследование является обязательным для снижения количества ложноотрицательных результатов.
Для оптимизации диагностической эффективности эндоскопии следует учитывать несколько факторов. Во-первых, введение спазмолитиков и муколитиков, таких как проназа, облегчает тщательное обследование в качестве предварительной обработки.6 Во-вторых, адекватное вдыхание воздуха и удаление слизи для оптимальной визуализации поверхности слизистой оболочки имеют важное значение для точного обнаружения EGC как технического аспекта обследования.В-третьих, протокол систематического скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений в качестве процедуры наблюдения.7 В дополнение к технически точной эндоскопической процедуре, знание особенностей подозрительных поражений важно для обнаружения EGC. Ключевыми признаками EGC являются поражения с неровной поверхностью (приподнятые или вдавленные поражения) и изменения цвета (красноватый или обесцвеченный), а также спонтанное кровотечение (). При подозрении на EGC или дисплазию хромоэндоскопия с использованием индигокармина может быть полезной для определения морфологии поверхности подозрительных поражений.Наконец, передовые методы визуализации, такие как увеличительная эндоскопия с узкополосным изображением, предоставляют подробную информацию о небольших поражениях желудка. В этом обзоре обсуждаются местоположения EGC, обнаруженные при эндоскопии скрининга и эпиднадзора, особенно в Корее. Эта статья внесет значительный вклад в литературу, предоставив лучшее понимание EGC, и послужит руководством для эндоскопистов в проведении тщательного эндоскопического обследования и наблюдения.
Изображения верхней эндоскопии при раннем раке желудка.( A ) Возвышенное красноватое поражение размером 1,5 см со спонтанным кровотечением (стрелка) находится на большой кривизне антрального отдела. ( B ) На нижней части тела малой кривизны обнаруживается вдавленное и обесцвеченное поражение размером 1,0 см (стрелка). ( C ) На кардии обнаружено плоское поражение размером 0,8 см с неоднородной эритемой (стрелка).
ВНУТРИГАСТИЧЕСКОЕ РАСПОЛОЖЕНИЕ EGC INDICATIVE ESD
Рак слизистой оболочки, размер которого при гистопатологическом исследовании составляет <2 см и показывает хорошо дифференцированные признаки без изъязвления, можно эффективно лечить с помощью ESD из-за низкого риска метастазирования в лимфатические узлы.8 Недавнее многоцентровое подтверждающее исследование (JCOG0607), проведенное Японской клинической онкологической группой, показало, что ЭСД должно быть стандартным лечением (предпочтительнее, чем гастрэктомия) для ЭГК кишечного типа, удовлетворяющего расширенным показаниям. 2 см без язвы, метаанализ, включающий 972 EGC недифференцированного типа из 14 ретроспективных исследований, показал, что ESD показал благоприятный краткосрочный результат.10 Хотя для подтверждения безопасности и эффективности необходимы дальнейшие данные после ESD, эндоскопическая резекция был выполнен с лечебной целью в клинической практике.11 Тем не менее, эндоскописты должны учитывать, что частота лечебной резекции ниже, чем при ESD для дифференцированного типа EGC.12
Раннее обнаружение EGC важно для достижения лечебной резекции с помощью ESD.
Несколько ретроспективных исследований, проведенных в Корее, продемонстрировали, что нижняя часть является наиболее частым местом для выполнения ESD для лечения EGC (). Одно исследование, в котором 647 последовательных поражений EGC были резецированы с помощью ESD, также показало, что наиболее частым местом возникновения EGC была нижняя часть желудка (89.6%). Это исследование показало, что меньшая кривизна была наиболее частым участком поражения (43,6%). 13
Таблица 1
Места раннего рака желудка, подвергшегося эндоскопической резекции
| Автор | Год | Нет | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Мин и др. 36 | 2015 | 1,497 | Единый центр | Тело (21,8) |
| Глазное дно (21.8) | ||||
| Кардия (21,8) | ||||
| Антрум (78,2) | ||||
| Угол (78,2) | ||||
| Ким и др. 3 | 2015 | 165 | Единый центр | Верхний (6,1 ) |
| Средний (14,5) | ||||
| Нижний (79,4) | ||||
| Чой и др. 37 | 2015 | 961 | Единый центр | Верхний (6,0) |
| Средний (21,2) | ||||
| Нижняя (72.8) | ||||
| Ан и др. 38 | 2011 | 1370 | Единый центр | Верхний (7,1) |
| Средний (32,3) | ||||
| Нижний (60,6) | ||||
| Шин и др. .39 | 2015 | 1,105 | Мультицентр | Верхний (4,3) |
| Средний (28,5) | ||||
| Нижний (67,2) |
Нижняя часть желудка включает антрально-пилорический отдел и нижняя треть тела желудка, включая угол.Средняя и верхняя часть относится к средней и верхней третям тела желудка, включая кардию и глазное дно. Инфекция H. pylori вызывает воспаление слизистой оболочки желудка. Раку желудка кишечного типа предшествует индуцированный воспалением каскад предраковых поражений, вызванных воспалением (последовательность атрофия-метаплазия-дисплазия-аденокарцинома) .14 Атрофические изменения слизистой оболочки продвигаются от антрального отдела к телу по меньшей кривизне.15 Распределение Характер атрофии объясняет более высокую частоту EGC в нижних отделах и меньшую кривизну желудка.Хотя вызванный воспалением каскад канцерогенеза инфекцией H. pylori не является основной причиной недифференцированного рака желудка, предполагается, что воспаление само по себе способствует развитию этих видов рака желудка. Таким образом, ЭГК недифференцированного типа обычно встречается в нижних отделах желудка.13,16
ХАРАКТЕРИСТИКИ ХИРУРГИЧЕСКОГО ИЗОБРЕТЕНИЯ РАКА ЖЕЛУДКА НА ОСНОВЕ ЕГО МЕСТОПОЛОЖЕНИЯ
Различные исследования, проведенные в Корее, показали, что нижняя часть является наиболее частым местом поражения. выявлять EGC у пациентов, перенесших хирургическую резекцию ().В одном исследовании оценивали 313 последовательных хирургически удаленных мелких раковых опухолей желудка размером <2 см, чтобы получить информацию об общих местах происхождения этого типа рака желудка.17 EGC в основном были обнаружены в антральном углу (42,2%) и кардии. (26,2%). Большинство (68%) мелких раковых образований желудка возникло по малой кривизне. Этот результат согласуется с исследованием, показывающим резекцию EGC с помощью ESD. Недифференцированные EGC чаще встречаются в дистальном отделе желудка, чем в проксимальном участке.18,19
Таблица 2
Локализация раннего рака желудка, подвергшегося хирургической резекции
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Jeon et al. 40 | 2018 | 275 | Единый центр | Верхний (4,4) |
| Средний (33,1) | ||||
| Нижний (62,5) | ||||
| Kim et al.3 | 2015 | 292 | Единый центр | Верхний (7,2) |
| Средний (14,4) | ||||
| Нижний (78,4) | ||||
| Ryu et al.41 | 2016 | 144 | Мультицентр | Верхний (4,9) |
| Средний (32,9) | ||||
| Нижний (62,2) | ||||
| Хан и др. 42 | 2018 | 1,206 | Мультицентр | Верхний (8.3) |
| Средний (32,8) | ||||
| Нижний (58,9) |
Клинико-патологические исследования по сравнению ранней аденокарциномы кардии желудка и ранней аденокарциномы дистального отдела желудка показали, что проксимальный рак желудка имеет следующие характеристики: 1) преобладание пожилых мужчин, 2) большая тенденция к подслизистой инвазии и 2) лучшая гистопатологическая дифференциация.20,21 В этих исследованиях проксимальный рак желудка определялся как опухоль, эпицентр которой расположен в пределах 3 см ниже желудочно-пищеводного перехода (во избежание ошибочная классификация рака пищевода как рака желудка).Эти отчеты помогут эндоскопистам более интенсивно исследовать угловой антральный отдел и малую кривизну, а также более тщательно оценить кардию у пожилых мужчин в географических районах с высокой распространенностью инфекции H. pylori . Примечательно, что при эндоскопическом обследовании молодых женщин с семейным анамнезом рака желудка необходимо сосредоточить внимание на теле желудка, особенно на участке около большой кривизны.22
ХАРАКТЕРИСТИКИ ОТСУТСТВУЮЩИХ СИНХРОННЫХ ПОВРЕЖДЕНИЙ ЖКТ ЭСД или гастрэктомия.23,24 Отсроченное обнаружение синхронных поражений может привести к дополнительному лечению, включая ЭСД или хирургическое вмешательство, что может вызвать дискомфорт у пациента и увеличить медицинские расходы.
Раннее обнаружение синхронных поражений желудка до того, как они перерастут в инвазивный рак, важно для улучшения прогноза пациентов. Метаанализ, включающий 22 исследования (шесть исследований, проведенных в Корее), показал, что частота пропуска синхронных поражений после ЭСД составляла 9,0% 25. Чрезмерное внимание первичным новообразованиям желудка во время эндоскопии может привести к тому, что другие синхронные поражения могут быть пропущены.26 В одном исследовании сообщалось, что более чем в половине случаев пропущенных синхронных поражений были зафиксированы изображения пропущенных поражений во время предыдущего эндоскопического обследования. 27 Нижние части желудка являются наиболее частым местом для обнаружения пропущенных синхронных поражений (). Факторами, связанными с пропущенными синхронными поражениями, были их небольшой размер и неглубокая морфология. 23,28 Невысокие и небольшие синхронные поражения, вероятно, будут пропущены, поскольку их трудно обнаружить при эндоскопии. Поэтому эндоскописты должны учитывать возможность синхронных новообразований желудка и тщательно обследовать весь желудок, чтобы оценить не только первичные поражения, но и проверить наличие синхронных поражений.
Таблица 3
Расположение пропущенных синхронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Nam и др. 26 | 2018 | 77 | Единый центр | Верхний (5,9) |
| Средний (21,3) | ||||
| Нижний (72,7) | ||||
| Yoo et al.28 | 2013 | 29 | Одноцентровое | Верхнее (6,9) |
| Среднее (31,0) | ||||
| Нижнее (62,1) | ||||
| Ли и др. 24 | 2010 | 12 | Единый центр | Верхний (6,3) |
| Средний (43,8) | ||||
| Нижний (50,0) | ||||
| Ким и др. 43 | 2017 | 141 | Многоцентровый | Верхний (7,1) |
| Средний (32.6) | ||||
| Нижняя (60,3) |
ХАРАКТЕРИСТИКИ МЕТАХРОННОГО РАКА ЖЕЛУДКА (MGC)
MGC обычно определяется как рак желудка, который развился в месте, удаленном от места первичной резекции во время контрольной эндоскопии после эндоскопии. index ESD.29 Ретроспективные исследования показали, что частота метахронных поражений колеблется от 3,6% до 6,1% .30,31 Таким образом, эндоскопическое наблюдение должно быть продолжено после желудочного ESD. В ретроспективном исследовании с участием 2779 пациентов, получавших ESD для EGC и эндоскопического наблюдения в Корее, кумулятивная частота MGC или дисплазии высокой степени за 5 и 10 лет составила 4.7% и 11,3% .30 Нижняя треть желудка была наиболее частой локализацией метахронных поражений (). Другими особенностями MGC являются небольшие дифференцированные внутрислизистые раковые образования размером менее 2 см.29 Таким образом, регулярное эндоскопическое наблюдение может позволить повторную эндоскопическую резекцию по поводу MGC.
Таблица 4
Расположение метахронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Cho et al.30 | 2017 | 96 | Одноцентровое | Верхнее (10,4) |
| Среднее (18,8) | ||||
| Нижнее (70,8) | ||||
| Ли и др. 44 | 2018 | 100 | Мультицентр | Верхний (7) |
| Средний (37) | ||||
| Нижний (56) |
ХАРАКТЕРИСТИКИ IGC
Высокий уровень обнаружения EGC в Корее и Японии объясняется регулярным выполнением скрининговых эндоскопий в этих странах4; однако в нескольких исследованиях сообщалось о случаях IGC.25,32 Понятие IGC происходит от рака толстой кишки и относится к раку, который диагностируется между моментом скрининга и следующей запланированной скрининговой эндоскопией. Следовательно, этот термин применим только в таких странах, как Корея и Япония, где действует национальная программа скрининга на рак желудка. Корейское исследование, в котором оценивались клинико-патологические характеристики IGC, показало, что частота IGC, диагностированная между моментом скрининга и пост-скрининговой эндоскопией, составляла 2.0% (16/81 762 пациента) .5 Характеристиками IGC были рак, обнаруженный в нижнем теле желудка (70,6%) и гистопатологические доказательства недифференцированных поражений (70,6%). Время удвоения рака желудка составляет примерно 2–3 года. 33 Таким образом, большинство поражений IGC в этом исследовании могли быть поражениями, которые прогрессировали из-за пропущенных аномалий слизистой оболочки желудка. Мета-анализ, изучающий частоту пропущенного рака желудка во время эндоскопии верхних отделов желудка, показал, что частота пропущенного рака желудка составляет 9,4%.Выявление рака в интервале от 6 месяцев до 3,5 лет после отрицательного результата эндоскопии считалось пропущенным раком. Таким образом, частота пропущенных поражений может быть выше.25 Большинство пропущенных раковых опухолей желудка представляли собой плохо дифференцированные поражения, расположенные в антральном отделе желудка и нижней части тела.34 Этот результат согласуется с предыдущим исследованием, описывающим IGC. Анатомические различия в различных частях желудка способствуют пропущенному раку желудка. Небольшие очаги рака желудка, возникающие в теле, могут быть скрыты внутри желудочных складок.Частая отрыжка связана с трудным исследованием тела желудка.35
ЗАКЛЮЧЕНИЕ
Раннее обнаружение улучшает прогноз и снижает экономическое бремя рака желудка. Кроме того, ESD — это лечебное средство для сохранения желудка у таких пациентов, когда EGC не прогрессирует до стадии, когда ESD неосуществим. Хорошие знания стандартных эндоскопических методов и эндоскопических особенностей EGC важны для повышения скорости обнаружения EGC. Поэтому эндоскопистам необходимо соответствующее обучение, чтобы улучшить свои технические навыки и знания о различных поражениях желудка.В этой статье основное внимание уделяется важности понимания общих мест возникновения EGC как ключа к точному выявлению рака желудка на ранних стадиях. Было замечено, что меньшая кривизна и нижняя часть желудка являются преобладающими местами, пораженными EGC, которые могут быть резектабельны с помощью ESD или гастрэктомии. Заболеваемость раком желудка с поражением кардии была выше у пожилых мужчин. Большинство IGC были плохо дифференцированы при гистопатологическом исследовании и располагались в антральном отделе желудка и нижней части тела.Эндоскописты должны помнить о возможности возникновения синхронных поражений без приподнятого уровня. Наконец, недавно обнаруженные EGC и MGC часто обнаруживаются в нижней трети, и большинство MGC, обнаруженных во время эндоскопического наблюдения, представляют собой небольшой дифференцированный внутрислизистый рак. В заключение, знание местоположения EGC полезно для точного эндоскопического обследования для скрининга и наблюдения.
Сноски
Раскрытие информации: У авторов нет потенциальных конфликтов интересов для раскрытия.
АвторАвторские взносы:
Концептуализация: Choi CW.
Написание — первоначальный черновик: Kim SJ.
Написание — просмотр и редактирование: Choi CW.
Список литературы
1. Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире.CA Cancer J Clin. 2018; 68 (6): 394–424. [PubMed] [Google Scholar] 2. Кикучи С., Катада Н., Сакурамото С., Кобаяси Н., Симао Х., Ватанабе М. и др. Выживаемость после хирургического лечения раннего рака желудка: хирургические методы и долгосрочное выживание. Langenbecks Arch Surg. 2004. 389 (2): 69–74. [PubMed] [Google Scholar] 3. Ким Й.И., Ким Ю.В., Чой И.Дж., Ким К.Г., Ли Дж.Й., Чо С.Дж. и др. Долгосрочная выживаемость после эндоскопической резекции по сравнению с хирургическим вмешательством при раннем раке желудка. Эндоскопия. 2015; 47 (4): 293–301. [PubMed] [Google Scholar] 4.Jun JK, Choi KS, Lee HY, Suh M, Park B, Song SH и др. Эффективность Корейской национальной программы скрининга рака в снижении смертности от рака желудка. Гастроэнтерология. 2017; 152 (6): 1319–1328.e7. [PubMed] [Google Scholar] 5. Пак М.С., Юн Дж.Й., Чанг Х.С., Ли Х., Пак Джей Си, Шин С.К. и др. Клинико-патологические характеристики интервального рака желудка в Корее. Кишечная печень. 2015; 9 (2): 166–173. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Kim GH, Cho YK, Cha JM, Lee SY, Chung I.K. Попытки повысить качество изображения при эндоскопии: роль проназы.Мир J Gastrointest Endosc. 2016; 8 (5): 267–272. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Японская ассоциация рака желудка. Японская классификация рака желудка: 3-е английское издание. Рак желудка. 2011. 14 (2): 101–112. [PubMed] [Google Scholar] 9. Хасуике Н., Оно Х., Боку Н., Мизусава Дж., Такидзава К., Фукуда Х. и др. Нерандомизированное подтверждающее исследование расширенного показания к эндоскопическому расслоению подслизистой оболочки при раке желудка кишечного типа (cT1a): исследование Японской группы клинической онкологии (JCOG0607) Рак желудка.2018; 21 (1): 114–123. [PubMed] [Google Scholar] 10. Bang CS, Baik GH, Shin IS, Kim JB, Suk KT, Yoon JH и др. Эндоскопическая диссекция подслизистой оболочки при раннем раке желудка с гистологией недифференцированного типа: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21 (19): 6032–6043. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Ким Дж. Важные соображения при рассмотрении возможности эндоскопической резекции недифференцированного рака желудка на ранней стадии. Мир Дж. Гастроэнтерол. 2016; 22 (3): 1172–1178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Jeon HK, Lee SJ, Kim GH, Park DY, Lee BE, Song GA. Эндоскопическая диссекция подслизистой оболочки при недифференцированном раке желудка на ранней стадии: краткосрочные и отдаленные результаты. Surg Endosc. 2018; 32 (4): 1963–1970. [PubMed] [Google Scholar] 13. Канг Д.Х., Чой С.В., Ким Х.В., Пак С.Б., Ким С.Дж., Нам Х.С. и др. Характеристики локализации раннего рака желудка, леченного с помощью эндоскопической диссекции подслизистой оболочки. Surg Endosc. 2017; 31 (11): 4673–4679. [PubMed] [Google Scholar] 14. Корреа П. Человеческая модель канцерогенеза желудка. Cancer Res.1988. 48 (13): 3554–3560. [PubMed] [Google Scholar] 15. Кимура К., Сато К., Идо К., Танигучи Ю., Такимото Т., Такемото Т. Гастрит в желудке японцев. Scand J Gastroenterol Suppl. 1996; 214: 17–20. [PubMed] [Google Scholar] 16. Кан Х.Й., Ким С.Г., Ким Дж.С., Юнг Х.С., Сон И.С. Клинические результаты эндоскопической диссекции подслизистой оболочки при недифференцированном раке желудка на ранней стадии. Surg Endosc. 2010. 24 (3): 509–516. [PubMed] [Google Scholar] 17. Хуанг Кью, Ши Дж., Сун Кью, Голд Дж. С., Чен Дж., Ву Х и др. Клинико-патологическая характеристика небольших (2 см или меньше) проксимальных и дистальных карцином желудка у населения Китая.Патология. 2015. 47 (6): 526–532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Е Б.Д., Ким С.Г., Ли Дж.Й., Ким Дж. С., Ян Х. К., Ким У. и др. Факторы прогнозирования метастазов в лимфатические узлы и стратегии эндоскопического лечения недифференцированного рака желудка на ранней стадии. J Gastroenterol Hepatol. 2008. 23 (1): 46–50. [PubMed] [Google Scholar] 19. Пак Й.Д., Чунг Й.Дж., Чунг Х.Й., Ю В., Пэ Х.И., Чон С.В. и др. Факторы, связанные с метастазированием лимфатических узлов и возможностью эндоскопической резекции слизистой оболочки для лечения низкодифференцированной аденокарциномы желудка.Эндоскопия. 2008. 40 (1): 7–10. [PubMed] [Google Scholar] 20. Хуан Ц., Фанг Ц., Ши Дж., Сунь Ц., Ву Х, Голд Дж. С. и др. Различия в клинико-патологии ранней карциномы желудка между проксимальной и дистальной локализацией у 438 китайских пациентов. Научный доклад 2015; 5 (1): 13439. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Tajima Y, Nakanishi Y, Yoshino T., Kokawa A, Kusano M, Shimoda T. Клинико-патологическое исследование ранней аденокарциномы кардии желудка: сравнение с ранней аденокарциномой дистального отдела желудка и пищевода.Онкология. 2001; 61 (1): 1–9. [PubMed] [Google Scholar] 22. Бай И, Ли З.С. Эндоскопические, клинико-патологические особенности и прогноз очень молодых пациентов с раком желудка. J Gastroenterol Hepatol. 2011. 26 (11): 1626–1629. [PubMed] [Google Scholar] 23. Като М., Нисида Т., Ямамото К., Хаяси С., Китамура С., Ябута Т. и др. Плановое эндоскопическое наблюдение контролирует вторичный рак после радикальной эндоскопической резекции по поводу раннего рака желудка: многоцентровое ретроспективное когортное исследование, проведенное исследовательской группой ESD Университета Осаки.Кишечник. 2013. 62 (10): 1425–1432. [PubMed] [Google Scholar] 24. Ли Х.Л., Ын С.С., Ли О.Й., Хан Д.С., Юн Б.К., Чой Х.С. и др. Когда мы пропускаем синхронные новообразования желудка при эндоскопии? Gastrointest Endosc. 2010. 71 (7): 1159–1165. [PubMed] [Google Scholar] 25. Пимента-Мело А.Р., Монтейро-Соарес М., Либаниу Д., Динис-Рибейро М. Частота отсутствия рака желудка во время эндоскопии верхних отделов желудочно-кишечного тракта: систематический обзор и метаанализ. Eur J Gastroenterol Hepatol. 2016; 28 (9): 1041–1049. [PubMed] [Google Scholar] 26.Нам Х.С., Ким Х.В., Чой С.В., Канг Д.Х., Пак С.Б., Ким С.Дж. и др. Характеристики упущенной синхронной неоплазии эпителия желудка после эндоскопической диссекции подслизистой оболочки. Медицина (Балтимор) 2018; 97 (39): e12536. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Gong EJ, Lee JH, Jung K, Cho CJ, Na HK, Ahn JY и др. Характеристики пропущенных одновременных поражений желудка на основе повторного анализа эндоскопического изображения. Clin Endosc. 2017; 50 (3): 261–269. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Ю Дж.Х., Шин С.Дж., Ли К.М., Чхве Дж.М., Ви Джо, Ким Д.Х. и др. Как мы можем предсказать наличие пропущенных синхронных поражений после эндоскопической диссекции подслизистой оболочки при раннем раке желудка или аденоме желудка? J Clin Gastroenterol. 2013; 47 (2): e17–22. [PubMed] [Google Scholar] 29. Абэ С., Ода И., Минагава Т., Секигучи М., Нонака С., Сузуки Х. и др. Метахронный рак желудка после радикальной эндоскопической резекции раннего рака желудка. Clin Endosc. 2018; 51 (3): 253–259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Cho CJ, Ahn JY, Jung HY, Jung K, Oh HY, Na HK и др. Заболеваемость и локальная предрасположенность метахронных опухолей после эндоскопической резекции дисплазии высокой степени и раннего рака желудка. Surg Endosc. 2017; 31 (1): 389–397. [PubMed] [Google Scholar] 31. Хосокава О, Кайдзаки Ю., Ватанабэ К., Хаттори М., Доден К., Хаяси Х. и др. Эндоскопическое наблюдение за остаточным раком желудка после ранней онкологической хирургии. Эндоскопия. 2002. 34 (6): 469–473. [PubMed] [Google Scholar] 32. Чедвик Дж., Гроен О, Райли С., Хардвик Р., Кросби Т., Хоар Дж и др.Рак желудка, пропущенный во время эндоскопии в Англии. Clin Gastroenterol Hepatol. 2015; 13 (7): 1264–1270.e1. [PubMed] [Google Scholar] 33. Фуджита С. Биология ранней карциномы желудка. Pathol Res Pract. 1978. 163 (4): 297–309. [PubMed] [Google Scholar] 34. Чо Й.С., Чунг И.К., Ким Дж.Х., Юнг Й, Ли TH, Пак Ш. и др. Факторы риска развития интервального раннего рака желудка после отрицательной эндоскопии. Dig Dis Sci. 2015; 60 (4): 936–943. [PubMed] [Google Scholar] 35. Ли С.П., Сун И.К., Ким Дж.Х., Ли С.И., Пак Х.С., Шим С.С.Факторы, влияющие на сотрудничество пациента во время плановой гастроскопии. Korean J Intern Med (Korean Assoc Intern Med) 2017; 32 (5): 819–826. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Мин Б. Х., Ким Э. Р., Ким К. М., Пак С. К., Ли Дж. Х., Ри П. Л. и др. Стратегия наблюдения, основанная на частоте и характере рецидивов после радикальной эндоскопической диссекции подслизистой оболочки при раннем раке желудка. Эндоскопия. 2015; 47 (9): 784–793. [PubMed] [Google Scholar] 37. Чой Дж., Ким С.Г., Им Дж. П., Ким Дж. С., Юнг Х.С. Отдаленные клинические результаты эндоскопической резекции при раннем раке желудка.Surg Endosc. 2015; 29 (5): 1223–1230. [PubMed] [Google Scholar] 38. Ahn JY, Jung HY, Choi KD, Choi JY, Kim MY, Lee JH и др. Эндоскопические и онкологические исходы после эндоскопической резекции по поводу раннего рака желудка: 1370 случаев абсолютных и расширенных показаний. Gastrointest Endosc. 2011. 74 (3): 485–493. [PubMed] [Google Scholar] 39. Shin KY, Jeon SW, Cho KB, Park KS, Kim ES, Park CK и др. Клинические результаты эндоскопической диссекции подслизистой оболочки раннего рака желудка сопоставимы между абсолютными и новыми расширенными критериями.Кишечная печень. 2015; 9 (2): 181–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Jeon HK, Kim GH, Lee BE, Park DY, Song GA, Kim DH и др. Отдаленный результат эндоскопического расслоения подслизистой оболочки сравним с таковым после операции по поводу рака желудка на ранней стадии: анализ с учетом предрасположенности. Рак желудка. 2018; 21 (1): 133–143. [PubMed] [Google Scholar] 41. Ryu SJ, Kim BW, Kim BG, Kim JH, Kim JS, Kim JI и др. Эндоскопическая диссекция подслизистой оболочки в сравнении с хирургической резекцией при раннем раке желудка: ретроспективное многоцентровое исследование немедленных и отдаленных результатов в течение 5 лет.Surg Endosc. 2016; 30 (12): 5283–5289. [PubMed] [Google Scholar] 42. Хан К.Ю., Пак СН, Ли Ю.К., Чанг Х., Пак Джей Си, Шин С.К. и др. Сравнительное исследование между эндоскопической диссекцией подслизистой оболочки и хирургическим вмешательством у пациентов с ранним раком желудка. Surg Endosc. 2018; 32 (1): 73–86. [PubMed] [Google Scholar] 43. Ким Х.Х., Ким Дж.Х., Ким Г.Х., Чой М.Г., Джи С.Р., Сон Г.А. Причины пропущенных синхронных новообразований эпителия желудка при эндоскопической диссекции подслизистой оболочки: многоцентровое исследование. Сканд Дж Гастроэнтерол. 2013. 48 (11): 1339–1346.[PubMed] [Google Scholar] 44. Ли HJ, Ли YJ, Lee JY, Kim ES, Chung WJ, Jang BK и др. Характеристики синхронных и метахронных множественных опухолей желудка после эндоскопической подслизистой диссекции раннего новообразования желудка. Clin Endosc. 2018; 51 (3): 266–273. [Бесплатная статья PMC] [PubMed] [Google Scholar]Обзор исследований в эпоху эндоскопической расслоения подслизистой оболочки
J Korean Med Sci. 2019 сентябрь 9; 34 (35): e231.
иСу Джин Ким
Кафедра внутренней медицины, Медицинский факультет Пусанского национального университета и научно-исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, Янсан, Корея.
Cheol Woong Choi
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Кафедра внутренней медицины, Школа медицины Пусанского национального университета и Научно-исследовательский институт конвергенции биомедицинских наук и технологий, Больница Янсан Пусанского национального университета, Янсан, Корея.
Автор, ответственный за переписку.Адрес для переписки: Cheol Woong Choi, MD, PhD. Отделение внутренней медицины, Медицинский научно-исследовательский институт, Медицинский факультет Пусанского национального университета и Исследовательский институт конвергенции биомедицинских наук и технологий, Госпиталь Янсан Пусанского национального университета, 20 Геумо-ро, Мулгым-уп, Янсан 50612, Республика Корея. ten.liamnah@ecaykculПоступила 01.04.2019; Принято 2 августа 2019 г.org / licenses / by-nc / 4.0 /), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.
Abstract
Выявление рака желудка на ранней стадии улучшает прогноз пациентов. Эндоскопическая подслизистая диссекция (ESD) — это лечебное и сохраняющее желудок лечение раннего рака желудка (EGC), связанное с низким риском метастазирования в лимфатические узлы. Однако в нескольких исследованиях сообщалось о пропущенном диагнозе рака желудка.Следовательно, эндоскописты должны обладать точными диагностическими навыками для устранения эндоскопических слепых пятен. Систематический протокол скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений. Знание особенностей EGC или дисплазии важно для выявления подозрительного поражения. Информация об общих местах возникновения EGC также может позволить провести подробное эндоскопическое обследование для повышения частоты выявления. Предыдущие отчеты об исследовании локализации рака желудка, удаленного с помощью ESD или хирургического вмешательства, показали, что преимущественно поражались антральный отдел и меньшая кривизна желудка. Helicobacter pylori -индуцированные атрофические изменения распространяются от антрального отдела к телу по малой кривизне, преимущественно затрагивая эти области. Рак желудка в антральном отделе и нижнем теле также часто пропускается во время скринингового обследования. Поэтому необходимо тщательное обследование нижней трети желудка, чтобы не пропустить синхронные и метахронные поражения желудка. Знание местоположения EGC позволяет проводить точное эндоскопическое обследование и обнаруживать EGC на ранней стадии.
Ключевые слова: Рак желудка, локализация, эндоскопия
Графическое резюме
ВВЕДЕНИЕ
Рак желудка является серьезной глобальной проблемой здравоохранения, особенно в азиатских странах, включая Корею, Японию и Китай.1 Несмотря на достижения в эндоскопической и хирургической резекции оборудование и методы, рак желудка является третьей по значимости причиной смертности от рака во всем мире. Выявление рака желудка на ранних стадиях и своевременное лечение связаны с благоприятным прогнозом.2,3 Пациенты, у которых диагностирован ранний рак желудка (EGC) во время скрининг-эндоскопии, демонстрируют низкий риск метастазирования лимфатических узлов и могут подвергнуться эндоскопической подслизистой диссекции (ESD) в качестве лечебного местного лечения для сохранения желудка. Однако у большинства пациентов с ЭГК наблюдаются неспецифические симптомы. Предыдущие исследования показали, что распространенность распространенного рака желудка была выше у пациентов, проходящих диагностическое обследование без предварительной эндоскопии для исследования причин желудочно-кишечных симптомов.4 Таким образом, программа массового обследования на рак желудка была принята в Корее и Японии. В недавнем исследовании оценивали влияние скрининга на рак желудка с помощью двухгодичной эндоскопии верхних отделов желудка или гастрографии у взрослых в возрасте ≥ 40 лет, что является Корейской национальной программой скрининга рака. В этом исследовании сообщается об эффективности такой оценки в снижении риска смертности, связанной с раком желудка. 4 Однако есть отчет о заболеваемости интервальным раком желудка (IGC) у пациентов, которые проходили периодическое эндоскопическое обследование в Корее.5 Следовательно, тщательное эндоскопическое обследование является обязательным для снижения количества ложноотрицательных результатов.
Для оптимизации диагностической эффективности эндоскопии следует учитывать несколько факторов. Во-первых, введение спазмолитиков и муколитиков, таких как проназа, облегчает тщательное обследование в качестве предварительной обработки.6 Во-вторых, адекватное вдыхание воздуха и удаление слизи для оптимальной визуализации поверхности слизистой оболочки имеют важное значение для точного обнаружения EGC как технического аспекта обследования.В-третьих, протокол систематического скрининга для картирования всего желудка без слепых пятен снижает риск пропущенных поражений в качестве процедуры наблюдения.7 В дополнение к технически точной эндоскопической процедуре, знание особенностей подозрительных поражений важно для обнаружения EGC. Ключевыми признаками EGC являются поражения с неровной поверхностью (приподнятые или вдавленные поражения) и изменения цвета (красноватый или обесцвеченный), а также спонтанное кровотечение (). При подозрении на EGC или дисплазию хромоэндоскопия с использованием индигокармина может быть полезной для определения морфологии поверхности подозрительных поражений.Наконец, передовые методы визуализации, такие как увеличительная эндоскопия с узкополосным изображением, предоставляют подробную информацию о небольших поражениях желудка. В этом обзоре обсуждаются местоположения EGC, обнаруженные при эндоскопии скрининга и эпиднадзора, особенно в Корее. Эта статья внесет значительный вклад в литературу, предоставив лучшее понимание EGC, и послужит руководством для эндоскопистов в проведении тщательного эндоскопического обследования и наблюдения.
Изображения верхней эндоскопии при раннем раке желудка.( A ) Возвышенное красноватое поражение размером 1,5 см со спонтанным кровотечением (стрелка) находится на большой кривизне антрального отдела. ( B ) На нижней части тела малой кривизны обнаруживается вдавленное и обесцвеченное поражение размером 1,0 см (стрелка). ( C ) На кардии обнаружено плоское поражение размером 0,8 см с неоднородной эритемой (стрелка).
ВНУТРИГАСТИЧЕСКОЕ РАСПОЛОЖЕНИЕ EGC INDICATIVE ESD
Рак слизистой оболочки, размер которого при гистопатологическом исследовании составляет <2 см и показывает хорошо дифференцированные признаки без изъязвления, можно эффективно лечить с помощью ESD из-за низкого риска метастазирования в лимфатические узлы.8 Недавнее многоцентровое подтверждающее исследование (JCOG0607), проведенное Японской клинической онкологической группой, показало, что ЭСД должно быть стандартным лечением (предпочтительнее, чем гастрэктомия) для ЭГК кишечного типа, удовлетворяющего расширенным показаниям. 2 см без язвы, метаанализ, включающий 972 EGC недифференцированного типа из 14 ретроспективных исследований, показал, что ESD показал благоприятный краткосрочный результат.10 Хотя для подтверждения безопасности и эффективности необходимы дальнейшие данные после ESD, эндоскопическая резекция был выполнен с лечебной целью в клинической практике.11 Тем не менее, эндоскописты должны учитывать, что частота лечебной резекции ниже, чем при ESD для дифференцированного типа EGC.12
Раннее обнаружение EGC важно для достижения лечебной резекции с помощью ESD.
Несколько ретроспективных исследований, проведенных в Корее, продемонстрировали, что нижняя часть является наиболее частым местом для выполнения ESD для лечения EGC (). Одно исследование, в котором 647 последовательных поражений EGC были резецированы с помощью ESD, также показало, что наиболее частым местом возникновения EGC была нижняя часть желудка (89.6%). Это исследование показало, что меньшая кривизна была наиболее частым участком поражения (43,6%). 13
Таблица 1
Места раннего рака желудка, подвергшегося эндоскопической резекции
| Автор | Год | Нет | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Мин и др. 36 | 2015 | 1,497 | Единый центр | Тело (21,8) |
| Глазное дно (21.8) | ||||
| Кардия (21,8) | ||||
| Антрум (78,2) | ||||
| Угол (78,2) | ||||
| Ким и др. 3 | 2015 | 165 | Единый центр | Верхний (6,1 ) |
| Средний (14,5) | ||||
| Нижний (79,4) | ||||
| Чой и др. 37 | 2015 | 961 | Единый центр | Верхний (6,0) |
| Средний (21,2) | ||||
| Нижняя (72.8) | ||||
| Ан и др. 38 | 2011 | 1370 | Единый центр | Верхний (7,1) |
| Средний (32,3) | ||||
| Нижний (60,6) | ||||
| Шин и др. .39 | 2015 | 1,105 | Мультицентр | Верхний (4,3) |
| Средний (28,5) | ||||
| Нижний (67,2) |
Нижняя часть желудка включает антрально-пилорический отдел и нижняя треть тела желудка, включая угол.Средняя и верхняя часть относится к средней и верхней третям тела желудка, включая кардию и глазное дно. Инфекция H. pylori вызывает воспаление слизистой оболочки желудка. Раку желудка кишечного типа предшествует индуцированный воспалением каскад предраковых поражений, вызванных воспалением (последовательность атрофия-метаплазия-дисплазия-аденокарцинома) .14 Атрофические изменения слизистой оболочки продвигаются от антрального отдела к телу по меньшей кривизне.15 Распределение Характер атрофии объясняет более высокую частоту EGC в нижних отделах и меньшую кривизну желудка.Хотя вызванный воспалением каскад канцерогенеза инфекцией H. pylori не является основной причиной недифференцированного рака желудка, предполагается, что воспаление само по себе способствует развитию этих видов рака желудка. Таким образом, ЭГК недифференцированного типа обычно встречается в нижних отделах желудка.13,16
ХАРАКТЕРИСТИКИ ХИРУРГИЧЕСКОГО ИЗОБРЕТЕНИЯ РАКА ЖЕЛУДКА НА ОСНОВЕ ЕГО МЕСТОПОЛОЖЕНИЯ
Различные исследования, проведенные в Корее, показали, что нижняя часть является наиболее частым местом поражения. выявлять EGC у пациентов, перенесших хирургическую резекцию ().В одном исследовании оценивали 313 последовательных хирургически удаленных мелких раковых опухолей желудка размером <2 см, чтобы получить информацию об общих местах происхождения этого типа рака желудка.17 EGC в основном были обнаружены в антральном углу (42,2%) и кардии. (26,2%). Большинство (68%) мелких раковых образований желудка возникло по малой кривизне. Этот результат согласуется с исследованием, показывающим резекцию EGC с помощью ESD. Недифференцированные EGC чаще встречаются в дистальном отделе желудка, чем в проксимальном участке.18,19
Таблица 2
Локализация раннего рака желудка, подвергшегося хирургической резекции
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Jeon et al. 40 | 2018 | 275 | Единый центр | Верхний (4,4) |
| Средний (33,1) | ||||
| Нижний (62,5) | ||||
| Kim et al.3 | 2015 | 292 | Единый центр | Верхний (7,2) |
| Средний (14,4) | ||||
| Нижний (78,4) | ||||
| Ryu et al.41 | 2016 | 144 | Мультицентр | Верхний (4,9) |
| Средний (32,9) | ||||
| Нижний (62,2) | ||||
| Хан и др. 42 | 2018 | 1,206 | Мультицентр | Верхний (8.3) |
| Средний (32,8) | ||||
| Нижний (58,9) |
Клинико-патологические исследования по сравнению ранней аденокарциномы кардии желудка и ранней аденокарциномы дистального отдела желудка показали, что проксимальный рак желудка имеет следующие характеристики: 1) преобладание пожилых мужчин, 2) большая тенденция к подслизистой инвазии и 2) лучшая гистопатологическая дифференциация.20,21 В этих исследованиях проксимальный рак желудка определялся как опухоль, эпицентр которой расположен в пределах 3 см ниже желудочно-пищеводного перехода (во избежание ошибочная классификация рака пищевода как рака желудка).Эти отчеты помогут эндоскопистам более интенсивно исследовать угловой антральный отдел и малую кривизну, а также более тщательно оценить кардию у пожилых мужчин в географических районах с высокой распространенностью инфекции H. pylori . Примечательно, что при эндоскопическом обследовании молодых женщин с семейным анамнезом рака желудка необходимо сосредоточить внимание на теле желудка, особенно на участке около большой кривизны.22
ХАРАКТЕРИСТИКИ ОТСУТСТВУЮЩИХ СИНХРОННЫХ ПОВРЕЖДЕНИЙ ЖКТ ЭСД или гастрэктомия.23,24 Отсроченное обнаружение синхронных поражений может привести к дополнительному лечению, включая ЭСД или хирургическое вмешательство, что может вызвать дискомфорт у пациента и увеличить медицинские расходы.
Раннее обнаружение синхронных поражений желудка до того, как они перерастут в инвазивный рак, важно для улучшения прогноза пациентов. Метаанализ, включающий 22 исследования (шесть исследований, проведенных в Корее), показал, что частота пропуска синхронных поражений после ЭСД составляла 9,0% 25. Чрезмерное внимание первичным новообразованиям желудка во время эндоскопии может привести к тому, что другие синхронные поражения могут быть пропущены.26 В одном исследовании сообщалось, что более чем в половине случаев пропущенных синхронных поражений были зафиксированы изображения пропущенных поражений во время предыдущего эндоскопического обследования. 27 Нижние части желудка являются наиболее частым местом для обнаружения пропущенных синхронных поражений (). Факторами, связанными с пропущенными синхронными поражениями, были их небольшой размер и неглубокая морфология. 23,28 Невысокие и небольшие синхронные поражения, вероятно, будут пропущены, поскольку их трудно обнаружить при эндоскопии. Поэтому эндоскописты должны учитывать возможность синхронных новообразований желудка и тщательно обследовать весь желудок, чтобы оценить не только первичные поражения, но и проверить наличие синхронных поражений.
Таблица 3
Расположение пропущенных синхронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Nam и др. 26 | 2018 | 77 | Единый центр | Верхний (5,9) |
| Средний (21,3) | ||||
| Нижний (72,7) | ||||
| Yoo et al.28 | 2013 | 29 | Одноцентровое | Верхнее (6,9) |
| Среднее (31,0) | ||||
| Нижнее (62,1) | ||||
| Ли и др. 24 | 2010 | 12 | Единый центр | Верхний (6,3) |
| Средний (43,8) | ||||
| Нижний (50,0) | ||||
| Ким и др. 43 | 2017 | 141 | Многоцентровый | Верхний (7,1) |
| Средний (32.6) | ||||
| Нижняя (60,3) |
ХАРАКТЕРИСТИКИ МЕТАХРОННОГО РАКА ЖЕЛУДКА (MGC)
MGC обычно определяется как рак желудка, который развился в месте, удаленном от места первичной резекции во время контрольной эндоскопии после эндоскопии. index ESD.29 Ретроспективные исследования показали, что частота метахронных поражений колеблется от 3,6% до 6,1% .30,31 Таким образом, эндоскопическое наблюдение должно быть продолжено после желудочного ESD. В ретроспективном исследовании с участием 2779 пациентов, получавших ESD для EGC и эндоскопического наблюдения в Корее, кумулятивная частота MGC или дисплазии высокой степени за 5 и 10 лет составила 4.7% и 11,3% .30 Нижняя треть желудка была наиболее частой локализацией метахронных поражений (). Другими особенностями MGC являются небольшие дифференцированные внутрислизистые раковые образования размером менее 2 см.29 Таким образом, регулярное эндоскопическое наблюдение может позволить повторную эндоскопическую резекцию по поводу MGC.
Таблица 4
Расположение метахронных поражений желудка после эндоскопической резекции в Корее
| Автор | Год | № | Дизайн исследования | Расположение опухоли (%) |
|---|---|---|---|---|
| Cho et al.30 | 2017 | 96 | Одноцентровое | Верхнее (10,4) |
| Среднее (18,8) | ||||
| Нижнее (70,8) | ||||
| Ли и др. 44 | 2018 | 100 | Мультицентр | Верхний (7) |
| Средний (37) | ||||
| Нижний (56) |
ХАРАКТЕРИСТИКИ IGC
Высокий уровень обнаружения EGC в Корее и Японии объясняется регулярным выполнением скрининговых эндоскопий в этих странах4; однако в нескольких исследованиях сообщалось о случаях IGC.25,32 Понятие IGC происходит от рака толстой кишки и относится к раку, который диагностируется между моментом скрининга и следующей запланированной скрининговой эндоскопией. Следовательно, этот термин применим только в таких странах, как Корея и Япония, где действует национальная программа скрининга на рак желудка. Корейское исследование, в котором оценивались клинико-патологические характеристики IGC, показало, что частота IGC, диагностированная между моментом скрининга и пост-скрининговой эндоскопией, составляла 2.0% (16/81 762 пациента) .5 Характеристиками IGC были рак, обнаруженный в нижнем теле желудка (70,6%) и гистопатологические доказательства недифференцированных поражений (70,6%). Время удвоения рака желудка составляет примерно 2–3 года. 33 Таким образом, большинство поражений IGC в этом исследовании могли быть поражениями, которые прогрессировали из-за пропущенных аномалий слизистой оболочки желудка. Мета-анализ, изучающий частоту пропущенного рака желудка во время эндоскопии верхних отделов желудка, показал, что частота пропущенного рака желудка составляет 9,4%.Выявление рака в интервале от 6 месяцев до 3,5 лет после отрицательного результата эндоскопии считалось пропущенным раком. Таким образом, частота пропущенных поражений может быть выше.25 Большинство пропущенных раковых опухолей желудка представляли собой плохо дифференцированные поражения, расположенные в антральном отделе желудка и нижней части тела.34 Этот результат согласуется с предыдущим исследованием, описывающим IGC. Анатомические различия в различных частях желудка способствуют пропущенному раку желудка. Небольшие очаги рака желудка, возникающие в теле, могут быть скрыты внутри желудочных складок.Частая отрыжка связана с трудным исследованием тела желудка.35
ЗАКЛЮЧЕНИЕ
Раннее обнаружение улучшает прогноз и снижает экономическое бремя рака желудка. Кроме того, ESD — это лечебное средство для сохранения желудка у таких пациентов, когда EGC не прогрессирует до стадии, когда ESD неосуществим. Хорошие знания стандартных эндоскопических методов и эндоскопических особенностей EGC важны для повышения скорости обнаружения EGC. Поэтому эндоскопистам необходимо соответствующее обучение, чтобы улучшить свои технические навыки и знания о различных поражениях желудка.В этой статье основное внимание уделяется важности понимания общих мест возникновения EGC как ключа к точному выявлению рака желудка на ранних стадиях. Было замечено, что меньшая кривизна и нижняя часть желудка являются преобладающими местами, пораженными EGC, которые могут быть резектабельны с помощью ESD или гастрэктомии. Заболеваемость раком желудка с поражением кардии была выше у пожилых мужчин. Большинство IGC были плохо дифференцированы при гистопатологическом исследовании и располагались в антральном отделе желудка и нижней части тела.Эндоскописты должны помнить о возможности возникновения синхронных поражений без приподнятого уровня. Наконец, недавно обнаруженные EGC и MGC часто обнаруживаются в нижней трети, и большинство MGC, обнаруженных во время эндоскопического наблюдения, представляют собой небольшой дифференцированный внутрислизистый рак. В заключение, знание местоположения EGC полезно для точного эндоскопического обследования для скрининга и наблюдения.
Сноски
Раскрытие информации: У авторов нет потенциальных конфликтов интересов для раскрытия.
АвторАвторские взносы:
Концептуализация: Choi CW.
Написание — первоначальный черновик: Kim SJ.
Написание — просмотр и редактирование: Choi CW.
Список литературы
1. Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире.CA Cancer J Clin. 2018; 68 (6): 394–424. [PubMed] [Google Scholar] 2. Кикучи С., Катада Н., Сакурамото С., Кобаяси Н., Симао Х., Ватанабе М. и др. Выживаемость после хирургического лечения раннего рака желудка: хирургические методы и долгосрочное выживание. Langenbecks Arch Surg. 2004. 389 (2): 69–74. [PubMed] [Google Scholar] 3. Ким Й.И., Ким Ю.В., Чой И.Дж., Ким К.Г., Ли Дж.Й., Чо С.Дж. и др. Долгосрочная выживаемость после эндоскопической резекции по сравнению с хирургическим вмешательством при раннем раке желудка. Эндоскопия. 2015; 47 (4): 293–301. [PubMed] [Google Scholar] 4.Jun JK, Choi KS, Lee HY, Suh M, Park B, Song SH и др. Эффективность Корейской национальной программы скрининга рака в снижении смертности от рака желудка. Гастроэнтерология. 2017; 152 (6): 1319–1328.e7. [PubMed] [Google Scholar] 5. Пак М.С., Юн Дж.Й., Чанг Х.С., Ли Х., Пак Джей Си, Шин С.К. и др. Клинико-патологические характеристики интервального рака желудка в Корее. Кишечная печень. 2015; 9 (2): 166–173. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Kim GH, Cho YK, Cha JM, Lee SY, Chung I.K. Попытки повысить качество изображения при эндоскопии: роль проназы.Мир J Gastrointest Endosc. 2016; 8 (5): 267–272. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Японская ассоциация рака желудка. Японская классификация рака желудка: 3-е английское издание. Рак желудка. 2011. 14 (2): 101–112. [PubMed] [Google Scholar] 9. Хасуике Н., Оно Х., Боку Н., Мизусава Дж., Такидзава К., Фукуда Х. и др. Нерандомизированное подтверждающее исследование расширенного показания к эндоскопическому расслоению подслизистой оболочки при раке желудка кишечного типа (cT1a): исследование Японской группы клинической онкологии (JCOG0607) Рак желудка.2018; 21 (1): 114–123. [PubMed] [Google Scholar] 10. Bang CS, Baik GH, Shin IS, Kim JB, Suk KT, Yoon JH и др. Эндоскопическая диссекция подслизистой оболочки при раннем раке желудка с гистологией недифференцированного типа: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21 (19): 6032–6043. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Ким Дж. Важные соображения при рассмотрении возможности эндоскопической резекции недифференцированного рака желудка на ранней стадии. Мир Дж. Гастроэнтерол. 2016; 22 (3): 1172–1178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Jeon HK, Lee SJ, Kim GH, Park DY, Lee BE, Song GA. Эндоскопическая диссекция подслизистой оболочки при недифференцированном раке желудка на ранней стадии: краткосрочные и отдаленные результаты. Surg Endosc. 2018; 32 (4): 1963–1970. [PubMed] [Google Scholar] 13. Канг Д.Х., Чой С.В., Ким Х.В., Пак С.Б., Ким С.Дж., Нам Х.С. и др. Характеристики локализации раннего рака желудка, леченного с помощью эндоскопической диссекции подслизистой оболочки. Surg Endosc. 2017; 31 (11): 4673–4679. [PubMed] [Google Scholar] 14. Корреа П. Человеческая модель канцерогенеза желудка. Cancer Res.1988. 48 (13): 3554–3560. [PubMed] [Google Scholar] 15. Кимура К., Сато К., Идо К., Танигучи Ю., Такимото Т., Такемото Т. Гастрит в желудке японцев. Scand J Gastroenterol Suppl. 1996; 214: 17–20. [PubMed] [Google Scholar] 16. Кан Х.Й., Ким С.Г., Ким Дж.С., Юнг Х.С., Сон И.С. Клинические результаты эндоскопической диссекции подслизистой оболочки при недифференцированном раке желудка на ранней стадии. Surg Endosc. 2010. 24 (3): 509–516. [PubMed] [Google Scholar] 17. Хуанг Кью, Ши Дж., Сун Кью, Голд Дж. С., Чен Дж., Ву Х и др. Клинико-патологическая характеристика небольших (2 см или меньше) проксимальных и дистальных карцином желудка у населения Китая.Патология. 2015. 47 (6): 526–532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Е Б.Д., Ким С.Г., Ли Дж.Й., Ким Дж. С., Ян Х. К., Ким У. и др. Факторы прогнозирования метастазов в лимфатические узлы и стратегии эндоскопического лечения недифференцированного рака желудка на ранней стадии. J Gastroenterol Hepatol. 2008. 23 (1): 46–50. [PubMed] [Google Scholar] 19. Пак Й.Д., Чунг Й.Дж., Чунг Х.Й., Ю В., Пэ Х.И., Чон С.В. и др. Факторы, связанные с метастазированием лимфатических узлов и возможностью эндоскопической резекции слизистой оболочки для лечения низкодифференцированной аденокарциномы желудка.Эндоскопия. 2008. 40 (1): 7–10. [PubMed] [Google Scholar] 20. Хуан Ц., Фанг Ц., Ши Дж., Сунь Ц., Ву Х, Голд Дж. С. и др. Различия в клинико-патологии ранней карциномы желудка между проксимальной и дистальной локализацией у 438 китайских пациентов. Научный доклад 2015; 5 (1): 13439. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Tajima Y, Nakanishi Y, Yoshino T., Kokawa A, Kusano M, Shimoda T. Клинико-патологическое исследование ранней аденокарциномы кардии желудка: сравнение с ранней аденокарциномой дистального отдела желудка и пищевода.Онкология. 2001; 61 (1): 1–9. [PubMed] [Google Scholar] 22. Бай И, Ли З.С. Эндоскопические, клинико-патологические особенности и прогноз очень молодых пациентов с раком желудка. J Gastroenterol Hepatol. 2011. 26 (11): 1626–1629. [PubMed] [Google Scholar] 23. Като М., Нисида Т., Ямамото К., Хаяси С., Китамура С., Ябута Т. и др. Плановое эндоскопическое наблюдение контролирует вторичный рак после радикальной эндоскопической резекции по поводу раннего рака желудка: многоцентровое ретроспективное когортное исследование, проведенное исследовательской группой ESD Университета Осаки.Кишечник. 2013. 62 (10): 1425–1432. [PubMed] [Google Scholar] 24. Ли Х.Л., Ын С.С., Ли О.Й., Хан Д.С., Юн Б.К., Чой Х.С. и др. Когда мы пропускаем синхронные новообразования желудка при эндоскопии? Gastrointest Endosc. 2010. 71 (7): 1159–1165. [PubMed] [Google Scholar] 25. Пимента-Мело А.Р., Монтейро-Соарес М., Либаниу Д., Динис-Рибейро М. Частота отсутствия рака желудка во время эндоскопии верхних отделов желудочно-кишечного тракта: систематический обзор и метаанализ. Eur J Gastroenterol Hepatol. 2016; 28 (9): 1041–1049. [PubMed] [Google Scholar] 26.Нам Х.С., Ким Х.В., Чой С.В., Канг Д.Х., Пак С.Б., Ким С.Дж. и др. Характеристики упущенной синхронной неоплазии эпителия желудка после эндоскопической диссекции подслизистой оболочки. Медицина (Балтимор) 2018; 97 (39): e12536. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Gong EJ, Lee JH, Jung K, Cho CJ, Na HK, Ahn JY и др. Характеристики пропущенных одновременных поражений желудка на основе повторного анализа эндоскопического изображения. Clin Endosc. 2017; 50 (3): 261–269. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Ю Дж.Х., Шин С.Дж., Ли К.М., Чхве Дж.М., Ви Джо, Ким Д.Х. и др. Как мы можем предсказать наличие пропущенных синхронных поражений после эндоскопической диссекции подслизистой оболочки при раннем раке желудка или аденоме желудка? J Clin Gastroenterol. 2013; 47 (2): e17–22. [PubMed] [Google Scholar] 29. Абэ С., Ода И., Минагава Т., Секигучи М., Нонака С., Сузуки Х. и др. Метахронный рак желудка после радикальной эндоскопической резекции раннего рака желудка. Clin Endosc. 2018; 51 (3): 253–259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Cho CJ, Ahn JY, Jung HY, Jung K, Oh HY, Na HK и др. Заболеваемость и локальная предрасположенность метахронных опухолей после эндоскопической резекции дисплазии высокой степени и раннего рака желудка. Surg Endosc. 2017; 31 (1): 389–397. [PubMed] [Google Scholar] 31. Хосокава О, Кайдзаки Ю., Ватанабэ К., Хаттори М., Доден К., Хаяси Х. и др. Эндоскопическое наблюдение за остаточным раком желудка после ранней онкологической хирургии. Эндоскопия. 2002. 34 (6): 469–473. [PubMed] [Google Scholar] 32. Чедвик Дж., Гроен О, Райли С., Хардвик Р., Кросби Т., Хоар Дж и др.Рак желудка, пропущенный во время эндоскопии в Англии. Clin Gastroenterol Hepatol. 2015; 13 (7): 1264–1270.e1. [PubMed] [Google Scholar] 33. Фуджита С. Биология ранней карциномы желудка. Pathol Res Pract. 1978. 163 (4): 297–309. [PubMed] [Google Scholar] 34. Чо Й.С., Чунг И.К., Ким Дж.Х., Юнг Й, Ли TH, Пак Ш. и др. Факторы риска развития интервального раннего рака желудка после отрицательной эндоскопии. Dig Dis Sci. 2015; 60 (4): 936–943. [PubMed] [Google Scholar] 35. Ли С.П., Сун И.К., Ким Дж.Х., Ли С.И., Пак Х.С., Шим С.С.Факторы, влияющие на сотрудничество пациента во время плановой гастроскопии. Korean J Intern Med (Korean Assoc Intern Med) 2017; 32 (5): 819–826. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Мин Б. Х., Ким Э. Р., Ким К. М., Пак С. К., Ли Дж. Х., Ри П. Л. и др. Стратегия наблюдения, основанная на частоте и характере рецидивов после радикальной эндоскопической диссекции подслизистой оболочки при раннем раке желудка. Эндоскопия. 2015; 47 (9): 784–793. [PubMed] [Google Scholar] 37. Чой Дж., Ким С.Г., Им Дж. П., Ким Дж. С., Юнг Х.С. Отдаленные клинические результаты эндоскопической резекции при раннем раке желудка.Surg Endosc. 2015; 29 (5): 1223–1230. [PubMed] [Google Scholar] 38. Ahn JY, Jung HY, Choi KD, Choi JY, Kim MY, Lee JH и др. Эндоскопические и онкологические исходы после эндоскопической резекции по поводу раннего рака желудка: 1370 случаев абсолютных и расширенных показаний. Gastrointest Endosc. 2011. 74 (3): 485–493. [PubMed] [Google Scholar] 39. Shin KY, Jeon SW, Cho KB, Park KS, Kim ES, Park CK и др. Клинические результаты эндоскопической диссекции подслизистой оболочки раннего рака желудка сопоставимы между абсолютными и новыми расширенными критериями.Кишечная печень. 2015; 9 (2): 181–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Jeon HK, Kim GH, Lee BE, Park DY, Song GA, Kim DH и др. Отдаленный результат эндоскопического расслоения подслизистой оболочки сравним с таковым после операции по поводу рака желудка на ранней стадии: анализ с учетом предрасположенности. Рак желудка. 2018; 21 (1): 133–143. [PubMed] [Google Scholar] 41. Ryu SJ, Kim BW, Kim BG, Kim JH, Kim JS, Kim JI и др. Эндоскопическая диссекция подслизистой оболочки в сравнении с хирургической резекцией при раннем раке желудка: ретроспективное многоцентровое исследование немедленных и отдаленных результатов в течение 5 лет.Surg Endosc. 2016; 30 (12): 5283–5289. [PubMed] [Google Scholar] 42. Хан К.Ю., Пак СН, Ли Ю.К., Чанг Х., Пак Джей Си, Шин С.К. и др. Сравнительное исследование между эндоскопической диссекцией подслизистой оболочки и хирургическим вмешательством у пациентов с ранним раком желудка. Surg Endosc. 2018; 32 (1): 73–86. [PubMed] [Google Scholar] 43. Ким Х.Х., Ким Дж.Х., Ким Г.Х., Чой М.Г., Джи С.Р., Сон Г.А. Причины пропущенных синхронных новообразований эпителия желудка при эндоскопической диссекции подслизистой оболочки: многоцентровое исследование. Сканд Дж Гастроэнтерол. 2013. 48 (11): 1339–1346.[PubMed] [Google Scholar] 44. Ли HJ, Ли YJ, Lee JY, Kim ES, Chung WJ, Jang BK и др. Характеристики синхронных и метахронных множественных опухолей желудка после эндоскопической подслизистой диссекции раннего новообразования желудка. Clin Endosc. 2018; 51 (3): 266–273. [Бесплатная статья PMC] [PubMed] [Google Scholar]Рак желудка: варианты диагностики и лечения
1. Джемал А., Мюррей Т, Сэмюэлс А, Гафур А, Отделение E, Тун MJ. Статистика рака, 2003 г. CA Cancer J Clin . 2003; 53: 5–26 ….
2. Gunderson LL, Donohue JH, Burch PA. Желудок. В: Abeloff MD. Клиническая онкология. 2-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон, 2000: 1545–79.
3. Боулз MJ, Бенджамин И.С. Азбука верхних отделов желудочно-кишечного тракта: рак желудка и поджелудочной железы. BMJ . 2001; 323: 1413–6.
4. Эль-Рифаи W, Пауэлл С.М. Молекулярные и биологические основы злокачественных новообразований верхних отделов желудочно-кишечного тракта.Карцинома желудка. Surg Oncol Clin N Am . 2002; 11: 273–91.
5. Рустги А.К. Новообразования желудка. В: Cecil RL, Gold-man L, Bennett JC. Сесил Учебник медицины. 21-е изд. Филадельфия, Пенсильвания: W.B. Сондерс, 2000: 738–41.
6. Fuchs CS, Mayer RJ. Карцинома желудка. N Engl J Med . 1995; 333: 32–41.
7. Сильверман М.А., Заиди У, Барнетт С, Роблес С, Хурана V, Manten H, и другие.Скрининг рака у пожилого населения. Гематол Онкол Клин Норт Ам . 2000. 14: 89–112.
8. Mayne ST, Риш HA, Даброу Р, Чау WH, Гаммон MD, Воан Т.Л., и другие. Потребление питательных веществ и риск подтипов рака пищевода и желудка. Биомаркеры эпидемиологии рака Назад . 2001; 10: 1055–62.
9. Koh TJ, Wang TC. Опухоли желудка. В: Feldman M, Friedman LS, Sleisenger MH.Заболевания желудочно-кишечного тракта и печени Слейзенгера и Фордтрана. 7-е изд. Филадельфия, Пенсильвания: Saunders, 2002: 829–44.
10. Cappell MS, Фридель Д. Роль эзофагогастродуоденоскопии в диагностике и лечении заболеваний верхних отделов желудочно-кишечного тракта. Med Clin North Am . 2002; 86: 1165–216.
11. Низкий VH, Левин М.С., Рубесин С.Е., Лауфер I, Херлингер Х. Диагностика рака желудка: чувствительность исследований с двойным контрастированием с барием. AJR Ам Дж. Рентгенол . 1994; 162: 329–34.
12. Циглер К., Sanft C, Циммер Т, Zeitz M, Фельзенберг Д., Штейн H, и другие. Сравнение компьютерной томографии, эндосонографии и интраоперационной оценки TN-стадии рака желудка. Кишечник . 1993; 34: 604–10.
13. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и градация гастрита.Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol . 1996; 20: 1161–81.
14. Redel CA, Zweiner RJ. Желудок. В: Feldman M, Friedman LS, Sleisenger MH. Заболевания желудочно-кишечного тракта и печени Слейзенгера и Фордтрана. 7-е изд. Филадельфия, Пенсильвания: W.B. Сондерс, 2002: 557–60.
15. Balch CM, et al. Меланома кожи. В: Грин FL. Американский объединенный комитет по раку. Американское онкологическое общество. Руководство по стадированию рака AJCC.6-е изд. Нью-Йорк, Нью-Йорк: Springer-Verlag, 2002; 209–20.
16. Мехта В.К., Фишер Г. Рак желудка. По состоянию на 22 января 2004 г. http://www.emedicine.com/med/topic845.htm.
17. Родер Дж. Д., Бутчер К, Буш Р, Виттекинд C, Германек П., Siewert JR. Классификация метастазов в регионарные лимфатические узлы от рака желудка. Немецкая группа по изучению рака. Рак . 1998. 82: 621–31.
18. Грин FL. Новообразования желудка после резекции желудка. Акушерский гинекологический хирург . 1990; 171: 477–80.
19. Allum WH, Халлисси MT, Палата LC, Хоккей МС. Контролируемое проспективное рандомизированное исследование адъювантной химиотерапии или лучевой терапии при резектабельном раке желудка: промежуточный отчет. Британская группа по лечению рака желудка. Br J Рак . 1989; 60: 739–44.
20. Сиверт Дж. Р., Финк У, Сендлер А, Беккер К, Бутчер К, Фельдманн HJ, и другие.Рак желудка. Curr Probl Surg . 1997; 34: 835–939.
21. Cheung LY, DelCore R. Stomach. В: Townsend CM, Sabiston DC. Сабистон Учебник хирургии: биологические основы современной хирургической практики. 16-е изд. Филадельфия, Пенсильвания: Saunders, 2001: 855–65.
22. Hundahl SA, Филлипс Дж. Л., Menck HR. Отчет Национальной базы данных по раку о плохой выживаемости пациентов с карциномой желудка в США, получавших гастрэктомию: Пятое издание Американского объединенного комитета по стадированию рака, проксимальному заболеванию и гипотезе «другого заболевания». Рак . 2000; 88: 921–32.
23. Рак желудка: лечение. По состоянию на 28 октября 2003 г., по адресу http://www.cancer.gov/cancerinfo/pdq/treatment/gastric/HealthProfessional.
24. Siewert JR, Бутчер К, Штейн HJ, Родер Дж. Д. Соответствующие прогностические факторы при раке желудка: десятилетние результаты Немецкого исследования рака желудка. Энн Сург . 1998. 228: 449–61.
25. Кайбара Н., Сумы К, Ёнекава М, Охта М, Макино М, Кимура О, и другие.Улучшает ли обширное рассечение лимфатических узлов результаты хирургического лечения рака желудка? Am J Surg . 1990; 159: 218–21.
26. Робертсон К.С., Чунг СК, Вудс SD, Гриффин С.М., Раймс С.А., Лау JT, и другие. Проспективное рандомизированное исследование по сравнению субтотальной гастрэктомии R1 и тотальной гастрэктомии R3 при антральном раке. Энн Сург . 1994; 220: 176–82.
27. Ирияма К., Асакава Т, Койке Х, Нишиваки H, Сузуки Х.Необходима ли обширная лимфаденэктомия для хирургического лечения внутрислизистого рака желудка? Arch Surg . 1989; 124: 309–11.
28. Bonenkamp JJ, Германс Дж., Сасако М, ван де Вельде CJ. Расширенная лимфодиссекция при раке желудка. Голландская группа рака желудка. N Engl J Med . 1999; 340: 908–14.
29. Macdonald J, Смолли S, Бенедетти Дж., Эстес Н, Халлер Д, Аджани Дж., и другие.Послеоперационная комбинированная лучевая и химиотерапия улучшает выживаемость без признаков заболевания (DFS) и общую выживаемость (OS) при удаленной аденокарциноме желудка и G.E. соединение. Результаты межгруппового исследования INT-0116 (SWOG 9008). Proc Am Soc Clin Oncol . 2000; 19: 1а.
30. Wilke H, Preusser P, Финк У, Gunzer U, Мейер HJ, Мейер Дж., и другие. Предоперационная химиотерапия при местнораспространенном и неоперабельном раке желудка: исследование фазы II с этопозидом, доксорубицином и цисплатином. Дж Клин Онкол . 1989; 7: 1318–26.
31. Абэ М, Такахаши М. Интраоперационная лучевая терапия: опыт Японии. Int J Radiat Oncol Biol Phys . 1981; 7: 863–8.
32. Myint AS. Роль лучевой терапии в паллиативном лечении рака желудочно-кишечного тракта. Eur J Gastroenterol Hepatol . 2000; 12: 381–90.
33. Moertel CG, Чайлдс Д.С., О’Фаллон-младший, Холбрук М.А., Schutt AJ, Reitemeier RJ.Комбинированный 5-фторурацил и лучевая терапия в качестве хирургического вспомогательного средства при плохом прогнозе карциномы желудка. Дж Клин Онкол . 1984; 2: 1249–54.
34. Schwarz RE. Послеоперационная адъювантная химиолучевая терапия для пациентов с удаленным раком желудка: межгрупповая 116. J Clin Oncol . 2001; 19: 1879–80.
Что такое рак желудка? | Исследования рака, Великобритания
Рак желудка — это рак, который начинается где-нибудь внутри желудка или стенки желудка.Его также называют раком желудка.
Желудок
Желудок является частью пищеварительной системы. Он находится в верхней левой части живота (брюшной полости). Верх желудка соединяется с нижней частью пищевода (пищевод), а другой конец соединяется с кишечником.
Это мускулистая сумка, состоящая из трех основных частей. Это:
- верх (глазное дно)
- средний (корпус)
- низ (антральный или привратник)
На каждом конце желудка есть клапан, называемый сфинктером.Эти клапаны контролируют движение пищи по пищеварительной системе.
Это:
- сердечный сфинктер — вверху, соединяющий пищевод с желудком
- пилорический сфинктер — снизу, соединяющий желудок с кишечником
Как работает желудок
Пища попадает из пищевода в желудок. Затем желудок накапливает пищу и расщепляет (переваривает), чтобы наш организм мог ее усвоить. Он делает это, производя соки и смешивая с ними пищу, чтобы она легко усваивалась.
Железы в стенке желудка вырабатывают соки. Эти соки содержат желудочный сок и белок пепсин. Они начинают течь, как только мы что-то чувствуем.
Мышечная стенка желудка сокращается, взбивая пищу с соками, превращая ее в густую жидкость. Это происходит через пару часов, а затем он попадает в кишечник, где его поглощает организм.
Даже когда он пуст, желудок продолжает вырабатывать соки и гормоны. Таким образом, чтобы защитить слизистую оболочку желудка от кислоты и пепсина, он также производит густую слизь.
Где начинается рак желудка
Рак может начаться в любой части желудка или стенки желудка. Ваше лечение зависит от того, где именно в желудке начинается рак.
Большинство раковых заболеваний желудка начинается в железистых клетках внутренней оболочки желудка. Их называют аденокарциномами.
Рак желудка может начаться в стенке желудка. Они называются стромальными опухолями желудочно-кишечного тракта (ГИСО) и представляют собой разновидность саркомы мягких тканей.
Некоторые виды рака также могут возникать в клетках иммунной системы желудка.Это называется неходжкинской лимфомой.
Или они могут начаться в гормональных клетках желудка. Это называется нейроэндокринным раком.
Насколько распространен рак желудка?
Около 6700 человек в Великобритании ежегодно диагностируют рак желудка. Число людей в Великобритании, у которых диагностирован рак желудка, сократилось с начала 1990-х годов.
Кто заболевает раком желудка?
Рак желудка чаще встречается у пожилых людей. Около 50 из 100 случаев (около 50%) возникают у людей в возрасте 75 лет и старше.
Это чаще встречается у мужчин, чем у женщин.
Многие виды рака желудка связаны с образом жизни или факторами окружающей среды, включая питание. Рак желудка связан с бактериями Helicobacter pylori, обитающими в желудке. Но не у всех с Helicobacter pylori разовьется рак желудка.
типов рака желудка: распространенные, редкие и другие
Рак желудка возникает, когда клетки начинают вести себя ненормально, бесконтрольно расти и размножаться.Желудок, полый орган, который собирает и расщепляет пищу, состоит из пяти различных частей — от верхней части желудка, которая соединяется с пищеводом, до нижней части желудка, которая соединяется с тонкой кишкой:
- Кардия, ближайшая к пищеводу область
- Глазное дно, верхняя часть живота
- Корпус, основная часть желудка
- Антрум, где пища расщепляется желудочной кислотой
- Привратник, который соединяется с тонкой кишкой.
Есть также пять слоев ткани и мышц, которые окружают желудок и составляют стенку желудка.Следуя от внутреннего к внешнему, слои бывают:
- Слизистая оболочка
- Подслизистая основа
- Собственная мышца
- Subserosa
- Сероза
Рак желудка постепенно распространяется через эти разные слои. Установление того, насколько далеко в стенке желудка распространился рак, является частью процесса определения стадии, который определяет, насколько серьезен рак и как лучше его лечить.
Слой слизистой оболочки, вырабатывающий кислоту желудка, является местом, где начинается большинство рака желудка.
Менее распространенный тип рака желудка вызывается опухолями стромы желудочно-кишечного тракта (ГИСО), которые возникают в незрелых клетках, называемых интерстициальными клетками Кахаля.
Другие редкие типы рака желудка, такие как лимфома и нейроэндокринные опухоли, начинаются с разных типов клеток желудка.
Различные типы рака желудка включают:
Аденокарциномы
Аденокарциномы желудка развиваются в клетках внутренней оболочки.По данным Американского онкологического общества (ACS), большинство случаев рака желудка, от 90 до 95 процентов, являются аденокарциномами.
Аденокарциномы делятся на две категории:
- Аденокарциномы кишечника обычно медленно растут и легче поддаются лечению. Часто эти виды рака можно лечить терапевтическими препаратами, которые предназначены для борьбы с конкретными мутациями в раковых клетках. Этот тип чаще всего встречается у мужчин и пожилых людей.
- Диффузные аденокарциномы менее распространены, чем аднокарциомы кишечника, и обычно более агрессивны.Они, как правило, быстрее растут и часто быстро распространяются (метастазируют) в другие части тела. Этот тип чаще встречается в более молодом возрасте, чем аденокарциномы кишечника.
Пластический линит — это редкий подтип аденокарциномы желудка, на который приходится от 7 до 14 процентов случаев, согласно исследованию, опубликованному в Annals of Surgical Oncology . При этом типе раковые клетки распространяются по желудку, заставляя ткани становиться жесткими. К моменту постановки диагноза рак пластического линита обычно распространяется на лимфатические узлы.По сравнению с другими типами аденокарциномы, как правило, трудно лечить.
Аденокарциномы на ранней стадии могут иметь такие симптомы, как:
- Несварение
- Вздутие живота
- Тошнота
- Плохой аппетит
- Изжога
По мере развития этих видов рака они могут вызывать:
- Стул с кровью
- Рвота
- Необъяснимая потеря веса
- Боль в животе
- Желтуха (пожелтение кожи и глаз)
- Затрудненное глотание
Для диагностики этих видов рака можно использовать различные тесты, в том числе:
- Анализы крови
- Эндоскопия (процедура осмотра желудка и прилегающих областей с помощью инструмента, вводимого через рот)
- Рентгеновские снимки и другие снимки
- Биопсия (процедура по удалению небольшого образца аномальной ткани / клеток для проверки на рак)
Варианты лечения включают:
Редкие виды рака желудка
Лимфомы — это рак ткани иммунной системы, который может возникать в любом месте, где обнаружены лимфатические ткани, в том числе в желудке.Однако лимфомы желудка встречаются редко и составляют около 4 процентов всех случаев рака желудка.
Лимфома MALT (лимфоидная ткань, связанная со слизистой оболочкой) — это тип неходжкинской лимфомы, который обычно возникает в желудке. Рак начинается в лимфатической ткани, выстилающей желудок.
Большинство людей, у которых развивается лимфома желудка MALT, перенесли бактериальную инфекцию, особенно вызванную Helicobacter pylori (H. pylori), или вирусную инфекцию. Этот рак имеет тенденцию к медленному росту (хотя известно, что он переходит в быстрорастущий тип) и обычно выявляется на ранних стадиях.Если он вызван инфекцией H. pylori, рак часто лечат антибиотиками.
Если рак не поддается лечению антибиотиками, другие варианты лечения включают:
- Лучевая терапия
- Химиотерапия
- Таргетная терапия
- Хирургия
Желудочно-кишечные стромальные опухоли , или GIST, представляют собой редкий тип рака желудка, который формируется в специальной клетке, находящейся в слизистой оболочке желудка, которая называется интерстициальными клетками Кахаля (ICC).Под микроскопом клетки GIST похожи на мышечные или нервные клетки. Эти опухоли могут развиваться по всему пищеварительному тракту, но от 60 до 70 процентов возникают в желудке. По данным ACS, в Соединенных Штатах ежегодно диагностируется от 4000 до 6000 новых случаев GIST в желудочно-кишечном тракте.
ГИСО в желудке могут вызывать:
- Боль в животе
- Масса или опухоль в желудке
- Рвота
- Плохой аппетит
- Необъяснимая потеря веса
Эти опухоли могут также кровоточить, что вызывает появление крови в рвоте и дефекации.Большие опухоли могут вызывать закупорку желудка и кишечника, что приводит к боли в желудке и рвоте. Эти симптомы часто побуждают людей обращаться к врачу.
Диагностика может включать:
Хирургия и таргетная терапия являются наиболее часто используемыми вариантами лечения GIST, но также могут использоваться химиотерапия и лучевая терапия.
Карциноидные опухоли обычно начинаются в продуцирующих гормоны клетках желудка. Эти опухоли обычно не распространяются на другие органы и составляют около 3 процентов случаев рака желудка.
Три типа карциноидных опухолей желудка:
- Карциноиды ECL-клеток типа I и II редко распространяются на другие части тела и могут не вызывать никаких симптомов. Чаще всего они обнаруживаются во время эндоскопии по поводу другого заболевания, например кислотного рефлюкса.
- Карциноиды ECL-клеток типа III более агрессивны. Избыточная секреция гормонов карциноидных опухолей может привести к состоянию, называемому карциноидным синдромом, которое характеризуется приливом крови, болью в животе, диареей, сужением бронхов в легких и, в некоторых случаях, сердечными заболеваниями, такими как дисфункция клапана.Карциноидный синдром — признак того, что может потребоваться более агрессивное лечение.
По данным ACS, в США ежегодно диагностируется около 8000 карциноидных опухолей желудочно-кишечного тракта. Не все эти виды рака начинаются в желудке — они также могут возникать в кишечнике, аппендиксе, толстой и прямой кишке.
Карциноидные опухоли желудка и пищеварительной системы могут быть диагностированы с помощью методов визуализации (таких как рентген, компьютерная томография и МРТ) и биопсии. Опухоли желудочно-кишечного тракта могут быть подвергнуты биопсии во время эндоскопии или биопсии иглой (процедура с использованием иглы для удаления небольшого образца подозрительной ткани, который анализируется, чтобы определить, содержит ли он рак, и определить тип опухоли).
Варианты лечения включают:
- Хирургия
- Химиотерапия
- Радиационная терапия
Наследственный (семейный) диффузный рак желудка: По данным Национального института рака, от 1 до 3 процентов всех случаев рака желудка являются редким типом, называемым наследственным диффузным раком желудка (HDGC). Этот тип рака желудка, который вызывается генетическим заболеванием, передающимся от родителей к детям, имеет тенденцию разрастаться во многих частях желудка и быстро распространяться на другие части тела.Генетическое тестирование показывает, есть ли у кого-то мутация, связанная с HDGC. Эти тесты рекомендуются людям, у которых есть два или более близких родственника, у которых в раннем возрасте развился рак желудка или у которых был диагностирован этот конкретный тип рака желудка.
Симптомы этого типа рака желудка могут включать:
- Боль в желудке
- Тошнота
- Рвота
- Плохой аппетит
- Необъяснимая потеря веса
- Затрудненное глотание
Обычно диагностируется с помощью игольной биопсии.Визуализирующие обследования, такие как ультразвук, компьютерная томография и позитронно-эмиссионная томография (ПЭТ), также могут использоваться для оценки размера, местоположения и распространения опухоли в организме.
Варианты лечения включают:
.

 Нарушение функций яичников возникает при двустороннем поражении яичников (Крукенберговский рак). Пальпаторно определяются метастазы Айриша в подмышечные лимфатические узлы, Вирхова в левый надключичный узел и метастаз сестры Марии Джозеф в пупок по ходу круглой связки печени.
Нарушение функций яичников возникает при двустороннем поражении яичников (Крукенберговский рак). Пальпаторно определяются метастазы Айриша в подмышечные лимфатические узлы, Вирхова в левый надключичный узел и метастаз сестры Марии Джозеф в пупок по ходу круглой связки печени.

 ПА Герцена» Минздравсоцразвития России. – 2012. – С. 12.
ПА Герцена» Минздравсоцразвития России. – 2012. – С. 12.
 Детальный анализ результата теста позволит определить, какой отдел желудка поражен.
Детальный анализ результата теста позволит определить, какой отдел желудка поражен.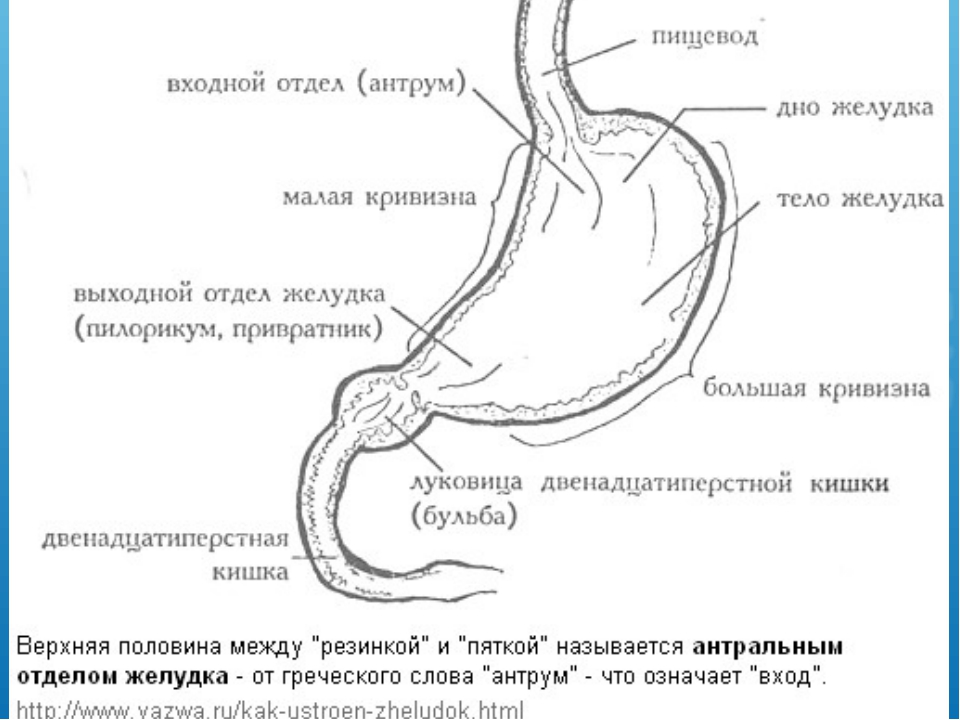 pylori – положительный результат. Такой результат свидетельствует об атрофическом пангастрите – состоянии, которое является самым значимым фактором риска рака желудка. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
pylori – положительный результат. Такой результат свидетельствует об атрофическом пангастрите – состоянии, которое является самым значимым фактором риска рака желудка. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
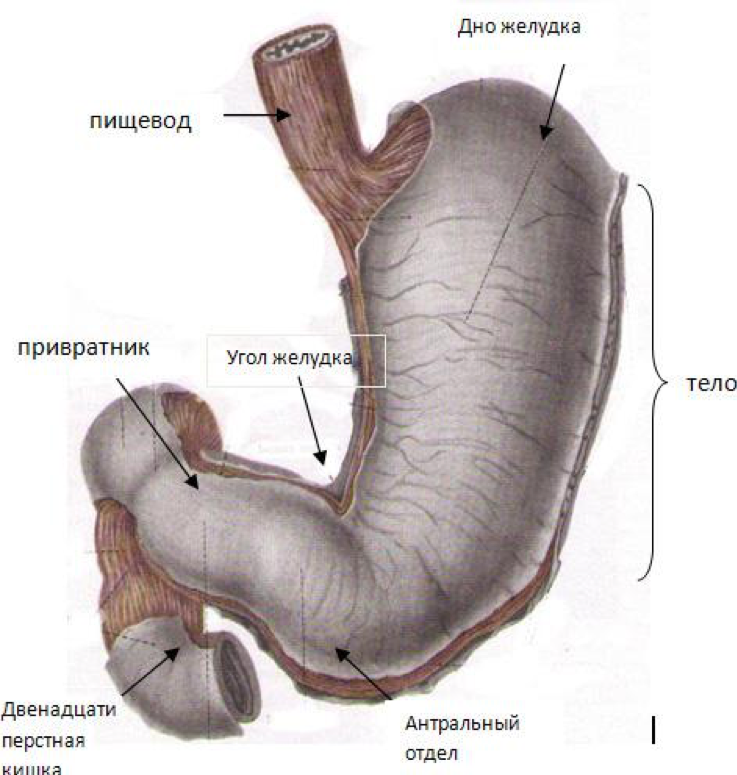 pylori – положительный результат
pylori – положительный результат