Защитите детский желудок! Почему гастрит встречается даже у самых маленьких | Здоровье ребенка | Здоровье
Если запустить гастрит или лечиться неправильно, можно раз и навсегда испортить пищеварительный тракт. Чтобы не сталкиваться с этой проблемой в течение всей жизни, лечиться следует своевременно и радикально.
Худой да бледный
Бытует мнение, что воспаление слизистой желудка угрожает главным образом подросткам, но на самом деле оно может возникнуть уже на первом году жизни ребёнка. Лактазная недостаточность, нарушение формирования микрофлоры кишечника, срыгивание, запоры и другие проблемы могут стать спусковым механизмом. Но всё-таки чаще поражение слизистой пищеварительного тракта формируется в моменты наиболее активного роста и развития ребёнка. Первый возрастной период, когда гастриты возникают наиболее часто, – это 5–6 лет, а второй – 10–15 лет.
Насторожить родителей должны такие симптомы, как жалобы ребёнка на тупые и ноющие боли и тяжесть в правом боку или в области желудка (усиливающиеся через 10–15 минут после приёма пищи), постепенное снижение аппетита, неприятный запах изо рта, отрыжка и изжога, вздутие живота и метеоризм.
Опасный микроб
Многие полагают (и небеспочвенно), что главная причина гастрита у детей – неправильное питание. Так и есть, но это не единственная проблема. Конечно, хроническое переедание или увлечение жирной, острой, слишком горячей или грубой пищей, а также употребление недоброкачественной еды (например, обсеменённой патогенными бактериями или изобилующей красителями, консервантами), безусловно, плохо отразятся на нежной слизистой желудка. Но есть и другие причины, провоцирующие заболевание. Например, у дошколят это глистно-паразитарные инвазии; у подростков – вредные привычки (алкоголь, курение), а также стрессы, агрессия, тревожность. Гастрит могут вызывать и аутоиммунные нарушения, а также сопутствующие хронические заболевания пищеварительного тракта, пищевая аллергия и даже многие ОРВИ.
Тем не менее всё это – лишь сопутствующие причины острого и хронического гастрита. А основным провоцирующим моментом является инфицирование бактерией Helicobacter pylori, обитающей в пилорическом отделе желудка. Именно она повреждает эпителий слизистой и выделяет агрессивные ферменты и токсины, вызывающие развитие воспаления, образование эрозий и язв.
Именно поэтому одним лечебным питанием и применением антацидных препаратов, нейтрализующих избыток соляной кислоты в желудке, вылечить хронический гастрит невозможно. Требуется первым делом устранить первопричину заболевания – избавиться от хеликобактерной инфекции. Современные препараты на основе висмута трикалия дицитрата помогают бороться не только с симптомами, но и с самой причиной гастрита и язвы желудка.
Важно и то, что висмута трикалия дицитрат обладает выраженным обволакивающим действием. В кислой среде ЖКТ он образует на поверхности повреждённой слизистой оболочки желудка и двенадцатиперстной кишки защитную плёнку, которая способствует рубцеванию язв и предохраняет от воздействия соляной кислоты и пепсина. Кроме того, висмута субцитрат стимулирует синтез простагландина Е2, который, в свою очередь, стимулирует образование слизи, что также улучшает заживление эрозий и язв.
Кроме того, висмута субцитрат стимулирует синтез простагландина Е2, который, в свою очередь, стимулирует образование слизи, что также улучшает заживление эрозий и язв.
Смотрите также:
Гастрит и функциональная диспепсия . Многопрофильный мед центр Ланта, г. Хабаровск.
По данным клинических исследований, проведенных одной крупной фармацевтической компанией на территории Российской Федерации в 2010 году, заболеваемость органов ЖКТ и язвенной болезнью имеют тенденцию к снижению, благодаря повсеместной эрадикации, однако заболеваемость гастритами и дуоденитами напротив растет, а вот такое заболевание, как функциональная диспепсия МКБ 10, К30 отсутствует в статистике вовсе и все потому, что еще 10 лет назад было принято называть “гастритом” заболевание, которое таковым не является, это преимущественно функциональная диспепсия и ГЭРБ (гастроэзофагиальная рефлюксная болезнь) не связанные с H. Pilory. К 2018 году ситуация изменилась.
В современной гастроэнтерологии диагноз “Хронический гастрит” практически исчез и вот почему:
-
Доказано, что отсутствует связь между гастритическими изменениями слизистой оболочки желудка и диспепсическими жалобами пациентов.

-
Несмотря на высокую заболеваемость хроническим гастритом в популяции до 80%, в большинстве случаев он протекает бессимптомно.
-
Частота заболеваемости функциональной диспепсией составляет 40% при этом не всегда имеются воспалительные изменения слизистой желудка.
-
Гастрит диагноз морфологический, то есть должно быть диагностировано с чем связано воспаление, а также установлена локализация воспалительных изменений.
-
Функциональная диспепсия диагноз клинический, основанный на клинических проявлениях заболевания, жалобах пациента.
Остановимся подробнее на каждом заболевании.
Гастрит — это хроническое, склонное к обострению и рецидиву заболевание слизистой оболочки желудка и двенадцатиперстной кишки — дуоденит из-за чего снижается способность желудка переваривать пищу. Хронический гастрит не содержит в себе информацию о каких-либо жалобах со стороны пациента, поэтому хронический гастрит часто переходит в острую форму,
Хронический гастрит не содержит в себе информацию о каких-либо жалобах со стороны пациента, поэтому хронический гастрит часто переходит в острую форму,
-
Боль и появление дискомфорта в области эпигастрия после приема пищи.
-
Тошнота и рвота.
-
Потеря аппетита.
-
Желудочные кровотечения, которые до появления выраженной анемии, могут быть не заметными.
Появление гастрита связано со следующими факторами:
-
Наличие бактерии H. Pilory.
-
Длительное употребление алкоголя.
-
Длительный прием аспирина и нестероидных противовоспалительных средств (НПВС).
-
Также на фоне воспалительных заболеваний, таких как болезнь Крона.

-
Патологические реакции иммунной системы — аутоиммунный гастрит.
Такой диагноз как гастрит должен быть морфологически обусловлен, то есть пациенту необходимо пройти ряд обследований в том числе и гистологических. Самое сложное в лечении гастрита, это его диагностика.
Первое и самое важное:
сделать фиброэзофагогастродуоденоскопию (ФЭГДС) для визуализации воспаления слизистой желудка и пищевода, а также двенадцаиперстной кишки. При гастроскопии может быть проведена биопсия.
Второе и не менее важное:
провести анализы на наличие H. Pilory.
Но когда гастрит диагностирован и найдена причина, то все достаточно просто:
-
Эрадикация.
-
Соблюдение диеты.
Снижение доз алкоголя или отказ от него.

-
Прием противоязвенных препаратов.
Лечение в среднем длится от 3 до 8 недель дома с регулярным посещением своего лечащего врача.
Но уменьшение активности гастрита очень редко способствует уменьшению диспепсических жалоб, к сожалению.
Функциональная диспепсия — это широкий спектр симптомов, ведь в переводе с греческого диспепсия означает “проблемы с пищеварением”. Симптомы самые разные от болей и тяжести в эпигастральной области до тошноты и отрыжки.
Факторы развития:
-
Наследственная предрасположенность.
-
Курение.
-
Перенесенная токсикоинфекция.
-
Полиморфизм гена Gn-β3.
-
Пищевая аллергия.

-
Алиментарные нарушения: нерегулярный прием пищи, злоупотребление алкоголем, переедание, чрезмерное употребление углеводов или растительной клетчатки, острой пищи.
-
Стрессовые ситуации острые или хронические, например нередко функциональная диспепсия наблюдается у студентов перед экзаменами.
Причины развития симптомов ФД:
-
Снижение моторики дистальных отделов (антральный гипокинез).
-
Задержка опорожнения желудка.
-
Снижение способности желудка к растяжению.
Важно понимать, что лечение функциональной диспепсии длительное!
-
Психотерапия.
-
Временный или постоянный отказ от продуктов, которые вызывают дискомфорт.

-
Отказ или замена лекарственных препаратов, вызывающих симптомы диспепсии.
-
Применение медикаментов для устранения симптомов диспепсии.
Все эти методы могут быть применены, как по отдельности так в комплексе.
Подводя итоги:
-
ФД и гастрит — разные заболевания!
-
Диагноз “гастрит”, может быть поставлен только на основании лабораторных анализов и с помощью ФГДС.
-
Диагноз “функциональная диспепсия” основывается на жалобах пациента.
-
Лечение этих двух заболеваний разное.
В медицинском центре “Ланта” прием ведут врачи высшей квалификационной категории. Записывайтесь на прием к нашим врачам по телефону +7(4212) 461800 или через форму он-лайн записи.
Гастрит. Симптомы — Клиника Здоровье 365 г. Екатеринбург
Признаки и симптомы гастрита могут быть различными, у некоторых пациентов гастрит протекает бессимптомно. Основные симптомы гастрита следующие:
- ноющая боль или жжение в верхней части живота, которая может усиливаться или стихать после еды;
- тошнота или рвота;
- потеря аппетита;
- икота;
- отрыжка или вздутие живота;
- чувство переполнения в верхней части живота после еды;
- снижение веса.
Острый гастрит возникает внезапно и, чаще всего, проявляется жгучей болью, тошнотой или дискомфортом в верхней части живота. Хронический гастрит развивается постепенно и, чаще проявляется тупой болью, ощущением переполнения желудка или отсутствием аппетита даже при приеме небольшого количества пищи. Многие люди, страдающие хроническим гастритом, симптомов не ощущают вообще.
Иногда, гастрит может вызвать желудочно-кишечное кровотечение, хотя это тяжелое осложнение встречается редко. Но имейте в виду, что желудочно-кишечное кровотечение, для которого характерны рвота цвета крови или «кофейной гущи» и / или жидкий стул черного (цвет битума) цвета, требует немедленной медицинской помощи.
Но имейте в виду, что желудочно-кишечное кровотечение, для которого характерны рвота цвета крови или «кофейной гущи» и / или жидкий стул черного (цвет битума) цвета, требует немедленной медицинской помощи.
Что такое гастрит?
Гастрит это воспаление слизистой оболочки желудка.
Гастрит может развиться внезапно (острый гастрит), или же медленно с течением времени (хронический гастрит). В некоторых случаях, гастрит может привести к язвам желудка и раку желудка.
Что является причиной гастрита?
Гастрит может быть обусловлен раздражением слизистой оболочки желудка из-за чрезмерного употребления алкоголя, или хронической рвоты. Причиной гастрита может быть стресс или применение некоторых лекарственных препаратов, таких как аспирин или противовоспалительные препараты.
Кроме того причиной гастрита может быть:
- Helicobacter Pylori — бактерия, при заражении которой может возникнуть гастрит. Без лечения инфекция может привести к язве желудка и двенадцатиперстной кишки, а у некоторых людей к раку желудка;
- Пернициозная анемия, является формой анемии, которая возникает, при недостатке в желудке естественного вещества, необходимого для правильного переваривания и усвоения витамина В12;
- Рефлюкс (заброс) желчи;
- Инфекции, вызванные бактериями и вирусами, например ротавирусная инфекция
Основные причины гастрита у детей
В последние годы хронический гастрит у детей встречается очень часто, составляя 70–80% от всей патологии пищеварительного тракта. Число заболеваний гастритом растет, он клинически выявляется у 120–140 детей из тысячи в возрасте 6–8 лет. При этом не учитываются те формы, которые протекают без болевых ощущений. Но в последнее время возле кабинета гастроэнтеролога все чаще можно увидеть мам с детьми, которым еще не исполнилось и 3 лет. Откуда берется гастрит у таких малышей? В этой статье мы попробуем ответить на этот и ряд других вопросов.
Число заболеваний гастритом растет, он клинически выявляется у 120–140 детей из тысячи в возрасте 6–8 лет. При этом не учитываются те формы, которые протекают без болевых ощущений. Но в последнее время возле кабинета гастроэнтеролога все чаще можно увидеть мам с детьми, которым еще не исполнилось и 3 лет. Откуда берется гастрит у таких малышей? В этой статье мы попробуем ответить на этот и ряд других вопросов.
Что такое гастрит? Гастрит — это воспаление слизистой оболочки желудка, которое в свою очередь приводит к нарушению его функций. Как и многие другие заболевания, он бывает острым и хроническим. Острый гастрит протекает ярко, с выраженными проявлениями. Острый гастрит имеет клиническую картину отравления. Но после правильного лечения и при нормализации питания о нем можно забыть навсегда, и он не повторяется в течение жизни. Зато хронический гастрит — это спутник на всю жизнь, хронический гастрит формируется в течение длительного времени и для него свойственны периодические обострения.
Причин, по которым возникает это заболевание, огромное множество. Они должны быть известны всем родителям — ведь если вы знаете о причинах заболевания, то сможете предотвратить его развитие или вовремя забить тревогу.
Группу риска по развитию гастрита среди детского населения составляют дети, находящиеся в периоде активного роста и переходных изменений в организме. Поэтому гастрит преимущественно возникает у детей раннего школьного возраста (6–10 лет), а также у подростков в переходном возрасте (от 12–13 до 16-17 лет). Эти возрастные предпосылки детского гастрита создают благоприятные условия для реализации негативного действия причинных факторов. К ним можно отнести.
- Неправильное питание. Относится к самой частой причине, как острого, так и хронического гастрита. Под неправильным питанием подразумевается употребление ребенком вредных продуктов фаст-фуда (гамбургеры, картошка фри, жареные пирожки и пр.), чипсов, сухариков, газированных напитков (кока-кола, спрайт, любые окрашенные жидкости), острых и блюд с избыточным содержанием специй, копченостей, излишне жирной пищи.
 Нарушение процесса и регулярности приема пищи. Увлечение модными диетами для похудения или если ребенок питается нерегулярно с большими промежутками между приемами пищи или размером порций, это создает высокий риск развития гастрита. Недоброкачественная пища. Если ребенок кушает, даже полезные продукты питания, но при этом они либо испорчены, либо инфицированы патогенными микроорганизмами, это станет причиной возникновения острого гастрита.
Нарушение процесса и регулярности приема пищи. Увлечение модными диетами для похудения или если ребенок питается нерегулярно с большими промежутками между приемами пищи или размером порций, это создает высокий риск развития гастрита. Недоброкачественная пища. Если ребенок кушает, даже полезные продукты питания, но при этом они либо испорчены, либо инфицированы патогенными микроорганизмами, это станет причиной возникновения острого гастрита. - Умственные и психо-эмоциональные перегрузки. Современные дети излишне загружены школьными обязанностями. Ребенок, у которого нет свободного времени, становится очень чувствительным к любым агрессивным факторам окружающей среды. При этом нарушается регуляция синтеза желудочного сока, снижается аппетит, и как следствие — воспалительный процесс в желудке.
- Физические перегрузки и гиподинамия. Как избыток физической активности, так и ее недостаток приводят к нарушению процессов кровообращения в растущем организме и срыву механизмов ауторегуляции защитных и секреторных процессов в желудке.

- Хеликобактерная инфекция. Гастритом можно заразиться. Совсем недавно еще считали, что все гастриты имеют неинфекционное происхождение. Но в настоящее время установлено, что это не так! Инфекционные гастриты есть. В происхождении хронических гастритов четко доказана роль хеликобактерий (Helicobacter pylori), для устранения которых необходима специфическая схема лечения, имеющая направленность на устранение столь опасного болезнетворного микроорганизма. До открытия Helicobacter pylori считалось, что основной причины язвенной болезни и гастрита является повышенная кислотность желудка и раздражение желудка продуктами питания. Естественно, методы лечения, основанные на этом ложном предположении, были малоэффективными. В противоположность им, современные схемы лечения гастрита и язвы желудка, направленные главным образом на устранение инфекции H. Pylori, демонстрируют очень высокую эффективность и приводят к полному выздоровлению от гастрита в подавляющем большинстве случаев.
 Точный механизм заражения Helicobacter pylori в настоящий момент не известен. Предполагается, что заразиться этой инфекцией можно через грязную воду, продукты питания, а также при близком контакте с людьми, зараженными этим микробом. Эти микроорганизмы могут существовать только в полости желудка в условиях повышенной кислотности. Поэтому они вызывают хронический гастрит только в условиях гиперсекреции желудочного сока и соляной кислоты. Не может быть хеликобактерного воспаления на фоне сниженной секреторной активности желудка. У некоторых людей, заражение хеликобактериозом не проявляется никакими симптомами, а сама инфекция проходит без всякого лечения спустя некоторое время после заражения (спонтанное выздоровление). У других же микроб способен длительное время выживать в желудке человека за счет уникальной способности нейтрализовать кислотность желудочного сока, и, паразитируя в слизистой оболочке желудка, Helicobacter pylori приводит к ее медленному разрушению. Не все знают о том, что гастрит является заразным заболеванием.
Точный механизм заражения Helicobacter pylori в настоящий момент не известен. Предполагается, что заразиться этой инфекцией можно через грязную воду, продукты питания, а также при близком контакте с людьми, зараженными этим микробом. Эти микроорганизмы могут существовать только в полости желудка в условиях повышенной кислотности. Поэтому они вызывают хронический гастрит только в условиях гиперсекреции желудочного сока и соляной кислоты. Не может быть хеликобактерного воспаления на фоне сниженной секреторной активности желудка. У некоторых людей, заражение хеликобактериозом не проявляется никакими симптомами, а сама инфекция проходит без всякого лечения спустя некоторое время после заражения (спонтанное выздоровление). У других же микроб способен длительное время выживать в желудке человека за счет уникальной способности нейтрализовать кислотность желудочного сока, и, паразитируя в слизистой оболочке желудка, Helicobacter pylori приводит к ее медленному разрушению. Не все знают о том, что гастрит является заразным заболеванием. Как говорилось выше, данное утверждение вовсе не справедливо. Это говорит о том, что больному гастритом ребенку или взрослому стоит выделить отдельную посуду для питания, отдельные игрушки, предметы личной гигиены и т. д.
Как говорилось выше, данное утверждение вовсе не справедливо. Это говорит о том, что больному гастритом ребенку или взрослому стоит выделить отдельную посуду для питания, отдельные игрушки, предметы личной гигиены и т. д. - Инфекционно-токсические, например, после перенесенного пищевого отравления или тяжелой ротавирусной и др. кишечной инфекции.
- Системные аутоиммунно-аллергические реакции. В случае когда «нападению» иммунной системы подвергается слизистая желудка, возникает так называемый аутоиммунный гастрит. При аутоиммунном гастрите клетки слизистой желудка разрушаются клетками иммунной системы и выделяемыми ими антителами.
- Наследственные факторы. Решающими факторами в возникновении острых и хронических форм гастрита и язвенной болезни у детей являются наследственная предрасположенность, а также особенности физического строения тела. Наследственная предрасположенность чаще имеет место у ребенка, отец которого болен язвенной болезнью.
 При этом предрасположенность к раннему заболеванию язвенной болезнью чаще передается по отцовской линии. По наследству от отца к сыну может передаваться предрасположенность организма производить недостаточное количество гормонов и других биологически активных веществ, обеспечивающих защиту и нормальное развитие слизистой оболочки желудка.
При этом предрасположенность к раннему заболеванию язвенной болезнью чаще передается по отцовской линии. По наследству от отца к сыну может передаваться предрасположенность организма производить недостаточное количество гормонов и других биологически активных веществ, обеспечивающих защиту и нормальное развитие слизистой оболочки желудка. - Последствия приема лекарств. Прием некоторых лекарственных средств вызывает раздражение слизистой оболочки желудка. К препаратам, вызывающим развитие гастрита, можно отнести: салицилаты, резерпин, некоторые антибиотики, гормоны-глюкокортикоиды, цитостатики и др. Если раздражение лекарствами происходит изо дня в день, то развивается воспаление и гастрит. К сожалению, в некоторых случаях использования таких препаратов нельзя избежать (например, когда ребенку требуется провести целый курс терапии в связи с каким-нибудь заболеванием). Но иногда родители самостоятельно занимаются лечением малыша, дают ему всевозможные таблетки на свое усмотрение, не задумываясь о возможных последствиях.
 В итоге прием таблеток может спровоцировать гастрит. Поэтому возьмите за правило не «прописывать» ребенку лекарства, руководствуясь только своими соображениями. Препараты больному малышу должен назначать только квалифицированный специалист — детский доктор.
В итоге прием таблеток может спровоцировать гастрит. Поэтому возьмите за правило не «прописывать» ребенку лекарства, руководствуясь только своими соображениями. Препараты больному малышу должен назначать только квалифицированный специалист — детский доктор.
Хроническая боль в животе в детстве: диагностика и лечение
АЛАН М. ЛЕЙК, доктор медицины, Медицинский факультет Университета Джона Хопкинса, Балтимор, Мэриленд
Am Fam Physician. , 1 апреля 1999; 59 (7): 1823-1830.
Более трети детей жалуются на боли в животе, продолжающиеся две недели и более. Диагностический подход к боли в животе у детей в значительной степени зависит от истории болезни, предоставленной родителем и ребенком, чтобы направить поэтапный подход к исследованию.Если анамнез и физикальное обследование предполагают функциональную боль в животе, запор или язвенную болезнь, ответ на эмпирический курс лечения имеет большее значение, чем множественные «исключающие» исследования. Дневник симптомов позволяет ребенку принимать активное участие в диагностическом процессе. Медицинское лечение запора, язвенной болезни и воспалительного заболевания кишечника включает стратегии питания, фармакологическое вмешательство, поведение и психологическую поддержку.
Дневник симптомов позволяет ребенку принимать активное участие в диагностическом процессе. Медицинское лечение запора, язвенной болезни и воспалительного заболевания кишечника включает стратегии питания, фармакологическое вмешательство, поведение и психологическую поддержку.
Хроническая боль в животе у детей определяется как боль продолжительностью более двух недель.1 Боль может быть постоянной или повторяющейся. Это огорчает ребенка, родителей и врача. Дифференциальный диагноз боли в животе у детей зависит от возраста, пола, генетической предрасположенности, воздействия питания и многих факторов окружающей среды. Хотя попытки отличить органическую боль от функциональной в животе достойны восхищения, эти явно противоположные этиологии не исключают друг друга у детей, поскольку психологические осложнения органических заболеваний являются обычным явлением.
Диагностика боли в животе у детей состоит из пяти компонентов.Относительная ценность каждого компонента зависит от возраста ребенка и, в некоторых случаях, от уровня сотрудничества ребенка и родителей. Пять компонентов включают анамнез, физикальное обследование, лабораторные исследования, результаты визуализационных исследований и реакцию на эмпирическую терапию. Этот подход кратко изложен в таблице 1.
Пять компонентов включают анамнез, физикальное обследование, лабораторные исследования, результаты визуализационных исследований и реакцию на эмпирическую терапию. Этот подход кратко изложен в таблице 1.
Просмотр / печать таблицы
ТАБЛИЦА 1Пять компонентов оценки детей с болью в животе
История | |
Местоположение, интенсивность, характер и продолжительность боль, время дня или ночи, в которое возникает боль | |
Аппетит, диета, сытость, тошнота, рефлюкс, рвота | |
Характер стула, консистенция, полнота опорожнения | |
Обзор систем : потеря веса, рост или задержка полового созревания, лихорадка, сыпь | |
Лекарства и диетические вмешательства | |
Семейный анамнез, путешествия | |
Помехи в учебе, игре, отношениях со сверстниками и семейной динамике | |
Физический осмотр | |
Ср. | |
Полное физикальное обследование | |
Объективные данные со стороны брюшной полости: локализация, отскок, масса, признак поясничной мышцы | |
Печень, селезенка и почки размер, асцит, боль в боку | |
Перианальные исследования: ректальное и тазовое обследование, исследование кала на скрытую кровь | |
Лабораторные исследования | |
Общий анализ крови с дифференциальной скоростью оседания эритроцитов | |
Общий анализ мочи и посев мочи | |
Лабораторные исследования, индивидуализированные в соответствии с показаниями | |
Анализ кала и посев на полиморфно-ядерные лейкоциты, паразитов, антиген лямблий | |
0 профиль проб, уровень амилазы | |
Тест на беременность, посев на венерические заболевания | |
Водородный тест в выдыхаемом воздухе: лактоза, фруктоза | |
Серологические тесты на хеликобактерии pylori | |
Визуализирующие исследования, индивидуализированные в соответствии с показаниями | |
Сонография брюшной полости и таза | |
Контрастное исследование верхних отделов желудочно-кишечного тракта с исследованием тонкой кишки, компьютерная томография брюшной полости | |
| колоноскопия, лапароскопия | |
Эмпирические вмешательства | |
Обучение пациентов и родителей | |
Дневник симптомов боли, характера кишечника, диеты и связанных характеристик, реакции на вмешательство | |
Запор исследован как фактор | |
Диетические вмешательства, включая скорректированное потребление клетчатки, уменьшенное потребление лактозы, уменьшенное потребление сока | |
Испытание пептической терапии | |
Пять компонентов оценки детей с болью в животе
История болезни | |||
Местоположение, интенсивность, характер и продолжительность боли, время дня или ночи, когда возникает боль | |||
Аппетит, диета, чувство насыщения, тошнота, рефлюкс, рвота | |||
Характер стула, последовательность, полнота опорожнения | |||
Обзор систем: потеря веса, рост или задержка полового созревания, лихорадка, сыпь | |||
Лекарства и меры по питанию | |||
Семейная история, путешествия | |||
Вмешательство в учебу, игры, отношения со сверстниками и семейную динамику | |||
Физический осмотр | |||
Вес, рост, скорость роста, стадия полового созревания, артериальное давление | |||
Полное физикальное обследование | |||
Объективные абдоминальные данные: расположение, отскок, масса, поясничный признак | |||
Размер печени, селезенки и почек, асцит, боль в боку | |||
Перианальные находки: ректальные и тазовые обследования, анализ стула на скрытую кровь | |||
Лабораторные исследования | |||
Общий анализ крови с дифференциалом, скорость оседания эритроцитов | |||
Общий анализ мочи и посев мочи | |||
Лабораторные исследования индивидуально к Показание | |||
Анализ кала и посев на полиморфноядерные лейкоциты, паразиты, антиген лямблий | |||
Профиль химического состава сыворотки, уровень амилазы | |||
| болезни | |||
Дыхательный водородный тест: лактоза, фруктоза | |||
Серологический тест на амебы, Helicobacter pylori | |||
Визуализирующие исследования | 9002 9002 9002 90020 и УЗИ органов малого таза | ||
Контрастное исследование верхних отделов желудочно-кишечного тракта с исследованием тонкой кишки, компьютерная томография брюшной полости | |||
Эндоскопия верхних отделов, колоноскопия, лапароскопия | |||
Эмпирический анализ в вмешательства | |||
Обучение пациентов и родителей | |||
Дневник симптомов боли, характера кишечника, диеты и связанных характеристик, реакция на вмешательство | |||
Запор исследован как фактор | |||
Диетические вмешательства, включая скорректированное потребление клетчатки, снижение потребления лактозы, уменьшение потребления сока | |||
Испытание пептической терапии | |||
Диагностическая оценка
ИСТОРИЯ
Местоположение боли определяется спецификой. Ребенок может указать место боли, указывая одним пальцем или всей рукой. Наблюдение Апли1 о том, что «чем дальше боль от пупка, тем больше вероятность органического заболевания», подтвердилось. Дети могут оценить интенсивность боли по шкале от 1 до 5 или от 1 до 10 или, для детей младшего возраста, указав на ряд лиц, от улыбки до хмурого взгляда до слез. Поскольку дети могут не понимать таких определений характера, как «жгучий», «острый» или «тупой», лучше всего формулировать вопросы о природе боли на их уровне понимания.Вот некоторые примеры вопросов: «Болит, как игла? Ощущение бабочек в животе? Это помогает есть? Помогает лечь или покакать? »
Ребенок может указать место боли, указывая одним пальцем или всей рукой. Наблюдение Апли1 о том, что «чем дальше боль от пупка, тем больше вероятность органического заболевания», подтвердилось. Дети могут оценить интенсивность боли по шкале от 1 до 5 или от 1 до 10 или, для детей младшего возраста, указав на ряд лиц, от улыбки до хмурого взгляда до слез. Поскольку дети могут не понимать таких определений характера, как «жгучий», «острый» или «тупой», лучше всего формулировать вопросы о природе боли на их уровне понимания.Вот некоторые примеры вопросов: «Болит, как игла? Ощущение бабочек в животе? Это помогает есть? Помогает лечь или покакать? »
Ночная боль или боль при пробуждении предполагает пептическое происхождение, тогда как боль, возникающая вечером или во время обеда, является признаком запора. Дети часто отрицают изжогу, но другие признаки язвенной болезни включают раннее насыщение, тошноту и осложнения гастроэзофагеального рефлюкса. Дневник, в котором перечисляются диета, симптомы и связанные с ними особенности на три-семь дней, неоценим, поскольку он указывает на потенциальные причины симптомов, такие как воздействие лактозы или нарушение нормального опорожнения кишечника. Дневник также должен включать любые вмешательства, инициированные ребенком или родителями.
Дневник также должен включать любые вмешательства, инициированные ребенком или родителями.
Обзор систем будет сосредоточен на характеристиках, которые могут быть связаны с болью в животе, таких как документированная потеря или прибавка в весе, рост в росте, лихорадка, жалобы на суставы и сыпь. Наличие одного или нескольких из этих признаков свидетельствует о воспалительном или инфекционном заболевании. Респираторные осложнения гастроэзофагеального рефлюкса, включая хронический кашель, реактивное заболевание дыхательных путей или стойкий ларингит, могут быть более выраженными, чем рвота или боль в груди.Тщательный обзор последних лекарств покажет, может ли боль подействовать на эмпирическую терапию; например, антибиотики могут предрасполагать пациента к чрезмерному бактериальному росту в кишечнике, лекарства от угрей могут вызывать эзофагит, а трициклические антидепрессанты могут вызывать запор.
Определяется семейный анамнез язвенной болезни, раздраженного или воспалительного заболевания кишечника, панкреатита, желчевыводящих путей или мигрени. Влияние боли на повседневную деятельность ребенка оценивается с помощью вопросов о посещаемости школы, спортивных занятиях и отношениях со сверстниками.По возможности следует уделить подросткам несколько минут наедине, чтобы обсудить проблемы в отсутствие родителей и получить честные ответы на сексуальные вопросы, психологические страхи и нарушения образа жизни, вызванные вмешательством родителей.
Влияние боли на повседневную деятельность ребенка оценивается с помощью вопросов о посещаемости школы, спортивных занятиях и отношениях со сверстниками.По возможности следует уделить подросткам несколько минут наедине, чтобы обсудить проблемы в отсутствие родителей и получить честные ответы на сексуальные вопросы, психологические страхи и нарушения образа жизни, вызванные вмешательством родителей.
ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Из-за взаимодействия между болью в животе, питанием и потребностями роста документируются антропометрические данные веса, роста и скорости роста. Регистрируют артериальное давление и строят график зависимости массы тела от роста для оценки недостаточности питания или ожирения.Обследование обычно завершается до того, как фокусируется на животе. Если сообщается о вздутии живота, следует задокументировать обхват живота в области пупка. Врач должен измерить объем печени, задокументировать размер селезенки и почек и определить влияние движения ног (поясничный признак).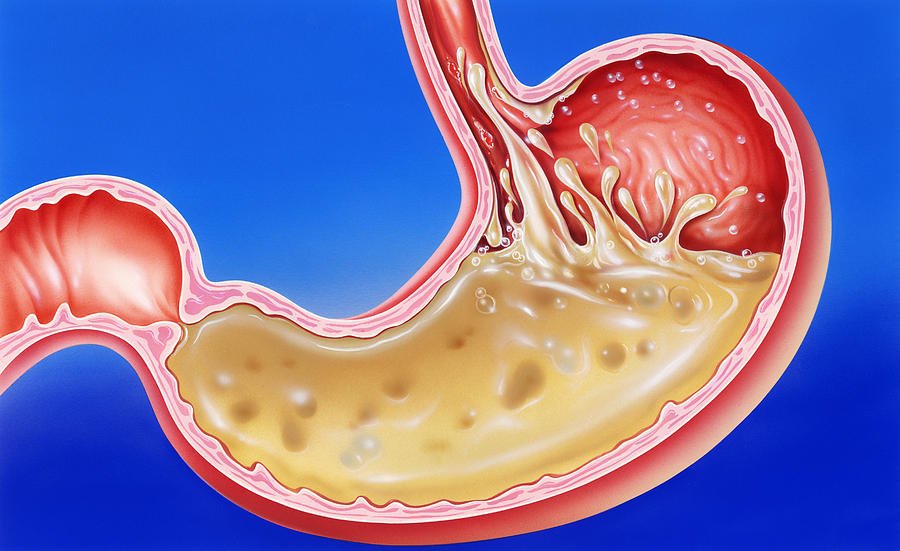 Обследование на предмет боли следует проводить с легким и глубоким надавливанием, а также с отскоком. При обследовании брюшной полости и прямой кишки можно выявить запор, воспалительную массу при болезни Крона, опухоли брюшной полости, такие как нейробластома или опухоль Вильмса, а также наличие грыж пуповины или брюшной стенки.Стул следует исследовать на кровь. Обследование органов малого таза может указывать на гинекологические проблемы, такие как эндометриоз, внематочная беременность, кисты или перекрут яичников.
Обследование на предмет боли следует проводить с легким и глубоким надавливанием, а также с отскоком. При обследовании брюшной полости и прямой кишки можно выявить запор, воспалительную массу при болезни Крона, опухоли брюшной полости, такие как нейробластома или опухоль Вильмса, а также наличие грыж пуповины или брюшной стенки.Стул следует исследовать на кровь. Обследование органов малого таза может указывать на гинекологические проблемы, такие как эндометриоз, внематочная беременность, кисты или перекрут яичников.
ЛАБОРАТОРНОЕ ТЕСТИРОВАНИЕ
Обычная скрининговая лабораторная оценка боли в животе у детей включает в себя полный подсчет клеток крови с дифференцировкой и скоростью оседания эритроцитов для оценки анемии, лейкоцитоза и хронического заболевания. Количество тромбоцитов часто повышается при воспалительных заболеваниях. Показан общий анализ мочи и обычный посев мочи.Образец для проверки стула на кровь берут во время ректального исследования, и результат часто подтверждается тремя дополнительными амбулаторными карточками образцов, используемыми дома.
Дополнительные лабораторные исследования выбираются на основе анамнеза и физического обследования2. Эти исследования включают посев кала, анализ стула на паразитов или антиген лямблии, химический профиль для оценки ферментов печени и амилазы, а также серологические тесты на Helicobacter pylori или амебы. . Углеводный дыхательный тест на непереносимость лактозы показан, если эмпирические диетические вмешательства не дали результатов.
ИЗУЧЕНИЕ ИССЛЕДОВАНИЙ
Сонография брюшной полости и таза обычно выполняется сначала, чтобы исключить некишечное происхождение боли. Следует избегать ограничений изолированной сонографии желчных или почек. Ультразвуковое исследование органов малого таза показано из-за его чувствительности к свободной жидкости, частоты забрюшинного заболевания и визуализации подвздошной кишки при болезни Крона, аденопатии и хронических проявлениях абсцесса от свищей или дивертикула Меккеля.
Если сонография не выявляет аномалий и подозревается хроническая язвенная болезнь или заболевание раздраженного кишечника, показана серия исследований верхних отделов желудочно-кишечного тракта с исследованием тонкой кишки.Если исследовать только верхний отдел желудочно-кишечного тракта, можно пропустить слишком много болезни. Бариевая клизма показана в первую очередь при обструкции или хронической инвагинации. Компьютерная томография (КТ) брюшной полости с контрастированием позволяет оценить экстракишечные новообразования, абсцесс и забрюшинное заболевание.
Верхняя эндоскопия редко используется в качестве исследования первой линии.3 Биопсия пищевода, антрального отдела желудка и двенадцатиперстной кишки может быть показана даже при отсутствии макроскопического заболевания для выявления микроскопических диагностических признаков эозинофильного гастрита, рефлюкс-эзофагита, H.pylori, гранулема болезни Крона и повреждение ворсинок при энтеропатии. Колоноскопия заменила бариевую клизму при оценке боли с хронической диареей или кровотечением.4
ЭМПИРИЧЕСКОЕ ВМЕШАТЕЛЬСТВО
Реакция ребенка на эмпирическое вмешательство является частью диагностической оценки. Перед посещением врача с хронической жалобой большинство родителей инициируют пробное диетическое вмешательство, безрецептурные препараты для подавления кислотности или слабительные. К сожалению, такие попытки управления могут также включать отстранение ребенка от занятий, которые кажутся слишком стрессовыми, таких как продвинутые академические программы или спорт, и это может быть более значительным с точки зрения уверенности ребенка в себе и чувства благополучия, чем с точки зрения вклад в боль.
Первым шагом в эмпирическом лечении является ознакомление ребенка и родителей с дифференциальным диагнозом и вариантами соответствующего вмешательства. Дневник предполагаемых симптомов следует использовать для документирования частоты боли, связанных событий и реакции на вмешательство. Поскольку у детей часто бывает непостоянная частота стула, целесообразным эмпирическим вмешательством является добавление пищевых добавок, чтобы исключить запор как переменную. Таблетки с клетчаткой могут использоваться у детей старше 10 лет, а для детей младшего возраста более новые, более вкусные порошки клетчатки можно смешивать с соком или смешивать и замораживать в соке для приготовления домашнего фруктового мороженого.
Поскольку чрезмерное количество непереваренных углеводов может способствовать возникновению боли в животе, часто уместно провести эмпирическое исследование выведения лактозы или уменьшения чрезмерного потребления сока.5 Эмпирические испытания антиспазматических, анксиолитических или антидепрессантов не показаны. Испытания антацидов редко бывают полезными, поскольку облегчение симптомов ограничивается детьми с эзофагитом, а соблюдение полного курса терапии достигается редко. Если анамнез и физикальное обследование предполагают, что боль имеет пептическое происхождение, может быть назначена пробная терапия блокаторами гистамина H 2 до начала подтверждающих исследований (рис. 1).
Просмотреть / распечатать Рисунок
Оценка на предмет язвенной болезни
РИСУНОК 1.
Алгоритмический подход к ребенку с вероятной язвенной болезнью.
Обследование на предмет язвенной болезни
РИСУНОК 1.
Алгоритмический подход к ребенку с вероятной язвенной болезнью.
Конкретные состояния заболевания
РЕЦИРКУЮЩИЙ СИНДРОМ БОЛИ В ЖИВОТНОМ ЖИВОТЕ
Синдром рецидивирующей боли в животе — это функциональная боль препубертатного периода с двумя различными пиками частоты.Первый пик наступает в возрасте от пяти до семи лет с одинаковой частотой у мальчиков и девочек и у 5-8 процентов детей. Это часто связывают с приспособлением к разлучению с родителями при поступлении в школу. Второй пик, с распространенностью около 25 процентов, приходится на возраст от 8 до 12 лет и гораздо чаще встречается у девочек.6 Боль нечеткая (определяется всей рукой пациента у пупка) и не связана с приемом пищи, активностью. или рисунок стула. Боль не будит пациентов.О расположении в эпигастрии сообщают 10 процентов пациентов. Сопровождается вегетативными особенностями, такими как бледность, тошнота, головокружение, головная боль и утомляемость. Семейный анамнез часто свидетельствует о функциональном заболевании кишечника, таком как синдром раздраженного кишечника7. Физикальное обследование поражает своей нормальностью, а скрининговые лабораторные исследования по определению нормальны.
Лечение повторяющихся болей в животе начинается с признания того, что боль реальна, что обширные исследования не требуются и что ребенок должен подчеркивать нормальность, оставаясь в школе, продолжая занятия и возобновляя нормальную диету.Если степень нетрудоспособности сохраняется, потребуется психологическая оценка и лечение. У детей старшего возраста и подростков компонент синдрома рецидивирующей боли в животе наблюдается в случаях депрессии или панического расстройства с выученной симптоматической конверсионной реакцией и связанной с этим потерей веса. Выполнение лабораторных тестов с отрицательными результатами может повысить уровень тревожности у детей старшего возраста.
Синдром истинного раздраженного кишечника редко возникает до позднего подросткового возраста.7 Лучше всего его можно охарактеризовать как нарушение моторики кишечника с интервалами неприятной диареи или запора. Боль тупая, спастическая и локализуется в левом нижнем квадранте или околопупочной области. Как и в случае рецидивирующего абдоминального болевого синдрома, характерны вегетативные особенности. Стресс вызывает обострение симптомов, и положительный семейный анамнез является обычным явлением. Лечение включает диетические факторы, такие как исключение непереносимости лактозы и добавление клетчатки в рацион, обучение методам управления стрессом и, в редких случаях, использование спазматических препаратов.
ЗАПОР
Запор — основная причина хронической боли в животе у детей от раннего до подросткового возраста. Запор лучше всего определить как неспособность достичь полной эвакуации из нижней части толстой кишки, а не с точки зрения нечастого или твердого стула. Этиология запора у большинства детей — это период, когда они «слишком заняты», чтобы полностью опорожнить кишечник, вызывая расширение нижней части толстой кишки, неустойчивый характер стула и частый энкопрез. Родители обычно не понимают, что вызывает у ребенка дискомфорт.Ребенок избегает твердого стула. В рационе обычно много продуктов, вызывающих запор (например, сыр, паста, крахмал), и мало клетчатки. Этот процесс обычно довольно продвинут, прежде чем семейный врач узнает о проблеме. Помимо осложняющего энкопреза и кровотечения из трещин прямой кишки, симптомы включают спастическую боль, которая возникает во время обильного приема пищи и сильно различается по интенсивности, снижение аппетита и вздутие живота (от стула и газов), возникающее вечером.
Целью лечения является полное опорожнение нижней части толстой кишки почти ежедневно.Это достигается любыми средствами, которые необходимы до тех пор, пока мышечный тонус не восстановится в течение двух-шести месяцев.8 Первоначально высокое потребление клетчатки может усугубить процесс в результате увеличения массы тела при отсутствии сократительного тонуса. Поэтому в первую очередь используются смягчители стула, такие как лактулоза (дюфалак) или минеральное масло. Они сочетаются с «мотивацией идти», которая может быть достигнута у некоторых детей с помощью наклеек, изменяющих поведение, но обычно требует стимулирующих лекарств, таких как гидроксид магния (молоко магнезии) или сенна (сенокот).Ребенку рекомендуется выработать «привычку» пользоваться туалетом с использованием ежедневного календаря, поощрений за попытку дефекации и поощрений за отсутствие энкопреза. Диетические меры начинаются с уменьшения потребления продуктов, вызывающих запор, и, в конечном итоге, включают увеличение количества клетчатки. Первоначальное лечение может потребовать использования клизмы или суппозитория, которые повторяются только в том случае, если отказ от эвакуации превышает три дня. Как смягчающие, так и стимулирующие препараты начинают в дозировках от одной до трех чайных ложек в день и корректируются с учетом реакции в среднем на два мягких стула в день в течение шести-восьми недель.В этот момент большинство детей могут перенести переход к повышенному содержанию пищевых волокон и привычному использованию туалета.
ПЕПТИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Пептические расстройства включают рефлюкс-эзофагит, антральный гастрит, язву желудка и двенадцатиперстной кишки и инфекцию H. pylori. Гастроэзофагеальный рефлюкс у детей недавно был рассмотрен в другой статье9.
Как мы упоминали в разделе, посвященном истории болезни, признаки и симптомы язвенной болезни включают раннюю утреннюю боль, раннее насыщение, ночное возбуждение и положительный семейный анамнез.Боль может быть эпигастральной или околопупочной и имеет очень постоянный характер. Скрытые кровотечения часты при язве и реже при гастрите.10
Основным фактором риска развития язвенной болезни в детстве является генетическая предрасположенность: у 50 процентов детей с язвенной болезнью двенадцатиперстной кишки есть родственники первой степени с язвенной болезнью. Распространенность язвы двенадцатиперстной кишки у мальчиков в два-три раза выше, чем у девочек. Язва желудка встречается значительно реже, чем язва двенадцатиперстной кишки, но у мальчиков и девочек распространенность одинакова.Подход к лечению язвенной болезни кратко представлен на Рисунке 1.
Стрессовые язвы составляют более 75 процентов язвенной болезни у младенцев и детей раннего возраста. Стрессовые язвы обычно проявляются острым, относительно безболезненным, драматическим кровотечением из верхних отделов желудочно-кишечного тракта, характерным для язвы желудка в результате приема нестероидных противовоспалительных препаратов (НПВП) .10 Синдром Золлингера-Эллисона с опухолью, продуцирующей гастрин, очень редко встречается у пациентов. дети; диагноз ставят только у детей с множественными язвами.Острое кровотечение часто встречается у детей с хронической почечной недостаточностью, серповидно-клеточной анемией, муковисцидозом и циррозом печени.
Антральный гастрит — частое проявление язвенной болезни у детей. У детей наблюдается хроническая боль в эпигастрии, раннее чувство насыщения с тошнотой, умеренная потеря веса и низкая частота семейной истории болезни язвенной болезни. Нарушается опорожнение желудка, могут быть выражены симптомы рефлюкса. Результаты анализа кала на скрытую кровь обычно отрицательны. Рентгенологические исследования либо нормальны, либо демонстрируют пилороспазм.Многие дети с антральным гастритом имеют острое начало гастрита, часто в контексте вирусного заболевания.
Эндоскопическое исследование обычно показано в контексте активного, стойкого или рецидивирующего кровотечения, при значительной заболеваемости, связанной с потерей веса, анорексией или болью в груди, или для уточнения аномальных результатов рентгенографических исследований. Детей с подозрением на неосложненную язвенную болезнь обычно лечат блокаторами H 2 , при этом эндоскопию откладывают из-за боли, которая сохраняется более четырех недель, рецидива заболевания, подозрения на H.pylori или исключение эозинофильного гастрита или энтеропатии.4
Медикаментозное лечение язвенной болезни суммировано в таблице 2. Сукральфат (карафат), гель сахарозы алюминия, особенно эффективен при лечении гастрита, вызванного лекарствами.
Посмотреть / распечатать таблицу
ТАБЛИЦА 2Ведение детской язвенной болезни
| Лекарство | Доступность | Дозировка | ||
|---|---|---|---|---|
H 2 900d 1 | 1 блокаторы рецепторов (блокаторы рецепторов300 мг на 5 мл, таблетки 200, 300, 400, 800 мг | От 20 до 40 мг на кг в день, разделенными дозами каждые 6 часов | ||
Ранитидин (Зантак) | 75 мг на 5 мл, таблетки по 150, 300 мг | От 4 до 8 мг на кг в день, в разделенных дозах каждые 8-12 часов | ||
Низатидин ( Axid) | 150-, 300-мг капсулы * | 4-8 мг на кг в день, в разделенных дозах, каждые 12 часов | ||
Фамотидин (Pepcid) | 40 мг на 5 м Таблетки L, 20, 40 мг | 1-2 мг на кг в день, один или два раза в день, максимальная доза: 40 мг в день | ||
Ингибиторы протонной помпы | ||||
Омепразол (Прилосек) | Капсулы по 10, 20 мг * | 0.От 5 до 3 мг на кг в день, разделенными дозами каждые 12 часов | ||
Лансопразол (превацид) | 15-, 30-мг капсулы * | от 0,3 до 1,5 мг на кг в день, в разделенных дозах каждые 12 часов | ||
Ведение детской язвенной болезни
| Лекарство | Доступность | Дозировка |
|---|---|---|
H 2 -блокаторы рецепторов | ||
300 мг на 5 мл, 200-, 300-, 400-, 800-мг таблетки | 20-40 мг на кг в день, в разделенных дозах каждые 6 часов | |
Ранитидин (Зантак) | 75 мг на 5 мл, таблетки по 150, 300 мг | От 4 до 8 мг на кг в день, в разделенных дозах каждые 8-12 часов |
Низатидин (Axid) | 150-, 300-мг капсулы * | 4-8 мг на кг в день, в разделенных дозах, каждые 12 часов |
Фамотидин (Пепцид) | 40 мг на 5 таблетки мл, 20, 40 мг | 1-2 мг на кг в день, один или два раза в день, максимальная доза: 40 мг в день |
Ингибиторы протонной помпы | ||
Омепразол (Прилосек) | Капсулы по 10, 20 мг * | 0.От 5 до 3 мг на кг в день, разделенными дозами каждые 12 часов |
Лансопразол (превацид) | 15-, 30-мг капсулы * | от 0,3 до 1,5 мг на кг в день, в разделенных дозах каждые 12 часов |
Дозировки блокаторов H 2 могут показаться высокими, особенно с учетом того, что лекарства обычно принимают три раза в день в течение первых двух недель терапии, но секреция кислоты у детей достигает взрослого уровня через возраст четыре месяца.К сожалению, ни одно из лекарств, применяемых при язвенной болезни, не было одобрено Управлением по контролю за продуктами и лекарствами США для использования у детей, и семейным врачам, не знакомым с педиатрической терапией пептической болезнью, рекомендуется координировать лечение с детским гастроэнтерологом.
Ингибиторы протонной помпы обычно используются только после подтверждения эндоскопической биопсией отсутствия ответа на терапию блокаторами H 2 . До получения дополнительной информации о безопасности длительного использования ингибиторы протонной помпы обычно назначают с интервалом от двух до четырех месяцев.11
В 1984 г. Маршалл и Уоррен12 продемонстрировали роль грамотрицательной аэрофильной бактерии H. pylori при хроническом гастрите и язвенной болезни у взрослых. Драмм и его коллеги13 быстро подтвердили роль Helicobacter в хроническом антральном гастрите у детей. Эта бактерия продуцирует цитотоксин, уреазу, муциназу и супероксиддисмутазу, которые действуют совместно, вызывая повреждение желудка и / или двенадцатиперстной кишки. Воздействие бактерии, измеряемое по продукции антител, увеличивается в детстве в Соединенных Штатах, достигая 11 процентов к пяти годам, 20 процентов к 10 годам и 45 процентов к более позднему подростковому возрасту.14 Поскольку этот уровень сероконверсии намного превышает уровень зарегистрированного пептического заболевания, значение изолированного положительного результата серологического теста неизвестно.
Наиболее описанным клиническим синдромом в детстве является антральный гастрит, который проявляется при эндоскопическом исследовании ранним чувством насыщения, болью в эпигастральной области живота и узловым антральным гастритом. Исследования, посвященные роли Helicobacter в менее пептических состояниях, таких как синдром рецидивирующей боли в животе, на сегодняшний день не дали окончательных результатов.15 Признавая ограничения положительного серологического результата и исследовательский статус дыхательного теста с C-13-уреазой, диагноз у детей имеет зависели от документации бактерии в эндоскопической биопсии желудка и двенадцатиперстной кишки.Большинство детей получают четырехкратную терапию с непрерывным подавлением кислотности в сочетании с двух-трехнедельным курсом амоксициллина или кларитромицина (биаксин), метронидазола (флагил) и субсалицилата висмута (пепто-бисмол) .16 Этот режим лечения эффективен примерно в 90% случаев. пациентов. Эндоскопическое подтверждение заживления показано при повторяющихся или стойких симптомах. Устойчивость к антибиотикам вызывает все большую озабоченность, поэтому эмпирическое лечение возможной инфекции Helicobacter не рекомендуется.
ПЕРИОДИЧЕСКИЙ СИНДРОМ ИЛИ ЦИКЛИЧЕСКАЯ РВОТА / АБДОМИНАЛЬНАЯ МИГРЕНИ
Первоначальное описание Джи синдрома с «приступами рвоты … с безболезненными интервалами» в 1882 году хорошо сохранилось в клиническом определении периодического синдрома, который теперь называется Синдром циклической рвоты или абдоминальная мигрень в детстве.17 Дети жалуются на эпизодическую тошноту, боль в животе и, как правило, значительную рвоту, обычно начинающуюся ночью или рано утром и продолжающуюся от шести до 48 часов с промежуточными интервалами от недель до месяцев без каких-либо симптомов. или находки вообще.Большинство детей имеют семейный анамнез мигрени и могут иметь другие вегетативные особенности, такие как бледность, взрывной понос, летаргия и тахикардия. Следует отметить, что головная боль редко встречается у детей с синдромом циклической рвоты, хотя в подростковом возрасте она может перерасти в более классическую мигрень. Лечение обычно представляет собой раннее вмешательство с применением противорвотных средств или лекарств от мигрени.
ВОСПАЛИТЕЛЬНАЯ БОЛЕЗНЬ КОЖИ
Боль в животе часто возникает у детей с язвенным колитом и болезнью Крона.Боль, которая обычно возникает в нижней части живота, носит схваткообразный характер и усиливается после еды или физической активности. Боль уменьшается, если есть небольшими порциями, что способствует анорексии и нарушению роста, которые возникают у детей с воспалительными заболеваниями кишечника. Диагноз относительно прост, если у ребенка диарея с кровью, потребность в дефекации ночью, перианальное заболевание или образование в подвздошной кишке при обследовании брюшной полости. Более тонкие признаки включают задержку полового созревания, анемию, не поддающуюся лечению железом, повторяющиеся афтозные язвы в полости рта, хроническое заболевание печени или синовит или артрит крупных суставов.18 Диагноз устанавливается с помощью рентгеновского исследования с контрастированием с барием тонкой кишки и колоноскопии с биопсией. Ведение воспалительного заболевания кишечника в детстве кратко описано в таблице 3.19
Просмотр / распечатка таблицы
ТАБЛИЦА 3Ведение воспалительного заболевания кишечника у детей
Поддерживающая помощь для ребенка и семьи | |||
Обеспечить учебные материалы для детей, родителей, учителей | |||
Предоставьте информацию о группах поддержки для детей и родителей | |||
Предложите психологическое консультирование при депрессии, отрицании и несоблюдении | |||
Ожидайте реактивного самоманипулирования дозировки лекарств и диета | |||
Нутриционная поддержка | |||
Коррекция дефицита макронутриентов и микроэлементов | |||
Обеспечение 125 процентов калорий для людей с высоким возрастом | |||
литивитамины и минеральные добавки | |||
Не поощряйте диеты и причуды «быстрого излечения» | |||
Ввести внутривенное питание пациентам с неизлечимой болезнью Крона или фистулой и перед операцией | |||
Рассмотрите возможность элементарной диеты в качестве первичной терапии у пациентов с болезнью Крона тонкой кишки | |||
Противовоспалительные / иммуномодулирующие препараты | |||
Преднизон (пероральная, внутривенная, местная клизма) | |||
Ценный во всех формах, но использование должно быть сбалансировано с учетом побочных эффектов | |||
Полезно в качестве хронической альтернативной дневной терапии у подростков с болезнью Крона | |||
Салицилаты: сульфасалазин (азульфидин), месаламин (Asacol, Pentasa, Rowasa) , аминосалициловая кислота (Paser Granu les) | |||
Полезен при лечении колита легкой и средней степени тяжести | |||
Метронидазол (Flagyl; возможно, ципрофлоксацин [Cipro] также у детей старшего возраста) | |||
Полезен при лечении перианальной болезни Крона или фистулы | |||
Также полезен при лечении осложненной инфекции Clostridium difficile 13 | Азатиоприн (Имуран) / 6-меркаптопурин (Пуринетол) | ||
Ценен при лечении умеренного и тяжелого колита Крона, язвенного колита | |||
Рыбий жир (EPA, Sea Omega, Promega | 900)|||
Ценна при лечении язвенного колита легкой степени | |||
Хирургическая резекция | |||
Тотальная колэктомия лечит язвенный колит | |||
Полезна при токсической мегаколонии и токсической мегаколонии при язвенном колите | 9002 6|||
Полезно при лечении непроходимости Крона, фистулы, абсцесса | |||
Полезно, когда медикаментозное лечение не помогает или побочные эффекты лекарств непереносимы | |||
Лечение воспалительного заболевания кишечника у детей
Поддерживающая забота о ребенке и семье | |||
Предоставлять образовательные материалы для ребенка, родителей, учителей | |||
Предоставлять информацию о группах поддержки для детей и родителей | |||
Предлагать психологическое консультирование при депрессии, отрицании и несоблюдение | |||
Ожидайте реактивного самостоятельного изменения дозировок лекарств и диеты | |||
Нутриционная поддержка | |||
Коррекция дефицита макронутриентов и микроэлементов | |||
Deliver Количество калорий в соответствии с ростом | |||
Рекомендовать рутинные поливитаминные и минеральные добавки | |||
Не поощрять диеты и причуды «быстрого лечения» | |||
Вводить внутривенное питание пациентам с неизлечимой болезнью Крона или свищами до операции | |||
Рассмотреть использование элементарной диеты в качестве первичной терапии у пациентов с болезнью Крона тонкой кишки | |||
Противовоспалительные / иммуномодулирующие препараты | |||
Преднизон (оральная, внутривенная, местная клизма ) | |||
Ценность во всех формах, но использование должно быть сбалансировано с учетом побочных эффектов | |||
Используется в качестве хронической альтернативной дневной терапии у подростков с болезнью Крона | |||
Салицилаты : сульфаты алазин (азульфидин), месаламин (Asacol, Pentasa, Rowasa), аминосалициловая кислота (Paser Granules) | |||
Ценны при лечении колита легкой и средней степени | |||
Метронидазол (Флагил; возможно, ципрофлоксацин [Cipro] также у детей старшего возраста) | |||
Полезен при лечении перианальной болезни Крона или фистулы | |||
Также полезен при лечении осложненной инфекции Clostridium difficile 13 | Азатиоприн (Имуран) / 6-меркаптопурин (Пуринетол) | ||
Ценен при лечении умеренного и тяжелого колита Крона, язвенного колита | |||
Рыбий жир (EPA, Sea Omega, Promega | 900)|||
Ценна при лечении язвенного колита легкой степени | |||
Хирургическая резекция | |||
Тотальная колэктомия лечит язвенный колит | |||
Полезна при токсической мегаколонии и токсической мегаколонии при язвенном колите | 9002 6|||
Полезен при лечении обструкции Крона, фистулы, абсцесса | |||
Полезен, когда медикаментозное лечение не помогает или побочные эффекты лекарств невыносимы | |||
Заключительный комментарий
После установления этиологии хронической боли в животе, процесс обучения пациентов и их семей только начался.Необходимо тщательное наблюдение, чтобы контролировать соблюдение режима лечения, восстановление нормальной жизнедеятельности и соответствующее вмешательство в семье. Детям не нравится чувствовать себя «другими», и они часто сопротивляются необходимости длительного нутритивного или фармакологического вмешательства. Необходимо тщательно соблюдать параметры роста. Группы поддержки для семьи и ребенка могут быть неоценимыми. Самое главное, ребенок должен чувствовать, что семейный врач понимает, что боль реальна, что вклад ребенка так же ценен, как и вклад родителей, и что конфиденциальная информация, переданная ему, будет оставаться конфиденциальной, если это вообще возможно.
Границы | Инфекция Helicobacter pylori усугубляет дисбактериоз кишечного микробиома у детей с гастритом
Введение
Helicobacter pylori — хорошо известный патоген при хроническом гастрите, язвенной болезни и раке желудка (Marshall and Warren, 1984), обычно приобретаемый в раннем детстве, в основном в возрасте до 5 лет (Weyermann et al., 2009; O ‘Ryan et al., 2015). Эта инфекция вызывает хроническую и низкую степень воспалительной реакции слизистой оболочки желудка и двенадцатиперстной кишки, которая может сохраняться на протяжении всей жизни без лечения. Инфекция H. pylori зависит от штамма и определяется ее ассоциацией с цитотоксическим геном A (cag A) (Wang et al., 2016), бактериальными характеристиками, воспалительным ответом, условиями хозяина и факторами окружающей среды. В Китае высока распространенность инфекции H. pylori . Уровень инфицирования в настоящее время составляет 40–60%, достигая 37,1% до 20-летней стадии инфекции. Таким образом, ранняя диагностика и лечение могут предотвратить осложнений, связанных с H. pylori (Sugano et al., 2015; Malfertheiner et al., 2017). Европейское и Североамериканское общества детской гастроэнтерологии, гепатологии и питания рекомендуют использовать тройную терапию, включая ингибиторы протонной помпы (ИПП) в сочетании с амоксициллином и имидазолом или кларитромицином, в качестве первой линии лечения эрадикации H. pylori . у детей (Koletzko et al., 2011). Однако успешная эрадикация у детей ниже из-за плохой приверженности к лекарствам и устойчивости к антибиотикам H.pylori (Oderda et al., 2007; Okuda et al., 2017). Мета-анализ предыдущих исследований показал, что тройная терапия, дополненная пробиотиками, увеличивает скорость эрадикации при одновременном снижении побочных реакций тройной терапии при инфекции H. pylori , особенно у детей (Szajewska et al., 2010; Li et al., 2014). Понимание того, как микробиом желудочно-кишечного тракта взаимодействует с H. pylori во время инфекции, может предоставить новые цели для его профилактики и лечения у детей.
Недавние исследования микробиома желудка показали, что взаимодействие между H. pylori и другими микробами может играть ключевую роль в развитии заболеваний, связанных с H. pylori (Bik et al., 2006; Schulz et al., 2015; Alarcon et al., 2017; Brawner et al., 2017; Llorca et al., 2017). Микробиом желудка в основном представлен четырьмя типами (Proteobacteria, Bacteroidetes, Firmicutes и Actinobacteria) в общей популяции, и заметные изменения в составе микробиома желудка наблюдались между H.pylori -положительных и H. pylori -отрицательных индивидов (Maldonado-Contreras et al., 2011; Alarcon et al., 2017). Положительный статус H. pylori был связан с увеличением численности протеобактерий, особенно эпсилонпротеобактерий, в основном из-за рода Helicobacter . Наблюдалось также увеличение численности спирохет и ацидобактерий при снижении численности актинобактерий, бактерий Bacteroidetes и фирмикутов (Maldonado-Contreras et al., 2011). Аналогичные результаты были получены для H.pylori -инфицированных детей, представляющих более высокую относительную численность рода Helicobacter (66,3%), чем у H. pylori-отрицательных детей (0,45%), и более низкое бактериальное разнообразие (Brawner et al., 2017; Llorca et al. , 2017). Было обнаружено, что дисбактериоз желудочной микробиоты и некоторых специфических бактерий связан с карциномой желудка или предраковыми поражениями (Coker et al., 2018; Ferreira et al., 2018). Примечательно, что H. pylori играет решающую роль в канцерогенезе.Некоторые исследования также показали, что взаимодействие между Lactobacillus, Streptococcus и H. pylori усиливает воспаление желудка и способствует канцерогенезу, связанному с H. pylori (Aviles-Jimenez et al., 2014; Rizzato et al., 2019) .
Для резидентных микроорганизмов хозяин — это уникальное образование в желудочно-кишечном тракте, и любое изменение этих факторов может изменить гомеостаз. Как упоминалось выше, в недавних исследованиях подчеркивалась роль инфекции H. pylori в микробиоме желудка и взаимодействие с ассоциированными желудочными заболеваниями.Взаимодействие между H. pylori и кишечной микробиотой также было проанализировано, хотя точный механизм, лежащий в основе, все еще остается неясным. Гипохлоргидрия и гипергастринемия, вызванные инфекцией H. pylori , были одними из причин взаимодействия между инфекцией H. pylori и кишечной микробиотой (Beasley et al., 2015; He et al., 2016). Секреция лептина и грелина снизилась у H. pylori -позитивных пациентов и косвенно также повлияла на микроокружение желудочно-кишечного тракта, модулируя секрецию кислоты желудочного сока и иммунный ответ (La Cava and Matarese, 2004; Baatar et al., 2011; Франсуа и др., 2011; Muhsen et al., 2015; He et al., 2016). Уровень грелина в плазме также значительно коррелировал с несколькими видами бактерий, включая Bifidobacterium и Bacteroides . Кроме того, повышенная иммунная реакция, вызванная инфекцией H. pylori , связана с генами в тканях желудка и легких (Kienesberger et al., 2016). Исследования на животных показали, что H. pylori приводит к отчетливым сдвигам в микробиоте кишечника в дистальных, не воспаленных частях желудочно-кишечного тракта (Heimesaat et al., 2014). Аналогичным образом, несколько исследований образцов фекалий человека о взаимосвязи между H. pylori и кишечной флорой также подтвердили различный состав микробиомы кишечника (Buhling et al., 2001; Myllyluoma et al., 2007; Chen et al., 2018; Gao et al., 2018; Иино и др., 2018). Некоторые из упомянутых нами публикаций были посвящены изменениям микробиома кишечника до и после лечения (Buhling et al., 2001; Myllyluoma et al., 2007; Chen et al., 2018). Myllyluoma et al. пришли к выводу, что концентрация клостридий и общая численность анаэробов значительно снизились у H.pylori -положительных по сравнению с H. pylori -отрицательными (Myllyluoma et al., 2007). Исследование Чена и др. В основном было сосредоточено на влиянии эрадикационной терапии H. pylori с использованием тройной терапии. Они также сначала сравнили две группы в день 0 и наблюдали значительное увеличение альфа-разнообразия у H. pylori -положительных образцов фекалий по сравнению с H. pylori -отрицательных субъектов (Chen et al., 2018). Кроме того, японское исследование 1123 взрослых субъектов с использованием амплификации 16S рРНК из образцов фекалий также подтвердило более высокую численность Lactobacillus в H.pylori -инфицированные субъекты с тяжелым атрофическим гастритом (Iino et al., 2018). Однако было проведено только одно исследование, связанное с фекальной микробиотой и инфекцией H. pylori у детей, которое включало 18 образцов фекалий из пяти японских семей (Osaki et al., 2018). Это указывало на схожий состав кишечной микробиоты у членов одной семьи, но размер выборки был небольшим. Связь между H. pylori , гастритом и вариациями кишечного микробиома практически не анализировалась (Chen et al., 2018; Gao et al., 2018), особенно у детей. В этом исследовании фекальный микробиом у детей с H. pylori -положительной группой гастрита (HPG), H. pylori -отрицательной группой гастрита (HNG) и здоровой контрольной группой (HCG) сравнивали до лечения с использованием гена 16S рРНК. последовательность для подтверждения воздействия инфекции H. pylori и гастрита на микробиом кишечника. Результаты этого исследования могут быть полезны для дальнейшей оценки инфекции H. pylori , профилактики и лечения у детей.
Материалы и методы
Дизайн исследования и участники
В рамках этого перспективного пилотного исследования, которое было одобрено экспертным советом учреждения Детской больницы Цилу Университета Шаньдун (IRB # QLCH-ET-2017-06), образцы собирались с января 2017 года по август 2017 года. Письменное информированное согласие и анкеты были получены от все субъекты (дети и законные опекуны), посещающие амбулаторное гастроэнтерологическое отделение Детской больницы Цилу. Они согласились служить донорами фекалий в соответствии с национальным законодательством и Кодексом этических принципов медицинских исследований с участием людей в качестве субъектов Всемирной медицинской ассоциации (Хельсинкская декларация).Для этого исследования были набраны дети с симптомами диспепсии в возрасте от 4 до 14 лет. Все дети были из одного географического района. Все пациенты с симптомами прошли 13 дыхательный тест на C-уреазу, ультрасонографию брюшной полости, экспресс-тест на уреазу (RUT), эндоскопию и гистопатологическое исследование образцов биопсии желудка. Пациентам с гастритом, показывающим положительную гистопатологию и RUT, впервые была диагностирована инфекция Helicobacter pylori , которые затем были разделены на HPG, тогда как пациенты с отрицательными результатами гистопатологии и RUT были разделены на HNG (Koletzko et al., 2011; Jones et al., 2017). Если один из результатов гистопатологии и RUT отрицательный, его можно объединить с результатами других тестов, например, 13 дыхательного теста с C-уреазой. Критерии исключения включали пациентов с язвой двенадцатиперстной кишки или желудка; активное желудочно-кишечное кровотечение; предыдущая неудача эрадиации; или хирургия желудка в анамнезе или медикаментозная терапия антибиотиками, пробиотиками или препаратами, подавляющими кислотность желудочного сока, в предшествующие 4 недели. Кроме того, контрольную группу составили здоровые дети (добровольцы) из той же географической области с соответствующим возрастным и половым составом, что и другие группы.Все они были здоровы, в семейном анамнезе не было заболеваний пищеварительной системы и лекарств от желудочных расстройств. Их результаты дыхательного теста с 13 С-уреазой были отрицательными (рис. 1). Данные были собраны с помощью стандартизированной анкеты, включая основную информацию, историю болезни, семейный анамнез и результаты обследования.
Рисунок 1 . Схема этого исследования. Первоначально для участия в исследовании были отобраны 210 детей с симптомами диспепсии и 64 здоровых ребенка. Девяносто пять человек отказались сдать образцы фекалий, а еще у 15 детей в анамнезе были пероральные наркотики.Все они были исключены. Во второй части тестов пять пациентов отказались от продолжения всех тестов, а еще три пациента с желудочно-кишечными язвами и / или кровотечением были пропущены. В группе здоровых детей один образец кала ребенка отсутствовал, а другой ребенок с пероральными препаратами в анамнезе был исключен.
Сбор образцов, экстракция ДНК и секвенирование
Образцы фекалий собирали в стерилизованные пробирки объемом 2 мл, содержащие чистый этанол на льду, немедленно замораживали (в течение 30 мин) и хранили при -80 ° C до анализа.Геномную ДНК экстрагировали с использованием метода цетилтриметиламмонийбромида (CTAB) (Wang X. et al., 2018). Эквивалент 1 мкл каждого образца использовали для количественного определения ДНК с помощью NanoDrop 2000 (Thermo Scientific). Для анализа бактериальной популяции и амплификации вариабельной области были выполнены V1 – V2 гена 16S рРНК. ПЦР проводили с использованием бактериальных универсальных праймеров 27F (5’AGAGTTTGATCMTGGCTCAG3 ‘) 355R (5’GCTGCCTCCCG TAGGAGT 3’). Продукты ПЦР проверяли с помощью электрофореза в 1% (мас. / Об.) Агарозных гелях в буфере TBE (Трис, борная кислота и ЭДТА), окрашенном Genecolour I ™ (Gene-bio) и визуализировали в УФ-свете.Ампликоны сначала очищали с использованием набора для быстрой ПЦР-очистки QIA (Qiagen, Барселона, Испания), количественно определяли с помощью NanoDrop 2000 (Thermo Scientific), а затем объединяли в равных концентрациях. Объединенные ампликоны (2 нМ) затем подвергали секвенированию с использованием Illumina HiSeq 2500, следуя стандартным протоколам платформы Illumina.
Анализ последовательности гена 16S рРНК
Набор данных о парных концах последовательности гена 16S рРНК был объединен и отфильтрован по качеству с использованием метода FLASH. Все анализы последовательностей проводились в программе Quantitative Insights Into Microbial Ecology (QIIME, версия 1.9.1) (Caporaso et al., 2010) согласно руководству QIIME (http://qiime.org/). Химерные последовательности были удалены с помощью usearch61 с моделями de novo . Последовательности были сгруппированы по рибосомной базе данных 2013 Green genes (13_8 release), 97% эталонного набора данных. Последовательности, которые не соответствовали никаким записям в этой ссылке, были впоследствии сгруппированы в de novo операционных таксономических единиц (OTU) с 97% сходством с UCLUST. Таксономия была присвоена всем OTU с использованием классификатора RDP в QIIME и набора справочных данных Greengenes (Cole et al., 2009).
Статистический анализ
Анкеты были проанализированы с помощью SPSS версии 15.0 (SPSS Inc, Иллинойс, США). Существенной разницы по возрасту, полу и показаниям к эндоскопии между группами не было (таблица 1). Чтобы учесть любую систематическую ошибку, вызванную неравномерной глубиной секвенирования, наименьшее количество последовательностей, присутствующих в любой данной выборке, было выбрано случайным образом из категории выборки до расчета показателей несходства в масштабах всего сообщества (альфа-разнообразие и бета-разнообразие).Затем таблица OTU была увеличена до глубины секвенирования 22000 на образец для обоих анализов разнообразия. Все анализы главных координат (PCoAs) были основаны на невзвешенных и взвешенных расстояниях UniFrac с использованием равномерно отобранных содержаний OTU. Анализ размера линейного дискриминантного эффекта (LEfSe) был проведен, чтобы найти признаки (таксоны), дифференциально представленные между пациентами и здоровыми людьми. LEfSe сочетает в себе тест Краскела – Уоллиса или попарный критерий суммы рангов Вилкоксона с линейным дискриминантным анализом (LDA).Он ранжирует особенности по эффективному размеру, что объясняет большинство биологических различий наверху. Анализ LEfSe проводился на основе порога логарифмической оценки LDA для отличительных признаков, равного 2,0. Влияние каждого из двух факторов, то есть возраста и пола на подтвержденные биомаркеры, было исследовано в рамках каждой из двух клинических категорий с помощью SPSS с помощью одностороннего теста ANOVA. Эффект считался значимым, если значение P- было <0,05. Прогнозирование функционального состава метагенома с использованием данных маркерных генов и базы данных эталонных геномов было выполнено с помощью филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний (PICRUSt) (Langille et al., 2013). Графическое представление результатов было выполнено с помощью R (McMurdie and Holmes, 2013) и STAMP. Расчет значений P- был выполнен с помощью теста Kruskal – Wallis H и теста Велча t . Различия считались достоверными, когда P <0,05.
Таблица 1 . Демографические и клинические характеристики пациентов.
Результаты
Демографические и клинические характеристики субъектов
210 детей с симптомами диспепсии и 64 подходящих здоровых ребенка были изначально включены в исследование.Сто человек отказались от участия, 19 детей были исключены, а один образец кала отсутствовал. Было задействовано около 154 человек (рисунок 1 и таблица 1), в том числе 50 детей в HPG (средний возраст 8,27 ± 2,8 года, 22 девочки и 28 мальчиков). 42 ребенка с гастритом, исключая инфекцию Helicobacter pylori , были включены в HNG (средний возраст 8,64 ± 2,35 года, 12 девочек и 30 мальчиков), тогда как 62 здоровых ребенка (средний возраст 8,41 ± 1,17 лет, 26 девочек и 36 мальчиков) были включены в ХГЧ.Образцы кала и анкеты были собраны у всех субъектов.
Разнообразие кишечного микробиома в трех группах детей
Мы сравнили богатство (оценка охвата на основе численности [ACE]) и разнообразие (Shannon) бактериального сообщества среди HNG, HPG и HCG (рис. 2). Не было значительных различий в индексах Шеннона и ACE при сравнении трех групп, за исключением индекса ACE при сравнении HNG и HCG ( P = 0,0042, рис. 2A).
Рисунок 2 .Сравнение альфа-разнообразия ( A , индекс Шеннона; и B , индекс ACE) на основе профиля OTU. HPG, HNG и HCG окрашены в красный, синий и зеленый цвета соответственно. Значение P вычислялось с помощью критерия суммы рангов Вилкоксона. HPG, Helicobacter pylori -индуцированная группа гастрита; HNG, H. pylori — группа отрицательного гастрита; ХГЧ, здоровая контрольная группа; OUT, операционная таксономическая единица.
Мы также оценили бета-разнообразие среди трех групп с помощью PCoA на основе невзвешенных расстояний UniFrac.PCoA продемонстрировал кластеризацию микробных сообществ между HNG и HPG (рис. 3A), HCG и HNG (рис. 3B), а также HCG и HPG (рис. 3C). Мы использовали анализ сходства (ANOSIM), чтобы проверить, существенно ли различаются две группы по PCoA. Результаты показали, что существует значительная разница в структуре микробиома кишечника между HNG и HPG ( P = 0,002, R = 0,055, ANOSIM), HCG и HNG ( P = 0,001, R = 0,178, ANOSIM). , а также HCG и HPG ( P = 0.001, R = 0,187, ANOSIM).
Рисунок 3 . PCoA бактериального бета-разнообразия на основе невзвешенного расстояния UniFrac. (A) Между HPG и HNG. (B) Между HNG и HCG. (C) Между HPG и HCG. PCoA, анализ главных координат; HPG, Helicobacter pylori -индуцированная группа гастрита; HNG, H. pylori — группа отрицательного гастрита; ХГЧ, здоровая контрольная группа.
Состав кишечного микробиома детей всех трех групп
По относительной численности таксонов в группах, используя 97% в качестве ограничения сходства, было идентифицировано 605 квалифицированных таксонов.На уровне филума в профилях кишечного микробиома в трех группах субъектов преобладали Bacteroidetes (HPG 51,37 ± 16,15%, HNG 50,71 ± 18,34% и HCG 44,07 ± 14,68%), Firmicutes (HPG 35,65 ± 11,92%, HNG 35,16). ± 14% и ХГЧ 46,54 ± 13,78%), протеобактерии (HPG 11,53 ± 12,13%, HNG 12,32 ± 9,49% и ХГЧ 8,09 ± 5,62%) (рис. 4A) (Caporaso et al., 2010; Langille et al., 2013; Макмерди и Холмс, 2013). Анализ уровня филума также продемонстрировал соотношение Firmicutes / Bacteroidetes (F: B), которое резко снизилось в HPG ( P = 0.012) и HNG ( P = 0,0039) по сравнению с ХГЧ. Однако не было разницы между HPG и HNG в соотношении F: B, что означает, что бактериальное сообщество в фекальном микробиоме может измениться в состоянии болезни. На уровне рода Bacteroides (HPG 38,03 ± 17,47%, HNG 37,47 ± 17,81% и HCG 30,18 ± 15,26%) и Prevotella (HPG 9,41 ± 14,96%, HNG 9,17 ± 15,1% и HCG 11,45 ± 16,58). %) были основным родом. Также увеличилась численность Bacteroides и Parabacteroides , уменьшилась численность Roseburia и Faecalibacterium в HPG и HNG по сравнению с HCG (Рисунок 4B).Кроме того, диаграмма Венна показывает 104 распространенных ИУ бактерий среди трех групп (рис. 4С). Есть четыре, три и одна уникальная OTU для HNG, HPG и HCG соответственно.
Рисунок 4 . Сравнение относительной численности таксонов HPG, HNG и HCG. (A) Сравнение относительной численности таксонов среди HPG, HNG и HCG на уровне филума. (B) Сравнение относительной численности таксонов HPG, HNG и HCG на уровне рода. (C) Диаграмма Венна.HPG, Helicobacter pylori -индуцированная группа гастрита; HNG, H. pylori — группа отрицательного гастрита; ХГЧ, здоровая контрольная группа.
Дифференциальная таксономическая численность в трех группах детей
Мы применили анализ LEfSe для дальнейшего выявления значительных различий в содержании между HNG и HPG, HCG и HNG, а также HCG и HPG. Результаты выявили 13 таксонов, различающих сообщества микробиома кишечника с HNG и HPG, с использованием оценки LDA выше 2 (рис. 5A).В каждом из них было 59 таксонов, различающих сообщества кишечного микробиома с HCG и HNG (рис. 5C) и HCG и HPG (рис. 5D) соответственно. Кладограмма (рисунки 5B, E, F) использовалась для представления преобладающих бактерий и структуры микробиоты в каждой группе. Чтобы оценить влияние H. pylori на микробиом кишечника у детей, был проанализирован фекальный микробиом в HPG и HNG (рис. 5A). Было более высокое содержание Betaproteobacteria и Lactobacillales и более низкое содержание Alphaproteobacteria в HPG.На уровне семейства и рода более высокая численность Streptococcus и Collinsella и более низкая численность Pseudomonadaceae, Erysipelotrichaceae и Megasphaera были обнаружены в HPG по сравнению с HNG. Кроме того, состав микробиома кишечника между HNG и HCG сравнивали для анализа измененного микробиома кишечника при гастрите. Обилие бактерий Bacteroidaceae, Enterobacteriaceae, Porphyromonadaceae, Fusobacteriaceae и Megasphaera было обнаружено в HNG.Однако более высокая численность Ruminococcaceae, Lachnospiraceae, Bifidobacteriaceae, Roseburia, Lactobacillus, Sutterella и Bifidobacterium была обнаружена в HCG (рис. 5C). Состав кишечного микробиома у детей, HPG и HCG также был сравнен и проанализирован. Существенные различия таксонов от типа к уровню рода были представлены в LDA. На уровне семейства и рода численность Bacteroidaceae, Enterobacteriaceae, Porphyromonadaceae, Bacteroides, Parabacteroides, Streptococcus и Lactococcus значительно увеличилась в HPG (рис. 5D).Наконец, состав кишечного микробиома в HNG и HCG, а также HPG и HCG сравнивали на пяти значимых бактериальных уровнях. Было значительно более высокое содержание Bacteroidaceae и Enterobacteriaceae и меньшее количество Bifidobacteriaceae, Lactobacillaceae и Lachnospiraceae в HPG и HNG по сравнению с HCG (Рисунки 5G – K). Таким образом, эти результаты означают, что воспаление желудка значительно изменяет состав микробиома кишечника, особенно у детей с H.pylori- индуцированный гастрит.
Рисунок 5 . Характеристики состава микробного сообщества в HPG, HNG и HCG. (A) Наиболее разные таксоны между HPG и HNG (оценка LDA выше 2), которые были получены на основе анализа LEfSe. (B) Обогащенные таксоны фекального микробиома в HPG и HNG представлены на кладограмме. Центральная точка представляет корень дерева (бактерии), а каждое кольцо представляет следующий более низкий таксономический уровень (от филума к роду: p — тип; c — класс; o — порядок; f — семейство; g — род). (C) Наиболее разные таксоны между HNG и HCG (оценка LDA выше 2), которые были получены на основе анализа LEfSe. (D) Наиболее разные таксоны между HPG и HCG (оценка LDA выше 2), которые были получены на основе анализа LEfSe. (E) Обогащенные таксоны фекального микробиома в HNG и HCG представлены на кладограмме. Центральная точка представляет корень дерева (бактерии), а каждое кольцо представляет следующий более низкий таксономический уровень (от филума к роду: p — тип; c — класс; o — порядок; f — семейство; g — род). (F) Обогащенные таксоны фекального микробиома в HPG и HCG представлены на кладограмме. Центральная точка представляет корень дерева (бактерии), а каждое кольцо представляет следующий более низкий таксономический уровень (от филума к роду: p — тип; c — класс; o — порядок; f — семейство; g — род). (G – K) Было проведено сравнение относительной численности пяти бактерий (Bacteroidaceae, Enterobacteriaceae, Bifidobacteriaceae, Lactobacillaceae и Lachnospiraceae) среди HPG, HNG и HCG. HPG, Helicobacter pylori -индуцированная группа гастрита; HNG, H.pylori — группа гастрита отрицательная; ХГЧ, здоровая контрольная группа; LDA — линейный дискриминантный анализ; LEfSe, величина линейного дискриминантного эффекта.
Прогностическая функция кишечного микробиома в трех группах детей
Мы также исследовали функцию микробиоты на основе предполагаемых метагеномов с использованием алгоритма PICRUSt. Мы сравнили различия между HNG и HPG, HCG и HNG, а также HCG и HPG в ортологии Киотской энциклопедии генов и геномов (KEGG). Среди 328 аффилированных путей KEGG 19 имели статистически значимые и разные P <0.05 в HNG и HPG (Рисунок 6A). Интересно, что пути, связанные с генетической информацией (основные факторы транскрипции) и обработкой информации окружающей среды (путь передачи сигналов кальция), были обогащены HPG. Пути, связанные с заболеваниями человека (токсоплазмоз, мелкоклеточный рак легких и колоректальный рак), клеточными процессами (сигнальный путь p53) и метаболизмом (углеводный обмен) были истощены в HPG. И было 23 пути KEGG, показывающих значительные различия в HCG и HNG (Рисунок 6B).Пути, связанные с метаболизмом (метаболизм аминокислот, жирных кислот, углеводов и лекарств - цитохром Р450 и устойчивость к бета-лактамам) и заболеваниями человека (бактериальная инвазия эпителиальных клеток) были обогащены HNG. Однако клеточные процессы, передача сигналов (другие ионно-связанные переносчики) и другой метаболизм (биосинтез пантотената и КоА, биосинтез фенилаланина, тирозина и триптофана и биосинтез лизина) были истощены в HNG. Семнадцать путей KEGG показали значительные различия в HCG и HPG (рис. 6C).Пути, связанные с метаболизмом (белки биосинтеза липополисахаридов [LPS], устойчивость к бета-лактамам, биосинтез LPS, метаболизм жирных кислот, биосинтез гликосфинголипидов – ганглиозный ряд, деградация гликозаминогликанов, метаболизм ксенобиотиков посредством цитохрома P450, биосинтез N-гликозидов, биосинтез N-гликозидов. и др. деградация гликанов) и болезни человека (коклюш, первичный иммунодефицит, рак мочевого пузыря, болезнь Шагаса, африканский трипаносомоз и бактериальная инвазия эпителиальных клеток) были обогащены HPG, но было обнаружено, что биосинтез пептидогликана истощен.Эти результаты показывают, что микробиом кишечника, пораженный инфекцией H. pylori и гастритом, также вызывает некоторые изменения в основных метаболических функциях организма, восприимчивости к заболеваниям и метаболизме лекарств. Также можно сказать, что микробиом кишечника влияет на воспаление желудка. Таким образом, эти результаты показывают, что у детей инфекция H. pylori , гастрит и измененный микробиом кишечника взаимодействуют друг с другом.
Рисунок 6 . Прогнозируемая функция метагенома на основе анализа пути KEGG.Графики с расширенными полосами погрешностей показывают значительно различающееся количество путей KEGG. (A) Между HPG и HNG. (B) Между HNG и HCG. (C) Между HPG и HCG. Пропорция (слева) указывает возможное количество микробов, обладающих каждым функциональным признаком, и разницу в пропорциях для каждого признака. Кружки (правая сторона) представляют собой разницу между средней долей бактерий (размер эффекта), прилегающей к их соответствующему ДИ (планки ошибок).KEGG, Киотская энциклопедия генов и геномов; HPG, Helicobacter pylori -индуцированная группа гастрита; HNG, H. pylori — группа отрицательного гастрита; ХГЧ, здоровая контрольная группа.
Обсуждения
Дисбиоз микробиома был связан с желудочно-кишечными заболеваниями, включая гастрит, в котором важную роль играет Helicobacter pylori (He et al., 2016; Minalyan et al., 2017; Sgambato et al., 2017; Gorkiewicz and Moschen, 2018) . Хотя существует несколько исследований, посвященных бактериальному биоразнообразию в верхних отделах желудочно-кишечного тракта, роль H.pylori и гастрит в кишечном бактериальном сообществе, особенно у детей, неизвестны. В предварительном исследовании оценивалось влияние инфекции H. pylori и гастрита на микробиом фекалий путем сравнения трех педиатрических групп с использованием анализа последовательности гена 16S рРНК. Это исследование выявило (i) значительные различия в анализе бета-разнообразия в трех группах, особенно в HPG, HNG и HCG; (ii) соотношение F: B резко снизилось как в HPG, так и в HNG, при этом более высокая численность Bacteroidaceae и Enterobacteriaceae и более низкая численность Lachnospiraceae, Bifidobacteriaceae и Lactobacillaceae также обнаружены в HPG и HNG; и (iii) HPG имел более высокую численность Betaproteobacteria, Lactobacillales и Streptococcus , более низкую численность Alphaproteobacteria, Megasphaera , чем HNG.Результаты показывают, что инфекция H. pylori и гастрит могут изменить микробиом кишечника.
В отличие от взрослых, детей, инфицированных H. pylori , в основном протекали бессимптомно с различными микроскопическими воспалениями желудка, и только у небольшой части из них развились клинические проявления хронической инфекции, например, язвенная болезнь и рак желудка (Jones et al., 2017). Со снижением распространенности у детей заболеваемость астмой с ранним началом, воспалительными заболеваниями кишечника (ВЗК), желудочно-кишечными и системными инфекциями, а также пищеводом Барретта увеличивалась (Arnold et al., 2011; Коэн и др., 2012; Castano-Rodriguez et al., 2017; Миналян и др., 2017). Это объясняется толерогенным иммунным состоянием, индуцированным H. pylori в раннем возрасте, что помогает бактериям сохраняться в организме человека-хозяина (Gorkiewicz and Moschen, 2018). Следовательно, H. pylori считается патогеном человека позднего возраста с потенциальными преимуществами в раннем возрасте. Снижение скорости эрадикации и повышение лекарственной устойчивости — основные проблемы у детей. Нет четкого консенсуса относительно оптимального возраста для H.pylori (Gotoda et al., 2018). Более того, связь между H. pylori , ВЗК и раком толстой кишки в настоящее время неясна. Изучение изменений микробиома кала, вызванных инфекцией H. pylori и гастритом, может быть полезным для оценки последствий инфекции H. pylori у детей, а также для изучения новых стратегий лечения.
Хотя точный механизм того, как воспаление желудка приводит к изменениям фекальной микробиоты, четко не определен, появляется все больше свидетельств того, что взаимодействие между бактериями и реакциями хозяина может формировать состав комменсальной микробиоты.Изменения микробиоты желудка, pH просвета и конечных продуктов бактериальной ферментации играют важную роль в формировании структуры сообщества кишечной микробиоты (Cremer et al., 2017). Однако о взаимосвязи между гастритом и микробиомом кишечника не сообщается (Chen et al., 2018; Gao et al., 2018). Хуан-Хуан Гао и др. проанализировали фекальный микробиом у пациентов с различными поражениями желудка, связанными с H. pylori . Они обнаружили изменения в доминантных типах Bacteroidetes, Firmicutes и Proteobacteria в группах с различными H.pylori (Gao et al., 2018). Они никогда не наблюдались в аналогичных исследованиях у детей. Результаты текущего исследования впервые показали, что различные флора в HNG и HCG до лечения были затронуты простым гастритом. Наши данные свидетельствуют о том, что численность Bacteroidaceae, Enterobacteriaceae, Porphyromonadaceae, Fusobacteriaceae, Bacteroides и Megasphaera увеличилась в HNG. Интересно, что большинство значимых таксонов принадлежало грамотрицательным бактериям, продуцирующим ЛПС.ЛПС кишечного микробиома вызывает хронический субклинический воспалительный процесс (Saad et al., 2016). Эти результаты вместе показывают, что вариации в микробиоме кала могут быть дополнительным фактором риска, способствующим воспалению желудочно-кишечного тракта у детей.
Инфекция H. pylori является основной причиной гастрита, и у нее были разработаны механизмы сосуществования в жестком микроокружении желудка, где она вызывает воспаление слизистой оболочки, активацию иммунной системы, гипергастринемию и различные эффекты на продукцию кислоты в желудке.На основании наших результатов мы пришли к выводу, что в HPG было больше лактобацилл и Streptococcus . В нашем исследовании численность Lactobacillaceae и Lactobacillus снизилась в HPG и HNG, но в HPG была более высокая численность Lactobacillales . Lactobacillales относятся к классу Bacilli и типу Firmicutes и имеют шесть семейств. Lactobacillaceae и Lactobacillus не увеличивались и не уменьшались при сравнении HPG и HNG.Однако у рода Streptococcus , который принадлежит к семейству Streptococcaceae, значительно увеличился показатель HPG. Таким образом, мы коррелировали высокую численность Lactobacillales с более высокой численностью представителей рода Streptococcus . Streptococcus принадлежит к комменсалам, таким как микробиом полости рта (Насидзе и др., 2009) и здоровый микробиом ядра пищевода (Hunt and Yaghoobi, 2017; Nardone et al., 2017). Khosravi et al. сообщили, что Streptococcus mitis индуцировал преобразование H.pylori в кокковидные клетки в исследованиях сокультивирования и подавлял их рост (Khosravi et al., 2014a). Кроме того, исследование показало, что (инсулин-гастрин) мыши INS-GAS, коинфицированные H. pylori и Streptococcus salivarius , развили более тяжелое воспаление желудка, чем H. pylori , только через 5 месяцев после инфицирования (Rizzato et al. ., 2019). Streptococcus также был связан с пептической язвой (Khosravi et al., 2014b) и канцерогенезом желудка (Coker et al., 2018). Следовательно, род Streptococcus существует в нормальном желудочно-кишечном тракте и взаимодействует с желудочными заболеваниями. Наше исследование также пришло к выводу, что более низкая численность Megasphaera была обнаружена в HPG по сравнению с HNG. Megasphaera , род Firmicutes бактерий в классе Negativicutes, был обнаружен в желудке крупного рогатого скота и овец, а также у плодов человека. Вид Megasphaera , названный Megasphaera elsdenii , обитает в кишечнике человека и обладает пробиотическим потенциалом (Kwon et al., 2018). Из-за технологических ограничений реальный бактериальный ответ у людей все еще требует подтверждения в дальнейших исследованиях.
В заключение, фекальный микробиом был затронут H. pylori у пациентов с гастритом. Однако сравнение составов кишечного микробиома в HPG и HCG также подтвердило вышеуказанное изменение фекального микробиома при гастрите и инфекции H. pylori . В то же время он также показывает, что большинство изменений кишечной флоры вызвано желудочной инфекцией.Однако факторы, вызванные инфекцией H. pylori , также могут вызывать изменения в количестве некоторых особых бактерий. Streptococcus и Megasphaera были обнаружены в изобилии в HPG и HNG. Это согласуется с симптомами несварения желудка, наблюдаемыми у пациентов с гастритом, вызванным H. pylori, и обычным гастритом (Correa Silva et al., 2016; Jones et al., 2017).
Что касается измененного состава фекального микробиома при гастрите, соотношение F: B резко снизилось в HPG и HNG.Снижение соотношения F: B у H. pylori -позитивных субъектов до лечения также было обнаружено в другом исследовании (Osaki et al., 2018). Хорошо известно, что соотношение F: B связано с ожирением, индексом массы тела (ИМТ), метаболическим синдромом, пожилыми людьми и искоренением инфекции H. pylori (Azuma et al., 2002; Claesson et al. др., 2011; Takeoka et al., 2016). Текущее исследование не измеряло ИМТ у всех людей; необходимы дальнейшие исследования, чтобы проверить взаимодействие между соотношением F: B и H.pylori инфекция. Более высокая численность Enterobacteriaceae и Bacteroides также была обнаружена в группах. В Enterobacteriaceae есть много видов патогенных бактерий, таких как Escherichia, Salmonella и Shigella . Энтеротоксигенный Escherichia coli (ETEC) может продуцировать энтеротоксин. Известно, что ETEC увеличивает высвобождение диаминоксидазы (DAO) и D -лактата в плазме, что может привести к повреждению мембраны эпителиальных клеток кишечника (Liu et al., 2017). Повышающая регуляция провоспалительных цитокинов и понижающая регуляция противовоспалительных цитокинов (Xun et al., 2015) может быть способом влияния на гастрит. Bacteroides fragilis , на долю которого приходится всего 0,5% микробиома толстой кишки человека, является наиболее часто выделяемым анаэробным патогеном. Кроме того, ряд Bacteroides spp. обладают высокой устойчивостью к антибиотикам (Mazmanian et al., 2005; Wexler, 2007). В нескольких исследованиях сообщалось об увеличении или уменьшении Bacteroidales в образцах слизистой оболочки субъектов с ВЗК по сравнению с контрольной группой (Zitomersky et al., 2013), что указывает на связь Bacteroidales с ВЗК. Обилие двух таксонов (Enterobacteriaceae и Bacteroides ) связано с воспалением кишечника и ВЗК.
Как правило, два рода Lactobacillus и Bifidobacterium считаются пробиотиками, которые важны для здоровья человека (Wang Y. et al., 2018). Это исследование показало, что эти два рода значительно уменьшились в микробиоме кишечника у детей с HPG и HNG. Они могут изменять PH кишечной среды, подавляя рост патогенных бактерий и стимулируя иммунный ответ (Zhu et al., 2018). Некоторые исследования также пришли к выводу, что Lactobacillus spp. в микробиоме желудка также оказывает ингибирующее действие против H. pylori (Zaman et al., 2014; Salas-Jara et al., 2016). В другом исследовании у детей с инфекцией H. pylori было снижено относительное количество Bifidobacterium , которое значительно увеличилось после того, как дети употребляли йогурт, содержащий пробиотики (Yang and Sheu, 2012). Более высокое содержание Lactobacillus и Bifidobacterium у здоровых детей может защитить их от воспаления желудочно-кишечного тракта.Но некоторые другие исследования также имеют противоположные результаты с Lactobacillus . Недавнее исследование коизолатов Lactobacillus и H. pylori от человека не выявило какого-либо значительного влияния лактобацилл на штаммов H. pylori (Skoog et al., 2011). Иино и др. также обнаружили, что инфекция H. pylori первоначально влияла на соотношение состава каждого вида Lactobacillus в кишечной микробиоте до прогрессирования атрофического гастрита, и предположили более высокую численность Lactobacillus в H.pylori -инфицированные субъекты с тяжелым атрофическим гастритом (Iino et al., 2018). Немецкое исследование также показало, что H. pylori привело к усиленному росту лактобацилл в фекальном микробиоме (Buhling et al., 2001). Считалось, что эти результаты учитывают долгосрочное подавление кислоты, вызванное инфекцией H. pylori , и терапию ИПП после атрофического гастрита (Takashima et al., 2001; Weck et al., 2009; Jackson et al., 2016). Это говорит о том, что бактерии, продуцирующие молочную кислоту, могут также усиливать воспалительные реакции желудка, вызванные H.pylori . По-прежнему существуют разногласия по поводу вида и дозировки Lactobacillus в качестве пробиотика при инфекции H. pylori (Schulz et al., 2015; Iino et al., 2018). Более низкое содержание двух родов в кишечном микробиоме детей в HPG может способствовать выработке воспалительных факторов, ведущих к гастриту. Однако, прежде чем результаты нашего исследования будут использованы для лечения гастрита, вызванного H. pylori- , с помощью Lactobacillus и Bifidobacterium , эти два вида бактерий должны быть подтверждены в будущих исследованиях.
Чтобы сравнить детально измененный путь KEGG, значительные различия в частоте возникновения колоректального рака между двумя группами были связаны со специфическими изменениями в составе микробиома кишечника. Было проведено исследование ассоциации в масштабе всего метагенома (MGWAS), и было обнаружено, что некоторые Bacteroides spp. (например, Bacteroides dorei, Bacteroides vulgatus и Bacteroides massilensis ) и E. coli были связаны с системным воспалением и стадией опухоли (Feng et al., 2015). За последние два десятилетия в нескольких исследованиях изучалась потенциальная связь инфекции H. pylori с колоректальной неоплазией (Breuer-Katschinski et al., 1999; Mizuno et al., 2005; Inoue et al., 2011; Papastergiou et al. , 2016). Однако прямая активация бактерией колоректального канцерогенеза остается спорной (Papastergiou et al., 2016). Наши данные предполагают, что более высокая численность Bacteroidaceae и Enterobacteriaceae была также обнаружена в HNG и HPG, а путь KEGG колоректального рака увеличился в HNG, как и в другом исследовании (Chen et al., 2018), в то время как в большинстве исследований сообщается, что количество путей колоректального рака, по прогнозам, будет выше в группе H. pylori -позитивных (Kountouras et al., 2018; Kumar et al., 2018). Необходимо подтвердить истинную связь между H. pylori , гастритом и колоректальным раком путем дальнейших исследований изменения микробиома кишечника.
Наше исследование показало значительное повышение активности метаболических путей у детей с ГПГ и ГНГ. Это включало метаболизм жирных кислот и устойчивость бета-лактама к лекарственным средствам за счет цитохрома P450. H. pylori зависит от биосинтеза ненасыщенных жирных кислот (НЖК) для поддержания своей мембранной структуры и функции (Bi et al., 2016). Уровень микробных НЖК значительно повышен в крови пациентов с пептической язвой, вызванной инфекцией H. pylori (Кцоян и др., 2010). Эти результаты предполагают, что инфекция H. pylori связана с повышенным метаболизмом липидов. Функциональный анализ микробиома показал, что метаболизм липидов увеличился в группе с гастритом, что указывает на то, что микробиом кишечника имеет те же эффекты, что и H.pylori -индуцированный гастрит. На эрадикацию H. pylori влияют устойчивость к антибиотикам и генотипы (Chunlertlith et al., 2017). Повышенная устойчивость к антибиотикам, таким как экспрессия гена бета-лактама и цитохрома P450 CYP2C19, который может кодировать разрушающий белок PPI, снижает скорость эрадикации H. pylori (Boyanova et al., 2016). Результаты показали, что резистентность к бета-лактаму и пути цитохрома P450 увеличиваются у детей как с HPG, так и с HNG, что является важной информацией для разработки альтернативных или улучшенных стратегий лечения.Таким образом, статус организма в отношении метаболизма глюкозы и липидов, резистентности к бета-лактамам, метаболизма ксенобиотиков с помощью цитохрома P450 и лекарств с помощью цитохрома P450 может быть связан с гастритом. Эффективность лечения гастрита, вызванного H. pylori , у детей может быть увеличена за счет изменения микробиома фекалий, особенно скорости эрадикации H. pylori .
Широкое использование антибиотиков у детей при гастрите H. pylori снижает эффективность H.pylori и увеличивает распространенность устойчивых к антибиотикам штаммов. В этом исследовании сообщается о различиях в микробиоме фекалий, наблюдаемых при инфекции, вызванной H. pylori и гастрите. Streptococcus и Megasphaera были обнаружены в микробиоме кишечника в HPG и HNG. Измененные категории в пути KEGG предполагают, что эти различные бактерии могут играть роль в лекарственной устойчивости инфекции H. pylori или во взаимосвязи с раком толстой кишки и ВЗК.Эти результаты предполагают, что гастрит сам по себе может вызывать изменения в составе фекального микробиома, которые могут усугубляться инфекцией H. pylori . Эти изменения микробиома кишечника могут быть связаны с лекарственной устойчивостью и развитием хронических желудочно-кишечных заболеваний, влияющих на лечение инфекции H. pylori и гастрита. Lactobacillus и Bifidobacterium могут использоваться в качестве пробиотиков для лечения пациентов с гастритом. Это действительно предполагает тесное взаимодействие H.pylori , гастрит и микробиома кишечника. Следовательно, решение исследовать и лечить инфекцию должно оцениваться с точки зрения очевидной пользы для конкретного ребенка. Детям следует подбирать разумное и эффективное лечение, чтобы избежать повторного применения антибиотиков против кишечной флоры. Ожидается, что пробиотики будут использоваться для лечения детей с легкими заболеваниями или для облегчения симптомов. Однако эффективность, вид и дозировка пробиотиков требуют дальнейшего изучения.
В заключение, это исследование впервые продемонстрировало структурный, композиционный и функциональный дисбиоз фекального микробиома при гастрите, вызванном H.pylori . Он показал, что текущие методы лечения в сочетании со стратегиями, которые модулируют микробиом кишечника, могут улучшить клинический исход гастрита, вызванного H. pylori- . Полученные данные могут проложить путь для начала клинических испытаний в более широкой когорте и разработки рекомендаций по терапевтическим стратегиям с пробиотиками. Однако у исследования есть и недостатки; например, технология точна только для нескольких видов, и соответствующий образец слизистой оболочки желудка и образцы крови отдельных лиц не собирались для сравнения с тем же образцом фекалий.К тому же количество привлеченных детей было меньше. В будущем потребуется более крупное исследование, и для подтверждения этих результатов необходимо будет собрать подробные клинические данные.
Заявление о доступности данныхВсе данные секвенирования, связанные с этим исследованием, были загружены в базу данных NCBI SRA (номер доступа: PRJNA544571). Веб-страница базы данных SRA: https://www.ncbi.nlm.nih.gov/sra.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены Комитетом по медицинской этике детской больницы Цилу Университета Шаньдун.Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном / ближайшими родственниками участников.
Авторские взносы
LZ и ZG разработали исследование. LY, JZ, CZ и JY выполнили измерения и анализ данных. JX, XW, YL, HL и YW получили образцы и клинические данные. LY и JZ написали рукопись. Все авторы прочитали и критически отредактировали рукопись.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим всех участников этого исследования, которое было поддержано Программой ключевых исследований и разработок провинции Шаньдун по контракту №. 2018CXGC1219 (для ZG), Программа ключевых исследований и разработок провинции Шаньдун по контракту № 2017G006039 (для YW) и Проект расширения техники Вэйхай по контракту № 2016GNS023, Национальный фонд естественных наук Китая по контракту № 31471202 и Программа ключевых исследований и разработок провинции Шаньдун по контракту №2016YYSP009 (в LZ). LZ также была поддержана программой стипендиатов Тайшань провинции Шаньдун. Мы также были благодарны Цзяньфэну Вану и Бин Чену (Beijing Nebula Medical Laboratory Co., Ltd.) за помощь в анализе данных и редактировании рукописей.
Список литературы
Аларкон, Т., Льорка, Л., и Перес-Перес, Г. (2017). Влияние Helicobacter pylori на микробиоту и развитие заболеваний желудка . Curr. Верхний. Microbiol. Иммунол. 400, 253–275.DOI: 10.1007 / 978-3-319-50520-6_11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арнольд И. К., Дехзад Н., Рейтер С., Мартин Х., Бехер Б., Таубе К. и др. (2011). Инфекция Helicobacter pylori предотвращает аллергическую астму на моделях мышей за счет индукции регуляторных Т-клеток. J. Clin. Инвестировать. 121, 3088–3093. DOI: 10.1172 / JCI45041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Авилес-Хименес, Ф., Васкес-Хименес, Ф., Медрано-Гусман, Р., Мантилья, А., и Торрес, Дж. (2014). Состав микробиоты желудка варьируется между пациентами с неатрофическим гастритом и пациентами с кишечным типом рака желудка. Sci. Реп. 4: 4202. DOI: 10.1038 / srep04202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Адзума Т., Суто Х., Ито Ю., Мурамацу А., Отани М., Додзё М. и др. (2002). Ликвидация инфекции Helicobacter pylori вызывает увеличение индекса массы тела. Алимент. Pharmacol. Ther. 16, 240–244. DOI: 10.1046 / j.1365-2036.16.s2.31.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бизли Д. Э., Кольц А. М., Ламберт Дж. Э., Фирер Н. и Данн Р. Р. (2015). Эволюция кислотности желудка и ее значение для микробиома человека. PLoS ONE 10: e0134116. DOI: 10.1371 / journal.pone.0134116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Би, Х., Чжу, Л., Цзя, Дж., Цзэн, Л., и Кронан, Дж. Э. (2016). Синтез ненасыщенных жирных кислот в желудочном патогене Helicobacter pylori происходит по механизму обратного отслеживания. Cell Chem. Биол. 23, 1480–1489. DOI: 10.1016 / j.chembiol.2016.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бик, Э. М., Экбург, П. Б., Гилл, С. Р., Нельсон, К. Э., Пурдом, Э. А., Франсуа, Ф. и др. (2006). Молекулярный анализ бактериальной микробиоты желудка человека. Proc.Natl. Акад. Sci. США 103, 732–737. DOI: 10.1073 / pnas.0506655103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боянова Л., Гергова Г., Евстатиев И., Спасова З., Кандиларов Н., Янева П. и др. (2016). Helicobacter pylori Устойчивость к шести антибиотикам по двум системам контрольных точек и эволюция устойчивости в Болгарии. Заражение. Дис. 48, 56–62. DOI: 10.3109 / 23744235.2015.1082035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браунер, К.М., Кумар, Р., Серрано, К. А., Птачек, Т., Лефковиц, Э., Морроу, К. Д. и др. (2017). Инфекция Helicobacter pylori связана с изменением микробиоты желудка у детей. Mucosal Immunol. 10, 1169–1177. DOI: 10.1038 / mi.2016.131
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брейер-Катчински Б., Немес К., Марр А., Рамп Б., Лейендекер Б., Брейер Н. и др. (1999). Helicobacter pylori и риск аденомы толстой кишки. Colorect. Дайджест группы по изучению аденомы. 60, 210–215. DOI: 10.1159 / 000007661
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Buhling, A., Radun, D., Muller, W. A., and Malfertheiner, P. (2001). Влияние тройной антихеликобактерной терапии метронидазолом, омепразолом и кларитромицином на микрофлору кишечника. Алимент. Pharmacol. Ther. 15, 1445–1452. DOI: 10.1046 / j.1365-2036.2001.01033.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капорасо, Дж.G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F. D., Costello, E. K., et al. (2010). QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нац. Методы 7, 335–336. DOI: 10.1038 / nmeth.f.303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастано-Родригес, Н., Каакуш, Н. О., Ли, В. С., и Митчелл, Х. М. (2017). Двойная роль видов Helicobacter и Campylobacter при ВЗК: систематический обзор и метаанализ. Кишечник 66, 235–249.DOI: 10.1136 / gutjnl-2015-310545
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, L., Xu, W., Lee, A., He, J., Huang, B., Zheng, W., et al. (2018). Воздействие инфекции Helicobacter pylori , эрадикационная терапия и добавление пробиотиков на гомеостаз микросреды кишечника: открытое рандомизированное клиническое исследование. EBioMedicine 35, 87–96. DOI: 10.1016 / j.ebiom.2018.08.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чунлертлит, К., Limpapanasit, U., Mairiang, P., Vannaprasaht, S., Tassaneeyakul, W., Sangchan, A., et al. (2017). Результаты рандомизированного контролируемого исследования, сравнивающего тройную терапию модифицированным высокими дозами омепразола и амоксициллина со стандартной тройной терапией для эрадикации Helicobacter pylori . Asian Pac. J. Cancer Prev. 18, 927–932. DOI: 10.22034 / APJCP.2017.18.4.927
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клаэссон, М. Дж., Кьюсак, С., О’Салливан, О., Грин-Диниз, Р., де Верд, Х., Фланнери, Э. и др. (2011). Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей. Proc. Natl. Акад. Sci. США 108, 4586–4591. DOI: 10.1073 / pnas.1000097107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коэн Д., Шохам О., Орр Н. и Мухсен К. (2012). Обратная и независимая связь между инфекцией Helicobacter pylori и заболеваемостью шигеллезом и другими диарейными заболеваниями. Clin. Заразить. Дис. 54, e35 – e42. DOI: 10.1093 / cid / cir916
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кокер, О. О., Дай, З., Не, Й., Чжао, Г., Цао, Л., Накацу, Г. и др. (2018). Дисбактериоз микробиома слизистой оболочки при канцерогенезе желудка. Кишечник 67, 1024–1032. DOI: 10.1136 / gutjnl-2017-314281
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коул, Дж. Р., Ван, К., Карденас, Э., Фиш, Дж., Чай, Б., Фаррис, Р.J., et al. (2009). Проект базы данных рибосом: улучшенное выравнивание и новые инструменты для анализа рРНК. Nucleic Acids Res. 37, D141 – D145. DOI: 10.1093 / nar / gkn879
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корреа Сильва, Р. Г., Мачадо, Н. К., Карвалью, М. А., и Родригес, М. А. (2016). Инфекция Helicobacter pylori часто встречается у детей при неязвенной диспепсии, но не связана со специфическими желудочно-кишечными симптомами. Acta Paediatr. 105, e228 – e231.DOI: 10.1111 / apa.13347
CrossRef Полный текст | Google Scholar
Кремер Дж., Арнольдини М. и Хва Т. (2017). Влияние потока воды и химической среды на рост и состав микробиоты в толстой кишке человека. Proc. Natl. Акад. Sci. США 114, 6438–6443. DOI: 10.1073 / pnas.1619598114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Feng, Q., Liang, S., Jia, H., Stadlmayr, A., Tang, L., Lan, Z., et al. (2015). Развитие кишечного микробиома по последовательности колоректальной аденомы-карциномы. Нац. Commun. 6: 6528. DOI: 10.1038 / ncomms7528
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррейра, Р. М., Перейра-Маркес, Дж., Пинто-Рибейро, И., Коста, Дж. Л., Карнейро, Ф., Мачадо, Дж. К. и др. (2018). Профилирование микробного сообщества желудка выявляет микробиоту, связанную с дисбиотическим раком. Кишечник 67, 226–236. DOI: 10.1136 / gutjnl-2017-314205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Франсуа, Ф., Ропер, Дж., Джозеф, Н., Пей, З., Чхада, А., Шак, Дж. Р. и др. (2011). Влияние эрадикации H. pylori на связанные с приемом пищи изменения в плазме грелина и лептина. БМЦ Гастроэнтерол. 11:37. DOI: 10.1186 / 1471-230X-11-37
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, Дж. Дж., Чжан, Ю., Герхард, М., Мехиас-Луке, Р., Чжан, Л., Вьет, М., и др. (2018). Связь между микробиотой кишечника и поражениями желудка, связанными с Helicobacter pylori , в популяции высокого риска рака желудка. Фронт. Клетка. Заразить. Microbiol. 8: 202. DOI: 10.3389 / fcimb.2018.00202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gotoda, T., Takano, C., Kusano, C., Suzuki, S., Ikehara, H., Hayakawa, S., et al. (2018). Микробиом кишечника можно восстановить без побочных эффектов после эрадикационной терапии Helicobacter pylori у подростков. Helicobacter 23: e12541. DOI: 10.1111 / hel.12541
PubMed Аннотация | CrossRef Полный текст | Google Scholar
He, C., Ян, З., и Лу, Н. (2016). Дисбаланс микробиоты желудочно-кишечного тракта в патогенезе заболеваний, ассоциированных с Helicobacter pylori . Helicobacter 21, 337–348. DOI: 10.1111 / hel.12297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Heimesaat, M. M., Fischer, A., Plickert, R., Wiedemann, T., Loddenkemper, C., Gobel, U. B., et al. (2014). Иммунопатология желудка, вызванная Helicobacter pylori, связана с отчетливыми изменениями микробиоты в толстом кишечнике длительно инфицированных монгольских песчанок . PLoS ONE 9: e100362. DOI: 10.1371 / journal.pone.0100362
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иино, К., Симояма, Т., Чинда, Д., Араи, Т., Чиба, Д., Накадзи, С. и др. (2018). Инфекция Helicobacter pylori и атрофический гастрит влияют на лактобациллы в кишечной микробиоте японского населения. Фронт. Иммунол. 9: 712. DOI: 10.3389 / fimmu.2018.00712
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иноуэ, И., Мукубаяси, К., Йошимура, Н., Нива, Т., Дегучи, Х., Ватанабе, М. и др. (2011). Повышенный риск колоректальной аденомы с хроническим гастритом, связанным с Helicobacter pylori : популяционное исследование случай-контроль. Внутр. J. Cancer 129, 2704–2711. DOI: 10.1002 / ijc.25931
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джексон, М.А., Гудрич, Дж. К., Максан, М. Е., Фридберг, Д. Э., Абрамс, Дж. А., Пул, А. С. и др. (2016). Ингибиторы протонной помпы изменяют состав микробиоты кишечника. Кишечник 65, 749–756. DOI: 10.1136 / gutjnl-2015-310861
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Н. Л., Колецко, С., Гудман, К., Бонтемс, П., Кадранель, С., Кассвалл, Т. и др. (2017). Совместное руководство ESPGHAN / NASPGHAN по лечению Helicobacter pylori у детей и подростков (обновление 2016 г.). J. Pediatr. Гастроэнтерол. Nutr. 64, 991–1003. DOI: 10.1097 / MPG.0000000000001594
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хосрави, Ю., Dieye, Y., Loke, M. F., Goh, K. L., and Vadivelu, J. (2014a). Streptococcus mitis вызывает преобразование Helicobacter pylori в кокковидные клетки во время совместного культивирования in vitro . PLoS ONE 9: e112214. DOI: 10.1371 / journal.pone.0112214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хосрави Ю., Дайе Ю., По, Б. Х., Нг, К. Г., Локе, М. Ф., Го, К. Л. и др. (2014b). Культивирование бактериальной микробиоты желудка Helicobacter pylori положительных и отрицательных пациентов с заболеваниями желудка. ScientificWorldJournal 2014: 610421. DOI: 10.1155 / 2014/610421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кинесбергер, С., Кокс, Л. М., Ливанос, А., Чжан, X. С., Чунг, Дж., Перес-Перес, Г. И. и др. (2016). Инфекция желудка Helicobacter pylori влияет на местные и отдаленные микробные популяции и реакцию хозяина. Cell Rep. 14, 1395–1407. DOI: 10.1016 / j.celrep.2016.01.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колецко, С., Джонс, Н. Л., Гудман, К. Дж., Голд, Б., Роуленд, М., Кадранель, С. и др. (2011). Основанные на фактах рекомендации ESPGHAN и NASPGHAN для инфекции Helicobacter pylori у детей. J. Pediatr. Гастроэнтерол. Nutr. 53, 230–243. DOI: 10.1097 / MPG.0b013e3182227e90
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Контурас Дж., Полизос С. А., Дулберис М., Зеглинас К., Артемаки Ф., Вардака Э. и др. (2018). Возможное влияние метаболического синдрома, связанного с Helicobacter pylori , на онкогенез верхних и нижних отделов желудочно-кишечного тракта. Метаболизм 87, 18–24. DOI: 10.1016 / j.metabol.2018.06.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кцоян З.А., Белобородова Н.В., Седракян А.М., Осипов Г.А., Хачатрян З.А., Келли Д. и др. (2010). Профили микробных жирных кислот в метаболоме человека зависят от заболевания. Фронт. Microbiol. 1: 148. DOI: 10.3389 / fmicb.2010.00148
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар, А., Ким, М., Лукин, Д. Дж. (2018). Helicobacter pylori ассоциируется с повышенным риском зубчатых полипов толстой кишки: анализ факторов риска зубчатых полипов. Indian J. Gastroenterol. 37, 235–242. DOI: 10.1007 / s12664-018-0855-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квон, Г., Ли, Дж., Кох, Дж. Х. и Лим, Ю. Х. (2018). Увеличение продолжительности жизни Caenorhabditis elegans за счет Butyricicoccus pullicaecorum и Megasphaera elsdenii с пробиотическим потенциалом. Curr. Microbiol. 75, 557–564. DOI: 10.1007 / s00284-017-1416-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лангиль, М. Г., Заневельд, Дж., Капорасо, Дж. Дж., Макдональд, Д., Найтс, Д., Рейес, Дж. А. и др. (2013). Прогнозирующее функциональное профилирование микробных сообществ с использованием последовательностей маркерного гена 16S рРНК. Нац. Biotechnol. 31, 814–821. DOI: 10.1038 / NBT.2676
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, С., Хуанг, X. L., Sui, J. Z., Chen, S. Y., Xie, Y. T., Deng, Y., et al. (2014). Метаанализ рандомизированных контролируемых исследований эффективности пробиотиков в эрадикационной терапии Helicobacter pylori у детей. евро. J. Pediatr. 173, 153–161. DOI: 10.1007 / s00431-013-2220-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, К., Ни, X., Ван, К., Пэн, З., Ниу, Л., Ван, Х. и др. (2017). Lactobacillus plantarum BSGP201683, выделенный из фекалий гигантской панды, ослаблял воспаление и улучшал микрофлору кишечника у мышей, зараженных энтеротоксигенным Escherichia coli . Фронт. Microbiol. 8: 1885. DOI: 10.3389 / fmicb.2017.01885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Льорка, Л., Перес-Перес, Г., Уррузуно, П., Мартинес, М. Дж., Иидзуми, Т., Гао, З. и др. (2017). Характеристика микробиоты желудка в педиатрической популяции в соответствии со статусом Helicobacter pylori . Педиатр. Заразить. Дис. J. 36, 173–178. DOI: 10.1097 / INF.0000000000001383
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мальдонадо-Контрерас, А., Гольдфарб, К. К., Годой-Виторино, Ф., Караоз, У., Контрерас, М., Блазер, М. Дж. И др. (2011). Структура бактериального сообщества желудка человека по отношению к статусу Helicobacter pylori . ISME J. 5, 574–579. DOI: 10.1038 / ismej.2010.149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мальфертхайнер П., Мегро Ф., О’Морайн К. А., Гисберт Дж. П., Койперс Э. Дж., Аксон А. Т. и др. (2017). Управление инфекцией Helicobacter pylori — Маастрихтский V / Флорентийский консенсусный отчет. Кишечник 66, 6–30. DOI: 10.1136 / gutjnl-2016-312288
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маршалл Б. Дж. И Уоррен Дж. Р. (1984). Неопознанные изогнутые бациллы в желудке больных гастритом и язвенной болезнью. Ланцет 1, 1311–1315. DOI: 10.1016 / s0140-6736 (84)
-6PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мазманян, С. К., Лю, К. Х., Цианабос, А. О., Каспер, Д. Л.(2005). Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина. Cell 122, 107–118. DOI: 10.1016 / j.cell.2005.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мак-Мерди, П. Дж., И Холмс, С. (2013). phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLoS ONE 8: e61217. DOI: 10.1371 / journal.pone.0061217
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миналян, А., Габриелян, Л., Скотт, Д., Джейкобс, Дж., И Писенья, Дж. Р. (2017). Микробиом желудка и кишечника: роль ингибиторов протонной помпы. Curr. Гастроэнтерол. Реп. 19:42. DOI: 10.1007 / s11894-017-0577-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мизуно, С., Морита, Ю., Инуи, Т., Асакава, А., Уэно, Н., Андо, Т. и др. (2005). Инфекция Helicobacter pylori связана с аденоматозными полипами толстой кишки, обнаруженными с помощью колоноскопии с высоким разрешением. Внутр. J. Cancer 117, 1058–1059. DOI: 10.1002 / ijc.21280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Myllyluoma, E., Ahlroos, T., Veijola, L., Rautelin, H., Tynkkynen, S., and Korpela, R. (2007). Влияние лечения анти- Helicobacter pylori и добавок пробиотиков на кишечную микробиоту. Внутр. J. Antimicrob. Агенты 29, 66–72. DOI: 10.1016 / j.ijantimicag.2006.08.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нардоне, Г., Сравните, Д., и Рокко, А. (2017). Микробиота-ориентированный взгляд на заболевания верхних отделов желудочно-кишечного тракта. Ланцет Гастроэнтерол. Гепатол. 2, 298–312. DOI: 10.1016 / S2468-1253 (16) 30108-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Насидзе, И., Ли, Дж., Куинк, Д., Танг, К., и Стоункинг, М. (2009). Глобальное разнообразие микробиома слюны человека. Genome Res. 19, 636–643. DOI: 10.1101 / gr.084616.108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Одерда, Г., Щербаков П., Бонтемс П., Уррузуно П., Романо К., Готтранд Ф. и др. (2007). Результаты Европейского педиатрического регистра для лечения Helicobacter pylori (PERTH). Helicobacter 12, 150–156. DOI: 10.1111 / j.1523-5378.2007.00485.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Окуда, М., Кикучи, С., Мабе, К., Осаки, Т., Камия, С., Фукуда, Ю. и др. (2017). Общенациональный обзор лечения Helicobacter pylori у детей и подростков в Японии. Педиатр. Int. 59, 57–61. DOI: 10.1111 / ped.13038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Райан, М. Л., Лусеро, Ю., Рабелло, М., Мамани, Н., Салинас, А. М., Пена, А., и др. (2015). Стойкие и преходящие инфекции Helicobacter pylori в раннем детстве. Clin. Заразить. Дис. 61, 211–218. DOI: 10.1093 / cid / civ256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Осаки, Т., Заман, К., Yonezawa, H., Lin, Y., Okuda, M., Nozaki, E., et al. (2018). Влияние аборигенной кишечной микробиоты на внутрисемейную инфекцию Helicobacter pylori в Японии. Фронт. Иммунол. 9: 287. DOI: 10.3389 / fimmu.2018.00287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Папастергю В., Каратапанис С. и Георгопулос С. Д. (2016). Helicobacter pylori и колоректальная неоплазия: есть ли причинная связь? Мир J.Гастроэнтерол. 22, 649–658. DOI: 10.3748 / wjg.v22.i2.649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Риццато К., Торрес Дж., Касамацу Э., Каморлинга-Понсе М., Браво М. М., Канциан Ф. и др. (2019). Потенциальная роль образования биопленок в развитии рака пищеварительного тракта с особым акцентом на инфекцию Helicobacter pylori . Фронт. Microbiol. 10: 846. DOI: 10.3389 / fmicb.2019.00846
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саад, М.Дж., Сантос А. и Прада П. О. (2016). Связь микробиоты кишечника и воспаления с ожирением и инсулинорезистентностью. Физиология 31, 283–293. DOI: 10.1152 / Physiol.00041.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Салас-Хара, М. Дж., Сануэса, Э. А., Ретамаль-Диас, А., Гонсалес, К., Уррутия, Х., и Гарсия, А. (2016). Пробиотик Lactobacillus fermentum Формирование биопленки UCO-979C на клетках AGS и Caco-2 и ингибирование Helicobacter pylori . Биообрастание 32, 1245–1257. DOI: 10.1080 / 084.2016.1249367
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шульц К., Кох Н., Шютте К., Пипер Д. Х. и Малфертхайнер П. Х. (2015). Pylori и его модуляция микробиоты желудочно-кишечного тракта. J. Dig. Дис. 16, 109–117. DOI: 10.1111 / 1751-2980.12233
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скуг, Э. К., Линдберг, М., и Линден, С. К.(2011). Штамм-зависимая пролиферация в ответ на муцин желудка человека и адгезионные свойства Helicobacter pylori не зависят от совместно изолированного Lactobacillus sp. Helicobacter 16, 9–19. DOI: 10.1111 / j.1523-5378.2010.00810.x
CrossRef Полный текст | Google Scholar
Sugano, K., Tack, J., Kuipers, E.J., Graham, D.Y., El-Omar, E.M., Miura, S., et al. (2015). Киотский глобальный консенсусный отчет по гастриту Helicobacter pylori . Кишечник 64, 1353–1367.DOI: 10.1136 / gutjnl-2015-309252
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаевска Х., Хорват А. и Пивоварчик А. (2010). Мета-анализ: влияние добавки Saccharomyces boulardii на частоту эрадикации Helicobacter pylori и побочные эффекты во время лечения. Алимент. Pharmacol. Ther. 32, 1069–1079. DOI: 10.1111 / j.1365-2036.2010.04457.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такашима, М., Фурута, Т., Ханаи, Х., Сугимура, Х. и Канеко, Э. (2001). Влияние инфекции Helicobacter pylori на секрецию желудочного сока и уровни гастрина в сыворотке крови у монгольских песчанок . Кишечник 48, 765–773. DOI: 10.1136 / gut.48.6.765
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такеока А., Тайама Дж., Ямасаки Х., Кобаяши М., Огава С., Сайго Т. и др. (2016). Влияние уровней иммуноглобулина G Helicobacter pylori и статуса атрофического гастрита на риск метаболического синдрома. PLoS ONE 11: e0166588. DOI: 10.1371 / journal.pone.0166588
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Г., Ромеро-Галло Дж., Бенуа С. Л., Пиазуэло М. Б., Домингес Р. Л., Морган Д. Р. и др. (2016). Метаболизм водорода в Helicobacter pylori играет роль в канцерогенезе желудка, облегчая транслокацию CagA. мБио 7: e1022-16. DOI: 10.1128 / mBio.01022-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Х., Zhang, L., Wang, Y., Liu, X., Zhang, H., Liu, Y., et al. (2018). Дисбактериоз кишечной микробиоты связан с пурпурой Шенлейна-Геноха у детей. Внутр. Иммунофармакол. 58, 1–8. DOI: 10.1016 / j.intimp.2018.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Ю., Го, Ю., Чен, Х., Вэй, Х., и Ван, К. (2018). Потенциал Lactobacillus plantarum ZDY2013 и Bifidobacterium bifidum WBIN03 в облегчении колита, вызванного кишечной микробиотой, иммунным и антиоксидантным стрессом. Банка. J. Microbiol. 64, 327–337. DOI: 10.1139 / cjm-2017-0716
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Век, М. Н., Гао, Л., и Бреннер, Х. (2009). Инфекция Helicobacter pylori и хронический атрофический гастрит: ассоциации в зависимости от тяжести заболевания. Эпидемиология 20, 569–574. DOI: 10.1097 / EDE.0b013e3181a3d5f4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вейерманн, М., Ротенбахер, Д., и Бреннер, Х. (2009). Приобретение инфекции Helicobacter pylori в раннем детстве: независимый вклад инфицированных матерей, отцов, братьев и сестер. г. J. Gastroenterol. 104, 182–189. DOI: 10.1038 / ajg.2008.61
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюнь, В., Ши, Л., Чжоу, Х., Хоу, Г., Цао, Т., и Чжао, К. (2015). Влияние куркумина на показатели роста, целостность слизистой оболочки тощей кишки, морфологию и иммунный статус поросят-отъемышей, зараженных энтеротоксигенным Escherichia coli . Внутр. Иммунофармакол. 27, 46–52. DOI: 10.1016 / j.intimp.2015.04.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян, Ю. Дж., И Шеу, Б. С. (2012). Йогурты, содержащие пробиотики, подавляют нагрузку Helicobacter pylori и изменяют иммунный ответ и кишечную микробиоту у детей, инфицированных Helicobacter pylori . Helicobacter 17, 297–304. DOI: 10.1111 / j.1523-5378.2012.00941.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заман, С., Осаки, Т., Ханава, Т., Ёнэдзава, Х., Курата, С., и Камия, С. (2014). Анализ микробной экологии между Helicobacter pylori и микробиотой желудка монгольских песчанок . J. Med. Microbiol. 63, 129–137. DOI: 10.1099 / jmm.0.061135-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу В., Линь К., Ли К., Дэн Х. и Ли К. (2018). Изменение состава фекальной кишечной микробиоты за счет приема высокомолекулярного танина хурмы у крыс с нормальным и высоким содержанием холестерина. Food Funct. 9, 541–551. DOI: 10.1039 / c7fo00995j
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зитомерский, Н. Л., Аткинсон, Б. Дж., Франклин, С. В., Митчелл, П. Д., Снаппер, С. Б., Комсток, Л. Е. и др. (2013). Характеристика адгезивных бактерий в биоптатах кишечника у детей и молодых людей с воспалительным заболеванием кишечника. PLoS ONE 8: e63686. DOI: 10.1371 / journal.pone.0063686
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аномалии толстой кишки у детей Manitoban с гастритом Helicobacter pylori
Цели .Связь между Helicobacter pylori (H. pylori) и патологией толстой кишки еще недостаточно изучена. Целью данной работы было изучить распространенность и характер изменений толстой кишки у детей с диагнозом гастрит H. pylori . Методы . Был проведен комплексный ретроспективный обзор медицинских карт всех детей Manitoban (≤17 лет) с диагнозом гастрита H. pylori с января 1996 года по май 2015 года. Выявлены дети с гастритом H. pylori , которым была проведена колоноскопия.Были задокументированы демографические данные пациентов, показания к колоноскопии, лабораторные и эндоскопические данные, а также гистопатологические аномалии толстой кишки. Результаты . Всего у 231 ребенка было выявлено H. pylori гастритов. Средний возраст постановки диагноза составлял 12,3 ± 4,1 года; 108 (46,6%) — девушки. Из 231 пациента 37 (16%) пациенту была выполнена колоноскопия. Показания к колоноскопии включали кровотечение из прямой кишки, значительную потерю веса и гипоальбуминемию.Двадцать два (59%) из 37 детей, которым была сделана колоноскопия, имели значительные эндоскопические и гистопатологические данные при колоноскопии, включая полипоз и колит. Мальчики с изменениями толстой кишки были диагностированы в более раннем возрасте по сравнению с мальчиками без них (11,5 ± 7,0 против 15,0 ± 2,0). Выводы . Наше исследование может предложить возможную связь между H. pylori и некоторыми изменениями толстой кишки у детей.
1. Введение
Helicobacter pylori (H. pylori) — одна из самых распространенных бактериальных инфекций во всем мире.Примерно половина населения мира страдает H. pylori гастритом. Распространенность H. pylori не всегда постоянна. Вариабельность может быть объяснена возрастом пациента, этническим происхождением и социально-экономическим статусом [1]. Инфекция более распространена и приобретается в более молодом возрасте в развивающихся странах по сравнению с промышленно развитыми странами [2]. Распространенность среди взрослого населения Канады составляет 20–30% [3] и 7,1% среди канадских детей [4]. H.pylori в педиатрической популяции Канады чаще встречается у аборигенов и иммигрантов в первом поколении [5]. В общине коренных народов Васагамак, Манитоба, распространенность среди детей в возрасте от 6 месяцев до 12 лет составила 67% [6].
Патофизиология инфекции — это разнообразное динамическое взаимодействие между хозяином и патогеном. Длительное инфицирование этим возбудителем стимулирует хроническое воспаление слизистой оболочки желудка. Хроническое воспаление в сочетании с измененной секрецией желудка и повреждением тканей может привести к хроническому гастриту и язвам и в конечном итоге, если его не лечить, может привести к раку желудка и лимфоме MALT.Возбудитель также сильно связан с язвой двенадцатиперстной кишки. Инфекция H. pylori может быть связана с экстрагастроинтестинальной (ЖКТ) патологией, включая сердечно-сосудистые заболевания, сахарный диабет, рак легких, гепатобилиарные заболевания и неврологические расстройства, такие как болезнь Альцгеймера у взрослых [7]. Инфекция была связана с внегастроинтестинальными проявлениями сидеробластной анемии и хронической идиопатической тромбоцитопенической пурпуры в педиатрической популяции [8].
Хотя большинство детей, у которых H.pylori протекает бессимптомно, инфекция сохраняется на всю жизнь, если не будет назначен режим лечения. У детей с симптомами заболевания могут наблюдаться неспецифические признаки, такие как постпрандиальная боль в эпигастрии, ночное пробуждение, необъяснимая тошнота и / или рвота, анорексия, гематемезис и железодефицитная анемия [8]. Также были установлены связи между патогеном и препятствиями роста [9].
Недавно мы случайно заметили значительные изменения толстой кишки у нескольких детей с H.pylori гастрит. Несмотря на то, что существует несколько исследований, в которых изучается корреляция между H. pylori и изменениями толстой кишки у взрослых [10–19], исследований в педиатрической популяции мало. Целью этого исследования было определить распространенность изменений толстой кишки у детей с H. pylori и охарактеризовать обнаруженные изменения толстой кишки.
2. Материалы и методы
Подробный ретроспективный обзор карт был проведен для всех детей (возраст ≤ 17 лет) с диагнозом H.pylori гастрита с января 1996 года по май 2015 года в Детской больнице, Виннипег, Манитоба, Канада. Демографические данные пациентов были получены из баз данных патологии и детской гастроэнтерологии.
Пациенты считались больными H. pylori гастритом, если у них было одно или несколько из следующих признаков: (1) Положительный результат гистопатологии для H. pylori (2) Положительный тест на Campylobacter -подобных организмов (CLO) при биопсии желудка (3) Положительный результат посева биопсии желудка на H.pylori (4) Положительный дыхательный тест на мочевину для H. pylori
Был выполнен поисковый запрос в Системе лабораторной информации Департамента патологии, чтобы определить, кто из пациентов с H. pylori прошел илеоколоноскопию в сочетании с гастроскопией. на момент диагноз H. pylori . Были задокументированы результаты гастроскопии и илеоколоноскопии. Участки биопсии включали нижний отдел пищевода, тело желудка, антральный отдел желудка, луковицу двенадцатиперстной кишки, вторую часть двенадцатиперстной кишки и тело желудка, а также пищевод.Образцы биопсии при илеоколоноскопии получали из терминальной части подвздошной кишки, слепой кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки, сигмовидной кишки и прямой кишки. Были получены по два образца биопсии с каждого участка, а также при гастроскопии и колоноскопии. Образцы биопсии были обработаны и исследованы в соответствии с общим протоколом для образцов желудочно-кишечного тракта, включая стандартное окрашивание гематоксилином и эозином (H&E). Кроме того, было выполнено обязательное окрашивание с использованием окрашивания Вартина-Старри для всех образцов из антрального отдела желудка.
2.1. Критерии включения
В исследование были включены все дети в возрасте 17 лет и младше с подтвержденным гастритом H. pylori , соответствующие вышеуказанному определению и которым была проведена илеоколоноскопия по любой причине в течение периода исследования.
Пациенты были исключены, если они были старше 17 лет или имели гастрит, вызванный не H. pylori.
Подробная информация о пациенте, включая симптомы, лабораторные данные, методы диагностики, патологические данные, лечение и результаты лечения, были задокументированы.Была собрана информация, относящаяся к процентилю роста пациента, процентиля веса и процентиля ИМТ на момент постановки диагноза. Были задокументированы любые сопутствующие хронические сопутствующие заболевания или другие лекарства, которые пациенты принимали во время постановки диагноза. Кроме того, был зарегистрирован семейный анамнез любых заболеваний ЖКТ, включая инфекцию H. pylori . Лабораторные данные, включая гемоглобин, скорость оседания эритроцитов (СОЭ), С-реактивный белок (СРБ), альбумин, общую железосвязывающую способность (TIBC), сывороточный ферритин и уровни железа, были задокументированы во время постановки диагноза.Следующие определения лабораторных значений, как это определено диагностическими службами Манитобы, использовались для классификации лабораторных значений как нормальных и аномальных: (1) Низкий гемоглобин: гемоглобин менее 115 г / л, если возраст ≤ 10 лет; гемоглобин менее 120 г / л в возрасте старше 10 лет (2) Высокий СОЭ: значения СОЭ более 15 мм / ч (3) Высокий СРБ: СРБ более 8 мг / л (4) Гипоальбуминемия: альбумин менее 35 г / л, если возраст ≤ 10 лет; альбумин менее 33 г / л, если возраст> 10 лет (5) Высокий TIBC: TIBC> 80% (6) Дефицит железа: ферритин менее 20 μ г / л (7) Низкий уровень железа: сывороточное железо менее 7 мкм моль / л
2.2. Этика
Предложение исследования было одобрено Советом по этике медицинских исследований Университета Манитобы.
2.3. Статистика
Все данные были записаны в файл Excel и импортированы в STATA версии 13 (StataCorp LP, College Station, Texas, USA) для статистического анализа. Были рассчитаны непрерывные переменные, такие как возраст, среднее значение, медиана и стандартное отклонение у пациентов с H. pylori . Для категориальных данных были рассчитаны частоты и проценты. Распространенность изменений толстой кишки у пациентов с H.pylori .
Двусторонний тест Стьюдента t проводился для непрерывных переменных, таких как возраст. Точный тест Фишера был проведен для дихотомических переменных, таких как пол и этническая принадлежность. Значение p считалось значимым, если <0,05.
3. Результаты
С января 1996 г. по май 2015 г. было рассмотрено около 2100 отчетов о патологии педиатрических эндоскопий верхних отделов желудка. При микроскопическом исследовании образцов биопсии, взятых из антрального отдела желудка, было обнаружено, что у 231 пациента был гастрит H. pylori . .Из них 108 (46,6%) пациентов составляли женщины. Средний возраст постановки диагноза гастрита H. pylori составил 12,3 ± 4,1 года. Средний возраст постановки диагноза для женщин составлял 12,5 ± 4,2 года и 12,2 ± 4,0 года ().
Этническое происхождение было зарегистрировано у 105 из 231 пациента с H. pylori . 43,3% людей с H. pylori не были белыми, а 2,1% — белыми. Сводная демография пациентов представлена в таблице 1.
| ||||||||||||||||||||||||||
Из 231 пациента у 37 пациентов была обнаружена илеоколоноскопия выполняется с помощью верхней эндоскопии по следующим показаниям: (1) Сильная боль в животе (2) Ректальное кровотечение (3) Диарея неизвестного происхождения (4) Анемия (5) Гипоальбуминемия (6) Патологические исследования изображений, такие как исследования бария
3.1. Изменения толстой кишки
Двадцать два (9,5%) пациента имели ненормальные гистопатологические данные в образцах биопсии при колоноскопии. Средний возраст постановки диагноза у пациентов с изменениями толстой кишки составляет 12,1 ± 3,9 года. 8 (36,4%) пациентов были женского пола, средний возраст 14,5 ± 1,4 года. Четырнадцать (63,6%) пациентов были мужчинами, средний возраст 10,8 ± 4,3 года (таблица 2). Тест Стьюдента t для сравнения возраста по полу у лиц с изменениями толстой кишки показывает, что мужчины с изменениями толстой кишки были диагностированы в значительно более раннем возрасте, чем женщины с ().Не было обнаружено значительных различий в демографических характеристиках между теми, у кого были изменения толстой кишки, и теми, у кого не было изменений толстой кишки (Таблица 2). Состояния, диагностированные до эндоскопии для H. pylori в этой группе, включали целиакию, воспалительное заболевание кишечника (ВЗК) и положительный ген FAP. В таблице 3 обобщены симптомы и лабораторные данные для всех участников с изменениями толстой кишки.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Общие признаки толстой кишки включали неспецифическое воспаление толстой кишки и колит (Таблица 4). Было несколько пациентов с уникальными находками. У одного пациента был обнаружен некротический гастрит (рис. 1 (а)) и острый колит (рис. 1 (б)). Этот пациент лечился тройной терапией пероральными анти- H. pylori (амоксициллин и метронидазол в течение 2 недель и омепразол в течение 1 месяца) со значительным улучшением его клинического состояния и лабораторных показателей с нормализацией его гемоглобина и сывороточного альбумина.Шесть месяцев спустя ему сделали повторную гастроскопию и колоноскопию с полностью нормальными биопсиями.
| |||||||||||||||||||||||||||||||||||||||||||||||||||
У другого пациента обнаружено H .pylori (рис. 2 (a)) и ювенильный полипоз толстой кишки (рис. 2 (b) –2 (e)) и считался синдромом Кронкхита-Канада, но не был подтвержден генетической оценкой. Ему была назначена тройная пероральная терапия анти- H. pylori (амоксициллин и метронидазол в течение 2 недель и омепразол в течение 1 месяца). Повторная эндоскопия и колоноскопия с биопсией через 6 месяцев подтвердила эрадикацию гастрита H. pylori , но наличие полипов толстой кишки; многие из них были удалены эндоскопически и показали гамартоматозные изменения в гистопатологии.Он и его родители прошли дальнейшее обширное генетическое обследование, которое не выявило его основного состояния.
У пяти из 22 пациентов также была обнаружена сопутствующая ВЗК. Они хорошо ответили на пероральную тройную терапию анти- H. pylori с успешной эрадикацией, что было подтверждено при контрольной эндоскопии.
3.2. Отсутствие изменений в толстой кишке
У пятнадцати пациентов не было значительных аномалий толстой кишки. Средний возраст этих пациентов составил 11,9 ± 5,1 года. Восемь (53,3%) пациентов были женщинами, средний возраст на момент постановки диагноза составлял 10 лет.0 ± 6,0 года. Семь (46,7%) пациентов были мужчинами, средний возраст 14,1 ± 2,9 года. Двусторонний тест Стьюдента t для сравнения возраста по полу у лиц без изменений толстой кишки не имел значимого значения (). Демографические данные для этой группы можно найти в таблице 2. В таблице 3 обобщены симптомы и лабораторные данные в этой группе. Сопутствующие заболевания включали васкулит, астму и рак поджелудочной железы. Изученные переменные приведены в таблицах 2 и 3.
4.Обсуждение
Было проведено несколько исследований взрослого населения с H. pylori гастритом и связанными с ним изменениями толстой кишки, но в настоящее время доступно очень мало исследований для педиатрической популяции [11–15]. Наше исследование является новым, поскольку нашей основной целью было определить распространенность изменений толстой кишки у педиатрических пациентов с гастритом H. pylori и изучить демографические характеристики этой популяции.
Мы идентифицировали 231 педиатрического пациента с инфекциями H.pylori , из которых у 22 (9,5%) обнаружены гистопатологические изменения толстой кишки. Между группами детей с гастритом H. pylori с изменениями толстой кишки и детьми без изменений толстой кишки, дети с изменениями толстой кишки были диагностированы в более раннем возрасте, чем дети без изменений толстой кишки. Хотя мы не обнаружили значительных различий между симптомами в этих двух группах, эти дети с изменениями толстой кишки могли быть обнаружены раньше из-за тяжести их симптомов или ранее существовавшего заболевания кишечника, требующего направления к специалисту по ЖКТ.И наоборот, у женщин без изменений толстой кишки диагностировали H. pylori в более раннем возрасте, чем у женщин с присутствующими изменениями толстой кишки. В Канаде хорошо известно, что аборигены и недавние иммигранты подвергаются большему риску заражения H. pylori [5] . Такие факторы, как надлежащая санитария и повышенное воздействие через контакт с эндемичными регионами, вероятно, способствуют повышенному риску. Мы определили, что 50% людей с изменениями толстой кишки — аборигены.Собранные данные показывают более высокую долю небелых людей с H. pylori с изменениями толстой кишки, чем у лиц без изменений толстой кишки. Однако не было обнаружено значительных различий в распределении этнической принадлежности в группах с изменением толстой кишки и отсутствием изменений толстой кишки. Эти данные свидетельствуют о том, что, хотя аборигены и иммигранты в первом поколении подвергаются большему риску заражения H. pylori , нет повышенного риска при наличии H. pylori и изменений толстой кишки в этих этнических группах.
Наиболее частыми симптомами, наблюдаемыми у людей с изменениями толстой кишки и без изменений толстой кишки, были боль в животе, анемия и потеря веса. В частности, боль в животе наблюдалась у 54,5% пациентов с изменениями толстой кишки и у 20% пациентов без изменений толстой кишки. Однако не было существенной разницы в этих пропорциях между пациентами с изменениями толстой кишки и без изменений толстой кишки. Это означает, что симптомы H. pylori , как правило, не имеют иной картины у пациентов с изменениями в толстой кишке и без изменений в толстой кишке.
H. pylori Колонизация слизистой оболочки желудка практически всегда связана с гастритом преимущественно хроническими воспалительными клеточными инфильтратами у детей [20]. Среди пациентов с H. pylori и изменениями толстой кишки у 21 пациента был хронический активный гастрит с присутствием H. pylori . Было обнаружено, что большинство изменений толстой кишки являются неспецифическим воспалением. Эти данные указывают на то, что инфекция H. pylori может оказывать некоторое влияние на воспаление в толстой кишке.Патологические последствия H. pylori обычно соответствуют хронологическому порядку гастрита, язвы желудка и двенадцатиперстной кишки и лимфомы желудка [21]. Лимфомы желудка у детей встречаются редко [1]. Учитывая результаты этого исследования, важно учитывать, является ли воспаление толстой кишки частью этих патологических последствий, особенно в педиатрической популяции.
У одного пациента с сильной болью в животе и кровотечением из прямой кишки был гастрит H. pylori и ювенильный полипоз толстой кишки, и предполагалось, что у него синдром Кронкхита-Канады (CCS), но не был подтвержден генетической оценкой.Связь между полипами толстой кишки и H. pylori не была полностью согласована в научном сообществе. В одном исследовании у трех пациентов с H. pylori исчез полипоз колпачка после эрадикации H. pylori [10]. Также была показана связь между H. pylori и тубуловиллярными аденомами и аденокарциномами [12]. Однако есть исследования, которые не показывают взаимосвязи между инфекцией и колоректальным раком или полипозом колпачка [13, 18].Этот пациент был дополнительно обследован на CCS. CCS — редкое негенетическое заболевание с высокой смертностью. Заболевание проявляется характерной диареей, болями в животе, алопецией, гиперпигментацией кожи и диффузным полипозом по всей толстой кишке. Был зарегистрирован как минимум один задокументированный случай CCS, который был излечен с помощью терапии H. pylori [22]. Хотя у нашего пациента не было полного разрешения полипоза толстой кишки после эрадикации H. pylori , у пациента было меньше полипов толстой кишки при последующих колоноскопиях, а также уменьшилась боль в животе и кровотечение из прямой кишки.На сегодняшний день во всем мире зарегистрировано 450 случаев заболевания CSS [23]. Оценка возможной ассоциации CCS и H. pylori имеет большое значение, как подчеркнули Kato et al. [22].
Наше исследование выявило 5 из 22 пациентов, у которых была сопутствующая ВЗК в сочетании с инфекцией H. pylori . Связь между IBD и H. pylori вызывает разногласия с разными выводами. В одном из таких исследований Oliveira et al. изолировали и культивировали H. pylori из кишечника и слизистой оболочки кишечника взрослых пациентов с болезнью Крона [17].Исследование Sladek et al. показал, что распространенность H. pylori ниже у педиатрических пациентов с ВЗК по сравнению с пациентами без ВЗК [24]. Дополнительная полярность очевидна в метаанализе и систематическом обзоре литературы, указывающих на защитное действие H. pylori против развития ВЗК [14], что привело к выводу о предполагаемой обратной связи между H. pylori и IBD. Обратная связь также была постулирована и продемонстрирована в исследовании Sonnenberg et al.между H. pylori гастритом и микроскопическим колитом, разновидностью ВЗК. В настоящее время неясно, соответствуют ли наши данные этим аргументам. Необходимы дальнейшие исследования и исследования для изучения взаимосвязи ВЗК и H. pylori у педиатрических пациентов.
Наше исследование является новым, но имеет несколько ограничений. Исследование ограничено ретроспективным дизайном и небольшим размером выборки для тех, кто прошел колоноскопию. Главный вопрос будет заключаться в том, являются ли наши выводы простой ассоциацией, а не причинно-следственной связью.[25]
Для дальнейшего изучения взаимосвязи между H. pylori и воспалением толстой кишки в будущем потребуются более крупные многоцентровые исследования, изучающие распространенность H. pylori и воспаление толстой кишки. Кроме того, представляют интерес будущие исследования факторов хозяина и факторов окружающей среды, предрасполагающих к инфицированию H. pylori и воспалению толстой кишки. Исследования, касающиеся воспаления толстой кишки и его распространенности у взрослых с H.pylori позволит провести сравнение с педиатрической популяцией. Когортное исследование пациентов с воспалением толстой кишки и H. pylori может помочь определить, есть ли какие-либо изменения в течении болезни у этих конкретных людей.
5. Выводы
У значительного числа педиатрических пациентов с гастритом H. pylori в Манитобе имелись патологии толстой кишки. Аборигенное население и иммигранты в первом поколении не подвергаются повышенному риску изменений толстой кишки в сочетании с H.пилори. Наше исследование подчеркивает возможную связь между гастритом H. pylori и изменениями толстой кишки у детей и требует правильно спланированных проспективных исследований для подтверждения наших результатов.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Выражение признательности
Доктор Ваэль Эль-Матари получил грант от Исследовательского института детской больницы Манитобы и Фонда детской больницы.
Коллагеновый гастрит: морфологическое и иммуногистохимическое исследование с участием 40 пациентов
Из-за редкости коллагенозного гастрита исследователям трудно оценить большую группу пациентов.Настоящая работа стала результатом сотрудничества между пятью учреждениями и включала в себя значительный объем консультаций из внешних больниц, что позволило нам проанализировать большую когорту. Это позволило нам оценить гистологический спектр коллагенового гастрита. Биопсии, полученные от всех пациентов, имеют характерные признаки субэпителиального отложения коллагена и воспаления в собственной пластинке. Однако существует заметная неоднородность ассоциированного воспалительного процесса. Коллагеновый гастрит возникает в трех различных воспалительных средах: паттерн, подобный лимфоцитарному гастриту, паттерн, богатый эозинофилами, и паттерн атрофического гастрита.Чтобы определить паттерн, подобный лимфоцитарному гастриту, мы применили те же критерии, которые определяют лимфоцитарный гастрит, обычно указываемый как минимум 25 интраэпителиальных лимфоцитов на поле с высоким увеличением. 24 Вне коллагенового гастрита лимфоцитарный гастрит часто ассоциировался с глютеновой спру, инфекцией H. pylori и, реже, с болезнью Крона, сифилисом и болезнью Менетрие. 24 Только у одного пациента в нашем исследовании был одновременный коллагеновый гастрит и H.pylori , и у этого пациента не было значительного увеличения интраэпителиальных лимфоцитов. У двух пациентов с воспалительным паттерном, похожим на лимфоцитарный гастрит, была глютеновая болезнь, у одного — коллагеновый литник в двенадцатиперстной кишке, а у остальных двух — увеличение интраэпителиальных лимфоцитов в двенадцатиперстной кишке. Это гистологическое открытие повышает вероятность того, что у последних двух пациентов может быть латентная форма чревного спру. Предыдущие сообщения о случаях коллагенового гастрита отмечали воспалительный паттерн, подобный лимфоцитарному гастриту, и отмечали связь с глютеновым спру. 4, 5 В предыдущем отчете Леунг и др. 17 отметили, что у 4 из 12 их пациентов был лимфоцитарный гастрит, у двоих из которых была сопутствующая целиакия или коллагеновый колит.
При определении паттерна коллагенового гастрита, богатого эозинофилами, мы использовали аналогичный порог (> 30 эозинофилов на поле высокого увеличения × 400), который использовался для определения гистологического эозинофильного гастрита. 23 Коллагеновый гастрит является частью дифференциального диагноза для гистологического обнаружения эозинофильного гастрита, и эозинофилия должна побудить к тщательному поиску субэпителиального коллагена.Кажется, есть тенденция к увеличению эозинофилов у более молодых пациентов, но важно подчеркнуть, что все пациенты с коллагеновым гастритом, которые мы наблюдали, имеют, по крайней мере, незначительную степень эозинофильного воспаления. Примечательно, что у 3 из 12 пациентов (25%) в группе Леунга были отмечены «выдающиеся» эозинофилы, и в их число вошли два из трех педиатрических пациентов в группе, преимущественно взрослой. Имеются также сообщения о коллагенозном гастрите у подростков и молодых людей, в которых особо отмечается выраженная эозинофилия собственной пластинки и повышается вероятность того, что отложение коллагена может быть связано с иммунным механизмом, связанным с тканевой эозинофилией. 14, 25
Атрофический паттерн — относительно необычный, но очень характерный паттерн в нашей серии. Атрофический паттерн характеризуется атрофией кислородной слизистой оболочки с заметным сокращением специализированных клеток, выстилающих кислородные железы (включая париетальные и главные клетки), метаплазией привратника и расширением гиперпластических гладких мышц в собственной пластинке. Распознавание места биопсии в теле тела очень важно для идентификации этого паттерна, который гистологически может быть ошибочно принят за биопсию антрального или пилорического отдела.Отрицательное иммуногистохимическое окрашивание гастрина полезно для подтверждения местоположения биопсии тела и поддержки интерпретации атрофии H&E. Атрофический паттерн имеет некоторое сходство с атрофическим паттерном слизистой оболочки тела, наблюдаемым при аутоиммунном гастрите. Кроме того, у двух из этих пациентов с «атрофическим» коллагенозным гастритом также была обнаружена кишечная метаплазия. Отсутствие кишечной метаплазии у других пациентов может быть частично связано с относительно коротким периодом наблюдения. Атрофический паттерн не был хорошо установленным воспалительным паттерном в предыдущих исследованиях.Leung et al. 17 не выявили атрофии у своих пациентов, несмотря на систематическую оценку этого признака. 12-летнее наблюдение, проведенное Коллетти и Трейнером в 1989 г., отметило умеренную атрофию желез. 2 Однако, хотя они отметили гиперплазию эндокринных клеток, в нашей серии этого не было.
Клинически мы можем подтвердить преобладание женских заболеваний и значительное количество проявлений у подростков и молодых людей.Когорта, которую мы представляем здесь, имеет систематическую ошибку отбора в пользу педиатрических пациентов из-за включения педиатрической больницы и значительного количества педиатрических консультаций, которые были рассмотрены для соответствующего исследования. Клинически наиболее частыми симптомами были симптоматическая анемия и боль в животе. Причина этих симптомов до конца не изучена, но некоторые авторы предполагают, что анемия возникает из-за кровотечения из поверхностных расширенных капилляров, захваченных коллагеном. 6, 16 В H.pylori , что патогенез диспепсии может быть связан с хроническим воспалением. 26 Остается неясным, вызывает ли диспепсию коллагенового гастрита воспалительный или другой механизм. Классическая узловая эндоскопическая картина была довольно распространенной в этой когорте. Наше открытие преобладающего заболевания антрального отдела у взрослых и преобладающего заболевания тела у детей интересно и может быть полезным моментом для эндоскопистов при проведении взятия проб. Поскольку значительная часть пациентов имеет коллаген только в антральном отделе или теле (более 25% в этом исследовании), эндоскописты должны взять пробы в обоих местах с учетом диагноза.
Долгосрочный исход коллагенозного гастрита остается неопределенным. Наша серия показывает, что гистологически этот процесс сохраняется в течение многих лет у большинства пациентов. Хотя у нас было неполное наблюдение, отсутствие коллагена при заключительной контрольной биопсии у пяти пациентов, в том числе у одного с подтвержденным исчезновением симптомов, указывает на то, что болезнь иногда полностью проходит. Учитывая неоднородный характер распределения коллагена в образцах биопсии, следует отметить, что отсутствие коллагена при последующих биопсиях может быть связано с ошибкой выборки, а не с фактическим разрешением болезни.
Этиология коллагенового гастрита остается неясной, а патофизиология плохо изучена. Мы исследовали два возможных механизма, связанных с эотаксином и IgG4. Эотаксин ранее был вовлечен в патогенез эозинофильного эзофагита. 19, 27 Фиброз с субэпителиальным отложением коллагена также является признаком эозинофильного эзофагита. 28 Выраженная эозинофилия собственной пластинки во многих биопсиях наших пациентов была дополнительным основанием для тестирования ткани на эотаксин.Отсутствие заметно усиленного окрашивания эотаксином означает, что мы не можем причастить повышенные уровни эотаксина к патогенезу коллагенового гастрита. Однако наши результаты ограничены чувствительностью используемого нами метода. Иммуногистохимия может обнаружить только очень повышенные уровни эотаксина, как в случае с контрольными воспалительными полипами носа, которые мы использовали. Однако в некоторых исследованиях эозинофильного эзофагита применялся более чувствительный количественный протокол ПЦР в реальном времени для обнаружения повышенных уровней эотаксина в тканях. 19 Этот тип исследования потребуется, прежде чем можно будет полностью исключить роль эотаксина.
Заболевания, связанные с IgG4, были недавно обнаружены в ряде воспалительных состояний, затрагивающих многие участки тела. 20 Прототипное заболевание, связанное с IgG4, аутоиммунный панкреатит, включает сториформный фиброз в качестве определяющего гистологического признака. Другие связанные с IgG4 заболевания, такие как забрюшинный фиброз и тиреоидит Риделя, связаны со значительным отложением коллагена.Сообщенные желудочные проявления IgG4-связанного заболевания включают диффузное увеличение IgG4-положительных плазматических клеток с хроническими язвами или без них, без ассоциированного субэпителиального коллагена. 29, 30, 31, 32 Мы идентифицировали значительное количество IgG4-положительных плазматических клеток (100 клеток на HPF; соотношение IgG4 / IgG 55%) в 1 биопсии из 23 протестированных. Хотя биопсия этого пациента превысила соотношение IgG4 / IgG на 50%, что, по имеющимся данным, свидетельствует о заболевании, связанном с IgG4, 20 , мы сочли, что это открытие было слишком редким, чтобы вовлекать IgG4 в патогенез коллагенозного гастрита.Кроме того, мы не выявили в анамнезе системных заболеваний, связанных с IgG4, ни у этого, ни у любого другого пациента.
Иммуногистохимия тенасцина была предложена в качестве полезного вспомогательного теста для подтверждения гистологического диагноза коллагенового колита с чувствительностью выше, чем при окрашивании H&E и трихромом. 21 Однако до этого исследования экспрессия тенасцина при коллагенозном гастрите не оценивалась. Окрашивание тенасцином подтвердило присутствие субэпителиального коллагена во всех исследованных нами биоптатах.Две биопсии, в которых мы определили субэпителиальное окрашивание тенасцином в областях, где коллаген был незаметен на H&E (например, рис. 5), повышают вероятность того, что тенасцин может играть роль в обнаружении случаев коллагенозного гастрита, которые слишком малозаметны для выявления только с помощью гистохимических красителей. хотя для подтверждения гипотезы о том, что тенасцин является более чувствительным маркером, чем трихром, в этих условиях потребуются дальнейшие исследования. Учитывая неоднородное распределение коллагена и тонкую коллагеновую полоску в некоторых биопсиях, возможность использования окрашивания тенасцином для выявления тонких случаев коллагенового гастрита (возможно, включая случаи с коллагеновой полоской меньше, чем текущее определение толщины 10 мкм м) у пациентов с подозрительной клинической картиной и фоновой воспалительной картиной — интересное возможное направление для будущих исследований.Хотя тенасцин может сыграть важную роль в будущих исследованиях и ограниченную роль в качестве чувствительного маркера для выявления диагностически сложных случаев коллагенозного гастрита, важно понимать, что тенасцин обычно не требуется для постановки диагноза. Коллаген у всех 40 пациентов, изученных здесь, был первоначально идентифицирован только с помощью гистохимических красителей.
В заключение, эта большая группа пациентов с коллагеновым гастритом подтверждает преобладание женского заболевания. В дополнение к диагностическому нерегулярному отложению субэпителиального коллагена можно увидеть три различных воспалительных паттерна, включая паттерн, подобный лимфоцитарному гастриту, паттерн с высоким содержанием эозинофилов и атрофический паттерн.Осознание связи этих трех воспалительных паттернов с коллагеновым гастритом может побудить патологов тщательно искать коллаген в неуловимых случаях. Коллаген часто сохраняется в течение многих лет, но может исчезнуть гистологически у меньшинства пациентов. Этиология коллагенового гастрита остается неясной, но наши исследования, похоже, исключают механизм, связанный с повышенным содержанием эотаксина или IgG4. Наконец, иммуногистохимия тенасцина, по-видимому, является чувствительным маркером заболевания и является областью будущих исследований этого расстройства.
Детское лечение боли в животе рядом со мной
К боли в животе следует относиться серьезно, поскольку она часто требует лечения. Вот почему Kidshealth Pediatrics предлагает педиатрические методы лечения боли в животе. Прочтите нашу страницу вопросов и ответов для получения дополнительной информации или позвоните по номеру
в нашу клинику сегодня же. Мы обслуживаем пациентов из Глендейла, Аризона, Скоттсдейл, Аризона, Темпе, Аризона, Меса, Аризона, Парадайз-Вэлли, Аризона и Феникс, Аризона.В какой-то момент жизни каждый испытывает боль в животе.От спазмов до болей до острой стреляющей боли — боль в животе бывает самых разных форм и форм. Когда наши дети испытывают боль в животе, это может быть особенно сложно диагностировать. К счастью, педиатры могут эффективно диагностировать, лечить и предотвращать боль в животе.
Что вызывает боль в животе?
Боль в животе может быть вызвана несколькими состояниями. Во многих случаях одно состояние может привести к другому. Например, камни в желчном пузыре могут вызывать дисфункцию печени, камни в почках могут вызывать мучительную боль, а язвы могут вызывать расстройство желудка.
Другие причины боли в животе включают:
Газ: Причиной боли в животе может быть газ. Газы естественным образом образуются в кишечнике и пищеварительном тракте и могут вызывать чувство давления, вздутия живота или полноты при его скоплении.
Расстройство желудка: Расстройство желудка — это чувство жжения в верхних отделах желудка, которое иногда может переходить в горло или рот. Ощущение дискомфорта также может ощущаться как боль в груди.
Гастрит: При гастрите слизистая оболочка желудка становится опухшей и болезненной, что может вызвать боль в животе.
Вирусы желудка: Вирусы желудка могут вызывать боль в желудке. Помимо боли в животе, гастроэнтерит — это вирус желудка, который может вызывать тошноту, рвоту и диарею. Люди с вирусом желудка также могут испытывать мышечные боли, головные боли и усталость.
Мышечная боль: Многие мышцы доходят до брюшной полости. Травма мышц или спазмы могут вызвать острую боль в верхней части живота.
Аппендицит: Инфекция аппендикса называется аппендицитом.Если не лечить, это может привести к разрыву аппендикса, и очень быстро это состояние может стать опасным для жизни.
Камни в желчном пузыре: Камни в желчном пузыре иногда могут блокировать желчные протоки. Закупорка желчным камнем может вызвать сильную боль в правом верхнем углу живота, а также другие симптомы.
Проблемы с печенью или поджелудочной железой: Печень, поджелудочная железа и желчный пузырь работают вместе, поддерживая пищеварение, и все три органа находятся в верхней правой части живота.Иногда невылеченные камни в желчном пузыре могут вызывать боль в печени или поджелудочной железе из-за закупорки желчных протоков. Заболевания печени, вызывающие воспаление, могут вызывать боль в печени. Воспаление поджелудочной железы, также известное как панкреатит, также может вызывать боль.
Непроходимость кишечника: Непроходимость кишечника вызывает закупорку кишечника, в результате чего прохождение чего-либо очень затруднено или даже невозможно. Это может вызвать запор, сильную боль и трудности с перевариванием пищи. Поскольку кишечник может разорваться или серьезно инфицироваться, непроходимость кишечника требует неотложной медицинской помощи.Если у вас непроходимость кишечника, немедленно обратитесь за медицинской помощью.
Дивертикулярная болезнь: Когда маленькие мешочки, известные как дивертикулы, воспаляются или инфицируются, у человека может развиться сильная боль в животе.
Что может быть причиной боли в животе у вашего ребенка?
Есть много причин боли в животе у детей, в том числе:
Проблемы с кишечником: Колики, запоры или синдром раздраженного кишечника
Инфекции: Гастроэнтерит, инфекции других частей тела, таких как ухо или грудь, почки или мочевой пузырь
Проблемы, связанные с пищевыми продуктами: Пищевая аллергия, переедание или пищевое отравление
Проблемы вне живота: Мигрень, растяжение мышц или растяжение
Хирургические проблемы: Непроходимость кишечника, аппендицит или инвагинация
Отравление: Яды, такие как ядовитые укусы, проглатывание вредных химикатов или курение.
Когда мне следует отвезти ребенка в отделение неотложной помощи при болях в животе?
Если боль в животе встречается с одним из следующих признаков, немедленно обратитесь за помощью в педиатрическую службу неотложной помощи:
- Ребенок безутешен
- Боль сильная и неумолимая
- Живот чувствителен к прикосновениям и / или боль распространяется на спину вашего ребенка
Если боль в животе вашего ребенка сопровождается следующими симптомами, ему может потребоваться неотложная помощь уход:
- Лихорадка
- Повторяющаяся рвота
- Сильная или кровавая диарея
- Ребенку трудно вовлечься или проснуться, и он не хочет есть или пить
- Судороги или обмороки
- Вздутие живота
Если у вашего ребенка боль, приходите сегодня в Kidshealth Pediatrics.Наши добрые и отзывчивые специалисты имеют опыт лечения детей с болью в животе и могут помочь диагностировать причину боли и лечить ее соответствующим образом. Чтобы получить дополнительную информацию о нашем лечении боли в животе у детей, позвоните по телефону в наш офис и свяжитесь с одним из наших специалистов. Чтобы записаться на прием к одному из наших специалистов по боли в животе, посетите наш веб-сайт или поговорите с нами по телефону сегодня.
Дополнительные услуги, которые могут вам понадобиться
Рост у детей с инфекцией Helicobacter pylori и диспепсией
Инфекция Helicobacter pylori играет причинную роль в нескольких заболеваниях, включая хронический гастрит, язвенную болезнь, аденокарциному желудка и лимфому у взрослых. 1 Инфекция обычно передается в детстве, последствия заражения у детей изучены недостаточно. 2, 3 У большинства из них симптомы отсутствуют 4, 5 , а язвенная болезнь в детстве встречается относительно редко. 6 Сообщалось о хроническом гастрите, связанном с инфекцией H. pylori 7 , но связь с диспепсией все еще остается спорной. Некоторые авторы исследовали роль H pylori в экстрагастродуоденальных заболеваниях; одна из таких ассоциаций связана с невысоким ростом. 8, 9, 10, 11
Корейское исследование показало, что инфекция H pylori в сочетании с железодефицитной анемией может подавлять линейный рост. 12 В недавнем исследовании Браво и его коллеги наблюдали за 347 колумбийскими детьми, у которых на момент включения в исследование не было H. pylori . 13 Сто пять детей заразились инфекцией H. pylori во время наблюдения и показали значительное замедление скорости роста.Влияние H pylori на скорость роста не зависело от социально-экономического статуса или перенаселенности. Однако другие исследователи предположили, что подавление роста у детей с инфекцией H pylori может быть связано с социально-экономическими, генетическими и экологическими факторами. 14
Хотя причинная роль инфекции H pylori у детей с рецидивирующими болями в животе является спорной, сообщалось о повышении частоты инфицирования у детей с диспепсией. 7 Также было высказано предположение, что диспепсия, связанная с H. pylori , может снижать потребление питательных веществ и вызывать подавление роста. В этом исследовании мы рассмотрели параметры роста детей с диспепсией, поступивших в региональное отделение детской гастроэнтерологии в Манчестере, Великобритания, которые были исследованы на инфекцию H. pylori в рамках их исследовательской работы.
МЕТОДЫ
Был проведен ретроспективный обзор больничных записей всех детей с диспепсией в период с января 2001 г. по июнь 2004 г., которые также прошли дыхательный тест с мочевиной 13 C.Диспепсия определялась как боль в верхней или центральной части живота с сопутствующими симптомами, такими как загрудинная боль, тошнота, рвота и / или потеря аппетита, продолжительностью не менее двух месяцев. Выявлено триста двадцать пять пациентов. Больничные записи о 50 пациентах отсутствовали или содержали неадекватную информацию, и поэтому были исключены. Группа педиатрических гастроэнтерологов оценила этих пациентов; 18 имели сопутствующие состояния, которые могут повлиять на рост, такие как воспалительное заболевание кишечника, синдром Алагилла, хроническая астма и лечение кортикостероидами, и также были исключены.После обследования гастроэнтерологом и при наличии клинических показаний были получены антиэндомизарные антитела, но целиакия не была исключена у каждого ребенка. Наконец, в это ретроспективное исследование были включены двести пятьдесят семь пациентов. Пятьдесят один пациент прошел эндоскопическое обследование по поводу боли в животе; у двух пациентов была язва желудка, у одного — язвенная болезнь двенадцатиперстной кишки и у 10 были эндоскопические доказательства гастрита, ассоциированного с H. pylori .
13 Дыхательный тест с мочевиной был выполнен с использованием стандартного протокола; после шестичасового голодания были собраны две исходные пробы дыхания.Затем ребенку дали 200 мл апельсинового сока, а затем 30 мл раствора, содержащего 75 мг порошка мочевины 13 C. Два образца дыхания были взяты через 30 минут после употребления тестируемого раствора. Они были проанализированы с помощью изотопного масс-спектрометра, который определяет соотношение 13 C: 12 C в образце выдыхаемого воздуха. Тест считался положительным, если разница в исходном значении и 30-минутном значении 13 C: 12 C превышала 4,0%. Лечение антибиотиками было прекращено по крайней мере за две недели до теста, а кислотоподавляющая терапия — по крайней мере за неделю до теста.
У всех пациентов были зарегистрированы их вес и рост во время дыхательного теста с мочевиной 13 . Был рассчитан индекс массы тела (ИМТ) (ИМТ = вес / рост 2 ). Показатели роста, веса и стандартного отклонения (SD) ИМТ были рассчитаны с использованием нормативных данных Великобритании за 1990 год, предоставленных Фондом детского роста Великобритании. 15 Также была собрана информация о симптомах, продолжительности симптомов, возрасте на момент обращения и изменении симптомов после эрадикации H. pylori .
Индекс множественной депривации 2004 (IMD 2004), который является показателем депривации на уровне небольшой территории, был рассчитан для 225 пациентов, у которых информация о почтовом индексе была доступна в больничных записях. 16 IMD 2004 содержит семь областей депривации: лишение дохода; лишение работы; лишение здоровья и инвалидность; лишение образования, навыков и профессиональной подготовки; препятствия на пути к жилью и услугам; депривация среды обитания; и преступность.Домены и IMD 2004 представлены на уровне нижнего уровня Super Output Area (SOA). Это относительно небольшие территории, где проживает около 1500 человек. В Англии 32 482 SOA нижнего уровня. Каждому SOA был присвоен рейтинг и рейтинг IMD 2004. На основе почтовых индексов пациента были рассчитаны баллы IMD 2004 для района, в котором они жили. Баллы депривации IMD 2004 варьируются от 1 до 100; чем выше баллы, тем беднее район.
Статистика
Мы использовали SPSS для Windows версии 10.1 (SPSS Inc., Чикаго, Иллинойс, США) для статистического анализа. Клинические симптомы субъектов из H pylori положительной и отрицательной группы и распространенность инфекции H. pylori у белых европеоидов и субъектов южноазиатского происхождения оценивались с использованием статистики χ 2 . Независимые выборки Тест Стьюдента t использовался для сравнения роста, веса и ИМТ SD в положительных и отрицательных группах H. pylori , а также для сравнения показателей IMD 2004 двух групп испытуемых.Показатели веса, роста и ИМТ для H pylori положительных и отрицательных групп также сравнивались после корректировки на социально-экономические депривации и этническую принадлежность с использованием линейного регрессионного анализа.
РЕЗУЛЬТАТЫ
Девяносто семь пациентов были H. pylori положительными и 160 — отрицательными. Таблица 1 суммирует возраст, пол, этническое происхождение и баллы депривации (IMD 2004) у H pylori отрицательных и положительных пациентов. Средняя продолжительность симптомов для H pylori положительных пациентов составила 14.1 (диапазон 2–84) месяца; для отрицательной группы он составлял 15,2 (от 2 до 72) месяцев. Как и ожидалось из дизайна исследования, наиболее частым симптомом у H pylori положительных и отрицательных пациентов была боль в животе. Частота различных симптомов у H pylori положительных и отрицательных групп пациентов представлена в таблице 2. Распространенность инфекции H. pylori была выше у пациентов южноазиатского происхождения (55%) по сравнению с белыми пациентами европеоидной расы (33%). ) (Таблица 1).
Стол 1Возраст, клинические характеристики и оценка IMD 2004 детей с инфекцией H pylori и без нее
Стол 2Симптомы пациентов с инфекцией H pylori и без нее
Вес, рост и ИМТ SD для двух групп пациентов приведены в таблице 3.Средние значения SD по весу и росту были значительно ниже у пациентов с инфекцией H. pylori , но по шкале SD по ИМТ — нет. Однако после учета ковариат социально-экономической депривации и этнической принадлежности разница в показателях SD по росту и весу перестала быть значимой (таблица 3).
Стол 3Средний вес, рост, ИМТ и стандартное отклонение (SD) детей с инфекцией H. pylori и без нее
Все пациенты с инфекцией H pylori получали двухнедельный курс омепразола, кларитромицина и метронидазола.Семьдесят четыре пациента прошли повторный дыхательный тест с мочевиной 13 , и инфекция была успешно ликвидирована у 45 пациентов (57%) после первого курса тройной терапии. У четырнадцати пациентов с инфекцией H. pylori в нашем исследовании был проведен полный анализ крови; как группа, у них не было микроцитарной анемии, указывающей на дефицит железа.
ОБСУЖДЕНИЕ
Дыхательный тест с мочевиной 13 — это проверенный метод диагностики желудочной инфекции H. pylori ; заявленная чувствительность и специфичность теста превышает 90%. 17 Тридцать восемь процентов пациентов с диспепсией, обратившихся в нашу больницу в течение трех с половиной лет исследования, были связаны с инфекцией H. pylori . Хотя причинно-следственная связь между H. pylori и болью в животе при отсутствии язвенной болезни является спорной, сообщалось о повышении частоты появления H. pylori у детей с абдоминальной болью. 7 Таким образом, можно утверждать, что эта группа детей может быть особенно уязвима для подавления роста в связи с инфекцией H. pylori .Наши результаты показывают, что дети с диспепсией и инфекцией H pylori короче и легче детей по сравнению с детьми без инфекции. Однако это не было значимым после поправки на смешивающие факторы, такие как социально-экономический статус и этнические различия между двумя группами пациентов. Наше исследование могло не иметь достаточной мощности для изучения влияния социально-экономического статуса и этнических различий на показатели SD роста у пациентов с инфекцией и без нее, и нам, возможно, не удалось обнаружить это из-за ограниченной мощности нашего исследования.Это может стать очевидным в более крупном исследовании. Хотя это и не является статистически значимым, разница в росте SD после поправки на баллы IMD 2004 и этническую принадлежность все еще была большой (0,33 SD или половина ширины канала на диаграммах роста Великобритании). Распространенность инфекции H. pylori была выше у пациентов южноазиатского происхождения по сравнению с белыми людьми европеоидной расы. Однако значительных различий в антропометрических параметрах между двумя этническими группами не наблюдалось (данные не показаны). Следует отметить, что количество пациентов южноазиатского происхождения в нашем исследовании было относительно небольшим.
Пациенты с инфекцией H. pylori жили в более неблагополучных районах по сравнению с пациентами без инфекции. Недавнее эпидемиологическое исследование показало, что, несмотря на общее улучшение роста, дети, живущие в неблагополучных районах, по-прежнему относительно ниже своих сверстников из менее неблагополучных районов. 18 Авторы этого исследования пришли к выводу, что это в основном связано с факторами питания. Однако они не проверяли статус H pylori своих субъектов.Хорошо задокументирована более высокая распространенность инфекции H pylori у детей, живущих в перенаселенных бедных районах. 19, 20 Возможно, что инфекция H. pylori может оказать какое-то пагубное влияние на рост, особенно во время пубертатного всплеска роста. Поскольку средний возраст наших пациентов составлял около 11 лет, можно утверждать, что влияние инфекции H pylori на рост могло быть более выраженным в более старшей когорте с более длительной продолжительностью инфекции.Поскольку у нас не было данных о пубертатном статусе наших пациентов, мы не смогли определить, было ли у некоторых пациентов отсроченное половое созревание и было ли это связано с инфекцией H pylori .
Что уже известно по темеПредыдущие исследования сообщили о подавлении роста у детей с инфекцией H pylori , живущих в развивающихся странах, у девочек полового созревания и в связи с дефицитом железа
Инфекция H. pylori была более распространена среди детей с более низким социально-экономическим статусом среди всех этнических групп, а дети с инфекцией были ниже по сравнению с детьми без
Социально-экономический статус, но не Инфекция H. pylori была основным фактором, способствовавшим разнице в росте между двумя группами
Корейское исследование показало, что инфекция H pylori сама по себе не оказала значительного влияния на рост, но в сочетании с железодефицитной анемией она может задерживать всплеск пубертатного роста. 12 H pylori может вызывать железодефицитную анемию по множеству и сложным механизмам, которые включают в себя авидность организма к железу, нарушение секреции кислоты желудочного сока, вызванное воспалением, и, возможно, аномальную секрецию аскорбиновой кислоты слизистыми оболочками. 21, 22 Информация о железодефицитной анемии была доступна только у небольшого числа пациентов в нашем исследовании, и мы не обнаружили значимой корреляции ни с одной из антропометрических переменных.
Имеющиеся данные об инфекции H. pylori и ее влиянии на рост детей противоречивы.В некоторых перекрестных исследованиях сообщалось о низком росте в сочетании с H pylori , но в этих исследованиях не учитывались социально-экономические факторы и факторы окружающей среды, которые могут независимо подавлять рост. Вполне возможно, что инфекция H pylori может вызвать подавление роста у уязвимых групп детей, таких как: дети, живущие в развивающихся странах 13 или в социально-экономически неблагополучных районах на западе, у лиц с железодефицитной анемией и у девочек полового созревания. 12 Более крупное проспективное исследование, оценивающее скорость роста после эрадикации H. pylori , может помочь уточнить связь между инфекцией H. pylori и ростом. Можно было бы ожидать, что скорость роста улучшится после эрадикации H pylori , если инфекция была основной причиной подавления роста.
Благодарности
Мы хотели бы поблагодарить Энди Вейла, лектора группы биостатистики Манчестерского университета за его помощь и советы при анализе данных, а также Нила Бенделя, специалиста по разведке здоровья, Манчестерское объединенное медицинское учреждение, за подсчет баллов депривации.
ССЫЛКИ
- ↵
Blaser MJ , Chyou PH, Nomura A. Возраст на момент установления инфекции Helicobacter pylori и рака желудка, язвы желудка и риска язвы двенадцатиперстной кишки. Cancer Res1995; 55: 562–5.
- ↵
Drumm B , Sherman P, Cutz E, et al. Ассоциация Campylobacter pylori на слизистой оболочке желудка с антральным гастритом у детей. N Engl J Med1987; 316: 1557–61.
- ↵
Macarthur C , Saunders N, Feldman W., et al. Helicobacter pylori и повторяющаяся боль в животе у детей: исследование случай-контроль на уровне сообщества. BMJ1999; 319: 822–3.
- ↵
O’Donohoe JM , Sullivan PB, Scott R, et al. Рецидивирующая боль в животе и Helicobacter pylori в выборке лондонских детей по месту жительства. Acta Paediatr 1996; 85: 961–4.
- ↵
Роуленд М , Имри С., Бурк Б., и др. Как следует вести себя с детьми, инфицированными Helicobacter pylori. Gut1999; 45: S136–9.
- ↵
Drumm B , Rhoads JM, Stringer DA, et al. Язвенная болезнь у детей: этиология, клиника и течение. Педиатрия 1988; 82 (3 pt 2): 410–14.
- ↵
Korzon M , Sikorska-Wisniewska G, Jankowski Z, et al. Клиническое и патологическое значение cagA-положительных штаммов Helicobacter pylori у детей с заболеваниями органов брюшной полости. Helicobacter1999; 4: 238–42.
- ↵
Perri F , Pastore M, Leandro G, и др. Инфекция Helicobacter pylori и задержка роста у детей старшего возраста. Arch Dis Child 1997; 77: 46–9.
- ↵
Goodman KJ , Correa P, Tengana Aux HJ, и др. Факторы питания и инфекция Helicobacter pylori у колумбийских детей. J Pediatr Gastroenterol Nutr 1997; 25: 507–15.
- ↵
Рихтер Т , Рихтер Т, Список S, и др. Дети от пяти до семи лет с инфекцией Helicobacter pylori меньше, чем дети без Helicobacter: поперечное популяционное исследование с участием 3315 детей. J Pediatr Gastroenterol Nutr, 2001; 33: 472–5.
- ↵
Patel P , Mendall MA, Khulusi S, et al. Инфекция Helicobacter pylori в детстве: факторы риска и влияние на рост. BMJ1994; 309: 1119–23.
- ↵
Cuoco L , Cammarota G, Jorizzo RA, et al. Железодефицитная анемия, инфекция Helicobacter pylori и задержка полового созревания. Арка Дис Детский 2000; 83: 456.
- ↵
Bravo LE , Mera R, Reina JC, и др. Влияние инфекции Helicobacter pylori на рост детей: проспективное когортное исследование.J Pediatr Gastroenterol Nutr2000; 37: 614–19.
- ↵
Oderda G , Palli D, Saieva C, et al. Низкий рост и инфекция Helicobacter pylori у итальянских детей: проспективное многоцентровое больничное исследование случай-контроль. Итальянская группа по изучению небольшого роста и H. pylori. BMJ1998; 317: 514–15.
- ↵
Коул ТДЖ . Мониторинг роста в соответствии с Британским справочником о росте за 1990 год.Arch Dis Child 1997; 76: 47–9.
- ↵
- ↵
Vandenplas Y , Blecker U, Devreker T, et al. Вклад дыхательного теста с 13C-мочевиной в выявление гастрита Helicobacter pylori у детей. Педиатрия 1992; 90: 608–11.
- ↵
Wright CM , Parker L. Сорок лет спустя: влияние депривации на рост в двух когортах новорожденных из Ньюкасла.Int J Epidemiol2004; 33: 147–52.
- ↵
Fiedorek SC , Malaty HM, Evans DL, et al. Факторы, влияющие на эпидемиологию инфекции Helicobacter pylori у детей. Педиатрия 1991; 88: 578–82.
- ↵
McCallion WA , Murray LJ, Bailie AG, et al. Инфекция Helicobacter pylori у детей: связь с текущими бытовыми условиями.Gut1996; 39: 18–21.
- ↵
Baysoy G , Ertem D, Ademoglu E, et al. Гистопатология желудка, статус железа и железодефицитная анемия у детей с инфекцией Helicobacter pylori. J Pediatr Gastroenterol Nutr, 2004; 38: 146–51.
- ↵
Ашорн M . Нарушения кислотности и железа, связанные с инфекцией Helicobacter pylori. J Pediatr Gastroenterol Nutr 2004; 38: 137–9.
Связь между фолликулярным гастритом и Helicobacter pylori у детей, обращающихся в государственную больницу в Перу
https://doi.org/10.1016/j.rgmxen.2016.01.003Получить права и контентРезюме
Справочная информация
На последнее Через 15 лет инфекция, вызванная Helicobacter pylori ( H. pylori ), была признана в патогенезе гастрита и, как известно, вызывает серьезную воспалительную реакцию у этих пациентов.
Цель
Определить связь между фолликулярным гастритом и H. pylori инфекция у детей, поступивших в государственную больницу в Перу.
Методология
Аналитическое перекрестное исследование было проведено на всех детях, проходивших лечение в Национальной больнице больницы «Ниньо Сан Бартоломе» в Лиме, Перу, в период с 2011 по 2012 год. Были собраны все личные данные из историй болезни пациентов и эндоскопических процедур. Грубые коэффициенты распространенности (PR) были получены и скорректированы (aPR) с их 95% доверительными интервалами (95% ДИ) с использованием обобщенных линейных моделей с биномиальным семейством и функцией логарифмической связи.
Результаты
Критериям исследования соответствовали 123 ребенка. Сорок восемь (39%) участников исследования составляли девочки, а средний возраст детей составлял 12 лет. H. pylori присутствовал в 44% образца, а 9% были представлены более чем 100 бактериями на поле (классифицировано как ++ +). Тридцать пять процентов детей заболели эзофагитом из-за сопутствующего рефлюкса. Присутствие H. pylori было связано с фолликулярным гастритом (P <0,01; aPR: 2,3; 95% CI: 1.49-3,49) с поправкой на возраст детей.
Выводы
На основании проанализированных данных был сделан вывод, что дети с фолликулярным гастритом имели большую вероятность иметь H. pylori , чем дети, у которых гастрит не был. Эти результаты могут быть экстраполированы на другие аналогичные группы населения и должны оцениваться в каждой обстановке, чтобы это не превратилось в проблему общественного здравоохранения в ближайшие несколько лет.
Resumen
Antecedentes
Durante los últimos 15 años la influencción por Helicobacter pylori (Hp) ha sido reconocida en la patogénesis de la gastritis, desencadenando una importanteia respuest.
Objetivo
Determinar la asociación entre gastritis folicular y la Инфекция Hp en niños atendidos en un publico peruano больница.
Metodología
Estudio transversal analítico desarrollado entre los anos 2011 y 2012, con la totalidad de los niños atendidos en Hospital Nacional Docente Madre «Niño San Bartolomé», de Lima, Perú. Se recolectaron los datos personales de su Historia clínica, datos del procedure endoscópico y sus hallazgos. Se obtuvieron las razones de prevalencia crudas y ajustadas (RPa) con sus intervalos de confianza del 95% (IC del 95%), usando los modelos lineales generalizados, con la familia binomial y la función de enlace log.
Результатов
Участие: 123 участника с критериями оценки, 48 (39%) fueron niñas y la mediana de edad fue 12 năm. Presentó Hp el 44% de ellos y el 9% presentó más de 100 bacterias por campo (clasificados como 3 cruces). El 35% tuvo esofagitis por reflujo concomitante. La presencia de Hp estuvo asociada a la gastritis folicular (p <0,01; RPa: 2,3; IC del 95%, 1,49–3,49), ajustando por la edad de los niños.
Выводы
Анализ данных по результатам анализа фоликулярных гастритов с вероятностью возникновения гастрита в настоящее время.Los resultados pueden ser extrapolados a otras poblaciones similares, debiendo ser evalado cada escenario para que esto no se convierta en un проблема de salud pública en unos años.
Ключевые слова
Helicobacter pylori
Дети
Гастрит
Перу (источник: DeCS BIREME)
Palabras clave
Helicobacter pylori
000 9000C ESC 9000C 9000C 9000CE 9000 9000 9000 9000 9000 GúsisРекомендуемые статьиЦитирующие статьи (0)
© 2016 Asociación Mexicana de Gastroenterología.






.jpg) Нарушение процесса и регулярности приема пищи. Увлечение модными диетами для похудения или если ребенок питается нерегулярно с большими промежутками между приемами пищи или размером порций, это создает высокий риск развития гастрита. Недоброкачественная пища. Если ребенок кушает, даже полезные продукты питания, но при этом они либо испорчены, либо инфицированы патогенными микроорганизмами, это станет причиной возникновения острого гастрита.
Нарушение процесса и регулярности приема пищи. Увлечение модными диетами для похудения или если ребенок питается нерегулярно с большими промежутками между приемами пищи или размером порций, это создает высокий риск развития гастрита. Недоброкачественная пища. Если ребенок кушает, даже полезные продукты питания, но при этом они либо испорчены, либо инфицированы патогенными микроорганизмами, это станет причиной возникновения острого гастрита.
 Точный механизм заражения Helicobacter pylori в настоящий момент не известен. Предполагается, что заразиться этой инфекцией можно через грязную воду, продукты питания, а также при близком контакте с людьми, зараженными этим микробом. Эти микроорганизмы могут существовать только в полости желудка в условиях повышенной кислотности. Поэтому они вызывают хронический гастрит только в условиях гиперсекреции желудочного сока и соляной кислоты. Не может быть хеликобактерного воспаления на фоне сниженной секреторной активности желудка. У некоторых людей, заражение хеликобактериозом не проявляется никакими симптомами, а сама инфекция проходит без всякого лечения спустя некоторое время после заражения (спонтанное выздоровление). У других же микроб способен длительное время выживать в желудке человека за счет уникальной способности нейтрализовать кислотность желудочного сока, и, паразитируя в слизистой оболочке желудка, Helicobacter pylori приводит к ее медленному разрушению. Не все знают о том, что гастрит является заразным заболеванием.
Точный механизм заражения Helicobacter pylori в настоящий момент не известен. Предполагается, что заразиться этой инфекцией можно через грязную воду, продукты питания, а также при близком контакте с людьми, зараженными этим микробом. Эти микроорганизмы могут существовать только в полости желудка в условиях повышенной кислотности. Поэтому они вызывают хронический гастрит только в условиях гиперсекреции желудочного сока и соляной кислоты. Не может быть хеликобактерного воспаления на фоне сниженной секреторной активности желудка. У некоторых людей, заражение хеликобактериозом не проявляется никакими симптомами, а сама инфекция проходит без всякого лечения спустя некоторое время после заражения (спонтанное выздоровление). У других же микроб способен длительное время выживать в желудке человека за счет уникальной способности нейтрализовать кислотность желудочного сока, и, паразитируя в слизистой оболочке желудка, Helicobacter pylori приводит к ее медленному разрушению. Не все знают о том, что гастрит является заразным заболеванием. Как говорилось выше, данное утверждение вовсе не справедливо. Это говорит о том, что больному гастритом ребенку или взрослому стоит выделить отдельную посуду для питания, отдельные игрушки, предметы личной гигиены и т. д.
Как говорилось выше, данное утверждение вовсе не справедливо. Это говорит о том, что больному гастритом ребенку или взрослому стоит выделить отдельную посуду для питания, отдельные игрушки, предметы личной гигиены и т. д. При этом предрасположенность к раннему заболеванию язвенной болезнью чаще передается по отцовской линии. По наследству от отца к сыну может передаваться предрасположенность организма производить недостаточное количество гормонов и других биологически активных веществ, обеспечивающих защиту и нормальное развитие слизистой оболочки желудка.
При этом предрасположенность к раннему заболеванию язвенной болезнью чаще передается по отцовской линии. По наследству от отца к сыну может передаваться предрасположенность организма производить недостаточное количество гормонов и других биологически активных веществ, обеспечивающих защиту и нормальное развитие слизистой оболочки желудка. В итоге прием таблеток может спровоцировать гастрит. Поэтому возьмите за правило не «прописывать» ребенку лекарства, руководствуясь только своими соображениями. Препараты больному малышу должен назначать только квалифицированный специалист — детский доктор.
В итоге прием таблеток может спровоцировать гастрит. Поэтому возьмите за правило не «прописывать» ребенку лекарства, руководствуясь только своими соображениями. Препараты больному малышу должен назначать только квалифицированный специалист — детский доктор. вес, рост, скорость роста, стадия полового созревания, артериальное давление
вес, рост, скорость роста, стадия полового созревания, артериальное давление