Недостаточно заботиться только о микрофлоре! | Еженедельник АПТЕКА
Нарушение микрофлоры кишечника — актуальная и часто обсуждаемая проблема. Казалось бы, ничего нового по этой теме уже нельзя сказать, все известно. Однако следует помнить, что наш организм — единая система, и микрофлора является ее частью. Поэтому невозможно рассматривать ее изолировано от места, где она обитает. А значит, состояние места обитания кишечной микрофлоры не менее важно, чем ее баланс.
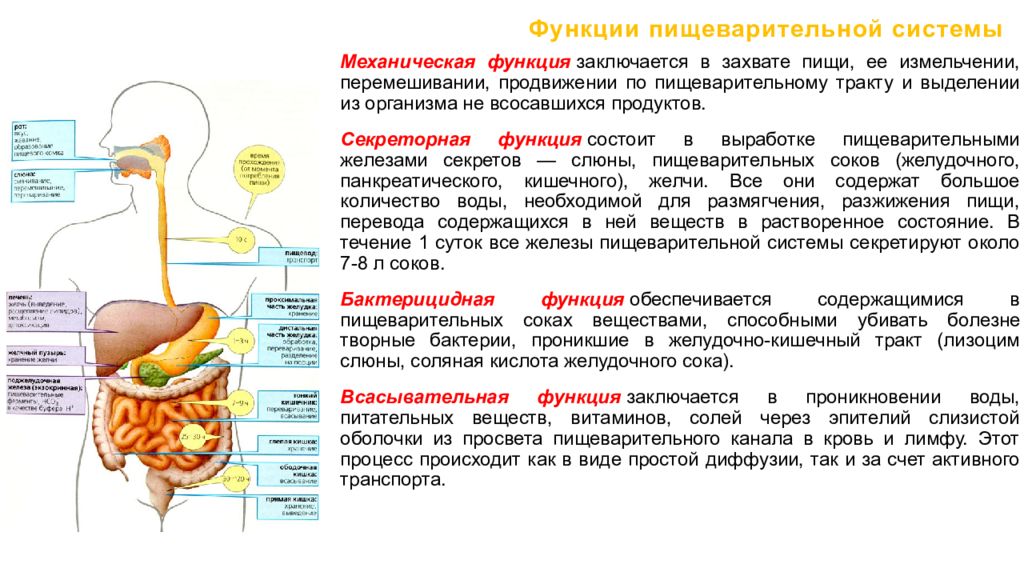
Наш пищеварительный тракт является органом с наибольшей протяженностью. Но при этом он помещается в относительно небольшом человеке. Так, длина пищевой трубки составляет почти 9 м, а площадь ее поверхности — около 400 м2! За всю жизнь через нее проходит приблизительно 60 т пищи. И справиться с этой едой кишечнику помогает микрофлора. Она формирует сложную самоорганизующуюся, саморегулирующуюся и саморазвивающуюся экосистему. В нее входит более 50 родов, насчитывающих около 500 видов различных бактерий.
Все вышесказанное большинству из нас очень хорошо известно. Но вот о взаимосвязи состояния слизистой оболочки кишечника и физиологической микрофлоры говорят не так часто. Тем не менее, результатом взаимодействия клеток эпителия и микроорганизмов является формирование сложной структуры — так называемого приэпителиального слизистого барьера. Он представляет собой биопленку, состоящую из слизи, молекул секреторного IgA, нормальной микрофлоры и ее метаболитов. Именно эта биопленка защищает слизистую оболочку кишечника от негативного воздействия различных физических и химических факторов, проникновения патогенных микробов и различных токсинов. Этот барьер обеспечивает также устойчивость к колонизации, конкуренцию с патогенными микроорганизмами за питательные вещества, витамины, минералы и метаболиты, синтез специальных бактериоцинов, которые ингибируют размножение патогенных штаммов. Такой компонент, как секреторный IgA также связывает антигены вирусов и бактерий, не позволяет им прикрепляться к слизистым оболочкам, связывает пищевые антигены и аллергены, способные провоцировать аллергические реакции.
Но вот о взаимосвязи состояния слизистой оболочки кишечника и физиологической микрофлоры говорят не так часто. Тем не менее, результатом взаимодействия клеток эпителия и микроорганизмов является формирование сложной структуры — так называемого приэпителиального слизистого барьера. Он представляет собой биопленку, состоящую из слизи, молекул секреторного IgA, нормальной микрофлоры и ее метаболитов. Именно эта биопленка защищает слизистую оболочку кишечника от негативного воздействия различных физических и химических факторов, проникновения патогенных микробов и различных токсинов. Этот барьер обеспечивает также устойчивость к колонизации, конкуренцию с патогенными микроорганизмами за питательные вещества, витамины, минералы и метаболиты, синтез специальных бактериоцинов, которые ингибируют размножение патогенных штаммов. Такой компонент, как секреторный IgA также связывает антигены вирусов и бактерий, не позволяет им прикрепляться к слизистым оболочкам, связывает пищевые антигены и аллергены, способные провоцировать аллергические реакции.
Нет, мы не будем утверждать, что дисбаланс кишечной микрофлоры достиг размеров эпидемии и возникает буквально у каждого. На самом деле, нередко нарушение баланса кишечной микрофлоры протекает практически бессимптомно. И в случае, если мы имеем дело всего лишь с дисбалансом нормальной микрофлоры, восстановить это равновесие не так уж и сложно: часто это происходит само по себе, без какого-либо нашего вмешательства, или же при употреблении кисломолочных продуктов.
Но вот когда мы сталкиваемся с различными диспептическими явлениями (вздутие живота, периодическая боль в эпигастрии, тяжесть и дискомфорт, возникающие после еды, диарея и расстройства стула) — самое время задуматься: быть может, мы имеем дело с повреждением энтероцитов — клеток эпителия кишечника?
Именно на фоне такого повреждения эпителия слизистой оболочки кишечника, снижается уровень активности пристеночных ферментов, в частности лактазы.
Вторичная лактазная недостаточность усугубляет дисбаланс микрофлоры кишечника. Накопление нерасщепленной лактозы в просвете кишечника сопровождается активным размножением условно-патогенных микроорганизмов. Это становится причиной появления таких симптомов, как метеоризм, боль и урчание в животе, ощущение тяжести и т.п.
Стоит ли говорить о том, что для устранения всех состояний, которые мы перечисляли выше — диареи, скопления газов, урчания и колик в животе — недостаточно лишь улучшить состояние кишечной микрофлоры. Необходимо еще обратить внимание на слизистую оболочку кишечника.
Необходимо еще обратить внимание на слизистую оболочку кишечника.
Позаботиться не только о нормализации состава микрофлоры, но и помочь восстановить нормальную функцию слизистой оболочки кишечника поможет препарат ЛАКТОВИТ ФОРТЕ.
Наиболее важной отличительной особенностью этого лекарственного средства является его комплексный состав, в который входят:
1. Восстановление нормальной микрофлоры кишечника: Bacillus coagulans продуцируют молочную кислоту, которая обладает антагонистической активностью в отношении патогенных и условно-патогенных микроорганизмов, а также создает благоприятные условия для формирования нормального микробиоценоза кишечника. Споры бактерий Bacillus coagulans, содержащиеся в капсулах ЛАКТОВИТ ФОРТЕ, активизируются в желудке, после чего в двенадцатиперстной кишке трансформируются в живую вегетативную форму и создают благоприятные условия для формирования нормального микробиоценоза кишечника за счет выделения L (+) молочной кислоты.
2. Восстановление слизистой оболочки кишечника.
Кому же рекомендовано принимать ЛАКТОВИТ ФОРТЕ? Кто нуждается в восстановлении не только микрофлоры, но и функции слизистой оболочки кишечника? Прежде всего, пациентам с жалобами на вздутие живота, периодическую боль в эпигастрии, тяжесть и дискомфорт после еды, диарею или расстройства стула — все эти симптомы могут свидетельствовать о том, что кроме дисбаланса микрофлоры произошло и повреждение слизистой оболочки кишечника.
В качестве второй категории следует отметить больных, которые применяют антибактериальные препараты. Ведь сегодня специалистам хорошо известно, что некоторые антибиотики оказывают непосредственное токсическое воздействие на слизистую оболочку кишечника (неомицин, тетрациклин) (Хавкин А.И., Жихарева Н.С., 2006).
Наконец, остается выяснить последнее: как принимают ЛАКТОВИТ ФОРТЕ? Тем более, что для удобства наших больших и маленьких пациентов он представлен в форме не только капсул, но и саше.
Так, например, у взрослых и детей препарат применяют 2 раза в сутки за 40 мин до еды. Разовая и суточная дозы определяются в зависимости от возраста (схема).
Детям в возрасте до 2 лет лекарственное средство можно принимать непосредственно перед кормлением по ½ капсуле/пакетику (раскрыв и растворив капсулу/содержимое пакетика в воде или молоке), в возрасте старше 2 лет — по 1 капсуле/пакетику; взрослым — 1–2 капсулы/пакетика.
ПРЕИМУЩЕСТВА препарата ЛАКТОВИТ ФОРТЕ
обладает двойным действием – способствует восстановлению микрофлоры и слизистой оболочки кишечника:
1.
2. содержит фолиевую кислоту (витамин В9) и цианокобаламин (витамин В12), оказывающие синергичное действие и восстанавливающие слизистую оболочку кишечника
Информация для профессиональной деятельности медицинских и фармацевтических специалистов
ЛАКТОВИТ ФОРТЕ (LAKTOVIT FORTE). Состав и форма выпуска. Капсулы, № 30: молочнокислые бактерии — 120 000 000 спор; кислота фолиевая — 1,5 мг; цианокобаламин — 15 мкг; Порошок. д/п орал. сусп. пакетик 4 г, № 10: молочнокислые бактерии — 120 000 000 спор; кислота фолиевая — 1,5 мг; цианокобаламин — 15 мкг. Показания. Взрослым и детям (начиная с первых месяцев жизни) при хроническом колите различной этиологии, в том числе неспецифическом язвенном колите; дисбактериозе, возникшем в результате применения антибиотиков, сульфаниламидных препаратов и т.д.; после перенесенных острых кишечных инфекций; при наличии дисфункции пищеварительного тракта или выделении патогенных и условно-патогенных бактерий; в акушерско-гинекологической практике при неспецифических воспалительных заболеваниях половых органов и предродовой подготовке у беременных, входящих в группу риска, с нарушением чистоты вагинального секрета III–IV степени; в составе комплексной терапии при крапивнице, экземе, диатезе у детей, атопическом дерматите. Применение. Взрослым и детям внутрь 2 раза в сутки за 40 мин до еды. Детям в возрасте до 2 лет можно принимать препарат непосредственно перед кормлением по ½ капсуле/пакетику (раскрыв и растворив капсулу/содержимое пакетика в воде или молоке), старше 2 лет и взрослым — по 1 капсулы/пакетика; взрослым — 1–2 капсулы/пакетика. Противопоказания. Гиперчувствительность к лактозе или другим компонентам препарата. Побочные эффекты. При медицинском применении препарата ЛАКТОВИТ ФОРТЕ в рекомендуемых дозах возникновение побочных реакций маловероятно. В редких случаях — аллергические реакции; незначительная диарея; очень редко — периферический сосудистый тромбоз.
Применение. Взрослым и детям внутрь 2 раза в сутки за 40 мин до еды. Детям в возрасте до 2 лет можно принимать препарат непосредственно перед кормлением по ½ капсуле/пакетику (раскрыв и растворив капсулу/содержимое пакетика в воде или молоке), старше 2 лет и взрослым — по 1 капсулы/пакетика; взрослым — 1–2 капсулы/пакетика. Противопоказания. Гиперчувствительность к лактозе или другим компонентам препарата. Побочные эффекты. При медицинском применении препарата ЛАКТОВИТ ФОРТЕ в рекомендуемых дозах возникновение побочных реакций маловероятно. В редких случаях — аллергические реакции; незначительная диарея; очень редко — периферический сосудистый тромбоз.
Р.с. МЗ Украины № UA/0160/01/01 от 12.12.2008 г. до 12.12.2013 г. (капсулы), № UA/0160/02/01 от 24.09.2008 г. до 24.09.2013 г. (порошок).
Представительство «Мили Хелскере» в Украине: 01032, Киев, бульв. Тараса Шевченко, 33Б, 5-й этаж; тел./факс: +38 (044) 498-13-34, 498-13-35.
Пресс-служба «Еженедельника АПТЕКА»
Лактовіт ФортеЦікава інформація для Вас:
Эндокринолог рассказала, как восстановить слизистую желудка
https://rsport. ria.ru/20210311/zheludok-1600819723.html
ria.ru/20210311/zheludok-1600819723.html
Эндокринолог рассказала, как восстановить слизистую желудка
Эндокринолог рассказала, как восстановить слизистую желудка — РИА Новости Спорт, 11.03.2021
Эндокринолог рассказала, как восстановить слизистую желудка
Врач-эндокринолог, доктор медицинских наук Зухра Павлова объяснила, как ускорить восстановление слизистой оболочки желудка и 12-перстной кишки после воспаления. РИА Новости Спорт, 11.03.2021
2021-03-11T17:50
2021-03-11T17:50
2021-03-11T17:50
зож
питание
здоровье
зухра павлова
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e4/03/13/1568839669_1042:0:4425:1903_1920x0_80_0_0_568b0308032a73a8aa81c8f30a68e89f.jpg
МОСКВА, 11 мар — РИА Новости. Врач-эндокринолог, доктор медицинских наук Зухра Павлова объяснила, как ускорить восстановление слизистой оболочки желудка и 12-перстной кишки после воспаления. По ее мнению, в первую очередь в рацион необходимо включить продукты, обладающие свойством обволакивать слизистую. К ним, прежде всего, относятся рисовый отвар и кисель. Положительный эффект также обеспечат фрукты, содержащие пектин, например, запеченные яблоки.»Надо исключить продукты, усугубляющие поражение слизистой желудочно-кишечного тракта, то есть специи (особенно перец и уксус), жареные блюда, сырые овощи и фрукты, содержащие грубую клетчатку, например, капусту или сельдерей», — написала в своем telegram-канале Павлова.Она добавила, что пищу важно тщательно пережевывать. В таком случае риск травм слизистых оболочек минимизируется.
По ее мнению, в первую очередь в рацион необходимо включить продукты, обладающие свойством обволакивать слизистую. К ним, прежде всего, относятся рисовый отвар и кисель. Положительный эффект также обеспечат фрукты, содержащие пектин, например, запеченные яблоки.»Надо исключить продукты, усугубляющие поражение слизистой желудочно-кишечного тракта, то есть специи (особенно перец и уксус), жареные блюда, сырые овощи и фрукты, содержащие грубую клетчатку, например, капусту или сельдерей», — написала в своем telegram-канале Павлова.Она добавила, что пищу важно тщательно пережевывать. В таком случае риск травм слизистых оболочек минимизируется.
https://rsport.ria.ru/20210311/avokado-1600787662.html
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
Новости
ru-RU
https://rsport.ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e4/03/13/1568839669_1577:0:4308:2048_1920x0_80_0_0_e443f1fe5ace095ecb6b7c23534ac14e.jpgРИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
питание, здоровье, зухра павлова
МОСКВА, 11 мар — РИА Новости. Врач-эндокринолог, доктор медицинских наук Зухра Павлова объяснила, как ускорить восстановление слизистой оболочки желудка и 12-перстной кишки после воспаления.
По ее мнению, в первую очередь в рацион необходимо включить продукты, обладающие свойством обволакивать слизистую. К ним, прежде всего, относятся рисовый отвар и кисель. Положительный эффект также обеспечат фрукты, содержащие пектин, например, запеченные яблоки.
«Надо исключить продукты, усугубляющие поражение слизистой желудочно-кишечного тракта, то есть специи (особенно перец и уксус), жареные блюда, сырые овощи и фрукты, содержащие грубую клетчатку, например, капусту или сельдерей», — написала в своем telegram-канале Павлова.
Она добавила, что пищу важно тщательно пережевывать. В таком случае риск травм слизистых оболочек минимизируется.
11 марта, 16:00ЗОЖЧто произойдет с организмом, если регулярно есть авокадо?Как защитить и восстановить слизистую желудка?
Товар есть в наличии в аптеках:
Товар есть в 51 аптеках, посмотрите все
Доставка
Игнатьевское шоссе, 9, ТвояАптека.рфИгнатьевское шоссе, 14/6, Социальная аптекаИгнатьевское шоссе, 17 (пом 1-13), Социальная аптекаНовотроицкое шоссе, 3, Аптека ПерекрестокУл. 50 лет Октября, 20 (Универмаг), Семейная аптекаУл. 50 лет Октября, 28, ТвояАптека.рф (круглосуточно)Ул. 50 лет Октября, 61. ТЦ «Мега», Социальная аптекаУл. 50 лет Октября, 202 (КПП), ТвояАптека.рфУл. Амурская, 60, ТвояАптека.рфУл. Амурская, 102, Семейная аптекаУл. Амурская, 165, Семейная аптекаУл. Василенко, 7, Социальная аптекаУл. Василенко, 7, АйболитУл. Дьяченко, 2, Социальная аптекаУл. Загородная, 53, Семейная аптекаУл. Зейская, 126, Семейная аптекаУл. Зейская,193, Социальная аптекаУл. Зейская, 256, Социальная аптекаУл. Институтская, 14, Семейная аптека (круглосуточно)Ул. Калинина, 38 (пом. 2), Аптека ВербенаУл. Калинина, 41, Семейная аптекаУл. Калинина, 105, Социальная аптекаУл. Калинина, 127, Семейная аптекаУл. Кантемирова, 1, АйболитУл. Красноармейская, 92, Социальная аптекаУл. Красноармейская, 132, Семейная аптека (круглосуточно)Ул. Красноармейская, 139 (Физкультурный техникум), ТвояАптека.рфУл. Красноармейская, 143, ТвояАптека.рфУл. Красноармейская, 194, АйболитУл. Кузнечная, 50, АйболитУл.
50 лет Октября, 20 (Универмаг), Семейная аптекаУл. 50 лет Октября, 28, ТвояАптека.рф (круглосуточно)Ул. 50 лет Октября, 61. ТЦ «Мега», Социальная аптекаУл. 50 лет Октября, 202 (КПП), ТвояАптека.рфУл. Амурская, 60, ТвояАптека.рфУл. Амурская, 102, Семейная аптекаУл. Амурская, 165, Семейная аптекаУл. Василенко, 7, Социальная аптекаУл. Василенко, 7, АйболитУл. Дьяченко, 2, Социальная аптекаУл. Загородная, 53, Семейная аптекаУл. Зейская, 126, Семейная аптекаУл. Зейская,193, Социальная аптекаУл. Зейская, 256, Социальная аптекаУл. Институтская, 14, Семейная аптека (круглосуточно)Ул. Калинина, 38 (пом. 2), Аптека ВербенаУл. Калинина, 41, Семейная аптекаУл. Калинина, 105, Социальная аптекаУл. Калинина, 127, Семейная аптекаУл. Кантемирова, 1, АйболитУл. Красноармейская, 92, Социальная аптекаУл. Красноармейская, 132, Семейная аптека (круглосуточно)Ул. Красноармейская, 139 (Физкультурный техникум), ТвояАптека.рфУл. Красноармейская, 143, ТвояАптека.рфУл. Красноармейская, 194, АйболитУл. Кузнечная, 50, АйболитУл. Лазо, 55, Социальная аптекаУл. Ленина, 54, Семейная аптекаУл. Ленина, 75, ТвояАптека.рфУл. Ленина, 123, АйболитУл. Ленина, 184, АйболитУл. Ленина, 187, Семейная аптека (круглосуточно)Ул. Муравьева-Амурского, 3, Социальная аптекаУл. Пионерская, 72, ТЦ Три кита, вход снаружи, Социальная аптекаУл. Свободная, 32, Семейная аптекаУл. Театральная, 23, ТвояАптека.рфУл. Театральная, 23, Социальная аптека (круглосуточно)Ул. Театральная, 81, ГосаптекаУл.Театральная, 170 (в ТЦ Реал), ТвояАптека.рфУл. Театральная, 239, Социальная аптекаУл. Тенистая, 160 (ТЦ Флагман — Самбери), Социальная аптекаУл. Чайковского, 20, АйболитУл. Чайковского, 193, Социальная аптекаУл. Шевченко,18, Аптека ВербенаУл. Шевченко, 80, Семейная аптекаУл. Шевченко, 85 (ТЦ XL), Социальная аптекас. Чигири, ул. Партизанская, 1А, Социальная аптека
Лазо, 55, Социальная аптекаУл. Ленина, 54, Семейная аптекаУл. Ленина, 75, ТвояАптека.рфУл. Ленина, 123, АйболитУл. Ленина, 184, АйболитУл. Ленина, 187, Семейная аптека (круглосуточно)Ул. Муравьева-Амурского, 3, Социальная аптекаУл. Пионерская, 72, ТЦ Три кита, вход снаружи, Социальная аптекаУл. Свободная, 32, Семейная аптекаУл. Театральная, 23, ТвояАптека.рфУл. Театральная, 23, Социальная аптека (круглосуточно)Ул. Театральная, 81, ГосаптекаУл.Театральная, 170 (в ТЦ Реал), ТвояАптека.рфУл. Театральная, 239, Социальная аптекаУл. Тенистая, 160 (ТЦ Флагман — Самбери), Социальная аптекаУл. Чайковского, 20, АйболитУл. Чайковского, 193, Социальная аптекаУл. Шевченко,18, Аптека ВербенаУл. Шевченко, 80, Семейная аптекаУл. Шевченко, 85 (ТЦ XL), Социальная аптекас. Чигири, ул. Партизанская, 1А, Социальная аптека
Восстановление микрофлоры слизистой кишечника при диарее
Количество просмотров: 5 360
Дата последнего обновления: 28.10.2021
Содержание:
Влияние диареи на микрофлору
Что происходит с иммунитетом при диарее?
Диарея и патогены
Нужно ли лечить диарею?
Влияние диареи на микрофлору
Во время диареи потеря жидкости и солей может приводить к обезвоживанию организма, и это только одна из опасностей. Частый жидкий стул способствует вымыванию кишечной микрофлоры и иммуноглобулинов. Восстановление бактериальной экосистемы — длительный процесс. Может потребоваться несколько недель и курсовое лечение пробиотиками. Избежать потерь можно, если вовремя остановить диарею.
Частый жидкий стул способствует вымыванию кишечной микрофлоры и иммуноглобулинов. Восстановление бактериальной экосистемы — длительный процесс. Может потребоваться несколько недель и курсовое лечение пробиотиками. Избежать потерь можно, если вовремя остановить диарею.
Наверх к содержанию
Что происходит с иммунитетом при диарее?
Кишечник является важным органом иммунной системы. В нём есть лимфоидная ткань, которая воспроизводит иммунокомпетентные клетки. Эти клетки способны вырабатывать иммуноглобулины в ответ на попавшие в кишечник чужеродные антигены. Иммуноглобулины — защитные белковые молекулы, которые связывают патогены и не дают им вредить нашему организму. Эффективность действия выделяемых иммуноглобулинов зависит от времени их нахождения в кишечнике: чем дольше, тем эффективнее. Вместе с жидким стулом потеря иммуноглобулинов увеличивается, их количество для подавления инфекции может стать недостаточным.
Наверх к содержанию
Диарея и патогены
Собственная микрофлора защищает кишечник человека от колонизации патогенными микроорганизмами1. Представители лакто- и бифидофлоры препятствуют подселению патогенов и конкурируют с ними за питательные вещества и «жилую площадь». Помимо этого, нормальная микрофлора вырабатывает активные субстанции, замедляющие рост вредных микробов2. Во время диареи скорость прохождения пищи по кишечнику увеличивается, вместе с кишечным содержимым теряются и полезные бактерии3. Патогенная флора начинает расти, поддерживать инфекционный процесс и усиливать воспаление в кишечнике.
Представители лакто- и бифидофлоры препятствуют подселению патогенов и конкурируют с ними за питательные вещества и «жилую площадь». Помимо этого, нормальная микрофлора вырабатывает активные субстанции, замедляющие рост вредных микробов2. Во время диареи скорость прохождения пищи по кишечнику увеличивается, вместе с кишечным содержимым теряются и полезные бактерии3. Патогенная флора начинает расти, поддерживать инфекционный процесс и усиливать воспаление в кишечнике.
Наверх к содержанию
Нужно ли лечить диарею?
Существует устойчивое мнение, что понос не представляет особой опасности и проходит сам собой. Это не так. Диарея ведет к вымыванию полезной микрофлоры и снижению местной иммунной защиты.
Восстановление нормофлоры — длительный процесс. Например, при диарее после применения антибиотиков изменённый состав микробиоты ЖКТ может регистрироваться в период до 6 месяцев1,4.
Прием пробиотиков способствует сокращению времени реабилитации, но нужно учитывать, что препараты необходимо принимать курсом, несколько раз в день, курс применения может составлять до 3 недель5. Очевидно, что длительный восстановительный период не потребуется, если предотвратить вымывание микрофлоры на ранних этапах заболевания. Чем раньше остановлена диарея, тем быстрее восстановится бактериальная экосистема.
Очевидно, что длительный восстановительный период не потребуется, если предотвратить вымывание микрофлоры на ранних этапах заболевания. Чем раньше остановлена диарея, тем быстрее восстановится бактериальная экосистема.
Для нормализации стула при диарее можно использовать препарат Имодиум® Экспресс на основе лоперамида. После приема однократной дозы (4 мг) его действие начинается в течение одного часа6,7. Останавливая диарею, Имодиум® Экспресс предотвращает вымывание полезных микроорганизмов и потерю иммуноглобулинов8. Это способствует сокращению времени восстановления нормальной микрофлоры.
Наверх к содержанию
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту.
Литература
- Броновец И. Н. Дисбактериоз кишечника: диагностика, профилактика и лечение.
 Медицинские новости. 2016; 11: 56-58
Медицинские новости. 2016; 11: 56-58 - Хавкин А. И. Микрофлора и развитие иммунной системы. Вопросы современной педиатрии.2012; 11 (5): 86-89
- Wen-Hung Hsu et al. Current applications of fecal microbiota transplantation in intestinal disorders. The Kaohsiung Journal of Medical Sciences. 24 Apr 2019
Вен-Хунг Хсу и другие. Современное применение трансплантации фекальной микробиоты при кишечных заболеваниях. https://onlinelibrary.wiley.com/doi/full/10.1002/kjm2.12069 - Усенко Д.В. Антибиотик-индуцированные изменения микробиома желудочно-кишечного тракта и их коррекция. Регулярные выпуски «РМЖ» №2 (II) от 26.03.2018: 96-99
- Инструкция Бифиформ® капсулы кишечнорастворимые. Регистрационное удостоверение П N013677/01
- Исследование Амери и соавт. «Мультицентровое двойное слепое исследование: сравнение эффективности применения лоперамида при острой диарее с двумя популярными противодиарейными агентами и плацебо», 1975 г.
- Инструкция по применению препарата ИМОДИУМ® Экспресс.

- Масловский Л.В. Лоперамида гидрохлорид: механизм действия и возможности использования в гастроэнтерологии (обзор литературы). Consilium Medicum. Гастроэнтерология. (Прил.). 2015; 1: 43-48.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
6789101112
13141516171819
20212223242526
2728293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Как оздоровить кишечник: семь простых способов
Проблемы в работе кишечника связаны с массой негативных последствий для организма. И наоборот — чем лучше он функционирует, тем меньше у человека проблем со стрессоустойчивостью, лишним весом, состоянием кожи и так далее, передает Telegraph.
И наоборот — чем лучше он функционирует, тем меньше у человека проблем со стрессоустойчивостью, лишним весом, состоянием кожи и так далее, передает Telegraph.
Ссылаясь на высказывание «отца медицины» Гиппократа, утверждавшего, что все болезни зарождаются в кишечнике, издание приводит данные нового исследования. Ученые обнаружили связь между кишечными бактериями и депрессией. Бактерии типа Faecalibacterium и Coprococcus чаще встречались у людей, которые высоко оценивали качество своей жизни. И наоборот, — у людей с депрессией объем этих бактерий был ниже среднего.
По мнению исследователей, кишечные бактерии в ходе жизнедеятельности производят нейротрансмиттеры, необходимые для хорошего психического здоровья.
До 70% ресурсов нашей иммунной системы зависят именно от работы кишечника — следует из научной работы. Кроме того, 90% серотонина (химического регулятора настроения) вырабатываются в кишечнике. Поэтому важно заботиться о «хороших» бактериях, и не допускать размножения «плохих», — приводит издание слова профессора пищевой микробиологии в университете Рединга Гленна Гибсона и дает семь советов своим читателям по поддержанию здоровья кишечника.
Самым простым способом обогатить микрофлору кишечника профессор считает разнообразие рациона питания. Необходимо расширить меню, включив в него продукты, богатые клетчаткой. Это могут быть макароны и хлеб из цельнозерновой муки, крупы — особенно овес, овощи, ягоды и фрукты. На особом счету — дыня, брокколи, морковь и орехи. Иначе вам может грозить ожирение, артрит и диабет.
Второй совет — включить в рацион пробиотические йогурты и пребиотики, которые находятся в луке, чесноке, цикории, фасоли и картофеле. Чаще употребляйте супы.
Следует употреблять продукты, содержащие полифенолы. Они содержатся во фруктах, овощах, какао, красном вине и чае. Они способствуют росту «хороших» бактерий и препятствуют росту «плохих» бактерий.
Также следует максимально сократить потребление сахара и сладостей, которые подавляют «дружественную» организму микрофлору.
Медики советуют освоить и технику массажа кишечника.
Не надеясь только лишь на еду и кишечник, профессор советует научиться противостоять стрессу, который провоцирует изменение кровотока и секреции в кишечнике, что создает комфортные условия для вредных бактерий и убивает полезные микроорганизмы.
Последний совет — пить больше чистой воды, если нет проблем с почками. В идеале каждое утро стоит начинать со стакана воды. И только потом заниматься водными процедурами, готовить завтрак и пр.
Ученые нашли новое средство для лечения дисбактериозов и ожирения
Чтобы нормализовать микрофлору кишечника, восстановить метаболизм и бороться с ожирением, ученые применили вещество, стимулирующее иммунитет. На мышах они получили убедительный результат. Дело за разработкой лекарства для человека.
06 сентября 13:48
В каждом человеке живет несколько килограммов бактерий, а количество бактериальных клеток в организме превышает количество наших родных клеток. Суммарный геном этих бактерий гораздо больше нашего, и в нем записаны очень важные белки, которые мы сами не можем синтезировать. Биологи не зря предлагают считать микробиом отдельным органом и даже производят его успешные трансплантации от здоровых людей тем, кто страдает от бактериальной анархии.
Суммарный геном этих бактерий гораздо больше нашего, и в нем записаны очень важные белки, которые мы сами не можем синтезировать. Биологи не зря предлагают считать микробиом отдельным органом и даже производят его успешные трансплантации от здоровых людей тем, кто страдает от бактериальной анархии.
Давно установлена связь состава кишечной микробиоты с метаболическими расстройствами.
Нарушение состава бактериального населения кишечника приводит к ожирению, диабету и сердечно-сосудистым заболеваниям.
Ученые из Сан-Франциско в статье, опубликованной в Nature, предложили новый способ борьбы с неправильной микрофлорой и нарушениями метаболизма. На мышах они показали, что от многих недугов помогает интерлейкин-22 — вещество, с помощью которого лейкоциты — иммунные охранники организма — «общаются» между собой. Он стимулирует иммунитет слизистой оболочки кишечника и таким образом влияет на живущих в нем бактерий.
Бактериальный состав кишечника может нарушиться, например, из-за приема антибиотиков, которые вместе с возбудителями инфекции способны убить и наших полезных сожителей.![]() Это чревато серьезными последствиями.
Это чревато серьезными последствиями.
Место полезных бактерий могут занять «нелегальные мигранты», отравляющие человека своими токсинами, которые приводят к хроническому воспалению слизистой оболочки кишечника.
Начинаются метаболические расстройства, симптомы которых принято называть дисбактериозом . Хотя на самом деле такого диагноза в списке «Международной классификаций болезней» нет, так как это не болезнь, а синдром — состояние. Впоследствии могут развиться ожирение, диабет, сердечно-сосудистые заболевания.
Кстати, в некоторых случаях ожирение происходит именно из-за нарушения обмена веществ по причине неправильного состава кишечной микрофлоры. И это те самые тяжелые случаи, в которых диета и занятия спортом не помогают похудеть.
Выход ученые нашли в трансплантации кишечной микробиоты. Как писала «Газета.Ru», они показали, что перенос бактерий из кишечника стройных мышей в кишечник толстых приводит к похуданию и нормализации обмена веществ у последних. Метод фекальной трансплантации применяется уже и на человеке, с его помощью удается лечить тяжелые кишечные расстройства, не поддающиеся иной терапии. Однако метод пока не получил широкого распространения, да и подойдет не всем.
Группа Вэнчжан Оуянг (Wenjun Ouyang) попыталась найти другой выход из ситуации с помощью интерлейкина-22 — пептида, синтезируемого лейкоцитами в ответ на воспаление и помогающего бороться с инфекциями. Ранее эксперименты с облученными мышами, проведенные специалистами из Memorial Sloan Kettering Cancer Center в Нью-Йорке показали, что интерлейкин-22 отвечает за производство и обучение клеток иммунной системы в тимусе (вилочковой железе). В 2013 году французскими учеными из Института Пастера была доказана его роль в противодействии бактериальной суперинфекции (в частности, пневмонии), которая возникает как осложнение на фоне или после заражения гриппом.
Ученые предложили интерлейкин-22 в качестве способа борьбы с «неправильной» микрофлорой.
Логика проста: если укреплять естественный иммунитет слизистых оболочек (в первую очередь слизистую кишечника), то патогенные организмы не смогут там закрепиться.
Эксперименты проводили на мышах. Их заражали патогенной бактерией Citrobacter rodentium, сажали на диету с высоким содержанием жиров, изучали также мышей с генетической предрасположенностью к ожирению. Оказалось, что у всех мышей с ожирением любой природы продукция интерлейкина-22 снижена.
Введение мышам интерлейкина-22 повлияло на них благотворно. Он стимулировал иммунитет слизистой, нормализовал состав микрофлоры и метаболические расстройства, а также увеличивал чувствительность инсулиновых рецепторов и помогал регулировать содержание сахара в крови.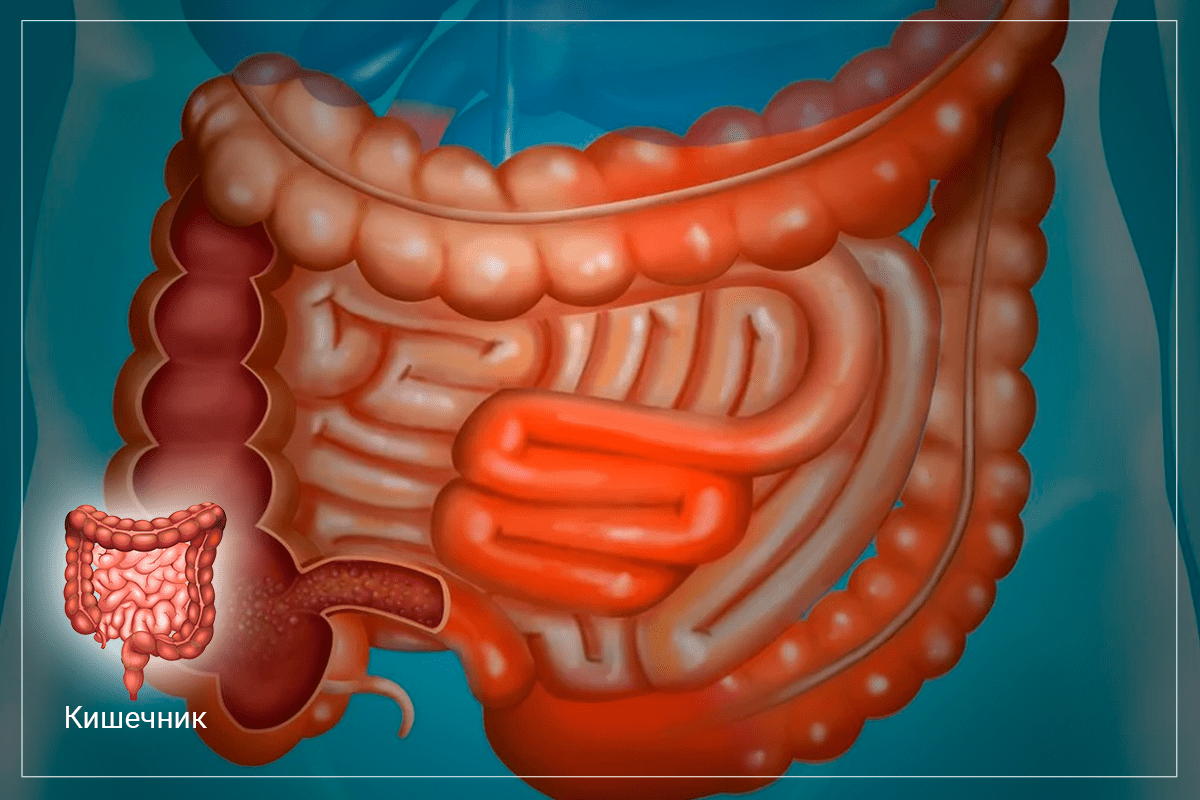
Это дает надежду на то, что интерлейкин-22 может стать основой для лекарств, нормализующих обмен веществ. Однако радоваться пока рано: от открытия терапевтической молекулы до момента внедрения лекарства порой проходит более десяти лет.
Если же дело до лекарства дойдет, то, возможно, у людей, генетически предрасположенных к ожирению, появится хорошая альтернатива: интерлейкин вместо трансплантации фекалий.
Не ненавидь свою кишку — вылечи их
Использование иммунной системы, гидрогелей и бактерий для лечения и профилактики кишечных заболеваний
Линдси Браунелл
Многие кишечные заболевания вызваны повреждением слизистой оболочки кишечника, что позволяет контактировать между микробиомом и иммунной системой, вызывая устойчивое воспаление. Ученые Wyss разрабатывают несколько подходов к лечению слизистого барьера, что может уменьшить страдания миллионов пациентов.Предоставлено: SewCream / Shutterstock.com Каждый из нас ежедневно переносит в кишечнике около 38 триллионов бактерий. Если бы вы захотели пересчитать их всех, это заняло бы более миллиона лет. Как может такой настоящий зоопарк микробов мирно жить в нашем кишечнике, не заставляя нашу иммунную систему атаковать их, как это делают «плохие» бактерии, вызывающие болезни? Ответ кроется в барьере слизистой оболочки кишечника, который включает в себя плотно связанные эпителиальные клетки, выстилающие кишечник, слой плотной слизи, защищающий эти клетки от бактерий и другого содержимого кишечника, и иммунные клетки под эпителиальными клетками, которые быстро убивают любые микробы, которые проникают внутрь. барьер.
Если бы вы захотели пересчитать их всех, это заняло бы более миллиона лет. Как может такой настоящий зоопарк микробов мирно жить в нашем кишечнике, не заставляя нашу иммунную систему атаковать их, как это делают «плохие» бактерии, вызывающие болезни? Ответ кроется в барьере слизистой оболочки кишечника, который включает в себя плотно связанные эпителиальные клетки, выстилающие кишечник, слой плотной слизи, защищающий эти клетки от бактерий и другого содержимого кишечника, и иммунные клетки под эпителиальными клетками, которые быстро убивают любые микробы, которые проникают внутрь. барьер.
Когда барьер слизистой оболочки нарушен, дружественные бактерии становятся врагами, поскольку иммунная система вырабатывает против них воспалительную реакцию. Это воспаление может препятствовать процессу заживления слизистого барьера, что продлевает контакт между кишечными микробами и иммунными клетками и создает порочную петлю обратной связи. Многие проблемы со здоровьем могут возникнуть в результате этого длительного иммунного ответа против кишечника, включая инфекции, пищевую аллергию, диабет, заболевания печени, неврологические состояния, рак и воспалительные заболевания кишечника (ВЗК), что ложится огромным бременем на пациентов. медсестры и врачи одинаково.Ученые из Института Висса изучают ряд различных стратегий для преодоления этой проблемы и эффективного лечения слизистого барьера, что могло бы облегчить страдания миллионов людей во всем мире.
медсестры и врачи одинаково.Ученые из Института Висса изучают ряд различных стратегий для преодоления этой проблемы и эффективного лечения слизистого барьера, что могло бы облегчить страдания миллионов людей во всем мире.
ВЗК — это, пожалуй, наиболее распространенное кишечное заболевание, связанное с воспалением, от которого страдают более 3 миллионов взрослых только в Соединенных Штатах. Основными типами ВЗК являются болезнь Крона и язвенный колит, и заболевание также может приводить к артриту, кожным заболеваниям, раку толстой кишки или перфорации кишечника.Поскольку эти проблемы вызваны сверхактивной иммунной системой, научные усилия по поиску лечения ВЗК начали сосредотачиваться на иммуномодулирующих препаратах, которые могут противодействовать воспалительной реакции и обеспечивать заживление слизистого барьера. Однако большинство соединений, которые были идентифицированы до сих пор, не подходят для использования в качестве лекарств, поскольку они несут повышенный риск токсичности, инфекции и рака — все побочные эффекты блокирования способности иммунной системы исследовать организм и защищать его. .
.
Эллиот Чайкоф, доктор медицинских наук, младший преподаватель Института Висс и главный хирург Медицинского центра Бет Исраэль Дьяконесса, решил попытаться решить эту проблему под другим углом — не блокируя естественные естественные процессы в организме. механизмы иммунной защиты, но они заставляют иммунные клетки выделять химические вещества, которые напрямую способствуют восстановлению слизистого барьера, тем самым прекращая вызывающий воспаление контакт между иммунными клетками и микробиомом кишечника.
Мыши с колитом, которым вводили PY109, показали восстановление структуры бокаловидных клеток в кишечнике (слева) через 11 дней, в то время как мыши, которым не давали соединение, нет (справа).Предоставлено: Институт Висса при Гарвардском университете В недавно опубликованной статье Чайкоф и его команда сосредоточили внимание на белково-арилуглеводородном рецепторе (AHR), который, как известно, при активации изменяет паттерны экспрессии определенных иммуноассоциированных генов и дезактивация которого имеет было показано, что он вызывает дисфункцию слизистого барьера. Исследователи синтезировали набор соединений, структуры которых похожи на те, которые, как известно, активируют AHR, а затем использовали комбинацию экспериментов и компьютерного моделирования для определения кандидатов, которые показали сильное связывание AHR.
Исследователи синтезировали набор соединений, структуры которых похожи на те, которые, как известно, активируют AHR, а затем использовали комбинацию экспериментов и компьютерного моделирования для определения кандидатов, которые показали сильное связывание AHR.
После нескольких раундов проектирования и доработки соединений-кандидатов команда отточила два, названные PY108 и PY109, которые казались наиболее многообещающими. Когда они вводили эти соединения в клетки кишечника человека и мыши, они наблюдали увеличение количества активации AHR, а их пероральное введение живым мышам с колитом значительно улучшило здоровье и выживаемость животных.
Мыши, обработанные PY109, испытали дополнительные положительные эффекты, включая активацию генов, кодирующих интерлейкины 22 (IL-22) и 17A (IL-17A), которые, как известно, усиливают выработку слизи и поддерживают функцию барьерных клеток.Когда исследователи протестировали соединение на человеческих Т-клетках, полученных от пациентов с ВЗК или без них, обе популяции клеток пациентов показали увеличение ИЛ-22, предполагая, что PY109 может быть полезен для модуляции иммунной системы и, таким образом, помогает заживлению слизистой оболочки. барьер — в том числе и у человека.
барьер — в том числе и у человека.
«Сейчас мы расширяем наши исследования, чтобы изучить влияние препаратов, нацеленных на AHR, на метаболический синдром и неалкогольную жировую болезнь печени, которые также связаны с нарушением барьера слизистой оболочки кишечника», — сказал Чайкоф.
Пробиотический пластырь © для кишечникаНацеливание на иммунную систему с целью уменьшения воспаления и восстановления кишечника может сработать для некоторых пациентов, но те, у кого ослаблена иммунная система или другие проблемы, могут быть не в состоянии переносить такое лечение. К счастью, член Института Висса Нил Джоши, доктор философии. разработал альтернативное решение: пробиотический гидрогель, который можно наносить на внутреннюю поверхность кишечника, как живую повязку, чтобы физически герметизировать нарушения слизистого барьера и способствовать заживлению без вовлечения иммунной системы.
На этом СЭМ-изображении показана сеть нановолокон curli (оранжевый), которая непрерывно продуцируется генетически запрограммированными непатогенными комменсальными бактериями E. coli (желтый) и связывается с белками слизи на поверхности стенки кишечника. Предоставлено: Институт Висса при Гарвардском университете
coli (желтый) и связывается с белками слизи на поверхности стенки кишечника. Предоставлено: Институт Висса при Гарвардском университете«Наш гидрогель содержит особый штамм генетически модифицированных бактерий E. coli , которые по существу секретируют биопленку, которая физически связывается со слоем слизи кишечника», — сказал Джоши, приглашенный научный сотрудник в Висс. Институт и доцент химии и химической биологии Северо-Восточного университета.«Мы можем легко ввести гидрогель в кишечник с помощью спрея, шприца, эндоскопа или перорального приема, и гель может регенерировать сам, потому что бактерии внутри него постоянно производят липкие волокна, которые связывают его с поверхностью кишечника».
Команда Джоши описала свое творение в недавней статье, опубликованной в Advanced Materials . Когда они вводили мышам свои «живые гели» орально, они обнаружили, что они выжили в жесткой, кислой среде желудка и оставались в кишечнике не менее пяти дней — в несколько раз дольше, чем существующие полимеры, которые направлены на увеличение стойкости лекарств в кишечнике. кишечник.Бактерии, находящиеся в живых гелях, также могут быть уничтожены до того, как гидрогель будет введен в кишечник, для более короткоживущих методов лечения и для пациентов, чья иммунная система может атаковать доброкачественные бактерии в гидрогелях.
кишечник.Бактерии, находящиеся в живых гелях, также могут быть уничтожены до того, как гидрогель будет введен в кишечник, для более короткоживущих методов лечения и для пациентов, чья иммунная система может атаковать доброкачественные бактерии в гидрогелях.
Исследователи продолжают совершенствовать свой подход, получивший название «Терапевтические гибриды курли, связанные с пробиотиками» (PATCH), и продемонстрировали, что он помогает уменьшить воспаление и улучшить выздоровление от колита у мышей, которые вернулись к почти нормальному функционированию после перорального лечения.
Заставляем кишечник проверять его самостоятельно Как и при любом другом заболевании, раннее обнаружение нарушения слизистой оболочки кишечника является ключом к правильному лечению пациентов и их максимальному выздоровлению. Однако симптомы нарушения слизистого барьера можно легко принять за другие, более безобидные состояния, такие как несварение желудка или газы, и пациенты, скорее всего, попробуют безрецептурные препараты или домашние средства, а не сразу же обратятся к врачу. Что, если бы кишечник мог контролировать себя и лечить себя, чтобы пациентам не приходилось терпеть длительный дискомфорт и инвазивные диагностические тесты? Это вопрос, который член факультета Wyss Core Памела Сильвер, доктор философии.Д. работает над ответом, создавая микробы, живущие в кишечнике человека, для обнаружения, регистрации и лечения болезней.
Что, если бы кишечник мог контролировать себя и лечить себя, чтобы пациентам не приходилось терпеть длительный дискомфорт и инвазивные диагностические тесты? Это вопрос, который член факультета Wyss Core Памела Сильвер, доктор философии.Д. работает над ответом, создавая микробы, живущие в кишечнике человека, для обнаружения, регистрации и лечения болезней.
Ее лаборатория использует методы синтетической биологии для создания генетических цепей, содержащих «пусковой элемент», который определяет присутствие целевого биомаркера, а затем включает «элемент памяти», который фиксирует присутствие цели, и может быть интегрирован в штаммы бактерий, обнаруженных в кишечнике человека. В знаменательном исследовании команда Сильвера вставила генетическую схему, предназначенную для включения при воздействии тетратионата (молекулы, вырабатываемой воспаленной тканью кишечника), в E. coli , а затем ввела бактерии мышам, чьи кишки были инфицированы патогенными S. Тифимуриум . Цепи в бактериях E. coli переходили в состояние «включено», когда они сталкивались с тетратионатом, и сохраняли память об этом воздействии в кишечнике мышей на срок до шести месяцев.
В знаменательном исследовании команда Сильвера вставила генетическую схему, предназначенную для включения при воздействии тетратионата (молекулы, вырабатываемой воспаленной тканью кишечника), в E. coli , а затем ввела бактерии мышам, чьи кишки были инфицированы патогенными S. Тифимуриум . Цепи в бактериях E. coli переходили в состояние «включено», когда они сталкивались с тетратионатом, и сохраняли память об этом воздействии в кишечнике мышей на срок до шести месяцев.
Исследователи продолжают идентифицировать генетические цепи, которые могут обнаруживать широкий спектр биомаркеров, с целью создания еще более сложных бактерий, которые могут контролировать кишечник на предмет множества потенциальных заболеваний, регистрировать наличие инфекции или травмы и даже выделяют молекулы, которые могут излечить барьер слизистой оболочки или активировать иммунную систему организма против конкретного инфекционного микроба.
«Эти живые клеточные устройства в конечном итоге могут быть разработаны в виде пробиотических таблеток, содержащих несколько типов искусственно созданных бактерий, которые могут колонизировать кишечник, воспринимать и записывать несколько сигналов одновременно», — сказал Сильвер, который также является Эллиотом Т.и Они Х. Адамс, профессор биохимии и системной биологии Гарвардской медицинской школы (HMS). «Это позволит клиницистам, по сути,« отследить »болезнь, основываясь на коллективных сигналах, которые производят бактерии, чтобы они могли поставить точный диагноз неинвазивным способом».
Перенести барьер из кишечника в лабораторию На этом иммунофлуоресцентном микроскопическом изображении поперечного сечения чипа толстой кишки видны дифференцированные бокаловидные клетки с гранулами, содержащими слизь (пурпурный), ядра, расположенные близко к базальной стороне, прикрепленной к пористой мембране (голубой), комплексы латеральной адгезии клеток (желтый) и край кисти, обнажающий апикальный просвет (серый).Предоставлено: Институт Вайса при Гарвардском университете,. Все эти методы лечения слизистой оболочки кишечника до сих пор были проверены на мышах, но все они должны быть продемонстрированы на людях, прежде чем их можно будет коммерциализировать в терапии. Клинические испытания общеизвестно дорогостоящие и длительные, а препараты, оказывающие положительный эффект на мышей, часто не приносят пользы или даже токсичны для людей.
Директор-основатель Wyss Institute Дональд Ингбер, доктор медицины, доктор философии более десяти лет работает над созданием чипов для органов, которые могут воспроизводить основные функции человеческих органов и позволяют тестировать лекарства в системе, которая более точно имитирует тело пациента.В рамках этого проекта лаборатория Ингбера создала чип толстой кишки, засеянный клетками кишечника человека, которые спонтанно производят свой собственный слой слизи и регенерируют, как и кишечник живого человека. В их экспериментах слизистый барьер, который образовался в чипе, реагировал на провоспалительную молекулу путем быстрого набухания, что указывает на то, что чип толстой кишки является хорошим показателем для изучения эффектов связанных с воспалением заболеваний кишечника, таких как ВЗК. Команда также провела метаболомный анализ внутри чипа толстой кишки и определила специфические молекулы, выделяемые микробиомом кишечника, которые на самом деле могут ухудшить повреждение слизистого барьера, вызванное «плохими» инфекционными бактериями.
Эта сканирующая электронная микрофотография (SEM) показывает зрелую бокаловидную клетку, встроенную в монослой покрытых микроворсинками энтероцитов в чипе толстой кишки. Предоставлено: Институт Висса при Гарвардском университете«Человеческий кишечник часто называют« черным ящиком », потому что его трудно изучать, учитывая сложные взаимодействия между человеческими и бактериальными клетками и их относительную недоступность внутри тела. Наш Colon Chip дает нам уникальную возможность наблюдать, как различные заболевания и лекарства влияют на кишечник в режиме реального времени.Мы надеемся, что эта технология в сочетании с передовыми методами, разрабатываемыми здесь, в Институте Висса, приведет к быстрому тестированию и утверждению более эффективных методов лечения, которые могут излечить слизистый барьер и потенциально вылечить множественные хронические изнурительные кишечные заболевания ». Ингбер также является профессором сосудистой биологии Джуды Фолкмана в HMS и Программе сосудистой биологии в Бостонской детской больнице, а также профессором биоинженерии в Гарвардской школе инженерии и прикладных наук Джона А. Полсона.
7 способов вылечить кишечник и улучшить здоровье пищеварительной системы в 2021 году
Целебные продукты и натуральные пробиотики — восхитительные способы улучшить здоровье кишечника. Обратите внимание на эти простые продукты, полезные для кишечника, и советы по питанию, которые помогут пищеварению и способствуют развитию здоровых кишечных бактерий в 2021 году.
После года изоляции мы все немного более подавлены и немного менее мотивированы, и это сказалось на наших пищевых привычках. В начале 2021 года пришло время поставить несколько простых целей в отношении продуктов, которые исцелят кишечник и восстановят здоровую флору кишечника.
Эти полезные для кишечника продукты и уловки дешевы и просты в применении. Вам не нужны добавки или экстракты экзотических корней, вам просто нужен список покупок с этими целебными продуктами, которые улучшают здоровье кишечника и естественным образом увеличивают количество полезных бактерий в кишечнике.
Содержание
1. Фрукты — не сок
Если вы думаете, что фруктовый сок полезен для вас, подумайте еще раз. Конечно, фруктовый сок содержит витамины и питательные вещества, но он также насыщен сахарами, которые быстро всасываются в кровоток, вызывая резкое повышение уровня инсулина и способствуя увеличению веса.Кроме того, простой сахар также питает бактерии, вызывающие воспаление кишечника.
Супер фрукты для улучшения здоровья кишечника
Эти супер-фрукты являются пребиотическими продуктами для полезных бактерий в кишечнике. Добавьте их в свою здоровую диету для кишечника, чтобы восстановить слизистую оболочку кишечника, укрепить стенку кишечника и бороться с воспалениями.
| Черника | Персики |
| Яблоки | Инжир |
| Клюква | Грейпфрут |
| Гранат | Виноград |
| Ананас | Киви |
☝ Определите идеальные продукты для кишечных бактерий с помощью микробиомного теста Atlas и получите индивидуальные еженедельные рекомендации по улучшению здоровья пищеварительной системы.
2. Разнообразьте углеводы
Добавляйте цельнозерновые продукты, чтобы улучшить здоровье кишечника и поддержать свой микробиом.Блюда с зерном, коричневым или диким рисом и бобовыми — это простой способ увеличить потребление клетчатки и улучшить здоровье кишечника. Зерновые и бобовые являются неотъемлемой частью вашей здоровой диеты с кишечными бактериями, потому что ваше тело не может переваривать клетчатку, а кишечные микробы могут!
Добавьте цельнозерновые или бобовые в любой прием пищи, и они будут содержать намного больше пищевых волокон, что поможет получить ежедневные 30 граммов.Если вам нужно вдохновение, загляните в кулинарные книги Средиземноморья, Ближнего Востока и Индии, чтобы найти вкусные рецепты, которые восстанавливают здоровье кишечника, например хумус, даль и тушеную фасоль.
Лучшие цельнозерновые и бобовые для здоровья кишечника
Цельнозерновые готовятся долго, поэтому готовьте их большими партиями и замораживайте для будущих блюд. Что касается бобовых, то вам не нужно замачивать чечевицу, но вы должны замачивать фасоль. Если у вас мало времени, приготовьте эти продукты, необходимые для здоровья кишечника, с помощью скороварки.
| Гречка | Киноа |
| Коричневый рис | Дикий рис |
| Ячмень | пишется |
| Овес | Горох |
| Бобы | Нут |
| Чечевица | Фрике |
3. Перекус на попкорне
Знаете ли вы, что взбитая кукуруза богата клетчаткой? Его даже считают цельным зерном, что является живым доказательством того, что здоровая пища не всегда бывает скучной.100 г кукурузных хлопьев содержат 10 г клетчатки, что делает это зерно отличным дополнением к вашей диете для здоровья кишечника.
Просто не забудьте приготовить попкорн дома и держитесь подальше от заранее приготовленной кукурузы в пакетах. Обработанный попкорн, как правило, содержит соль и / или сахар, ни один из которых (в избытке) не исправит ваш кишечник и не излечит плохое пищеварение.
☝ СОВЕТ ☝ Вы можете приготовить попкорн на сковороде с оливковым маслом (только не забудьте накрыть крышкой) и в микроволновой печи. Добавьте аромат приправ, пищевых дрожжей и оливкового масла первого холодного отжима.
4. Разогрейте картофель и макаронные изделия
Когда картофель и макароны остывают, содержащиеся в них крахмалы превращаются в устойчивый крахмал. Устойчивый крахмал способствует здоровью обмена веществ, а также может улучшить состав кишечных бактерий. Просто приготовьте и охладите картофель и макароны (желательно на ночь в холодильнике), разогрейте их, и вы улучшите здоровье кишечника с минимальными усилиями!
Польза для здоровья стойкого крахмала
- аналог пищевых волокон
- снижает уровень сахара в крови
- повышает чувствительность к инсулину
- снижает уровень холестерина в сыворотке
- может помочь похудеть
5.30 продуктов вызов
Вылечите свой кишечник с помощью задания из 30 продуктовРастительные продукты обладают естественными целебными свойствами для человеческого организма. Они содержат клетчатку, антиоксиданты, витамины и минералы, которые необходимы вашим клеткам для оптимального функционирования. Вам не нужно становиться веганом, чтобы вылечить кишечник, вам просто нужно небольшое забавное испытание.
Еженедельная задача из 30 блюд очень проста. Попробуйте каждую неделю добавлять в свой рацион 30 различных растительных продуктов. Может показаться, что это много, но на самом деле это не так. Добавьте эти три приема пищи в свой еженедельный планировщик меню, и вы уже будете получать 18 из 30 различных растительных продуктов!
| Овощная пленка | Салат Радуга | Овощное карри |
|---|---|---|
| Помидор | Кале | Картофель |
| Авокадо | Огурец | Лук |
| Тофу на гриле | Манго | Баклажан |
| Кориандр | Капуста | Цветная капуста |
| Хумус | Орехи макадамия | Кабачок |
| Руккола | Коричневый рис | Монетный двор |
5.Ферментированные продукты
Вам не нужно покупать дорогие пробиотические добавки, чтобы улучшить кишечную флору, все, что вам нужно, — это продукты и напитки, выращенные на живых культурах, такие как чайный гриб, кефир, йогурт и квашеная капуста. Эти ферментированные продукты созданы хорошими бактериями, такими как Lactobacillus , которые полезны для здоровья пищеварительной системы.
Сделайте их дома или купите ферментированные продукты, на этикетке которых указано живых культур и сырых . Если вы покупаете их в магазине, всегда проверяйте этикетку, чтобы убедиться, что они не были пастеризованы (что устраняет большинство бактерий) и что в них нет сахара.Вот несколько распространенных ферментированных продуктов для вдохновения:
| Йогурт | Кефир молочный |
| Натто | Кимчи |
| Квашеная капуста | Чайный гриб |
6. Выполните упражнения
Вам не нужно ходить в тренажерный зал или следить за тренировками Джо Уикса и ограниченными тренировками, вам просто нужно двигаться. Сердечно-сосудистые упражнения, такие как быстрая ходьба, бег трусцой, езда на велосипеде, плавание, танцы и игра в бадминтон с социальной дистанцией, сделают свое дело.
Курцгесагт, как бактерии управляют вашим телом. Упражнения отлично подходят для улучшения здоровья кишечника, потому что они буквально заставляют ваш кишечник двигаться, что может решить запор. Кроме того, тренировки могут даже помочь вам получить хорошие кишечные бактерии. Да, у спортивных людей более счастливый микробиом, чем у бездельника. Исследования даже показывают, что микробы производят вещества, успокаивающие воспаленный кишечник!
7. Пройдите тест на микробиом кишечника (Великобритания)
Тест на микробиом Атлас анализирует бактерии в кишечнике.Вы получите полный отчет с результатами о вашем разнообразии, бутирате и витаминах (от воспаления), расщеплении клетчатки, а также индивидуальные рекомендации по продуктам, которые исцеляют микробиом кишечника.
| Отчет | Что вы узнаете |
|---|---|
| Защита от болезней | Посмотрите, как ваши микробы защищают вас от таких болезней, как болезнь Крона и язвенный колит. |
| Разнообразие микробиома | Откройте для себя свой показатель разнообразия бактерий, живущих в кишечнике |
| Потенциал синтеза бутирата | Узнайте, вырабатывают ли ваши бактерии достаточно бутирата, чтобы поддерживать здоровье кишечника |
| Энтеротип микробиома | Посмотрите, что ваш микробиом говорит о вашем рационе |
| Пробиотики и полезные бактерии | Познакомьтесь с пробиотическими бактериями в кишечнике и посмотрите, достаточно ли их у вас |
| Пищевые волокна | Узнайте, насколько хорошо ваши кишечные микробы расщепляют различные пищевые волокна, содержащиеся в пище |
| Синтез витаминов | Кишечные микробы производят 8 различных витаминов: насколько они полезны для вас? |
| Происхождение микробиома | Узнайте, с какой национальностью или этнической группой ваши микробы больше всего связаны |
☝ Подпишитесь на обновления блога Atlas и получите скидку 10% на тест Atlas Microbiome Test☝ .
границ | Заживление ран слизистой оболочки кишечника и целостность барьера при ВЗК — перекрестные помехи и торговля клеточными игроками
Введение
Слизистая оболочка кишечника образует плотный барьер с двумя противоположными функциями. Хотя он избирательно проницаем, позволяя абсорбировать питательные вещества, он также отделяет хозяина от просветных токсинов, антигенов и микробов, которые потенциально способствуют развитию заболевания [см. Обзор в (1)]. При повреждении слизистой оболочки эпителиальный барьер становится неплотным, что способствует транслокации и, следовательно, чрезмерному воздействию кишечных микробных антигенов на более глубокие слои слизистой оболочки.Это может привести к привлечению иммунных клеток, высвобождающих различные цитокины, и может привести к нарушению гомеостаза [подробнее см. В (2, 3)]. Следовательно, регуляция функции эпителиального барьера важна для поддержания гомеостаза слизистой оболочки.
Различные факторы могут потенциально способствовать повреждению слизистой оболочки, включая факторы окружающей среды, лекарства, диету, микробиоту хозяина, инфекции, такие как ВИЧ, а также генетические факторы, такие как полиморфизм в гене CDh2, кодирующем E-кадгерин, что связано с повышенным риском для развития язвенного колита (ЯК) [обзор в (4, 5)].В целом, патогенез нескольких хронических воспалительных заболеваний, включая воспалительные заболевания кишечника (ВЗК), ЯК и болезнь Крона (БК), связан с дисфункциональным кишечным эпителиальным барьером, а также с недостаточным и замедленным заживлением ран слизистой оболочки (6–9). В частности, заживление ран как необходимое условие для восстановления эпителиального барьера слизистой оболочки и гомеостаза кишечника имеет решающее значение для эффективного разрешения воспаления. Следовательно, заживление слизистой оболочки (ЗС) становится все более признанной целью терапии ВЗК для достижения и поддержания длительной ремиссии.Однако восстановление слизистой оболочки и заживление ран — сложные процессы, координируемые динамическими перекрестными помехами различных клеточных игроков, включая эпителиальные клетки и инфильтрирующие иммунные клетки, а также их медиаторы [обзор в (10)], которые все еще не полностью изучены. Поэтому лучшее понимание этих взаимодействий может помочь в разработке тканеспецифичных подходов для ускорения заживления ран и лечения воспаления кишечника.
В следующих параграфах мы рассмотрим современные концепции заживления ран слизистой оболочки кишечника, пролив свет на роль инфильтрирующих иммунных клеток и их взаимодействия с эпителиальными клетками.Наконец, мы подчеркиваем клиническую значимость ЗГ и трансляционных подходов для терапевтического воздействия на этот процесс.
Заживление эпителиальных ран кишечника
Заживление эпителиальных ран кишечника — сложный процесс, модулируемый различными регуляторными пептидами, включая факторы роста (GF) и цитокины. Можно выделить три разные фазы: реституция, пролиферация и дифференциация и созревание. Однако, in vivo , эти процессы сливаются друг с другом и перекрываются [обзор в (11)].
Во-первых, эпителиальные клетки, окружающие рану, быстро мигрируют в обнаженную область, образуют псевдоподиеподобные структуры, реорганизуются, чтобы распространиться в рану, а затем повторно дифференцируются после закрытия раневого дефекта. Этот процесс называется восстановлением эпителия и происходит в течение нескольких минут или часов [см. Обзор (12)]. Интересно, что реституция не зависит от пролиферации клеток, и одним из наиболее важных стимуляторов реституции кишечных эпителиальных клеток (IEC) является трансформирующий фактор роста β (TGF-β) (13-15).Внутри слизистой оболочки кишечника TGF-β продуцируется различными типами клеток, включая эпителиальные клетки, стромальные клетки, регуляторные Т-клетки (T regs) , дендритные клетки (DC) и макрофаги [обзор в (16)]. После активации TGF-β он усиливает реституцию за счет усиления экспрессии матриксной металлопротеиназы-1 (MMP-1), MMP-10 и набора генов, включая Slc28a2, Tubb2a и Cpe, которые преимущественно экспрессируются в IEC плода (17 , 18). Кроме того, медиаторы, такие как фактор роста эндотелия сосудов (VEGF), которые высвобождаются из воспаленной слизистой оболочки, участвуют в миграции эпителиальных клеток TGF-β-зависимым образом (19).Кроме того, было показано, что такие аминокислоты, как гистидин и аргинин, играют важную роль в TGF-β-опосредованной реституции IEC, вероятно, через взаимодействие с передачей сигналов Smad (20). Кроме того, Lopetuso et al. (21) показали, что во время острого разрешенного колита IL-33 / ST2 способствует восстановлению и восстановлению эпителия, индуцируя miR-320. Ранее было продемонстрировано, что miR-320 снижается в контексте воспаления кишечника, предполагая, что это может привести к врожденному дефекту восстановления эпителия (22).Недавно Desmocollin-2 (Dsc2), десмосомальный кадгерин, экспрессируемый исключительно на IECs, был идентифицирован как дополнительный ключевой участник миграции и восстановления IEC in vivo (23).
Чтобы увеличить количество клеток, способных повторно выходить на поверхность раны, необходима пролиферация, которая происходит в течение нескольких часов или дней [обзор в (12)]. Эта фаза преимущественно поддерживается различными GF, такими как эпидермальный фактор роста (EGF), фактор роста кератиноцитов (KGF) и фактор роста фибробластов (FGF) (24–27), а также различные цитокины, включая IL-28, который, как было показано, контролирует пролиферацию IEC путем активации STAT1 (28) и IL-22, который индуцирует передачу сигналов STAT3, важного регулятора иммунного гомеостаза и заживления ран слизистой оболочки кишечника (29).Более того, было показано, что TLR2 подавляет апоптоз IECs in vivo путем избирательной регуляции экспрессии фактора трилистника 3 (TFF) и контроля заживления эпителиальной раны кишечника путем модуляции эпителиального коннексина-43 (30, 31).
Наконец, для восстановления и поддержания барьерной функции слизистой оболочки необходимы дифференцировка и созревание. В нормальных условиях кишечные стволовые клетки (ISC) Lgr5 + , расположенные в основании крипт, дифференцируются в короткоживущие пролиферирующие предшественники, усиливающие транзит, которые далее дифференцируются в абсорбирующие (энтероциты) и секреторные предшественники под контролем. передачи сигналов Wnt / Notch [обзор в (32, 33)].Секреторные предшественники затем развиваются в энтероэндокринные клетки Neurog3-зависимым образом или в клетки Кубка или Панета после активации Atoh2, также известного как Math2. Позже разные типы клеток приобретают свою клон-специфичную экспрессию факторов транскрипции (TFs), таких как Sox9 для клеток Панета и Klf4 для клеток Goblet (34-36). Также стоит упомянуть, что существует две различные популяции ISC: столбчатые клетки основания крипты (CBC), которые активно пролиферируют и резервируют кишечные стволовые клетки (rISC), которые являются покоящимися стволовыми клетками, пока не активируются при повреждении.В соответствии с этим Gonzalez et al. (37) показали, что клетки Hopx + (rISC) устойчивы к повреждению и являются вероятным источником обновления эпителия после длительного ишемического повреждения (37).
Кроме того, взаимодействия хозяина и микробиоты могут существенно влиять на пролиферацию эпителиальных клеток и участвовать в барьерной функции кишечника. Например, короткоцепочечные жирные кислоты (SCFA), продуцируемые комменсальными бактериями, способствуют пролиферации и дифференцировке клеток вдоль оси крипта-ворсинка и, таким образом, способствуют восстановлению эпителия (38).Более того, они также напрямую участвуют в поддержании целостности эпителия, чтобы противодействовать повреждению тканей (39). В дополнение к этим прямым эффектам на эпителиальные клетки, SCFAs также глубоко влияют на дифференцировку Т-клеток слизистой оболочки и индуцируют T regs (40), которые участвуют в заживлении ран слизистой оболочки, как описано ниже. Дополнительные сведения об этой новой области можно найти в других источниках [обзор в (41, 42)].
Другой важный клеточный механизм, который следует рассматривать в контексте заживления кишечных эпителиальных ран, — это эпителиально-мезенхимальный переход (ЭМП).Во время этого процесса эпителиальные клетки теряют некоторые из своих эпителиальных характеристик, такие как полярность и адгезивность, и приобретают миграционные функции и свойства мезенхимальных клеток. Эта трансформация характеризуется взаимодействием различных медиаторов, таких как TF, РНК и белки семейства TGF-β [обзор в (43)]. У пациентов с ВЗК Leeb et al. (44) сообщили о сниженной миграционной способности фибробластов, которые обычно необходимы для сокращения раны во время начальной фазы заживления раны (44, 45).На основании этих результатов можно предположить, что эпителиальные клетки вынуждены подвергаться ЭМП, чтобы компенсировать дисфункцию фибробластов и быстро восстановить барьерную функцию кишечника, что, в свою очередь, может предрасполагать к образованию CD-ассоциированных свищей (46).
Вклад различных типов иммунных клеток в восстановление кишечника и их взаимодействие с эпителиальными клетками
Лимфоциты и врожденные лимфоидные клетки
Цитокины и другие медиаторы, секретируемые различными субпопуляциями Т-клеток, играют важную роль в заживлении ран (см. Рисунок 1).Разнообразные модели травм у мышей (включая модели, сфокусированные на других органах, кроме кишечника, доказательства для которых ограничены) показывают, что истощение T regs во время различных фаз заживления ран приводит к худшему клиническому исходу, что позволяет предположить, что они играют важную роль в регулирование заживления ран, вероятно, путем противодействия провоспалительным стимулам (47–52). Носбаум и др. (53) показали, что T regs в кожных ранах ослабляет продукцию интерферона-γ (IFN-γ) и снижает накопление провоспалительных макрофагов.Их устранение привело к замедленной реэпителизации раны и закрытию раны. Ранее было показано, что IFN-γ влияет на эпителиальные межклеточные соединения и ослабляет закрытие кишечных эпителиальных ран, ингибируя миграцию эпителиальных клеток по β1-интегрин-зависимому механизму (54, 55). Носбаум и др. (53) также смогли показать, что механически T regs индуцировал экспрессию EGFR на раннем этапе после ранения, а клон-специфическая делеция EGFR в regs T приводила к снижению накопления и активации, а также к увеличению накопления провоспалительные макрофаги.Кроме того, есть доказательства того, что FGF2, продуцируемый T regs вместе с IL-17, участвует в регуляции генов для восстановления поврежденного кожного и кишечного эпителия (53, 56). Более того, сообщалось, что CD4 + CD25 + Foxp3 + T regs , выделенные из периферической крови здоровых людей, вызывают фенотипический переход человеческих моноцитов / макрофагов на макрофаги для заживления ран (57). После высвобождения IL-33 из поврежденного эпителия амфирегулин GF является еще одним медиатором, продуцируемым T regs , который участвует в ограничении воспаления и содействует восстановлению эпителия (47, 58).
Рисунок 1 . Вклад некоторых из наиболее важных иммунных клеток в заживление кишечных ран. Циркулирующие иммунные клетки привлекаются к области раны в результате процессов клеточного переноса. После попадания в ткань эти клетки могут подвергаться процессам дифференцировки и секретировать различные медиаторы, которые способствуют или подавляют заживление ран слизистой оболочки (подробности см. В основном тексте).
Другими важными типами клеток, участвующих в заживлении ран слизистой оболочки кишечника, являются Т-хелперные клетки (T H ) и врожденные лимфоидные клетки (ILC).IL-22 продуцируется клетками T H 17 и T H 22, а также ILC группы 3 (ILC3) на слизистых поверхностях и является ключевым медиатором этого процесса [обзор в (59)]. Активируя STAT3, IL-22 может не только ускорять пролиферацию IEC, но также индуцировать экспрессию связанных со слизью молекул и восстановление клеток, продуцирующих слизь (29, 60). В частности, было показано, что IL-22, продуцируемый ILC3 после повреждения кишечника, активирует стволовые клетки кишечника, способствуя регенерации (61).Выше, при повреждении ткани, IL-23 может высвобождаться, что приводит к продукции IL-22 с помощью ILC3 (62). В соответствии с этим, мыши, дефицитные по IL-36γ, мощному индуктору IL-23, показали пониженные уровни IL-22 и не смогли оправиться от острого кишечного повреждения. Это нарушенное восстановление может быть спасено применением экзогенного IL-23 (63).
ILC1 демонстрирует аналогичный паттерн экспрессии цитокинов, что и клетки T H 1, и в основном проявляет свою функцию, секретируя фактор некроза опухоли α (TNF-α) и IFN-γ для набора и активации других воспалительных клеток (64).Как упоминалось выше, IFN-γ также участвует в регуляции целостности эпителиального барьера (54, 55). Таким образом, неудивительно, что истощение интраэпителиальных ILC1 было связано со снижением воспаления проксимального отдела толстой кишки на мышиной модели колита (65).
Напротив, ILC2 продуцируют T H 2-клеточные цитокины, включая IL-4, IL-5, IL-9 и IL-13 [обзор в (66, 67)]. При стимуляции IL-33 и аналогично T regs , ILC2 продуцируют амфирегулин, который, как было показано, способствует регенерации кишечных эпителиальных клеток у мышей, обработанных декстраном натрия сульфатом (DSS) (58).
Кроме того, при заживлении кишечных ран необходимо учитывать γδ Т-клетки, поскольку они являются основным источником KGF в слизистой оболочке. KGF, высвобождаемый интраэпителиальными γδ Т-клетками, важен для поддержания пролиферации кишечных эпителиальных клеток и роста ворсинок, для содействия восстановлению эпителиальных повреждений, а также участвует в дифференцировке эпителиальных клеток (68). Было показано, что у мышей, лишенных γδ Т-клеток, повышена восприимчивость к DSS-индуцированному колиту и снижена способность восстанавливать поврежденный эпителий (69).В соответствии с этим Chen et al. (70) обнаружили, что интраэпителиальные γδ Т-клетки сохраняют целостность поврежденных эпителиальных поверхностей за счет локальной доставки KGF (70, 71).
Нейтрофилы
Нейтрофилы играют решающую роль в первой линии защиты от микробов. Их противомикробные механизмы включают образование внеклеточных ловушек нейтрофилов, называемых «NET» (72), и устранение вторгшихся микробов посредством фагоцитоза, дегрануляции и производства активных форм кислорода (ROS) [обзор в (73)].Эти механизмы необходимы для заживления ран, с одной стороны, предотвращая инфекцию через транслокацию патогенов, а с другой стороны, опосредуя раннюю так называемую воспалительную фазу заживления ран. Рекрутинг нейтрофилов мышей в место кожного повреждения начинается через 4 часа после первоначального повреждения и достигает пика через 18 часов (74). Было показано, что истощение нейтрофилов в поврежденной слизистой оболочке приводит к более тяжелому колиту, а также к нарушению восстановления и восстановления целостности эпителия (75–77).Кроме того, было показано, что нейтрофилы усиливают продукцию амфирегулина IEC, способствуя барьерной функции эпителия и восстановлению тканей (75). Другой механизм, влияющий на ранозаживляющие свойства нейтрофилов, — это их способность создавать гипоксическое микроокружение внутри поврежденной ткани за счет продукции АФК, что, в свою очередь, приводит к стабилизации HIF-1α в слизистой оболочке кишечника (78). Было показано, что HIF-1α усиливает эпителиальную экспрессию TFF3, который выполняет барьерно-защитную функцию (79).Кроме того, HIF-1α как TF способствует активации генов, участвующих в заживлении ран, включая адгезионные белки, различные GF и компоненты внеклеточного матрикса [обзор в (80)]. Более того, нейтрофилы продуцируют IL-22 и IL-23, которые, как упоминалось выше, являются важными медиаторами заживления ран (77, 81, 82).
Однако нейтрофилы также могут оказывать негативное влияние на заживление ран. Например, было показано, что противодействие alarmin HMGB1 приводит к уменьшению образования NET, что приводит к улучшенному заживлению ран, а ингибирование NETosis улучшает заживление ран у мышей с диабетом (83).Кроме того, накопление двухцепочечных разрывов в слизистой оболочке, вызванное нейтрофилами, привело к нарушению заживления ран и геномной нестабильности (84). Таким образом, влияние нейтрофилов на этот процесс можно рассматривать как палку о двух концах.
Моноциты и макрофаги
Циркулирующие моноциты быстро привлекаются к участкам повреждения ткани или инфекции, где они далее дифференцируются в воспалительные M1-подобные макрофаги или ранозаживляющие M2-подобные макрофаги. Хотя эта классификация использовалась для объяснения многих экспериментальных наблюдений, тем временем она рассматривается как чрезмерное упрощение (85).
Хотя уровень экспрессии CD16 и CD14 можно использовать для дифференциации трех разных субпопуляций моноцитов у людей, они делятся на две субпопуляции на основе их поверхностной экспрессии Ly6C и / или CX3CR1 у мышей (86, 87). Было показано, что моноциты Ly6C hi более доминируют в ранней воспалительной фазе, проявляя фагоцитарную и воспалительную функции, тогда как моноциты Ly6C low доминируют на более поздней фазе, проявляя противовоспалительные свойства и способствуя заживлению (88).Поддерживающая роль макрофагов для барьерной функции была продемонстрирована их способностью увеличивать трансэпителиальное электрическое сопротивление и высоту клеток монослоев энтероидов (89). Истощение макрофагов в различных моделях мышей привело к серьезным изменениям морфологии ран, замедленной реэпителизации, уменьшению отложения коллагена, нарушению ангиогенеза и уменьшению пролиферации клеток в заживающих ранах (90, 91). Из-за своей неоднородности макрофаги играют важную роль на всех этапах заживления ран.Более конкретно, истощение после воспалительной фазы увеличивало повреждение и замедляло регенерацию, в то время как истощение в ранней воспалительной фазе значительно снижало образование васкуляризированной грануляционной ткани, нарушало эпителизацию, но также приводило к уменьшению образования рубцов в почках и коже (92, 93). Как упоминалось выше, IL-23 является важным медиатором заживления ран, и макрофаги были идентифицированы как основной источник этого цитокина (94). Кроме того, высвобождение IL-10 макрофагами приводит к пролиферации эндотелиальных клеток и активации эпителиальных пролиферативных путей в кишечнике (95).Интересно, что моноциты и макрофаги экспрессируют практически все известные коллаген и связанные с коллагеном мРНК, что важно для фазы ремоделирования при заживлении ран (96). Макрофаги также влияют на другие иммунные клетки, например, индуцируя дифференцировку Foxp3 + T regs в собственной пластинке (97).
Поляризация макрофагов по фенотипу заживления ран важна для процессов восстановления и регулируется различными медиаторами. Было показано, что блокада IL-1β стимулирует образование M2-подобных макрофагов у мышей с диабетом, а IL-33 значительно ускоряет заживление кишечных ран, способствуя фенотипу M2 (98, 99).Более того, STAT6-опосредованная поляризация M2 способствовала репарации у мышей, обработанных 2,4,6-тринитробензолсульфоновой кислотой (TNBS), посредством активации пути передачи сигнала Wnt (100). Кроме того, IL-4 или IL-13 в сочетании с апоптозными клетками способны активировать макрофаги для заживления ран. В отсутствие апоптотических сигналов пролиферация тканевых макрофагов, индукция противовоспалительных генов и генов восстановления тканей нарушаются после индукции колита (101). Недавно было показано, что Fpr2 / 3, который экспрессируется эпителиальными клетками, регулирует миграцию моноцитов к участкам повреждения слизистой оболочки, а CX3CR1 важен для накопления макрофагов в ране (102).
Однако моноциты и макрофаги также могут оказывать негативное влияние на эпителиальный барьер. Мононуклеарные фагоциты взаимодействуют с IEC с помощью E-кадгерина, что приводит к дисрегуляции дифференцировки эпителиальных клеток и воспалению кишечника за счет нарушения гомеостаза слизистой оболочки (103, 104). В соответствии с этим было высказано предположение, что комбинация паракринной и гетероклеточной коммуникации между IECs и макрофагами играет ключевую роль в регуляции функции эпителиальных клеток и нарушении регуляции кишечного эпителиального барьера (105).Sablet et al. продемонстрировали, что воспалительные моноциты способствуют потере функции кишечного барьера во время криптоспоридиоза, продуцируя TNF-α и IL-1β (106).
В совокупности макрофаги играют решающую роль во многих аспектах заживления кишечных ран. В зависимости от их поляризации и фазы заживления раны они могут либо способствовать закрытию раны, либо предрасполагать к нарушению регуляции ЗГ.
Торговля клетками в контексте заживления ран слизистой оболочки кишечника
Поскольку все иммунные клетки, обсуждаемые в рамках этого обзора, являются циркулирующими клетками или потомками таких клеток, существует очевидная потребность в перемещении этих эффекторов для достижения места поражения.Таким образом, перенос клеток следует рассматривать как неотъемлемую часть процессов заживления ран, и мы вкратце рассмотрим его здесь.
Более подробно описанный в другом месте, перенос клеток описывает все процессы, которые вовлечены в локализацию клеток и, следовательно, включают клеточный приток, удержание в эффекторных тканях и выход из них [как описано в (3, 107)]. Приток из кровотока регулируется жестко контролируемым многоступенчатым каскадом адгезии. В качестве предварительного условия для трансмиграции через эндотелий взаимодействие селектинов и их соответствующих лигандов на эндотелиальных клетках привлекает циркулирующие клетки к стенкам сосудов высоких эндотелиальных венул (HEV), что приводит к перекатыванию и снижению скорости (108).Это замедление увеличивает доступность циркулирующих клеток для хемотаксических стимулов, особенно для хемокинов, тем самым обеспечивая индуцированные хемокинами конформационные изменения гетеродимерных интегринов. Активированные интегрины способны прочно связываться с молекулами адгезии эндотелиальных клеток, что приводит к остановке циркулирующих клеток на стенке сосуда и последующей пара- или внутриклеточной трансмиграции и инвазии ткани-мишени (109).
Что касается хоминга в кишечнике, ось молекулы 1 адгезии клеток 1 (MAdCAM-1) интегрина α4β7-адгезии сосудов слизистой оболочки (MAdCAM-1) была идентифицирована как важная из-за практически исключительной экспрессии MAdCAM-1 на HEV в кишечном тракте (110).Релевантность этой оси для заживления кишечных ран была недавно продемонстрирована, поскольку лечение мышей антителами против α4β7 на модели раны толстой кишки привело к нарушению закрытия кишечной раны, скорее всего, из-за уменьшения хоминга неклассических моноцитов (NCM) и уменьшения раневых макрофагов, полученных из NCM (111). Кроме того, кишечная специфичность в процессах доставки может быть обеспечена исключительной экспрессией хемокинов в кишечнике, как, например, лиганд CCR9 CCL25 и лиганд GPR15 в тонком и толстом кишечнике, соответственно (112, 113).Их участие в рекрутировании клеток в кишечные раны до сих пор не изучено и требует дальнейшего выяснения. Интересно, что и α4β7, и CCR9 индуцируются на Т-клетках кишечника посредством ретиноевой кислоты (RA), продуцируемой дендритными клетками в ассоциированной с кишечником лимфоидной ткани. Что касается ILC, было показано, что это имеет место только для ILC1 и ILC3, тогда как экспрессия α4β7 на ILC2 происходит независимо от RA и уже индуцируется в костном мозге (114). В связи с вышеупомянутой ролью ILC в заживлении ран, есть соблазн предположить, что это может привести к постоянному возвращению в кишечник секретирующих амфирегулин ILC2, способствующих гомеостазу, в то время как рекрутирование ILC3 может регулироваться уровнем имеющегося воспаления.Однако трудно представить себе последствия для заживления ран, поскольку ILC3 не только способствуют восстановлению слизистой оболочки посредством IL-22, но также могут способствовать воспалению и, таким образом, вторичному повреждению тканей (115).
Удержание домашних клеток в тканях-мишенях контролируется либо косвенно, регуляцией рецепторов исходящего сигнала, либо прямым закреплением в тканевых структурах. Ключевым примером непрямого удержания является взаимодействие CD69 со сфингозин-1-фосфатным рецептором-1 (S1PR1), приводящее к деградации последнего и ингибированию экстравазации по градиенту S1P в кровоток (116, 117).Дальнейшие сигналы экстравазации могут быть обеспечены взаимодействием CCR7 и CCL19 или CCL21, облегчая рекрутирование несущих рецептор клеток в лимфатическую систему (118, 119). Прямое закрепление рекрутированных клеток может быть обеспечено взаимодействием интегринов с молекулами клеточной адгезии в ткани. Например, αE-интегрин (CD103) димеризуется с β7-интегрином и опосредует удержание в ткани посредством взаимодействия с E-кадгерином (120, 121). Хотя задержка клеток в области раны или их рециркуляция в кровь, безусловно, будет иметь значение для пространственно-временной координации процесса заживления ран, поскольку это может привести к накоплению или сокращению популяций клеток, способствующих или препятствующих восстановлению, эти механизмы кишечника специально не исследовались в этом контексте.Однако, что интересно, на моделях кожи есть доказательства того, что резидентные Т-клетки памяти (клетки T RM ), которые играют важную роль в патогенезе ВЗК (122), способствуют заживлению эпителиальных ран (123, 124).
Также стоит упомянуть, что профили цитокинов слизистой оболочки при БК и ЯК различаются. В то время как в UC преобладают ассоциированные с T H 2 цитокины, такие как IL-5, IL-13, IL-9 и IL-4 (125–129), CD маркируется цитокинами, такими как IFN-γ и IL- 2, ассоциированный с фенотипом T H 1 (125, 130).Клетки и цитокины T H 17, по-видимому, участвуют в обоих образованиях (131). В то же время существуют макроскопические различия в изъязвлениях между БК и ЯК (132), и паттерны воспаления между БК и ЯК различаются инфильтрацией иммунных клеток, ограниченной слизистой оболочкой толстой кишки при ЯК, но трансмуральной и потенциально возможной во всем желудочно-кишечном тракте. в CD [обзор в (133)]. Это убедительно свидетельствует о том, что к иммунным клеткам при БК и ЯК применяются разные механизмы самонаведения, которые также могут влиять на заживление ран.Интересно, что наблюдались различия в экспрессии маркеров самонаведения кишечника на разных субпопуляциях Т-клеток и различное использование путей самонаведения кишечника при БК подвздошной кишки по сравнению с ЯК толстой кишки [обзор в (134, 135)]. Однако для более глубокого изучения этого предположения необходимы дальнейшие специализированные исследования.
В совокупности последствия иммунного трафика для заживления кишечных ран очевидны. В частности, их необходимо рассматривать в терапевтическом контексте, особенно когда механизмы трафика напрямую управляются антителами.Это также подчеркивает необходимость дальнейшего исследования механизмов трафика, участвующих в заживлении кишечных ран.
Клиническая значимость лечения слизистых оболочек и терапевтические подходы
Заживление слизистой оболочки (ЗС), термин, введенный Трулавом и Уиттсом в 1955 г. (136), в настоящее время считается важной конечной точкой исследования и все более важной целью лечения ВЗК. Несколько клинических испытаний показали важность и улучшение клинических результатов после достижения ЗГ, определяемого как отсутствие или слабые признаки повреждения слизистой оболочки при эндоскопии (137–141).При ЯК и БК это связано с длительной ремиссией и снижением потребности в хирургическом вмешательстве (142, 143). На тканевом уровне и механически очевидно, что заживление ран и восстановление функции кишечного эпителиального барьера являются основными шагами в достижении ЗГ. Следовательно, содействие заживлению ран было предложено в качестве потенциального терапевтического инструмента (144). Кальпротектин — это растворимый белок в цитозоле нейтрофилов, уровень которого, как известно, повышен как в слизистой оболочке кишечника, так и в кале пациентов с ВЗК (145).Несколько исследований показали корреляцию между низкой концентрацией кальпротектина (ФК) в кале и гистологической ремиссией, а также ЗГ у пациентов с ЯК и БК. Следовательно, низкие уровни кальпротектина могут быть ранним предиктором терапевтического успеха с точки зрения ЗГ (146, 147).
Одним из экспериментальных подходов к достижению заживления ран, который рассматривался в нескольких исследованиях, но не в кишечнике, было стимулирование рекрутирования и поляризации моноцитов и макрофагов заживления ран (148, 149). Маруяма и его коллеги (150) показали, что после инъекции IL-1β-активированных макрофагов мышам продукция VEGF-C увеличивалась, а заживление кожных ран улучшалось.Интересно, что одним из механизмов действия кортикостероидов является подавление макрофагов M1 в ответ на стимуляцию LPS, в которой участвует miR-155 (151). Более того, нейтрофилы как клеточные медиаторы могут быть нацелены. В контексте перитонита Norling et al. (152) показали, что наночастицы, содержащие вызываемый аспирином резольвин D1 или аналог липоксина A4, снижают приток полиморфно-ядерных клеток и улучшают заживление ран. Поскольку разные GFs, такие как EGF, VEGF и KGF, опосредуют восстановление эпителия, они также могут быть интересными кандидатами [rev. (153)].Другой многообещающий терапевтический подход — нацеливание на IL-22, который, как считается, способствует целостности эпителия посредством STAT3. Следовательно, слитый белок IL-22 IgG4 Fc (UTTR1147A) в настоящее время тестируется на пациентах с умеренным и тяжелым ЯК и БК (идентификатор ClinicalTrials.gov: NCT03558152, NCT03650413).
В дополнение к этим экспериментальным концепциям было показано, что несколько современных методов лечения ВЗК обладают защитным или регенеративным эффектом на поврежденный эпителий и способствуют развитию ЗГ [обзор в (154)].Аминосалицилаты не только влияют на воспаление кишечника через различные сигнальные пути, такие как NF-κB, но также напрямую стимулируют заживление эпителиальных ран, усиливая реституцию и пролиферацию эпителиальных клеток (155–157). Антитела против TNF-α, такие как инфликсимаб и адалимумаб, способны индуцировать и поддерживать ЗГ (144, 158–160) за счет ограничения воспалительного инфильтрата и пролиферации Т-клеток в собственной пластинке слизистой оболочки, а также за счет подавления экспрессии металлопротеиназ и провоспалительных молекул. (161).Для инфликсимаба описан однонуклеотидный полиморфизм в гене TRAP1, связанный с ЗГ у пациентов с БК (162). Более того, антитела против TNF-α поддерживают регенеративные процессы, уменьшая воспаление, восстанавливая барьерную функцию кишечника, секрецию слизистой оболочки и активируя фибробласты (163). Кроме того, было высказано предположение, что эти антитела опосредуют Fc-зависимую индукцию макрофагов для заживления ран. Было показано, что инфликсимаб, как и адалимумаб, может вызывать заживление ран макрофагами in vitro и in vivo (164, 165).Точно так же устекинумаб, моноклональное антитело, направленное против IL-12 и IL-23, успешно индуцировало ЗГ у пациентов с БК (166).
Поскольку путь JAK / STAT, по-видимому, играет важную роль во взаимодействии лимфоцитов и IEC через различные цитокины, неудивительно, что тофацитиниб, ингибитор JAK, обычно используемый при лечении ЯК, способен индуцировать и поддерживать MH ( 167). Lechner et al. (168) недавно продемонстрировали, что тофацитиниб специфически снижает провоспалительные цитокины, которые продуцируются Т-клетками собственной пластинки, и влияет на их потенциал самонаведения, подавляя экспрессию поверхностного интегрина на Т-клетках.Однако в экспериментальной модели раны слизистой оболочки кишечника высокие концентрации тофацитиниба довольно продолжали заживление ран (168), что требует дальнейших трансляционных исследований, чтобы согласовать его с клиническими исходами.
Другой важный класс терапевтических средств против ВЗК — это агенты против незаконного оборота [обзор в (3)]. Ведолизумаб, гуманизированное моноклональное антитело против α4β7, ингибирует связывание и последующую миграцию лимфоцитов в кишечник (169). Исследование GEMINI I показало, что значительно больше пациентов с ЯК, получавших ведолизумаб, чем плацебо, достигли ЗГ (140, 170).Однако механистические данные, объясняющие влияние ведолизумаба на перенос клеток, участвующих в заживлении ран при воспалении, пока отсутствуют. Таким образом, неясно, является ли это прямым эффектом или вторичным результатом уменьшения воспаления и связанных с ним изменений баланса клеток, способствующих и противодействующих восстановлению слизистой оболочки. В отличие от данных о ЗГ как конечной точке исследования, оценивающей контроль воспаления, в нескольких (но не во всех) исследованиях сообщалось, что пациенты, получавшие ведолизумаб, более уязвимы к послеоперационным осложнениям (171–176).Возможное объяснение может заключаться в том, что, согласно недавнему исследованию нашей группы, блокирование α4β7 нарушает самонаведение NCM в кишечнике, что было связано с задержкой заживления ран и уменьшением перилезионного присутствия макрофагов для заживления ран (111). Важно отметить, что это не обязательно противоречит упомянутым данным ЗГ, поскольку это исследование рассматривало исключительно экзогенное повреждение ткани в отсутствие воспаления, и вполне вероятно, что продолжающееся воспаление будет существенно модулировать пути передачи, коммуникации и передачи сигналов.
В совокупности почти все доступные методы лечения ВЗК продемонстрировали свой потенциал индуцировать ЗГ, хотя неясно, в какой степени это является результатом прямого воздействия на процессы заживления ран или вторичного эффекта уменьшения воспаления. Таким образом, необходимы дополнительные механистические данные и дополнительные усилия для непосредственного содействия заживлению ран и целостности барьера в контексте ВЗК.
Заключительные замечания
Заживление ран слизистой оболочки кишечника — ключевые шаги для достижения и поддержания ЗГ, что связано с благоприятными клиническими результатами.Однако взаимодействие, а также характеристики транспортировки наиболее важных клеточных медиаторов, таких как лимфоциты, нейтрофилы и моноциты / макрофаги, недостаточно охарактеризованы. Необходимы дальнейшие исследования, чтобы лучше понять вклад переноса клеток в заживление ран слизистой оболочки и основать целевые терапевтические подходы на этом процессе.
Авторские взносы
Рукопись написалиKS, MW, TM, KH и SZ. Все авторы критически отредактировали рукопись и одобрили окончательную версию.
Финансирование
Исследование MN и SZ было поддержано Междисциплинарным центром клинических исследований (IZKF) и программой ELAN Университета Эрланген-Нюрнберг, Else Kröner-Fresenius-Stiftung, Fritz Bender-Stiftung, Dr. Robert Pfleger Stiftung , Litwin IBD Pioneers Initiative Американского фонда Крона и колита (CCFA), Фонда Кеннета Рейнина, Научно-исследовательского фонда Эрнста Юнга, Немецкого фонда Крона и колита (DCCV) и Немецкого исследовательского фонда (DFG) через индивидуальные гранты (ZU 377 / 4-1) и Центры совместных исследований TRR241, 643, 796 и 1181.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Deutsche Forschungsgemeinschaft и Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) за поддержку в рамках программы финансирования Open Access Publishing.
Список литературы
1. Аллер Дж. М., Кроули С. М., Ло Х. Т., Чанг С. Ю., Ко Х. Дж., Валланс Б. А..Кишечный эпителий: центральный координатор иммунитета слизистых оболочек. Тенденции Иммунол . (2018) 39: 677–96. DOI: 10.1016 / j.it.2018.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Зундлер С., Беккер Э., Шульце Л.Л., Нейрат М.Ф. Перенос и удержание иммунных клеток при воспалительном заболевании кишечника: механистические идеи и терапевтические достижения. Кишечник . (2019) 68: 1688–700. DOI: 10.1136 / gutjnl-2018-317977
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Pearson AD, Eastham EJ, Laker MF, Craft AW, Nelson R. Кишечная проницаемость у детей с болезнью Крона и целиакией. Br Med J (Clin Res Ed) . (1982) 285: 20–1. DOI: 10.1136 / bmj.285.6334.20
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Ирвин Э. Дж., Маршалл Дж. К. Повышенная кишечная проницаемость предшествует началу болезни Крона у субъекта с семейным риском. Гастроэнтерология . (2000) 119: 1740–4. DOI: 10.1053 / gast.2000.20231
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Холландер Д., Вадхейм С.М., Бреттхольц Э., Петерсен Г.М., Делаханти Т., Роттер Дж. И.. Повышенная кишечная проницаемость у пациентов с болезнью Крона и их родственников. Возможный этиологический фактор. Энн Интерн Мед. . (1986) 105: 883–5. DOI: 10.7326 / 0003-4819-105-6-883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Münch A, Söderholm JD, Ost A, Ström M. Повышенное проникновение E.coli K12 при коллагенозном колите сохраняется после лечения будесонидом. Ам Дж. Гастроэнтерол . (2009) 104: 679–85. DOI: 10.14309 / 00000434-2000-00028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Дигнасс А.Ю., Баумгарт Д.К., Штурм А. Обзорная статья: этиопатогенез воспалительного заболевания кишечника — иммунология и механизмы восстановления. Алимент Фармакол Тер . (2004) 4 (Дополнение 20): 9–17. DOI: 10.1111 / j.1365-2036.2004.02047.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Бассон, доктор медицины, Модлин И.М., Флинн С.Д., Йена Б.П., Мадри Дж.А. Независимая модуляция миграции и пролиферации энтероцитов факторами роста, матриксными белками и фармакологическими агентами в модели заживления слизистой оболочки in vitro. Хирургия . (1992) 112: 299–307.
PubMed Аннотация | Google Scholar
14. Дигнасс А.У., Подольский ДК. Цитокиновая модуляция реституции кишечных эпителиальных клеток: центральная роль трансформирующего фактора роста бета. Гастроэнтерология . (1993) 105: 1323–32.DOI: 10.1016 / 0016-5085 (93)
-ZPubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Бек П.Л., Розенберг И.М., Ксавьер Р.Дж., Кох Т., Вонг Дж.Ф., Подольский Д.К. Трансформирующий фактор роста-бета опосредует заживление кишечника и восприимчивость к травмам in vitro, и in vivo, , через эпителиальные клетки. Ам Дж. Патол . (2003) 162: 597–608. DOI: 10.1016 / S0002-9440 (10) 63853-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Шен Й, Чжан С., Чен Ю. TGF-β при воспалительных заболеваниях кишечника: рассказ о янусоподобном цитокине. Crit Rev Eukaryot Gene Expr . (2015) 25: 335–47. DOI: 10.1615 / CritRevEukaryotGeneExpr.2015013974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Salmela MT, Pender SL, Karjalainen-Lindsberg ML, Puolakkainen P, Macdonald TT, Saarialho-Kere U. Коллагеназа-1 (MMP-1), матрилизин-1 (MMP-7) и стромелизин-2 (MMP- 10) экспрессируются мигрирующими энтероцитами во время заживления кишечной раны. Сканд Дж Гастроэнтерол . (2004) 39: 1095–104. DOI: 10.1080 / 00365520410003470
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Анзай С., Кавамото А., Нагата С., Такахаши Дж., Кавай М., Куно Р. и др. TGF-β способствует экспрессии генов плода и скорости миграции клеток в модели заживления ран нетрансформированных эпителиальных клеток кишечника. Биохимия Биофиз Рес Коммуна . (2020) 524: 533–41. DOI: 10.1016 / j.bbrc.2020.01.108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Bulut K, Pennartz C, Felderbauer P, Ansorge N, Banasch M, Schmitz F и др. Фактор роста эндотелия сосудов (VEGF164) уменьшает повреждение эпителия кишечника in vitro в монослоях IEC-18 и Caco-2 за счет индукции высвобождения TGF-бета из эпителиальных клеток. Сканд Дж Гастроэнтерол . (2006) 41: 687–92. DOI: 10.1080 / 00365520500408634
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Мацуи Т., Итикава Х., Фудзита Т., Такемура С., Такаги Т., Осада-Ока М. и др.Гистидин и аргинин модулируют восстановление клеток кишечника посредством трансформации фактора роста-β (1). Eur J Pharmacol . (2019) 850: 35–42. DOI: 10.1016 / j.ejphar.2019.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Лопетузо Л. Р., Де Сальво С., Пасторелли Л., Рана Н., Сенкфор Н. Н., Петито В. и др. IL-33 способствует выздоровлению от острого колита, индуцируя miR-320 для стимуляции восстановления и восстановления эпителия. Proc Natl Acad Sci U S A . (2018) 115: E9362 – e9370.DOI: 10.1073 / pnas.1803613115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Пьердоменико М., Чези В., Куккьяра С., Витали Р., Прете Е., Костанцо М. и др. NOD2 регулируется Мир-320 в физиологических условиях, но этот контроль изменяется в воспаленных тканях пациентов с воспалительным заболеванием кишечника. Воспаление кишечника . (2016) 22: 315–26. DOI: 10.1097 / MIB.0000000000000659
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Флемминг С., Луиссин А.С., Д.Кастерс Х.М., Рая-Сандино А., Фан С., Чжоу Д.В. и др. Десмоколлин-2 способствует восстановлению слизистой оболочки кишечника, контролируя интегрин-зависимую адгезию и миграцию клеток. Клетка Mol Biol . (2020) 31: 407–18. DOI: 10.1091 / mbc.E19-12-0692
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Дизе Р.С., Фрей М.Р., Уайтхед Р.Х., Полк Д.Б. Эпидермальный фактор роста стимулирует активацию Rac через Src и фосфатидилинозитол-3-киназу, что способствует миграции эпителиальных клеток толстой кишки. Am J Physiol Gastrointest Liver Physiol . (2008) 294: G276–85. DOI: 10.1152 / ajpgi.00340.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Grotendorst GR, Soma Y, Takehara K, Charette M. EGF и TGF-alpha являются сильнодействующими хемоаттрактантами для эндотелиальных клеток, а EGF-подобные пептиды присутствуют в местах регенерации тканей. Дж. Клеточная физиология . (1989) 139: 617–23. DOI: 10.1002 / jcp.10413
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Brown GL, Curtsinger L 3rd, Brightwell JR, Ackerman DM, Tobin GR, Polk HC Jr, et al. Усиление регенерации эпидермиса за счет биосинтетического фактора роста эпидермиса. J Exp Med . (1986) 163: 1319–24. DOI: 10.1084 / jem.163.5.1319
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Чжэн З., Кан Х.Й., Ли С., Кан С.В., Гу Би, Чо С.Б. Повышающая регуляция экспрессии фактора роста фибробластов (FGF) 9 и передачи сигналов FGF-WNT / β-катенин при лазерно-индуцированном заживлении ран. Регенерация для восстановления ран .(2014) 22: 660–5. DOI: 10.1111 / wrr.12212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Chiriac MT, Buchen B, Wandersee A, Hundorfean G, Günther C., Bourjau Y, et al. Активация эпителиального преобразователя сигнала и активатора транскрипции 1 интерлейкином 28 контролирует заживление слизистой оболочки у мышей с колитом и увеличивается в слизистой оболочке пациентов с воспалительным заболеванием кишечника. Гастроэнтерология . (2017) 153: 123–38.e8. DOI: 10.1053 / j.gastro.2017.03.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Пикерт Г., Нойферт С., Леппкес М., Чжэн И., Витткопф Н., Варнтьен М. и др. STAT3 связывает передачу сигналов IL-22 в эпителиальных клетках кишечника с заживлением ран слизистой оболочки. J Exp Med . (2009) 206: 1465–72. DOI: 10.1084 / jem.20082683
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Ey B, Eyking A, Gerken G, Podolsky DK, Cario E. TLR2 опосредует межклеточную коммуникацию щелевого соединения через коннексин-43 при повреждении кишечного эпителиального барьера. Дж. Биол. Хим. . (2009) 284: 22332–43. DOI: 10.1074 / jbc.M9200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Подольский Д.К., Геркен Г., Эйкинг А., Карио Э. Вариант TLR2, связанный с колитом, вызывает нарушение восстановления слизистой оболочки из-за дефицита TFF3. Гастроэнтерология . (2009) 137: 209–20. DOI: 10.1053 / j.gastro.2009.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Санман Л. Е., Чен И. В., Бибер Дж. М., Стери В., Трентезо С., Ханн Б. и др.Клетки, усиливающие транзит, координируют изменения клеточного состава кишечного эпителия. Ячейка разработчика . (2021) 56: 356–65.e9. DOI: 10.1016 / j.devcel.2020.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Дженни М., Уль К., Рош С., Дулюк И., Гильермин В., Гиймо Ф. и др. Нейрогенин3 по-разному необходим для спецификации судьбы эндокринных клеток в кишечном и желудочном эпителии. Эмбо J . (2002) 21: 6338–47. DOI: 10.1093 / emboj / cdf649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Мори-Акияма Й., ван ден Борн М., ван Эс Дж. Х., Гамильтон С. Р., Адамс Х. П., Чжан Дж. И др. SOX9 необходим для дифференцировки клеток панета в эпителии кишечника. Гастроэнтерология . (2007) 133: 539–46. DOI: 10.1053 / j.gastro.2007.05.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Кац Дж. П., Перро Н., Гольдштейн Б. Г., Ли К. С., Лабоски П. А., Ян В. В. и др. Фактор транскрипции «цинковые пальцы» Klf4 необходим для терминальной дифференцировки бокаловидных клеток толстой кишки. Развитие . (2002) 129: 2619–28.
PubMed Аннотация | Google Scholar
37. Гонсалес Л.М., Стюарт А.С., Фройнд Дж., Кучера С.Р., Декани С.М., Магнесс С.Т. и др. Сохранение резервных эпителиальных стволовых клеток кишечника после тяжелого ишемического повреждения. Am J Physiol Gastrointest Liver Physiol . (2019) 316: G482 – g494. DOI: 10.1152 / ajpgi.00262.2018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Парк Дж. Х., Котани Т., Конно Т., Сетиаван Дж., Китамура Ю., Имада С. и др.Содействие обновлению кишечных эпителиальных клеток комменсальными бактериями: роль короткоцепочечных жирных кислот. PLOS ONE . (2016) 11: e0156334. DOI: 10.1371 / journal.pone.0156334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Келли С.Дж., Чжэн Л., Кэмпбелл Е.Л., Саиди Б., Шольц С.К., Бейлесс А.Дж. и др. Перекрестное взаимодействие между короткоцепочечными жирными кислотами, полученными из микробиоты, и HIF кишечного эпителия усиливает барьерную функцию ткани. Клеточный микроб-хозяин .(2015) 17: 662–71. DOI: 10.1016 / j.chom.2015.03.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Арпайя Н., Кэмпбелл С., Фан Х, Дикий С., ван дер Викен Дж., ДеРоос П. и др. Метаболиты, продуцируемые комменсальными бактериями, способствуют образованию периферических регуляторных Т-клеток. Природа . (2013) 504: 451–5. DOI: 10.1038 / природа12726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Каяма Х, Окумура Р., Такеда К. Взаимодействие между микробиотой, эпителием и иммунными клетками в кишечнике. Анну Рев Иммунол . (2020) 38: 23–48. DOI: 10.1146 / аннурев-иммунол-070119-115104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Leeb SN, Vogl D, Gunckel M, Kiessling S, Falk W., Göke M, et al. Снижение миграции фибробластов при воспалительном заболевании кишечника: роль медиаторов воспаления и киназы очаговой адгезии. Гастроэнтерология . (2003) 125: 1341–54. DOI: 10.1016 / j.gastro.2003.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Батай Ф., Рормайер С., Бейтс Р., Вебер А., Ридер Ф., Бренмель Дж. И др. Доказательства роли эпителиального мезенхимального перехода в патогенезе свищей при болезни Крона. Воспаление кишечника . (2008) 14: 1514–27. DOI: 10.1002 / ibd.20590
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Бурзин Д., Кусванто В., Колодин Д., Шадрах Дж. Л., Черлетти М., Янг Ю. и др. Особая популяция регуляторных Т-клеток усиливает восстановление мышц. Ячейка .(2013) 155: 1282–95. DOI: 10.1016 / j.cell.2013.10.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Ито М., Комай К., Мисе-Омата С., Иидзука-Кога М., Ногучи Ю., Кондо Т. и др. Регулирующие Т-клетки мозга подавляют астроглиоз и усиливают неврологическое восстановление. Природа . (2019) 565: 246–50. DOI: 10.1038 / s41586-018-0824-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Кинси Г.Р., Шарма Р., Хуанг Л., Ли Л., Вергис А.Л., Йе Х. и др.Регуляторные Т-клетки подавляют врожденный иммунитет при ишемии-реперфузии почек. Дж. Ам Соц Нефрол . (2009) 20: 1744–53. DOI: 10.1681 / ASN.2008111160
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Weirather J, Hofmann UD, Beyersdorf N, Ramos GC, Vogel B, Frey A, et al. Foxp3 + CD4 + Т-клетки улучшают заживление после инфаркта миокарда, модулируя дифференцировку моноцитов / макрофагов. Circ Res . (2014) 115: 55–67. DOI: 10.1161 / CIRCRESAHA.115.303895
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Шарир Р., Семо Дж., Шимони С., Бен-Мордехай Т., Ланда-Рубен Н., Мэйсель-Ауслендер С. и др. Экспериментальный инфаркт миокарда вызывает измененный гемостаз регуляторных Т-клеток, а адоптивный перенос ослабляет последующее ремоделирование. PLOS ONE . (2014) 9: e113653. DOI: 10.1371 / journal.pone.0113653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Вильялта С.А., Розенталь В., Мартинес Л., Каур А., Спарвассер Т., Тидболл Дж. Г. и др.Регуляторные Т-клетки подавляют мышечные воспаления и травмы при мышечной дистрофии. Научный перевод медицины . (2014) 6: 258ra142. DOI: 10.1126 / scitranslmed.3009925
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Носбаум А., Превел Н., Чыонг Х.А., Мехта П., Эттингер М., Шаршмидт Т.С. и др. Передний край: регуляторные Т-клетки способствуют заживлению кожных ран. Дж. Иммунол . (2016) 196: 2010–4. DOI: 10.4049 / jimmunol.1502139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54.Тонг Q, Васильева Е.В., Иванов А.И., Ван З., Браун Г.Т., Parkos CA и др. Интерферон-гамма подавляет миграцию эпителиальных клеток Т84, перенаправляя трансцитоз интегрина бета1 с переднего края миграции. Дж. Иммунол . (2005) 175: 4030–8. DOI: 10.4049 / jimmunol.175.6.4030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Брювер М., Люгеринг А., Кухарзик Т., Паркос Калифорния, Мадара Д.Л., Хопкинс А.М. и др. Провоспалительные цитокины нарушают функцию эпителиального барьера с помощью механизмов, не зависящих от апоптоза. Дж. Иммунол . (2003) 171: 6164–72. DOI: 10.4049 / jimmunol.171.11.6164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Сонг Х, Дай Д., Хэ Икс, Чжу С., Яо Й, Гао Х и др. Фактор роста FGF2 взаимодействует с интерлейкином-17 для восстановления повреждений эпителия кишечника. Иммунитет . (2015) 43: 488–501. DOI: 10.1016 / j.immuni.2015.06.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Тимессен М.М., Джаггер А.Л., Эванс Х.Г., ван Хервейнен М.Дж., Джон С., Таамс Л.С.CD4 + CD25 + Foxp3 + регуляторные Т-клетки индуцируют альтернативную активацию человеческих моноцитов / макрофагов. Proc Natl Acad Sci U S A . (2007) 104: 19446–51. DOI: 10.1073 / pnas.0706832104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Монтичелли Л.А., Осборн Л.К., Ноти М., Тран С.В., Заисс Д.М., Артис Д. IL-33 способствует врожденному иммунному пути защиты кишечной ткани, зависящему от взаимодействий амфирегулин-EGFR. Proc Natl Acad Sci U S A . (2015) 112: 10762–7.DOI: 10.1073 / pnas.15012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Сугимото К., Огава А., Мидзогути Е., Шимомура Ю., Андох А., Бхан А. К. и др. IL-22 уменьшает воспаление кишечника на мышиной модели язвенного колита. Дж. Клин Инвест . (2008) 118: 534–44. DOI: 10.1172 / JCI33194
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Lindemans CA, Calafiore M, Mertelsmann AM, O’Connor MH, Dudakov JA, Jenq RR, et al.Интерлейкин-22 способствует опосредованной кишечными стволовыми клетками регенерации эпителия. Природа . (2015) 528: 560–4. DOI: 10.1038 / природа16460
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Ханаш А.М., Дудаков Дж. А., Хуа Г., О’Коннор М. Х., Янг Л. Ф., Сингер Н. В. и др. Интерлейкин-22 защищает стволовые клетки кишечника от иммуноопосредованного повреждения тканей и регулирует чувствительность к реакции трансплантат против хозяина. Иммунитет . (2012) 37: 339–50. DOI: 10.1016 / j.immuni.2012.05.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Нго В.Л., Або Х., Максим Э., Харусато А., Джем Д., Медина-Контрерас О. и др. Сеть цитокинов, включающая IL-36γ, IL-23 и IL-22, способствует антимикробной защите и восстановлению после повреждения кишечного барьера. Proc Natl Acad Sci U S A . (2018) 115: E5076 – e5085. DOI: 10.1073 / pnas.17185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Бернинк Дж. Х., Петерс С. П., Муннеке М., Те Велде А. А., Мейер С. Л., Вейер К. и др.Врожденные лимфоидные клетки человека 1 типа накапливаются в воспаленных тканях слизистой оболочки. Нат Иммунол . (2013) 14: 221–9. DOI: 10.1038 / ni.2534
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Фукс А., Верми В., Ли Дж. С., Лонарди С., Гилфиллан С., Ньюберри Р. Д. и др. Интраэпителиальные врожденные лимфоидные клетки типа 1 представляют собой уникальную субпопуляцию IL-12- и IL-15-чувствительных клеток, продуцирующих IFN-γ. Иммунитет . (2013) 38: 769–81. DOI: 10.1016 / j.immuni.2013.02.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68.Ян Х., Энтони П.А., Вильдхабер Б.Е., Тейтельбаум Д.Х. Фактор роста кератиноцитов, происходящий из интраэпителиальных лимфоцитов кишечника, гамма-дельта-Т-клеток, модулирует рост эпителия у мышей. Дж. Иммунол . (2004) 172: 4151–8. DOI: 10.4049 / jimmunol.172.7.4151
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Кобер О.И., Ахл Д., Пин С., Холм Л., Кардинг С.Р., Джудж Н. Мыши с дефицитом Т-лимфоцитов γδ обнаруживают изменения в экспрессии муцина, гликозилировании и бокаловидных клетках, но сохраняют неповрежденный слой слизи. Am J Physiol Gastrointest Liver Physiol . (2014) 306: G582–93. DOI: 10.1152 / ajpgi.00218.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Чен Й, Чоу К., Фукс Э., Хавран В.Л., Бойсмену Р. Защита слизистой оболочки кишечника интраэпителиальными гамма-дельта-Т-клетками. Proc Natl Acad Sci U S A . (2002) 99: 14338–43. DOI: 10.1073 / pnas.2122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Boismenu R, Feng L, Xia YY, Chang JC, Havran WL.Экспрессия хемокинов интраэпителиальными гамма-дельта-Т-клетками. Значение для набора воспалительных клеток в поврежденный эпителий. Дж. Иммунол . (1996) 157: 985–92.
PubMed Аннотация | Google Scholar
72. Бринкманн В., Райхард Ю., Гусманн С., Фаулер Б., Улеманн Ю., Вайс Д.С. и др. Внеклеточные ловушки нейтрофилов убивают бактерии. Наука . (2004) 303: 1532–5. DOI: 10.1126 / science.1092385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74.Ким М.Х., Лю В., Боржессон Д.Л., Карри Ф.Р., Миллер Л.С., Чунг А.Л. и др. Динамика инфильтрации нейтрофилов при заживлении и инфицировании кожных ран с использованием флуоресцентной томографии. Дж Инвест Дерматол . (2008) 128: 1812–20. DOI: 10.1038 / sj.jid.5701223
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Чен Ф, Ян В., Хуанг Х, Цао А.Т., Билотта А.Дж., Сяо И и др. Нейтрофилы способствуют выработке амфирегулина в эпителиальных клетках кишечника через TGF-β и способствуют гомеостазу кишечника. Дж. Иммунол . (2018) 201: 2492–501. DOI: 10.4049 / jimmunol.1800003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Кюль А.А., Какирман Х., Янотта М., Дреер С., Кремер П., Павловски Н.Н. и др. Обострение различных типов экспериментального колита из-за истощения или адгезионной блокады нейтрофилов. Гастроэнтерология . (2007) 133: 1882–92. DOI: 10.1053 / j.gastro.2007.08.073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77.Zindl CL, Lai JF, Lee YK, Maynard CL, Harbour SN, Ouyang W. и др. Нейтрофилы, продуцирующие IL-22, способствуют противомикробной защите и восстановлению целостности эпителия толстой кишки во время колита. Proc Natl Acad Sci U S A . (2013) 110: 12768–73. DOI: 10.1073 / pnas.1300318110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Кэмпбелл Э.Л., Брюнинкс В.Дж., Келли С.Дж., Гловер Л.Е., МакНами Э.Н., Бауэрс Б.Э. и др. Переносимые нейтрофилы формируют микросреду слизистой оболочки за счет локального дефицита кислорода, чтобы влиять на разрешение воспаления. Иммунитет . (2014) 40: 66–77. DOI: 10.1016 / j.immuni.2013.11.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Фурута Г.Т., Тернер Дж. Р., Тейлор К. Т., Хершберг Р. М., Комерфорд К., Нарравула С. и др. Индуцируемый гипоксией фактор 1 индукция кишечного фактора трилистника защищает барьерную функцию во время гипоксии. J Exp Med . (2001) 193: 1027–34. DOI: 10.1084 / jem.193.9.1027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80.Hong WX, Hu MS, Esquivel M, Liang GY, Rennert RC, McArdle A, et al. Роль фактора, индуцируемого гипоксией, в заживлении ран. Adv Wound Care (New Rochelle) . (2014) 3: 390–9. DOI: 10.1089 / рана.2013.0520
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Zhou G, Yu L, Fang L, Yang W, Yu T, Miao Y, et al. CD177 (+) нейтрофилы как функционально активированные нейтрофилы отрицательно регулируют ВЗК. Кишечник . (2018) 67: 1052–63. DOI: 10.1136 / gutjnl-2016-313535
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82.Kvedaraite E, Lourda M, Ideström M, Chen P, Olsson-Åkefeldt S, Forkel M, et al. Нейтрофилы, инфильтрирующие ткань, представляют собой основной источник IL-23 в толстой кишке пациентов с ВЗК. Кишечник . (2016) 65: 1632–41. DOI: 10.1136 / gutjnl-2014-309014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Ли Й.С., Кан Су, Ли М. Х., Ким Х. Дж., Хан Ч., Вон Х. Р. и др. ГнРГ ухудшает заживление диабетических ран из-за усиленного НЕТоза. Cell Mol Immunol . (2020) 17: 856–64.DOI: 10.1038 / s41423-019-0252-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Butin-Israel V, Bui TM, Wiesolek HL, Mascarenhas L, Lee JJ, Mehl LC, et al. Геномная нестабильность, вызванная нейтрофилами, препятствует разрешению воспаления и заживлению ран. Дж. Клин Инвест . (2019) 129: 712–26. DOI: 10.1172 / JCI122085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Шоу Т.Н., Хьюстон С.А., Уэмисс К., Бриджман Х.М., Барбера Т.А., Зангерле-Мюррей Т. и др.Резидентные в тканях макрофаги в кишечнике являются долгоживущими и определяются экспрессией Tim-4 и CD4. J Exp Med . (2018) 215: 1507–18. DOI: 10.1084 / jem.20180019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Bain CC, Bravo-Blas A, Scott CL, Perdiguero EG, Geissmann F, Henri S, et al. Постоянное пополнение циркулирующими моноцитами поддерживает пул макрофагов в кишечнике взрослых мышей. Нат Иммунол . (2014) 15: 929–37. DOI: 10.1038 / ni.2967
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Нахрендорф М., Свирски Ф.К., Айкава Э., Стангенберг Л., Вурдингер Т., Фигейредо Дж. Л. и др. Заживляющий миокард последовательно мобилизует две субпопуляции моноцитов с дивергентными и взаимодополняющими функциями. J Exp Med . (2007) 204: 3037–47. DOI: 10.1084 / jem.20070885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Ноэль Г., Баец Н. В., Стааб Дж. Ф., Доновиц М., Ковбаснюк О., Пасетти М. Ф. и др.Первичная модель совместного культивирования человеческих макрофагов и энтероидов для исследования физиологии слизистой оболочки кишечника и взаимодействий между хозяином и патогеном. Научная репутация . (2017) 7: 45270. DOI: 10.1038 / srep45270
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Горен И., Аллманн Н., Йогев Н., Шюрманн К., Линке А., Холденер М. и др. Модель индуцибельного истощения макрофагов на трансгенных мышах: эффекты индуцируемого токсином дифтерии лизоцима M-специфической клеточной линии абляции на воспалительные, ангиогенные и сократительные процессы в ране. Ам Дж. Патол . (2009) 175: 132–47. DOI: 10.2353 / ajpath.2009.081002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Mirza R, DiPietro LA, Koh TJ. Избирательная и специфическая абляция макрофагов вредна для заживления ран у мышей. Ам Дж. Патол . (2009) 175: 2454–62. DOI: 10.2353 / ajpath.2009.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Лукас Т., Вайсман А., Ранджан Р., Роуз Дж., Криг Т., Мюллер В. и др.Различная роль макрофагов в различных фазах восстановления кожи. Дж. Иммунол . (2010) 184: 3964–77. DOI: 10.4049 / jimmunol.06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Arnold IC, Mathisen S, Schulthess J, Danne C, Hegazy AN, Powrie F. Моноциты / макрофаги CD11c (+) способствуют хроническому воспалению кишечника, вызванному Helicobacter hepaticus, посредством продукции IL-23. Иммунол слизистой оболочки . (2016) 9: 352–63. DOI: 10,1038 / mi.2015.65
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Quiros M, Nishio H, Neumann PA, Siuda D., Brazil JC, Azcutia V, et al. IL-10, происходящий из макрофагов, опосредует восстановление слизистых оболочек посредством эпителиальной передачи сигналов WISP-1. Дж. Клин Инвест . (2017) 127: 3510–20. DOI: 10.1172 / JCI
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Шнор М., Каллен П., Лорковски Дж., Штолле К., Робенек Х., Тройер Д. и др. Производство коллагена типа VI макрофагами человека: новое измерение функциональной неоднородности макрофагов. Дж. Иммунол . (2008) 180: 5707–19. DOI: 10.4049 / jimmunol.180.8.5707
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Деннинг Т.Л., Ван Ю.К., Патель С.Р., Уильямс И.Р., Пулендран Б. Макрофаги и дендритные клетки Lamina propria по-разному индуцируют регуляторные и продуцирующие интерлейкин 17 Т-клеточные ответы. Нат Иммунол . (2007) 8: 1086–94. DOI: 10.1038 / ni1511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98.Мирза Р.Э., Фанг М.М., Эннис В.Дж., Ко TJ. Блокирование интерлейкина-1β вызывает связанный с заживлением фенотип макрофагов раны и улучшает заживление при диабете 2 типа. Диабет . (2013) 62: 2579–87. DOI: 10.2337 / db12-1450
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Seo DH, Che X, Kwak MS, Kim S, Kim JH, Ma HW, et al. Интерлейкин-33 регулирует воспаление кишечника, модулируя макрофаги при воспалительном заболевании кишечника. Научная репутация . (2017) 7: 851.DOI: 10.1038 / s41598-017-00840-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Косин-Роджер Дж., Ортис-Масиа, Мэриленд, Баррачина, Мэриленд. Макрофаги как новый источник лигандов Wnt: значение для целостности слизистой оболочки. Фронт Иммунол . (2019) 10: 2297. DOI: 10.3389 / fimmu.2019.02297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Босурги Л., Цао Ю. Г., Кабеза-Кабреризо М., Туччи А., Хьюз Л. Д., Конг И. и др. Функция макрофагов в восстановлении и ремоделировании тканей требует наличия IL-4 или IL-13 с апоптотическими клетками. Наука . (2017) 356: 1072–6. DOI: 10.1126 / science.aai8132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Биркл Д., О’Лири М.Н., Кирос М., Ацкутия В., Шаллер М., Рид М. и др. Формилпептидный рецептор 2 регулирует рекрутирование моноцитов, способствуя заживлению ран слизистой оболочки кишечника. FASEB J. (2019) 33: 13632–43. DOI: 10.1096 / fj.201
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Ихара С., Хирата Ю., Хикиба Ю., Ямасита А., Цубои М., Хата М. и др.Адгезивные взаимодействия между мононуклеарными фагоцитами и кишечным эпителием нарушают нормальную дифференцировку эпителия и служат терапевтической мишенью при воспалительном заболевании кишечника. Дж. Колит Крона . (2018) 12: 1219–31. DOI: 10.1093 / ecco-jcc / jjy088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Фарро Г., Стакенборг М., Гомес-Пинилья П.Дж., Лабиу Э., Говерс Г., Ди Джовангиулио М. и др. CCR2-зависимые макрофаги, происходящие из моноцитов, устраняют воспаление и восстанавливают моторику кишечника при послеоперационной непроходимости кишечника. Кишечник . (2017) 66: 2098–109. DOI: 10.1136 / gutjnl-2016-313144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Аль-Гадбан С., Кайси С., Хомайдан ФР, Наим Х.Й., Эль-Саббан М.Э. Взаимосвязь между эпителиальными клетками кишечника и иммунными клетками при воспалительном заболевании кишечника. Научная репутация . (2016) 6: 29783. DOI: 10.1038 / srep29783
PubMed Аннотация | CrossRef Полный текст
106. de Sablet T, Potiron L, Marquis M, Bussière FI, Lacroix-Lamandé S, Laurent F.Cryptosporidium parvum увеличивает проницаемость кишечника за счет взаимодействия с эпителиальными клетками и IL-1β и TNFα, высвобождаемыми воспалительными моноцитами. Клеточный микробиол . (2016) 18: 1871–80. DOI: 10,1111 / cmi.12632
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Лей К., Лауданна С., Цибульский М.И., Нуршар С. Добраться до очага воспаления: обновлен каскад адгезии лейкоцитов. Нат Рев Иммунол . (2007) 7: 678–89. DOI: 10.1038 / nri2156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110.Берлин К., Берг Е.Л., Брискин М.Дж., Эндрю Д.П., Килшоу П.Дж., Хольцманн Б. и др. Интегрин альфа 4 бета 7 опосредует связывание лимфоцитов с сосудистым адресом слизистой оболочки MAdCAM-1. Ячейка . (1993) 74: 185–95. DOI: 10.1016 / 0092-8674 (93)
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Schleier L, Wiendl M, Heidbreder K, Binder MT, Atreya R, Rath T. и др. Неклассическое возвращение моноцитов в кишечник через интегрин α4β7 опосредует макрофагозависимое заживление кишечных ран. Кишечник . (2020) 69: 252–63. DOI: 10.1136 / gutjnl-2018-316772
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Нгуен Л.П., Пан Дж., Динь Т.Т., Хадейба Х., О’Хара Э. II, Эбтикар А. и др. Роль и видоспецифическая экспрессия рецептора самонаведения Т-клеток толстой кишки GPR15 при колите. Нат Иммунол . (2015) 16: 207–13. DOI: 10.1038 / ni.3079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Ким М.Х., Тапаровски Э.Дж., Ким Ч.Ретиноевая кислота по-разному регулирует миграцию субпопуляций врожденных лимфоидных клеток в кишечник. Иммунитет . (2015) 43: 107–19. DOI: 10.1016 / j.immuni.2015.06.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Цзэн X, Сюй В.К., Лок TM, Ма HT, Пун RYC. Дисбаланс контрольной точки сборки веретена способствует опосредованной ядом веретена цитотоксичности с отчетливой кинетикой. Смерть клетки . (2019) 10: 314. DOI: 10.1038 / s41419-019-1539-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116.Банкович А.Дж., Шиоу Л.Р., Цистер Дж.Г. CD69 подавляет функцию сфингозин-1-фосфатного рецептора-1 (S1P1) посредством взаимодействия со спиралью 4 мембраны. J Biol Chem . (2010) 285: 22328–37. DOI: 10.1074 / jbc.M110.123299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Хла Т., Венкатараман К., Мишо Дж. Сосудистые источники градиента S1P-клетки и биологическое значение. Biochim Biophys Acta . (2008) 1781: 477–82. DOI: 10.1016 / j.bbalip.2008.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Мартенс Р., Перманьер М., Верт К., Ю К., Браун А., Галле О. и др. Эффективное перемещение Т-клеток через афферентные лимфатические узлы требует механической остановки и контроля хемокинов, поддерживаемых интегрином. Нац Коммун . (2020) 11: 1114. DOI: 10.1038 / s41467-020-14921-w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Мокрани М., Клиби Дж., Блюто Д., Висмут Г., Мами-Шуаиб Ф.Пути Smad и NFAT взаимодействуют, чтобы индуцировать экспрессию CD103 в Т-лимфоцитах CD8 человека. Дж. Иммунол . (2014) 192: 2471–9. DOI: 10.4049 / jimmunol.1302192
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Сепек К.Л., Шоу С.К., Паркер С.М., Рассел Г.Дж., Морроу Дж.С., Римм Д.Л. и др. Адгезия между эпителиальными клетками и Т-лимфоцитами, опосредованная E-кадгерином и интегрином альфа E beta 7. Природа . (1994) 372: 190–3. DOI: 10.1038 / 372190a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122.Зундлер С., Беккер Э., Споцинска М., Славик М., Парга-Видаль Л., Старк Р. и др. Управляемые хобитами и Blimp-1 CD4 (+) Т-клетки памяти, находящиеся в тканях, контролируют хроническое воспаление кишечника. Нат Иммунол . (2019) 20: 288–300. DOI: 10.1038 / s41590-018-0298-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Тулон А., Бретон Л., Тейлор К. Р., Тененхаус М., Бхавсар Д., Ланиган С. и др. Роль резидентных Т-клеток кожи человека в заживлении ран. J Exp Med .(2009) 206: 743–50. DOI: 10.1084 / jem.20081787
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Заид А., Маккей Л.К., Рахимпур А., Браун А., Велдхоен М., Карбон FR и др. Сохранение резидентных Т-клеток памяти в эпидермальной нише. Proc Natl Acad Sci U S A . (2014) 111: 5307–12. DOI: 10.1073 / pnas.13222
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Фасс И.Дж., Нейрат М., Бойривант М., Кляйн Дж.С., де ла Мотт С., Стронг С.А. и др.Несопоставимые профили секреции лимфокинов CD4 + lamina propria (LP) при воспалительном заболевании кишечника. LP-клетки болезни Крона проявляют повышенную секрецию IFN-гамма, тогда как LP-клетки язвенного колита проявляют повышенную секрецию IL-5. Дж. Иммунол . (1996) 157: 1261–70.
PubMed Аннотация | Google Scholar
126. Берреби Д., Лангуэпин Дж., Феркдаджи Л., Фусса А., Де Лагаузи П., Пэрис Р. и др. Цитокины, хемокиновые рецепторы и распределение молекул самонаведения в прямой кишке и желудке у педиатрических пациентов с язвенным колитом. J Педиатр Гастроэнтерол Нутр . (2003) 37: 300–8. DOI: 10.1097 / 00005176-200309000-00018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Heller F, Fuss IJ, Nieuwenhuis EE, Blumberg RS, Strober W. Оксазолоновый колит, модель Th3-колита, напоминающая язвенный колит, опосредуется производящими IL-13 NK-T-клетками. Иммунитет . (2002) 17: 629–38. DOI: 10.1016 / S1074-7613 (02) 00453-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128.Герлах К., Хван Й, Николаев А., Атрея Р., Дорнхофф Х., Штайнер С. и др. Клетки TH9, которые экспрессируют фактор транскрипции PU.1, вызывают колит, опосредованный Т-клетками, посредством передачи сигналов рецептора IL-9 в эпителиальных клетках кишечника. Нат Иммунол . (2014) 15: 676–86. DOI: 10.1038 / ni.2920
PubMed Аннотация | CrossRef Полный текст | Google Scholar
129. Попп В., Герлах К., Мотт С., Туровска А., Гарн Н., Атрея Р. и др. Ректальная доставка ДНКзима, который специфически блокирует фактор транскрипции GATA3 и уменьшает колит у мышей. Гастроэнтерология . (2017) 152: 176–92.e5. DOI: 10.1053 / j.gastro.2016.09.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Муллин Г.Е., Майкон З.Р., Браун-Эльверт Л., Черкиа Р., Джеймс С.П., Кац С. и др. Биопсия слизистой оболочки при воспалительном заболевании кишечника имеет специализированные профили мРНК лимфокинов. Воспаление кишечника . (1996) 2: 16–26. DOI: 10.1002 / ibd.3780020105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132.Ли Дж.Й., Мин Б.Х., Ли Дж.Г., Но Ди, Ли Дж.Х., Ри П.Л. и др. Эндоскопическая диссекция подслизистой оболочки при ранней неоплазии желудка, возникающей в остаточном желудке после дистальной резекции желудка. Clin Endosc . (2016) 49: 182–6. DOI: 10.5946 / ce.2015.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Зундлер С., Шиллингер Д., Фишер А., Атрея Р., Лопес-Посадас Р., Уотсон А. и др. Блокада интегрина αEβ7 подавляет накопление лимфоцитов CD8 (+) и Th9 у пациентов с ВЗК в воспаленном кишечнике in vivo . Кишечник . (2017) 66: 1936–48. DOI: 10.1136 / gutjnl-2016-312439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Zundler S, Neurath MF. Новые сведения о механизмах самонаведения кишечника и антиадгезионной терапии при воспалительных заболеваниях кишечника. Воспаление кишечника . (2017) 23: 617–27. DOI: 10.1097 / MIB.0000000000001067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al.Поддерживающий инфликсимаб при болезни Крона: рандомизированное исследование ACCENT I. Ланцет . (2002) 359: 1541–9. DOI: 10.1016 / S0140-6736 (02) 08512-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Полковник Дж. Ф., Сандборн В. Дж., Рейниш В., Манцарис Г. Дж., Корнблут А., Рахмилевиц Д. и др. Инфликсимаб, азатиоприн или комбинированная терапия болезни Крона. N Engl J Med . (2010) 362: 1383–95. DOI: 10.1056 / NEJMoa02
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139.Adedokun OJ, Sandborn WJ, Feagan BG, Rutgeerts P, Xu Z, Marano CW и др. Связь между концентрацией инфликсимаба в сыворотке крови и эффективностью у взрослых пациентов с язвенным колитом. Гастроэнтерология . (2014) 147: 1296–307.e5. DOI: 10.1053 / j.gastro.2014.08.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Feagan BG, Rutgeerts P, Sands BE, Hanauer S, Colombel JF, Sandborn WJ, et al. Ведолизумаб как индукционная и поддерживающая терапия язвенного колита. N Engl J Med . (2013) 369: 699–710. DOI: 10.1056 / NEJMoa1215734
PubMed Аннотация | CrossRef Полный текст | Google Scholar
141. Сандборн В. Дж., Фиган Б. Г., Рутгертс П., Ханауэр С., Коломбел Дж. Ф., Сэндс Б. Е. и др. Ведолизумаб как индукционная и поддерживающая терапия болезни Крона. N Engl J Med . (2013) 369: 711–21. DOI: 10.1056 / NEJMoa1215739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
142. Frøslie KF, Jahnsen J, Moum BA, Vatn MH.Заживление слизистой оболочки при воспалительном заболевании кишечника: результаты исследования норвежской популяции. Гастроэнтерология . (2007) 133: 412–22. DOI: 10.1053 / j.gastro.2007.05.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143. Рейнинк А.Р., Ли Т.К., Хиггинс П.Д. Эндоскопическое заживление слизистой оболочки предсказывает благоприятные клинические исходы при воспалительном заболевании кишечника: метаанализ. Воспаление кишечника . (2016) 22: 1859–69. DOI: 10.1097 / MIB.0000000000000816
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144.Полковник JF, Rutgeerts P, Reinisch W., Esser D, Wang Y, Lang Y, et al. Раннее заживление слизистых оболочек инфликсимабом связано с улучшением отдаленных клинических исходов при язвенном колите. Гастроэнтерология . (2011) 141: 1194–201. DOI: 10.1053 / j.gastro.2011.06.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Берстад А., Арслан Г., Фольвик Г. Взаимосвязь между кишечной проницаемостью и концентрацией кальпротектина в жидкости промывания кишечника. Сканд Дж Гастроэнтерол .(2000) 35: 64–9. DOI: 10.1080 / 003655200750024551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
146. Зиттан Э., Келли О. Б., Кирш Р., Милгром Р., Бернс Дж., Нгуен Г. К. и др. Низкий фекальный кальпротектин коррелирует с гистологической ремиссией и заживлением слизистой оболочки при язвенном колите и болезни Крона толстой кишки. Воспаление кишечника . (2016) 22: 623–30. DOI: 10.1097 / MIB.0000000000000652
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147.Бертани Л., Бландицци С., Мумоло М.Г., Чеккарелли Л., Альбано Е., Тапете Г. и др. Фекальный кальпротектин предсказывает заживление слизистых оболочек у пациентов с язвенным колитом, получающих биологическую терапию: проспективное исследование. Клин Транс Гастроэнтерол . (2020) 11: e00174. DOI: 10.14309 / ctg.0000000000000174
PubMed Аннотация | CrossRef Полный текст | Google Scholar
148. Hu MS, Walmsley GG, Barnes LA, Weiskopf K, Rennert RC, Duscher D, et al. Доставка клеток моноцитарного происхождения в биомиметический каркас усиливает восстановление тканей. JCI Insight . (2017) 2: e96260: doi: 10.1172 / jci.insight.96260
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Фанг Й, Шен Дж, Яо М., Бигли К.В., Хэмбли Б.Д., Бао С. Гранулоцитарно-макрофагальный колониестимулирующий фактор усиливает заживление ран при диабете за счет активации провоспалительных цитокинов. Br J Дерматол . (2010) 162: 478–86. DOI: 10.1111 / j.1365-2133.2009.09528.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
150.Маруяма К., Асаи Дж., Ии М., Торн Т., Лосордо Д.В., Д’Амор, Пенсильвания. Уменьшение количества и активации макрофагов приводит к уменьшению образования лимфатических сосудов и способствует нарушению заживления диабетических ран. Ам Дж. Патол . (2007) 170: 1178–91. DOI: 10.2353 / ajpath.2007.060018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
151. Чжэн Й., Сюн С., Цзян П., Лю Р., Лю Х, Цянь Дж. И др. Глюкокортикоиды подавляют воспалительный ответ, опосредованный липополисахаридами, подавляя микроРНК-155: новый противовоспалительный механизм. Свободный Радик Биол Мед . (2012) 52: 1307–17. DOI: 10.1016 / j.freeradbiomed.2012.01.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
152. Норлинг Л.В., Спайт М., Ян Р., Флауэр Р.Дж., Перретти М., Серхан К.Н. Передний край: гуманизированные наноразлагающие лекарства имитируют разрешение воспаления и ускоряют заживление ран. Дж. Иммунол . (2011) 186: 5543–7. DOI: 10.4049 / jimmunol.1003865
PubMed Аннотация | CrossRef Полный текст | Google Scholar
153.Кришнан К., Арноне Б., Бухман А. Факторы роста кишечника: потенциальное использование при лечении воспалительного заболевания кишечника и их роль в заживлении слизистой оболочки. Воспаление кишечника . (2011) 17: 410–22. DOI: 10.1002 / ibd.21316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
155. Baumgart DC, Vierziger K, Sturm A, Wiedenmann B, Dignass AU. Месаламин способствует заживлению эпителиальных ран кишечника in vitro посредством TGF-бета-независимого механизма. Сканд Дж Гастроэнтерол .(2005) 40: 958–64. DOI: 10.1080 / 00365520510015854
PubMed Аннотация | CrossRef Полный текст | Google Scholar
156. Накасе Х. Оптимизация использования существующих методов лечения и новых терапевтических подходов для достижения терапевтического успеха у пациентов с воспалительным заболеванием кишечника. Печень кишечника . (2020) 14: 7–19. DOI: 10.5009 / gnl18203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
157. Бокемейер Б., Хоммес Д., Гилл И., Броберг П., Дигнасс А.Месалазин при левостороннем язвенном колите: анализ эффективности из исследования PODIUM по поддержанию ремиссии и заживлению слизистой оболочки. Дж. Колит Крона . (2012) 6: 476–82. DOI: 10.1016 / j.crohns.2011.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
158. D’Haens G, Van Deventer S, Van Hogezand R, Chalmers D, Kothe C, Baert F, et al. Эндоскопическое и гистологическое заживление с помощью антител к фактору некроза опухолей инфликсимаба при болезни Крона: европейское многоцентровое исследование. Гастроэнтерология . (1999) 116: 1029–34. DOI: 10.1016 / S0016-5085 (99) 70005-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
159. Rutgeerts P, Van Assche G, Sandborn WJ, Wolf DC, Geboes K, Colombel JF, et al. Адалимумаб вызывает и поддерживает заживление слизистых оболочек у пациентов с болезнью Крона: данные исследования EXTEND. Гастроэнтерология . (2012) 142: 1102–11.e2. DOI: 10.1053 / j.gastro.2012.01.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
160.Cholapranee A, Hazlewood GS, Kaplan GG, Peyrin-Biroulet L, Ananthakrishnan AN. Систематический обзор с метаанализом: сравнительная эффективность биопрепаратов для индукции и поддержания заживления слизистой оболочки при контролируемых исследованиях болезни Крона и язвенного колита. Алимент Фармакол Тер . (2017) 45: 1291–302. DOI: 10.1111 / apt.14030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
161. Baert FJ, D’Haens GR, Peeters M., Hiele MI, Schaible TF, Shealy D., et al.Терапия антителом к фактору некроза опухоли (инфликсимаб) значительно подавляет воспаление при илеоколите Крона. Гастроэнтерология . (1999) 116: 22–8. DOI: 10.1016 / S0016-5085 (99) 70224-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
162. Пак Ш., Хонг М., Ли Х.С., Йе Б.Д., Хван С.В., Юнг С. и др. Связь TRAP1 с индуцированным инфликсимабом заживлением слизистой оболочки при болезни Крона. Дж Гастроэнтерол Гепатол . (2019) 34: 2118–25. DOI: 10.1111 / jgh.14696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
163. Suenaert P, Bulteel V, Lemmens L, Noman M, Geypens B, Van Assche G, et al. Лечение противоопухолевым фактором некроза восстанавливает кишечный барьер при болезни Крона. Ам Дж. Гастроэнтерол . (2002) 97: 2000–4. DOI: 10.1111 / j.1572-0241.2002.05914.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
164. Вос А.С., Вильденберг М.Э., Арийс И., Дуйвестайн М., Верхаар А.П., де Хертог Г. и др.Регулирующие макрофаги, индуцированные инфликсимабом, участвуют в заживлении in vivo и in vitro . Воспаление кишечника . (2012) 18: 401–8. DOI: 10.1002 / ibd.21818
PubMed Аннотация | CrossRef Полный текст | Google Scholar
165. Вос А.С., Вильденберг М.Э., Дуйвестайн М., Верхаар А.П., ван ден Бринк Г.Р., Хоммес Д.В. Антитела против фактора некроза опухоли-α индуцируют регуляторные макрофаги зависимым от области Fc образом. Гастроэнтерология . (2011) 140: 221–30.DOI: 10.1053 / j.gastro.2010.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
166. Рутгиртс П., Гасинк С., Чан Д., Ланг И, Поллак П., Коломбел Дж. Ф. и др. Эффективность устекинумаба для стимуляции эндоскопического заживления у пациентов с болезнью Крона. Гастроэнтерология . (2018) 155: 1045–58. DOI: 10.1053 / j.gastro.2018.06.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
167. Sandborn WJ, Su C., Sands BE, D’Haens GR, Vermeire S, Schreiber S, et al.Тофацитиниб в качестве индукционной и поддерживающей терапии язвенного колита. N Engl J Med . (2017) 376: 1723–36. DOI: 10.1056 / NEJMoa1606910
PubMed Аннотация | CrossRef Полный текст | Google Scholar
168. Герлах К., Лехнер К., Попп В., Оффенспергер Л., Зундлер С., Виндл М. и др. Ингибитор тофацитиниба JAK1 / 3 подавляет самонаведение и активацию Т-клеток при хроническом воспалении кишечника. Дж. Колит Крона . (2021) 15: 244–57. DOI: 10.1093 / ecco-jcc / jjaa162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
169.Binder MT, Becker E, Wiendl M, Schleier L, Fuchs F, Leppkes M и др. Аналогичное подавление динамической адгезии лимфоцитов пациентов с ВЗК к MAdCAM-1 с помощью ведолизумаба и этролизумаба. Воспаление кишечника . (2018) 24: 1237–50. DOI: 10.1093 / ibd / izy077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
170. Полковник Дж. Ф., Сэндс Б. Э., Рутгертс П., Сандборн В., Данезе С., Д’Хаенс Дж. И др. Безопасность ведолизумаба при язвенном колите и болезни Крона. Кишечник .(2017) 66: 839–51. DOI: 10.1136 / gutjnl-2015-311079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
171. Лайтнер А.Л., Раффалс Л.Е., Матис К.Л., Цима Р.Р., Це С.С., Пембертон Дж. Х. и др. Послеоперационные результаты у пациентов, получавших ведолизумаб, перенесших абдоминальные операции по поводу воспалительного заболевания кишечника. Дж. Колит Крона . (2017) 11: 185–90. DOI: 10.1093 / ecco-jcc / jjw147
PubMed Аннотация | CrossRef Полный текст | Google Scholar
172.C.Law CY, Нарула A, Лайтнер AL, McKenna NP, Colombel JF, Narula N. Систематический обзор и метаанализ: предоперационное лечение ведолизумабом и послеоперационные осложнения у пациентов с воспалительным заболеванием кишечника. Дж. Колит Крона . (2018) 12: 538–45. DOI: 10.1093 / ecco-jcc / jjy022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
173. Лайтнер А.Л., Маккенна Н.П., Це С.С., Раффалс Л.Е., Лофтус Е.В. мл., Матис К.Л. Послеоперационные результаты у пациентов с болезнью Крона, получавших ведолизумаб, после крупных операций на брюшной полости. Алимент Фармакол Тер . (2018) 47: 573–80. DOI: 10.1111 / apt.14459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
174. Лайтнер А.Л., Матис К.Л., Цзе С.С., Пембертон Дж. Х., Шен Б., Кочхар Г. и др. Послеоперационные результаты у пациентов, получавших ведолизумаб, перенесших обширные абдоминальные операции по поводу воспалительного заболевания кишечника: ретроспективное многоцентровое когортное исследование. Воспаление кишечника . (2018) 24: 871–6. DOI: 10.1093 / ibd / izx076
PubMed Аннотация | CrossRef Полный текст | Google Scholar
175.Юнг Д.Е., Хореш Н., Лайтнер А.Л., Бен-Хорин С., Элиаким Р., Кулаузидис А. и др. Систематический обзор и метаанализ: ведолизумаб и послеоперационные осложнения воспалительного заболевания кишечника. Воспаление кишечника . (2018) 24: 2327–38. DOI: 10.1093 / ibd / izy156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
176. Лайтнер А.Л., Эдвард В.Л. младший, Маккенна Н.П., Раффалс Л.Е. Ведолизумаб в периоперационном ведении воспалительных заболеваний кишечника. Curr Drug Targets .(2019) 20: 1317–22. DOI: 10.2174/13894501206661130142
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дырявый кишечник и как улучшить здоровье кишечника
Вы, возможно, слышали термин «дырявый кишечник», которым обвиняют практически все, от увеличения веса до экземы и депрессии. Медицинские работники называют это состояние повышенной кишечной проницаемостью, но что это такое и как узнать, есть ли оно у вас?
«Кишечник — очень сложная система, и мы все еще изучаем, как она влияет на здоровье», — говорит Эрика Ла Велла, доктор медицинских наук, хирург из Самаритянского института управления весом.«Мы знаем, что при отсутствии лечения негерметичный кишечник может вызвать желудочно-кишечные заболевания, такие как синдром раздраженного кишечника, глютеновая болезнь и болезнь Крона».
В обзоре литературы, опубликованном в журнале BMJ, сообщается, что исследователи связали здоровье кишечника и микробиома с другими состояниями, такими как ожирение, аллергия, артрит, психические заболевания, болезнь Паркинсона, аутизм, заболевания печени, диабет 2 типа, рак и другие заболевания. аутоиммунные заболевания, такие как рассеянный склероз и волчанка.
Как развивается дырявый кишечник?
Стенки кишечника состоят из одного слоя клеток, называемых энтероцитами. Эти клетки связаны между собой белками с плотными контактами, которые действуют как закрытые отверстия, позволяющие питательным веществам из кишечника попадать в кровоток. Когда эти плотные соединения повреждаются, непереваренные частицы пищи, бактерии и токсины могут «просачиваться».
Кишечник состоит из трех основных частей, работающих вместе:
- физическая структура кишечника, включая энтероциты и плотные контакты;
- слизистая оболочка, которая действует как буфер для защиты клеток кишечника и препятствует проникновению вредных бактерий под поверхность;
- полезных бактерий, переваривающих пищу.
Все системы должны работать должным образом, иначе это может привести к хроническому воспалению и потенциально вызвать срабатывание иммунной системы.
«Самая большая коллекция иммунных клеток в организме находится в кишечнике», — говорит доктор Ла Велла. «Когда наблюдается повышенная кишечная проницаемость, иммунная система реагирует на эти частицы, усиливая воспаление».
Причины повреждений
Повреждение мест соединений может быть вызвано:
- Диета. Примечательно, что стандартная американская диета с низким содержанием клетчатки и высоким содержанием сахара и насыщенных жиров способствует ухудшению функции кишечника.
- Стресс. Клетки кишечника имеют рецепторы гормона стресса (кортизола), повреждающего плотные контакты и, как полагают, являются основным фактором синдрома раздраженного кишечника (СРК).
Повреждение слизистой оболочки может быть вызвано:
- Диета с низким содержанием клетчатки. Волокно питает кишечные бактерии, которые производят целебные химические вещества (короткоцепочечные жирные кислоты) для клеток и иммунной системы. Это помогает снять воспаление.
- Прием таких лекарств, как НПВП (обычно применяемые ибупрофен, алев и напроксен).Эти лекарства прокалывают дыры в слизистой оболочке, что приводит к изъязвлению не только желудка, но и тонкой кишки. Это делает кишечник еще более уязвимым для воздействия токсинов.
«Воспаление кишечника может произойти быстро, в зависимости от вашей диеты, лекарств и стресса», — говорит д-р Ла Велла. «Хорошая новость заключается в том, что кишечник также может быстро зажить благодаря снижению стресса, правильному питанию и отказу от лекарств, которые повреждают кишечник или ослабляют слизистую оболочку».
Симптомы дырявого кишечника
Если у вас негерметичный кишечник, вы можете испытать:
- Вздутие живота и газы
- Усталость
- Чувствительность к пище
- Боль в суставах
- Увеличение или потеря веса
Исцеление кишечника с помощью диеты
Независимо от причины повышенной проницаемости кишечника правильное питание может помочь вам почувствовать себя лучше.
«От продуктов, которые вы едите, зависит, даете ли вы своему телу шанс на выздоровление», — говорит доктор Ла Велла. «Диета — одна из важных составляющих лечения симптомов повышенной кишечной проницаемости».
Она отмечает, что пищевые продукты, подвергшиеся сверхобработке, являются распространенной проблемой, потому что они содержат мало клетчатки, много жира и часто содержат химические добавки. Эта комбинация может нанести вред здоровому росту бактерий и повредить плотные контакты в кишечнике.
Доктор Ла Велла рекомендует употреблять цельные продукты из всех групп продуктов, включая фрукты, овощи, злаки, нежирный белок и кисломолочные продукты.Поищите рецепты средиземноморской диеты или диеты DASH, в которых используются вкусные полезные ингредиенты.
Другие диетические рекомендации
- Ограничьте или избегайте сверхпереработанных продуктов, таких как хлеб длительного хранения, сладкие хлопья для завтрака, замороженные обеды, закуски, такие как чипсы или крекеры, а также рис или картофель быстрого приготовления. Все эти продукты подвергаются глубокой переработке и в значительной степени утратили свою пищевую ценность.
- Ограничьте или избегайте сахара, алкоголя и насыщенных жиров, которые содержатся в продуктах животного происхождения, таких как масло, сыр и красное мясо, которые, как было показано, уменьшают количество полезных бактерий в кишечнике.
- Ешьте много клетчатки, которая питает здоровые бактерии. Фрукты, овощи, бобовые, орехи и цельнозерновые являются богатыми источниками клетчатки.
- Ешьте ферментированные продукты и кисломолочные продукты, которые способствуют заселению кишечника полезными бактериями. К кисломолочным продуктам относятся традиционно кисломолочный йогурт и кефир, напиток, похожий на йогурт. К распространенным ферментированным продуктам относятся квашеная капуста, кимчи и мисо. Оптимальная доза ферментированных продуктов неизвестна, но доктор Ла Велла рекомендует есть ферментированные продукты при каждом приеме пищи.Однако она предупреждает, что те, кто не привык регулярно есть ферментированные продукты или клетчатку, будут испытывать газы и вздутие живота, когда организм приспосабливается. «Начни со столовой ложки в день и работай», — предлагает она.
«Бактерии переваривают пищу, которую мы едим, поэтому диета, богатая антиоксидантами, и цельные продукты с растительной клетчаткой, важны для здоровья, а не только для уменьшения талии», — говорит доктор Ла Велла. «Соблюдение сбалансированной диеты для оптимизации микробиома лежит в основе моей личной и профессиональной практики
Не пренебрегайте сном
Хороший сон каждую ночь — еще один ключевой аспект здоровья кишечника.Исследования показывают, что недостаток сна отрицательно влияет на баланс кишечных бактерий, реактивность иммунной системы и целостность слизистой оболочки кишечника. Исследование, опубликованное в International Review of Neurobiology, показало, что все тело, включая микробиом кишечника, имеет циркадный ритм, на который влияет здоровый сон.
Нужна ли мне добавка?
Согласно исследованию, опубликованному в журнале Frontiers in Immunology, есть некоторые свидетельства того, что пробиотики могут улучшить функцию кишечника и даже помочь вылечить негерметичный кишечник, но все же необходимы долгосрочные исследования.На сегодняшний день нет ни одного исследования, которое бы показало, что пробиотики вредны.
«Добавки с пробиотиками больше похожи на удобрения, которые передаются вашим существующим кишечным бактериям. Он может регулировать pH и взаимодействовать с другими бактериями, увеличивая количество короткоцепочечных жирных кислот, которые являются пищей для клеток кишечника, и помогает регулировать воспаление и иммунную систему кишечника », — говорит доктор Ла Велла. «Чтобы сохранить здоровье кишечника, обычно достаточно отказаться от обработанных пищевых продуктов и перейти на цельные продукты.”
Травяные добавки могут быть полезны в определенных ситуациях, но не обязательно быстро.
«Я думаю о добавках как о лекарствах; всегда есть риск и польза. Я предпочитаю думать о восстановлении баланса экосистемы, а не о добавках, чтобы прикрыть неправильную диету или образ жизни », — говорит д-р Ла Велла.
Когда мне следует обратиться к врачу?
Улучшение диеты может помочь вам почувствовать себя лучше, но дырявый кишечник иногда может иметь другие причины, например инфекцию или болезнь.
В некоторых случаях симптомы могут быть вызваны чувствительностью к пище. Если вы подозреваете, что у вас повышенная чувствительность к пище, доктор Ла Велла рекомендует проконсультироваться с врачом, чтобы определить вашу чувствительность.
«Это совершенно безопасно для всех, кто придерживается диеты из цельных продуктов, и вы, вероятно, начнете чувствовать себя лучше в течение нескольких недель», — говорит доктор Ла Велла. «Если у вас сохраняются симптомы, и вы по-прежнему обеспокоены после внесения этих изменений, поговорите со своим врачом. Может быть основная причина, которую нужно лечить.”
Получите медицинскую поддержку и поддержку в области питания на пути к снижению веса. Посетите бесплатный семинар , чтобы узнать, как Samaritan Weight Management Institute может помочь вам чувствовать себя лучше.
Узнайте больше о пробиотиках и улучшении здоровья кишечника.
Ремонт поврежденной слизистой оболочки кишечника на мышиной модели сепсиса
World J Emerg Med. 2013; 4 (3): 223–228.
Жуй-мин Чанг
1 Отделение неотложной медицины, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
Ли-цян Вэнь
1 Отделение неотложной помощи Медицина, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
Цзяньсин Чанг
2 Отделение общей хирургии Мемориальной больницы Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
Yu-ru Fu
1 Отделение неотложной медицины, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
Zhi-peng Jiang
1 Отделение неотложной медицины, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
Шуанг Чен
2 Отделение General Sur gery, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
1 Отделение неотложной медицины, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
2 Отделение общей хирургии, Мемориальная больница Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу 510120, Китай
Получено 22 января 2013 г .; Принята в печать 12 июня 2013 г.
Авторские права: © World Journal of Emergency MedicineЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии наличия оригинала. работа правильно цитируется.
Эта статья цитируется в других статьях в PMC.Abstract
ИСТОРИЯ:
Кишечник — это не только основная мишень, поражаемая сепсисом, но и жизненно важный орган, опосредовавший сепсис.Восстановление поврежденной структуры и функции кишечного барьера связано с возникновением и исходом синдрома полиорганной недостаточности (СПОН). Как защитить и уменьшить повреждение слизистой оболочки кишечника и как способствовать восстановлению слизистой оболочки кишечника в течение многих лет были важными темами при сепсисе. Это исследование было направлено на изучение факторов, влияющих на реконструкцию слизистой оболочки кишечника после повреждения эпителия кишечника in vivo на мышиной модели сепсиса.
МЕТОДЫ:
Мышей подвергали перевязке слепой кишки и пункции (CLP) для индукции сепсиса для оценки повреждения слизистой оболочки кишечника, апоптоза эпителиальных клеток и количества трансформированных бокаловидных клеток, а также для определения концентрации TNF-α, IL- 1 и экспрессия TGF-β1 и TFF3 (фактор трилистника 3) в слизистой оболочке тонкого кишечника. Все вышеперечисленное было выполнено с помощью окрашивания НЕ, вестерн-блоттинга, ELISA и иммуногистохимии соответственно. Подопытные животные были разделены на группу сепсиса и группу имитации операции.Животных с сепсисом убивали отдельно через 6 (7 животных), 24 (7 животных) и 48 часов (7 животных) после CLP.
РЕЗУЛЬТАТЫ:
Поврежденная слизистая оболочка кишечника наблюдалась в 3 группах под световым микроскопом, в которых оценки повреждений в 24-часовой и 48-часовой группах были выше, чем в 6-часовой группе, и не было обнаружено никакой разницы между две группы. Более того, меньшее количество бокаловидных клеток или других эпителиальных клеток, прилегающих к поврежденной поверхности, мигрировало в рану, чтобы покрыть обнаженную область.Количество бокаловидных клеток было существенно уменьшено в трех группах CLP по сравнению с группой ложной операции. Уровни белка IL-1 и TNF-α были значительно увеличены в 3–4 раза во все моменты времени по сравнению с группой имитации операции, а каспаза-3 расщеплялась в 4 раза. Хотя экспрессия TFF3 была умеренно увеличена в течение 6 часов после начала CLP, она, по-видимому, снизилась через 24 часа и 48 часов, как показал вестерн-блоттинг. Аналогичная тенденция наблюдалась при использовании TGF-β1, то есть уровень белка не повышался через 24 часа 48 часов, а незначительно повышался через 6 часов.
ВЫВОДЫ:
Сепсис от CLP показывает меньшую реституцию на поверхности поврежденной слизистой оболочки кишечника. Имеются данные о том, что как постоянная воспалительная реакция, так и апоптоз эпителиальных клеток могут влиять на восстановление слизистой оболочки кишечника в начале сепсиса. Слизистая оболочка после тяжелого сепсиса показала состояние сильного воспаления, снижение функции бокаловидных клеток и реконструкцию слизистой оболочки, что повлияло на восстановление поврежденного кишечного барьера. Постоянная воспалительная реакция и снижение функции бокаловидных клеток и способности к реконструкции слизистой оболочки могут повлиять на восстановление слизистой оболочки кишечника в начале сепсиса.
КЛЮЧЕВЫЕ СЛОВА: Сепсис, лигирование слепой кишки и пункция, слизистая оболочка кишечника, реституция, бокаловидные клетки, фактор трехлистного кишечника, трансформирующий фактор роста β1, цистеинсодержащие аспартат-специфические протеазы
ВВЕДЕНИЕ
Множественный сепсис и сепсис органная недостаточность остается серьезной проблемой для клиницистов. Несмотря на обширные исследования в прошлом, патофизиология сепсиса все еще плохо изучена, а количество госпитализаций и смертность пациентов с сепсисом увеличивается с каждым годом.Для изучения основных механизмов сепсиса и связанной с ним системной воспалительной реакции было разработано несколько экспериментальных моделей на животных, имитирующих патофизиологические изменения у пациентов с сепсисом. Перевязка слепой кишки и пункция у грызунов стала широко используемой моделью сепсиса и в настоящее время считается золотым стандартом в исследованиях. Кишечник — это не только основная цель, поражаемая сепсисом, но и жизненно важный орган, опосредовавший сепсис. Восстановление поврежденной структуры и функции кишечного барьера связано с возникновением и исходом синдрома полиорганной недостаточности (СПОН).[1-3] Как защитить и уменьшить повреждение слизистой оболочки кишечника и как способствовать восстановлению слизистой оболочки кишечника в течение многих лет были важными темами исследований в области сепсиса. В этом исследовании мы исследовали факторы, влияющие на реконструкцию слизистой оболочки кишечника при повреждении эпителия in vivo на мышиной модели сепсиса.
МЕТОДЫ
Экспериментальные животные и группы
Мышей Kunming массой от 20 до 25 г, полученных из Центра экспериментальных животных Университета Сунь Ятсена в Гуанчжоу, Китай, были случайным образом разделены на группу фиктивных операций и сепсис. группа.В группе ложной операции мышей только анестезировали и оперировали, но не подвергали перевязке слепой кишки и пункции (CLP). В группе сепсиса мышей разделили на три группы в соответствии с различными временными точками после фиктивной операции, а именно: 6-часовая группа, 24-часовая группа и 48-часовая группа ( n = 7). . Кроме того, для расчета уровня смертности использовали еще 30 мышей, перенесших CLP. Эксперимент завершен в лаборатории патофизиологии Института сердечно-легочной церебральной реанимации им. Сунь Ятсена.
Экспериментальная модель сепсиса
Сепсис был вызван CLP. [4] После ночного голодания мышей анестезировали пентобарбиталом натрия внутрибрюшинно (100 мг / кг). С помощью лапаротомии по средней линии слепая кишка была обнажена и перевязана шелком № 4 на 2/3. Дистальный конец слепой кишки прокалывали два раза иглами шприца № 18 и мягко сжимали, чтобы небольшое количество кишечного содержимого попадало в брюшную полость. Две полоски шелка 7 # были оставлены через слепую кишку.Чтобы избежать выпадения, мы завязали шелк двумя концами. Затем брюшную полость закрыли, чтобы закончить операцию. Мышей умерщвляли соответственно через 6, 24 и 48 часов после операции. Образцы дистального отдела подвздошной кишки собирали и промывали PBS. Их обрабатывали 4% параформальдегидом (pH 7,4), замораживали в жидком азоте и хранили при –8 ° C.
Гистопатологическое исследование
Патология подвздошной кишки
Фиксированные параформальдегидом, залитые парафином образцы дистального отдела подвздошной кишки были разрезаны на срезы толщиной 4–5 мкм, депарафинизированы в ксилоле и повторно гидрированы в этаноле.Затем срезы окрашивали гематоксилин-эозином (HE) для гистологического наблюдения под световым микроскопом.
Бокаловидные клетки в слизистой оболочке
Подсчитывали количество бокаловидных клеток в срезах, полученных в разные моменты времени. Отбирали по десять крипт ворсинок кишечника в каждом отделе, и в среднем брали по три среза на животное.
Оценка повреждения слизистой оболочки подвздошной кишки
Наблюдалось следующее повреждение слизистой оболочки: [5,6] Степень 0: нормальная структура слизистой оболочки кишечника; 1 степень: субэпителиальная щель расширяется на верхушке ворсинки, что сопровождается застоем капиллярной крови; Степень 2: субэпителиальная щель еще больше расширяется и эпителиальные слои отделяются от собственной пластинки; Степень 3: много эпителиальных слоев отделено от ворсинок с обеих сторон, и несколько ворсинок расслоены; Степень 4: собственная пластинка обнажена из-за отслоения большого количества ворсинок; Степень 5: собственная пластинка переваривается и распадается, что приводит к изъязвлению.
Вестерн-блоттинг
Экспрессию каспазы-3 в слизистой оболочке кишечника определяли вестерн-блоттингом. Слизистую оболочку кишечника соскабливали, и предварительно охлажденный лизат белка RIPA добавляли в слизистую оболочку кишечника и измельчали. Его подвергали крекингу в течение 30 минут на льду с буфером для лизиса, затем супернатант собирали после центрифугирования лизата при 20 000 g в течение 30 минут при 4 ° C. Концентрацию белка в лизате измеряли с помощью набора PIERCE BCA TM Protein Assay kit (Thermo Fisher Scientific Inc.Rockford, США), затем белок хранили в холодильнике с температурой –80 ° C. Образцы белка (20 мкг) смешивали с буфером для загрузки образцов, нагревали в течение 5 минут при 95 ° C и разделяли с помощью SDS-PAGE. Затем белки переносили на нитроцеллюлозную мембрану Hybond ECL (Amersham Pharmacia Biotech Europe GmbH, Фрайбург, Германия). Сайты неспецифического связывания блокировали в 5% обезжиренном молоке и 0,1% Tween-20 в TBS в течение одного часа при комнатной температуре, после чего мембрану инкубировали в буфере для первичных антител в течение ночи, осторожно встряхивая при 4 ºC, с последующей трехкратной промывкой в 0 .1% TBST. После этого мембрану инкубировали с меченными пероксидазой вторичными антителами при комнатной температуре в течение 1 часа и снова трижды промывали 0,1% TBST. Затем блоты детектировали с помощью Lumi-Light (Roche, Мангейм, Германия) с Kodak Imager. Полосы, соответствующие обнаруженному белку, анализировали с помощью программы Adobe Photoshop 7.0.
Перед электрофорезом белок смешивали с буфером для образцов в соотношении 3: 1 и денатурировали при 100 ºC в течение 5 минут. Во время электрофореза в 12% полиакриламидном геле было взято 20 мкг белков.После переноса на NC-мембрану после электрофореза образцы блокировали в течение одного часа и инкубировали при 4 ° C с первыми антителами (антитела к казазе-3 от Cell Signaling Technology, США; TFF3, приобретенные от Abcam) в течение ночи. Затем добавляли специфическое вторичное антитело, меченное HRP (U.S. Biological, USA), и образцы инкубировали при комнатной температуре в течение одного часа и подвергали воздействию реагента ECL. NC-мембрану снова блокировали после элюирования, и кроличьи антитела против GAPDH мыши (Novus Biologicals) использовали для реакции блоттинга, сканирования изображений и анализа оптической плотности полосы.
ELISA
TNF-α, IL-1 и TGF-β1 в слизистой оболочке анализировали с помощью набора для ELISA, который был приобретен у Dakota Bio-Technology Company. Набор Human Quantikine TGF-β1 был куплен у R&D Systems.
Статистический анализ
Данные выражены как среднее ± стандартная ошибка. И сравнения были выполнены между группами данных с использованием однофакторного дисперсионного анализа. Значение P менее 0,05 считалось статистически значимым. Все данные были проанализированы с помощью SPSS 13.0 статистическое программное обеспечение.
РЕЗУЛЬТАТЫ
Анализ смертности
Согласно, смертность увеличивалась с развитием сепсиса. Смертность составила 3,3% (1/30) в течение 12 часов и 63,3% (19/30) в течение 48 часов; общая летальность составила 83,3%. Ни одна мышь не умерла через 72 часа, и ни одна из мышей в группе ложной операции не умерла.
Анализ смертности 30 мышей с сепсисом.
Патологические изменения слизистой оболочки подвздошной кишки
Под световым микроскопом (рисунки 2 и 3) серьезно поврежденная слизистая оболочка подвздошной кишки наблюдалась в трех временных точках.Баллы поврежденных слизистых оболочек составили 2,24, 3,01 и 3,13 соответственно в 6-, 24- и 48-часовых группах, и они статистически различались по сравнению с таковой в группе фиктивной операции (0,56) ( P <0,01). 24- и 48-часовые группы показали более серьезные повреждения, чем 6-часовая группа. Никаких явных бокаловидных клеток в ворсинках кишечника или клетках лиственного эпителия не наблюдалось. Количество бокаловидных клеток в 6-, 24- и 48-часовых группах было значительно ниже, чем в группе ложной операции.Более того, показатели в 24- и 48-часовых группах были значительно ниже, чем в 6-часовой группе.
Репрезентативные фотографии поврежденной слизистой оболочки кишечника после CLP (HE, исходное увеличение × 200).
Очки повреждения слизистой оболочки тонкого кишечника после CLP. По сравнению с группой фиктивных операций * P <0,01; по сравнению с 6-часовой группой: # P <0,05.
ELISA
Уровни IL-6 и TNF-α в трех экспериментальных группах были в 3–4 раза выше, чем в группе фиктивной операции ( P <0.05). А уровень TGF-β1 в 6-часовой группе был выше, чем в группе ложной операции; но уровни в 24-часовой и 48-часовой группах снизились более значительно, чем в 6-часовой группе ().
Таблица 1
Уровни медиаторов воспаления и количество бокаловидных клеток в слизистой оболочке кишечника после CLP (среднее ± SD, n = 7)
Вестерн-блоттинг
Уровни белка каспазы-3 в слизистой оболочке кишечника 6-, 24-, 48-часовые группы были в 2-4 раза выше, чем группы фиктивной операции, но статистической значимости в группах не наблюдалось.Уровень белка TFF3 в слизистой оболочке 6-часовой группы был немного повышен по сравнению с таковым в группе фиктивной операции; но уровни белка TFF3 в 24-, 48-часовых группах были значительно ниже, чем в группе фиктивной операции (Рисунки 4 и 5).
Вестерн-блоттинг, показывающий экспрессию каспазы-3 в поврежденной слизистой оболочке кишечника после CLP ( n = 3).
Экспрессия TFF3 слизистой оболочки кишечника в псевдооперационных, 6-, 24- и 48-часовых группах. По сравнению с группой фиктивных операций, * P <0.05.
ОБСУЖДЕНИЕ
Некоторые исследования показали, что поврежденная слизистая оболочка кишечника имеет способность быстро восстанавливаться и может установить целостность поверхностных эпителиальных клеток за короткий период времени. В нашем исследовании, однако, мы не обнаружили очевидной быстрой реконструкции слизистой оболочки кишечника у мышей с сепсисом, вызванным перевязкой слепой кишки и пункцией (CLP). Бокаловидные клетки, которые сыграли важную роль в реконструкции кишечного эпителия, не собирались в большом количестве вокруг поврежденных ворсинок, а наоборот, уменьшались.Экспрессия TFF3 и TGF-β1, которые играют важную роль в реконструкции слизистой оболочки кишечника, также показала прогрессивное снижение. Эти данные, сопровождаемые повышенным уровнем провоспалительных цитокинов и проапоптотического белка caspse-3, свидетельствуют о том, что стойкое воспаление слизистой оболочки, апоптоз клеток кишечного эпителия и снижение способности к реконструкции являются факторами, влияющими на восстановление поврежденной слизистой оболочки кишечника.
Ремонт кишечного эпителия имеет по крайней мере три различных и перекрывающихся механизма и подвергается сложной и жесткой регуляции.[7] Эпителиальные клетки около поврежденного участка покрывают поверхность ворсинок или слизистой оболочки за счет миграции и восстанавливают новую сплошную поверхность ворсинок. Это восстановление без пролиферации клеток называется реконструкцией, которая происходит от нескольких минут до нескольких часов после повреждения слизистой оболочки, обычно в течение 24-48 часов. Более того, необходим физический барьер для предотвращения транслокации бактерий и эндотоксинов. Затем происходит мобилизация клеточной пролиферации, чтобы дополнить уменьшенное количество клеток и пролиферацию клеток посредством дифференцировки.Слизистая оболочка в конечном итоге будет соответствовать биологической функции эпителия слизистой оболочки. [8,9] Следовательно, первым шагом к восстановлению повреждения слизистой оболочки кишечника является реконструкция эпителиальных клеток, в которых бокаловидные клетки особенно важны. В текущем исследовании бокаловидные клетки не принимали значительного участия в реконструкции. TFF3, важный продукт бокаловидных клеток, играет ключевую роль в защите слизистой оболочки кишечника и способствует восстановлению поврежденной слизистой оболочки. Dignass et al [10] сообщили, что участие TFF3 увеличивает способность бокаловидных клеток в 3-6 раз к реконструкции.Наши исследования [11,12] также подтвердили, что быстрая реконструкция поврежденной слизистой оболочки кишечника у животных с геморрагическим шоком сопровождалась повышенной экспрессией TFF3.
Подобно TFF3, TGF-β1 способствует восстановлению поврежденного эпителия кишечника. TGF-β1 может также способствовать миграции кишечных эпителиальных клеток к поврежденной слизистой оболочке. [10,13] В нашем исследовании TGF-β1 в 6-часовой группе показал временное повышение, за которым последовало быстрое снижение, а затем приблизилось к уровень фиктивной группы.Поскольку поврежденные клетки могут высвобождать часть TGF-β1, его истинная экспрессия может быть ниже. Помимо поддержки обновления клеток, TGF-β1 может регулировать воспаление слизистой оболочки, ингибируя экспрессию провоспалительных цитокинов TNF-α и IFN-γ и увеличивая экспрессию противовоспалительных медиаторов IL-10. [14,15] Другое исследование. обнаружили, что ряд других факторов, участвующих в восстановлении тканей, таких как IL-1, IL-2 и IFN-бета, и гормон роста (EGF и FGF), активируются TGF-β1-зависимым путем.Таким образом, низкий уровень экспрессии TGF-β1 не только не смог снизить воспалительный ответ, но также увеличил повреждение кишечного эпителия и замедлило заживление после повреждения. [16-18]
Уровни воспалительных цитокинов 6, 24, и через 48 часов после CLP были в несколько раз выше, чем в контрольной группе. Это открытие доказало, что воспаление слизистой оболочки продолжалось. Воспалительные цитокины, высоко экспрессируемые в слизистой оболочке кишечника, могут приводить к апоптозу большого количества эпителиальных клеток кишечника, включая бокаловидные клетки.Гибель клеток может происходить из-за снижения стимулирующих факторов репарации или ингибирования реконструкции или репарации слизистой оболочки.
Сепсис приводит к повреждению слизистой оболочки кишечника, бактериальной транслокации и дальнейшему усугублению поражения кишечника и удаленных органов. Апоптоз большого количества эпителиальных клеток кишечника может привести к повреждению кишечного барьера. Снижение количества бокаловидных клеток и экспрессия TFF3 и TGF-β1, которые могут защитить слизистую кишечника и способствовать ее восстановлению после повреждения, влияют на восстановление поврежденной слизистой оболочки.
Сноски
Финансирование: Исследование было поддержано грантом Китайского национального фонда естественных наук (81071761) и Гуандунского национального фонда естественных наук (101510080135).
Этическое разрешение: Настоящее исследование было одобрено Комитетом по уходу и использованию животных Мемориальной больницы Сунь Ятсена Университета Сунь Ятсена, Гуанчжоу, Китай.
Конфликт интересов: У авторов нет конкурирующих интересов, имеющих отношение к настоящему исследованию.
Соавторы: Чанг Р.М. предложил и написал статью. Все авторы отредактировали окончательную версию статьи.
СПРАВОЧНАЯ ИНФОРМАЦИЯ
1. Deitch EA. Лимфа и лимфатические сосуды кишечника: источник факторов, ведущих к повреждению и дисфункции органов. Ann N Y Acad Sci. 2010; 1207: E103–11. [PubMed] [Google Scholar] 2. Coopersmith CM, Stromberg PE, Dunne WM, Davis CG, Amiot DM, 2nd, Buchman TG, et al. Ингибирование апоптоза кишечного эпителия и выживаемость на мышиной модели вызванного пневмонией сепсиса.ДЖАМА. 2002; 287: 1716–1721. [PubMed] [Google Scholar] 3. Hassoun HT, Kone BC, Mercer DW, Moody FG, Weisbrodt NW, Moore FA. Посттравматическая полиорганная недостаточность: роль кишечника. Шок. 2001; 15: 1–10. [PubMed] [Google Scholar] 4. Хаббард WJ, Choudhry M, Schwacha MG, Kerby JD, Rue LW, 3rd, Bland KI, et al. Перевязка слепой кишки и пункция. Шок. 2005; 24: 52–57. [PubMed] [Google Scholar] 5. Фернандес-Эстиварис К., Гу Л.Х., Гу Л., Йонас С.Р., Уоллес Т.М., Паскаль Р.Р. и др. Экспрессия трилистника пептида и количество бокаловидных клеток в кишечнике крысы: эффекты KGF и возобновление кормления натощак.Am J Physiol Regul Integr Comp Physiol. 2003; 284: R564–573. [PubMed] [Google Scholar] 6. Надлер Е.П., Дикинсон Э., Книзели А., Чжан XR, Бойл П., Бир-Штольц Д. и др. Экспрессия индуцибельной синтазы оксида азота и интерлейкина-12 при экспериментальном некротическом энтероколите. J Surg Res. 2000. 92: 71–77. [PubMed] [Google Scholar] 7. Инь К., Данг СК, Чжан Дж. Взаимосвязь между экспрессией запускающего рецептора-1 на миелоидных клетках в ткани кишечника и дисфункцией кишечного барьера при тяжелом остром панкреатите.Мир J Emerg Med. 2011; 2: 216–221. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Поттен С.С., Келлетт М., Рью Д.А., Робертс С.А. Пролиферация в эпителии желудочно-кишечного тракта человека с использованием бромдезоксиуридина in vivo : данные для различных участков, близости к опухоли и полипоза кишечной палочки. Кишечник. 1992; 33: 524–529. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Нусрат А, Делп С, Мадара Дж. Реституция кишечного эпителия. Характеристика модели клеточной культуры и картирование элементов цитоскелета в мигрирующих клетках.J Clin Invest. 1992; 89: 1501–1511. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Дигнасс А, Линч-Девани К., Киндон Х, Тим Л, Подольский ДК. Пептиды трилистника способствуют миграции эпителия через бета-независимый путь трансформирующего фактора роста. J Clin Invest. 1994; 94: 376–383. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Чжан Ц., Гао Г.Р., Цзян Х.Й., Лв Ц.Г., Чжан Б.Л., Се М.С. и др. Влияние гипотермии окружающей среды на гемодинамику и динамику кислорода в модели геморрагического шока свиньи, находящейся в сознании.Мир J Emerg Med. 2012; 3: 128–134. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Ciacci C, Lind SE, Подольский ДК. Трансформирующий фактор роста бета-регуляция миграции в монослоях эпителия кишечника раненых крыс. Гастроэнтерология. 1993; 105: 93–101. [PubMed] [Google Scholar] 13. Шулл М.М., Ормсби И., Кир А.Б., Павловски С., Диболд Р.Дж., Инь М. и др. Нацеленное нарушение гена трансформирующего фактора роста-β1 мыши приводит к мультифокальному воспалительному заболеванию. Природа. 1992; 359: 693–699. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14.Сакураба Х., Исигуро Й., Ямагата К., Мунаката А., Накане А. Блокада TGF-бета ускоряет разрушение слизистой оболочки за счет апоптоза эпителиальных клеток. Biochem Biophys Res Commun. 2007; 359: 406–412. [PubMed] [Google Scholar] 15. Sturm A, Dignass AU. Реституция эпителия и заживление ран при воспалительном заболевании кишечника. Мир Дж. Гастроэнтерол. 2008. 14: 348–353. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Ши HP, Deitch EA, Da Xu Z, Lu Q, Hauser CJ. Гипертонический раствор улучшает барьерную функцию слизистой оболочки кишечника и повреждение легких после травмо-геморрагического шока.Шок. 2002; 17: 496–501. [PubMed] [Google Scholar] 17. Чжан З.Дж., Пэн Л.Б., Ло Ю.Дж., Чжоу С.Ю. Перспективные экспериментальные исследования защитного действия улинастатина на почки после отравления паракватом. Мир J Emerg Med. 2012; 3: 299–304. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Канаяма Н., Эль-Марадни Е., Ямамото Н., Токунага Н., Маэхара К., Терао Т. Ингибитор трипсина в моче: новый препарат для лечения преждевременных родов: сравнительное исследование с ритодрином. Eur J Obstet Gynecol Reprod Biol. 1996. 67: 133–138. [PubMed] [Google Scholar], как слой кишечной слизи управляет кишечной микробиотой
Gastroenterol Rep (Oxf).2019 Фев; 7 (1): 3–12.
Bjoern O Schroeder
Лаборатория Валленберга и Центр сердечно-сосудистых и метаболических исследований Sahlgrenska, Отделение молекулярной и клинической медицины, Институт медицины, Bruna Stråket 16, Университет Гетеборга, SE 413 45 Гетеборг, Швеция
Лаборатория Валленберга и Центр Sahlgrenska для сердечно-сосудистых и метаболических исследований, Отделение молекулярной и клинической медицины, Институт медицины, Бруна Стракет 16, Гётеборгский университет, SE 413 45 Гётеборг, Швеция
Автор, ответственный за переписку .Лаборатория Валленберга и Центр сердечно-сосудистых и метаболических исследований Сальгренска, Отделение молекулярной и клинической медицины, Институт медицины, Бруна Стракет 16, Гётеборгский университет, SE 413 45 Гётеборг, Швеция. Тел: + 46-31-34-28-67-2; Электронная почта: [email protected]Поступило 7 ноября 2018 г .; Пересмотрено 29 ноября 2018 г .; Принято 13 декабря 2018 г.
Авторские права © Автор (ы) 2019. Опубликовано Oxford University Press и Шестой дочерней больницей Университета Сунь Ятсена Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http : // creativecommons.org / licenses / by-nc / 4.0 /), который разрешает некоммерческое повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. По вопросам коммерческого повторного использования обращайтесь по адресу [email protected]. Эта статья цитируется в других статьях PMC.Abstract
В кишечном тракте обитает огромное количество микроорганизмов, называемых кишечной микробиотой. Эти микроорганизмы живут в мутуалистических отношениях со своим хозяином и способствуют разложению сложных углеводов.Хотя микробиота кишечника обычно считается полезной, огромное количество микробных клеток также представляет собой постоянную угрозу для хозяина. Таким образом, эпителий кишечника покрыт плотным слоем слизи, чтобы предотвратить перемещение микробиоты кишечника в подлежащие ткани. Кишечная слизь представляет собой организованную сеть гликопротеинов с гликановой структурой, специфичной для хозяина. Хотя слой слизи долгое время считался пассивным барьером, созданным хозяином, недавние исследования показали, что на созревание и функцию слоя слизи сильно влияет микробиота кишечника.В свою очередь, репертуар гликанов муцинов может отобрать отдельные бактерии, ассоциированные со слизистой оболочкой, которые способны связывать или разрушать определенные гликаны муцина в качестве источника питательных веществ. Поскольку слой кишечной слизи находится на важнейшем стыке между хозяином и микробами, его разрушение приводит к вторжению кишечных бактерий, что в конечном итоге может вызвать воспаление и инфекцию. Соответственно, при колите у мышей и людей наблюдается дисфункциональный слой слизи. Более того, недавно было продемонстрировано, что повышенное потребление диеты западного типа с низким содержанием клетчатки в нашем современном обществе вызывает бактериальные дефекты слизистого слоя кишечника.Здесь я рассмотрю текущие знания о взаимодействии между кишечными бактериями и слоем кишечной слизи при здоровье и болезнях. Понимание молекулярных деталей этого взаимодействия между хозяином и микробом может способствовать разработке новых вариантов лечения заболеваний, связанных с дисфункциональным слоем слизи, таких как язвенный колит.
Ключевые слова: Пищевые волокна, микробиота кишечника, взаимодействие хозяина и микроба, воспалительное заболевание кишечника, слизь, муцин, слизистый барьер, метаболическое заболевание, пробиотики, язвенный колит
Введение
Сообщество кишечных микробов, называемое микробиотой кишечника, живет в мутуалистических отношениях со своим хозяином и производит витамины и другие метаболиты, полезные для физиологии хозяина.Однако, хотя эти производные от микробиоты молекулы могут передавать сигналы органам, удаленным от кишечника [1], их микробные продуценты должны содержаться в просвете кишечника. Поскольку микробиота кишечника отделена от хозяина только одним слоем энтероцитов, триллионы бактериальных клеток представляют собой постоянную угрозу. Таким образом, для предотвращения транслокации комменсальных и патогенных микроорганизмов через барьер слизистой оболочки хозяин разработал эффективные защитные механизмы, включая формирование физического слизистого барьера, покрывающего эпителий кишечника.
Кишечная слизь продуцируется бокаловидными клетками и образует высокоорганизованную гликопротеиновую сеть, в основном состоящую из муцина 2 (MUC2), но также содержащую стабильный протеом ядра [2]. Слизистый слой долгое время считался простым лубрикатором, облегчающим прохождение фекального материала по кишечному каналу, но недавний интерес к кишечной микробиоте также привлек внимание исследователей к кишечной слизи. Хотя мы все еще только начинаем понимать функцию и важность слизистого слоя, недавние исследования уже показали, что его взаимодействие с кишечной микробиотой более интенсивно, чем считалось ранее.Более того, наблюдение дефектов слизи при таких заболеваниях, как воспалительное заболевание кишечника [3, 4] и гипергликемия [5], подчеркивает важность этого барьера для физиологии хозяина. Здесь я делаю обзор недавних результатов о взаимодействии между кишечной микробиотой и слоем кишечной слизи при здоровье и болезни.
Структура слизистого слоя кишечника
Кишечная слизь вырабатывается бокаловидными клетками, специализированными секреторными клетками эпителиального слоя. В тонком кишечнике бокаловидные клетки преимущественно локализуются в криптах Либеркюн, но также в меньшем количестве на ворсинах тонкого кишечника.В толстой кишке секретирующие слизь клетки накапливаются в открытии крипт толстой кишки, но также обнаруживаются глубже в криптах и на поверхности толстой кишки. Недавно у мышей в открытии крипты толстой кишки был идентифицирован специализированный подтип «сторожевых» бокаловидных клеток, которые регулируют секрецию слизи в ответ на бактериальные захватчики, которым удалось проникнуть во внутренний слой слизи толстой кишки [6].
Основным секретируемым белком слизи в кишечнике является MUC2, кодируемый геном MUC2 на хромосоме 11 человека.Этот гелеобразующий гликопротеин состоит из более чем 5100 аминокислот и сильно O-гликозилирован [7], генерируя молекулярную массу около 2,7 МДа на молекулу муцина [8]. Фактически, более 80% его молекулярной массы связано с боковыми цепями олигосахаридов, что объясняет характерные гелеобразующие свойства. Кроме того, специфический для слизи гликановый декор является важной частью его взаимодействия с микробиотой кишечника и будет обсуждаться более подробно ниже.
Внутри эндоплазматического ретикулума бокаловидных клеток мономеры MUC2 димеризуются через свои С-концевые дисульфидные мостики [9] и впоследствии тримеризуются через межмолекулярные дисульфидные мостики через характерные N-концевые D-домены Виллебранда в Гольджи [10].Эти олигомеры муцина затем плотно упаковываются в секреторные везикулы, где низкий pH, высокая концентрация Ca 2+ и отсутствие воды облегчают организованные условия хранения. Последующая секреция слизи лучше всего охарактеризована в тонкой кишке: секреция гидрокарбоната (HCO 3 —) каналом трансмембранного регулятора проводимости муковисцидоза (CFTR) приводит к подщелачиванию условий и снижению концентрации Ca 2+ по сравнению с к окружающей среде в гранулах слизи.Эти изменения окружающей среды делают возможным массовое разрастание олигомеров слизи, генерируя 2D, высокоорганизованные листы, которые взаимодействуют с ранее сформированными, создавая трехмерный слой слизи [11, 12]. В то же время гидратация приводит к набуханию слизи, вызывая увеличение объема упакованного муцина в 100–1000 раз [13]. Однако недавние результаты показывают, что сборка муцина, вероятно, еще более сложна и может также включать молекулы, не являющиеся муцинами: например, присутствие фактора трилистника-3 (TFF3), кератинов и кальций-связывающих белков в препарате нативного муцина может указывать на их значимость. для сборки муцина, даже несмотря на то, что их индивидуальные роли и вклады должны быть проверены экспериментально [14].
При секреции в тонкий кишечник слизь образует единый слой, который распространяется на кончики ворсинок тонкого кишечника [15]. В то время как только несколько исследований подробно изучали слизь тонкого кишечника, похоже, что у мышей слизь не является полностью непроницаемой для бактерий и высвобождается из эпителия микробной протеазой меприн-β [15, 16]. Учитывая, что тонкий кишечник является метаболически активным органом, который специализируется на поглощении питательных веществ, рыхлая сеть муцина может способствовать поглощению пищевых молекул через эпителиальную границу.Однако, чтобы предотвратить побег условно-патогенных бактерий из окружающей среды просвета, слизь тонкого кишечника заряжается защитными молекулами, сравнимыми с электрическим забором () [17]. Эти антибактериальные белки и пептиды включают, среди прочего, дефенсины, продуцируемые клетками Панета, лизоцим, регенерирующий островковый белок 3α (REG3α; REG3γ у мышей) и фосфолипазу A2-IIA [17–20]. Кроме того, агрегация бактерий индуцируется такими молекулами, как иммуноглобулин А или альфа-дефенсин 6, которые тем самым предотвращают пересечение слизистых оболочек за счет исключения размера [21, 22].Следует отметить, что, несмотря на то, что для эффективной защиты хозяина от кишечной микробиоты требуется герметичный физический барьер, в слое слизи обнаруживаются определенные лазейки. Они локализуются в областях над пятнами Пейера, которые представляют собой очаговые структуры, характеризующиеся наличием микроскладчатых (М) клеток в связанном с фолликулом эпителии [23]. Поскольку М-клетки специализируются на взятии проб микробных и пищевых антигенов из просвета кишечника, физический слизистый барьер поверх этих структур проницаем для бактерий или даже может отсутствовать [15, 23].
На структуру слизистого слоя влияет микробиота кишечника. Кишечные бактерии отделены от эпителия хозяина слоем кишечной слизи, который усилен защитными молекулами хозяина, такими как дефенсины, домен Ly6 / PLAUR, содержащий белок 8 (LYPD8), белок гранул зимогена 16 (ZG16), регенерирующие белки, происходящие из островков 3 (REG3α / γ) и другие. Присутствие кишечной микробиоты индуцирует экспрессию генов, кодирующих муцин 2 ( Muc2 ) и галактозид 2-альфа-L-фукозилтрансферазу 2 ( Fut2 ), тем самым влияя на прочность слизи и структуру гликанов муцина.Это, в свою очередь, может повлиять на состав кишечной микробиоты, поскольку определенные кишечные бактерии, такие как Bacteroides thetaiotaomicron , могут связывать и метаболизировать гликаны муцина в качестве источника энергии. Разложение гликанов приводит к образованию микробных метаболитов, которые не только влияют на дифференцировку бокаловидных клеток, но также через перекрестное питание других видов микробов, например Faecalibacterium prausnitzii . Соответственно, состав микробиоты кишечника влияет на функцию слизи за счет наличия микробных метаболитов.
В толстой кишке слизь характеризуется отчетливым многослойным внутренним слоем, который практически не содержит бактерий, и менее выраженным внешним слоем, который состоит из слизи, кишечных бактерий и пищевых продуктов [24]. Из-за смешивания с содержимым кишечника внешний слой часто трудно наблюдать на срезах ткани толстой кишки или с помощью других методов визуализации. Напротив, внутренний слой слизи толстой кишки отчетливо виден, показывая, что его толщина поддерживается на довольно постоянном уровне: ~ 50–80 мкм у мышей и ~ 100 мкм у людей [4, 15, 24, 25].Поскольку слизь постоянно секретируется на базальном уровне, это указывает на то, что переход от внутреннего слоя к внешнему должен строго регулироваться. В самом деле, активированный кальцием регулятор хлоридных каналов 1 (CLCA1), который, несмотря на свое название, является металлопротеазой с высоким содержанием в слизи толстой кишки, как недавно было показано, вносит вклад в этот переход [26]. Однако делеция Clca1 у мышей показала, что дополнительные, еще не идентифицированные цистеиновые протеазы могут компенсировать недостаток этого фермента, предполагая уровень избыточности в этом процессе.Опосредуется ли переход между внутренним и внешним слоем слизи только протеазами хозяина, или же бактериальные ферменты могут добавить дополнительный уровень сложности, будет интересным вопросом, который необходимо изучить в будущих исследованиях.
В отличие от подвздошной кишки, в которой антимикробные пептиды убивают микроорганизмы, которые достигают эпителия, бактерии толстой кишки образуют активный внутренний биореактор, производящий огромное количество метаболитов, включая витамины и короткоцепочечные жирные кислоты (SCFA), которые влияют на физиологию хозяина в основном благотворно [1, 27–31].Следовательно, внутренний биореактор необходимо поддерживать регулируемым образом — следовательно, на достаточном расстоянии от эпителия. Соответственно, эпителий толстой кишки производит меньше антибактериальных пептидов, которые прилипают к слизи, но скорее секретирует пептиды, которые связывают и агрегируют бактерии и, следовательно, ингибируют проникновение бактерий через исключение физического размера и ингибирование подвижности. Примечательно, что, несмотря на относительно макроскопический механизм, эти пептиды довольно специфичны. Недавно было показано, что домен Ly6 / PLAUR, содержащий белок 8 (Lypd8), специфически связывает флагеллированные бактерии и, таким образом, блокирует их подвижность в толстой кишке мышей [32].Кроме того, лектин-подобный белок zymogen granulae protein 16 (ZG16) специфически связывает пептидогликан бактериальной клеточной стенки грамположительных бактерий и тем самым ингибирует их проникновение во внутренний слой слизи толстой кишки [33]. Однако эта система защиты от связывания / агрегации дополняется дополнительными антимикробными пептидами, такими как REG3γ, резистиноподобная молекула β (RELMβ) и другие [19, 34]. Следовательно, слизь в тонком и толстом кишечнике защищает хозяина от кишечной микробиоты с помощью разных, но схожих эффективных механизмов.
Специфическое взаимодействие между кишечной микробиотой и слоем слизи
Несмотря на то, что кишечная слизь является барьером против кишечной микробиоты, для развития ее полной функциональности необходимо присутствие бактерий, как было показано на стерильных (GF) животных. Ранние гистохимические анализы уже описали более тонкий или местами даже отсутствующий слой слизи в толстой кишке крыс GF [35]. Более того, окрашивание периодической кислотой-Шиффом (PAS) — методика, используемая для окрашивания полисахаридов и гликопротеинов — в том же исследовании выявило структурные различия внутри слоя, поскольку слой слизи толстой кишки выглядел менее плотным у крыс GF по сравнению с крысами, выращенными традиционным способом (). [35].Эти данные были дополнены более специфическим окрашиванием лектинов, которое выявило менее интенсивную реактивность на UEA-1 ( Ulex europaeus agglutinin I ; α-L-фукоза) и DBA ( Dolichis biflorus agglutinin ; α-N-Acetyl-D -галактозамин) инкубация бокаловидных клеток в слепой кишке, но не в тонком или толстом кишечнике мышей GF [36]. Хотя это указывает на то, что концевые остатки гликана в слепой кишке мышей GF отличаются от их обычных аналогов, секретируемая слизь в этом исследовании не анализировалась.Однако важно отметить, что наблюдение, что гликозилирование муцина различается уже внутриклеточно до выделения слизи, предполагает, что не только бактериальная деградация конкретных гликанов слизи (см. Ниже), но также опосредованные бактериями процессы хозяина вносят вклад в фукозилирование слизи. Эта гипотеза подтверждается данными сравнения фукозилированных гликоконъюгатов между GF и мышами, выращенными традиционным способом: в тонком кишечнике колонизированные мыши демонстрировали возрастающий градиент фукозилированных эпитопов в энтероцитах, клетках Панета и бокаловидных клетках, тогда как фукозилирование в тонком кишечнике у мышей GF могло быть только обнаружен в клетках Панета на дне крипт Либеркюн [37].Дальнейшие эксперименты показали, что микробиота специфически индуцирует экспрессию фукозилтрансфераз хозяина, которые добавляют L-фукозу в α-1,2 положении [37].
В то время как сравнение между взрослыми GF и грызунами, выращиваемыми традиционным способом, показывает четкую разницу в толщине и составе слизи [35, 36, 38, 39], модель GF на мышах представляет собой крайний случай естественной ситуации, в которой кишечник новорожденного становится после рождения колонизированы отдельной микробной популяцией. Интересно, что хотя экспрессия генов муцина мыши Muc1-4 увеличивалась между 1 и 6 днями постнатального периода даже в отсутствие микробиоты [40], присутствие сложной микробиоты приводило к более высокой исходной экспрессии гена, кодирующего секретируемый MUC2. , но не мембраносвязанных муцинов 1, 3 и 4.Напротив, мыши, моноколонизированные пробиотическими бактериальными штаммами Lactobacillus acidophilus NCFM или Escherichia coli Nissle 1917, демонстрировали сходную экспрессию Muc2 по сравнению с уровнем мышей GF [40]. Это указывает на то, что другие члены сложного микробного сообщества необходимы для стимуляции экспрессии Muc2 или что потенциальное метаболическое взаимодействие между видами микробов необходимо для выработки сигнала, индуцирующего Muc2 .
Поскольку экспрессия мРНК Muc2 не полностью соответствует продукции MUC2, а функция слизи в значительной степени регулируется на посттрансляционном уровне, анализа экспрессии Muc2 недостаточно для полной оценки функции слизистого слоя кишечника [12]. Таким образом, содержание белка MUC2 и, используя метод ex vivo для исследования функции слизи в живой ткани [25], исследовали толщину слизи и проницаемость слизи у мышей GF после колонизации сложным микробным сообществом [41].Мыши GF имели проницаемый слой слизи внутренней толстой кишки, который содержал более низкое относительное содержание белка MUC2 по сравнению с мышами, выращенными традиционным способом. Примечательно, что толщина внутреннего слоя слизи толстой кишки не различалась между двумя группами мышей при использовании этого метода ex vivo , но, поскольку проницаемая слизь, которая содержит более низкую концентрацию белка MUC2, возможно, сжимается больше, чем неповрежденный слой во время фиксации. [42], эти данные, вероятно, описывают тот же биологический дефект, который наблюдался в фиксированных срезах ткани [38, 39, 43].После того, как мыши GF были колонизированы сложным микробным сообществом, слизистому слою толстой кишки требовалось около 5 недель, чтобы стать непроницаемым — столько же времени, сколько необходимо для нормального отделения слизи тонкого кишечника от кишечного эпителия [41].
Несмотря на наличие основного сообщества кишечной микробиоты, которое наблюдается у большинства людей, существуют значительные различия в микробном составе кишечника между отдельными хозяевами [44–48]. Учитывая решающее влияние микробиоты кишечника на функцию слизи [41], неудивительно, что различия в составе микробиоты влияют на свойства слизи.Соответственно, в двух колониях мышей, которые были размещены в разных комнатах одного и того же помещения для животных, одна колония показывала нормальный непроницаемый внутренний слой слизи толстой кишки, тогда как вторая колония имела проницаемую слизь. Это различие может быть связано со специфическим составом микробиоты кишечника, поскольку фенотип слизи передавался мышам GF при трансплантации микробиоты слепой кишки [49]. Однако, хотя наблюдались различия в микробном составе между двумя колониями мышей, сильные межиндивидуальные различия в колониях мышей не позволяли причинно связать определенные бактериальные таксоны с функцией слизи.Следовательно, хотя очевидно, что состав микробного сообщества влияет на функцию слизи, эффекты конкретных членов кишечного микробного сообщества в значительной степени неизвестны, а влияние на функцию слизи может зависеть от структуры сообщества, а не от отдельных таксонов. Однако все больше данных свидетельствует о том, что некоторые штаммы бактерий обладают более сильным потенциалом, чем другие, влиять на функцию слизи (см. Ниже).
Следует отметить, что анализы кишечной микробиоты и трансплантации микробиоты часто фокусируются на членах бактериального сообщества, игнорируя потенциальное влияние вирусов и грибов, которые также пересаживаются в сложные сообщества.В частности, было показано, что бактериофаги — специфические для бактерий вирусы, которые населяют кишечник в большом разнообразии [50], локализуются на поверхности слизистых оболочек и особенно обогащены слизью по сравнению с окружающей средой [51]. Согласно предложенной модели «прилипания бактериофагов к слизи» (BAM), фаги могут прикрепляться к гликановым остаткам гликопротеинов муцина посредством взаимодействия с Ig-подобными доменами их белков капсида вируса, тем самым формируя дополнительный независимый от хозяина антимикробный щит против кишечника. микробиота [51].Наблюдение за тем, что вирусный состав в кишечнике пациентов с воспалительным заболеванием кишечника (ВЗК) отличается от здоровых людей, в основном за счет увеличения бактериофагов Caudovirales, дополнительно подтверждает важность сложного фаго-бактериального взаимодействия в кишечнике, которое важно для здоровья. и болезнь [52, 53].
Гликаны слизи как источник энергии для кишечной микробиоты
О-связанные олигосахариды составляют около 80% от общей молекулярной массы кишечной слизи [7, 54].Поскольку селективные кишечные бактерии могут разлагать гликаны слизи в качестве источника энергии [39, 55, 56], вполне вероятно, что на видоспецифический состав кишечной микробиоты влияет профиль гликозилирования слизистого слоя, который также различается у разных видов [54 , 57–60]. В поддержку этой теории, мыши, у которых отсутствует экспрессия производных ядра 1 O-гликанов, имеют тонкие различия микробиоты в просвете слепой кишки [61]. Однако, поскольку характер гликозилирования слизи скорее влияет на бактерии, связанные со слизистой оболочкой, вполне вероятно, что микробная популяция слизистой оболочки кишечника будет затронута в большей степени.Действительно, у людей экспрессия галактозид 2-α-L-фукозилтрансферазы 2 (FUT2), кодируемая геном FUT2 (секретор), как было показано, влияет на состав кишечной микробиоты, связанный со слизистой оболочкой толстой кишки [62]. FUT2 передает концевой остаток фукозы гликопротеинам слизистого слоя и других секретов организма и отвечает за экспрессию антигенов группы гистокрови ABO [63]. Нонсенс-мутация в гене FUT2 , которая инактивирует фермент и приводит к «несекреторному» фенотипу, была связана с болезнью Крона [64, 65].Более того, взаимодействие между болезнью Крона и генотипом секретора было связано с изменениями в бактериальных сообществах: на уровне вида (идентичность ≥97%) одна операционная таксономическая единица (OTU), связанная с Lactobacillus , и две OTU, связанные с Stenotrophomonas были более многочисленны среди здоровых секреторных генотипов, в то время как пять OTU, принадлежащих к Prevotella , Brevundimonas , Sutterella , Faecalibacterium и неклассифицированному Lachnospiraceae, были связаны с несекреторными вересками.Напротив, три ОТЕ, принадлежащие к Alistipes , Coprococcus и неклассифицированному Lachnospiraceae, были более многочисленны у несекреторных индивидуумов с болезнью Крона [62]. Это говорит о том, что сочетание определяемой генотипом структуры гликанов и статуса заболевания может влиять на микробное сообщество кишечника на слизистой оболочке кишечника. Однако снижение численности бифидобактерий, о котором сообщалось в образцах стула несекреторов в когорте из 79 финнов [66], не могло быть подтверждено при тестировании более крупных когорт [67, 68].Тем не менее, в соответствии с ранее упомянутым исследованием на мышах [61], ясно, что генотип FUT2 влияет только на микробное сообщество, связанное со слизистой оболочкой, и не модулирует состав фекальной микробиоты, который был проанализирован в больших когортах.
Было продемонстрировано, что взаимодействие между структурой гликанов слизи и составом кишечной микробиоты является более систематическим, чем считалось ранее: в эпохальном исследовании Брай и его коллеги [37] обнаружили, что Bacteroides thetaiotaomicron ( B.theta ), обычный представитель нормальной кишечной микробиоты мыши и человека, способен индуцировать фукозилирование в подвздошной кишке мыши (). Примечательно, что индукция фукозилтрансфераз хозяина с помощью B. theta регулировалась фактической концентрацией фукозы, производной от хозяина [69], и отсутствовала у изогенного бактериального мутанта, который был неспособен метаболизировать L-фукозу в качестве источника энергии [37]. Это указывает на то, что B. theta индуцирует фукозилирование слизистой оболочки, чтобы создать свою собственную нишу, обеспечивающую питательные вещества.Хотя этот феномен иллюстрирует взаимодействие bona fide хозяин-микроб, молекулярный сигнал, который стимулирует эпителиальные фукозилтрансферазы, остается неизвестным, но включает передачу сигналов через регулируемые внеклеточными сигналами киназы (ERK) и пути передачи сигнала N-концевых киназ c-Jun (JNK). в слизистой оболочке кишечника [70].
Помимо воздействия на фукозилирование слизи, B. theta также способствует дифференцировке бокаловидных клеток, стимулируя секреторную линию в эпителии толстой кишки крыс — эффект, опосредованный ацетатом SCFA [71].Кроме того, присутствие B. theta приводило к увеличению экспрессии гликанов, несущих остатки сиаловой кислоты гликанов слизи, тогда как экспрессия сульфатированных и нейтральных олигосахаридов снижалась. Интересно, что когда моноколонизированных крыс B. theta- были дополнены Faecalibacterium prausnitzii , потребителем ацетата и продуцентом бутирата, увеличение дифференцировки бокаловидных клеток и изменение гликанового профиля слизи прекратилось [71]. Следовательно, это исследование ясно показало, что не вся слизь создается одинаково, но вместо этого присутствие бактерий, а точнее наличие и относительное количество определенных бактерий, формирует гликановый профиль слизистого слоя ().
Микробиота кишечника разлагает пищевые субстраты, которые не метаболизируются и не поглощаются тонкой кишкой и, таким образом, достигают просвета толстой кишки. Эти пищевые субстраты представляют собой в основном полисахариды растительного происхождения, для которых хозяин имеет лишь ограниченный ферментный репертуар, состоящий примерно из 17 углеводно-активных ферментов (CAZymes) [72]. Напротив, генетический репертуар кишечной микробиоты человека (кишечного микробиома) кодирует по крайней мере 89 семейств CAZyme, что предполагает способность расщеплять широкий спектр углеводов [72, 73].Фактически, протеом B. theta сам по себе включает по крайней мере 172 гликозилгидролазы, тем самым превышая возможности многих других секвенированных кишечных микробиоты [74]. Примечательно, что распространенность CAZymes в микробиоте кишечника, как было установлено, зависит от географического положения и возраста, что позволяет предположить, что адаптация, зависящая от диеты, возможна [72].
В то время как пищевые углеводы являются основным источником питательных веществ для микробиоты кишечника, слой слизи является альтернативным источником гликанов, полученных из организма хозяина, и способствует колонизации и сохранению бактерий в кишечнике человека [55, 75, 76].Такая метаболическая гибкость особенно очевидна и полезна для микробов, когда в рационе отсутствуют сложные углеводы или углеводы, доступные для микробиоты (МАК [77]), о чем свидетельствуют исследования по изучению метаболизма гликанов B. theta у новорожденных мышей. [78] или у мышей, которых кормили диетой, лишенной пищевых волокон [79]. Возможность переключения с пищевых гликанов на гликаны, полученные от хозяина, соответственно определяет, какая кишечная микробиота может сохраняться в кишечнике, когда диетические МАК являются недостаточными.
Среди синтетического сообщества, состоящего из 13 видов кишечных микробов человеческого происхождения, которые охватывают представителей доминирующих типов в кишечнике человека, было обнаружено, что Akkermansia muciniphila и Barnesiella кишечника являются специалистами по слизи и питаются исключительно муцином O- гликаны. Напротив, B. theta и Bacteroides caccae продемонстрировали метаболическую гибкость, упомянутую выше, и поэтому были названы универсальными слизистыми, которые могут питаться различными полисахаридами [39].Примечательно, что когда мышей, которые были колонизированы этим синтетическим сообществом, были переведены с рациона, богатого клетчаткой, на диету без клетчатки, экспрессия и активность CAZymes отреагировали увеличением ферментов, нацеленных на слизь, и уменьшением ферментов, нацеленных на клетчатку. Как следствие, у мышей, получавших диету без клетчатки, уменьшилась толщина слизистого слоя толстой кишки, что повысило восприимчивость к инфекции, вызываемой патогеном кишечной слизистой оболочки мыши Citrobacter rodentium () [39]. Следует отметить, что мыши с дефектом основного белка слизи MUC2 (Muc2 — / — ) были одинаково восприимчивы к C.rodentium [80], которая напоминает инфицирование человека энтеропатогенной E. coli (EPEC) и энтерогеморрагической E. coli (EHEC) [81]. Таким образом, параллель между зависимой от диеты дестабилизацией слизистого слоя и отсутствием MUC2 указывает на решающую роль микробиоты кишечника в формировании защитного слизистого экрана против инфекции кишечными патогенами.
Дефекты слизистой оболочки кишечника усугубляют кишечную инфекцию и воспаление.Рационы, в которых отсутствуют углеводы, доступные для микробиоты, содержащиеся в пищевых волокнах, заставляют микробные организмы кишечника разрушать гликаны слизистого слоя кишечника (обозначенные более светлым цветом слизи), тем самым снижая прочность слизи. Дефектный слой слизи увеличивает риск кишечных инфекций, например, мышиного патогена Citrobacter rodentium. Дефект слизи, вызванный диетой, можно предотвратить с помощью определенных кишечных бактерий, таких как Bifidobacterium longum . Во время колита (изображенного интенсивными красными эпителиальными клетками) повышенная экспрессия резистиноподобной молекулы β (Relmβ) индуцирует выработку антимикробного белка, регенерирующего островковый белок 3β (REG3β), который снижает количество полезных видов Lactobacillus .Соответственно, применение Lactobacillus может уменьшить колит. В слизи пациентов с воспалительным заболеванием кишечника наблюдается повышенное количество разлагающей слизь бактерии Ruminococcus gnavus , в то время как дефектный слой слизи может приводить к повышенной транслокации бактериального липополисахарида, тем самым способствуя метаболическим заболеваниям.
Помимо защиты от кишечных патогенов, защита от триллионов комменсальных кишечных бактерий является не менее важной задачей для кишечной слизи.Действительно, кормление гнотобиотических мышей диетой, не содержащей МАК, привело к истончению слизистого слоя толстой кишки и, как следствие, к увеличению близости комменсальных кишечных бактерий к слизистой оболочке [38]. Это сопровождалось усилением продукции антибактериальной защитной молекулы REG3β в подвздошной кишке. Примечательно, что аналогичная повышающая регуляция Reg3β и Reg3γ наблюдалась в тонком и толстом кишечнике мышей Muc2 – / –, у которых отсутствует защитный слизистый барьер и в конечном итоге развивается колит [4, 82].Таким образом, эти исследования дополнительно демонстрируют, что недостаток МАК в пище может привести к пагубным изменениям слизистого слоя, что в конечном итоге может вызвать кишечные заболевания.
В недавнем исследовании мы смогли показать, что соблюдение диеты западного образца (WSD) — диеты с высоким содержанием насыщенных жирных кислот и сахарозы, но с низким содержанием пищевых волокон — привело к увеличению проницаемости слизистого слоя толстой кишки [83] . Хотя это частично можно объяснить микробной деградацией гликанов хозяина [38, 39, 55], мы также обнаружили меньше белка MUC2 в слизи толстой кишки мышей, получавших WSD, по сравнению со слизью мышей, получавших контрольную диету [ 83].Это указывает на то, что проникновение кишечных бактерий в слой слизи может быть связано с усилением деградации бактериальных гликанов, но также может быть вызвано дефектом хозяина, который приводит к снижению продукции, секреции или сборки муцина MUC2.
Здоровый внутренний слизистый слой толстой кишки расширяется по направлению к просвету кишечника со скоростью около 2 мкм / мин («скорость роста слизи»), тем самым активно отталкивая кишечную микробиоту от эпителиальной поверхности [25]. Однако при кормлении WSD эта скорость роста снизилась примерно до 0.5 мкм / мин — дефект, который можно предотвратить, добавив к WSD трансплантат микробиоты от мышей, получавших контрольную диету, богатую клетчаткой, или даже с одним пробиотиком штамма Bifidobacterium longum [83]. Следовательно, обусловленные диетой изменения микробиоты кишечника привели к дефектам слизистого слоя, которые, вероятно, вызваны комбинацией факторов хозяина и микробов (2).
Взаимодействие микробиоты и слизи и актуальность для болезни
Мыши с дефицитом MUC2 неспособны предотвратить контакт кишечной микробиоты с эпителием хозяина.Соответственно, у этих мышей развивается спонтанный колит и усиленное распространение инфекции C. rodentium толстой кишки, что подчеркивает вклад слизистого слоя в заболевание кишечника [4, 80, 84]. Точно так же у людей слизь пациентов с язвенным колитом, самоограничивающимся колитом и острым аппендицитом была проницаема для бактерий и выявляла уменьшенную толщину слизи, которая коррелировала с тяжестью заболевания [3, 4, 85]. Более того, у пациентов с ВЗК было обнаружено повышенное количество прилипающих к слизистой оболочке бактерий по сравнению со здоровым контролем или пациентами с синдромом раздраженного кишечника (СРК) [86].Соответственно, характеристика бактерий, ассоциированных со слизистой оболочкой, является лучшим предиктором фенотипа заболевания, чем анализ состава фекальной микробиоты [87].
В то время как изменения в составе кишечной микробиоты у пациентов с ВЗК наблюдались в нескольких больших и малых когортах, методологические различия, когортная гетерогенность и повышенные колебания микробиома у пациентов с ВЗК не смогли идентифицировать специфические общие микробные таксоны, которые были связаны с любой из форм IBD [88–91].Тем не менее, недавнее продольное исследование микробиоты стула у пациентов с ВЗК на срок до 12 месяцев выявило новую кладу Ruminococcus gnavus , которая временно обогащалась у пациентов с ВЗК [91]. Примечательно, что при исследовании специфических геномных адаптаций клады R. gnavus авторы идентифицировали гены, участвующие в утилизации слизи и сахара исключительно в IBD-специфической кладе R. gnavus (). Такая специфичность путей деградации слизи у R.gnavus соответствует предыдущему исследованию, в котором анализировалось разложение слизи и утилизация двух штаммов R. gnavus человеческого происхождения: только штамм ATCC 29149, но не E1, мог расти на муцине как единственном источнике углеводов — особенность это может быть связано с присутствием специфической сиалидазы и фукозидаз [92].
Бактериальная деградация муцина, которая превышает обновление слизи хозяином, является очевидным фактором, который приводит к дисфункции барьера и, вероятно, способствует развитию болезни.Однако недавние исследования показывают, что самого проницаемого слоя слизи или его отсутствия может быть недостаточно, чтобы вызвать заболевание. Например, в отсутствие MUC2 повышенная экспрессия гена Retnlb (кодирующего RELMβ) индуцировала продукцию антимикробного белка REG3β, что уменьшало количество полезных видов Lactobacillus [93]. Соответственно, применение двух лактобацилл, полученных от мышей, но не коммерческой смеси пробиотиков, содержащей три штамма Lactobacillus человеческого происхождения, может облегчить колит у мышей Muc2 — , /, — ().Хотя мыши, обработанные Lactobacillus , имели повышенное содержание SCFA в толстой кишке, необходимо определить, действительно ли эти органические кислоты способствуют облегчению колита, особенно потому, что сравнение со штаммами Lactobacillus человеческого происхождения демонстрирует, что модуляция барьерной функции слизистой оболочки является существенной. штамм-специфичный. Аналогичным образом было показано, что два штамма Lactobacillus reuteri , полученные от крысы или человека, увеличивают толщину внутреннего слизистого слоя на модели химически индуцированного декстрансульфата натрия (DSS) колита на мышах — эффект, который сопровождался сниженной экспрессией маркеры воспаления и повышенная экспрессия белков плотного соединения [94].
Подобный эффект увеличения толщины слизи недавно наблюдался у крыс после применения штамма Bifidobacterium pseudolongum Patronus, который был выделен из стула крыс, получавших антибиотики [95]. Анализ микробиоты у этих крыс выявил относительное снижение A. muciniphila , который, несмотря на его специфическую способность разлагать слизь [39, 96], считается полезным обитателем кишечника [43, 97]. Таким образом, неясно, связано ли улучшение толщины слизи с увеличением численности Bifidobacterium или с уменьшением разложения слизи на A.Муцинифила . Следует отметить и вопреки ожиданиям, введение A. muciniphila мышам, получавшим диету с высоким содержанием жиров, привело к увеличению толщины слизи в толстой кишке [43]. Поскольку такой результат не наблюдался у мышей, получавших контрольную диету, влияние A. muciniphila на разложение слизи и, следовательно, толщину слизи может зависеть от контекста и особенно от диеты. Кроме того, и в пользу прямой способности модулировать слизь у отдельных штаммов Bifidobacterium , мы недавно показали, что применение пробиотика B.longum может предотвратить дефект роста слизи у мышей, получавших WSD [83]. Более того, обогащение WSD с низким содержанием клетчатки инулином из пищевых волокон, который, как известно, способствует росту Bifidobacterium [98, 99], предотвращает проницаемость слизи в нашем анализе слизи ex vivo . Таким образом, хотя молекулярный механизм пока неясен, возможно, что отдельные метаболические или структурные компоненты конкретных штаммов Bifidobacterium и / или Lactobacillus предотвращают кишечное заболевание, модулируя функцию слизистого слоя.
Микробиота кишечника влияет не только на физиологию кишечника, но и передает сигнал отдаленным органам, тем самым влияя на метаболизм всего тела [29, 83]. Таким образом, кишечные бактерии были идентифицированы как фактор, способствующий метаболическим заболеваниям, а дефектный барьер слизистой оболочки кишечника может быть решающим связующим звеном между хозяином и микробами [100–104]. Действительно, транслокация липополисахарида бактериального эндотоксина (ЛПС) из кишечника вызывает воспаление жировой ткани, и люди и мыши с ожирением имеют повышенные уровни ЛПС в плазме [102, 104, 105].
Без сомнения, потребление WSD с высоким содержанием сахара и жира способствует метаболическим заболеваниям, но, в то же время, нарушение функции кишечной слизи наблюдалось в нескольких исследованиях, как описано выше. Кроме того, было показано, что обычные диетические эмульгаторы, такие как карбоксиметилцеллюлоза и полисорбат-80, вызывают легкое воспаление, метаболический синдром и колит на модели восприимчивых мышей посредством модуляции микробиоты кишечника [106]. Даже у людей в недавнем исследовании было обнаружено повышенное количество неопознанных кишечных бактерий в слизи пациентов с нарушенным метаболизмом глюкозы по сравнению с контрольной группой [5].Хотя эта ассоциация предполагает критическую роль неповрежденного слизистого барьера для метаболизма глюкозы, необходимы дальнейшие исследования, чтобы продемонстрировать, что дисфункциональный слизистый слой действительно способствует метаболическим изменениям у людей.
Заключение и перспективы
Слой кишечной слизи отделяет микробиоту кишечника от хозяина, и накопленные данные свидетельствуют о том, что нарушение этого противоинфекционного барьера способствует развитию таких заболеваний, как колит и метаболические заболевания.Хотя изменения в составе кишечной микробиоты были связаны с этими заболеваниями, молекулярные детали еще предстоит идентифицировать.
В последние годы в нескольких исследованиях было обнаружено, что микробиота кишечника влияет на физиологию и функцию слизистого слоя. После того, как предыдущие, в основном ассоциативные, исследования наблюдали корреляции между структурой слизи и конкретными микробными сообществами кишечника, текущие анализы изучают влияние изолированных бактерий на функцию слизи. Эти исследования показали, что микробная модуляция функции слизи не определяется на уровне вида, но что микробная характеристика требует, по крайней мере, разрешения на уровне штамма.Поскольку микробиота кишечника представляет собой сложное сообщество, на которое влияют факторы окружающей среды, эти внешние факторы также необходимо учитывать. Здесь состав рациона и, в частности, изобилие пищевых волокон является критическим фактором, влияющим на то, как индивидуальная микробиота кишечника взаимодействует со слоем слизи.
Нацеливание на микробиоту кишечника для улучшения барьерной функции слизистых оболочек является основной целью исследований в этой области. Таким образом, слой кишечной слизи как решающий интерфейс между хозяином и микробами является многообещающей мишенью, которая только недавно стала предметом внимания.Соответственно, определение молекулярного механизма — почему отдельные кишечные бактерии вызывают полезные, укрепляющие барьеры эффекты, а другие, близкородственные штаммы — нет, — может быть использовано для разработки будущих пробиотиков следующего поколения. Более того, обогащение полезной микробиоты за счет целенаправленных диетических вмешательств может обеспечить дополнительный подход к лечению или даже профилактике желудочно-кишечных заболеваний в будущем.
Благодарности
B.O.S. благодарит Рози Перкинс за ценные отзывы редакторов о рукописи и Анну Халлен за прекрасную помощь с графическими иллюстрациями.
Финансирование
B.O.S. поддерживается долгосрочной стипендией программы Human Frontier Science Program (LT000109 / 2014).
Заявление о конфликте интересов: Не заявлено.
Ссылки
1. Шредер Б.О., Бекхед Ф .. Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Нат Мед 2016; 22: 1079–89. [PubMed] [Google Scholar] 2. Родригес-Пиньейро AM, Бергстрём JH, Эрмунд А. и другие. Исследования слизи в желудке, тонком и толстом кишечнике мышей.II. Протеом слизи желудочно-кишечного тракта обнаруживает Muc2 и Muc5ac, сопровождаемые набором основных белков. Am J Physiol Gastrointest Liver Physiol 2013; 305: G348–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Свидсински А., Лёнинг-Бауке В., Тайссиг Ф. и другие. Сравнительное исследование слизистого барьера кишечника нормальной и воспаленной толстой кишки. Gut 2007; 56: 343–50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Йоханссон М.Э., Густафссон Дж., Хольмен-Ларссон Дж. и другие. Бактерии проникают через обычно непроницаемый слой слизи внутренней толстой кишки как на моделях мышиного колита, так и у пациентов с язвенным колитом.Gut 2014; 63: 281–91. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Chassaing B, Raja SM, Lewis JD. и другие. Посягательство микробиоты толстой кишки коррелирует с дисгликемией у людей. Cell Mol Gastroenterol Hepatol 2017; 4: 205–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Birchenough GMH, Nyström EEL, Johansson MEV. и другие. Сторожевые бокаловидные клетки охраняют крипту толстой кишки, вызывая Nlrp6-зависимую секрецию Muc2. Наука 2016; 352: 1535–42. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Аллен А., Хаттон Д.А., Пирсон Дж. П.. Продукт гена MUC2: муцин кишечника человека. Int J Biochem Cell Biol 1998; 30: 797–801. [PubMed] [Google Scholar] 8. Axelsson MAB, Asker N, Hansson GCO .. Гликозилированный мономер и димер MUC2 из клеток LS 174T растворимы в воде, тогда как более крупные виды MUC2, образовавшиеся на ранней стадии биосинтеза, нерастворимы и содержат невосстанавливаемые межмолекулярные связи. Журнал биол. Химии 1998; 273: 18864–70. [PubMed] [Google Scholar] 9. Аскер Н., Аксельссон МАБ, Олофссон С.О. и другие. Димеризация муцина MUC2 человека в эндоплазматическом ретикулуме сопровождается зависимым от N-гликозилированием переносом моно- и димеров в аппарат Гольджи.J Biol Chem 1998; 273: 18857–63. [PubMed] [Google Scholar] 10. Годл К., Йоханссон МЭВ, Лиделл МЭ. и другие. N-конец муцина MUC2 образует тримеры, которые удерживаются вместе внутри резистентного к трипсину основного фрагмента. J. Biol Chem. 2002; 277: 47248–56. [PubMed] [Google Scholar] 11. Ambort D, Johansson MEV, Gustafsson JK. и другие. Зависящая от кальция и pH упаковка и высвобождение гелеобразующего муцина MUC2. Proc Natl Acad Sci USA 2012; 109: 5645–50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Макгукин М.А., Хаснайн С.З.. Бокаловидные клетки как стражи слизистой оболочки иммунитета. Mucosal Immunol 2017; 10: 1118–21. [PubMed] [Google Scholar] 14. Мелдрам О.В., Якубов Г.Э., Бонилла МР. и другие. Сборка муцинового геля контролируется коллективным действием немуциновых белков, дисульфидных мостиков, связей, опосредованных Ca 2+ , и водородных связей. Sci Rep 2018; 8: 5802 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Эрмунд А., Шютте А., Йоханссон MEV. и другие. Исследования слизи в желудке, тонком и толстом кишечнике мышей. I. Слои слизи желудочно-кишечного тракта имеют разные свойства в зависимости от местоположения, а также от бляшки Пейера.Am J Physiol Gastrointest Liver Physiol 2013; 305: G341–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Шютте А., Эрмунд А., Беккер-Паули К. и другие. Индуцированное микробами расщепление меприна β в муцине MUC2 и функциональный канал CFTR необходимы для высвобождения заякоренной слизи тонкого кишечника. Proc Natl Acad Sci USA 2014; 111: 12396–401. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Мейер-Хофферт У., Хорнеф М.В., Энрикес-Нормарк Б. и другие. Секретируемое кишечное антимикробное действие локализуется в поверхностном слое слизи.Кишечник 2008; 57: 764–71. [PubMed] [Google Scholar] 18. Bevins CL, Зальцман NH .. Клетки Панета, антимикробные пептиды и поддержание гомеостаза кишечника. Nat Rev Microbiol 2011; 9: 356–68. [PubMed] [Google Scholar] 19. Вайшнава С., Ямамото М., Северсон К.М. и другие. Антибактериальный лектин RegIIIgamma способствует пространственному разделению микробиоты и хозяина в кишечнике. Наука 2011; 334: 255–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Лоонен Л.М., Столте Э.Х., Яклофски М.Т. и другие. У мышей с дефицитом REG3γ изменилось распределение слизи и увеличилась воспалительная реакция слизистой оболочки на микробиоту и кишечные патогены в подвздошной кишке.Mucosal Immunol 2014; 7: 939–47. [PubMed] [Google Scholar] 21. Моор К., Диард М., Селлин М.Э. и другие. IgA с высокой авидностью защищает кишечник, удерживая растущие бактерии. Природа 2017; 544: 498–502. [PubMed] [Google Scholar] 22. Чу Х, Пазгиер М., Юнг Дж. и другие. Человеческий α-дефенсин 6 способствует врожденному иммунитету слизистых оболочек за счет самособирающихся пептидных наносетей. Наука 2012; 337: 477–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Mowat AM. Анатомические основы толерантности и иммунитета к кишечным антигенам.Нат Рев Иммунол 2003; 3: 331–41. [PubMed] [Google Scholar] 24. Йоханссон М.Э., Филлипсон М., Петерссон Дж. и другие. Внутренний из двух слоев слизи, зависимой от муцина Muc2 в толстой кишке, лишен бактерий. Proc Natl Acad Sci USA 2008; 105: 15064–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Gustafsson JK, Ermund A, Johansson MEV. и другие. Метод ex vivo для изучения образования, свойств и толщины слизи в биоптатах толстой кишки человека и эксплантатах тонкого и толстого кишечника мышей. Am J Physiol-Gastrointest Liver Physiol 2012; 302: G430-8.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Nyström EEL, Birchenough GMH, van der Post S. и другие. Регулятор 1 хлоридного канала, активируемый кальцием (CLCA1), регулирует распространение слизи в толстой кишке за счет протеолитической активности. EBioMedicine 2018; 33: 134–43. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Ламас Б., Ричард М.Л., Ледук В. и другие. CARD9 воздействует на колит, изменяя метаболизм триптофана в кишечной микробиоте до лигандов арилуглеводородных рецепторов. Нат Мед 2016; 22: 598–605. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Зеланте Т., Яннитти Р.Г., Кунья К. и другие. Катаболиты триптофана из микробиоты взаимодействуют с рецепторами арилуглеводородов и уравновешивают реактивность слизистой оболочки через интерлейкин-22. Иммунитет 2013; 39: 372–85. [PubMed] [Google Scholar] 29. Ко А., Де Ваддер Ф, Ковачева-Датчары П. и другие. От пищевых волокон к физиологии хозяина: короткоцепочечные жирные кислоты как ключевые бактериальные метаболиты. Cell 2016; 165: 1332–45. [PubMed] [Google Scholar] 31. Додд Д., Спитцер М.Х., Треурен В.В. и другие. Бактериальный путь кишечника превращает ароматические аминокислоты в девять циркулирующих метаболитов.Природа 2017; 551: 648–52. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Окумура Р., Куракава Т., Накано Т. и другие. Lypd8 способствует разделению жгутиковой микробиоты и эпителия толстой кишки. Природа 2016; 532: 117–21. [PubMed] [Google Scholar] 33. Бергстрём JH, Birchenough GMH, Katona G. и другие. Грамположительные бактерии удерживаются на расстоянии в слизи толстой кишки лектин-подобным белком ZG16. Proc Natl Acad Sci USA 2016; 113: 13833–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Пророк, округ Колумбия, Чара А.Л., Харрис Т.А.и другие. Резистиноподобная молекула β представляет собой бактерицидный белок, который способствует пространственной сегрегации микробиоты и эпителия толстой кишки. Proc Natl Acad Sci USA 2017; 114: 11027–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Szentkuti L, Riedesel H, Enss M-L. и другие. Слой преэпителиальной слизи в толстой кишке обычных и стерильных крыс. Histochem J 1990; 22: 491–7. [PubMed] [Google Scholar] 36. Кандори Х., Хираяма К., Такеда М. и другие. Гистохимические, лектин-гистохимические и морфометрические характеристики бокаловидных клеток кишечника стерильных и обычных мышей.Exp Anim 1996; 45: 155–60. [PubMed] [Google Scholar] 37. Брай Л., Фальк П. Г., Мидтведт Т. и другие. Модель взаимодействия хозяина и микробов в открытой экосистеме млекопитающих. Наука 1996; 273: 1380–3. [PubMed] [Google Scholar] 38. Эрл К.А., Биллингс Дж., Сигал М. и другие. Количественная визуализация пространственной организации кишечной микробиоты. Клеточный микроб-хозяин 2015; 18: 478–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Десаи М.С., Сикац А.М., Коропаткин Н.М. и другие. Микробиота кишечника, лишенная пищевых волокон, разрушает слизистый барьер толстой кишки и повышает восприимчивость к патогенам.Cell 2016; 167: 1339–53.e21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Бергстрём А, Кристенсен МБ, Баль Мичиган. и другие. Характер бактериальной колонизации влияет на транскрипцию генов муцина у мышей в течение первой недели жизни. BMC Res Notes 2012; 5: 402 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Йоханссон MEV, Якобссон HE, Holmén-Larsson J. и другие. Нормализация слоев слизи кишечника хозяина требует длительной микробной колонизации. Клеточный микроб-хозяин 2015; 18: 582–92. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42.Йоханссон MEV, GC Hansson. Сохранение слизи в гистологических срезах, иммуноокрашивание муцинов в фиксированной ткани и локализация бактерий с помощью FISH В: McGuckin MA, Thornton DJ (eds). Муцины: методы и протоколы. Тотова, штат Нью-Джерси: Humana Press, 2012, 229–35. [PubMed] [Google Scholar] 43. Эверард А., Белзер С., Геуртс Л. и другие. Взаимодействие между Akkermansia muciniphila и кишечным эпителием контролирует ожирение, вызванное диетой. Proc Natl Acad Sci USA 2013; 110: 9066–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44.Зоетендал Э.Г., Аккерманс А.Д., Де Вос В.М. Анализ гель-электрофореза в градиенте температуры 16S рРНК из образцов фекалий человека выявляет стабильные и специфичные для хозяина сообщества активных бактерий. Appl Environ Microbiol 1998; 64: 3854–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Держите GL, Pryde SE, Russell VJ. и другие. Оценка микробного разнообразия в образцах толстой кишки человека с помощью анализа последовательности 16S рДНК. FEMS Microbiol Ecol 2002; 39: 33–9. [PubMed] [Google Scholar] 49. Якобссон HE, Родригес-Пиньейро AM, Шютте А.и другие. Состав кишечной микробиоты формирует слизистый барьер толстой кишки. EMBO Rep 2015; 16: 164–77. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Breitbart M, Hewson I, Felts B. и другие. Метагеномный анализ некультивируемого вирусного сообщества из человеческих фекалий. J Bacteriol 2003; 185: 6220–3. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Барр Дж. Дж., Ауро Р., Фурлан М. и другие. Бактериофаг, прилипший к слизи, обеспечивает иммунитет, не связанный с хозяином. Proc Natl Acad Sci USA 2013; 110: 10771–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52.Норман Дж. М., Хэндли С. А., Болдридж М. Т.. и другие. Специфические изменения кишечного вирома при воспалительном заболевании кишечника. Cell 2015; 160: 447–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Ван В., Джовел Дж., Хэллоран Б. и другие. Метагеномный анализ микробиома в ткани толстой кишки субъектов с воспалительными заболеваниями кишечника показывает взаимодействие вирусов и бактерий. Воспаление кишечника 2015; 21: 1419–27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Маркобаль А., Саутвик А.М., Эрл К.А. и другие.Утонченный вкус: бактериальное потребление гликанов хозяина в кишечнике. Гликобиология 2013; 23: 1038–46. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Martens EC, Chiang HC, Gordon JI .. Поедание гликанов слизистой оболочки улучшает приспособленность и передачу сахаролитического бактериального симбионта кишечника человека. Клеточный микроб-хозяин 2008; 4: 447–57. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Мартенс Э.С., Нойман М., Десаи М.С. Взаимодействие комменсалов и патогенных микроорганизмов со слизистой оболочкой кишечника. Nat Rev Microbiol 2018; 16: 457–70.[PubMed] [Google Scholar] 57. Сломяны Б.Л., Мурты В.Л., Сломяны А .. Выделение и характеристика олигосахаридов из гликопротеина слизи толстой кишки крысы. Журнал биологии химии 1980; 255: 9719–23. [PubMed] [Google Scholar] 58. Томссон К.А., Хольмен-Ларссон Дж. М., Ангстрем Дж. и другие. Подробная O-гликомика муцина Muc2 из толстой кишки мышей дикого типа с дефицитом core 1 и core 3 трансферазы подчеркивает различия по сравнению с MUC2 человека. Гликобиология 2012; 22: 1128–39. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59.Карлссон Н.Г., Херрманн А., Карлссон Х. и другие. Гликозилирование муцина Muc2 кишечника крыс варьируется в зависимости от линии крыс, а также в тонком и толстом кишечнике. J Biol Chem 1997; 272: 27025–34. [PubMed] [Google Scholar] 60. Робби К., Каплун С., Коддевиль Б. и другие. Структурное разнообразие и специфическое распределение О-гликанов в нормальных муцинах человека вдоль кишечного тракта. Biochem J 2004; 384: 307–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Соммер Ф., Адам Н., Йоханссон М.Э. и другие. Измененное гликозилирование слизи у мышей с дефицитом О-гликана core 1 влияет на состав микробиоты и архитектуру кишечника.PLoS One 2014; 9: e85254 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Рауш П., Рехман А., Кюнцель С. и другие. На микробиоту слизистой оболочки толстой кишки влияет взаимодействие болезни Крона и генотипа FUT2 (Secretor). Proc Natl Acad Sci USA 2011; 108: 19030–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Уоткинс WM, Биохимия и генетика систем групп крови ABO, Lewis и P В: Harris H, Hirschhorn K (eds). Успехи в генетике человека. Бостон, Массачусетс: Springer US, 1980, 1–136.[PubMed] [Google Scholar] 64. Келли Р.Дж., Рукье С., Джорджи Д. и другие. Последовательность и экспрессия кандидата в ген секреторной группы крови человека α (1, 2) фукозилтрансферазы (FUT2). J Biol Chem 1995; 270: 4640 .. [PubMed] [Google Scholar] 65. Макговерн Д.П., Джонс М.Р., Тейлор К.Д. и другие. Несекреторный статус фукозилтрансферазы 2 (FUT2) связан с болезнью Крона. Hum Mol Genet 2010; 19: 3468–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Wacklin P, Mäkivuokko H, Alakulppi N. и другие. Генотип секретора (ген FUT2) прочно связан с составом бифидобактерий в кишечнике человека.PLoS One 2011; 6: e20113 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Турпин В., Бедрани Л., Эспин-Гарсия О. и другие. Генотип FUT2 и секреторный статус не связаны с микробным составом кала и предполагаемой функцией у здоровых субъектов. Кишечные микробы 2018; 9: 357–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Давенпорт ER, Гудрич Дж. К., Белл Дж. Т.. и другие. Статусы ABO-антигена и секретора не связаны с составом кишечной микробиоты у 1500 близнецов. BMC Genomics 2016; 17: 941 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Хупер Л.В., Сюй Дж., Фальк П.Г. и другие. Молекулярный датчик, который позволяет кишечному комменсалу контролировать свою питательную основу в конкурентной экосистеме. Proc Natl Acad Sci USA, 1999; 96: 9833–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Мэн Д., Ньюбург Д.С., Янг К. и другие. Бактериальные симбионты индуцируют FUT2-зависимую фукозилированную нишу на эпителии толстой кишки посредством передачи сигналов ERK и JNK. Am J Physiol Gastrointest Liver Physiol 2007; 293: G780-7. [PubMed] [Google Scholar] 71. Wrzosek L, Miquel S, Noordine M-L.и другие. Bacteroides thetaiotaomicron и Faecalibacterium prausnitzii влияют на выработку гликанов слизи и развитие бокаловидных клеток в эпителии толстой кишки модельного гнотобиотического грызуна. BMC Biol 2013; 11:61 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Бхаттачарья Т., Гош Т.С., Манде СС .. Глобальное профилирование углеводно-активных ферментов в микробиоме кишечника человека. PLoS One 2015; 10: e0142038 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Ломбард V, Голаконда Рамулу Х, Друла Э.и другие. База данных углеводно-активных ферментов (CAZy) в 2013 г. Nucleic Acids Res 2014; 42: D490–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Сюй Дж., Бьюрселл М.К., Химрод Дж. и другие. Геномный взгляд на симбиоз человека и бактероидов thetaiotaomicron. Наука 2003; 299: 2074–6. [PubMed] [Google Scholar] 75. Salyers AA, West SE, Vercellotti JR. и другие. Ферментация муцинов и полисахаридов растений анаэробными бактериями из толстой кишки человека. Appl Environ Microbiol 1977; 34: 529–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76.Сальерс AA, Верчеллотти-младший, West SE. и другие. Ферментация муцина и полисахаридов растений штаммами Bacteroides из толстой кишки человека. Appl Environ Microbiol 1977; 33: 319–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Зонненбург Э.Д., Зонненбург Ю.Л. Истощение нашего микробного «я» голодом: пагубные последствия диеты с дефицитом углеводов, доступных для микробиоты. Cell Metab 2014; 20: 779–86. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Бьюрселл М.К., Мартенс Э.С., Гордон Д.И. Функциональные геномные и метаболические исследования адаптации выдающегося симбионта кишечника взрослого человека, bacteroides thetaiotaomicron, к периоду кормления грудью.Журнал биологии химии 2006; 281: 36269–79. [PubMed] [Google Scholar] 79. Зонненбург Ю.Л., Сюй Дж., Лейп Д.Д. и другие. Гликановое кормление in vivo адаптированным к кишечнику бактериальным симбионтом. Наука 2005; 307: 1955–9. [PubMed] [Google Scholar] 80. Бергстром КСБ, Киссун-Сингх В., Гибсон Д.Л. и другие. Muc2 защищает от смертельного инфекционного колита, отделяя патогенные и комменсальные бактерии от слизистой оболочки толстой кишки. PLoS Pathog 2010; 6: e1000902 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Коллинз Дж. В., Кини К. М., Крепин В. Ф..и другие. Citrobacter rodentium : инфекция, воспаление и микробиота. Nat Rev Microbiol 2014; 12: 612–23. [PubMed] [Google Scholar] 82. Паассен Н.Б., Лоонен Л.М., Витте-Баума Дж. и другие. Дефицит муцина Muc2 и отлучение от груди влияет на экспрессию врожденных защитных генов Reg3β, Reg3γ и ангиогенина-4. PLoS One 2012; 7: e38798 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Шредер Б.О., Birchenough GMH, Стольман М. и другие. Бифидобактерии или клетчатка защищают от вызванного диетой разрушения слизи толстой кишки, опосредованного микробиотой.Клеточный микроб-хозяин 2018; 23: 27–40.e7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Слуис М.В., дер Конинг, BAED, Bruijn ACJMD. и другие. У мышей с дефицитом Muc2 спонтанно развивается колит, что указывает на то, что MUC2 имеет решающее значение для защиты толстой кишки. Гастроэнтерология 2006; 131: 117–29. [PubMed] [Google Scholar] 85. Пуллан Р.Д., Томас Г.А., Родс М. и другие. Толщина приставшего геля слизи на слизистой оболочке толстой кишки у людей и его значение для колита. Gut 1994; 35: 353–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 86.Свидсински А., Вебер Дж., Ленинг-Бауке В. и другие. Пространственная организация и состав флоры слизистой оболочки у пациентов с воспалительным заболеванием кишечника. J Clin Microbiol 2005; 43: 3380–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87. Геверс Д., Кугатхасан С., Денсон Л.А. и другие. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клеточный микроб-хозяин 2014; 15: 382–92. [Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Цзо Т., Камм М.А., полковник Дж.Ф. и другие. Урбанизация и микробиота кишечника в здоровом и воспалительном заболевании кишечника.Нат Рев Гастроэнтерол Гепатол 2018; 15: 440–52. [PubMed] [Google Scholar] 90. Халфварсон Дж., Брислон Си-Джей, Ламенделла Р. и другие. Динамика микробиома кишечника человека при воспалительном заболевании кишечника. Nat Microbiol 2017; 2: 17004 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 91. Холл AB, Яссур М., Саук Дж. и другие. Новый Ruminococcus gnavus clade, обогащенный у пациентов с воспалительными заболеваниями кишечника. Genome Med 2017; 9: 103 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 92. Crost EH, Tailford LE, Gall GL. и другие.Использование муциновых гликанов симбионтом кишечника человека Ruminococcus gnavus зависит от штамма. PLoS One 2013; 8: e76341 .. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Морампуди В., Далвади У., Бхиндер Г. и другие. Медиатор RELM-β, полученный из бокаловидных клеток, вызывает спонтанный колит у мышей с дефицитом Muc2, способствуя комменсальному микробному дисбиозу. Mucosal Immunol 2016; 9: 1218–33. [PubMed] [Google Scholar] 94. Ахл Д., Лю Х., Шрайбер О. и другие. Lactobacillus reuteri увеличивает толщину слизи и облегчает у мышей колит, вызванный декстрансульфатом натрия.Acta Physiol (Oxf) 2016; 217: 300–10. [PubMed] [Google Scholar] 95. Манжен I, Досу-Йово Ф., Левек К. и другие. Пероральное введение жизнеспособного штамма Bifidobacterium pseudolongum Patronus изменило микробиоту толстой кишки и увеличило толщину слоя слизи у крыс. FEMS Microbiol Ecol 2018; 94: DOI: 10.1093 / femsec / fiy177. [PubMed] [Google Scholar] 96. Дерриен М., Воган Э., Плагин СМ. и другие. Akkermansia muciniphila gen. Ноябрь, sp. Ноябрь, кишечная бактерия, разлагающая муцин человека. Int J Syst Evol Microbiol 2004; 54: 1469–76.[PubMed] [Google Scholar] 97. Пловье Х, Эверард А., Друарт К. и другие. Очищенный мембранный белок из Akkermansia muciniphila или пастеризованной бактерии улучшает метаболизм у мышей с ожирением и диабетом. Нат Мед 2017; 23: 107–13. [PubMed] [Google Scholar] 98. Гибсон Г.Р., Битти Е.Р., Ван Х. и другие. Селективная стимуляция бифидобактерий толстой кишки человека олигофруктозой и инулином. Гастроэнтерология 1995; 108: 975–82. [PubMed] [Google Scholar] 99. Вандепутте Д., Фалони Дж., Виейра-Силва С.и другие. Пребиотические фруктаны инулинового типа вызывают специфические изменения в микробиоте кишечника человека. Gut 2017; 66: 1968–74. [Бесплатная статья PMC] [PubMed] [Google Scholar] 100. Бэкхед Ф., Дин Х., Ван Т. и другие. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci USA 2004; 101: 15718–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Бэкхед Ф., Манчестер Дж. К., Семенкович К. Ф. и другие. Механизмы, лежащие в основе устойчивости к ожирению, вызванному диетой, у стерильных мышей. Proc Natl Acad Sci USA 2007; 104: 979–84.[Бесплатная статья PMC] [PubMed] [Google Scholar] 102. Caesar R, Reigstad CS, Bäckhed HK. и другие. Полученный из кишечника липополисахарид увеличивает накопление жировых макрофагов, но не является существенным для нарушения толерантности к глюкозе или инсулину у мышей. Кишечник 2012; 61: 1701–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Амар Дж., Чабо К., Вагет А. и другие. Прилипание к слизистой оболочке кишечника и транслокация комменсальных бактерий в начале диабета 2 типа: молекулярные механизмы и лечение пробиотиками. EMBO Mol Med 2011; 3: 559–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Кани П.Д., Амар Дж., Иглесиас М.А. и другие. Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность. Диабет 2007; 56: 1761–72. [PubMed] [Google Scholar] 105. Крили SJ, McTernan PG, Kusminski CM. и другие. Липополисахарид активирует ответ врожденной иммунной системы в жировой ткани человека при ожирении и диабете 2 типа. Am J Physiol-Endocrinol Metab 2007; 292: E740-7. [PubMed] [Google Scholar] 106. Чассен Б., Корен О., Гудрич Дж. и другие. Пищевые эмульгаторы влияют на микробиоту кишечника мышей, вызывая колит и метаболический синдром.Природа 2015; 519: 92–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]Как вылечить дырявый кишечник за 9 простых шагов
Хотя «дырявый кишечник» может показаться некрасивым, описание довольно точное и относится к тому моменту, когда стенки кишечника становятся хронически проницаемые. Вот что это значит — и как вылечить дырявый кишечник.
Выстилка пищеварительного тракта состоит всего из одного клеточного слоя. Эти узкоспециализированные клетки, называемые энтероцитами, образуют барьер между вами, вашим кровотоком, вашей иммунной системой и внешним миром, который поступает через ваш рот в виде еды, питья, лекарств, бактерий и токсинов.
Эти клетки цементируются вместе с белками, называемыми плотными соединениями, которые образуют защитный барьер, гарантирующий, что все, что вы едите, должным образом обрабатывается клетками энтероцитов, и ваше тело может справиться с этим, не заболевая. Такие вещи, как хронический стресс, плохое питание, бактериальные инфекции и аутоиммунные расстройства, могут вызывать бреши в этом защитном барьере. Когда эти белки или плотные контакты разрушаются, возникает «дырявый кишечник».
Симптомы дырявого кишечника
У протекающего кишечника много побочных эффектов.В результате того, что ваша иммунная система подвергается воздействию продуктов питания, бактерий и химикатов, которые она никогда не должна была видеть, она может перейти в постоянное состояние «включено», посылая постоянный поток воспалительных химикатов через ваше тело.
Эти иммунные химические вещества и вызываемое ими воспаление могут вызывать такие разнообразные симптомы, как угри, экзема, повышенная чувствительность к пище, гормональный дисбаланс, боль в теле, туман в мозгу, бессонница и даже аутоиммунные заболевания, такие как тиреоидит Крона, Хашимото и ревматоидный артрит.
Как диагностировать негерметичность кишечника?
Дырявый кишечник, также известный как кишечная проницаемость, является обычным явлением. Трудно точно сказать, у скольких людей он есть, потому что лишь немногие врачи его проверяют. Врачи Parsley Health обычно диагностируют проницаемость кишечника с помощью комбинации специальных специальных тестов, таких как всесторонний посев кала и детальная оценка ваших симптомов и истории болезни. Если вам поставили диагноз кишечной проницаемости, хорошая новость в том, что есть способы вылечить проницаемость кишечника.
Вот 9 простых вещей, которые вы можете сделать, чтобы навсегда вылечить синдром дырявого кишечника.
1. Исключите из своего рациона токсичные продукты.
Глютен, молочные продукты, сахар, обработанные пищевые продукты, продукты, обработанные пестицидами (также известные как ГМО-культуры), и алкоголь — одни из наиболее распространенных продуктов, которые атакуют чувствительные клетки кишечника. Если вы хотите вылечить синдром дырявого кишечника, мы рекомендуем отказаться от этих продуктов как минимум на три месяца и в дальнейшем избегать их в избытке.
2.Постарайтесь придерживаться диеты, основанной на растительной диете.
Если у вас повышенная кишечная проницаемость, диета, содержащая клетчатку и растительную пищу, может уменьшить воспаление и раздражение, вызванное глютеном и другими сахарами. Мясо и рыбу можно есть, но сосредоточьтесь на безглютеновых зернах, овощах и фруктах, орехах, семенах и полезных жирах (возьмите авокадо). Кроме того, пребиотики, содержащиеся в цельных продуктах с высоким содержанием клетчатки, таких как спаржа и цельнозерновой овес, имеют решающее значение для питания пробиотических бактерий в микробиоме кишечника и поддержания его здоровья.
3. Ешьте больше полезных жиров.
N-бутират, короткоцепочечная жирная кислота, помогает питать клетки, выстилающие кишечник, и помогает им заживать. Ваши кишечные бактерии могут производить больше н-бутирата, если вы кормите их растворимыми волокнами во фруктах и овощах. Вы также можете получить н-бутират в виде топленого масла. Еще один источник полезных жиров — кокосовое масло, которое содержит жирные кислоты со средней длиной цепи, полезные для кишечника!
4. Управляйте своим стрессом с помощью практик разума и тела.
Гормоны стресса атакуют и разрушают плотные соединения, которые удерживают вместе клетки пищеварительного тракта. Когда вы уменьшаете количество гормонов стресса, таких как кортизол и адреналин, с помощью отдыха и расслабления, осознанного питания и медитации, эти узкие контакты могут излечить.
5. Принимайте пищеварительные ферменты.
Ферменты, принимаемые регулярно во время еды, помогают расщеплять крупные белки и бактериальные продукты, которые могут повредить слизистую оболочку кишечника. Мы рекомендуем принимать ферменты широкого спектра действия перед употреблением в пищу продуктов, богатых белками и жирами, чтобы поддержать пищеварение и предотвратить раздражение слизистой оболочки кишечника.
6. Увеличьте потребление коллагена.
Коллаген содержит аминокислоты глицин, пролин и гидроксипролин, которые необходимы для восстановления и восстановления слизистой оболочки кишечника. Регулярное употребление продуктов, содержащих коллаген, таких как костный бульон, желатин и порошки коллагена, может быть терапевтическим дополнением к диете, которое может помочь вылечить и предотвратить повышенную кишечную проницаемость. Исследования показывают, что дополнительные пептиды коллагена могут помочь укрепить барьер кишечника, делая его менее проницаемым и с большей вероятностью удерживая питательные вещества из пищи.Употребление в пищу продуктов, повышающих выработку коллагена в организме, например яиц, цитрусовых, брокколи, семян подсолнечника и грибов, также может помочь увеличить выработку естественного коллагена в организме.
7. Попробуйте принимать противовоспалительные добавки.
Для восстановления кишечного барьера существует множество витаминов и добавок, из которых вы можете выбирать, — говорит доктор Пальма. L-глутамин обычно используется при лечении проницаемости кишечника. Корень солодки и жир печени трески омега-3, богатый витаминами A и D, обладают противовоспалительным действием, уменьшая воспаление кишечного барьера.
Высококачественные лечебные травы, такие как вяз скользкий и кошачий коготь, также могут помочь при повышенной кишечной проницаемости (и при других воспалительных заболеваниях кишечника), успокаивая слизистую оболочку кишечника.
8. Увеличьте нагрузку на кардио.
Исследования показывают, что сердечно-сосудистые упражнения улучшают транспорт кислорода в организме и через пищеварительный тракт, способствуя присутствию, активности и разнообразию кишечных микробов, особенно тех, которые производят н-бутират жирных кислот, заживляющих кишечник. Чтобы поддержать улучшение здоровья как пищеварительной, так и сердечно-сосудистой систем, мы рекомендуем ставить цель — как минимум 150 минут в неделю повышать частоту сердечных сокращений.
9. Высыпайся.
Убедитесь, что вы спите хотя бы 7 часов непрерывно каждую ночь, чтобы дать своему телу и мозгу время, необходимое для отдыха и восстановления. Когда вы спите, ваш разум может полностью обработать день и создать новые воспоминания. Сон или его отсутствие влияет не только на способность нашего мозга обрабатывать данные, но и на другие механизмы нашего тела, связанные с иммунной функцией, сопротивляемостью болезням и здоровьем сердца. Даже одна ночь плохого сна может сделать вас более раздражительным, усилить тягу к углеводам и вызвать туман в мозгу.Регулярный сон менее 7 часов в сутки был даже связан с более неблагоприятными последствиями для здоровья, такими как увеличение веса, диабет, гипертония, болезни сердца и инсульт.

 Медицинские новости. 2016; 11: 56-58
Медицинские новости. 2016; 11: 56-58