Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.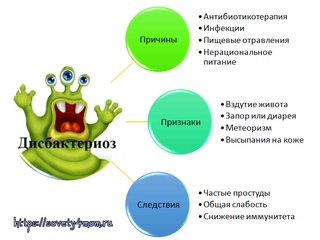
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
Дисбактериоз кишечника у детей: симптомы, признаки, лечение
Появление на свет нового человечка — самая главная страница в жизни каждой женщины. И конечно, маме необходимо быть во всеоружии при обнаружении любых возможных недомоганий у малыша. Зачастую детские слезы вызваны болями в животике, а причиной дискомфорта в кишечнике является дисбиоз.
И конечно, маме необходимо быть во всеоружии при обнаружении любых возможных недомоганий у малыша. Зачастую детские слезы вызваны болями в животике, а причиной дискомфорта в кишечнике является дисбиоз.
Чтобы не запутать читателя терминами, отметим, что дисбактериоз представляет собой дисбаланс только бактериальной составной микрофлоры. Дисбиоз же — более широкое понятие, под которым подразумевается нарушение баланса всей микрофлоры: и бактерий, и вирусов, и грибов, и простейших. И во многих случаях врачи под привычным нам термином «дисбактериоз» подразумевают именно дисбиоз.
Причины дисбактериоза (дисбиоза) кишечника у ребенка
Простыми словами, дисбиоз — это состояние микрофлоры, при котором количество полезных микроорганизмов меньше, чем патогенных или условно-патогенных. Давайте разберемся, почему появляется дисбиоз и каким он бывает.
Различают два вида дисбиоза:
- транзиторный (от нуля до семи дней после рождения). Это нормальное состояние, ведь малыш только знакомится с нашим миром.
 Микрофлора начинает формироваться буквально после первого прикладывания к груди — в кишечник с молоком попадают питательные вещества, полезные бактерии, гормоны.
Микрофлора начинает формироваться буквально после первого прикладывания к груди — в кишечник с молоком попадают питательные вещества, полезные бактерии, гормоны. - истинный (с седьмого дня). Малыш растет, растут и крошечные колонии микроорганизмов в его желудочно-кишечном тракте. Теперь мама должна учитывать все аспекты повседневной жизни, влияющие на физиологическое развитие малыша.
Вот ряд факторов, способствующих развитию дисбиоза у ребенка:
- недоношенность,
- длительное пребывание малыша отдельно от матери,
- искусственное вскармливание,
- прием антибиотиков,
- инфекционные заболевания,
- снижение иммунитета по различным причинам.
Конечно, на некоторые из этих факторов мы повлиять никак не можем. Поэтому так важно проводить профилактику дисбиоза. Не стоит менять рацион грудничков без рекомендации педиатра, кормить нужно каждые три-четыре часа, не чаще. Необходимо, чтобы пища была теплой и нежирной. Добавьте в рацион малыша молочнокислые продукты, например кефир. Кроме того, если ребенку выписали антибиотик, можно и даже нужно параллельно давать пробиотики (подробнее об их пользе для здоровья кишечника мы расскажем ниже). Очень велика ценность грудного вскармливания: оно положительно влияет на развитие нормальной микрофлоры кишечника грудничка и на его иммунитет, ведь с грудным молоком в организм ребенка поступают иммуноглобулины IgA, IgМ и IgG, интерферон, а также макрофаги и лимфоциты.
Кроме того, если ребенку выписали антибиотик, можно и даже нужно параллельно давать пробиотики (подробнее об их пользе для здоровья кишечника мы расскажем ниже). Очень велика ценность грудного вскармливания: оно положительно влияет на развитие нормальной микрофлоры кишечника грудничка и на его иммунитет, ведь с грудным молоком в организм ребенка поступают иммуноглобулины IgA, IgМ и IgG, интерферон, а также макрофаги и лимфоциты.
Признаки дисбактериоза (дисбиоза) кишечника у детей: маме на заметку
Дисбактериоз (дисбиоз) кишечника выражается у малышей следующими симптомами:
- пенистый кал с неприятным кислым запахом,
- колики,
- беспокойство и постоянный плач, ребенок подтягивает ножки к животу,
- обильное срыгивание,
- рвота,
- вздутие живота,
- запоры,
- диарея,
- аллергические реакции, дерматит.
Если вы заметили такие симптомы у вашего малыша, важно вовремя обратиться к педиатру. Дисбактериоз (дисбиоз) кишечника у детей до года — это распространенная проблема, которую довольно просто решить при правильном подходе. Однако необходимо исключить вероятность болезней желудочно-кишечного тракта — у них могут быть похожие симптомы.
Однако необходимо исключить вероятность болезней желудочно-кишечного тракта — у них могут быть похожие симптомы.
Меры по устранению дисбактериоза (дисбиоза)
Хоть термин «дисбиоз» и звучит как название болезни, это все-таки не болезнь. И все мероприятия по нормализации микрофлоры — скорее, не лечение, а коррекция, устранение патогенных бактерий из организма и восстановление (или создание) нормальной микрофлоры.
В начале коррекции нужно провести специальное микробиологическое исследование кала. Оно позволит определить количество потенциально-патогенных микроорганизмов. Если их количество превышает допустимый уровень, назначают специальные средства — бактериофаги. Это предшественники антибиотиков, вирусы, выборочно угнетающие рост «вредных» микроорганизмов. Бактериофагами в нашей стране лечили еще до появления антибиотиков, и их лечебная эффективность доказана на практике многих поколений.
Это важно
Давать антибактериальные средства малышу необходимо строго по рекомендации лечащего врача — самостоятельное назначение может только усугубить ситуацию. Впрочем, любое самолечение в принципе недопустимо.
Впрочем, любое самолечение в принципе недопустимо.
Как еще можно лечить дисбактериоз (дисбиоз) кишечника у ребенка?
- Для уменьшения агрессивности содержимого кишечника применяют сорбенты (Энтеросгель®, Смекта®). Это средства, связывающие и выводящие из организма малыша токсины.
- Нормализовать моторную функцию кишечника можно с помощью пребиотиков (лактулоза, клетчатка). Эти вещества активизируют содержащиеся в кишечнике полезные бактерии и способствуют оздоровлению микрофлоры.
- Для улучшения переваривания пищи назначают ферменты, расщепляющие белки, жиры и углеводы для их полноценного усвоения.
- Рациональное и полноценное питание — одно из важнейших условий поддержания здоровья ребенка. При дисбиозе исключают из меню сырые овощи и фрукты, кислые соки. В первые два дня лечения малышам до года дают овощные пюре, каши и слизистые супы, компот и запеченные яблоки. На третий день разрешается добавлять в рацион бульоны из нежирных сортов рыбы и мяса.

- Восстановить микрофлору помогает и прием пробиотиков. Это культуры лактобацилл и бифидобактерий, которые участвуют в выработке собственного витамина B5 (пантотеновой кислоты), стимулируют местный иммунитет, выводят токсины, поддерживают пристеночное пищеварение, участвуют в процессе всасывания и усвоения питательных веществ, улучшают перистальтику кишечника и нормализуют процесс эвакуации непереваренных остатков.
Лакто- и бифидобактерии «по умолчанию» содержатся в кишечнике с первых дней жизни. Однако их количественная пропорция в организме малыша варьируется в зависимости от ряда индивидуальных показателей: характера питания, наличия заболеваний, особенностей метаболизма и других. Понять, в каком именно виде полезных микроорганизмов нуждается детский организм, непросто, поэтому оптимален прием комплексного пробиотика, в котором содержатся и бифидо-, и лактобактерии. Такой состав предпочтителен и потому, что лактобациллы синтезируют молочную кислоту, которая обеспечивает благоприятную для полезных бифидобактерий кислую среду.
При выборе пробиотика стоит обратить внимание не только на состав, но и на форму выпуска средства. Для коррекции дисбактериоза (дисбиоза) кишечника у детей до трех лет оптимальная форма — это капли. Как правило, их можно смешивать с теплым молоком или добавлять в пищу, что обеспечивает комфортное применение у малыша. К тому же капли часто оснащают удобным дозатором, позволяющим отмерить необходимое количество средства.
В настоящее время много споров о том, является ли дисбиоз отклонением от нормы и стоит ли его лечить. Тем не менее дисбиоз имеет вполне конкретные причины и симптомы, своевременная корректировка которых крайне важна для растущего детского организма.
Лечение дисбактериоза у детей в Приморском районе СПБ
Дисбактериоз – это нарушение баланса микрофлоры кишечника. В современной педиатрии дисбактериоз не является заболеванием, однако это состояние требует обязательной коррекции. При дисбактериозе в кишечнике появляются патогенные микроорганизмы, которые вызывают дискомфорт в кишечнике и неприятные симптомы.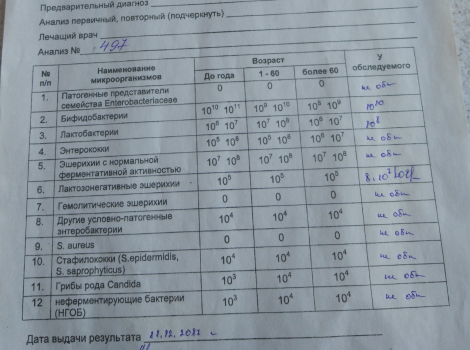
Дисбактериоз часто встречается у детей младшего возраста, включая грудничков. Что может вызвать дисбаланс микрофлоры? Врачи выделяют следующие факторы риска:
- Позднее прикладывание ребенка к груди. В молоке матери содержатся защитные вещества, которые формируют полезную микрофлору.
- Неправильное питание. Резкий переход на искусственное вскармливание или частая смена разных смесей вызывает дисбаланс микрофлоры. В более старшем возрасте дисбактериоз вызывает частое употребление пищи, в которой содержится клетчатка.
- Кишечные инфекции. При вирусной инфекции (сальмонеллез, дизентерия, ротавирус) в кишечник попадают болезнетворные микробы. Это приводит к развитию дисбактериоза.
- Применение антибиотиков. Антибиотики разрушают естественную микрофлору кишечника: убивают не только вредные бактерии, но и те, которые необходимы организму.
Симптомы дисбактериоза
- колики, чувство тяжести и вздутия в животе, метеоризм;
- жидкий стул водянистой консистенции;
- расстройства стула: понос или запор;
- стул с комочками непереваренной пищи или со слизью;
- частые срыгивания, тошнота, в некоторых случаях – рвота;
- воспалительные заболевания кожи, высыпания, раздражения;
- неприятный запах изо рта;
- налет на языке и на зубах;
- пониженный аппетит.
Такие же симптомы могут возникнуть и в случае других заболеваний ЖКТ, поэтому необходимо обратиться к врачу для точной диагностики.
Методы диагностики и лечения
Дисбактериоз диагностируется в лабораторных условиях. Необходимо сдать кал на копрологическое, биохимическое и бактериологическое исследование, а также исследовать соскоб со слизистой оболочки кишечника.
Лечение заключается в устранении причины дисбактериоза. Если нарушение вызвано кишечной инфекцией, необходимо вылечить основную патологию. При нарушениях диеты – скорректировать питание. В любом случае важно восстановить баланс микрофлоры и заселить кишечник полезными бактериями.
При лечении дисбактериоза следует соблюдать диету и режим дня. Кисло-молочные смеси и продукты с высокими содержанием лакто- и бифидобактерий восстанавливают баланс микроорганизмов в кишечнике. Врач может назначить и медикаментозное лечение: препараты с содержанием полезных бактерий и средства, которые стимулируют их размножение.
Запись на прием к детскому врачу
Чтобы записаться на прием к педиатру или детскому гастроэнтерологу достаточно оставить свой номер телефону в форме обратной связи и наши администраторы свяжутся с вами, чтобы выбрать удобное для вас время приема.
симптомы, анализ, лечение в 2021 году
Есть ли жизнь в кишечнике?В человеческом организме есть немало мест, где очень «уютно» различным микроорганизмам. Они есть в носоглотке, легких, влагалище, кишечнике. При этом наличие маленьких жителей вовсе не означает, что человек чем-то болен. Если и микроорганизмы, и их «хозяин» чувствуют себя отлично, то такое мирное соседство называется симбиозом. Комбинацию бактерий для каждого определенного места их сосуществования принято называть микрофлорой.
Источник фото: http://alfa-med.su/
Если ее количественный и качественный состав позволяет организму пребывать в здоровом состоянии, то он считается оптимальным для данного человека и называется эубиозом. Если же в силу каких-то причин состав и свойства микрофлоры нарушаются, начинается дисбактериоз. Чаще всего этот термин употребляется для характеристики нарушений микрофлоры кишечника, хотя дисбактериоз может возникнуть и в других местах обитания микроорганизмов.
Ребенок рождается, попадая из стерильной среды в мир, где обитает множество бактерий. Первое заселение его организма маленькими обитателями – бактериями, грибками – происходит еще во время прохождения по родовым путям. Следующий этап – первое прикладывание к груди. С капельками материнского молозива малыш получает полезные бактерии – залог будущего крепкого иммунитета. Ведь микрофлора кишечника выполняет множество важных функций:
- участвует в производстве витаминов группы В, витамина К, никотиновой кислоты, стимулирует деятельность органов кроветворения;
- поддерживает газообмен в кишечнике в пределах нормы;
- участвует в синтезе аминокислот и фиксации азота воздуха;
- способствует обмену холина, мочевой кислоты, а также желчных и жирных кислот;
- повышает активность ферментов тонкого кишечника;
- выделяет специальные вещества, стимулирующие перистальтику кишечника, влияет на процессы всасывания воды;
- способствует оптимальному делению и обновлению клеток слизистой оболочки кишечника;
- стимулирует выработку лимфоидными клетками иммуноглобулинов и лизоцима, которые препятствуют проникновению в организм инфекций.
Но кроме полезных микроорганизмов (бифидо- и лактобактерий), в кишечнике также живут и условно-патогенные. Они тоже необходимы организму, но в определенных условиях могут вызывать различные заболевания. К ним относятся энтерококки, клебсиелла, стафилококки, стрептококки, грибы рода Кандида и другие. Если баланс между «хорошими» и «плохими» не нарушен, то ничего страшного не происходит. Но случается, что условно-патогенная флора начинает усиленно размножаться, подавляя полезную. Возникает дисбактериоз.
Миф, симптомы, болезнь или диагноз?Наверное, ни один диагноз не вызывает столько разногласий у медиков, как дисбактериоз. Одни вообще не верят в его существование, другие готовы обвинить его в самых различных болезнях – от атопического дерматита и язвы до кариеса.
Интересный факт: в международной классификации болезней, принятой ВОЗ, такой диагноз вообще отсутствует. Этот синдром может быть спутником многих заболеваний и не имеет специфической симптоматики. Нарушение микрофлоры – это последствие болезней, а не их причина. Поэтому лечить нужно не дисбактериоз, а заболевание, его вызвавшее.
Признаки, по которым мама может заподозрить у ребенка наличие дисбактериоза (частые поносы или запоры, срыгивания, метеоризм, кишечные колики, плохой аппетит и недобор веса), могут свидетельствовать как о другом заболевании желудочно-кишечного тракта, так и о ситуативных проблемах. Соответственно, когда уходит проблема – дисбактериоза кишечника тоже не будет.
Источник фото: http://medic-mir.ru/
Причины и следствияУ детей дисбактериоз связан с недостаточно сформированными защитными реакциями организма и факторами риска, которым подвергается малыш с момента рождения. Эти факторы зависят от возраста ребенка.
Возраст ребенка | Факторы риска развития дисбактериоза |
|---|---|
Новорожденный |
|
Ребенок грудного возраста |
|
Ребенок школьного возраста |
|
Вопреки распространенному мнению, применение антибиотиков по стандартной схеме (5 – 7 дней) и согласно возрастным нормам вызвать дисбактериоз у детей не может. Такое нарушение может возникнуть лишь в том случае, если курс антибиотика длительный (более 14 дней), сам препарат широкого спектра действия, а пациент страдает иммунными нарушениями. Во всех остальных случаях баланс флоры восстанавливается самостоятельно сразу же после отмены лечения.
Источник фото: http://facekid.ru
Анализ кала на дисбактериоз у грудничка, лечениеТак нужно ли сдавать такой популярный анализ на дисбактериоз? Практикующие медики говорят о том, что посев кала на дисбактериоз малоинформативен и, по меньшей мере, нерационален. Конечно, сдать его несложно. Но и показатели будут недостоверными по нескольким причинам:
- анализ не отображает истинную картину микрофлоры всего кишечника, показывает флору его последних отделов;
- некоторые бактерии на воздухе погибают, что отрицательно влияет на качество анализа;
- на результаты влияет то, в какое время суток собран кал, его количество и то, в какой лаборатории был проведен анализ;
- оценить «нормальность» флоры, руководствуясь результатами такого анализа, невозможно, поскольку бактерии, участвующие в процессе пищеварения, живут на стенках кишечника; материал для исследования поступает из просвета толстой кишки;
- норму эубиоза определить трудно, так как она зависит от очень многих показателей и индивидуальна для каждого человека.
Хотя у такого анализа есть свой плюс: он может показать, есть ли в кишечнике патогенные и условно-патогенные бактерии в большом количестве. Если при этом присутствует клиническая картина заболевания: ребенок страдает поносами, запорами, имеет плохой аппетит, в общем, выглядит нездоровым – лечение необходимо. Но перед этим следует определить причину возникновения дисбактериоза, провести тщательную диагностику. И, конечно, лечить не дисбактериоз как проявление болезни, а саму болезнь.
Если же ребенок в целом чувствует себя хорошо, то никакой необходимости ни в анализе, ни в лечении нет. При соблюдении следующих несложных правил состояние флоры должно самостоятельно прийти в норму:
- Кормить ребенка грудью как можно дольше (хотя бы 1 год).
- Следить за чистотой. Обязательное мытье рук: и мамы перед кормлением ребенка, и малыша перед едой.
- Старшему ребенку организовать рациональное питание. Он должен получать в достаточном количестве молочные и кисломолочные продукты, мясо и рыбу, фрукты и овощи. Избегайте избытка сладостей, жиров, да и избытка пищи в целом.
- Ежедневные прогулки на воздухе, купание, физкультура и закаливание.
Так называемое лечение дисбактериоза с помощью различных препаратов неэффективно. Пробиотики (полезные микроорганизмы) из таблетки, которые якобы должны заселить кишечник, погибают еще в пути под воздействием желудочного сока, желчи, ферментов поджелудочной железы и тонкого кишечника. Остаточные бактерии, которые все же поступают в кишечник, являются для него чужеродными и не приживаются.
Наиболее безвредным и эффективным путем коррекции дисбактериоза кишечника медики считают восстановление его собственной микрофлоры, сформированной на протяжении жизни ребенка. Хорошо при этом помогают пребиотики. Они не содержат бактерий, но служат питательной средой для них, благодаря чему происходит рост собственной полезной флоры и подавление патогенной. Пребиотики входят в состав многих продуктов для специального детского питания – смесей, каш, напитков. Но при этом маме следует учитывать, что выбор таких продуктов все же нужно обсудить с врачом.
Родители должны помнить: и в профилактике, и в лечении всех детских заболеваний главным является здравый смысл мамы и папы.
Сравнение цен на анализы для детей:
Автор: Брикульская Юлия. Медицинский эксперт проектов, медицинский тренер, практикующий врач-терапевт. Специально для Простобанк Консалтинг
Дисбактериоз у грудничка: симптомы и лечение
Как известно помимо стерильных областей нашего организма (такой как, например, кровь), у нас есть органы, в которых живут различные бактерии. Среди них различают «дружественные», «враждебные» и «нейтральные». Набор бактерий у каждого человека свой, именно его и называют микрофлорой. Как только состояние микрофлоры отклоняется от нормы (индивидуальной для каждого организма), диагностируется дисбактериоз. Причиной изменений во флоре ребенка всегда является стресс — смена климата, режима, нарушение биоритмов, болезнь, введение в рацион новых продуктов и пр. Самый верный сценарий поведения родителей в сложившейся ситуации — подождать.
Симптомы дисбактериоза у грудничка исчезнут при одном из условий:
1. Организм адаптируется к новым условиям
2. Причина, вызвавшая сбой (простуда или стресс), будет устранена.
Многие педиатры убеждены, что дисбактериоз нужно лечить и рекомендуют принимать препараты для восстановления микрофлоры. Зачастую они неэффективны, однако, мама принимает естественное возвращение здоровья малыша в норму за результат от лечения.
Какие симптомы указывают на дисбактериоз у грудничка:
- Плохой аппетит
- Метеоризм, вздутие живота
- Боли в животе
- Молочница, стоматит
- Расстройство стула — запоры, понос
- Отрыжка, рвота
- Неприятный запах изо рта
Безусловно, эти симптомы могут сигнализировать о действительно серьезных заболеваниях ЖКТ. Поэтому для определения причин недомогания делают анализ кала. Дисбактериоз по нему определить невозможно, а вот выявить опасные кишечные инфекции (дизентерию, сальмонеллез и др.) — да.
Рекомендаций для лечения синдрома не существует, однако для профилактики дисбактериоза у младенцев стоит выполнять следующие советы педиатров:
- Кормите ребенка грудью (как минимум полгода после рождения, в идеале —до 1–1,5 года). Мамино молоко — залог здоровья малыша. Грудничкам, страдающим от дисбактериоза, оно нужно особенно.
- Смесь для искусственников подбирайте вместе с наблюдающим ребенка педиатром. Хорошо, если в ней будет содержаться пребиотик ГОС (такой есть в каждой смеси Valio Baby®). Он похож на естественные пищевые волокна, которые содержатся в грудном молоке и способствуют формированию здоровой микрофлоры младенца.
#PROMO_BLOCK#
- Не увлекайтесь стерильностью. Разумеется, это не значит, что ребенок должен жить в грязи, однако полностью ограждать детский организм от внешних бактерий не стоит. У малыша должен сформироваться иммунитет.
- Чаще и дольше гуляйте на свежем воздухе.
- Не кормите ребенка насильно, если у него нет аппетита или он перенес какой-либо стресс (смену режима, нововведения в меню, переезд). Доказано, что микрофлора быстрее приходит в норму, если кишечник не перегружен. Некоторые родители практикуют намеренное ограничение в питании малыша, чтобы он быстрее почувствовал себя лучше.
Дисбактериоз у детей
Дисбактериоз у детей – явление очень частое. К счастью, диагнозом дисбактериоз кишечника не является, то есть не входит в международную классификацию болезней. Тем не менее, дисбактериоз существует, и в особенности часто у детей.
Что же такое дисбактериоз?
Ребенок, как мы с Вами знаем уже из предыдущих статей, рождается в этом мире абсолютно стерильным. Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Если в эти первые часы жизни в организм ребенка попадут помимо условно хороших бактерий еще и не очень хорошие, или патогенные бактерии, то у ребенка с самого момента его появления на свет будет нарушено состояние поверхностной защиты, иными словами, пленка может оказаться с дырками. Через эти слабые места в дальнейшем возможно попадание в организм различных аллергенов, вирусов и бактерий.
Точно также «дырки в защитной пленке» образуются в результате применения различных химиотерапевтических препаратов, прежде всего, антибиотиков.
Отсюда вывод: если мама ребенка во время беременности или во время лактации (кормления грудью), или же сам ребенок сразу после рождения получали антибиотики, дисбактериоз обеспечен.
А как следствие дисбактериоза возникают проблемы с аллергией, вплоть до непереносимости белка материнского молока. В настоящее время уже появились анализы на антитела IgE и IgG грудного ребенка к белку не только коровьего, но даже грудного материнского молока.
Как мы можем вылечить дисбактериоз?
Справедливости ради надо сказать, что вылечить дисбактериоз нельзя, поскольку это не болезнь, как уже написано выше. Но если в микробиологическом анализе кала на дисбактериоз высеиваются патогенные бактерии, то это – не дисбактериоз, а кишечная инфекция, которая лечится, увы, антибиотиками.
Во всех остальных случаях нарушения нормальной микрофлоры кишечника, запомните, дисбактериоз Не лечится антибиотиками!
В настоящее время принято очень много схем лечения дисбактериоза, которые включают различные бактериофаги – специальные вирусы, которые паразитируют на плохих микробах, во все схемы лечения дисбактериоза обязательно входят сорбенты – препараты, связывающие и выводящие из организма токсины патогенных бактерий, а также пищевые аллергены.
Но основным методом лечения дисбактериоза кишечника по-прежнему остается длительный прием пробиотиков, то есть колоний хороших, полезных бактерий, которые очень нужны для правильного пищеварения и профилактики аллергии у детей, кто бы и что Вам не говорил.
Лечение дисбактериоза – это длительный и сложный процесс, но стоит того, чтобы предотвратить у ребенка развитие хронического запора или остановить развитие атопического дерматита.
Самостоятельно нельзя начинать прием никаких препаратов для лечения дисбактериоза, так как любые препараты имеют и плюсы, и минусы, то есть возможные побочные эффекты, и только грамотный врач педиатр, аллерголог илигастроэнтеролог должны подобрать и контролировать необходимый курс лечения.
признаки, симптомы, лечение дисбактериоза у ребенка
Наверное, нет такой мамы, которая не слышала бы о дисбактериозе кишечника у грудничков. Такой диагноз ставят практически каждому малышу, лишь 10% новорожденных не столкнулись с проблемой нарушения микрофлоры. Почему такое состояние является вариантом нормы? Как определить дисбактериоз кишечника у грудничка и какие меры можно предпринять для коррекции?
Иногда возникает путаница с терминами «дисбактериоз» и «дисбиоз». На самом деле это почти синонимы, но второе понятие шире. Под дисбактериозом подразумевается дисбаланс только бактериальной составной микрофлоры, под дисбиозом — нарушение баланса всей микрофлоры. Поэтому правильнее говорить именно о дисбиозе, ведь флора кишечника представлена не только бактериями.
Что такое дисбактериоз (дисбиоз) кишечника?
В кишечнике здорового человека обитают триллионы разных микроорганизмов: по большей части это бактерии, но есть также дрожжевые грибы, вирусы, простейшие. Бактерии не просто мирно живут там, а приносят пользу: участвуют в работе иммунитета, помогают усваивать питательные вещества, обезвреживают яды, производят витамины, подавляют рост вредной флоры. «Хорошие» микробы — это бифидо- и лактобактерии. Остальные микроорганизмы, населяющие кишечник, — безвредные или условно-патогенные. Последние при определенных обстоятельствах способны стать причиной болезни.
Дисбиоз — это нарушение нормального состояния микрофлоры и соотношения отдельных ее компонентов. Другими словами, полезных бактерий становится меньше, а условно-патогенные и вредные микробы интенсивно размножаются. Это проявляется признаками расстройства пищеварения (и не только). Особенно подвержен дисбиозу организм малышей, и этому есть объяснение.
Пока ребенок находится в утробе матери, его кишечник стерилен. В процессе появления на свет, проходя через родовые пути, малыш впервые «знакомится» с микробами. В последующие дни бактерии продолжают заселять кишечник новорожденного. В организм крохи они проникают в основном с грудным молоком, а еще при контакте с кожей матери, с окружающими предметами.
Более или менее нормальный состав микрофлоры устанавливается к концу первой недели жизни и окончательно стабилизируется примерно к году. Поэтому до седьмого дня дисбиоз — абсолютно физиологическое явление. Его так и называют — транзиторный, то есть преходящий. Если в первые дни жизни у малыша частый жидкий стул, бить тревогу не стоит — конечно, при условии, что новорожденный чувствует себя хорошо, активно питается и набирает вес.
К сожалению, транзиторный дисбиоз (дисбактериоз) кишечника у детей часто переходит в истинный. О нем говорят, когда признаки нарушения пищеварения не проходят спустя неделю после появления на свет или развиваются в дальнейшем на фоне полного благополучия.
Истинный дисбиоз не возникает на пустом месте, хотя точно установить его причину удается не всегда. Известно, что нарушению равновесия микрофлоры у грудничков способствуют:
- Недоношенность. Организм малышей, родившихся раньше положенного срока, мало приспособлен к условиям внешнего мира, иммунная система таких деток очень слаба.
- Искусственное вскармливание. Нет лучшей пищи для новорожденного, чем молоко матери. С ним в организм малыша поступают полезные лакто- и бифидобактерии и антитела, которые формируют здоровый состав микрофлоры и устойчивость к неблагоприятным воздействиям. Если по каким-то причинам грудное вскармливание невозможно, ребенок лишается естественной защиты, и на этом фоне часто развивается дисбиоз.
- Инфекционные заболевания — как у самого малыша, так и у матери. Они подавляют иммунитет и провоцируют размножение вредной флоры в кишечнике.
- Прием антибиотиков. Бывает так, что из-за осложненных родов, инфекций и других причин молодая мама вынуждена принимать антибактериальные препараты. Иногда приходится назначать их и малышу. Антибиотики — величайшее изобретение медицины, но у них есть побочные эффекты. Наряду с возбудителями болезней они убивают и здоровую кишечную флору, что ведет к дисбиозу (дисбактериозу) кишечника у новорожденных.
- Изоляция от матери в первые дни жизни. Постоянный контакт с мамой очень важен для становления «правильной» микрофлоры и иммунитета крохи. И речь не только о грудном вскармливании, хотя о нем в первую очередь — раннее прикладывание к груди служит обязательным условием формирования иммунной защиты. Но имеет значение и сам по себе контакт. Постоянное нахождение рядом с мамой помогает регулированию обмена веществ и других важных процессов[1].
Симптомы и признаки дисбактериоза (дисбиоза) кишечника у детей до года
Изменения в составе кишечной микрофлоры можно обнаружить лабораторным путем. Но такие анализы назначают, конечно, не всем малышам, а лишь тем, у которых есть характерные признаки дисбиоза. Чтобы вовремя выявить нарушения, маме стоит запомнить, как проявляется дисбиоз (дисбактериоз) кишечника у детей. Насторожить должны следующие симптомы:
- Колики. Практически все груднички в возрасте примерно от 1 до 3 месяцев страдают от болей в животике, вызванных несовершенством моторики ЖКТ. Но при дисбиозе колики обычно сильнее, и этот период длится дольше.
- Беспокойство. Из-за болей в животе малыш плачет, плохо спит, часто просыпается.
- Метеоризм. Нарушения пищеварения ведут к процессам брожения, скоплению газов в кишечнике. Это проявляется вздутием живота и болями.
- Срыгивание и рвота. Если в течение нескольких минут после кормления малыш периодически «выдает» обратно небольшое количество молока или смеси, это нормально и тревожиться не о чем. Но если срыгивания повторяются слишком часто и их объем больше допустимого, это повод заподозрить дисбиоз (дисбактериоз) кишечника у младенца.
- Диарея. В норме стул у грудничков может быть после каждого кормления. Он однородной консистенции, желтоватого цвета, без неприятного запаха. У детей на искусственном вскармливании опорожнение кишечника происходит реже — 1–3 раза в сутки. Учащенный (больше 12 раз в день) жидкий стул с частичками непереваренной пищи, примесью пены и слизи, с неприятным запахом — это диарея, которая очень часто сопутствует дисбалансу микрофлоры.
- Запор. При нарушении равновесия кишечной микрофлоры иногда наблюдается и обратная картина: слишком редкий стул (1 раз в 2–3 дня и реже), затрудненное опорожнение кишечника.
- Нерегулярный стул. При дисбиозе (дисбактериозе) кишечника у грудного ребенка запоры нередко перемежаются поносами.
- Изменение характера испражнений. Зеленый цвет кала, резкий гнилостный или кислый запах, наличие в нем большого количества слизи, пены, хлопьев даже при отсутствии поноса свидетельствуют о том, что с микрофлорой не все в порядке.
- Кожные проявления. Иногда при дисбиозе у малыша можно заметить сыпь на щеках, участки сухости и шелушения на локтях и коленях, трещины в уголках рта. Все это — следствие недостатка витаминов и минеральных веществ.
Лечение дисбактериоза (дисбиоза) кишечника у детей: устраняем симптомы и причины
Дисбиоз кишечника не считается болезнью, поэтому о его лечении говорить не совсем правильно. Скорее речь идет о коррекции микрофлоры. Задача состоит в том, чтобы:
- уменьшить численность вредных и условно-патогенных микроорганизмов;
- заселить кишечник полезными бактериями, помочь им, создать подходящие условия для роста;
- наладить пищеварение малыша;
- избежать вероятности дисбаланса микрофлоры в будущем.
Чтобы достичь всех этих целей, нужно действовать комплексно. Прежде всего стоит обратиться к детскому врачу. Грамотный педиатр назначит анализы (копрограмму, бактериологическое исследование кала) и, если их результаты подтвердят дисбиоз, разработает программу коррекции. Скорее всего, в нее будут включены следующие мероприятия (или некоторые из них).
Назначение антибактериальных средств . Первоочередная задача при коррекции микрофлоры — замедлить рост вредных микробов. Если анализ показал, что их количество намного больше нормы, врач может назначить бактериофаги. Это «предшественники» антибиотиков, вирусы, которые проникают в клетки бактерий конкретных видов (есть «убийцы» стафилококков, стрептококков и других) и разрушают их. Антибиотики при дисбиозе прописывают редко и только тогда, когда для этого есть веские основания, например кишечная инфекция.
Пробиотики и пребиотики . Их часто путают из-за схожести названий. Непонимание разницы ведет к тому, что родители порой не знают, какие средства выбрать для коррекции микрофлоры у малыша. На самом деле нужно и то и другое. Пребиотики — это вещества, которые стимулируют рост полезной флоры в кишечнике. Многие из них содержатся в пище. Существуют и специальные пребиотические добавки.
Что касается пробиотиков, то они представляют собой живые культуры «хороших» микроорганизмов — бифидобактерий и/или лактобацилл. Эти средства помогают не только предотвратить дисбиоз, но и избавить малыша от проявлений уже существующего нарушения. Предпочтительнее использовать пробиотики, которые содержат оба вида бактерий (лакто- и бифидо-): тогда и эффект будет комплексным. Средства выпускают в сухом и жидком виде. Для грудничков удобнее для применения форма капель.
Сорбенты . При дисбалансе микрофлоры нарушается пищеварение, и в кишечнике образуются токсины, которые сорбенты связывают и выводят из ЖКТ.
Микробиологическое исследование кала на дисбиоз — один из самых популярных анализов в педиатрической практике. Но не все специалисты считают его информативным. Дело в том, что на результат влияет слишком много условий, и данные не всегда можно расценивать как объективные. Поэтому опытные врачи руководствуются прежде всего симптоматикой и лечат ребенка, а не «анализы». Важная роль лабораторного исследования в том, что оно позволяет определить, каких именно вредных микробов в кишечнике больше всего.
Ферменты . Их задача — помочь неокрепшей пищеварительной системе грудного ребенка справиться с расщеплением белков, жиров и углеводов.
Средства для нормализации моторики ЖКТ . Они избавляют малыша от запоров и диареи, помогают уменьшить газообразование и колики.
Огромная роль в коррекции проявлений дисбиоза принадлежит правильному питанию. Грудное молоко — это лучший вид пищи для ребенка от рождения до года: оно не только прекрасно усваивается, но и содержит защитные факторы, которые служат основой крепкого иммунитета малыша. К сожалению, не у каждой мамы есть возможность кормить ребенка грудью. Если случилось так, что грудное вскармливание невозможно, важно правильно подобрать адаптированную молочную смесь и наладить режим питания. Ни в коем случае нельзя увеличивать порции или концентрацию, даже если кажется, что малыш плохо прибавляет в весе. Следите за реакцией ребенка на смесь: если она вызвала аллергию или расстройство пищеварения, стоит подобрать другую.
Очень осторожными следует быть при введении прикорма. До 6 месяцев единственной пищей малыша должно быть материнское молоко или адаптированная молочная смесь. Новые продукты включайте в рацион крохи постепенно, внимательно отслеживая реакцию.
Грудной малыш — крохотное и беспомощное существо, и его здоровье полностью зависит от близких. Только мама (да еще, пожалуй, опытный и чуткий семейный врач) знает, что хорошо для ребенка. В вопросе коррекции дисбиоза нельзя полагаться на случайные мнения, и выбор средств должен быть осознанным. Пробиотик с комплексным составом — оптимальное решение для восстановления нарушенной микрофлоры.
архивов клинической микробиологии | инсайт медицинское издательство
Импакт-фактор журнала: 0,72 *; 1,37 * (5-летний импакт-фактор)
Index Copernicus Value: 88.97
H Index: 3
Глобальный импакт-фактор: 0,564
Research Gate Journal Impact: 0,16
Архив клинической микробиологии (ISSN: 1989-8436) — это рецензируемый международный журнал, в редакционной коллегии которого участвуют всемирно признанные ученые.С быстрой публикацией статей во всех областях микробиологии и инфекционных болезней. Архив клинической микробиологии существует уже восьмой год, и он был включен в каталог Национальной медицинской библиотеки (NLM) (первый шаг, который будет проиндексирован в PubMed). Кроме того, он проиндексирован в Index Copernicus (ICV: 88.97), DeepDyve, Open J Gate, JournalSeek, EBSCO A-Z.
https://www.imedpub.com/submissions/archives-clinical-microbiology.html или отправьте в виде вложения по электронной почте в редакцию по адресу [электронная почта защищена]
Патогенные бактерии
Патогенные бактерии — это бактерии, которые при попадании в организм способны вызывать заболевание и распространяться через воду, воздух, почву, а также при физическом контакте.В основном бактерии безвредны и полезны, но некоторые из них являются патогенными.
Связанные журналы патогенных бактерий
Журнал гепатита, Журнал иммунологических методов лечения инфекционных заболеваний, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Журнал патологии и трансляционной медицины, Журнал патологии. Клинические исследования, отчеты о клинических случаях в клинической патологии, журнал Джейкобса по микробиологии и патологии, текущие отчеты по патобиологии, Международный журнал судебной медицины и патологии, Открытие патологии.
Вирусная болезнь
Вирусные болезни — это инфекции, вызываемые вирусом или микроорганизмами. вирус, поражающий клетку, или формирование вирусной капсулы на поверхности клетки, которая может начать размножаться сама по себе и начинает распространяться, что приводит к вирусному заболеванию.
Связанные журналы вирусных заболеваний
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусная болезнь, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в области вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Вирусология пищевых продуктов и окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Микобактериальные болезни
Микобактериальное заболевание — это инфекция одного типа, вызываемая скоплением микробов. Эти микобактериальные заболевания включают туберкулез, проказу, микобактерии язвы и Mycobacterium Para tuberculosis. Обычно их лечат такими лекарствами, как рифампицин, этамбутол и изониазид. Mycobacterium leprae лечится дапсоном.
Связанные журналы микобактериальных болезней
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинские журнал микологии, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Бактериальная инфекция
Бактериальные инфекции — это инфекции, вызываемые бактериями. Инфекционная бактерия быстро размножается и выделяет токсичные химические вещества, которые повреждают ткани. Общие бактериальные инфекции включают пневмонию, ушные инфекции, диарею, инфекции мочевыводящих путей и кожные заболевания
Журналы, связанные с бактериальной инфекцией
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Патогены и болезни, Текущие отчеты по клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и окружающей среды , Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал исследований микробиологии.
Вирусная инфекция
Вирусные инфекции — это небольшой инфекционный организм, который меньше грибка или бактерии. Вирус прикрепляется к поверхности клетки и высвобождает свою вирусную ДНК или РНК внутри клеток, которые затем реплицируются сами по себе внутри клетки, чтобы сделать клетку более заразной и распространяться от одной клетки к другой, что приводит к вирусной инфекции.
Журналы, относящиеся к вирусным инфекциям
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Вирусология пищевых продуктов и окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Грибковая инфекция
Грибковые инфекции — это инфекция, которая обычно начинается в легких или на коже, прогрессирует медленно и редко бывает серьезной, если иммунная система не работает на выходных. Когда иммунная система выходит на выходные, она может быть очень агрессивной и быстро распространяться, что приводит к смерти.
Связанные журналы по грибковой инфекции
Медицинская микология: открытый доступ, журнал патологии и эпидемиологии, исследования первичного и приобретенного иммунодефицита, журнал вирусологических и противовирусных исследований, достижения в области антибиотиков и антител, отчеты о текущих грибковых инфекциях, журнал инвазивных грибковых инфекций, отчеты о случаях медицинской микологии, медицинская микология журнал, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Медицинская микробиология
Медицинская микробиология начинается с анализа иммунной системы, с помощью которой микроорганизмы или токсины проникают силой, чтобы победить клетки и встретиться с ними. Это исследование микроорганизмов или микробов, которые влияют на все аспекты нашей жизни, а также включают реакцию хозяина на микроорганизмы.
Родственные журналы медицинской микробиологии
Клиническая микробиология: Открытый доступ, Журнал новых инфекционных заболеваний, Журнал судебной патологии, Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Открытый журнал медицинской микробиологии, Журнал медицинской микробиологии, Международный журнал медицинской микробиологии, Медицина Микробиология и иммунология, Индийский журнал медицинской микробиологии, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Обзоры по медицинской микробиологии, Международный журнал медицинской микробиологии, Приложение, Письма по медицинской микробиологии.
Вирус гепатита
Гепатит — это заболевание печени, при котором печень набухает и воспаляется из-за вирусной инфекции, которая приводит к гепатиту. Состояние может проходить самостоятельно или прогрессировать до фиброза, цирроза или рака печени. Вирусная инфекция гепатита бывает пяти типов: гепатит A, B, C, D и E, а также может возникать в результате употребления алкоголя.
Связанные журналы вируса гепатита
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Текущие отчеты гепатологии, Исследования и лечение гепатита, Вирусный гепатит на практике, Ежемесячный гепатит, Текущие отчеты о гепатите, Еженедельный гепатит, Журнал вирусных гепатитов, Обзоры вирусных гепатитов, Ежегодник гепатита B, Горячие темы по вирусному гепатиту
Microbial Genomics
Микробная геномика — это исследование микроорганизмов, генетический материал которых содержит микробы.Анализ всего микробного генома дает представление о микробной оценке и разнообразии микробов, помимо филогении отдельных белков или генов.
Связанные журналы микробной геномики
Микробная и сравнительная геномика, Наука и технологии генома, Новые микробы и инфекции, Микробная информатика и эксперименты, Микробная биотехнология, Фабрики микробных клеток, Микробные выбросы: вирусы, бактерии, грибы, Микробная экология в здоровье и болезнях.
Золотистый стафилококк
Золотистый стафилококк — это бактерия, вызывающая болезни человека. Чаще всего абсцессы или целлюлит — это инфекции, вызванные золотистым стафилококком. Это происходит, когда кожа порезается или царапается, что позволяет бактериям проникнуть внутрь, а затем инфицировать. Это будет происходить в основном в ногах и руках.
Журналы, относящиеся к Staphylococcus aureus
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Патогены и болезни, Текущие отчеты клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и микробиологии окружающей среды, Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал микробиологических исследований.
Вирус иммунодефицита человека
Вирус иммунодефицита человека — это вирус, который атакует иммунную систему, заражая лейкоциты. Лейкоциты — важная часть иммунной системы, которая будет уничтожена определенным вирусом, называемым ВИЧ, что приводит к нехватке лейкоцитов, что снижает иммунную силу.
Связанные журналы вируса иммунодефицита человека
Журнал ВИЧ и ретро-вируса, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, The lancet HIV, Журнал клинических исследований в области ВИЧ, СПИДа и профилактики, Исследования и лечение СПИДа, ВИЧ / СПИД (Окленд, Н.Z.), Журнал исследований СПИДа и ВИЧ (онлайн), Журнал эпиднадзора за ВИЧ и эпидемиологией СПИДа, Будущее лечение ВИЧ, Журнал профилактики ВИЧ / СПИДа у детей и молодежи, Исследования СПИДа и ретровирусы человека, Обзор ВИЧ и СПИДа.
Холера
Холера — инфекционное заболевание, вызывающее диарею. Vibrio cholera — это бактерия, вызывающая холеру, которая может быть обнаружена в загрязненной воде или пище и приводит к обезвоживанию из-за потери жидкости организма во время диареи.
Журналы по теме холеры
Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архивы воспаления, Текущие отчеты об инфекционных заболеваниях, Медицина путешествий и инфекционные заболевания, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Текущие клинические темы инфекционных заболеваний, Скандинавский журнал инфекционных заболеваний, Инфекционные добавки в клинической практике, Kansenshogaku zasshi.Журнал Японской ассоциации инфекционных заболеваний, Достижения в области детских инфекционных заболеваний, Междисциплинарные перспективы инфекционных заболеваний, Журнал глобальных инфекционных заболеваний, Американский журнал инфекционных заболеваний.
Болезнь, вызванная вирусом Эбола
Вирус Эбола — это вирус, вызывающий острое и серьезное заболевание, которое при отсутствии лечения часто заканчивается летальным исходом. Его иначе называют геморрагической лихорадкой Эбола, которая является смертельным вирусом, вызывающим внутреннее и внешнее кровотечение в организме.
Связанные журналы болезни, вызванной вирусом Эбола
Архив клинической микробиологии, Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Современные мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Ротавирусная инфекция
Инфекция, вызванная вирусом рота, является наиболее частой причиной тяжелой диареи, вызывающей обезвоживание. Она может распространяться через заражение рук, воды, пищи или любых предметов. Вирус попадает внутрь через пищевые продукты и распространяется через слизистые оболочки, что в конечном итоге приводит к диарее из-за инфекции.
Журналы, относящиеся к ротавирусной инфекции
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архив воспаления, вирусных заболеваний, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Текущие мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Нам необходимо решить проблему недостаточности кишечника у младенцев прямо сейчас, предупреждают исследователи.
Новое рецензируемое исследование, опубликованное в Scientific Reports , показало, что 90% младенцев в США могут страдать от значительного дефицита важных ключевых бактерий. для переваривания грудного молока и развития иммунной системы.
Детали исследования
Исследователи из Стэнфордского университета, Университета Небраски и Evolve BioSystems собрали образцы фекалий 227 младенцев в возрасте до шести месяцев во время визитов педиатров в пяти разных штатах: Калифорния, Джорджия, Орегон, Пенсильвания и Южная Каролина. .
Исследовательская группа применила метагеномику дробовика для характеристики: (1) кишечных бактериальных сообществ здоровых младенцев в США в первые 6 месяцев жизни; (2) функции экосистемы путем определения метаболического потенциала кишечных микробиомов различных энтеротипов для метаболизма олигосахаридов грудного молока (HMOs) из грудного молока; и (3) носительство генов устойчивости к антибиотикам (ARG) у младенцев в разных штатах США.
Приведенные выше критерии использовались для классификации микробиомов как дисбиотических или нет, на основе концепции экосистемных услуг, адаптированной для оценки преимуществ, которые младенцы получают от функций, обеспечиваемых их кишечными микробиомами.
Образцы были проанализированы на наличие бактерий и их количество. Они также были протестированы на способность бактерий полностью использовать грудное молоко человека — признак наличия полезных для здоровья бактерий, а также на наличие в них генов устойчивости к антибиотикам.
Исследователи не включали образцы от младенцев с желтухой, от тех, кто активно проходил лечение антибиотиками, или от тех, у кого были диагностированы проблемы с всасыванием углеводов в кишечнике, из-за влияния таких условий на способность кишечника младенцев переносить из нормальных процессов.
Результаты
Исследование показало, что примерно у девяти из 10 младенцев отсутствуют Bifidobacterium longum subsp. Infantis (B. infantis) в микробиоме кишечника — тип бактерий, играющих критически важную роль в здоровье и развитии младенцев. Этот конкретный тип кишечных бактерий был широко задокументирован как оказывающий наиболее благотворное влияние на здоровье кишечника младенцев и обладающий способностью полностью раскрыть питательные свойства грудного молока, которое включает некоторые фракции олигосахаридов, которые не усваиваются другими способами.
«Подавляющее большинство младенцев испытывают дефицит этой ключевой кишечной бактерии с самых первых недель жизни, и это совершенно вне поля зрения большинства родителей и педиатров», — сказал соавтор исследования Карл Сильвестр, доктор медицины. профессор хирургии и педиатрии и заместитель декана отдела исследований здоровья матери и ребенка Стэнфордского университета.
Что такое «здоровый»?По словам авторов, «Этот опрос предлагает новую перспективу при рассмотрении младенцев в контексте здорового микробиома и его острых и долгосрочных последствий» , в связи с чем возникает вопрос: можно ли рассматривать младенцев здоровы, когда в них отсутствуют полезные бактерии и много потенциально патогенных бактерий?
«Совершенно верно.Мы склонны рассматривать здоровье как отсутствие болезней, но в этом случае младенцы могут выглядеть здоровыми и достичь определенных этапов своего развития, но микробиомы кишечника нездоровы изнутри. Мы должны помнить, что первые месяцы жизни задали траекторию для многих аспектов нашего иммунного, метаболического и когнитивного здоровья, и все это связано с правильным развитием микробиома нашего кишечника. Вот почему так важен B. infantis. Когда B infantis переваривает HMO в кишечнике ребенка, он питает кишечные клетки ребенка, помогает герметизировать слизистую оболочку стенки кишечника и уменьшает воспаление.Младенцы, лишенные B. infantis в микробиоме кишечника, упускают эти преимущества, и мы считаем, что это одна из основных причин, по которой мы наблюдаем рост аллергии, астмы, экземы и других заболеваний, таких как диабет 1 типа », — пояснил д-р Реббека Дуар, . Главный научный сотрудник Evolve Biosystems и соавтор исследования.
Устойчивость к антибиотикам: следующая глобальная пандемия
Дуар сказал, что самым удивительным открытием, полученным в результате исследования, было то, что диета, похоже, не имела никакого эффекта.
«Мы склонны связывать грудное вскармливание с более высоким содержанием бифидобактерий, но мы не обнаружили этого. И младенцы, вскармливаемые смесью, и грудным молоком, были дисбиотиками. Это открытие, вероятно, означает, что отсутствие B. infantis является проблемой поколений, и мы нарушили естественную передачу B. infantis от матери к ребенку », — сказал Дуар.
Она добавила, что еще одним удивительным и довольно мрачным открытием стало обнаружение генов устойчивости к антибиотикам, которые были специфичными для состояния. «Эти гены позволяют патогенам выжить при лечении антибиотиками, иногда их называют« супербактериями ».«В Калифорнии мы обнаружили 20 генов устойчивости к антибиотикам, которые не были обнаружены у младенцев ни в одном другом месте, которое мы тестировали, и еще 17 были уникальными для младенцев из Южной Каролины. Это может означать, что устойчивость к антибиотикам развивается независимо в разных регионах, и младенцы подхватывают эти бактерии там, где они живут. Устойчивость к антибиотикам широко считается следующей глобальной пандемией. Если мы извлекли урок из этого исследования, мы действительно должны принять упреждающий подход к решению детского дисбактериоза прямо сейчас.
Взгляд в будущее
«Это исследование дает наиболее четкую на сегодняшний день картину того, насколько широко распространена эта проблема, и подчеркивает необходимость с самого начала решать проблему дефицита B. infantis в кишечнике младенца», — предположил Сильвестр.
Хотя в отчете признается, что этот дефицит B. Infantis полностью вне поля зрения большинства родителей и педиатров, что они могут сделать? которые могут открыть окно в микробиом кишечника младенца.
«Повышенный pH в фекалиях, определяемый как 5,5 или выше, не только оказывает раздражающее действие на кожу, которое может проявляться в виде опрелостей, но также является признаком того, что B. infantis отсутствует, а ребенок страдает кишечными расстройствами. дисбактериоз, или то, что также называется кишечной недостаточностью новорожденных. Evivo (активированный B. infantis EVC001) — единственный детский пробиотик, который клинически доказал, что восстанавливает B. infantis в кишечнике младенца, уменьшает количество патогенных бактерий на 80%, снижает pH кала до рекомендуемых уровней и создает защитную среду в кишечнике младенца.Bifidobacterium (включая B. infantis) — это «дружественный» штамм бактерий, содержащийся во многих типах пробиотиков, продаваемых для младенцев, но Evivo (B. infantis EVC001) — единственный штамм, клинически доказано, что он ограничивает рост вредных бактерий в кишечнике ребенка. помогает направлять развитие иммунной системы как основу для здоровья на протяжении всей жизни », — поясняет изд. Ed Duar.
«Мы надеемся, что сосредоточимся не на проблеме, а на имеющихся решениях», — сказал Дуар. «Ранее мы показали в клинических исследованиях, что B. infantis можно восстановить, и можно решить детский дисбактериоз кишечника. Теперь цель состоит в том, чтобы убедиться, что у всех младенцев есть B. infantis в их микробиомах. ”
Наука о микробиоме: развивающаяся область
В последние годы произошел грандиозный прогресс в технологиях секвенирования и омики следующего поколения, что подтолкнуло науку о микробиоме к новым захватывающим рубежам в персонализированном питании.
Учитывая огромный прогресс, Дуар сказала, что считает тестирование микробиома на младенцах стандартом лечения в будущем.
«Стоимость секвенирования, метода, используемого для считывания микробиома, резко снизилась за последнее десятилетие. По мере того, как технологии развиваются, и мы продолжаем узнавать о том, насколько наши микробиомы взаимосвязаны с нашим здоровьем, анализ микробиома, скорее всего, станет стандартом лечения. Ключевым моментом здесь является наличие опыта интерпретации результатов », — сказал Дуар. «Микробиом невероятно сложен, и мы постоянно узнаем больше о том, какие функции он выполняет, и прогресс идет огромными темпами.
Источник: Scientific Reports
11, 1472 (2021) doi.org/10.1038/s41598-020-80583-9
«Метагеномное понимание структуры и функционирования сообщества микробиома младенцев на нескольких участках в США »
Авторы: Г. Касабури и др.
Микробиом кишечника младенца как микробный орган, влияющий на благополучие хозяина | Итальянский педиатрический журнал
Prakash S, Rodes L, Coussa-Charley M, Tomaro-Duchesneau C.Микробиота кишечника: новый рубеж в понимании здоровья человека и разработке биотерапевтических средств. Биопрепараты. 2011; 5: 71–86.
PubMed PubMed Central Google Scholar
Savage DC. Микробная экология желудочно-кишечного тракта. Annu Rev Microbiol. 1977; 31: 107–33.
CAS PubMed Статья PubMed Central Google Scholar
Miller TL, Wolin MJ, Conway de Macario E, Macario AJ.Выделение Methanobrevibacter smithii из фекалий человека. Appl Environ Microbiol. 1982. 43 (1): 227–32.
CAS PubMed PubMed Central Статья Google Scholar
Аманн Р.И., Людвиг В., Шлейфер К.Х. Филогенетическая идентификация и обнаружение in situ отдельных микробных клеток без культивирования. Microbiol Rev.1995; 59 (1): 143–69.
CAS PubMed PubMed Central Google Scholar
Zoetendal EG, Collier CT, Koike S, Mackie RI, Gaskins HR. Молекулярно-экологический анализ микробиоты желудочно-кишечного тракта: обзор. J Nutr. 2004. 134 (2): 465–72.
CAS PubMed Статья PubMed Central Google Scholar
Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа. 2006. 444 (7122): 1022–3.
CAS PubMed Статья PubMed Central Google Scholar
Суау А., Боннет Р., Сутрен М., Годон Дж. Дж., Гибсон Г. Р., Коллинз М. Д. и др. Прямой анализ генов, кодирующих 16S рРНК из сложных сообществ, позволяет выявить множество новых молекулярных видов в кишечнике человека. Appl Environ Microbiol. 1999. 65 (11): 4799–807.
CAS PubMed PubMed Central Статья Google Scholar
Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, et al. Метагеномный анализ микробиома дистального отдела кишечника человека.Наука. 2006. 312 (5778): 1355–9.
CAS PubMed PubMed Central Статья Google Scholar
Manichanh C, Rigottier-Gois L, Bonnaud E, Gloux K, Pelletier E, Frangeul L, et al. Уменьшение разнообразия фекальной микробиоты при болезни Крона, выявленное с помощью метагеномного подхода. Кишечник. 2006. 55 (2): 205–11.
CAS PubMed PubMed Central Статья Google Scholar
Rajilic-Stojanovic M, Smidt H, de Vos WM. Пересмотр разнообразия микробиоты желудочно-кишечного тракта человека. Environ Microbiol. 2007. 9 (9): 2125–36.
PubMed Статья Google Scholar
Turroni F, Peano C, Pass DA, Foroni E, Severgnini M, Claesson MJ, et al. Разнообразие бифидобактерий в кишечной микробиоте младенцев. PLoS One. 2012; 7 (5): e36957.
CAS PubMed PubMed Central Статья Google Scholar
Экбург П.Б., Бик Е.М., Бернштейн К.Н., Пурдом Э., Детлефсен Л., Сарджент М. и др. Разнообразие микробной флоры кишечника человека. Наука. 2005. 308 (5728): 1635–8.
PubMed PubMed Central Статья Google Scholar
Клаэссон М.Дж., Кьюсак С., О’Салливан О., Грин-Диниз Р., де Верд Н., Фланнери Е. и др. Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей. Proc Natl Acad Sci U S A.2011; 108 (Приложение 1): 4586–91.
CAS PubMed Статья Google Scholar
Backhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. Хозяин-бактериальный мутуализм в кишечнике человека. Наука. 2005; 307 (5717): 1915–20.
PubMed Статья CAS Google Scholar
Sender R, Fuchs S, Milo R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме.PLoS Biol. 2016; 14 (8): e1002533.
PubMed PubMed Central Статья CAS Google Scholar
Цинь Дж., Ли Р., Раес Дж., Арумугам М., Бургдорф К.С., Маничан С. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа. 2010. 464 (7285): 59–65.
CAS PubMed PubMed Central Статья Google Scholar
Ventura M, Sozzi T, Turroni F, Matteuzzi D, van Sinderen D.Влияние бактериофагов на пробиотические бактерии и разнообразие кишечной микробиоты. Genes Nutr. 2011; 6 (3): 205–7.
CAS PubMed Статья Google Scholar
Милани С., Дуранти С., Боттачини Ф., Кейси Э., Туррони Ф., Махони Дж. И др. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81 (4).
Каплан Дж. Л., Ши Х. Н., Уокер В. А..Роль микробов в иммунологическом программировании развития. Pediatr Res. 2011; 69 (6): 465–72.
PubMed Статья Google Scholar
Клаасен HLBM, Vanderheijden PJ, Stok W., Poelma FGJ, Koopman JP, Vandenbrink ME, et al. Апатогенные кишечные сегментированные нитчатые бактерии стимулируют иммунную систему слизистых оболочек мышей. Заражение иммунной. 1993. 61 (1): 303–6.
CAS PubMed PubMed Central Статья Google Scholar
Talham GL, Jiang HQ, Bos NA, Cebra JJ. Сегментированные нитчатые бактерии являются мощными стимулами физиологически нормального состояния иммунной системы слизистой оболочки кишечника мышей. Заражение иммунной. 1999. 67 (4): 1992–2000.
CAS PubMed PubMed Central Google Scholar
Gaboriau-Routhiau V, Rakotobe S, Lecuyer E, Mulder I., Lan A, Bridonneau C, et al. Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника.Иммунитет. 2009. 31 (4): 677–89.
CAS PubMed Статья Google Scholar
Корбетт А.Дж., Экл С.Б., Биркиншоу Р.В., Лю Л., Патель О., Махони Дж. И др. Активация Т-клеток преходящими неоантигенами, происходящими из различных микробных путей. Природа. 2014; 509 (7500): 361–5.
CAS PubMed Статья Google Scholar
Вонг Дж. М., де Соуза Р., Кендалл К. В., Эмам А., Дженкинс Д. Д..Здоровье толстой кишки: ферментация и жирные кислоты с короткой цепью. J Clin Gastroenterol. 2006. 40 (3): 235–43.
CAS PubMed Статья Google Scholar
Turroni F, Ribbera A, Foroni E, van Sinderen D, Ventura M. Микробиота кишечника человека и бифидобактерии: от состава к функциональности. Антони Ван Левенгук. 2008. 94 (1): 35–50.
PubMed Статья Google Scholar
Мазманян СК, Раунд JL, Каспер DL. Фактор микробного симбиоза предотвращает воспалительные заболевания кишечника. Природа. 2008. 453 (7195): 620–5.
CAS PubMed Статья Google Scholar
Atarashi K, Tanoue T., Shima T., Imaoka A, Kuwahara T., Momose Y, et al. Индукция регуляторных Т-клеток толстой кишки аборигенными видами Clostridium. Наука. 2011. 331 (6015): 337–41.
CAS PubMed Статья Google Scholar
Zhang LL, Chen X, Zheng PY, Luo Y, Lu GF, Liu ZQ и др. Oral Bifidobacterium модулирует иммунное воспаление кишечника у мышей с пищевой аллергией. J Gastroenterol Hepatol. 2010. 25 (5): 928–34.
PubMed Статья CAS Google Scholar
Ливингстон М., Лоуч Д., Уилсон М., Таннок Г.В., Бэрд М. Комменсальный кишечник Lactobacillus reuteri 100-23 стимулирует иммунорегуляторный ответ. Immunol Cell Biol. 2010. 88 (1): 99–102.
PubMed Статья Google Scholar
Мангалам А., Шахи С.К., Лаки Д., Карау М., Мариетта Е., Луо Н. и др. Комменсальные бактерии кишечного происхождения человека подавляют воспалительные и демиелинизирующие заболевания ЦНС. Cell Rep. 2017; 20 (6): 1269–77.
CAS PubMed PubMed Central Статья Google Scholar
Penders J, Thijs C, Vink C, Stelma FF, Snijders B., Kummeling I, et al.Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатрия. 2006. 118 (2): 511–21.
PubMed Статья PubMed Central Google Scholar
Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н. и др. Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S. A. 2010; 107 (26): 11971–5.
PubMed PubMed Central Статья Google Scholar
Hopkins MJ, Macfarlane GT, Furrie E, Fite A, Macfarlane S. Характеристика кишечных бактерий в стуле младенцев с использованием ПЦР в реальном времени и анализов северной гибридизации. FEMS Microbiol Ecol. 2005. 54 (1): 77–85.
CAS PubMed Статья PubMed Central Google Scholar
Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, Knight R и др.Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4578–85.
CAS PubMed Статья PubMed Central Google Scholar
Палмер С., Бик Э.М., ДиДжиулио ДБ, Релман Д.А., Браун П.О. Развитие кишечной микробиоты младенца у человека. PLoS Biol. 2007; 5 (7): e177.
PubMed PubMed Central Статья CAS Google Scholar
Тернбо П.Дж., Хамади М., Яцуненко Т., Кантарел Б.Л., Дункан А., Лей Р.Э. и др. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009. 457 (7228): 480–4.
CAS PubMed Статья PubMed Central Google Scholar
Ковач А., Бен-Джейкоб Н., Тайем Х., Гальперин Е., Иракский Ф.А., Гофна Ю. Генотип является более сильным детерминантом, чем пол микробиоты кишечника мыши. Microb Ecol. 2011. 61 (2): 423–8.
PubMed Статья PubMed Central Google Scholar
Zhang CH, Zhang MH, Wang SY, Han RJ, Cao YF, Hua WY, et al. Взаимодействие между кишечной микробиотой, генетикой хозяина и диетой, имеющее отношение к развитию метаболических синдромов у мышей (том 4, стр. 232, 2010). ISME J. 2010; 4 (2): 312–3.
CAS Статья Google Scholar
Goodrich JK, Davenport ER, Clark AG, Ley RE. Обращается внимание на взаимосвязь между геномом человека и микробиомом. Анну Рев Жене. 2017; 51: 413–33.
CAS PubMed PubMed Central Статья Google Scholar
Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, et al. Сожительствующие члены семьи разделяют микробиоту друг с другом и со своими собаками. eLife. 2013; 2: e00458.
PubMed PubMed Central Статья Google Scholar
Ley RE, Hamady M, Lozupone C, Turnbaugh PJ, Ramey RR, Bircher JS, et al. Эволюция млекопитающих и их кишечных микробов. Наука. 2008. 320 (5883): 1647–51.
CAS PubMed PubMed Central Статья Google Scholar
Muegge BD, Kuczynski J, Knights D, Clemente JC, Gonzalez A, Fontana L, et al. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека. Наука. 2011. 332 (6032): 970–4.
CAS PubMed PubMed Central Статья Google Scholar
Munyaka PM, Khafipour E, Ghia JE. Внешнее влияние на формирование микробиоты кишечника в раннем детстве и последующие последствия для здоровья.Фронт Педиатр. 2014; 2: 109.
PubMed PubMed Central Статья Google Scholar
Garcia-Mantrana I, Alcantara C, Selma-Royo M, Boix-Amoros A, Dzidic M, Gimeno-Alcaniz J, et al. MAMI: когорта новорожденных, сосредоточенная на микробиоте матери и ребенка в раннем возрасте. BMC Pediatr. 2019; 19 (1): 140.
PubMed PubMed Central Статья Google Scholar
Dogra S, Sakwinska O, Soh SE, Ngom-Bru C, Bruck WM, Berger B и др. Скорость установления микробиоты кишечника в младенчестве имеет последствия для здоровья в будущем. Кишечные микробы. 2015; 6 (5): 321–5.
PubMed PubMed Central Статья Google Scholar
Vael C, Desager K. Важность развития кишечной микробиоты в младенчестве. Curr Opin Pediatr. 2009. 21 (6): 794–800.
PubMed Статья PubMed Central Google Scholar
Saavedra JM, Dattilo AM. Раннее развитие кишечной микробиоты: последствия для здоровья в будущем. Гастроэнтерол Clin N Am. 2012. 41 (4): 717–31.
Артикул Google Scholar
Houghteling PD, Walker WA. Почему первоначальная бактериальная колонизация кишечника важна для здоровья младенцев и детей? J Педиатр Гастроэнтерол Нутр. 2015; 60 (3): 294–307.
PubMed PubMed Central Статья Google Scholar
Olszak T, An D, Zeissig S, Vera MP, Richter J, Franke A, et al. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336 (6080): 489–93.
CAS PubMed PubMed Central Статья Google Scholar
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352 (6285): 539–44.
CAS PubMed PubMed Central Статья Google Scholar
Джонсон СС, собственник ДР. Бактериальная микробиота кишечника младенцев и риск детской астмы и аллергических заболеваний. Перевод Рез. 2017; 179: 60–70.
PubMed Статья PubMed Central Google Scholar
Johnson CC, Ownby DR. Аллергия и астма: являются ли атопические расстройства результатом неадекватного иммунного гомеостаза, вызванного дисбактериозом кишечника младенцев? Эксперт Рев Клин Иммунол. 2016; 12 (4): 379–88.
CAS PubMed PubMed Central Статья Google Scholar
Азад МБ, Козырский АЛ. Перинатальное программирование астмы: роль кишечной микробиоты. Clin Dev Immunol. 2012; 2012: 932072.
PubMed Статья PubMed Central Google Scholar
Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S, Yurist-Doutsch S, et al. Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы. Sci Transl Med. 2015; 7 (307): 307ра152.
PubMed Статья CAS PubMed Central Google Scholar
Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC. Низкое разнообразие кишечной микробиоты в раннем младенчестве предшествует астме в школьном возрасте. Clin Exp Allergy. 2014; 44 (6): 842–50.
CAS PubMed Статья PubMed Central Google Scholar
Stiemsma LT, Arrieta MC, Dimitriu PA, Cheng J, Thorson L, Lefebvre DL, et al. Сдвиги у Lachnospira и Clostridium sp. В 3-месячном стуле микробиом ассоциируется с астмой дошкольного возраста.Clin Sci. 2016; 130 (23): 2199–207.
CAS PubMed Статья PubMed Central Google Scholar
Каллиомаки М., Салминен С., Арвиломми Х., Керо П., Коскинен П., Изолаури Е. Пробиотики в первичной профилактике атопических заболеваний: рандомизированное плацебо-контролируемое исследование. Ланцет. 2001. 357 (9262): 1076–9.
CAS PubMed Статья PubMed Central Google Scholar
Penders J, Thijs C., van den Brandt PA, Kummeling I., Snijders B., Stelma F, et al. Состав кишечной микробиоты и развитие атопических проявлений в младенчестве: когортное исследование KOALA Birth. Кишечник. 2007. 56 (5): 661–7.
CAS PubMed Статья PubMed Central Google Scholar
Penders J, Stobberingh EE, Thijs C., Adams H, Vink C., van Ree R, et al. Молекулярный фингерпринт микробиоты кишечника младенцев, у которых атопическая экзема развивалась или не развивалась.Clin Exp Allergy. 2006. 36 (12): 1602–8.
CAS PubMed Статья PubMed Central Google Scholar
Ван М., Карлссон С., Олссон С., Адлерберт И., Уолд А.Е., Страчан Д.П. и др. Уменьшение разнообразия в ранней фекальной микробиоте младенцев с атопической экземой. J Allergy Clin Immunol. 2008. 121 (1): 129–34.
PubMed Статья Google Scholar
Исмаил И.Х., Оппедисано Ф., Джозеф С.Дж., Бойл Р.Дж., Личчарди П.В., Робинс-Браун Р.М. и др. Уменьшение разнообразия кишечных микробов в раннем возрасте связано с более поздним развитием экземы, но не атопии у младенцев из группы высокого риска. Pediatr Allergy Immunol. 2012. 23 (7): 674–81.
PubMed Статья PubMed Central Google Scholar
Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC. Низкое разнообразие кишечной микробиоты у младенцев с атопической экземой.J Allergy Clin Immunol. 2012; 129 (2): 434–40 40 e1–2.
PubMed Статья PubMed Central Google Scholar
Nylund L, Nermes M, Isolauri E, Salminen S, de Vos WM, Satokari R. Тяжесть атопического заболевания обратно коррелирует с разнообразием кишечной микробиоты и бактериями, продуцирующими бутират. Аллергия. 2015; 70 (2): 241–4.
CAS PubMed Статья PubMed Central Google Scholar
Simonyte Sjodin K, Vidman L, Ryden P, West CE. Новые данные о роли микробиоты кишечника в развитии аллергических заболеваний. Curr Opin Allergy Clin Immunol. 2016; 16 (4): 390–5.
PubMed Статья CAS PubMed Central Google Scholar
Fujimura KE, Sitarik AR, Havstad S, Lin DL, Levan S, Fadrosh D, et al. Микробиота кишечника новорожденных связана с мультисенсибилизированной атопией у детей и дифференцировкой Т-клеток.Nat Med. 2016; 22 (10): 1187–91.
CAS PubMed PubMed Central Статья Google Scholar
Исмаил И.Х., Бойл Р.Дж., Личчарди П.В., Оппедисано Ф., Лахтинен С., Робинс-Браун Р.М. и др. Ранняя колонизация кишечника Bifidobacterium breve и B. catenulatum по-разному модулирует риск экземы у детей с высоким риском развития аллергических заболеваний. Pediatr Allergy Immunol. 2016; 27 (8): 838–46.
PubMed Статья PubMed Central Google Scholar
Каллиомаки М., Салминен С., Пусса Т., Изолаури Э. Пробиотики в течение первых 7 лет жизни: совокупное снижение риска экземы в рандомизированном плацебо-контролируемом исследовании. J Allergy Clin Immunol. 2007. 119 (4): 1019–21.
PubMed Статья PubMed Central Google Scholar
Isolauri E, Arvola T, Sutas Y, Moilanen E, Salminen S. Пробиотики в лечении атопической экземы. Clin Exp Allergy. 2000. 30 (11): 1604–10.
CAS PubMed Статья PubMed Central Google Scholar
Копп М.В., Хеннемут I, Хайнцманн А., Урбанек Р. Рандомизированное двойное слепое плацебо-контролируемое испытание пробиотиков для первичной профилактики: отсутствие клинических эффектов при добавлении Lactobacillus GG. Педиатрия. 2008; 121 (4): e850–6.
PubMed Статья PubMed Central Google Scholar
Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al. Рекомендации Всемирной аллергологической организации и Университета Макмастера по профилактике аллергических заболеваний (GLAD-P): пробиотики. World Allergy Organ J. 2015; 8 (1): 4.
PubMed PubMed Central Статья Google Scholar
Фили Т., Планкетт С.Х., Бао Р.Й., Хонг SMC, Каллин Е., Бельда-Ферре П. и др. У здоровых младенцев есть кишечные бактерии, защищающие от пищевой аллергии.Nat Med. 2019; 25 (3): 448.
CAS PubMed PubMed Central Статья Google Scholar
Диас М., Гуадамуро Л., Эспиноза-Мартос И., Манкабелли Л., Хименес С., Молинос-Норниелла С. и др. Микробиота и производные параметры в образцах фекалий младенцев с аллергией на белок коровьего молока, отличной от IgE, при строгой диете. Питательные вещества. 2018; 10 (10).
PubMed Central Статья CAS PubMed Google Scholar
Reinhardt C, Reigstad CS, Backhed F. Кишечная микробиота в младенчестве и ее значение для ожирения. J Педиатр Гастроэнтерол Нутр. 2009. 48 (3): 249–56.
PubMed Статья Google Scholar
Колева П.Т., Бриджман С.Л., Козырский А.Л. Микробиом кишечника младенца: данные о риске ожирения и диетическом вмешательстве. Питательные вещества. 2015; 7 (4): 2237–60.
CAS PubMed PubMed Central Статья Google Scholar
Каллиомаки М., Колладо М.К., Салминен С., Изолаури Э. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am J Clin Nutr. 2008. 87 (3): 534–8.
CAS PubMed Статья Google Scholar
Scheepers LE, Penders J, Mbakwa CA, Thijs C., Mommers M, Arts IC. Состав кишечной микробиоты и развитие веса у детей: когортное исследование KOALA Birth Cohort Study. Int J Obes. 2015; 39 (1): 16–25.
CAS Статья Google Scholar
Kerr CA, Grice DM, Tran CD, Bauer DC, Li D, Hendry P, et al. События ранней жизни влияют на метаболическое здоровье в течение всей жизни через микрофлору кишечника и проницаемость кишечника. Crit Rev Microbiol. 2015; 41 (3): 326–40.
CAS PubMed Статья Google Scholar
Blustein J, Attina T., Liu M, Ryan AM, Cox LM, Blaser MJ, et al.Связь кесарева сечения с ожирением у детей в возрасте от 6 недель до 15 лет. Int J Obes. 2013. 37 (7): 900–6.
CAS Статья Google Scholar
Dogra S, Sakwinska O, Soh SE, Ngom-Bru C., Bruck WM, Berger B, et al. На динамику микробиоты кишечника младенца влияют способ родоразрешения и продолжительность беременности, и она связана с последующим ожирением. mBio. 2015; 6 (1).
Gohir W, Ratcliffe EM, Sloboda DM.Из ошибок, которые нас формируют: материнское ожирение, микробиом кишечника и долгосрочный риск заболеваний. Pediatr Res. 2015; 77 (1-2): 196-204.
PubMed Статья Google Scholar
Манко М. Микробиота кишечника и программирование развития мозга: от данных о поведенческих эндофенотипах до новых перспектив ожирения. Front Cell Infect Microbiol. 2012; 2: 109.
PubMed PubMed Central Статья Google Scholar
Луото Р., Каллиомаки М., Лайтинен К., Изолаури Э. Влияние перинатального пробиотического вмешательства на развитие избыточного веса и ожирения: последующее исследование от рождения до 10 лет. Int J Obes. 2010. 34 (10): 1531–7.
CAS Статья Google Scholar
Луото Р., Колладо М.К., Салминен С., Изолаури Э. Изменение микробиоты кишечника в раннем возрасте: функциональное влияние на риск ожирения? Энн Нутр Метаб. 2013; 63 (Дополнение 2): 17–26.
CAS PubMed Статья PubMed Central Google Scholar
Махана Д., Трент С.М., Курц З.Д., Бокулич Н.А., Батталья Т., Чанг Дж. И др. Нарушение антибиотиками микробиома кишечника мышей усиливает ожирение, инсулинорезистентность и заболевания печени, связанные с диетой с высоким содержанием жиров. Genome Med. 2016; 8 (1): 48.
PubMed PubMed Central Статья CAS Google Scholar
Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014. 158 (4): 705–21.
CAS PubMed PubMed Central Статья Google Scholar
Нобель Ю.Р., Кокс Л.М., Киригин Ф.Ф., Бокулич Н.А., Яманиши С., Тейтлер И. и др. Метаболические и метагеномные исходы импульсного лечения антибиотиками в раннем возрасте.Nat Commun. 2015; 6: 7486.
PubMed PubMed Central Статья Google Scholar
Cox LM, Blaser MJ. Антибиотики в молодости и ожирении. Nat Rev Endocrinol. 2015; 11 (3): 182–90.
PubMed Статья PubMed Central Google Scholar
Турта О., Раутава С. Антибиотики, ожирение и связь с микробами — что мы делаем с нашими детьми? BMC Med.2016; 14: 57.
PubMed PubMed Central Статья Google Scholar
Korpela K, de Vos WM. Использование антибиотиков в детстве изменяет микробиоту кишечника и предрасполагает к избыточному весу. Microb Cell. 2016; 3 (7): 296–8.
CAS PubMed PubMed Central Статья Google Scholar
Gulden E, Wong FS, Wen L. Микробиота кишечника и диабет 1 типа.Clin Immunol. 2015; 159 (2): 143–53.
CAS PubMed PubMed Central Статья Google Scholar
de Goffau MC, Fuentes S, van den Bogert B, Honkanen H, de Vos WM, Welling GW, et al. Аберрантный состав микробиоты кишечника в начале диабета 1 типа у детей раннего возраста. Диабетология. 2014; 57 (8): 1569–77.
PubMed Статья CAS Google Scholar
Костич А.Д., Геверс Д., Сильяндер Х., Ватанен Т., Хиотилайнен Т., Хамалайнен А.М. и др. Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Клеточный микроб-хозяин. 2015; 17 (2): 260–73.
CAS PubMed PubMed Central Статья Google Scholar
Ширбель А., Фиокки С. Нацеленность на врожденную иммунную систему при воспалительных заболеваниях кишечника у детей. Эксперт Рев Гастроэнтерол Гепатол.2011; 5 (1): 33–41.
CAS PubMed Статья Google Scholar
Ван Ф., Каплан Дж. Л., Голд Б. Д., Бхасин М. К., Уорд Н. Л., Келлермайер Р. и др. Выявление микробного дисбактериоза, связанного с детской болезнью Крона, несмотря на высокую изменчивость микробиоты кишечника. Cell Rep. 2016; 14 (4): 945–55.
CAS PubMed PubMed Central Статья Google Scholar
О’Махони С.М., Марчези Дж. Р., Скалли П., Кодлинг С., Сеолхо А. М., Куигли Е. М. и др. Стресс в раннем возрасте изменяет поведение, иммунитет и микробиоту у крыс: последствия для синдрома раздраженного кишечника и психических заболеваний. Биол Психиатрия. 2009. 65 (3): 263–7.
PubMed Статья Google Scholar
О’Махони С.М., Феличе В.Д., Налли К., Савиньяк Х.М., Клаессон М.Дж., Скалли П. и др. Нарушение микробиоты кишечника в молодом возрасте выборочно влияет на висцеральную боль во взрослом возрасте, не влияя на когнитивное или связанное с тревогой поведение у самцов крыс.Неврология. 2014; 277: 885–901.
CAS PubMed Статья Google Scholar
Кристоф К., Кочиш Е., Надь К. Клиническая микробиология раннего и позднего неонатального сепсиса, особенно среди недоношенных детей. Acta Microbiol Immunol Hung. 2009. 56 (1): 21–51.
PubMed Статья Google Scholar
Арболея С., Бинетти А., Салазар Н., Фернандес Н., Солис Дж., Эрнандес-Барранко А. и др.Становление и развитие кишечной микробиоты у недоношенных новорожденных. FEMS Microbiol Ecol. 2012. 79 (3): 763–72.
CAS PubMed Статья Google Scholar
Arboleya S, Sanchez B, Milani C, Duranti S, Solis G, Fernandez N, et al. Развитие кишечной микробиоты у недоношенных новорожденных и действие перинатальных антибиотиков. J Pediatr. 2015. 166 (3): 538–44.
CAS PubMed Статья Google Scholar
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.С., Смит Д.П., Нельсон А., Абдулкадир Б. и др. Временное бактериальное и метаболическое развитие кишечника недоношенных выявляет специфические признаки здоровья и болезни. Микробиом. 2016; 4 (1): 67.
PubMed PubMed Central Статья Google Scholar
Ward DV, Scholz M, Zolfo M, Taft DH, Schibler KR, Tett A, et al. Метагеномное секвенирование с разрешением на уровне штаммов указывает на уропатогенные E.coli при некротическом энтероколите и смертности недоношенных детей. Cell Rep. 2016; 14 (12): 2912–24.
CAS PubMed PubMed Central Статья Google Scholar
Leach ST, Lui K, Naing Z, Dowd SE, Mitchell HM, Day AS. Множественные условно-патогенные микроорганизмы, но не ранее существовавшие воспаления, могут быть связаны с некротическим энтероколитом. Dig Dis Sci. 2015; 60 (12): 3728–34.
PubMed Статья Google Scholar
Sim K, Shaw AG, Randell P, Cox MJ, McClure ZE, Li MS и др. Дисбактериоз, предвосхищающий некротический энтероколит у очень недоношенных детей. Clin Infect Dis. 2015; 60 (3): 389–97.
CAS PubMed Статья Google Scholar
Май В., Янг К.М., Уханова М., Ван Х, Сунь И., Каселла Г. и др. Микробиота кала у недоношенных детей до некротического энтероколита. PLoS One. 2011; 6 (6): e20647.
CAS PubMed PubMed Central Статья Google Scholar
Морроу А.Л., Лагомарчино А.Дж., Шиблер К.Р., Тафт Д.Х., Ю З., Ван Б. и др. Ранние микробные и метаболомные признаки предсказывают более позднее начало некротического энтероколита у недоношенных детей. Микробиом. 2013; 1 (1): 13.
PubMed PubMed Central Статья Google Scholar
Torrazza RM, Ukhanova M, Wang X, Sharma R, Hudak ML, Neu J, et al. Микробная экология кишечника и факторы окружающей среды, влияющие на некротический энтероколит.PLoS One. 2013; 8 (12): e83304.
PubMed PubMed Central Статья CAS Google Scholar
Warner BB, Deych E, Zhou Y, Hall-Moore C, Weinstock GM, Sodergren E, et al. Дисбактериоз кишечных бактерий и некротический энтероколит у младенцев с очень низкой массой тела при рождении: проспективное исследование случай-контроль. Ланцет. 2016; 387 (10031): 1928–36.
PubMed PubMed Central Статья Google Scholar
Стюарт С.Дж., Нельсон А., Треуман А., Скит Т., Каммингс С.П., Эмблтон Н.Д. и др. Метаболомический и протеомный анализ сыворотки крови недоношенных детей с некротизирующим энтерколитом и поздним сепсисом. Pediatr Res. 2016; 79 (3): 425–31.
CAS PubMed Статья Google Scholar
Collado MC, Cernada M, Neu J, Perez-Martinez G, Gormaz M, Vento M. Факторы, влияющие на иммунное взаимодействие желудочно-кишечного тракта и микробиоты у недоношенных детей.Pediatr Res. 2015; 77 (6): 726–31.
PubMed Статья Google Scholar
Cernada M, Bauerl C, Serna E, Collado MC, Martinez GP, Vento M. Сепсис у недоношенных детей вызывает изменения в экспрессии генов слизистой оболочки и профилях микробиоты по сравнению с близнецами без сепсиса. Научный доклад 2016; 6: 25497.
CAS PubMed PubMed Central Статья Google Scholar
Мадан Дж. К., Салари Р. К., Саксена Д., Дэвидсон Л., О’Тул Г. А., Мур Дж. Х. и др. Колонизация кишечных микробов у недоношенных новорожденных прогнозирует неонатальный сепсис. Arch Dis Child Fetal Neonatal Ed. 2012. 97 (6): F456–62.
PubMed PubMed Central Статья Google Scholar
Май В., Торрацца Р.М., Уханова М., Ван Х, Сунь Й., Ли Н. и др. Нарушения в развитии кишечной микробиоты, связанные с поздним началом сепсиса у недоношенных детей.PLoS One. 2013; 8 (1): e52876.
CAS PubMed PubMed Central Статья Google Scholar
Arrieta MC, Stiemsma LT, Amenyogbe N, Brown EM, Finlay B. Кишечный микробиом в раннем возрасте: здоровье и болезни. Фронт Иммунол. 2014; 5: 427.
PubMed PubMed Central Статья CAS Google Scholar
Roger LC, Costabile A, Holland DT, Hoyles L, McCartney AL.Исследование фекальных популяций Bifidobacterium у младенцев, вскармливаемых грудью и искусственными смесями, в течение первых 18 месяцев жизни. Микробиология. 2010. 156 (Pt 11): 3329–41.
CAS PubMed Статья Google Scholar
Bergstrom A, Skov TH, Bahl MI, Roager HM, Christensen LB, Ejlerskov KT, et al. Установление кишечной микробиоты в раннем возрасте: продольное исследовательское исследование большой когорты датских младенцев. Appl Environ Microbiol.2014. 80 (9): 2889–900.
CAS PubMed PubMed Central Статья Google Scholar
Валлес Ю., Артачо А., Паскуаль-Гарсия А., Феррус М.Л., Госальбес М.Дж., Абеллан Дж.Дж. и др. Последовательность микробов в кишечнике: направленные тенденции таксономических и функциональных изменений в когорте новорожденных испанских младенцев. PLoS Genet. 2014; 10 (6): e1004406.
PubMed PubMed Central Статья CAS Google Scholar
Тиссье. Recherchers sur la естественная кишечная флора и патология нуриссон. [Диссертация]: Парижский университет; 1900.
Turroni F, Duranti S, Bottacini F, Guglielmetti S, Van Sinderen D, Ventura M. Bifidobacterium bifidum как пример специализированного комменсала кишечника человека. Front Microbiol. 2014; 5: 437.
PubMed PubMed Central Статья Google Scholar
Milani C, Turroni F, Duranti S, Lugli GA, Mancabelli L, Ferrario C и др.Геномика рода Bifidobacterium выявляет видоспецифичную адаптацию к богатой гликаном кишечной среде. Appl Environ Microbiol. 2016; 82 (4): 980–91.
CAS PubMed PubMed Central Статья Google Scholar
Duranti S, Lugli GA, Mancabelli L, Armanini F, Turroni F, James K, et al. Материнское наследование сообществ бифидобактерий и бифидофагов у младенцев путем вертикальной передачи. Микробиом.2017; 5 (1): 66.
PubMed PubMed Central Статья Google Scholar
Ventura M, Canchaya C, Tauch A, Chandra G, Fitzgerald GF, Chater KF, et al. Геномика актинобактерий: прослеживание эволюционной истории древнего типа. Microbiol Mol Biol Rev.2007; 71 (3): 495–548.
CAS PubMed PubMed Central Статья Google Scholar
Milani C, Mangifesta M, Mancabelli L, Lugli GA, James K, Duranti S, et al. Представляем биогеографию бифидобактерий ветви древа жизни млекопитающих. ISME J. 2017; 11 (12): 2834–47.
PubMed PubMed Central Статья Google Scholar
Duranti S, Lugli GA, Milani C, James K, Mancabelli L., Turroni F, et al. Bifidobacterium bifidum и микробиота кишечника младенца: интригующий случай совместной эволюции микроба и хозяина.Environ Microbiol. 2019; 21: 3683–95.
CAS PubMed Статья PubMed Central Google Scholar
Milani C, Hevia A, Foroni E, Duranti S, Turroni F, Lugli GA и др. Оценка фекальной микробиоты: оптимизированный протокол анализа генов 16S рРНК с ионным потоком. PLoS One. 2013; 8 (7): e68739.
CAS PubMed PubMed Central Статья Google Scholar
Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, Wagendorp AA, Klijn N, Bindels JG, et al. Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Педиатр Гастроэнтерол Нутр. 2000. 30 (1): 61–7.
CAS PubMed Статья PubMed Central Google Scholar
Мюллер С., Сонье К., Ханиш С., Норин Е., Алм Л., Мидтведт Т. и др. Различия в фекальной микробиоте в разных европейских исследуемых популяциях в зависимости от возраста, пола и страны: кросс-секционное исследование.Appl Environ Microbiol. 2006. 72 (2): 1027–33.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Foroni E, Pizzetti P, Giubellini V, Ribbera A, Merusi P, et al. Изучение разнообразия популяции бифидобактерий в кишечном тракте человека. Appl Environ Microbiol. 2009. 75 (6): 1534–45.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Marchesi JR, Foroni E, Gueimonde M, Shanahan F, Margolles A и др. Микробиомный анализ популяции бифидобактерий в дистальном отделе кишечника человека. ISME J. 2009; 3 (6): 745–51.
CAS PubMed Статья Google Scholar
Tissier H. Recherchers sur la естественная кишечная флора и патология нуриссон. Париж: Парижский университет; 1900.
Google Scholar
Milani C, Mancabelli L, Lugli GA, Duranti S, Turroni F, Ferrario C и др. Изучение вертикальной передачи бифидобактерий от матери к ребенку. Appl Environ Microbiol. 2015; 81: 7078–87.
CAS PubMed PubMed Central Статья Google Scholar
Duranti S, Gaiani F, Mancabelli L, Milani C, Grandi A, Bolchi A, et al. Выяснение микробиома кишечника при язвенном колите: бифидобактерии как новые микробные биомаркеры.FEMS Microbiol Ecol. 2016; 92 (12).
PubMed Статья CAS PubMed Central Google Scholar
Иган М., О’Коннелл Мазервэй М., Килкойн М., Кейн М., Джоши Л., Вентура М. и др. Перекрестное питание Bifidobacterium breve UCC2003 во время совместного культивирования с Bifidobacterium bifidum PRL2010 в среде на основе муцина. BMC Microbiol. 2014; 14 (1): 282.
PubMed PubMed Central Статья CAS Google Scholar
Иган М., О’Коннелл Мазервэй М., Вентура М., ван Синдерен Д. Метаболизм сиаловой кислоты с помощью Bifidobacterium breve UCC2003. Appl Environ Microbiol. 2014. 80 (14): 4414–26.
PubMed PubMed Central Статья CAS Google Scholar
Ferrario C, Duranti S, Milani C, Mancabelli L, Lugli GA, Turroni F и др. Изучение аминокислотной ауксотрофии в Bifidobacterium bifidum PRL2010. Front Microbiol. 2015; 6: 1331.
PubMed PubMed Central Статья Google Scholar
Turroni F, Serafini F, Foroni E, Duranti S, O’Connell Motherway M, Taverniti V и др. Роль сортазозависимых пилей Bifidobacterium bifidum PRL2010 в модулировании взаимодействий бактерия-хозяин. Proc Natl Acad Sci U S. A. 2013; 110 (27): 11151–6.
CAS PubMed PubMed Central Статья Google Scholar
Serafini F, Strati F, Ruas-Madiedo P, Turroni F, Foroni E, Duranti S, et al. Оценка адгезионных свойств и антибактериальной активности комменсального кишечника младенца Bifidobacterium bifidum PRL2010.Анаэроб. 2013; 21: 9–17.
CAS PubMed Статья PubMed Central Google Scholar
Serafini F, Turroni F, Ruas-Madiedo P, Lugli GA, Milani C, Duranti S, et al. Кефирное молоко и кефиран способствуют росту Bifidobacterium bifidum PRL2010 и модулируют экспрессию его генов. Int J Food Microbiol. 2014; 178: 50–9.
CAS PubMed Статья PubMed Central Google Scholar
Turroni F, Taverniti V, Ruas-Madiedo P, Duranti S, Guglielmetti S, Lugli GA и др. Bifidobacterium bifidum PRL2010 модулирует врожденный иммунный ответ хозяина. Appl Environ Microbiol. 2014; 80 (2): 730–40.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Foroni E, Montanini B, Viappiani A, Strati F, Duranti S и др. Глобальное профилирование транскрипции генома Bifidobacterium bifidum PRL2010 в условиях in vitro и идентификация эталонных генов для количественной ПЦР в реальном времени.Appl Environ Microbiol. 2011. 77 (24): 8578–87.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Strati F, Foroni E, Serafini F, Duranti S, van Sinderen D, et al. Анализ предсказанных систем транспорта углеводов, кодируемых Bifidobacterium bifidum PRL2010. Appl Environ Microbiol. 2012. 78 (14): 5002–12.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Serafini F, Mangifesta M, Arioli S, Mora D, van Sinderen D, et al. Экспрессия зависящих от сортировки пилей Bifidobacterium bifidum PRL2010 в ответ на условия окружающей среды в кишечнике. FEMS Microbiol Lett. 2014; 357 (1): 23–33.
CAS PubMed Статья PubMed Central Google Scholar
Zanotti I, Turroni F, Piemontese A, Mancabelli L, Milani C, Viappiani A, et al. Доказательства активности Bifidobacterium bifidum PRL2010 по снижению холестерина посредством модуляции микробиоты кишечника.Appl Microbiol Biotechnol. 2015; 99 (16): 6813–29.
CAS PubMed Статья Google Scholar
Turroni F, Ozcan E, Milani C, Mancabelli L, Viappiani A, van Sinderen D, et al. Активность перекрестного питания гликанов между бифидобактериями в условиях in vitro. Front Microbiol. 2015; 6: 1030.
PubMed PubMed Central Статья Google Scholar
Turroni F, Milani C, Duranti S, Mancabelli L, Mangifesta M, Viappiani A и др. Расшифровка метаболических взаимодействий, опосредованных бифидобактериями, и их влияния на микробиоту кишечника с помощью многопрофильного подхода. Исме Дж. 2016; 10: 1656–68.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Milani C, van Sinderen D, Ventura M. Генетические стратегии метаболизма муцина в Bifidobacterium bifidum PRL2010: пример возможной коэволюции человека и микроба.Кишечные микробы. 2011; 2 (3): 183–9.
PubMed Статья Google Scholar
Turroni F, Bottacini F, Foroni E, Mulder I., Kim JH, Zomer A, et al. Геномный анализ Bifidobacterium bifidum PRL2010 выявляет метаболические пути для добычи гликанов хозяином. Proc Natl Acad Sci U S. A. 2010; 107 (45): 19514–9.
CAS PubMed PubMed Central Статья Google Scholar
Colagiorgi A, Turroni F, Mancabelli L, Serafini F, Secchi A, van Sinderen D, et al. Понимание биосинтеза тейхоевой кислоты Bifidobacterium bifidum PRL2010. FEMS Microbiol Lett. 2015; 362 (17): fnv141.
PubMed Статья CAS PubMed Central Google Scholar
Манчино В., Дуранти С., Манкабелли Л., Лонги Г., Анзалоне Р., Милани С. и др. Передача бифидобактерий от матери к ребенку при исследовании модели на животных.Микроорганизмы. 2019; 7 (9).
PubMed Central Статья Google Scholar
Хупер Л.В., Сюй Дж., Фальк П.Г., Мидтведт Т., Гордон Дж. Молекулярный датчик, который позволяет кишечному комменсалу контролировать свою питательную основу в конкурентной экосистеме. Proc Natl Acad Sci U S. A. 1999; 96 (17): 9833–8.
CAS PubMed PubMed Central Статья Google Scholar
Caballero-Franco C, Keller K, De Simone C, Chadee K. Пробиотическая формула VSL # 3 индуцирует экспрессию и секрецию гена муцина в эпителиальных клетках толстой кишки. Am J Physiol Gastrointest Liver Physiol. 2007; 292 (1): G315–22.
CAS PubMed Статья PubMed Central Google Scholar
Руас-Мадиедо П., Геймонд М., Фернандес-Гарсия М., де лос Рейес-Гавилан К.Г., Марголлес А. Разложение муцина штаммами Bifidobacterium, выделенными из кишечной микробиоты человека.Appl Environ Microbiol. 2008. 74 (6): 1936–40.
CAS PubMed PubMed Central Статья Google Scholar
Lombard V, Golaconda Ramulu H, Drula E, Coutinho PM, Henrissat B. База данных по углеводно-активным ферментам (CAZy) в 2013 г. Nucleic Acids Res. 2014; 42 (выпуск базы данных): D490–5.
CAS PubMed Статья PubMed Central Google Scholar
Ventura M, Turroni F, Motherway MO, MacSharry J, van Sinderen D. Взаимодействия между хозяином и микробом, которые способствуют колонизации кишечника комменсальными бифидобактериями. Trends Microbiol. 2012. 20 (10): 467–76.
CAS PubMed Статья PubMed Central Google Scholar
Lopez P, Gonzalez-Rodriguez I, Gueimonde M, Margolles A, Suarez A. Иммунный ответ на штаммы Bifidobacterium bifidum поддерживает пластичность Treg / Th27. PLoS One.2011; 6 (9): e24776.
CAS PubMed PubMed Central Статья Google Scholar
Caffarelli C, Cardinale F, Povesi-Dascola C, Dodi I, Mastrorilli V, Ricci G. Использование пробиотиков при детских инфекционных заболеваниях. Expert Rev Anti-Infect Ther. 2015; 13 (12): 1517–35.
CAS PubMed Статья PubMed Central Google Scholar
Как соблюдать диету при дисбактериозе для лечения нездорового кишечника
Что такое дисбактериоз? Дисбиоз — это когда вредные бактерии одолели ваши полезные бактерии, что может вызвать вздутие живота, депрессию, IBS и, в конечном итоге, даже рак.
Дисбактериоз может возникать на вашей коже — это верно, у вас есть хорошие бактерии, живущие на вашей коже — во рту, во влагалище, прямой кишке или в кишечнике. Давайте пока сосредоточимся на дисбактериозе кишечника.
Вы можете исправить дисбактериоз с помощью диеты, которую мы приводим ниже. Ваш врач может также порекомендовать добавки или лекарства, которые помогут вылечить дисбактериоз кишечника.
Дисбиоз: определение и общие симптомы
Дисбиоз относится к бактериальному (иногда грибковому) дисбалансу в вашем теле или внутри него, например, в кишечной флоре.
Этот дисбаланс в составе микробиоты кишечника может привести к различным симптомам и осложнениям.
По оценкам, человеческое тело содержит в десять раз больше бактерий, чем человеческих клеток! Эти бактерии необходимы для пищеварения, иммунной функции, профилактики заболеваний и восстановления тканей, а также для многих других функций
Но если эти кишечные микробы повреждены или выброшены из строя, вредные бактерии или дрожжи начинают колонизировать. Это может вызвать хроническое воспаление, депрессию или даже дисфункцию иммунной системы.
Сколько времени нужно, чтобы вылечить дисбактериоз кишечника? Прежде чем дисбактериоз кишечника вылечится, необходимо как минимум пару недель изменить здоровую диету. У некоторых через две недели и — мгновение — они заживают. В других случаях могут потребоваться месяцы диетической коррекции, добавок и / или лекарств, чтобы навсегда обратить вспять дисбактериоз кишечника.
Может ли дисбактериоз вызвать потерю веса? Нет, дисбактериоз обычно вызывает прибавку в весе . Дисбиоз нарушает ваш метаболизм и пищеварение, и то и другое может привести к увеличению веса.
Каковы общие симптомы дисбактериоза?
- Вздутие живота
- Расстройство желудка
- Бессонница
- Усталость
- Беспокойство
- Депрессия
- Увеличение массы тела
- Неприятный запах изо рта
- Сыпь
- Расстройство желудка
- Тошнота
- Запор
- Диарея
- Затрудненное мочеиспускание
- Ректальное или вагинальное кровотечение
- Нарушение обмена веществ
- Воспаление
- Аутоиммунное заболевание
Продукты для лечения дисбактериоза
Существует несколько диет, которые могут исправить проблемы с кишечником, в том числе диета с низким содержанием FODMAP и диета с микробиомом.Типичные западные диеты основаны на сахаре и обработанных пищевых продуктах, что может привести к расстройствам желудочно-кишечного тракта, таким как дисбактериоз. Присоединяйтесь к нашей 6-недельной элиминационной диете онлайн, чтобы найти диету, которая хорошо работает для вашего тела.
Какой бы ни была диета, ваш врач-терапевт позаботится о том, чтобы она вернула вашему кишечнику форму.
Продукты питания с низким содержанием FODMAP
FODMAP означает ферментируемые олигосахариды, дисахариды, моносахариды и полиолы . Эти короткоцепочечные жирные кислоты и сахарные спирты могут привести к дисбактериозу.
Диета с низким содержанием FODMAP — распространенное лечение СРК. Это неудивительно, поскольку удаление FODMAP из рациона снижает ферментацию и газообразование в кишечнике.
- Все непереработанное мясо, особенно рыба
- Яйца
- Фрукты с низким содержанием фруктозы (лимоны, лаймы, клубника, виноград, ананас)
- Помидоры
- Картофель
- Перец
- Морковь
- Зеленая фасоль
- Зеленая капуста
- Бамия
- Кале
- имбирь
- Чай зеленый
- Миндальное молоко
- Вода
Пребиотики и пробиотики
Мы должны быть осторожны с диетическими пробиотиками и пребиотиками.Поскольку они содержат полезные бактерии (пробиотики) или являются предшественниками роста полезных бактерий (пребиотики), они, как правило, представляют собой ферментируемые углеводы (FODMAP).
Но пробиотики (такие как Bifidobacterium и Lactobacillus ) и пребиотики, как известно, улучшают здоровье кишечника и восстанавливают баланс полезных бактерий.
Вот пробиотики и пребиотики, которые вы можете добавить в свой рацион, не нарушая дисбактериоз кишечника:
- Козий йогурт или кокосовый йогурт (без коровьего молока)
- Мягкие сыры (не рикотта)
- Темпе
- Мисо (только органическое)
- Овес
- Семена льна
- Незрелые бананы или подорожники
- Водоросли
- Какао-порошок
- Инулин (FODMAP, поэтому употребляйте с осторожностью)
- Кефир (FODMAP, поэтому употребляйте с осторожностью)
- Комбуча (FODMAP, поэтому употребляйте с осторожностью)
Продукты, которых следует избегать при дисбактериозе
Давайте разделим продукты, чтобы избегать их, так же, как продукты, которые нужно есть.
Избегайте обработанных пищевых продуктов, ферментируемых углеводов и сахаров. В приведенном ниже списке будет указано, каких продуктов следует избегать.
FODMAP
- Пшеница
- Большинство молочных продуктов
- Репчатый лук
- Чеснок
- Фрукты с высоким содержанием фруктозы (особенно яблоки)
- Артишок
- Спаржа
- Цветная капуста
- Лимская фасоль
- Печеные бобы
- Чай улун, чай с фенхелем, чай с ромашкой
Обработанные продукты
- Приготовление пищи в микроволновке
- Мясные деликатесы
- Колбаса
- Бекон
- Мороженое
- Картофельные чипсы
- Картофель фри
- Сухие завтраки
- Масло канолы
Продукты с высоким содержанием сахара
- Сладкие напитки
- Конфеты
- Многие приправы (например, кетчуп)
- Нектар агавы
- Сухофрукты
- Арахисовое масло
- Заправки для салатов
6 добавок от дисбактериоза для улучшения питания
У следующих пищевых добавок есть несколько преимуществ для здоровья, но восстановление кишечных бактерий и лечение дисбактериоза кишечника — общая тема, подтвержденная исследованиями.
- Пробиотики
- Пребиотики
- Мультивитаминный комплекс B
- Кальций
- Магний
- имбирь
Перед приемом новой пищевой добавки обязательно проконсультируйтесь с врачом.
Как ваш врач диагностирует дисбактериоз кишечника
Диагностика дисбактериоза не займет много времени. Ваш врач расскажет вам об истории болезни и любых симптомах дисбактериоза, которые у вас проявились.
Ваш врач также спросит, относится ли к вам какой-либо из факторов риска дисбактериоза кишечника.Пропустите два раздела, чтобы узнать больше о факторах риска.
Функциональный врач, вероятно, также спросит о вашей семейной истории болезни. История вашей семьи многое говорит вам о том, чего ожидать от собственной жизни и как к этому подготовиться.
Вот четыре распространенных теста на дисбактериоз:
- Анализ мочи (измерение органических кислот)
- Водородный дыхательный тест (тесты на SIBO)
- Комплексный анализ пищеварительного стула
- Тест кишечной проницаемости
В отличие от обычных врачей, ваш функциональный врач сделает упор на вашей диете как на лечении дисбактериоза кишечника .К сожалению, большинство обычных врачей почти не обучаются питанию, а это означает, что они не всегда осведомлены о том, как использовать пищу в качестве лекарства для лечения дисбактериоза кишечника.
Лекарства и другие методы лечения для восстановления баланса кишечника
Обычные врачи полагаются на фармацевтические препараты для лечения болезней.
Хотя PrimeHealth является практикой функциональной медицины, мы не сбрасываем со счетов эффективность некоторых лекарств. Мы просто не полагаемся на это, поскольку изменения в диете и образе жизни помогают избавиться от искусственных химикатов и побочных эффектов.
Вот некоторые антибиотики, которые врач может назначить вам при дисбактериозе кишечника:
- Рифаксимин
- Неомицин
- Метронидазол или тинидазол
- Дифлюкан
- Нистатин
Действительно, эти антибиотики лечат симптомы дисбактериоза, возможно, убивая при этом полезные бактерии. Но в крайних случаях необходимо соблюдать баланс.
Пересадка фекальной микробиоты (FMT) — еще одно возможное лечение дисбактериоза кишечника.Звучит мерзко, не правда ли? Но исследования показывают, что FMT может предотвратить дисбактериоз пищеварительного тракта.
FMT сейчас является экспериментальным лечением, и вокруг него возникли некоторые противоречия. Однако похоже, что это лечение может получить более широкое распространение, поскольку положительные результаты будут видны в клинических испытаниях на людях.
Факторы риска дисбактериоза кишечника
Кто подвержен риску дисбактериоза кишечника? Основными факторами риска являются:
- Чрезмерный бактериальный рост в тонком кишечнике (SIBO), когда чрезмерное количество бактерий колонизируется в тонком кишечнике
- Чрезмерное употребление антибиотиков, которое убивает хорошие бактерии с помощью плохих
- Новое лекарство
- Новая диета, например повышенное потребление сахара или полуфабрикатов
- Употребление более одного алкогольного напитка в день
- Плохая гигиена полости рта
Осложнения дисбактериоза кишечника
Исследования показывают, что дисбактериоз кишечника связан с удивительным количеством заболеваний.Следующие нарушения являются осложнениями дисбактериоза кишечника , если их не лечить .
Взгляд в будущее
Дисбактериоз кишечника поддается лечению. Диета при дисбактериозе должна навсегда исправить ваши проблемы с кишечником, если вы будете придерживаться этих диетических изменений.
Мы в PrimeHealth верим, что наш функциональный подход заключается в том, чтобы навсегда вылечить дисбактериоз. Наш функциональный подход сотворил чудеса с сотнями пациентов , которые не нашли успеха у обычных врачей.
Чтобы заказать бесплатную телефонную консультацию, пожалуйста, нажмите здесь .
— Медицинское освидетельствование Сойона Рафатья, доктор медицины. 26 мая 2020 года
Источники
- Кроули, Дж., Болл, Л., и Хиддинк, Дж. Дж. (2019). Питание в медицинском образовании: систематический обзор. The Lancet Planetary Health , 3 (9), e379-e389. Полный текст.
- Чонг, П.П., Чин, В. К., Луи, К. Ю., Вонг, В. Ф., Мадхаван, П., и Йонг, В. К. (2019). Микробиом и синдром раздраженного кишечника — Обзор патофизиологии, текущих исследований и будущей терапии. Frontiers in microbiology , 10 , 1136. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6579922/
- Magge, S., & Lembo, A. (2012). Диета с низким содержанием FODMAP для лечения синдрома раздраженного кишечника. Гастроэнтерология и гепатология , 8 (11), 739.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3966170/
- Альтобелли, Э., Дель Негро, В., Анджелетти, П. М., и Лателла, Г. (2017). Диета с низким содержанием FODMAP улучшает симптомы синдрома раздраженного кишечника: метаанализ. Nutrients , 9 (9), 940. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5622700/
- Wosinska, L., Cotter, P. D., O’Sullivan, O., & Guinane, C. (2019). Возможное влияние пробиотиков на микробиом кишечника спортсменов. Питательные вещества , 11 (10), 2270.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6835687/
- Шарма В., Родионов Д. А., Лейн, С. А., Тран, Д., Яблоков, С. Н., Динг, Х.,… и Петерсон, С. Н. (2019). Совместное использование витамина B способствует стабильности микробных сообществ кишечника. Frontiers in microbiology , 10 , 1485. Полный текст: https://www.frontiersin.org/articles/10.3389/fmicb.2019.01485/full
- Чаплин А., Парра П., Лараичи С., Серра Ф. и Палоу А. (2016). Добавка кальция регулирует микробиоту кишечника пребиотическим образом у мышей с ожирением, которые питаются ожирением. Молекулярное питание и исследования пищевых продуктов , 60 (2), 468-480. Аннотация: https://www.ncbi.nlm.nih.gov/pubmed/26582185
- Кроули, Э. К., Лонг-Смит, К. М., Мерфи, А., Паттерсон, Э., Мерфи, К., О’Горман, Д. М.,… и Нолан, Ю. М. (2018). Пищевые добавки со смесью морских минералов, богатой магнием, увеличивают разнообразие желудочно-кишечной микробиоты. Морские препараты , 16 (6), 216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024889/
- Кумар Сингх, А., Кабрал, К., Кумар, Р., Гангули, Р., Кумар Рана, Х., Гупта, А.,… и Пандей, А. К. (2019). Благоприятное влияние пищевых полифенолов на микробиоту кишечника и стратегии повышения эффективности доставки. Nutrients , 11 (9), 2216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6770155/
- Нью-Йорк-Среднеатлантический консорциум генетических служб и служб скрининга новорожденных. (2009). Понимание генетики: руководство для пациентов и медицинских работников в Нью-Йорке, Срединно-Атлантический океан .Лулу. com. Полный текст: https://www.ncbi.nlm.nih.gov/books/NBK115560/
- Шмидт, Э. К., Торрес-Эспин, А., Рапозо, П. Дж., Мадсен, К. Л., Кигерл, К. А., Попович, П. Г.,… и Фуад, К. (2020). Пересадка фекалий предотвращает дисбактериоз кишечника и тревожное поведение после травмы спинного мозга у крыс. Plos one , 15 (1), e0226128. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6961833/
- Келли, К. Р., Ихунна, К., Фишер, М., Хоруц, А., Суравич, К., Афзали, А.,… и Гордон, С. (2014). Трансплантация фекальной микробиоты для лечения инфекции Clostridium difficile у пациентов с ослабленным иммунитетом. Американский журнал гастроэнтерологии, 109 (7), 1065. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5537742/
- Уилкинс, Л. Дж., Монга, М., и Миллер, А. В. (2019). Определение дисбактериоза для группы хронических заболеваний. Научные отчеты , 9 (1), 1-10. Полный текст: https://www.nature.com/articles/s41598-019-49452-y
- Мутлу, Э., Кешаварзян, А., Энген, П., Форсайт, К. Б., Сикаруди, М., и Жиллевет, П. (2009). Дисбактериоз кишечника: возможный механизм алкогольной эндотоксемии и алкогольного стеатогепатита у крыс. Алкоголизм: клинические и экспериментальные исследования , 33 (10), 1836-1846. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3684271/
- Шиппа, С., и Конте, М. П. (2014). Дисбиотические явления в микробиоте кишечника: влияние на здоровье человека. Питательные вещества , 6 (12), 5786-5805.Аннотация: https://www.ncbi.nlm.nih.gov/pubmed/25514560/ Загрузить PDF: https://scholar.google.com/scholar_url?url=https://www.mdpi.com/2072-6643 / 6/12/5786 / pdf & hl = en & sa = T & oi = gsb-gga & ct = res & cd = 0 & d = 63227848841533 & ei = M9CqXu-AAoGzmAGyv6DwCw & scisig = AAGBfm3t_fLhRGDhp
- Чан, Ю. К., Эстаки, М., и Гибсон, Д. Л. (2013). Клинические последствия дисбактериоза, вызванного диетой. Annals of Nutrition and Metabolism , 63 (Suppl.2), 28-40. Полный текст: https://www.karger.com/Article/Fulltext/354902
- Шефлин А. М., Уитни А. К. и Вейр Т. Л. (2014). Раковые эффекты микробного дисбактериоза. Текущие онкологические отчеты , 16 (10), 406. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4180221/
Микробиом кишечника младенцев и пробиотики, которые работают
Осенью 2018 года группа исследователей из Института науки Вейцмана в Израиле опубликовала результаты, согласно которым коктейль из 11 штаммов Lactobacillus и Bifidobacterium оказал минимальное немедленное воздействие и не оказывает длительного воздействия на состав кишечного микробиома мышей или людей.Фактически, пробиотические бактерии не были обнаружены ни у одного из четырнадцати взрослых участников после прекращения приема добавок.
Эти недавние открытия получили довольно много внимания в прессе и усилили мнение общественности о том, что пробиотики — живые микроорганизмы, которые, как предполагается, приносят пользу человеческому хозяину, — не работают. Десятилетия исследований показали, что большинство пробиотиков не способно колонизировать кишечник человека и не оказывать длительного воздействия на него. Некоторые критики даже предположили, что пробиотики не могут быть многообещающим средством лечения болезней или иного улучшения здоровья и благополучия.Но мы подумали: «Не выбрасывайте ребенка вместе с водой из ванны — наша работа показывает, что правильный пробиотик может работать в кишечнике младенца». Результаты, опубликованные нами в 2017 году, показали, что кормление грудных детей пробиотиком, который включал в себя определенный штамм Bifidobacterium longum подвид infantis ( B. infantis EVC001), приводило к среднему увеличению уровня фекалий B. infantis в 10 000 000 раз. . Этот уровень сохранялся в течение одного месяца после приема добавки и оставался повышенным в течение одного года после лечения.
Чтобы понять, почему микробиом кишечника младенца так сильно изменился за последнее столетие, мы попытались понять, как формируется микробиом кишечника младенца.
Колонизация кишечника младенца B. infantis имела защитные эффекты, такие как снижение уровней потенциальных кишечных патогенов и фекального эндотоксина, компонента внешней мембраны грамотрицательных организмов, вызывающих воспаление. Мы также обнаружили, что у младенцев, получавших пробиотик B. infantis , наблюдалось уменьшение воспаления кишечника по сравнению с младенцами на грудном вскармливании, которые не получали пробиотик.Микробиомы кишечника B. infantis младенцев содержат меньше генов устойчивости к антибиотикам — признак меньшего количества патогенов — и показали меньшую деградацию муцина, гликопротеина, секретируемого кишечным эпителием, который защищает эпителиальные клетки от прямого контакта с кишечными микробами. Эти данные подтверждают более ранние выводы Марка Андервуда и его коллег из Калифорнийского университета в Дэвисе. В 2013 году команда Андервуда показала, что при кормлении недоношенных детей другой штамм, B.Infantis ATCC15697, привело к большему увеличению фекальных Bifidobacterium и снижению уровней потенциальных патогенов по сравнению с младенцами, получавшими пробиотик, содержащий B. lactis . B .Infantis . Вопрос был в том, почему.
Происхождение микробиома
Подсказки о микробиоме младенцев можно найти в статьях столетней давности о комменсальных бактериях в детских фекалиях. У. Р. Логан, клинический патолог из исследовательской лаборатории Королевского колледжа врачей в Эдинбурге, был первым, кто 100 лет назад сообщил, что бактерии в фекальных мазках младенцев, находящихся на грудном вскармливании, представляют собой почти монокультуру Bacillus bifidus , которая является сегодня известный как род Bifidobacterium .Напротив, в мазках кала младенцев, вскармливаемых смесями того времени, было обнаружено разнообразие бактерий, в том числе относительно небольшое количество Bifidobacterium , что больше похоже на микробное разнообразие, обнаруженное у младенцев, вскармливаемых грудью сегодня.
Эти поразительные изменения в составе микробиома кишечника, наблюдавшиеся за последнее столетие, согласуются с нашим недавним открытием, что pH фекалий у младенцев, вскармливаемых грудью, резко увеличился с pH 5,0 до 6,5 за последние 100 лет, что связано с очевидной потерей из поколения в поколение Bifidobacterium и сопутствующее увеличение числа потенциальных патогенов.Снижение уровня Bifidobacterium в микробиоме кишечника младенцев, находящихся на грудном вскармливании, вероятно, является непреднамеренным последствием медицинской практики, которая может спасти жизни, но не поддерживает рост Bifidobacterium . Такая медицинская практика включает лечение антибиотиками, к которым чувствительны Bifidobacterium ; детская смесь, не содержащая того питания, которое требуется бактериям; и большее количество родов путем кесарева сечения, которые обходят путь передачи бактерии от матери к ребенку.Эти медицинские практики связаны с повышенным риском аллергических и аутоиммунных заболеваний, распространенных в странах, богатых природными ресурсами. Предполагается, что снижение уровня Bifidobacterium и увеличение количества провоспалительных микробов в раннем младенчестве происходит во время критического периода развития иммунной системы и, таким образом, может повышать риск иммунных заболеваний в более позднем возрасте.
Чтобы понять, почему микробиом кишечника младенца так сильно изменился за последнее столетие, мы попытались понять, как формируется это сообщество.Колонизация кишечного микробиома младенца начинается при родах с контакта с материнскими микробами — в основном вагинальными и фекальными микробами у младенцев, рожденных естественным путем, или преимущественно микробами из кожи, рта и окружающей среды у младенцев, рожденных путем кесарева сечения. После рождения младенцы подвергаются бомбардировке огромным количеством микробов, встречающихся в окружающей среде, в том числе в грудном молоке, но виды, которые становятся прочными членами микробного сообщества, часто передаются матерями младенцев через физический контакт.
Дети продолжают приобретать виды кишечного микробиома от своих матерей и других членов общества в раннем возрасте. Это контрастирует с микробиомом кишечника взрослого человека, который стабилен и сопротивляется изменениям в значительной степени потому, что доступное пространство и пища уже используются установленными микробами — экологические ниши просто заняты в кишечнике взрослого человека. Таким образом, логично, что пробиотик имеет больше шансов сохраниться в кишечнике младенца, где он сталкивается с меньшей конкуренцией, и, следовательно, с большей вероятностью будет иметь пищу, которую он может потреблять, и место, где он может расти.Пробиотик служит для младенца еще одним источником контакта с новыми бактериями.
Осознавая это, мы начали задаваться вопросом: в наших исследованиях, какую экологическую нишу занял B. infantis , которая способствовала его сохранению у младенцев еще долгое время после прекращения приема пробиотиков?
Изменяющийся микробиом младенцаИсторически микробиом кишечника грудного ребенка был почти монокультурой Bifidobacterium ( J Pathol Bacteriol , 18: 527–51, 1913).Микробиом кишечника младенцев на искусственном вскармливании был гораздо более разнообразным. Микробиом кишечника детей, вскармливаемых грудью, и микробиом кишечника детей, вскармливаемых искусственными смесями, теперь более похожи на исторический микробиом кишечника детей, вскармливаемых молочными смесями, хотя современные дети, находящиеся на грудном вскармливании, имеют больше Bifidobacterium , чем современные дети, вскармливаемые молочными смесями. |
Подготовка к работе
Основным фактором, определяющим, какие бактерии процветают в кишечнике, является доступность их углеводных источников пищи.Таким образом, чтобы пробиотик работал у младенца, микроорганизмы должны быть выбраны таким образом, чтобы источник пищи, который они использовали, наиболее эффективно соответствовал доступному — пища, которая присутствует и еще не потребляется другими бактериями. Мы решили определить, какие углеводы B. infantis потребляет в кишечнике младенца.
Естественно, мы обратились к грудному молоку, которое на протяжении миллионов лет было единственным продуктом питания, способным исключительно питать и защищать младенцев в течение первых шести месяцев жизни.Грудное молоко содержит питательные вещества, а также непитательные биоактивные молекулы, включая углеводы, известные как олигосахариды грудного молока (HMOs). Еще в середине 1900-х годов Пауль Дьёрдь, всемирно известный биохимик, диетолог и педиатр из больницы Пенсильванского университета, и его коллеги по незнанию ссылались на больничные кассы, когда они предполагали существование «бифидного фактора», чего-то уникального в мире. грудное молоко, которым кормили Bifidobacterium . Хотя люди не могут переваривать ОПЗ, оказывается, что Bifidobacterium , особенно B.Infantis , кан. В 2007 году наша группа в Калифорнийском университете в Дэвисе использовала инструменты на основе масс-спектрометрии в сочетании с микробиологией, чтобы показать, что B. infantis поглощает HMO в качестве единственного источника энергии, в то время как другие виды Bifidobacterium потребляют только некоторые HMO в дополнение к растениям. , углеводы животного и хозяйского происхождения.
HMOs представляют собой разнообразный класс сложных углеводных молекул, синтезируемых молочной железой. Имея примерно 200 различных молекулярных видов, они представляют собой третий по распространенности твердый компонент в грудном молоке после лактозы и жира.Поскольку ОПЗ сложны и различаются по структуре, их производство дорого. Современные смеси для младенцев могут содержать одну или две простые структуры HMO, но в меньшей концентрации, чем в грудном молоке. Детским смесям не хватает изобилия и сложности ОПЗ для выборочного кормления полезных кишечных микробов, а также для связывания и нейтрализации патогенных микроорганизмов из кишечника.
Вид бактерий в кишечнике младенца, способный потреблять HMO, можно рассматривать как ориентированный на молоко микробиом (MOM).Хотя B. infantis , по-видимому, является наиболее эффективным потребителем ОПЗ, другие виды Bifidobacterium , в частности B. breve и B. bifidum , могут потреблять и потребляют некоторые ОПЗ, но также потребляют растительные, углеводы животного и хозяйского происхождения. Виды Bifidobacterium , которые колонизируют кишечник, изменяются на протяжении всей жизни в ответ на доступные углеводы в рационе хозяина. Например, B. infantis , B. breve и B.bifidum — это бифидобактерии MOM, которые обычно обнаруживаются в стуле детей, находящихся на исключительно грудном вскармливании, тогда как B. longum и B. adolescentis , которые преимущественно потребляют углеводы растительного и животного происхождения, обычно обнаруживаются в стуле взрослых. Тем не менее, существуют различия и совпадения между видами, присутствующими на разных этапах жизни.
Основным фактором, определяющим, какие бактерии процветают в кишечнике, является доступность их углеводного источника пищи.
Из бифидобактерий MOM, обнаруженных в микробиоме кишечника младенца, разные виды могут иметь разное значение для микробиома.Например, когда мы давали младенцам исключительно грудного вскармливания добавку с пробиотиком B. infantis EVC001, в их кишечнике преобладали представители рода Bifidobacterium — относительная численность кишечного микробиома составляла более 80 процентов, а количество потенциальных патогенов составляло менее 10 процентов сообщества. С другой стороны, микробиомы кишечника младенцев, вскармливаемых исключительно грудью, которым не вводили B. infantis EVC001, имели гораздо более низкие уровни Bifidobacterium , с относительной численностью лишь около 30 процентов, а потенциальные патогены составляли около 40 процентов микробов. в их интуиции, результаты, которые согласуются с предыдущей работой нашей группы и других.Эта почти монокультура Bifidobacterium , по-видимому, управлялась B. infantis , что составляло около 90 процентов от общего количества Bifidobacterium у младенцев, получавших пробиотик. Напротив, B. longum был преобладающим кишечным Bifidobacterium в контрольной группе, за которым следовали B. brev e и B. bifidum . Эти данные подчеркивают жизненно важное значение штаммовой специфичности пробиотиков и сочетание присутствия B.Infantis и грудное вскармливание для поддержания защитной среды кишечника у младенцев.
Чтобы понять, как дополнительный корм B. infantis может так успешно превосходить другие микробы в кишечнике младенца, мы глубоко погрузились в его стратегию кормления. Оказывается, он разборчив в еде, питается исключительно в ОПЗ, а когда ОПЗ в изобилии, B. infantis жадно их пожирает. В отличие от других бифидобактерий MOM, B. infantis обладает всеми генами, необходимыми для полной внутренней деградации HMO, и предпочтительно использует HMO по сравнению с любым другим источником углеводов.Другие бифидобактерии MOM, такие как штаммы B. bifidum и B. breve , обладают способностью к росту только с подмножеством ОПЗ. B. infantis , таким образом, имеет конкурентное преимущество, когда грудное молоко составляет весь рацион.
Исследование 2008 года, проведенное коллегами из Калифорнийского университета в Дэвисе и их соавторами, показало, как B. infantis быстро использует HMO: со связывающими белками для захвата HMO из просвета кишечника и переносчиками, которые направляют их в цитоплазму, расщепляя их на моносахариды. которые затем ферментируются в лактат и ацетат короткоцепочечных жирных кислот, которые секретируются из клетки.Эти конечные продукты поддерживают более низкий pH в кишечной среде, поддерживая транспорт этих соединений в эпителий кишечника для использования хозяином и создавая нежелательную среду для потенциальных патогенов. Производство ацетата также блокирует проникновение токсичных молекул, продуцируемых патогенными бактериями, за счет усиления барьерной функции кишечника и ингибирования провоспалительных и апоптотических реакций. Недавние результаты одного исследования in vitro показали, что количество ацетата и лактата, продуцируемого различными видами бифидобактерий, зависит от того, насколько хорошо они потребляют доступные им углеводы.Следовательно, если кормить потребляющим углеводы микробом его предпочтительным углеводом, у него будет больше возможностей производить больше своих защитных конечных продуктов.
Другая причина, по которой B. infantis превосходит другие штаммы бифидобактерий в кишечнике младенцев, вскармливаемых грудью, заключается в том, что все переваривание HMO происходит внутри бактериальной клетки. B. bifidum , с другой стороны, переваривает ОПЗ извне. Это внеклеточное пищеварение высвобождает простые углеводы и может обеспечивать перекрестное питание других видов Bifidobacterium , но также и перекрестное питание и, таким образом, открывает экологическую нишу для других, возможно, менее полезных микробов.Перекрестное кормление микробами разнообразит микробиом кишечника, который считается полезным для взрослых.
Но есть ли преимущество в почти монокультуре Bifidobacterium у младенцев? Задав этот вопрос, мы сосредоточились на развитии иммунной системы.
Молоко-ориентированный микробиомОлигосахариды грудного молока (HMOs) представляют собой сложные углеводы, которые микробные виды молочно-ориентированного микробиома (MOM) могут использовать в качестве источника пищи. Bifidobacterium infantis кодирует многие белки, которые специфически связывают и транспортируют все типы HMO в ее клетку и переваривают их внутри. Другие виды Bifidobacterium переваривают только некоторые ОПЗ, а некоторые делают это извне. Переваривание HMO с помощью MOM Bifidobacterium приводит к выработке лактата и ацетата короткоцепочечных жирных кислот, которые секретируются в просвет кишечника. Эти молекулы снижают pH в кишечной среде, что улучшает их транспорт в эпителий для использования хозяином и создает нежелательную среду для потенциальных патогенов, таких как E.coli . © laurie o’keefe | |
© laurie o’keefe | B. infantis преимущественно потребляет все виды ОПЗ, а не другие источники углеводов.
|
© laurie o’keefe | B. bifidum питается только частью ОПЗ.
|
Преимущества
BifidobacteriumСнижение уровня Bifidobacterium в микробиомах кишечника младенцев и связанное с этим нарушение регуляции микробного сообщества с более многочисленными потенциальными патогенами было предложено как один из возможных факторов увеличения частоты аутоиммунных заболеваний, которые чума жителей богатых ресурсами стран.И наоборот, обсервационные исследования показали положительные иммунные эффекты наличия в фекальном микробиоме доминирования Bifidobacterium . В двух исследованиях с участием младенцев и детей раннего возраста из Бангладеш, численность фекальных бактерий B. infantis и Bifidobacterium в возрасте двух месяцев сильно коррелировала с улучшенными ответами на вакцины в возрасте шести месяцев и двух лет по сравнению с младенцами, не колонизированными B. или с низкой относительной численностью Bifidobacterium .
Кроме того, бифидобактерии с меньшей вероятностью, чем другие микробы, особенно потенциальные патогены, несут и разделяют гены устойчивости к противомикробным препаратам, что может привести к более высокому риску устойчивых к антибиотикам инфекций. В обсервационном исследовании младенцев из Бангладеш и Швеции преобладание кишечной Bifidobacterium было связано со значительным сокращением как количества, так и распространенности генов устойчивости к антибиотикам. Более того, по сравнению с младенцами из контрольной группы, вскармливаемых грудью, добавка B.Infantis EVC001 привело к снижению генов устойчивости к антибиотикам на 90 процентов, что в значительной степени обусловлено снижением уровней Escherichia , Clostridium и Staphylococcus — потенциально патогенных бактерий, которые играют важную роль в эволюции и распространение генов устойчивости к антибиотикам.
В попытке восстановить микробиом кишечника младенцев с преобладанием Bifidobacterium , который был типичным для младенцев, вскармливаемых грудью 100 лет назад, мы решили провести рандомизированное контролируемое исследование с использованием B.Infantis EVC001 пробиотик. Учитывая, что не все штаммы B. infantis эффективно потребляют все ОПЗ, мы выбрали B. infantis EVC001, потому что мы знали, что этот штамм имеет полную кассету генов, необходимую для полного переваривания всех ОПЗ. Здоровые доношенные дети, находящиеся на грудном вскармливании, были рандомизированы для употребления B. infantis EVC001 в течение 21 дня подряд, начиная с 7-го дня после рождения, или для отказа от пробиотика.
ПРОБИОТИК, КОТОРЫЙ УДАР: полученные с помощью сканирующего электронного микроскопа микрофотографии образцов кала младенцев показывают значительное увеличение количества микробов Bifidobacterium у тех, кто лечился пробиотиком под названием EVC001 (справа) по сравнению с контрольной группой (слева).
По сравнению с контрольными младенцами, находившимися на грудном вскармливании, которые не получали пробиотик, добавка привела к увеличению в 10 000 000 раз в среднем уровней фекальных B. infantis и к увеличению фекальных Bifidobacterium на 79 процентов в течение периода приема добавок, и это все еще сохранялось. верно через месяц после приема добавок. Это означает, что колонизация Bifidobacterium продолжалась без продолжения приема пробиотиков. Кроме того, колонизация B.infantis сохранялся до одного года, если младенцы продолжали потреблять грудное молоко и не подвергались воздействию антибиотиков. Важно отметить, что у младенцев, получавших добавки, наблюдалось 80-процентное снижение потенциальных кишечных патогенов, принадлежащих к семействам Enterobacteriaceae и Clostridiaceae , а также снижение содержания эндотоксина в фекалиях. Кроме того, мы наблюдали 2-кратное увеличение содержания лактата и ацетата в кале и 10-кратное снижение pH кала. Микробиомы и биохимия кишечника младенцев с добавками напоминают нормы, соблюдаемые столетие назад.
Мы также нашли некоторые подсказки о последствиях «модернизации» микробиома кишечника. Младенцы, находящиеся на грудном вскармливании с низким содержанием Bifidobacterium в фекалиях, выделяли со стулом в 10 раз больше ОПЗ в течение двухмесячного периода исследования, чем младенцы, получавшие добавку B. infantis EVC001, что указывает на то, что ОПЗ — третий по содержанию компонент в грудном молоке — были будет тратить впустую. Мы также обнаружили, что у младенцев с низким содержанием фекальных Bifidobacterium уровень провоспалительных цитокинов
в фекалиях был в несколько раз выше, чем у младенцев, в кишечных микробиомах которых преобладали Bifidobacterium после приема B.Infantis EVC001.
Взятые вместе, эти данные демонстрируют, что этот конкретный штамм B. infanti s, предоставляемый в качестве пробиотика младенцам, находящимся на грудном вскармливании, резко колонизировал микробиом кишечника младенца во время и после приема добавок и благотворно реконструировал микробную, биохимическую и иммунологическую среду. в кишечнике младенца. Многие младенцы во всем мире никогда не получают B. infantis , но сочетание грудного вскармливания и приема пробиотиков с этой бактерией, по-видимому, приводит к питательной и защитной среде кишечника.
Многие младенцы во всем мире никогда не получают B. infantis , но сочетание кормления грудью и приема пробиотиков с этой бактерией, по-видимому, приводит к созданию питательной и защитной среды кишечника.
Наши результаты также подтверждают гипотезу о том, что неэффективность некоторых пробиотиков у взрослых отчасти связана с тем, что они вводят новый вид в устоявшееся сообщество с небольшим количеством открытых экологических ниш. Пробиотики могут не работать у младенцев, если существует несоответствие между потребностью в пробиотиках в углеводах и наличием высокоспецифичных углеводов, таких как HMO, в грудном молоке.Поскольку B. infantis эффективно потребляет почти все ОПЗ, обнаруженные в грудном молоке, он, вероятно, найдет открытую экологическую нишу и затем побьет другие микробы, особенно провоспалительные патогены.
Многие ученые работают над тем, чтобы понять, что на самом деле означает микробиом кишечника младенцев для здоровья на протяжении всей жизни. Между тем, мы обращаем наше внимание на другие вопросы: Чем отличаются модели колонизации Bifidobacterium в младенческих популяциях во всем мире от младенчества до отъема от груди? И какие твердые продукты поддерживают здоровье кишечника и иммунной системы? Работая при финансовой поддержке Национального института здоровья, мы в настоящее время проводим исследование, призванное понять, как углеводные структуры прикорма влияют на микробную функцию, которая будет поддерживать здоровый микробиом кишечника и развитие иммунной системы в позднем младенчестве и раннем детстве.Конечная цель — определить конкретные углеводные структуры в рационе, которые выборочно питают полезные кишечные микробы у детей в критический период иммунного развития для здоровья на протяжении всей жизни.
Дженнифер Смиловиц — заместитель директора Программы исследований человека в Институте пищевых продуктов для здоровья и научный сотрудник Департамента пищевых наук и технологий Калифорнийского университета в Дэвисе. Диана Хазард Тафт — научный сотрудник лаборатории Дэвида Миллса в Департаменте пищевых наук и технологий и член Института продуктов питания для здоровья в Калифорнийском университете в Дэвисе.
Дисбактериоз кишечника — Педиатрия | Nutricia
По материалам Peterson and Round, 2014. 1
Что вызывает дисбактериоз кишечной микробиоты у младенцев?
Ранняя жизнь — критическое время для развития микробиома кишечника, поэтому кишечник младенца особенно уязвим для дисбактериоза. Есть несколько факторов, которые влияют на состав кишечного микробиома у младенцев, в том числе: 1,4-6
- Срок беременности
- Материнское окружение
- Способ родоразрешения (вагинальное или кесарево)
- Питание (грудное или искусственное вскармливание)
- Использование антибиотиков
- Диета
- Загрязнение воздуха
- Генетика
Генетические факторы и изменения факторов окружающей среды могут изменить состав микробиома кишечника, что приведет к дисбактериозу. 1
Какая связь между дисбактериозом кишечной микробиоты и аллергией?
Сообщалось о дисбиозе кишечной микробиоты у младенцев с аллергическими состояниями, такими как аллергия на белок коровьего молока (CMPA). У здоровых младенцев, находящихся на грудном вскармливании, в кишечнике обычно преобладает группа полезных бактерий, известных как бифидобактерии. Эти бактерии сначала передаются от матери во время родов и с грудным молоком. 7–9
У младенцев с аллергическими заболеваниями факторы окружающей среды могут влиять на состав микробиоты кишечника.Младенцы с АБКМ часто имеют более низкие уровни бифидобактерий в микробиоте кишечника по сравнению со здоровыми младенцами, находящимися на грудном вскармливании. 9 В настоящее время считается, что дисбактериоз кишечника потенциально может привести к развитию аллергии и другим последствиям для здоровья в более позднем возрасте. 1
Может ли дисбактериоз кишечной микробиоты повлиять на развитие иммунной системы?
Ранний период жизни — критический период как для развития иммунной системы, так и для кишечной микробиоты.Иммунная система быстро развивается в течение первых 1000 дней жизни, и хорошо известно, что между иммунной системой и микробиотой кишечника возникает перекрестное взаимодействие.
Таким образом, дисбиоз кишечной микробиоты может повлиять на развитие иммунной системы, что может привести к аллергии, такой как CMPA, и другим последствиям для здоровья, таким как астма, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 4,15–17
Может ли дисбактериоз кишечной микробиоты приводить к аллергическим заболеваниям, таким как аллергия на белок коровьего молока, у младенцев?
Считается, что дисбиоз кишечной микробиоты играет определенную роль в развитии пищевой аллергии, такой как аллергия на белок коровьего молока (АБКМ) в раннем возрасте.Несколько исследований показали, что дисбактериоз кишечника у младенцев может задерживать развитие оральной толерантности — процесса, при котором подавляется иммунный ответ на пищевой белок.
Нарушение пероральной толерантности может привести к развитию пищевой аллергии. 16 Дисбактериоз кишечника в раннем возрасте также был связан с развитием ряда заболеваний, включая астму, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 17
Можем ли мы вернуть баланс к здоровой микробиоте кишечника?
Грудное молоко содержит как пребиотики природного происхождения, такие как олигосахариды грудного молока (HMO), так и полезные бактерии (пробиотики).Оба эти элемента помогают поддерживать здоровую микробиоту кишечника и поддерживать развитие иммунной системы. 16,17
Если грудное вскармливание невозможно, добавление уникальной комбинации пребиотиков и пробиотиков, известных как синбиотики, к детской смеси, восстанавливает баланс кишечного микробиома и способствует пероральной переносимости, потенциально снижая риск аллергических заболеваний. 20,23,24
Почему стоит рассмотреть уникальную смесь синбиотиков при аллергии на белок коровьего молока?
Растущее количество клинических данных свидетельствует о том, что уникальная смесь синбиотиков может иметь положительный эффект у младенцев с риском пищевой аллергии или живущих с ней, таких как АБКМ. 12,23,24 Признавая потенциальные преимущества пре- и пробиотиков, Группа рекомендаций Всемирной организации по аллергии предлагает рассмотреть вопрос о добавлении пре- и пробиотиков для младенцев с риском аллергии, если они не находятся на исключительно грудном вскармливании. 21,22
В настоящее время большинство содержащих пробиотики детских смесей включают виды Bifidobacterium и / или молочнокислые бактерии, такие как Lactobacillus views, 25 , которые в целом считаются безопасными и разрешенными в пищевых продуктах для использования в соответствии с Правилами Австралии и Новой Зеландии по пищевым стандартам.
В последнее десятилетие различные пребиотические смеси галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) были изучены на предмет их положительного воздействия на младенцев с риском пищевой аллергии или живущих с ней. Клинические исследования пребиотических смесей для младенцев, состоящих из короткоцепочечной (sc) GOS и длинноцепочечной (lc) FOS, scGOS / lcFOS в соотношении 9: 1, напоминающих олигосахаридные компоненты грудного молока как по количеству, так и по разнообразию, показали преимущества, связанные с регулированием микробиоты кишечника и иммунной системы, снижением частоты инфекций и размягчением стула. 25
Отобранные продукты Nutricia для лечения аллергии на белок коровьего молока содержат уникальную запатентованную смесь синбиотиков пребиотиков (включая scGOS / lcFOS (9: 1)) и пробиотиков (Bifidobacterium breve M16V), вдохновленных компонентами грудного молока.
Роль микробиома в истоках развития здоровья и болезней
Abstract
Несмотря на то, что видная роль микробиома в здоровье человека была установлена, в настоящее время признается, что микробиом в раннем возрасте оказывает большое влияние на долгосрочное развитие. здоровье и развитие человека.Вариации в составе и функциональном потенциале микробиома в молодом возрасте являются результатом факторов образа жизни, таких как способ родов, грудное вскармливание, диета и использование антибиотиков. Кроме того, вариации в составе микробиома в раннем возрасте связаны с конкретными исходами болезней, такими как астма, ожирение и нарушения развития нервной системы. Это указывает на этот бактериальный консорциум как на посредника между факторами раннего образа жизни и здоровьем и болезнями. Кроме того, вариации микробной внутриматочной среды могут предрасполагать новорожденных к определенным последствиям для здоровья в более позднем возрасте.В этом коллективном исследовании подтверждается роль микробиома в причинах развития здоровья и болезней. Подчеркивая критическое окно восприимчивости в раннем возрасте, связанное с развитием микробиома, мы обсуждаем микробную колонизацию младенцев, начиная с обмена микробами от матери к плоду внутриутробно и вплоть до влияния грудного вскармливания в первый год жизни. Кроме того, мы рассматриваем имеющиеся данные по конкретным заболеваниям, указывающие на то, что микробиом является механистическим посредником в развитии происхождения здоровья и болезни.
За последнее десятилетие микробиом стал одним из основных факторов, влияющих на здоровье человека. 1 В текущих исследованиях было высказано предположение, что микробиом в раннем возрасте является решающим фактором для правильного иммунного развития и долгосрочного здоровья. 2 , 3 Преходящий микробный дисбиоз в этот период времени был связан с развитием иммуноопосредованных, метаболических нарушений и нарушений развития нервной системы. 4 — 7 Кроме того, все больше данных используется в поддержку жизненно важной роли материнского и внутриутробного микробиома в здоровье и развитии детей. 8 В совокупности эти результаты были использованы для поддержки микробиома как ключевого участника исследования «Истоки развития здоровья и болезней» (DOHaD). В этом обзоре мы обсудим текущие исследования, касающиеся созревания микробиома на ранних этапах жизни, и то, как временные изменения в этом бактериальном консорциуме могут иметь долгосрочные последствия для здоровья человека.
ДОХАД: где подходит микробиом?
Гипотеза о происхождении развития предполагает вариации в программировании плода и младенца из-за воздействия окружающей среды во время критического окна ранней жизни. 9 Первоначально названная гипотезой Баркера, 10 , 11 , в которой основное внимание уделялось связи между недоеданием плода и гипертонией в более позднем возрасте, эта теория с тех пор расширилась, чтобы учесть многие типы воздействий в раннем возрасте. и исходы родов, связанные с долгосрочным здоровьем и развитием. Например, высокая масса тела при рождении связана с увеличением риска рака груди и толстой кишки, 12 , 13 , и основной механизм этой связи может быть связан с внутриутробным воздействием высоких уровней гормонов роста. 9
Инфекции раннего возраста и воздействие микробов изначально не были связаны с DOHaD, но были предложены в качестве значительного влияния окружающей среды на развитие иммунной системы младенцев в гигиенической гипотезе аллергического заболевания. 14 С развитием исследований микробиома человека было предложено современное расширение гипотезы гигиены, известное как гипотеза микрофлоры. 15 Согласно гипотезе микрофлоры, воздействие окружающей среды в раннем возрасте изменяет развитие микробиома человека. 15 Считается, что изменения в составе микробиома смещают созревание иммунной системы в сторону гиперчувствительного и / или гипервоспалительного состояния. 15 Например, врожденная и адаптивная ветви иммунной системы активно участвуют в стимулировании воспалительного ответа. Однако воздействие микробов обычно вызывает реакцию, опосредованную Т-хелпером 1, которая подавляет активность Т-хелпера 2, часто связанную с иммуноопосредованными реакциями и реакциями гиперчувствительности. 3 Обсуждение механизмов, регулирующих взаимодействие между иммунной системой и микробиотой, выходит за рамки настоящего обзора; пожалуйста, см. Тамбурини и др. 3 для недавнего подробного обсуждения этой темы.
Аналогично DOHaD, критическое окно развития на раннем этапе жизни также было предложено для микробиома. Преходящий микробный дисбиоз (нездоровое микробное состояние) в течение этого периода времени был связан с долгосрочными проблемами иммунного и метаболического здоровья, 2 заслуживает своего исследования в области происхождения развития (рис. 1).
РИСУНОК 1Микробиом младенца наиболее уязвим к воздействиям окружающей среды в раннем возрасте. Передача микробов от матери к плоду, способ рождения, антибиотики и диета могут изменить колонизацию и созревание микробиома в раннем возрасте. Эти вызванные образом жизни изменения в составе и функциях микробиома могут иметь продолжительное влияние на здоровье человека и могут привести к развитию заболеваний в более позднем возрасте.
Раннее развитие микробиома
Микробиота человека представляет собой сложный организм, состоящий из 10–100 триллионов микробных клеток (бактерий, архей и микробных эукариот) и вирусов. 16 , 17 Чтобы подчеркнуть впечатляющий функциональный потенциал микробиоты, геномный каталог этого суперорганизма, микробиома, состоит из примерно 3,3 миллиона неизбыточных генов. 16 Хотя термины «микробиота» и «микробиом» описывают микробный состав и геномный каталог, соответственно, в этой области исследований они используются взаимозаменяемо. Следующие разделы посвящены описанию первоначальной колонизации и становления бактериальной микробиоты человека в младенчестве, от зачатия до первого года жизни.
Перенос микробов от матери к плоду
До недавнего времени внутриутробная среда считалась стерильной. 18 Однако с тех пор непатогенные бактерии были обнаружены с помощью молекулярных методов в околоплодных водах и плаценте здоровых младенцев, 19 , 20 , что предполагает обмен микробами от матери к плоду. Кроме того, путем сравнения микробиоты околоплодных вод, плаценты и мекония, Колладо и др. 21 сообщают, что микробиота мекония младенцев, рожденных с помощью кесарева сечения, на ~ 55% разделяет свои бактериальные таксоны с микробиотами плаценты и околоплодных вод.Пренатальный материнский микробиом также может модулировать иммунную систему младенца. Например, сообщалось, что колонизация кишечной палочки Escherichia coli HA107 только во время беременности изменяет врожденную иммунную систему слизистой оболочки кишечника и транскриптом потомства. 22
У людей изменения в составе микробиома плаценты были связаны с материнской беременностью (стресс и гестационный диабет) и исходами здоровья новорожденных (масса тела при рождении, преждевременные роды). 7 , 23 — 25 Также сообщалось, что микробиом плаценты недоношенных младенцев различается по составу в зависимости от гестационной прибавки в весе, 26 предполагает, что этот бактериальный консорциум может опосредовать развитие плода в зависимости от состояние здоровья матери.
Выделение бактерий из плаценты часто связано с патофизиологическим состоянием, угрожающим здоровью матери и ребенка. Из-за отсутствия культурального анализа микробиома плаценты существуют некоторые разногласия по поводу его достоверности. 27 Кроме того, во многих молекулярных исследованиях, характеризующих внутриутробный микробиом, отсутствуют соответствующие меры контроля для устранения фонового загрязнения. 28
Также возможно, что плацента не содержит каких-либо жизнеспособных бактерий, а скорее состоит из фагоцитированных побочных продуктов микробов или компонентов клеточной стенки. 8 , 22 , 29 Отсутствие жизнеспособных бактерий не отменяет способности микробиома плаценты модулировать развитие плода, поскольку взаимодействия с молекулярными патогенами, связанными с патогенами, могут по-прежнему регулировать дифференцировку и пролиферацию клеток. 8 , 22 , 29 Кроме того, после реализации строгих стратегий валидации метагеномных анализов плаценты микробиом плаценты может использоваться как биомаркер здоровья и болезни матери и плода. Было проведено несколько исследований для изучения функции микробиома плаценты, 23 , 25 , подчеркивая возможность будущих исследований в этой области. Анализ микробных метаболитов и применение метатранскриптомических подходов для характеристики функциональной способности микробиома плаценты будут ключевыми в определении его роли в DOHaD.
Вагинальные роды: первый шаг в послеродовой микробной колонизации
Послеродовая бактериальная колонизация младенца начинается во время рождения, когда новорожденные подвергаются воздействию фекальных и вагинальных микробиот матери. 30 В течение 24 часов после родов микробиоты на различных участках тела (ротовая полость, кожа, меконий и т. Д.) Новорожденных после кесарева сечения первоначально заселяются бактериями, находящимися на коже матери (например, Staphylococcus spp.), Тогда как вагинально родившиеся младенцы заселены типичными вагинальными бактериями (например, Prevotella , Atopobium spp.). 30 В недавнем исследовании Чу и др. 31 предположили, что это открытие может быть специфическим для микробиома кишечника новорожденных. В их исследовании 81 диады матери и младенца микробиомы других участков тела (ноздри, кожа и т. Д.) Младенцев, рожденных естественным путем, выявили бимодальный образец материнского происхождения, заселенный как влагалищными, так и кожными бактериями матери, а не одним или одним из них. другой. 31 Однако в обоих исследованиях предполагается, что микробиоты младенцев однородно распределены по участкам тела (например, меконию, коже, ноздрям и т. Д.) Сразу после рождения. 30
Профилирование микробиома кишечника новорожденных сразу после рождения и в возрасте до 2 лет позволяет предположить, что способ родов может привести к длительному микробному дисбиозу кишечника новорожденных. 32 В исследовании с участием 43 диад матери и младенца младенцы, рожденные посредством кесарева сечения, демонстрировали повышенное филогенетическое разнообразие сразу после рождения. 32 Однако после 1 месяца филогенетическое разнообразие младенцев, рожденных с помощью кесарева сечения, снизилось по сравнению с младенцами, родившимися естественным путем. 32 Чу и др. 31 слегка оспаривают этот вывод. В их недавнем исследовании способ рождения был связан с вариациями микробиома ноздрей, кожи и ротовой полости сразу после рождения, но не с вариациями микробиома младенческого мекония. Исследователи обоих исследований подтверждают влияние способа рождения на колонизацию новорожденных в целом; однако необходимы дополнительные исследования, чтобы определить влияние этого фактора ранней жизни на микробиомы определенных участков тела.
Из-за преимуществ для здоровья, связанных с вагинальными родами, 33 Dominguez-bello et al. 34 провели первое исследование, направленное на повторное заселение младенцев, рожденных с помощью кесарева сечения, вагинальными бактериями. Авторы сообщают о частичном восстановлении микробиоты новорожденных, рожденных посредством кесарева сечения, по сравнению с микробиотой новорожденных, рожденных естественным путем. 34 Однако долгосрочные последствия для здоровья и состав микробиома младенца еще не известны. 34 Будущий анализ новорожденных, рожденных после кесарева сечения, подвергшихся воздействию вагинального микробиома, будет чрезвычайно ценным для определения преимуществ бактерий, полученных из влагалища, для долгосрочного здоровья человека. Кроме того, проведение проспективных исследований на людях и животных моделей с попытками аналогичной колонизации вагинальными бактериями среди потомства, рожденного посредством кесарева сечения, будет иметь решающее значение для выяснения роли вагинальных микробов в развитии заболевания.
Грудное вскармливание способствует созреванию микробиоты в раннем возрасте
По мере роста новорожденного гомогенный микробиом, населяющий его или ее тело, расходится в специфические для микробов ниши. 18 , 31 Созревание всего микробиома младенца изучается в течение первого года жизни, но после этого времени большинство исследователей сосредотачиваются именно на микробиоме кишечника. Микробиом кишечника человека, в значительной степени обусловленный грудным вскармливанием и питанием младенцев, продолжает созревать до тех пор, пока ребенок не достигнет возраста 2–3 лет, после чего его состав стабилизируется. 35
Грудное вскармливание создает семена микробиома кишечника младенца через контакт с материнскими ареолярными микробами и микробами грудного молока и обеспечивает ключевые источники энергии для многих бактерий (олигосахариды грудного молока). 36 — 39 В исследовании 107 диад матери и младенца младенцы, находившиеся на грудном вскармливании в течение первых 30-40 дней жизни, получали в среднем ~ 28% бактерий из грудного молока и ~ 10% — из грудного молока. материнская ареолярная кожа. 38 Авторы также сообщают о дозозависимой связи между составом микробиома кишечника младенца и долей ежедневного грудного вскармливания. 38
Существует четкое различие в составе между детьми, находящимися на грудном вскармливании и на искусственном вскармливании, при этом в младенцах, находящихся на грудном вскармливании, больше Bifidobacteria и Lactobacillus spp.а среди младенцев, вскармливаемых смесью, больше преобладают клостридиалы и протеобактерии. 32 , 40 Кроме того, у детей, вскармливаемых смесями, наблюдается снижение разнообразия и бактериального богатства даже после первого года жизни (в возрасте 12–24 месяцев). 32 В исследовании 30 недоношенных детей сообщалось также, что влияние грудного вскармливания (по сравнению с кормлением смесью) маскирует влияние массы тела при рождении на микробиом младенца, подчеркивая, что грудное вскармливание является потенциально защитным (по крайней мере, в отношении микробиома младенца). ) против традиционного фактора риска DOHaD. 41 Эпидемиологические данные подтверждают полезную роль грудного вскармливания в укреплении здоровья младенцев. Кормление смесью было связано с повышенным риском различных гипервоспалительных и иммуноопосредованных заболеваний. 42 , 43 Кроме того, исследователи недавнего эпидемиологического исследования сообщили, что грудное вскармливание защищает от хрипов в течение первого года жизни младенцев, рожденных от матерей с астмой. 43 В рамках работы, обсуждаемой в этом разделе, мы предполагаем, что микробиом может быть посредником между этими ассоциациями.
Связанная с беременностью диета матери формирует развивающийся микробиом младенца
Последние данные были использованы для подтверждения значительной роли материнской диеты, связанной с беременностью, в формировании микробиома грудного ребенка. Сообщалось, что рацион матери с высоким содержанием жиров во время беременности и кормления грудью вызывает дисбактериоз в микробиоме потомства японских макак. 44 Эти вызванные материнской диетой микробные вариации сохранялись у молодых макак. 44 Кроме того, контрольная диета с низким содержанием жиров после отъема не смогла исправить дисбактериоз, вызванный материнской диетой с высоким содержанием жиров. 44 В проспективной когорте из 26 диад матери и младенца, гестационная диета матери с высоким содержанием жиров была связана с отчетливыми вариациями микробного состава кишечника новорожденных (меконий), которые сохранялись до 4–6-недельного возраста. 45 В модели на мышах рацион матери с высоким содержанием клетчатки был связан с повышенным продуцированием короткоцепочечных жирных кислот (SCFA) у потомства. 46 Подчеркивая иммуномодулирующую способность микробиома материнской диеты во время беременности, у этих детенышей также были обнаружены более высокие частоты Т-регуляторных клеток тимуса. 46 Наконец, демонстрируя влияние материнского рациона на функциональную способность микробиома младенца, поросята, рожденные от свиноматок, которых кормили западной диетой (высокоэнергетическая, высокожировая, основанная на фруктозе диета) во время беременности, показали снижение продукции SCFA . 47 В этих исследованиях подтверждается важность микробиома как медиатора, связывающего рацион матери, связанный с беременностью, со здоровьем ребенка, что подтверждает роль микробиома в DOHaD. Будущие исследования могут пролить больше света на длительное воздействие на здоровье и развитие материнской диеты, связанной с беременностью.
Антибиотики изменяют колонизацию младенца и уменьшают созревание микробиоты
Возможно, неудивительно, что пре- и постнатальное воздействие антибиотиков является основным экологическим фактором стресса для микробиома младенца в раннем возрасте. Сообщалось, что пренатальное воздействие антибиотиков на мать изменяет разнообразие как микробиоты новорожденных 48 — 50 , так и микробиоты матери 51 . Также сообщалось, что воздействие антибиотиков во время родов изменяет состав микробиома полости рта младенца. 52 В частности, бактериальные семейства streptococcaceae и gemellaceae и порядок лактобацилл были уменьшены, тогда как бактериальные семейства в типе протеобактерий были обогащены среди младенцев, матери которых получали антибиотики во время родов. 52 Кроме того, среди младенцев, матери которых получали антибиотики, состав микробиома полости рта младенцев дополнительно дифференцировался в зависимости от того, получала ли мать коктейль антибиотиков по сравнению с тем, если бы она получала только 1 антибиотик. 52
Постнатальные курсы антибиотиков, проводимые младенцам в первые 3–9 месяцев жизни, приводили к изменению численности определенных кишечных бактериальных таксонов (а именно, Ruminococcus и клостридиалов). 32 Кроме того, использование антибиотиков в первые 6–12 месяцев жизни было связано со снижением созревания детской микробиоты. 32 Это говорит о том, что антибиотики могут задерживать развитие микробиоты, если их вводить в течение этого периода времени, что потенциально может предрасполагать младенцев к заболеваниям, связанным с микробиомом, в более позднем возрасте. 32
В эпидемиологических исследованиях было высказано предположение, что вызванный антибиотиками дисбиоз в младенчестве способствует развитию многих неинфекционных заболеваний в более позднем детстве и во взрослом возрасте (например, ожирение, астма, воспалительное заболевание кишечника [ВЗК]). 53 — 56 Однако эти эпидемиологические анализы не выясняют, связаны ли эти заболевания причинно-следственной связью с использованием антибиотиков в раннем возрасте или они указывают на иммунную недостаточность в раннем возрасте или предрасположенность к инфекции.Тем не менее, есть несколько многообещающих моделей на животных и перспективных когортных исследований на людях, которые пытаются решить это затруднительное положение и предоставить дополнительную поддержку микробиому как ключевому посреднику развития при DOHaD.
Связанные с дисбиозом неинфекционные заболевания обеспечивают дополнительную поддержку микробиома в DOHaD
Критическое окно в раннем возрасте
Как упоминалось в начале этого обзора, DOHaD подчеркивает критическое окно восприимчивости от зачатия до раннего возраста, в котором факторы окружающей среды наиболее глубоко влияют на здоровье человека в долгосрочной перспективе.Аналогичное критическое окно появилось для развития микробиома. Ученые сузили критическое окно микробиома для ранней жизни до периода между зачатием и первым годом жизни (рис. 1). 1 Хотя для подтверждения этой теории необходимы дополнительные исследования, уязвимость микробиома к воздействиям окружающей среды, по-видимому, меняется во времени, становится более существенной на ранних этапах жизни и уменьшается по мере того, как он становится взрослым (рис. 1). В следующих разделах мы обсудим исследования конкретных заболеваний (в частности, некротический энтероколит [NEC], астму и атопические заболевания, ожирение и нарушения развития нервной системы), которые указывают на это критическое окно в раннем возрасте и дополнительно подтверждают роль микробиома в DOHaD (сведено в Таблицу 1).
ТАБЛИЦА 1Исследования, в которых исследователи связывают микробиом в раннем возрасте с последствиями для здоровья в более позднем детстве и в зрелом возрасте
NEC
Помимо рисков для здоровья, связанных с преждевременными родами, у недоношенных детей наблюдается выраженный микробный дисбиоз новорожденных. Этот дисбактериоз увеличивает их восприимчивость к болезням, особенно к НЭК, которая может измениться под воздействием антибиотиков в этот критический период времени. 57 Путем анализа существующих данных о последовательности гена 16S рибосомной РНК, авторы определили различную численность протеобактерий, фирмикутов и бактероидетов, которые предшествовали началу НЭК. 57 В исследовании 122 новорожденных с крайне низкой массой тела при рождении также сообщалось, что дисбактериоз кишечника, характеризующийся аналогичными вариациями бактериальных таксонов, предшествовал НЭК. 58 Увеличение протеобактерий наряду с повышенной активностью Toll-подобного рецептора 4 энтероцитов у этих новорожденных с NEC предполагает гипервоспалительный ответ на дисбиотический микробиом. 59 Однако недавнее исследование было проведено, в котором исследователи определили уропатогенную колонизацию E coli как значимый маркер риска для NEC. 59 Это говорит о том, что инвазивные виды микробов могут иметь синергетический эффект в управлении этим расстройством, связанным с дисбиозом. Кроме того, младенцы, получавшие антибиотики в течение 7–14 дней (независимо от статуса NEC), были обогащены на E coli по сравнению с младенцами, получавшими антибиотики в течение 0–6 дней. 59 Это подтверждает роль неонатального дисбактериоза, вызванного антибиотиками, в НЭК, который может повысить уязвимость кишечного микробиома новорожденного к инвазии патогенов. Из-за очевидной связи между микробным дисбиозом и НЭК добавление пробиотиков к недоношенным новорожденным становится важной областью исследований для профилактики и лечения НЭК. 109 , 110 В систематическом обзоре и метаанализе 26 исследований пробиотического вмешательства для NEC предполагается, что пробиотическое вмешательство действительно предотвращает NEC. 60 Однако конкретные штаммы, которые будут использоваться, и их влияние на группы высокого риска (младенцы с крайне низкой массой тела при рождении) требуют дальнейшего изучения. 60 Тем не менее, в ближайшем будущем может появиться возможность оптимизировать микробиом новорожденных для борьбы с развитием этого заболевания и предотвращения связанной с ним детской смертности.
Астма и атопическое заболевание
Исследования NEC подчеркивают динамическую связь между микробиомом кишечника и развивающейся иммунной системой. Однако, хотя иммунная система новорожденных находится в состоянии повышенной готовности к патогенным захватчикам, исследователи, проводившие исследования астмы и атопических заболеваний (пищевая аллергия, атопический дерматит и т. Д.), Предполагают, что на ее развитие сильно влияют комменсальные бактерии.
В недавней оценке микробиома в развитии астмы подтверждается более существенная роль материнской микробиоты в развитии плода, чем считалось ранее.В модели аллергического воспаления дыхательных путей на мышах кормление беременных мышей с высоким содержанием клетчатки (которое, как сообщается, стимулирует продукцию SCFAs микробиомом 111 ) или ацетатом (SCFA) модулировало материнскую микробиоту и защищало последующее потомство от развития. аллергическое заболевание дыхательных путей. 73 Авторы этого исследования также предоставили предварительные доказательства этой ассоциации у людей; высокие уровни ацетата в сыворотке беременных коррелировали с сокращением посещений терапевта по поводу кашля и хрипов у потомства в течение первых 12 месяцев жизни. 73
Постнатальный дисбактериоз в раннем периоде жизни кишечника человека 2 , 4 , 5 , 70 и микробиом дыхательных путей 78 , а также микробиом, связанный с астмой развитие у детей. Этот дисбиоз характеризуется сдвигами в распространенности специфических бактерий 4 , 5 и таксонов грибов 70 , которые являются временными и наиболее заметными в период между рождением и 3 месяцами жизни.Большинство исследований на людях в этой области исследований выявляют только коррелятивные доказательства связи дисбактериоза в раннем возрасте с астмой. Тем не менее, Arrieta et al., , 4, предоставляют предварительные доказательства причинно-следственной связи, связанной с преходящим дисбактериозом в раннем возрасте и развитием иммунной системы в контексте астмы. В этом исследовании прививка мышей, ранее свободных от микробов (GF), 4 видами бактерий, которые были уменьшены у младенцев с высоким риском астмы, уменьшила аллергическое воспаление дыхательных путей у этих мышей. 4
Имеются также данные, подтверждающие роль микробиома раннего возраста в пищевой аллергии.Azad et al., , 74, сообщают об уменьшении микробного разнообразия в возрасте 3 месяцев и увеличении соотношения энтеробактерий / бактериоидных в возрасте 3 месяцев и 1 года, что было связано с повышенной пищевой сенсибилизацией у годовалых детей. Вариации микробиома кишечника в возрасте 3 и 6 месяцев также были связаны с разрешением аллергии на молоко к 8 годам. 75 Таким образом, авторы текущего исследования микробиома астмы и аллергии предполагают временной период между рождением и возрастом в один год как окно возникновения этого заболевания.Эта иммунная гиперчувствительность сохраняется в более позднем детстве и во взрослом возрасте, несмотря на временный характер микробного дисбиоза.
Ожирение
Подобно астме и атопическому заболеванию, проспективные исследования выявляют изменения в составе микробиома кишечника в раннем возрасте, которые предшествуют развитию ожирения. 88 , 91 Недавнее исследование выявило временные и композиционные ассоциации микробиома с ожирением в раннем детстве. 89 В частности, младенцы с высокой численностью Streptococcus в возрасте 6 месяцев демонстрировали повышенное ожирение в возрасте 18 месяцев. 89 Это подчеркивает важность как состава микробиома, так и времени созревания микробиома в развитии детского ожирения.
Исследования на мышиных моделях использовались для механической поддержки потенциальных метаболических эффектов микробного дисбиоза в раннем возрасте и подчеркивали способность антибиотиков вызывать ожирение. В исследовании Cho et al., Введение 90 антибиотиков мышам в раннем возрасте привело к последующему увеличению ожирения и метаболических гормонов.Кокс и др. 6 продвинули это исследование, манипулируя микробиотой раннего возраста с помощью низких доз пенициллина (LDP). Здесь они сообщают, что воздействие LDP в молодом возрасте увеличивало влияние диеты с высоким содержанием жиров на микробиоту, которая могла быть передана мышам GF, чтобы вызвать ожирение. 6 Для будущих исследователей будет важно включить как проспективные исследования на людях, так и модели на животных, чтобы определить связанные с микробиомом эффекты воздействия антибиотиков в раннем возрасте на здоровье человека.
Расстройства нервного развития
Менее интуитивная роль микробиома кишечника в здоровье и развитии человека связана с влиянием микробного дисбиоза в раннем возрасте на развитие нервной системы (т.е. ось кишечник-мозг). Появляется все больше доказательств, подтверждающих вариации микробного состава в раннем возрасте при реакции на стресс и тревогу. На животных моделях предполагается, что неонатальный стресс после разлучения с матерью приводит к долгосрочным изменениям состава кишечной микробиоты, 95 , 96 , и лечение крысят пробиотиками может противодействовать возникающему в результате повышенному уровню кортикостерона. 95 Пренатальное воздействие SCFA, пропионовой кислоты, также, как сообщалось, усиливало тревожное поведение у мышей. 97 В недавнем исследовании Gur et al. 7 сообщают о влиянии пренатального материнского стресса на мышей и его способности изменять как материнский, так и неонатальный микробиомы кишечника. Взрослые потомки, подвергшиеся пренатальному материнскому стрессу, также проявляли повышенное тревожное поведение. 7 Кроме того, пренатальный стресс также вызвал изменения в микробиоме плаценты. 7 Это говорит о том, что внутриутробная микробная среда является потенциальным посредником материнского пренатального стресса и, как следствие, стресса у потомства.
Вариации микробиома кишечника также связаны со многими аспектами социального поведения. Взрослые потомки традиционных самок (ранее GF, но колонизированные микробиомом мышей, свободных от специфических патогенов [SPF]), как сообщалось, демонстрируют пониженную двигательную активность по сравнению с потомками от самок GF. 98 Buffington et al. 93 сообщают о нарушении социального поведения (аналогичном тому, которое наблюдается при расстройстве аутистического спектра) у потомков самок, которых кормили диетой с высоким содержанием жиров, что опосредовано вариациями микробиома потомства.Кроме того, с помощью метагеномного секвенирования с использованием дробовика эта группа определила значительное снижение уровня Lactobacillus reuteri среди потомства, получавшего материнское питание с высоким содержанием жиров. 93 Пополнение питьевой воды л реутери привело к восстановлению социального дефицита потомства. 93 Примечательно, что большинство исследований с участием исследователей, сосредоточенных на критическом окне в раннем периоде жизни в отношении развития нервной системы, было проведено на животных моделях. Однако есть недавние данные, подтверждающие роль микробиома кишечника младенца в когнитивном развитии человека.Carlson et al., , 94, сообщили об изменениях α-разнообразия кишечного микробиома у годовалых детей, которые коррелировали с их когнитивными способностями, измеренными в возрасте 2 лет. Дополнительные исследования на людях подтвердят эти доказательства. Однако интересно отметить, что исследователи последовательно определяют период времени между беременностью и первым годом жизни как наиболее важный для человеческого развития.
В совокупности это исследование, посвященное конкретному заболеванию, используется для подтверждения роли микробиома в раннем возрасте в развитии плода и ребенка в различных контекстах.

 Микрофлора начинает формироваться буквально после первого прикладывания к груди — в кишечник с молоком попадают питательные вещества, полезные бактерии, гормоны.
Микрофлора начинает формироваться буквально после первого прикладывания к груди — в кишечник с молоком попадают питательные вещества, полезные бактерии, гормоны.