ВПЧ ( вирус папилломы человека) типы 16, 18
ВПЧ 16, 18 относятся к группе высокого и среднего риска озлокачествления пораженных клеток.
Инфицирование осуществляется следующими путями:
1. Передача ВПЧ 18, 16 типа при случайных интимных отношениях без контрацептивов.
2. Контактный способ в бытовых условиях.
3. Передача папилломавируса 16, 18 типов плоду через материнскую плаценту.
Развитие вируса папилломы человека 16, 18 типов делят на несколько этапов:
1.Инкубационный период. Характеризуется бессимптомным развитием инфекционного процесса. Длительность периода прогнозировать невозможно.
2. Этап активного роста новообразований. Наблюдается появление характерных признаков – папиллом 16 типа. Делительный процесс этих структур ускоряется и становится незакономерным, в результате возникает рост новообразований.
3. Дисплазия.
Обнаружение предракового состояния – это косвенные показатели ВПЧ 16, 18 типов.
4. Злокачественная форма заболевания. После изменения клеточной структуры происходят мутации клеток под влиянием возбудителя папилломы 16, 18 и развивается онкологический процесс.
Папилломы человека 16, 18 типа представляют собой наросты округлой формы, связанные с телом посредством тонкой ножки. Образования имеют мягкую структуру, безболезненные. По цвету наросты практически не отличаются от здоровой кожи. На слизистых оболочках часто появляются остроконечные образование – кондиломы. Такие наросты чаще локализуются группами, внешне напоминающими коралл. В случае активизации заболевания могут проявляться более выраженные признаки вируса папилломы 16 типа: жжение и раздражительность в области гениталий, появление нехарактерных выделений с неприятным запахом. ВПЧ 18 типа вызывает около 60% случаев появления онкозаболевания женских и мужских половых органов.
Диагностика
Самым точным и диагностически важным методом является полимеразная цепная реакция или анализ ПЦР.
ПЦР основывается на определении ДНК вируса в исследуемой биологической среде, полученной от обследуемого. Это может быть кровь, слюна, моча, в которые для определения вируса вводят специальный реагент.
Сдать анализ на ВПЧ ( вирус папилломы человека) типы 16, 18 в Екатеринбурге можно по адресам ул. Большакова д.68 и ул. Викулова 33/2
Вирус папилломы человека 16,18,31,33,35,39,45,52,58,59,67 высокого канцерогенного риска (ВКР)
Качественное определение ДНК вируса папилломы человека (ВПЧ) 16, 18 типа (HPV 16, 18) в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени». Исследование выполняется на оборудовании «Corbett Research» ( компании «Quagen», Германия) по стандартизованной технологии.
Вирус папилломы человека (ВПЧ) может быть причиной возникновения рака гениталий у женщин и плоскоклеточного рака у мужчин и женщин.
- определяемый фрагмент — специфичные участки ДНК ВПЧ 16, 18 типа;
- специфичность определения — 100%;
- чувствительность определения 100 копий ДНК ВПЧ 16, 18 типа в образце.
За 1–2 суток до взятия мазка (соскоба) воздержаться от половых контактов.
По согласованию с лечащим врачом за 10–14 дней до взятия биоматериала прекратить прием лекарственных препаратов и лечебные процедуры.
Мазки на инфекции и посевы сдавать не ранее, чем через 3 недели после приема антибиотиков.
Для женщин: взятие биоматериала производится после менструации, не ранее, чем на 4–5 день цикла, если другие сроки не назначены врачом. Желательно отказаться от приема ванны в день накануне взятия биоматериала. За 1–2 суток до взятия мазка (соскоба) необходимо исключить половые контакты, нельзя также проводить УЗИ, кольпоскопию. В течение 24 часов до взятия мазка (соскоба) необходимо исключить спринцевания, влагалищные души, тампоны, свечи и другие местные препараты (в том числе и контрацептивы). Допускается только наружный туалет половых органов. Нельзя мочиться в течение 3 часов до процедуры взятия мазка (соскоба) из уретры.
Для мужчин: За 1–2 суток до взятия мазка (соскоба) необходимо исключить половые контакты. В день накануне взятия биоматериала нельзя использовать антисептики. Нельзя мочиться в течение 1,5-2 часов до процедуры.
- Проявления трансформирующей дисплазии в различной степени.

- Ослабление иммунитета.
- Профилактические скрининговые исследования
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Интерпретация результата
Тест качественный. Результат выдаётся в терминах «положительный» или «отрицательный» для каждого типа ВПЧ (16, 18).
- «положительный»: в анализируемом образце биологического материала найдены фрагменты ДНК, специфичные для ВПЧ 16, 18 типа; инфицирование ВПЧ указанного типа.
- «отрицательный»: в анализируемом образце биологического материала не найдено фрагментов ДНК, специфичных для ВПЧ 16, 18 типа или концентрация возбудителей в образце ниже границы чувствительности теста.

Обращаем внимание, что сроки выполнения ПЦР-исследований могут быть увеличены при проведении подтверждающих тестов.
ВПЧ — КВД №2
Что такое ВПЧ?
Генитальная папилломавирусная инфекция – это инфекция, передаваемая половым путем (ИППП). Возбудитель папилломавирусной инфекции — вирусы папилломы человека (ВПЧ). Вирусы папилломы человека – это группа вирусов, которая включает около 100 различных типов. Более 30 типов ВПЧ передаются половым путем, инфицируют половые органы и область ануса женщин и мужчин.
Большинство инфицированных не знают о своем заболевании, не имеют клинических проявлений и, более того, могут самопроизвольно выздороветь.
Часть этих вирусов называют вирусами «высокого канцерогенного риска», они могут вызвать предраковые поражения гениталий. Исследования последних лет подтвердили главную роль ВПЧ в развитии рака шейки матки. ВПЧ высокого риска также играют роль в возникновении рака вульвы, влагалища у женщин и рака полового члена у мужчин. К вирусам высокого риска относят 16, 18, 31, 33, 35, 39, 45, 52, 53, 56, 58, 59, 68, 69 типы – эти типы ВПЧ ответственны за 95-98% случаев развития рака шейки матки. Они вызывают рост ненормальных клеток, который является обычно плоским и почти невидим при обычном осмотре по сравнению с доброкачественными бородавками, которые вызываются вирусами низкого риска – 6, 11 типами. Доброкачественные аногенитальные бородавки появляются через 2 – 6 месяцев после заражения. На развитие предраковых или раковых изменений, связанных с носительством ВПЧ высокого риска уходят годы и часто происходит самопроизвольное излечение от ВПЧ.
К вирусам высокого риска относят 16, 18, 31, 33, 35, 39, 45, 52, 53, 56, 58, 59, 68, 69 типы – эти типы ВПЧ ответственны за 95-98% случаев развития рака шейки матки. Они вызывают рост ненормальных клеток, который является обычно плоским и почти невидим при обычном осмотре по сравнению с доброкачественными бородавками, которые вызываются вирусами низкого риска – 6, 11 типами. Доброкачественные аногенитальные бородавки появляются через 2 – 6 месяцев после заражения. На развитие предраковых или раковых изменений, связанных с носительством ВПЧ высокого риска уходят годы и часто происходит самопроизвольное излечение от ВПЧ.
Инфекция наиболее распространена в возрасте от 15 до 40 и затрагивает одинаково и женщин и мужчин. К 50 годам жизни, около 80 процентов женщин приобретут ВПЧ — инфекцию.
Около 50-75% сексуально активных людей инфицируются ВПЧ в течение их жизни, и в большинстве случаев инфекция не вызывает заболевания и самопроизвольно излечивается.
Приблизительно 90% ВИЧ-инфицированных также имеют ВПЧ-инфекцию.
Как передается ВПЧ
Вирусы папилломы человека, инфицирующие половую область, передаются, через половые контакты. Большинство заразившихся не имеют видимых проявлений заболевания и поэтому носители ВПЧ не знают о своем инфицировании и могут заразить своих половых партнеров. Иногда инфицированная мать может заразить новорожденного во время родов. Это может привести к так называемому папилломатозу гортани новорожденных.
Проявления инфекции
Большинство заразившихся людей не знают об этом. ВПЧ часто не вызывает никаких проявлений на коже и слизистых оболочках. У части людей развиваются половые бородавки или происходят предраковые изменения на шейке матки, вульве, анальной области или половом члене. Очень редко эти изменения переходят непосредственно в рак. От инфицирования до развития тяжелой дисплазии в среднем проходит 20 лет. Большинство женщин спонтанно излечиваются в течение 9 – 15 месяцев от момента заражения. Основное проявление папилломавирусной инфекции – половые бородавки или остроконечные кондиломы (вызываются ВПЧ 6 и 11 типа) — мягкие бородавчатые образования на короткой тонкой ножке, напоминающие цветную капусту или петушиный гребень с различным расположением (головка полового члена, половой член, малые и большие половые губы, влагалище, шейка матки, область ануса).
Диагностика инфекции
Диагностика кондилом проводится на основании осмотра. Диагностика ВПЧ высокого канцерогенного риска и связанных с ними изменений, более сложная задача. В основе диагностики предраковых заболеваний шейки матки в течении многих стоял цитологический анализ мазка (исследование мазка под микроскопом). Однако он имеет ряд существенных недостатков – сложность, низкая чувствительность и высокая частота неопределенных результатов. Американский комитет FDA (комитет по медикаментам и продовольствию) одобрил исследование ВПЧ методом полимеразной цепной реакции — ПЦР, который может определить 13 типов ВПЧ высокого риска. ПЦР на ВПЧобладает высокой чувствительностью, прост в исполнении. Совместное использование цитологических исследований и ПЦР тестов позволяет значительно повысить эффективность диагностики, чувствительность увеличивается до 99 – 100%. Применяемые в РКВД ПЦР тест-системы не уступают, а чаще, даже превосходят зарубежные аналоги. Важно, что выявление ВПЧ высокого риска происходит задолго до появления предраковых изменений слизистых.
Применяемые в РКВД ПЦР тест-системы не уступают, а чаще, даже превосходят зарубежные аналоги. Важно, что выявление ВПЧ высокого риска происходит задолго до появления предраковых изменений слизистых.
ПЦР исследование на ВПЧ высокого риска рекомендовано:
— Как первичный метод в дополнение к цитологии для женщин старше 30 лет.
— Для разрешения сомнительных результатов цитологического исследования.
— Пациенткам, проходящим лечение по поводу дисплазии или рака.
— На первом этапе диагностики для стран, где плохо организованы программы обследования на папилломавирусную инфекцию.
— Для обследования мужчин.
Можно ли излечить это заболевание?
Диагностика и лечение ИППП, должна проводиться в условиях специализированной клиники – КВД, имеющей все необходимые средства для быстрой и точной диагностики.
Специфического лекарства против ВПЧ на сегодняшний день нет. Существует множество методов удаления кондилом, но болезнь может вернуться вновь, поскольку вирус остается в организме человека. Рецидивы возможны в 25% случаев в течение 3 месяцев после лечения. При лечении кондилом необходим осмотр половых партнеров. Однако подавляющее большинство половых партнеров заражены ВПЧ и просто не имеют видимых проявлений заболевания.
Рецидивы возможны в 25% случаев в течение 3 месяцев после лечения. При лечении кондилом необходим осмотр половых партнеров. Однако подавляющее большинство половых партнеров заражены ВПЧ и просто не имеют видимых проявлений заболевания.
Лечение предраковых заболеваний заключается в использовании химических, физических и других методов, с целью изменить структуру пораженных участков слизистых оболочек, а также в применении препаратов стимулирующих иммунитет. В дальнейшем необходимо ежегодное цитологическое исследование и определение ВПЧ методом ПЦР.
Какая связь между ВПЧ и раком шейки матки?
Только факты:
- Вирусы папилломы человека высокого риска являются основной причиной рака шейки матки.
- В случаях тяжелой дисплазии (предрака) и рака шейки матки ВПЧ выявляется почти в 100% случаев.
- Выявление ВПЧ связано с 250-кратным увеличением риска развития тяжелой дисплазии.
- Рак шейки матки занимает 1-е место среди причин женской смертности в развивающихся странах.

- Рак шейки матки занимает 2-е место после рака молочной железы среди женщин в мире – 250 тысяч смертей ежегодно.
- В России ежегодно 12 300 женщин заболевает раком шейки матки и более 6 тысяч пациенток ежегодно умирает.
- За последние 10 лет средний возраст заболевших снизился с 58 до 55 лет.
- У женщин до 29 лет заболеваемость выросла в 2 раза.
- ВПЧ высокого риска вызывают рак шейки матки в 100% случаев, рак заднего прохода – 90%, рак влагалища и вульвы – 40%, рак полового члена – 40% и рак ротоглотки в 12% случаев.
- Американское Общество Раковых Заболеваний прогнозировали на 2004 год, что приблизительно у 10 520 женщин разовьется агрессивный рак шейки матки и приблизительно 3 900 женщины умрут от этой болезни. Большинство женщин с агрессивным раком шейки матки, не проходили правильного обследования на ВПЧ инфекцию.
Профилактика инфекции
Вернейший способ предотвращения половой ВПЧ-инфекции состоит в том, чтобы воздержаться от любого полового контакта с другим индивидуумом.
Долговременные сексуальные отношения с постоянным половым партнером не дает 100% гарантии от инфицирования ВПЧ. Трудно определить, без специальных тестов, инфицирован ли в настоящее время половой партнер.
Мужские презервативы из латекса, при правильном применении снижают риск передачи инфекции.
Любые проявления, такие как боль или неприятные ощущения при мочеиспускании, необычная сыпь, выделения являются сигналом для прекращения половых контактов и немедленного обследования в условиях специализированной клиники – РКВД. Если у больного обнаружены ИППП, он должен сообщить об этом своим половым партнерам, для того чтобы они также прошли полное обследование и соответствующее лечение. Это снизит риск развития серьезных осложнений и предотвратит возможность повторного заражения.
Вирус папилломы человека тип 16, 18 – количественный метод
Вирус папилломы человека тип 16, 18 – количественный метод
Папилломавирусная инфекция относится к инфекциям, передаваемым половым путем. Вирус папилломы человека (ВПЧ) является эпителиотропным, он способен поражать клетки кожи, слизистых половых органов, ротовой полости. Инфицирование ВПЧ широко распространено и является важной проблемой здравоохранения.
Вирус папилломы человека (ВПЧ) является эпителиотропным, он способен поражать клетки кожи, слизистых половых органов, ротовой полости. Инфицирование ВПЧ широко распространено и является важной проблемой здравоохранения.
По степени злокачественности папилломавирусы подразделяют на 2 группы:
— ВПЧ низкого онкогенного риска, к ним относятся 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 типы вируса, которые вызывают развитие кондилом гениталий, респираторного папилломатоза.
— ВПЧ высокого онкогенного риска, которые являются причиной развития интраэпителиальной дисплазии и рака шейки матки. На сегодняшний день охарактеризовано 15 генотипов ВПЧ высокого канцерогенного риска: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82 типы.
С ВПЧ высокого онкогенного риска связано 95,3% случаев заболеваний рака шейки матки. Рак шейки матки, по данным ВОЗ, занимает второе место в мире по распространенности среди злокачественных заболеваний женщин.
У инфицированной женщины вирус может в течение многих лет находится в латентной форме, не вызывая изменений в клетках. У большинства женщин инфицирование может пройти транзиторно, в течение 9-15 месяцев может произойти самоизлечение.
Длительное носительство ВПЧ приводит к дисплазии легкой степени, затем средней и тяжелой, которая заканчивается развитием инвазивного рака шейки матки. Вероятность развития интраэпителиальной дисплазии и рака шейки матки более чем в 300 раз выше у женщин с персистирующей инфекцией ВПЧ высокого онкогенного риска.
ВПЧ 16/18 КОЛИЧЕСТВЕННЫЙ — методом ПЦР Real-time проводится дифференцированное выявление и количественное определение ДНК 16 и 18 типов вируса папилломы человека, обладающих наибольшей онкогенностью. Материал для исследования: соскоб из цервикального канала.
В случае получения неудовлетворительных результатов обследования необходима консультация врача-гинеколога, который выберет оптимальную тактику дальнейшего обследования, наблюдения и лечения.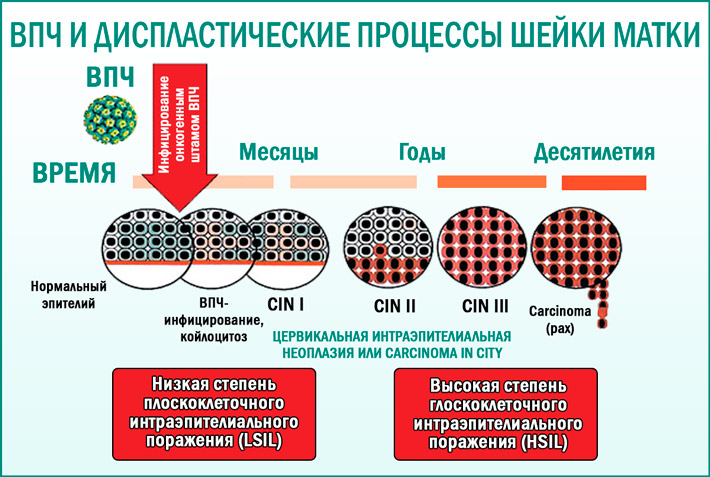
|
Возможные неполовые пути передачи вируса папилломы человека Абстракт Цель Все больше фактов указывают на то, что основными способами передачи вируса папилломы человека (ВПЧ), инфекционного агента, способного спровоцировать рак шейки матки, являются вертикальный и горизонтальный пути. Новорожденные, дети, взрослые люди могут заразиться инфекцией высокого или низкого онкогенного типа при рождении либо при тесном контакте, при том, что основной механизм передачи ВПЧ – половой путь. Чтобы оценить вероятность заражения ВПЧ неполовым путем, был осуществлен тщательный анализ литературы. Методы При поиске в электронных базах данных обзора статей, кросс-секционных исследований, когортных исследований и докладов по поводу иных способов передачи ВПЧ, кроме полового, были использованы термины «вирус папилломы человека (ВПЧ)», «передача», «горизонтальный путь», «вертикальный путь», «фомиты». Были пересмотрены статьи, опубликованные в период от 1983 года по 2015 год. Результаты Данные многих эпидемиологических и клинических исследований свидетельствуют о различных неполовых способах передачи ВПЧ, в частности во время родов и при тесном контакте. Хотя роль фомитов в заражении ВПЧ еще четко не установлена, однако, сообщалось о позитивных результатах тестов на ДНК ВПЧ после рутинной дезинфекции трансвагинальных ультразвуковых зондов и кольпоскопов. Заключение Население следует информировать обо всех возможных путях передачи вируса. Необходимы долгосрочные проспективные исследования, чтобы обосновать вероятность неполовых путей передачи ВПЧ. Введение Папиллома вирусы – это небольшие безоболочечные вирусы с икосаэдральной симметрией с двухцепочечной ДНК. Вирусы папилломы видоспецифичны, они инфицируют эпителиальные клетки базального слоя и слизистой оболочки, вызывая различные типы бородавок и аногенитальные виды рака. В ряде эпидемиологических и молекулярных испытаний выявлена сильная связь ВПЧ инфекции с цервикальным раком. Наиболее распространенными типами ВПЧ во всем мире являются типы 16 и 18, обусловливающие развитие инвазивного цервикального рака. Почти 70% случаев инвазивного цервикального рака ассоциированы с этими двумя типами ВПЧ. По данным выполненных в Индии эпидемиологических исследований рака шейки матки, общее количество ВПЧ-позитивных женщин составило 98%. Рак шейки матки является самым распространенным видом рака в сельских районах Индии; почти четверть глобального бремени рака шейки матки приходится на Индию. Внезапное купирование высокоонкогенной ВПЧ-инфекции происходит в 80% случаев. Папилломавирусная инфекция является одним из самых распространенных заболеваний, передающихся половым путем. Большинство исследований ВПЧ выполнено на базе клинических больниц с участием практически только сексуально активных женщин. В последние два десятилетия у сексуально неактивных женщин для скрининга на предмет ВПЧ-инфекции используются образцы мочи и влагалищного отделяемого, полученные неинвазивным путем самостоятельно пациенткой. Осведомленность по поводу различных неполовых способов передачи ВПЧ является значимым фактором для стратегии вакцинации, а также эпидемиологических исследований и клинического ведения ВПЧ-позитивных неполовоззрелых подростков и детей. Признание возможных неполовых путей передачи вируса поможет избежать процесса выяснения причины заражения детей и подростков. В обществе так много культурных и социальных предубеждений и предрассудков, что многие родители выступают против вакцинации как дополнительной защиты от передающихся половым путем заболеваний своих незамужних дочерей. Хорошо информированный работник здравоохранения может осведомить пациентов и родителей пациентов о различных неполовых путях передачи онкогенного вируса. В данном контексте мы изучили доступную литературу по неполовым способам передачи ВПЧ. Не было необходимости в получении одобрения Экспертного совета организации для следующего ретроспективного анализа. Все изложенные в Хельсинкской Декларации принципы были соблюдены. Методы Был осуществлен комплексный поиск литературы по теме «неполовые способы передачи ВПЧ-инфекции у бессимптомных женщин» и идентифицированы опубликованные исследования в период от 1983 года по 2015 год по поводу. Для поиска литературы мы использовали электронные базы данных PubMed-Medline, CINAHL, Scopus и Google Scholar. Были идентифицированы соответствующие статьи исследований на английском языке с участием людей, используя термины «вирус папилломы человека», «ВПЧ», «передача», «горизонтальная передача», «вертикальная передача», «фомиты». Также были изучены статьи, опубликованные в рецензируемых научных журналах. Статьи с информацией о половом способе передачи ВПЧ, ВПЧ среди взрослого населения, гомосексуальных мужчин, а также иммунокомпрометированных пациентов были исключены из анализа. В анализ включили исследования, выполненные при участии сексуально неактивных женщин и неполовоззрелых детей. Основное бремя инфекции лежит на женщинах по причине снижения иммунитета и большей вероятности длительного сохранения инфекции в их организмах. Из 1140 статей, опубликованных на английском языке с 1983 года, 33 статьи соответствовали заданной теме «неполовые способы передачи генитальной ВПЧ-инфекции у здоровых женщин и детей». В конечную оценку были включены анализы статей, когортные, кросс-секционные исследования и частные случаи из клинической практики; во всех этих исследованиях наличие ВПЧ подтверждалось молекулярными тестами. Результаты Несмотря на то, что папилломавирусная инфекция является одним из самых распространенных в мире заболеваний, передающихся половым путем, в значительной доле населения заражение происходит вертикальным и горизонтальным способами. Более ранние исследования продемонстрировали возможность вертикальной передачи инфекций [10-12]. Совсем немного исследований было выполнено среди сексуально неактивного взрослого населения; необходимо провести ряд дополнительных исследований, чтобы понять природу причин появления ВПЧ у детей и подростков. Поиск литературы На рисунке 1 изображен процесс отбора литературы. Для более детальной оценки в анализ были включены полнотекстовые статьи 46 исследований. Из них четыре исследования, в которых для диагностики ВПЧ-инфекции не применяли метод полимеразной цепной реакции (ПЦР), два исследования, не содержащие данные о матерях и детях, и одно исследование, в котором дети не принимали участия, были исключены из анализа. Одно исследование, в которое были включены участники после родов, также было исключено. В конечную оценку не были включены исследования, в которые были вовлечены дети с красным плоским лишаем вульвы и матери с раком шейки матки. Еще одно исследование в Южной Корее было также исключено, поскольку исследование с участием данной когорты ранее было уже выполнено Парком и соавт [13]. В таблице 1 представлен процесс тщательного анализа исследований. Рисунок 1 Таблица 1. Исследования неполовых способов передачи ВПЧ Вертикальный путь передачи При вертикальном механизме передачи ВПЧ-инфекции заражение вирусом происходит от матери или отца к ребенку. Инфицирование вирусом плода или новорожденного ребенка происходит от матери во время беременности или родов. Заражение может также происходить в процессе зачатия через инфицированную яйцеклетку или сперматозоид. До настоящего момента не было выполнено ни одно исследование в отношении выявления ВПЧ в яйцеклетках, несмотря на тот факт, что вирус был обнаружен в семенной жидкости и сперматозоидах. Вирус передается от матери к ребенку в период беременности и родоразрешения – это основной путь передачи инфекции. Данные о длительности инкубационного периода ВПЧ и персистенции ВПЧ у новорожденных с врожденной инфекцией полностью отсутствуют. Внутриутробное заражение У ВПЧ отсутствует виремическа фаза, а гематогенный путь распространения вируса от матери к плоду маловероятен. Плод может быть инфицирован через микротрещины на плодных оболочках или через плаценту при наличии у матери генитальной ВПЧ-инфекции. Частота выявления ДНК ВПЧ в образцах плаценты у женщин с нормальным течением беременности составляет от 0% до 42,5%.[17] Недавно Федрицци и соавт. сообщили о том, что ДНК ВПЧ регистрируется в образцах нормального неизмененного эндометрия в 3,5 раза чаще у курящих пациентов по сравнению с некурящими. Финские исследователи пришли к выводу, что частота выявления ВПЧ в образцах плаценты у курящих оказалась в три раза выше по сравнению с некурящими. Перинатальное заражение Большинство инфекций у новорожденных передается во время родов. Соответствие типов ВПЧ у матери и ребенка свидетельствует о перинатальной передаче. Перинатальное заражение вирусом, как правило, происходит вследствие непосредственного контакта с инфицированными тканями родовых путей или восходящего пути инфицирования плода, в частности при преждевременном разрыве плодных оболочек. В большинстве исследований матери проходили тест на папилломавирусную инфекцию генитального тракта в третьем триместре беременности. В одном недавно выполненном исследовании здоровые женщины с нормальным течением беременности находились под наблюдением в течение всех триместров беременности и далее после родов. Как стало ясно, частота выявления ВПЧ оказалась ниже в последнем триместре по сравнению с таковой в первых двух триместрах беременности. [21] Находящаяся в генитальном тракте ВПЧ-инфекция может проникать в плаценту или пуповинную кровь. Наиболее высокая вероятность обнаружить ВПЧ в пуповинной крови существует при наличии у матери генитальных кондилом в анамнезе. У женщин с генитальными кондиломами часто отмечается персистирующая ВПЧ-инфекция; существует высокая вероятность внутриутробного заражения плода инфекцией. Другие исследователи обнаружили меньшую вероятность перинатального заражения (приблизительно 2,8%) в контексте беременных женщин с клинически и лабораторно подтвержденной ВПЧ-инфекцией. Показатель соответствия типов ВПЧ у матери и ребенка оказался 39%, c диапазоном 0,2 – 73%. [12] Согласно результатам исследования под эгидой Парка и соавт. у детей первых месяцев жизни отмечается полная элиминация инфекции к 6-месячному возрасту.[13] Не рекомендована вакцинация женщин до наступления беременности, поскольку вероятность заражения оказалась ниже, согласно данным эпидемиологических исследований.[12] Риск заражения при прохождении через естественные родовые пути оказался ниже, наличие папилломавирусной инфекции генитального тракта не является показанием к проведению кесарева сечения.[16] Согласно результатам систематического мета-анализа, выполненного Медейросом и соавт., объединенный относительный риск (ОР) вертикального пути передачи составил 4,8. Вероятность выявления ВПЧ у новорожденного ребенка выше при наличии папилломавирусной инфекции в пуповинной крови или плаценте. На сегодняшний день имеются противоречивые данные в отношении персистирования ВПЧ у детей, инфицированных с рождения. Случаи вирусной инфекции, способной дать персистенцию на длительный срок жизни ребенка, – довольно редкое явление, однако, у ВПЧ-позитивных детей следует предполагать другие возможные пути передачи инфекции при непосредственном контакте или через фомиты.[18] Ромбальди и соавт. провели проспективное исследование, согласно которому у детей первых месяцев жизни с выявленным ВПЧ в образце (слюны) из полости рта тест на ДНК ВПЧ оказался отрицательным к 6-месячному возрасту.[18] Другие исследования продемонстрировали персистирование инфекций, приобретенных вертикальным путем, на протяжении 2 лет. В течение двух лет финские исследователи вели наблюдение за 76 семьями, уровень распространенности оральной ВПЧ-инфекции 7% был выявлен в течение первого года наблюдения. ВПЧ высокого онкогенного риска, в частности ВПЧ-16, был обнаружен в мазках со слизистой оболочки рта у новорожденных, детей первых месяцев жизни и детей старшего возраста. Бандиопадхай и соавт. сообщили об элиминации инфекции к первому году жизни у 10 инфицированных детей, включенных в наблюдение с момента рождения.[16] Согласно результатам анализа статьи ЛаКура и Тримбла, новорожденные и дети первых месяцев жизни могут быть инфицированы ВПЧ высокого онкогенного риска как половым, так и неполовым путем. Инфицирование при грудном вскармливании Несмотря на то, что в грудном молоке и молозиве были выявлены ДНК ВПЧ, в том числе высокого онкогенного риска, не было установлено соответствия между ДНК ВПЧ, выделенного из грудного молока, и ДНК ВПЧ, обнаруженной в цервикальном канале или образце слюны матери. В недавно выполненном исследовании 21 ВПЧ-позитивных и 11 ВПЧ-негативных женщин Маммас и соавт. не смогли подтвердить присутствие ДНК ВПЧ высокого онкогенного риска в грудном молоке. Не рекомендован отказ от грудного молока в случае выявления у матери ВПЧ-инфекции. Горизонтальные пути передачи Среди сексуально неактивных взрослых и детей вирус папилломы человека может передаваться горизонтальным путем, способом аутоинокуляции, гетероинокуляции или через фомиты.[20] ВПЧ-инфекция может проникать в организм ребенка в период послеродового ухода при непосредственном контакте с матерью.[19] Ауто- и гетероинокуляция Вирус папилломы человека может распространяться среди членов одной семьи через поцелуи или тактильный контакт. Взрослые люди с генитальными кондиломами могут передавать генитальные типы ВПЧ своим половым партнерам через телесный контакт (при контакте рук с гениталиями).[15] Заражение партнера также происходит через непроникающий половой акт или через телесный контакт. Дети могут быть инфицированы во время непосредственного контакта с членами своей семьи либо опекунами, имеющие на руках бородавки, во время проведения гигиенических процедур в аногенитальной области у детей.[11] Распространенным путем переноса инфекции на половые органы является аутоинокуляция. Оральная ВПЧ-инфекция довольно часто распространяется внутри одной семьи. У детей вирус персистирует более длительное время в полсти рта, чем в генитальном тракте; наиболее распространенными типами инфекции в полости рта являются низкоонкогенные, ВПЧ-6 и -11. Даже типы инфекции высокого онкогенного риска, ВПЧ-16 и -18, могут быть переданы при аутоинокуляции.
Заражение через контаминированные предметы обихода Согласно исследованию Ференци и соавт. 1989 года, в больницах распространенность ДНК ВПЧ-позитивности хирургических инструментов и перчаток оказалась ниже после стерилизации. Стерилизация или замачивание в 2-процентном растворе глутаральдегида или нагревание до температуры 100°C обеспечивает качественную дезинфекцию. Обнаружение ДНК ВПЧ у бессимптомных лиц, используя только чувствительные анализы, еще не подтверждают наличие инфекции, поскольку вирус повсеместен. ДНК ВПЧ может быть занесена в генитальный тракт с помощью фомитов. Однако дети не могут быть инфицированы ВПЧ при посещении бассейна или туалета европейского типа в школе или дома. Финским ученым под эгидой Пуранена и соавт. не удалось обнаружить ДНК ВПЧ на полу и местах для сидения в таких общественных местах, как бани, бассейны, туалеты. Однако, как утверждают де Мартино и соавт., ВПЧ может передаваться через пользование контаминированными полотенцами или другими предметами обихода. Роль фомитов в развитии инфекции четко не установлена. В отделениях гинекологии инфицирование ВПЧ может произойти через использование трансвагинальных ультразвуковых зондов и кольпоскопов; в большинстве случаев используемые методы очистки и дезинфекции не могут полностью нейтрализовать ВПЧ. В недавнем исследовании ученые пришли к выводу, что нозокомиальные инфекции могут попадать в организм при использовании трансвагинальной ультрасонографии; на зондах были обнаружены ДНК ВПЧ и свободные вирионы даже после действия экзонуклеазы. Также на зондах были выявлены ДНК ВПЧ после применения низкоуровневых дезинфицирующих средств, например, четвертичных соединений аммония. ВПЧ является одним из самых трудноустранимых агентов. Принимая во внимание, что вирус представляет канцерогенный риск, работники здравоохранения должны пересмотреть требования к проведению дезинфекции в больницах. Согласно рекомендациям центров по контролю и профилактике заболеваний, эндовагинальные УЗИ зонды классифицируются как полукритические инструменты (поверхности). Для тщательной дезинфекции следует использовать средства дезинфекции высокого уровня, например, пероксид водорода, глютаралдегид, надуксусную кислоту, либо проводить очистку нехимическим способом (УФ-излучение), чтобы нейтрализовать безоболочечные вирусы. Ультразвуковой очистка пероксидом водорода считается высокоэффективным средством дезинфекции ВПЧ-16 и ВПЧ-18.
Обсуждение Папилломавирусная инфекция обычно передается контактным путем через мелкие ранки и трещины на коже (бородавки), половым путем (генитальные кондиломы), во время прохождения по родовым путям (ювенильный папилломатоз гортани), в результате аутоинокуляции или орального секса. Папиллома может появиться на слизистых оболочках ротовой полости в результате орального секса ил аутоинокуляции. В редких случаях ВПЧ-инфекция оральной локализации может представлять угрозу для новорожденных детей в форме ювенильного рецидивирующего респираторного папилломатоза. В любом возрасте, заражение вирусом может произойти через контаминированные предметы обихода либо медицинские процедуры, однако вирус может быть занесен на гениталии фомитами в крайне редких случаях. При наличии генитальных кондилом высока вероятность передачи вируса, поскольку при непосредственном контакте 65% людей заразятся инфекцией. Вирус также попадает в организм при длительном ношении контаминированной одежды. Был выполнен ряд исследований с целью изучить распространенность ВПЧ-инфекции у детей, исследуя образцы из аногенитальной области и образцы мочи. Все включенные в анализ исследования подтвердили, что большинство аногенитальных ВПЧ-инфекций у детей препубертатного возраста являются результатом неполового заражения. Необходимо провести дополнительные исследования по поводу персистирования генитальной ВПЧ-инфекции у детей первых месяцев жизни и детей старшего возраста. В условиях ограниченных ресурсов и большой численности населения невозможно реализовать длительные проспективные исследования в развивающихся странах. Таким образом, большинство детей заражаются ВПЧ-инфекцией горизонтальным путем. В развивающихся странах много случаев ВПЧ-инфекции у сексуально неактивного взрослого населения и детей не регистрируются, поскольку, как принято в таких странах, большинство инфекций диагностируется на основании характерных клинических проявлений. Часто врачам трудно произвести забор отделяемого половых органов у сексуально неактивных лиц; другим препятствием является ограничение ресурсов для поведения молекулярного анализа, являющегося дорогим и технически сложным. Ключевая роль в понимании механизма персистирующей инфекции и последующей тенденции к развитию инвазивных форм опухолей у сексуально неактивных лиц отводится длительным наблюдениям. Образцы мочи могут быть использованы в скрининговом алгоритме по поводу выявления генитальной ВПЧ-инфекции как у мужчин, так и у женщин. Выявление ДНК ВПЧ в образцах мочи является альтернативным малозатратным вариантом для масштабных популяционных исследований. Тем не менее, наличие вируса в моче может свидетельствовать о сопутствующих половых инфекциях в различных чувствительных к инфекционным воздействиям зонах, например, влагалище и вульве, в частности среди сексуально активного взрослого населения. Переходная зона шейки матки наиболее уязвима для ВПЧ, тропного к эпителию генитального тракта. Наличие ДНК ВПЧ в моче свидетельствует о локализации вируса в шейке матки, влагалище, вульве или анальном канале.
Значение для общественного здоровья
Интактная иммунная система хозяина элиминирует почти все ВПЧ-инфекции, приобретенные в детстве или при рождении. Если у детей выявлены генитальные кондиломы, необходимо провести тщательное обследование родителей, опекунов и других лиц, осуществляющих уход за ребенком, на предмет аналогичных новообразований. Требуется выполнить ряд долгосрочных проспективных исследований из-за дефицита данных о промежутке времени элиминации инфекции из организма сексуально неактивного населения. Призыв к вакцинации девочек еще до вступления в половую жизнь с целью обеспечить защиту от онкогенного вируса, передающегося половым путем, может оказаться непрактичным решением в странах с низкими доходами, где превалирует неопределенность в отношении социальной приемлемости. Прежде чем создавать программы иммунизации любой популяции, необходимо преодолеть барьеры, препятствующие эффективной вакцинации населения, например, культурные и религиозные. По результатам недавнего исследования в Майсуре, Индия, индийские родители предпочитают выполнить курс вакцинации против ВПЧ у своих дочерей в старшем возрасте, так как у них отмечается позднее начало половой жизни по сравнению со сверстницами из развитых стран. Работники здравоохранения должны учитывать тот факт, что, несмотря на либерализацию экономической деятельности и половой морали в современном мире, большинство лиц из развивающихся стран следуют традиционным моральным ценностям и нормам. Повышение уровня осведомленности в отношении различных способов передачи вируса поможет сделать адекватный выбор родителей или опекунов «за» или «против» вакцинации их детей.
Значение клинических исследований В течение последних 10 лет был опубликован ряд исследований в отношении неполовых путей передачи инфекции среди детей и неполовоззрелых подростков. Неинвазивные допустимые с культурной точки зрения, образцы мочи облегчат проведение наблюдений в условиях ограниченных ресурсов. Сообщается о латентной форме ВПЧ-инфекции, активизирующейся при снижении иммунитета. Необходимо начать проспективные исследования среди детей и сексуально неактивного взрослого населения с ВПЧ-инфекцией, а далее провести долгосрочные когортные исследования.
|
Possible non-sexual modes of transmission of human papilloma virusAbstractAim There is strong evidence to suggest vertical and horizontal modes of transmission of human papilloma virus (HPV), an established etiologic agent of cervical cancer. Infants, children, and adults can acquire both high-risk and low-risk infections by birth or by close contact even though HPV is mainly transmitted sexually. A thorough review of the literature was performed to assess the possible non-sexual modes of transmission of HPV. Methods An electronic search of databases for review articles, cross-sectional studies, cohort studies, and case reports on non-sexual modes of transmission among sexually unexposed women and children was carried out using search terms such as “human papilloma virus, HPV, transmission, horizontal transmission, vertical transmission, and fomites”. Articles published between 1983 and 2015 were retrieved. Results Epidemiological and clinical data support various non-sexual modes of transmission especially at the time of birth and by close contact. Even though the role of fomites in the transmission of HPV is not well established, HPV-DNA positivity has been reported in transvaginal ultrasound probes and colposcopes after routine disinfection. Conclusion Awareness needs to be spread among the public about alternate modes of transmission. For a proper understanding of the exact natural history of HPV infection acquired via the non-sexual route, long-term prospective studies need to be undertaken. Introduction The papilloma viruses are small, non-enveloped icosahedral viruses with a double-stranded DNA genome. These viruses are species specific and infect the basal epithelial cells of the skin and mucous membranes, causing different types of warts and anogenital cancers. The International Committee on the Taxonomy of viruses (ICTV) has officially classified the papilloma viruses as a separate family of Papillomaviridae. Papillomaviruses have been classified further on the basis of the species of origin and the degree of genetic relatedness with other papillomaviruses infecting the same species. To date, the human papilloma viruses (HPV) have been classified into 170 types, and the characterization of new HPV types is ongoing. Epidemiological and molecular studies have established the strong association of HPV infection with cervical cancer. Worldwide, HPV-16 is the commonest type seen in invasive cervical cancer, followed by HPV-18. Almost 70% of invasive cervical cancers are associated with these two types. In epidemiological studies on cervical cancer from India, HPV positivity is as high as 98%. Cervical cancer is the commonest cancer in rural India, and almost one-fourth of the total cervical cancer cases worldwide are reported from India. Spontaneous resolution of high-risk HPV infection occurs in approximately 80% of cases in women. Most of the remaining 20% of infections develop into non-progressive cervical intra-epithelial neoplasia grade I (CIN-1), which regresses without any treatment. A minority of HPV infections persist and develop into CIN-II or CIN-III, and 5% of CIN lesions progress to cervical cancer if left unattended. Approximately 1% of high-risk infections develop into cervical cancer. Human papilloma virus infection is one of the most common sexually transmitted infections globally. Most of the studies on HPV infection are hospital based, focusing on sexually exposed women. The last two decades witnessed the use of non-invasive samples such as self-collected vaginal and urine samples to screen sexually unexposed women for genital HPV infection. The awareness of various alternate modes of transmission other than the sexual route has significance with regard to vaccination strategies, epidemiological studies and the clinical management of HPV-infected children and adolescents. The perception of possible non-sexual modes of transmission can facilitate the avoidance of investigative procedures in children and sexually unexposed adolescents. There are so many cultural issues and social stigmas in the minds of parents regarding a vaccine against a sexually transmitted infection for their unmarried daughters. A well-informed health-care worker can counsel effectively regarding the various alternate modes of transmission of this oncogenic virus. In this context, we reviewed the available literature on non-sexual modes of HPV transmission. Institutional ethical review board approval was not deemed necessary for the following retrospective review. All principles outlined in the Declaration of Helsinki were followed Methods A comprehensive literature search to identify all published studies between 1983 and 2015 on “non-sexual modes of transmission of HPV infection among asymptomatic women” was carried out. The electronic databases included in the search were PubMed-Medline, CINAHL, Scopus, and Google Scholar. The relevant articles in English involving human subjects were identified using search terms such as “human papilloma virus OR HPV AND transmission AND horizontal transmission AND vertical transmission AND fomites NOT men”. A library search for articles published in peer-reviewed journals was also performed. The articles pertaining to the sexual transmission of HPV, HPV infection among adult men, homosexual men, and immunocompromised persons were excluded. The studies conducted among sexually unexposed women and children were reviewed. Women bear the main brunt of the infection due to their reduced immunity and a greater possibility of persistence. From 1140 articles in English published since 1983, 33 articles relevant to the non-sexual modes of transmission of genital HPV among healthy women and children were retrieved for the final evaluation. This includes review articles, cohort studies, cross-sectional studies and case reports and all these studies confirmed HPV infection by molecular testing. Results Even though HPV is one of the most common sexually transmitted infections all over the world, vertical and horizontal routes also account for a significant proportion of infections. Earlier studies have established the vertical mode of transmission. Fewer studies, however, have been carried out among sexually unexposed adults, and further follow-up studies are required to understand the natural history of HPV infection when detected in infants and children. Literature search The study selection process is shown in Figure 1. For detailed evaluation, full-text articles of 46 studies were retrieved. Four studies in which polymerase chain reaction (PCR) was not used to diagnose HPV infection, two studies with no data on mothers and children, two studies in which mothers were not studied, and one study in which the children were not studied, were excluded. One study in which subjects were included after delivery was also excluded. Studies carried out in children with lichen planus of vulva and mothers with cervical cancer were not included in the final analysis. Another study from South Korea was excluded because the same cohort was studied and followed up earlier by Park et al. As shown in Table 1, 12 studies were reviewed in detail.
Vertical transmission Vertical transmission of HPV infection can occur from father or mother to the offspring. From the mother, the virus can be transmitted to the embryo, fetus or baby during pregnancy or childbirth. The infection can also occur at the time of fertilization via infected oocyte or spermatozoon. At present, there are no studies on HPV detection in oocytes, even though the virus has been detected in the seminal plasma and spermatozoa. The main mode of transmission from the mother to child occurs during pregnancy and at the time of delivery. There is a complete absence of information regarding the exact incubation period of HPV and the persistence of infection among congenitally infected neonates. Intrauterine transmission There is no viremic phase of HPV, and hematogenous spread from mother to fetus is unlikely. A fetus can become infected through the micro-tears in fetal membranes or through the placenta if the mother has genital HPV infection. The detection rates of HPV-DNA in placental samples have varied from 0% to 42.5% in normal pregnant women.[17] Fedrizzi et al. recently reported that HPV-DNA was 3.5-fold more frequent in the normal endometrial samples of smokers compared with non-smokers. A Finnish family study noted a threefold higher HPV prevalence in the placental samples of smokers compared with non-smokers. Perinatal transmission Most of the infections in newborns occur at the time of delivery. The concordance of type-specific HPV between mothers and newborns is suggestive of perinatal transmission. Perinatal transmission usually occurs from direct contact with the infected maternal genital tract or by ascending infection especially after premature rupture of membranes. In most of the studies, mothers were tested for genital HPV infection in the third trimester. In one recent study, healthy mothers were followed up in all three trimesters and then after delivery. In that study, the prevalence of HPV infection was lower in the last trimester than in the first two trimesters.[21] Genital HPV infection can lead to placental and cord blood positivity. There is a higher possibility of cord blood HPV detection when a mother has a history of genital warts. Women with genital warts often progress to persistent HPV infection, and there is a higher chance of intrauterine transmission to the fetus. Another study found a lower chance of perinatal transmission (approx. 2.8%) in the context of pregnant women with clinical and laboratory evidence of HPV infection. The concordance of HPV infection between the mother and infant is 39%, with a range of 0.2–73%.[12] In a study by Park et al., complete resolution of the infection in newborn babies occurred by 6 months of age.[13] The immunization of women prior to pregnancy is not recommended because the possibility of infection is lower, as per the epidemiological data.[12] The risk of infection in vaginal delivery is low, and cesarean section is not recommended if the pregnant woman is found to have genital HPV infection.[16] As per the systematic meta-analysis by Medeiros et al., the pooled relative risk (RR) of vertical transmission is 4.8. The possibility of the newborn testing positive for HPV is higher if the cord blood or placenta is positive for HPV-DNA. There are controversial results regarding the persistence of HPV infection in babies infected at birth. The persistence of infection acquired during birth is very rare among infants, and alternate modes of transmission by close contact or through fomites should be considered in children with HPV infection.[18] According to one prospective study by Rombaldi et al., infants with positive HPV-DNA in buccal samples tested negative by 6 months of life.[18] Another study reported vertically acquired HPV infections persisting for 2 years. The Finnish HPV family study followed up 76 families over 2 years, and an oral HPV infection rate of 7% was found at 1-year follow-up. The high-risk HPV (HR-HPV), mainly HPV-16, has been detected in the oral swabs from newborns, infants, and children. Bandyopadhyay et al. reported a clearance of infection by 1 year of age, among 10 infected infants followed up since birth.[16] As per the review article by LaCour and Trimble, newborns and infants can become infected with HR-HPV by both sexual and non-sexual routes. Transmission through breast milk Even though there are reports of isolation of HPV-DNA including high-risk types from breast milk and colostrum, there was no concordance between the HPV-DNA isolated from breast milk and that detected in the cervical or oral samples of the mothers. A recent study on 21 HPV-positive and 11 HPV-negative mothers by Mammas et al. failed to demonstrate high-risk HPV-DNA in breast milk. The restriction of breast-feeding is not advised if the mother is found to be infected with HPV. Horizontal modes of transmission Human papilloma virus can be transmitted horizontally among sexually unexposed adults and children by autoinoculation, heteroinoculation or via fomites.[20] HPV infection in the mothers at post-partum clinics can lead to infection in babies by close contact.[19] Auto- or heteroinoculation Human papilloma virus may be transmitted among the family members by kissing and digital contact. Adults with genital warts may transmit the genital HPV types to their sexual partners by finger–genital contact.[15] Non-penetrative sex or inoculation via fingers can infect the partner. Children acquire the infection from close family members and caregivers with hand warts during cleaning of the anogenital area and diaper changing.[11] Autoinoculation can also occur by scratching the genital area. Oral HPV infection plays an important role in the viral transmission between family members. The virus persists longer in the oral cavity than in the genital area in children, and the most prevalent types of oral infections are low-risk types, HPV-6 and -11. Even high-risk HPV-16 and -18 can be transmitted by autoinoculation.[8] Transmission through fomites According to the 1989 study by Ferenczy et al., HPV-DNA positivity in the hospital, surgical instruments and gloves is low after sterilization. Washing and soaking in 2% glutaraldehyde or heating to 100°C is sufficient for disinfection. The detection of HPV-DNA in asymptomatic individuals using sensitive assays alone does not mean infection, because the virus is ubiquitous. The HPV-DNA can be transmitted to the genital area via fomites. It is not possible, however, for children to become infected with HPV via swimming pools and the sharing of Western-style toilets at school or at home. A study conducted in Finland by Puranen et al. failed to detect HPV-DNA in the floors and seats of bathing resorts. According to another study by de Martino et al., HPV can be transmitted through infected towels or other objects. The role of fomites in the development of active infection is not well established. In gynecology clinics, transvaginal ultrasound probes and colposcopes can transmit the infection and most of the disinfectants are not sufficient to neutralize HPV. A recent study found that nosocomial infection may be possible in invasive procedures such as transvaginal ultrasonogram; and probes tested positive for HPV-DNA and free virions even after treating with exonucleases. Ultrasound probes have also been found to be positive for HPV-DNA after the use of low-level disinfectants such as quaternary ammonium compounds. HPV comes under the category of one of the most difficult agents to disinfect. Taking into consideration the established carcinogenic risk associated with this virus, health-care workers should review hospital disinfection practices. According to the Centers for Disease Control and Prevention recommendation, endovaginal ultrasound probes are classified as semi-critical devices. For proper disinfection, high-level disinfectants such as hydrogen peroxide, glutaraldehyde, peracetic acid or non-chemical alternatives such as ultraviolet C-band should be used to eliminate non-enveloped viruses. Sonicated hydrogen peroxide was found to be highly effective against HPV-16 and HPV-18 in a recent study on the efficacy of high-level disinfectants. Discussion Papilloma infection is commonly acquired through skin abrasions (skin warts), by sexual intercourse (genital warts), during passage through an infected birth canal (juvenile-onset laryngeal papilloma), autoinoculation or by oral sex. Oral papilloma can develop as a result of oral sex or autoinoculation. Oral HPV infection can, rarely, be a potential health hazard to newborn babies in the form of juvenile recurrent respiratory papillomatosis. At any age, transmission may occur via fomites and medical procedures, but transmission to the external genitalia through fomites is rare. The visible presence of genital warts can increase the chances of infection because 65% of people coming into contact with warts will develop the infection. The acquisition of infection can happen by prolonged exposure to contaminated clothing because the virus may be carried on fomites. Most of the studies have been carried out in children using anogenital samples or urine samples. All the articles we reviewed point towards the fact that the prevalence of sexual abuse is very low among children with genital warts. One important aspect that needs to be investigated is the persistence of genital HPV infection in babies and children. Long-term prospective studies are nearly impossible in developing countries due to limited resources and the huge population. Horizontal transmission via close contact plays a major role in HPV acquisition in children. HPV infection in sexually unexposed adults and children from developing countries goes unreported and undiagnosed given that most of the infections are diagnosed clinically. Often clinicians find it difficult to collect genital samples from sexually naïve individuals, and another impediment is the lack of facilities for molecular testing, which is expensive and technically demanding. Follow-up studies are essential among the sexually unexposed population to understand the possibility of persistence and further progression into invasive lesions. Urine sampling can be reliably used for the screening of genital HPV infection in both sexes. The detection of HPV-DNA in urine samples is an alternate cost-effective option for large population-based studies. Nevertheless, the presence of virus in urine may indicate concurrent infections at different susceptible sites such as vagina and vulva, especially among sexually exposed adults. HPV is highly tropic to the squamocolumnar junction of the cervix, with no predilection to the urinary tract. The presence of HPV-DNA in urine indicates exfoliation from the cervix, vagina, vulva or anus and urine contamination with exfoliated cervical cells increases with the severity of cervical lesions. Public health implications With intact host immunity, almost all the HPV infections acquired in infancy and childhood clear. When children present with genital warts, a thorough clinical examination should be carried out for similar-looking lesions in the guardians and caregivers. Long-term prospective studies are needed due to the scarcity of data on the time taken for the natural clearance of infection in the sexually naïve population. Advocating vaccination before sexual exposure in girls to protect them from an oncogenic sexually transmitted virus may not be a practical solution in low-income countries, and uncertainty prevails regarding the social acceptance. Prior to implementing health-care policies or immunization programs in any population, cultural and religious barriers have to be overcome. A recent study conducted in Mysore, India noted that Indian parents prefer vaccinating their daughters against HPV at a later age because there is a delay in the onset of sexual activity among young women compared with their counterparts from developed countries. Health-care professionals have to consider the fact that even in the era of economic and sexual liberalization, most of the individuals from developing countries follow traditional values and customs. Creating awareness in the community of various alternate modes of transmission, however, can enable the parents and guardians to make an informed choice regarding immunization of their children. Clinical and research implications The last 10 years have witnessed articles being published on non-sexual modes of transmission among children and sexually naïve adolescents. Non-invasive and culturally feasible, urine sampling will facilitate follow-up studies in resource-poor settings. There are reports of latent HPV infection becoming apparent when the immunity of the individual reduces. Prospective studies need to be initiated among children and sexually unexposed adults with HPV infection, and the cohort should be followed up in the long term.
|
ВПЧ (вирус папилломы человека) — симптомы, лечение
ВИРУС ПАПИЛЛОМЫ ЧЕЛОВЕКА
Папилломы и кондиломы представляют собой доброкачественные новообразования на слизистых половых органов, кожном покрове промежности и вокруг анального отверстия, а также в дыхательном тракте.
Причиной формирования папиллом являются вирусы папилломы человека (ВПЧ). На сегодняшний день известно более 120 типов ВПЧ.
Папилломавирусная инфекция является одной из самых распространённых вирусных заболеваний.
Отдельные виды ВПЧ не наносят вреда организму человека, однако некоторые способны вызвать разнообразные злокачественные опухоли, которые возникают из клеток эпителия и прежде всего в области гениталий:
· Злокачественная опухоль, которая развивается на слизистой шейки матки (онкология шейки матки) у женщин.
· Предраковые и патологические видоизменения шейки матки (так называемые видоизменения клеток шейки матки, которые несут риск развития и трансформации в злокачественную опухоль).
· Злокачественная опухоль женских наружных половых органов (рак вульвы и влагалища).
· Кондиломы (бородавки) в области гениталий у женского и мужского населения.
В настоящее время наблюдается рост онкологической заболеваемости. Несмотря на доступность диагностических исследований, рак шейки матки занимает второе место в мире среди злокачественных опухолей репродуктивных органов у женщин и уступает только раку молочной железы.
Как передаётся и распространяется вирус папилломы человека?
- При несоблюдении правил личной гигиены. Когда одними и теми же вещами пользуются несколько человек. Например, полотенце и одежда(нижнее бельё).
- При посещении мест общественного пользования. Это могут быть бани, сауны, бассейны, спортивные клубы.
- При контакте с носителем вируса. Определёнными штаммами вируса можно заразиться даже при рукопожатии. Что говорить о близких связях. Если в семье есть носитель ВПЧ, то вероятность того, что остальные члены семьи заражены очень высокая.
- Вертикальный путь передачи. Частота передачи ВПЧ от матери плоду разнится весьма существенно – от 4 до 87%. Наиболее вероятна восходящая ВПЧ – инфекция околоплодных вод и плаценты.
- Самозаражение. Перенос вируса с одного участка тела на другой во время удаления волос или бритья.
Риску инфицированием ВПЧ подвержены больше всего люди в возрасте от 16 до 20 лет. При хроническом течении заболевания способствовует развитию предракового состояния, а в последующем (через 20-30 лет) перейти в рак.
Факторы риска инфицирования ВПЧ:
· раннее начало половой жизни,
· наличие большого числа и частая смена половых партнёров,
· высокая распространённость инфекций, передаваемых половым путём,
· молодой возраст,
· курение, алкоголь,
· беременность,
· эндометриоз,
· эндогенные факторы (авитаминоз, изменение иммунного статуса).
Симптомы заболевания.
Одним из самых ярких проявлений ВПЧ являются остроконечные кондиломы. Это сосцевидные образования розового цвета, чаще они светлее слизистой, но иногда имеют более яркий цвет.
Симптомы вируса папилломы человека у мужчин могут отличаться от обнаруживаемых симптомов у женщин. Это обусловлено различием в строении их репродуктивных органов.
ВПЧ у женщин, поражает слизистую шейки матки, иногда полипы могут образовываться и в полости матки.
У мужчин чаще поражает кожу перианальной области и слизистую прямой кишки. Именно в этих областях, наблюдается развитие остроконечных кондилом, а они нередко приводят к плоскоклеточному раку прямой кишки.
Методы диагностики:
· осмотр пациента,
· кольпоскопия,
· цитология мазка из шейки матки,
· гистология ткани,
· ПЦР.
Лечение вируса папилломы человека.
Существует 2 основных направления:
· Ликвидация вируса из организма человека. Для этого применяются различные противовирусные, иммуномодулирующие средства.
· Коррекция косметических дефектов. Для этого применяются различные методы удаления папиллом: жидким азотом, коагулятором, лазером и др.
Профилактика.
Неспецифическая профилактика, это соблюдение личной гигиены, правил поведения в общественных местах, повышение общего иммунитета и необходимость избегать беспорядочных половых контактов.
Специфическая профилактика, это вакцины!
В мире выпускается два типа вакцин. Одна вакцина — четырёхвалентная, то есть защищает от инфицирования четырьмя типами ВПЧ – 6, 11, 16 и 18. А вторая вакцина – бивалентная, и защищает только от двух типов ВПЧ – 16 и 18. Четырехвалентная вакцина против папилломы человека называется Гардасил, и выпускается голландской фармацевтической фирмой «MSD — Мерк Шарп и Дому Б.В.», а двухвалентная, производится в Бельгии компанией «GlaxoSmithKline Biologicals» и имеет наименование Церварикс.
На сегодняшний день вакцины против папилломы человека можно использовать и для мальчиков, и для девочек.
Благодаря эффектам от вакцинации, удается предотвратить развитие рака в 90 – 95% случаев.
ДНК папилломавируса (Human Papillomavirus, ВПЧ) 16 типа в Москве недорого
Забор урогенитальных мазков у лиц, не достигших 18 летнего возраста, не производится. У беременных женщин производится только по адресу: ул. Новослободская, д. 14/19 стр.1
Внимание! Стоимость анализа указана для каждой отдельно взятой локализации.
Вирус папилломы человека (ВПЧ) развивается в клетках эпителия шейки матки, изменяя их, это может привести к эпителиальной дисплазии и возникновению рака шейки матки.
Два типа ВПЧ (16 и 18) вызывают 70% всех случаев рака шейки матки и предраковых патологических состояний шейки матки — они относятся к вирусам папилломы высокого канцерогенного риска (ВПЧ ВКР). Мужчина может быть носителем вируса папилломы человека 16 типа, при половом контакте он может передать его женщине, у которой при соответствующей предрасположенности иммунной системы вирус может начать развиваться в клетках шейки матки.
Результат выдается в качественном формате (обнаружено или не обнаружено)
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К ИССЛЕДОВАНИЮ УРОГЕНИТАЛЬНЫХ МАЗКОВ У ЖЕНЩИН
Необходимо соблюдать общие рекомендации:
- за сутки до взятия биоматериала воздержаться от половых контактов;
- исследования можно проводить до или не ранее, чем через сутки после мануального исследования, кольпоскопии, ультразвукового исследования с использованием влагалищного датчика;
- рекомендуется не мочиться в течение 2–3 часов до получения биоматериала из уретры.
Исследование отделяемого урогенитального тракта не проводится во время менструации. Повторное исследование возможно не ранее, чем через неделю.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К ИССЛЕДОВАНИЮ УРОГЕНИТАЛЬНЫХ МАЗКОВ У МУЖЧИН
Необходимо воздержаться от половых контактов в течение 2–3 дней до исследования. Рекомендуется не мочиться в течение 2–3 часов до исследования. Повторное исследование возможно не ранее, чем через неделю.
Информация о вирусе папилломы человека (ВПЧ)
Что такое ВПЧ?
ВПЧ — инфекция, передающаяся половым путем. ВПЧ расшифровывается как вирус папилломы человека. Это очень распространено. У многих людей нет никаких симптомов, и инфекция может пройти сама по себе. Но некоторые типы ВПЧ могут привести к раку шейки матки, раку головы и шеи или раку заднего прохода или полового члена.
ВПЧ — это не просто вирус. Существует более 100 видов, и некоторые из них более опасны, чем другие.
Типы ВПЧ
Каждый вирус папилломы человека имеет свой номер или тип.Термин «папиллома» относится к разновидности бородавок, возникающих в результате некоторых типов ВПЧ.
ВПЧ живет в тонких плоских клетках, называемых эпителиальными клетками. Они находятся на поверхности кожи. Они также находятся на поверхности влагалища, ануса, вульвы, шейки матки и головки полового члена. Их также можно найти во рту и в горле.
Около 60 из 100 типов ВПЧ вызывают бородавки на таких участках, как руки или ноги. Остальные 40 или около того попадают в тело во время полового контакта. Они притягиваются к слизистым оболочкам тела, например к влажным слоям вокруг ануса и гениталий.
Не все из 40 вирусов папилломы человека, передающихся половым путем, вызывают серьезные проблемы со здоровьем.
Высокий риск
Штаммы ВПЧ высокого риска включают ВПЧ 16 и 18, которые вызывают около 70% случаев рака шейки матки. Другие вирусы папилломы человека высокого риска включают 31, 33, 45, 52, 58 и некоторые другие.
Штаммы ВПЧ низкого риска, такие как ВПЧ 6 и 11, вызывают около 90% остроконечных кондилом, которые редко перерастают в рак. Эти наросты могут выглядеть как шишки. Иногда они имеют форму цветной капусты.Бородавки могут появиться через несколько недель или месяцев после полового акта с инфицированным партнером.
Низкий риск
Штаммы ВПЧ низкого риска, такие как ВПЧ 6 и 11, вызывают около 90% остроконечных кондилом, которые редко перерастают в рак. Эти наросты могут выглядеть как шишки. Иногда они имеют форму цветной капусты. Бородавки могут появиться через несколько недель или месяцев после полового акта с инфицированным партнером.
Симптомы ВПЧ
Часто инфекции ВПЧ не вызывают никаких симптомов, и организм избавляется от инфекции самостоятельно через несколько лет.Многие люди никогда не узнают, что они инфицированы ВПЧ.
Но иногда инфекция ВПЧ высокого риска длится дольше. Это может вызвать изменения в клетках шейки матки, которые могут привести к раку, включая рак вульвы. То же самое может вызвать аномальные изменения клеток полового члена и ануса, но это случается редко.
Симптомами инфекции ВПЧ низкого риска являются бородавки. Тип бородавок будет зависеть от того, какой у вас тип ВПЧ.
- Остроконечные кондиломы. Это либо плоские пятна, либо неровности. У женщин они обычно растут на вульве, но также могут появляться на заднем проходе, шейке матки или влагалище. Мужчины получают их на половом члене, мошонке или анусе.
- Бородавки обыкновенные. Эти грубые неровности обычно появляются на руках и пальцах.
- Подошвенные бородавки. Подошвенные бородавки — это твердые, зернистые, болезненные бугорки, поражающие ступни.
- Плоские бородавки. Это слегка приподнятые пятна с плоской вершиной.Их можно достать где угодно, но они часто встречаются на лице и ногах.
Причины и факторы риска ВПЧ
Вирус папилломы человека заражает вас, попадая в ваше тело через порез, царапину или разрыв на коже. Вы получаете его при контакте кожа к коже, вагинальном, анальном или оральном сексе. Вы можете передать ВПЧ своему ребенку, если у вас есть остроконечные кондиломы во время беременности. В редких случаях это может вызвать доброкачественный рост голосового аппарата ребенка (гортани).
Бородавки заразны.Вы можете получить их, прикоснувшись к чужой бородавке или прикоснувшись к поверхности, которая соприкасалась с ней.
Некоторые факторы повышают ваши шансы заразиться ВПЧ. К ним относятся:
- Поврежденная кожа. На участках кожи, которые сильно порезались или имеют отверстия, с большей вероятностью могут появиться обычные бородавки.
- Прямой контакт. Если вы прикоснетесь к чьим-либо бородавкам или прикоснетесь к поверхностям, которых коснулись бородавки, вы можете заразиться ВПЧ.
- Количество половых партнеров. Чем больше у вас сексуальных партнеров, тем выше риск заражения ВПЧ. Если вы занимаетесь сексом с кем-то, у кого много партнеров, это тоже увеличивает ваш риск.
- Возраст. У детей больше шансов получить обычные бородавки. Остроконечные кондиломы чаще встречаются у подростков и молодых людей.
- Слабая иммунная система. Если у вас есть такое заболевание, как ВИЧ или СПИД, или вы принимаете лечение, ослабляющее вашу иммунную систему, у вас больше шансов заразиться ВПЧ.
Диагностика ВПЧ
Ваш врач может определить, что у вас ВПЧ, просто осмотрев ваши бородавки.Но есть также несколько тестов, которые они могут использовать, если у вас нет видимых симптомов.
- Тест раствора уксуса. В этом тесте используется раствор уксуса (уксусной кислоты). Ваш врач наносит его на область ваших гениталий. Если у вас есть поражения в этой области, они станут белыми.
- Пап-тест. Ваш врач использует мазок для взятия образцов из шейки матки или влагалища. Они отправляют образцы в лабораторию, чтобы узнать, есть ли у вас аномальные клетки. Аномальные клетки могут привести к раку.
- ДНК-тест. Если вы женщина старше 30 лет, ваш врач может порекомендовать этот тест вместе с тестом Папаниколау. Они изучают ДНК клеток шейки матки, чтобы определить, есть ли у вас тип ВПЧ, который может привести к раку.
Лечение ВПЧ
Бородавки могут исчезнуть без лечения, особенно у детей. Но есть и лекарства, которые их лечат, в том числе:
- Салициловая кислота. Вы наносите лечение этим ингредиентом прямо на бородавку. Они уничтожают бородавку по одному слою.Не используйте его на лице.
- Имиквимод. Это рецептурный крем, который помогает вашей иммунной системе избавиться от ВПЧ. Это может вызвать покраснение и припухлость в области нанесения.
- Podofilox. Вы наносите этот гель непосредственно на остроконечные кондиломы, чтобы разрушить их ткань. Вы можете почувствовать жжение и зуд.
Трихлоруксусная кислота. Это сожжет бородавки на ладонях, подошвах ног и гениталиях. Это может вызвать раздражение кожи.
Обычно врач сначала порекомендует лекарство. Если это не сработает, они могут удалить их с помощью:
- Криотерапия (замораживание жидким азотом)
- Электрокаутеризация (сжигание электрическим током)
- Хирургия
- Лазерная хирургия (использование интенсивного света для уничтожения бородавок и аномальных клеток. )
В отношении ВПЧ на шейке матки ваш врач может использовать процедуру, называемую кольпоскопией, чтобы найти и удалить клетки, которые выглядят ненормально. Они будут использовать инструмент, называемый кольпоскопом, чтобы увеличить шейку матки и взять образцы (биопсию) из этих областей.
Чтобы удалить любые предраковые клетки на шейке матки, ваш врач может использовать:
- Процедура электрохирургического удаления петли (LEEP). Используется тонкая проволочная петля с электрическим током для удаления слоя ткани шейки матки.
- Конизация холодным ножом (коническая биопсия). Врач удаляет конусообразный кусок ткани из шейки матки и отправляет его в лабораторию для поиска аномальных клеток.
- Криохирургия. Ваш врач использует сильный холод для разрушения аномальных тканей.
- Хирургия
- Лазерная хирургия
Нет никаких одобренных FDA тестов для выявления вызванных ВПЧ клеточных изменений в анусе, половом члене, голове и шее. Но мазок Папаниколау для ануса может помочь вашему врачу увидеть ранние клеточные изменения или предраковые клетки. Ваш врач может посоветовать вам получить его, если вы относитесь к категории высокого риска по ВПЧ.
Осложнения ВПЧ
Когда ВПЧ не проходит, это может привести к другим проблемам. Некоторые инфекции ВПЧ вызывают поражения или аномальные участки на языке, миндалинах, мягком небе, в носу или гортани.
ВПЧ также может вызывать рак. Определенные штаммы ВПЧ могут вызывать рак:
- Гениталии
- Анус
- Рот и верхние дыхательные пути
Профилактика ВПЧ
Вы можете заразиться ВПЧ половым путем (вагинальным, анальным или оральным). Он распространяется через контакт кожи с кожей.
ВПЧ может инфицировать кожу, обычно не покрытую презервативом, поэтому его использование не защитит вас полностью.
Вы не можете заразиться ВПЧ через сиденье унитаза, бассейны или через кровь инфицированного человека.
Единственный способ избежать любого риска заражения ВПЧ — это никогда не быть сексуально активным — вагинальным, анальным или оральным сексом.
Чтобы снизить риск, вы также можете ограничить количество половых партнеров. И вы можете выбирать партнеров, у которых до вас было мало или совсем не было половых партнеров.
Три вакцины — Церварикс, Гардасил и Гардасил-9 — защищают от ВПЧ. Они доступны мальчикам и девочкам в возрасте от 9 лет и взрослым в возрасте до 26 лет.
Вакцины предназначены для лечения некоторых типов ВПЧ с повышенным риском.Все три защищают от ВПЧ 16 и 18. Гардасил и Гардасил-9 также эффективны против ВПЧ 6 и 11, которые вызывают большинство остроконечных кондилом. Гардасил-9 также защищает от штаммов высокого риска 31, 33, 45, 52 и 58.
Хотя вы не можете полностью избежать инфекций ВПЧ низкого риска, которые вызывают обычные или подошвенные бородавки, вы можете снизить свои шансы, если вы:
- Не трогайте уже имеющиеся у вас бородавки.
- Не грызите ногти.
- Носите обувь или сандалии в раздевалках или общественных бассейнах.
Штаммы ВПЧ | Только малое число вызывает проблемы
Штаммы вируса папилломы человека (ВПЧ)
Вирусы папилломы человека (ВПЧ) — чрезвычайно распространенные ДНК-вирусы, которые инфицируют только людей.
Папиллома — это слово, обозначающее небольшой бородавчатый нарост на коже или слизистой оболочке. Существует много типов вирусов папилломы — даже некоторые из них могут заразиться вашим питомцем. Например, собаки заражаются папилломавирусами собак. Итак, если вы задаетесь вопросом: «Можно ли заразиться ВПЧ от животных?» ответ — нет.ВПЧ — это только кожная инфекция человека.
ВПЧ считается самой распространенной инфекцией, передаваемой половым путем (ИППП) в мире. Почти каждый человек в какой-то момент своей жизни будет болен ВПЧ.
Существует более 150 типов ВПЧ, которые живут в организме, и только небольшое количество типов (например, ВПЧ высокого риска) вызывают проблемы, изменяя клетки с нормальных на аномальные.
ВПЧ поражают клетки кожи. Инфекция ВПЧ низкого риска может вызвать появление наружных остроконечных кондилом. ВПЧ низкого риска (lrHPV) — ВПЧ 6 и ВПЧ 11 вызывают примерно 90% остроконечных кондилом и редко связаны с предраком или раком нижних отделов половых путей.
Бородавки на других частях тела, например на руках, вызываются различными типами ВПЧ. Контакт с этими бородавками, по-видимому, не вызывает генитальных бородавок ВПЧ.
Инфекция, вызываемая типами ВПЧ высокого риска (ВПЧ), которые не устраняются иммунной системой, может вызывать рак шейки матки и значительную долю рака заднего прохода, ротоглотки, влагалища, вульвы и полового члена. На развитие рака ВПЧ уходит много лет.
К 14 наиболее канцерогенным типам ВПЧ относятся типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68.Типы 16 и ВПЧ 18 чаще всего связаны с развитием рака, вместе составляя около 70% инвазивного рака шейки матки. Однако не все инфекции, вызванные ВПЧ 16 или 18, действительно приводят к раку. Кроме того, ВПЧ 16 тесно связан с раком анального канала и раком горла.
Текущие исследования показывают, что ВПЧ высокого риска изменяет хозяйскую (человеческую) клетку, но для ее роста необходимы дополнительные триггеры, чтобы вызвать рак.
Большинство инфекций ВПЧ носят временный характер и, как считается, проходят естественным путем, прежде чем вызовут какие-либо проблемы со здоровьем.
Инфекция, вызванная вирусом папилломы человека (ВПЧ) ротоглотки
Обзор
Что такое вирус папилломы человека (ВПЧ)?
ВПЧ — вирус, передающийся половым путем. Существует более 150 подтипов ВПЧ, которые могут инфицировать половые органы и горло (ротоглоточный ВПЧ).
Насколько распространена инфекция горла, вызванная вирусом папилломы человека (ВПЧ) ротоглотки?
Недавнее исследование показало, что 7 процентов американцев в возрасте от 14 до 69 лет инфицированы ротоглоточным ВПЧ.В том же исследовании было обнаружено, что за последние три десятилетия распространенность значительно увеличилась и что ротоглоточная инфекция ВПЧ встречается у мужчин больше, чем у женщин.
Наиболее частым выявляемым подтипом ротоглоточного ВПЧ является ВПЧ-16, подтип ВПЧ высокого риска для рака ротоглотки (горла). Примерно 2/3 случаев рака ротоглотки содержат ДНК ВПЧ. Заражение ВПЧ-16 встречается примерно у 1 процента мужчин и женщин.
Как происходит заражение вирусом папилломы человека (ВПЧ) ротоглотки?
Имеющиеся данные убедительно свидетельствуют о том, что ВПЧ ротоглотки преимущественно передается половым путем.Предполагается, что рост орального секса является причиной увеличения распространенности ротоглоточной инфекции ВПЧ, хотя некоторые виды сексуального поведения, по-видимому, связаны с распространенностью ВПЧ.
Риск заражения возрастает с увеличением числа пожизненных или недавних половых партнеров для любого типа сексуального поведения (вагинальный секс, оральный секс). При наличии 20 или более половых партнеров в течение жизни распространенность ротоглоточной инфекции ВПЧ достигает 20 процентов. Курильщики также подвергаются большему риску, чем некурящие, причем особенно высокому риску подвергаются нынешние заядлые курильщики.
Симптомы и причины
Каковы признаки и симптомы инфекции, вызванной вирусом папилломы человека (ВПЧ) ротоглотки?
Большинство людей с ротоглоточной инфекцией ВПЧ не имеют симптомов и поэтому не осознают, что инфицированы и могут передать вирус партнеру.
Каковы последствия инфицирования вирусом папилломы человека (ВПЧ) ротоглотки?
Инфекция тонзиллярного ВПЧ может вызвать рак ротоглотки. Увеличение заболеваемости раком ротоглотки происходило параллельно с увеличением распространенности инфекции ВПЧ миндалин.Однако у подавляющего большинства людей с инфекциями ВПЧ миндалин не развивается рак, потому что подтипы ВПЧ, которыми они инфицированы, не связаны с развитием рака. Хотя у миллионов американцев есть тонзиллярный ВПЧ, менее 15 000 ежегодно заболевают ВПЧ-положительным раком ротоглотки.
Некоторые виды рака ротоглотки связаны не с инфекцией ВПЧ, а с употреблением табака и алкоголя. Люди с ВПЧ-положительным раком ротоглотки, как правило, моложе и реже курят и пьют.
Существуют ли какие-либо признаки, специфичные для рака ротоглотки, положительного по отношению к вирусу папилломы человека (ВПЧ)?
Первым признаком часто бывает затруднение глотания. Другие знаки:
- Кашель с кровью
- Шишка на шее или в щеке
- Не проходящая охриплость
К сожалению, это поздние признаки болезни.
Другие потенциальные признаки и симптомы рака полости рта:
- Боль в горле
- Белое или красное пятно на миндалинах
- Боль или отек челюсти
- Проблемы с глотанием, новый
Эти признаки не обязательно означают, что у вас рак, но если какие-либо признаки присутствуют дольше двух недель, вам следует обратиться к врачу.
Диагностика и тесты
Как обнаруживается инфекция, вызванная вирусом папилломы человека (ВПЧ) ротоглотки?
Не существует теста, который может обнаружить ранние признаки ВПЧ-инфекции горла. Некоторые раковые или предраковые поражения ВПЧ ротоглотки могут быть обнаружены во время скрининга или осмотра стоматологом или врачом, но большинство из них обнаруживается путем тестирования у людей, у которых уже есть признаки или симптомы.
Для осмотра труднодоступных участков горла, гортани (голосового аппарата) и основания языка врачи могут использовать небольшие зеркала.Для некоторых структур в горле, которые нельзя легко увидеть с помощью зеркала, гибкие ларингоскопы и фарингоскопы могут проникать глубже, чтобы врач мог их увидеть напрямую.
Врач может провести биопсию участков, подозрительных на рак. Биопсия — это небольшой образец клеток, взятый с помощью тонкой полой иглы или щипцов. Затем клетки просматривают под микроскопом, чтобы найти признаки рака. Образцы биопсии от рака горла могут быть проверены на наличие ДНК ВПЧ.Присутствие ДНК ВПЧ сигнализирует о том, что рак лучше поддается лечению, чем рак, отрицательный по ВПЧ.
Ведение и лечение
Как лечится рак, положительный по отношению к вирусу папилломы человека (ВПЧ) ротоглотки?
Лечение по выбору — либо химиотерапия, либо лучевая терапия, либо хирургическое вмешательство с последующей лучевой терапией с добавлением химиотерапии или без нее. Лучевая терапия включает в себя доставку высоких уровней радиации для уничтожения раковых клеток или предотвращения их роста и деления.Химиотерапия — это лечение рака, которое чаще всего используется для описания лекарств, убивающих раковые клетки, и обычно вводится внутривенно.
После операции по удалению рака ротоглотки может потребоваться дополнительная операция для восстановления частей ротовой полости, которые были удалены в ходе лечения.
Профилактика
Можно ли предотвратить инфицирование вирусом папилломы человека (ВПЧ) ротоглотки?
Единственный верный способ предотвратить это — воздержаться от секса. Были разработаны вакцины, снижающие риск заражения подтипами ВПЧ, которые, как известно, вызывают рак шейки матки, хотя их влияние на предотвращение рака ротоглотки, связанного с теми же подтипами ВПЧ, неизвестно.Эти вакцины являются профилактическими в том смысле, что они могут предотвратить инфекцию ВПЧ (они не лечат уже существующую инфекцию), и поэтому рекомендуются до того, как человек вступит в половую жизнь. Теперь у вашего врача можно получить несколько вакцин.
Центры по контролю и профилактике заболеваний (CDC) рекомендуют, чтобы все девочки в возрасте 11 или 12 лет получали вакцину против ВПЧ для защиты от рака шейки матки, а также вакцинировать женщин в возрасте от 13 до 26 лет, если они не получили ВПЧ. вакцина, когда они были моложе.
CDC также рекомендует вакцину против ВПЧ всем мальчикам в возрасте 11 или 12 лет, а также мальчикам в возрасте от 13 до 21 года, которые не получали вакцину в молодом возрасте. Все мужчины могут получить вакцину до 26 лет. Вакцина против ВПЧ также рекомендуется всем мужчинам, имеющим половые контакты с мужчинами и мужчинами с ослабленной иммунной системой до 26 лет (если они не были вакцинированы в более молодом возрасте).
Поговорите со своим врачом, чтобы узнать, подходит ли вам вакцинация и какая вакцина лучше всего подходит для вас.
Перспективы / Прогноз
Каков прогноз рака ротоглотки, положительный для вируса папилломы человека (ВПЧ)?
К счастью, ВПЧ-положительный рак ротоглотки имеет лучшие результаты и имеет меньше рецидивов после лечения, чем ВПЧ-отрицательный рак. У пациентов с раком ротоглотки, получавших лучевую и химиотерапию, выживаемость была больше у пациентов с ВПЧ-положительными опухолями по сравнению с ВПЧ-отрицательными опухолями.
Вирус папилломы 16 + 18
Вирус папилломы человека (ВПЧ) — наиболее распространенная вирусная инфекция репродуктивного тракта.Большинство сексуально активных женщин и мужчин будут инфицированы в какой-то момент своей жизни, а некоторые могут заразиться повторно.
Вирусы папилломы человека (ВПЧ) представляют собой небольшие вирусы с двухцепочечной ДНК, относящиеся к семейству Papillomaviridae. Эти вирусы инфицируют эпителиальные клетки кожи или слизистых оболочек, поэтому вирусную ДНК можно обнаружить в образцах кожи, ротовой полости и аногенитальной области из всех популяций человека. В настоящее время более 200 типов ВПЧ полностью охарактеризованы и преимущественно отнесены к трем родам: Alphapapillomavirus, Betapapillomavirus и
Gammapapillomavirus.Среди 65 типов ВПЧ, принадлежащих к альфа-папилломавирусу (типы альфа-ВПЧ), ограниченный набор вирусов, 15 генотипов высокого риска (ВПЧ-16, 18, 31, 33, 35, 39, 45, 51, 52, 56 , 58, 59, 66, 68 и 82) считаются онкогенными и связаны с развитием рака шейки матки и его предшественников.
ВПЧ передается при интимном контакте кожа к коже, чаще всего при вагинальном, анальном или оральном сексе с носителем вируса. Почти все мужчины и женщины заражаются им в какой-то момент своей жизни, потому что этот вирус может передаваться, даже если у инфицированного человека нет никаких признаков или симптомов.Фактически, у вас могут развиться симптомы спустя годы после заражения, что затрудняет определение того, когда вы впервые заразились. Большинство инфекций ВПЧ не вызывают симптомов или болезней и проходят спонтанно. Но когда ВПЧ не исчезает, он может вызвать проблемы со здоровьем, такие как остроконечные кондиломы, респираторный папилломатоз, рак шейки матки, аногенитальный и ротоглоточный рак.
Рак шейки матки является четвертым по распространенности раком среди женщин во всем мире и имеет особое значение в развивающихся странах из-за отсутствия надлежащих программ скрининга на рак шейки матки.В частности, определенные типы ВПЧ (16 и 18) наиболее часто могут приводить к предраковым поражениям. Мужчины и женщины могут получить рак ротовой полости / горла и ануса / прямой кишки, вызванный инфекциями ВПЧ. У мужчин также может развиться рак полового члена. У женщин инфекция ВПЧ может вызвать рак шейки матки, влагалища и вульвы. В настоящее время существуют вакцины, которые могут предотвратить заражение типами ВПЧ, которые чаще всего вызывают рак.
Для обнаружения ВПЧ в образцах кожи, ротовой полости и аногенитальных пробах (в основном, соскобах шейки матки и биопсийном материале) было разработано множество диагностических методов разной чувствительности и специфичности.Поскольку HPV не может быть эффективно культивирован, а клинические результаты серологических анализов плохие, диагностика HPV-инфекции почти полностью основана на молекулярных методах. В настоящее время ПЦР в реальном времени обеспечивает высокую чувствительность и может выполняться с различными типами образцов.
Вирус папилломы человека типа 16 — обзор
1.3.3 Контроль экспрессии
foxm1 онкопротеинами небольших ДНК опухолевых вирусовHPV16 (семейство Papillomaviridae ), аденовируса ( Adenoviridae (семейство ) и SV Polyomaviridae ) представляют собой небольшие ДНК-опухолевые вирусы (Butel, 2000; Howley, Livingston, 2009; Javier and Butel, 2008; Klein, 2002; Levine, 1994; McLaughlin-Drubin and Münger, 2008; Talbot and Crawford, 2004).Поскольку родственные им онкопротеины E7, E1A и большой T каждый инактивируют ключевой супрессор опухоли RB (Ahuja et al., 2005; Ali and DeCaprio, 2001; Ben-Israel and Kleinberger, 2002; Blanchette and Branton, 2009; Caracciolo et al. , 2006; Chakrabarti and Krishna, 2003; Cheng et al., 2009; Chinnadurai, 2011; Cress and Nevins, 1996; D’Abramo and Archambault, 2011; DeCaprio, 2009; Duensing and Münger, 2004; Duensing et al., 2009 ; Endter, Dobner, 2004; Fehrmann, Laimins, 2003; Felsani et al., 2006; Ferrari et al., 2009; Фриш и Мымрик, 2002; Галлимор и Тернелл, 2001; Гангули и Парихар, 2009; Ghittoni et al., 2010; Хамид и др., 2009; Хелт и Галлоуэй, 2003; Янсен-Дюрр, 1996; Джонс и Мюнгер, 1996; Клингельхуц и Роман, 2012; Korzeniewski et al., 2011; Lavia et al., 2003; Ли и Чо, 2002; Lehoux et al., 2009; Лю и Марморштейн, 2006; Лизано и др., 2009; Лонгворт и Лайминс, 2004; Маккэнс, 2005; Маклафлин-Друбин и Мюнгер, 2009a, b; Моенс и др., 2007; Муди и Лайминс, 2010; Мюнгер, 2003; Мюнгер и Хоули, 2002; Münger et al., 2001, 2004; Нарисава-Сайто и Киёно, 2007 г .; О’Ши, 2005а, б; Пагги и др., 2003; Пелка и др., 2008; Пим и Бэнкс, 2010; Пипас, 2009; Позник, 2009; Рандоу и Ленер, 2009; Саенс-Роблес и Пипас, 2009 г .; Саенс-Роблес и др., 2001; Санг и др., 2002; Шеффнер и Уитакер, 2003; Салливан и Пипас, 2002; Tan et al., 2012; Vousden, 1995; Вайнберг, 1997; Белый и Халили, 2004, 2006; Уайз-Дрейпер и Уэллс, 2008; Югава и Киёно, 2009 г .; Zwerschke and Jansen-Dürr, 2000) и начиная с RB, где in vivo занимает промотор foxm1 (Millour et al., 2011; Wang et al., 2007b, 2008c), репрессирует экспрессию мРНК и белка прямого гена-мишени E2F foxm1 (рис. 6.2) (Dean et al., 2012; Markey et al., 2007), можно предположить, что E7, E1A и большой T вызывают сверхэкспрессию FOXM1 посредством инактивации RB. Кроме того, большой T SV40 инактивирует ключевой опухолевый супрессор p53 (Ahuja et al., 2005; Ali and DeCaprio, 2001; Cheng et al., 2009; Levine, 2009; Liu and Marmorstein, 2006; Moens et al., 2007; О’Ши и Фрид, 2005; Пипас, 2009; Пипас, Левин, 2001; Саенс-Роблес, Пипас, 2009; Саенс-Роблес и др., 2001; Салливан и Пипас, 2002; White and Khalili, 2004), который in vivo занимает (Kurinna et al., 2013) и репрессирует (Chen et al., 2013b; Millour et al., 2011) промотор foxm1 и подавляет активность foxm1 уровни мРНК и белка (Barsotti, Prives, 2009; Bellelli et al., 2012; Bhonde et al., 2006; Chen et al., 2013b; Lok et al., 2011; Millour et al., 2011; Pandit et al. , 2009; Qu et al., 2013; Rovillain et al., 2011; Spurgers et al., 2006), так что большой T SV40 может также достигать сверхэкспрессии FOXM1 посредством инактивации p53.
Напротив, уровень мРНК foxm1 был снижен белком репликации вируса E2 HPV18 (рис. 6.2) (Thierry et al., 2004), еще одного HPV высокого риска, который может привести к раку шейки матки (zur Hausen, 2002).
Вирус папилломы человека (ВПЧ): основы практики, история вопроса, патофизиология
[Рекомендации] Комитет ACOG по практическим бюллетеням — гинекология. Бюллетень практики ACOG No. 109: Цитологический скрининг шейки матки. Акушерский гинекол . 2009 декабрь114 (6): 1409-20. [Медлайн].
Санчес-Алеман, Массачусетс, Урибе-Салас, Ф. Дж., Ласкано-Понсе, ЕС, Конде-Глез, К. Дж. Заболеваемость вирусом папилломы человека и факторы риска среди мексиканских студенток колледжей. Секс Трансмиссия . 2011 Апрель 38 (4): 275-8. [Медлайн].
Castle PE, Rodriguez AC, Burk RD, et al. Длительное сохранение широко выявленных инфекций, вызванных вирусом папилломы человека, при отсутствии выявляемых предраков и рака шейки матки. J Заразить Dis .2011 15 марта. 203 (6): 814-22. [Медлайн]. [Полный текст].
Джулиано А.Р., Ли Дж. Х., Фулп В. и др. Заболеваемость и исчезновение генитальной инфекции папилломы человека у мужчин (HIM): когортное исследование. Ланцет . 2011 12 марта. 377 (9769): 932-40. [Медлайн]. [Полный текст].
Чатурведи А.К., Катки Н.А., Хильдесхайм А. и др. Инфекция, вызванная вирусом папилломы человека, разного типа: характер коинфекции и риск заболевания шейки матки. J Заразить Dis .2011 г. 1. 203 (7): 910-20. [Медлайн]. [Полный текст].
Becker TM, Stone KM, Alexander ER. Генитальная инфекция, вызванная вирусом папилломы человека. Растущее беспокойство. Акушерская гинекология Clin North Am . 14 июня 1987 г. (2): 389-96. [Медлайн].
Winer RL, Lee SK, Hughes JP, Adam DE, Kiviat NB, Koutsky LA. Генитальная инфекция, вызванная вирусом папилломы человека: заболеваемость и факторы риска в когорте студенток университетов. Am J Epidemiol . 1 февраля 2003 г.157 (3): 218-26. [Медлайн].
Chuang TY. Condylomata acuminata (остроконечные кондиломы). Эпидемиологический взгляд. J Am Acad Dermatol . 1987, 16 февраля (2, часть 1): 376-84. [Медлайн].
Chuang TY, Perry HO, Kurland LT, Ilstrup DM. Condyloma acuminatum в Рочестере, штат Миннесота, 1950-1978 гг. II. Анаплазии и неблагоприятные исходы. Дерматол Арки . 1984 апр.120 (4): 476-83. [Медлайн].
Nebesio CL, Mirowski GW, Chuang TY.Вирус папилломы человека: клиническое значение и злокачественный потенциал. Инт Дж Дерматол . 2001 июн. 40 (6): 373-9. [Медлайн].
Insinga RP, Dasbach EJ, Elbasha EH. Эпидемиологическое естествознание и клиническое ведение болезни, вызванной вирусом папилломы человека (ВПЧ): критический и систематический обзор литературы по разработке модели динамической передачи ВПЧ. BMC Infect Dis . 29 июля 2009 г. 9: 119. [Медлайн]. [Полный текст].
Rhea WG Jr, Буржуа BM, Сьюэлл ДР.Острая кондилома: смертельное заболевание ?. Am Surg . 1998, ноябрь 64 (11): 1082-7. [Медлайн].
Коутский Л. Эпидемиология генитальной инфекции папилломы человека. Am J Med . 1997 5 мая. 102 (5A): 3-8. [Медлайн].
Bernard HU, Burk RD, Chen Z, van Doorslaer K, Hausen Hz, de Villiers EM. Классификация папилломавирусов (ПВ) на основе 189 типов ПВ и предложения таксономических поправок. Вирусология . 2010 25 мая.401 (1): 70-9. [Медлайн]. [Полный текст].
Ли Л.А., Ченг А.Дж., Фанг Т.Дж., Хуанг К.Г., Ляо С.Т., Чанг Дж.Т. и др. Высокая частота злокачественной трансформации папилломы гортани на Тайване. Ларингоскоп . 2008 января 118 (1): 50-5. [Медлайн].
de Sanjose S, Quint WG, Alemany L, et al. Атрибуция генотипа вируса папилломы человека при инвазивном раке шейки матки: ретроспективное перекрестное всемирное исследование. Ланцет Онкол . 2010 ноя.11 (11): 1048-56. [Медлайн].
Клиффорд Г.М., Смит Дж. С., Пламмер М., Муньос Н., Франчески С. Типы вируса папилломы человека при инвазивном раке шейки матки во всем мире: метаанализ. Рак Дж. . 13 января 2003 г. 88 (1): 63-73. [Медлайн]. [Полный текст].
Вайншток Х, Берман С., Кейтс У. Младший. Заболевания, передаваемые половым путем среди американской молодежи: оценки заболеваемости и распространенности, 2000. Perspect Sex Reprod Health . 2004 янв-фев. 36 (1): 6-10.[Медлайн].
Hariri S, Unger ER, Sternberg M, Dunne EF, Swan D, Patel S и др. Распространенность генитального вируса папилломы человека среди женщин в США, Национальное обследование здоровья и питания, 2003–2006 годы. J Заразить Dis . 2011 15 августа. 204 (4): 566-73. [Медлайн].
Chuang TY, Perry HO, Kurland LT, Ilstrup DM. Condyloma acuminatum, Рочестер, Миннесота, 1950–1978. I. Эпидемиология и клинические особенности. Дерматол Арки .1984 апр.120 (4): 469-75. [Медлайн].
Кливер Е.В., Демерс А.А., Эллиотт Л., Лотоцкий Р., Батлер Дж. Р., Бриссон М. Двадцатилетние тенденции в заболеваемости и распространенности диагностированных аногенитальных бородавок в Канаде. Секс Трансмиссия . 2009 июн. 36 (6): 380-6. [Медлайн].
Хой Т., Сингхал П.К., Вилли В.Дж., Инсинга Р.П. Оценка заболеваемости и экономического бремени остроконечных кондилом на основе данных, полученных от населения США, застрахованного на коммерческой основе. Curr Med Res Opin .2009 25 октября (10): 2343-51. [Медлайн].
Коутский Л.А., Галлоуэй Д.А., Холмс К.К. Эпидемиология генитальной инфекции папилломы человека. Эпидемиол. Ред. . 1988. 10: 122-63. [Медлайн].
Nuovo GJ. Обнаружение ДНК вируса папилломы человека в нижних отделах половых путей. Заразить Урол . 1994. 87-93.
Бейтнер К.Р., Рейтано М.В., Ричвальд Г.А., Wiley DJ. Наружные остроконечные кондиломы: отчет Консенсусной конференции Американской медицинской ассоциации.Группа экспертов AMA по внешним остроконечным кондиломам. Клин Инфекция Дис . 1998, 27 октября (4): 796-806. [Медлайн].
Fleischer AB Jr, Parrish CA, Glenn R, Feldman SR. Condylomata acuminata (остроконечные кондиломы): демографические данные пациентов и лечащие врачи. Секс Трансмиссия . 2001 28 ноября (11): 643-7. [Медлайн].
Cates W Jr. Оценки заболеваемости и распространенности заболеваний, передаваемых половым путем в Соединенных Штатах. Панель Американской ассоциации социального здоровья. Секс Трансмиссия . 1999 26 апреля (4 доп.): S2-7. [Медлайн].
Практический бюллетень ACOG. Руководство по клиническому ведению акушеров-гинекологов. Номер 61, апрель 2005 г. Вирус папилломы человека. Акушерский гинекол . 2005 апр. 105 (4): 905-18. [Медлайн].
Peng TC, Searle CP 3rd, Shah KV, Repke JT, Johnson TR. Распространенность инфекций вируса папилломы человека при доношенной беременности. Am J Perinatol . 1990, апрель, 7 (2): 189-92.[Медлайн].
Rando RF, Lindheim S, Hasty L, Sedlacek TV, Woodland M, Eder C. Повышенная частота обнаружения дезоксирибонуклеиновой кислоты вируса папилломы человека в слущенных клетках шейки матки во время беременности. Am J Obstet Gynecol . 1989 июль 161 (1): 50-5. [Медлайн].
Шнайдер А., Хотц М., Гиссманн Л. Повышенная распространенность вирусов папилломы человека в нижних отделах половых путей беременных женщин. Инт Дж. Рак . 1987 15 августа.40 (2): 198-201. [Медлайн].
Shah K, Kashima H, Polk BF, Shah F, Abbey H, Abramson A. Редкость кесарева сечения в случаях респираторного папилломатоза с юношеским началом. Акушерский гинекол . 1986 декабрь 68 (6): 795-9. [Медлайн].
Bosch FX, Manos MM, Munoz N и др. Распространенность вируса папилломы человека при раке шейки матки: мировая перспектива. Группа изучения международного биологического исследования рака шейки матки (IBSCC). Национальный институт рака .1995, 7 июня. 87 (11): 796-802. [Медлайн].
Паркин Д.М., Брей Ф. Глава 2: Бремя рака, связанного с ВПЧ. Вакцина . 2006 31 августа. 24 Дополнение 3: S3 / 11-25. [Медлайн].
Syrjanen K, Syrjanen S. Эпидемиология инфекций вируса папилломы человека и неоплазии половых органов. Scand J Infect Dis Suppl . 1990. 69: 7-17. [Медлайн].
Pham TH, Nguyen TH, Herrero R, et al. Инфекция вируса папилломы человека среди женщин Южного и Северного Вьетнама. Инт Дж. Рак . 20 марта 2003 г. 104 (2): 213-20. [Медлайн].
Kjaer SK, Svare EI, Worm AM, Walboomers JM, Meijer CJ, van den Brule AJ. Инфекция вируса папилломы человека у датских секс-работниц. Снижение распространенности с возрастом, несмотря на постоянно высокую сексуальную активность. Секс Трансмиссия . 2000 сентября, 27 (8): 438-45. [Медлайн].
Hippelainen M, Syrjanen S, Hippelainen M, et al. Распространенность и факторы риска инфекций генитального вируса папилломы человека (ВПЧ) у здоровых мужчин: исследование финских призывников. Секс Трансмиссия . 1993 ноябрь-декабрь. 20 (6): 321-8. [Медлайн].
Шанкаранараянан Р., Нене Б.М., Шастри С.С., Джаянт К., Мувонге Р., Будух А.М. и др. Скрининг на ВПЧ на рак шейки матки в сельских районах Индии. N Engl J Med . 2009 апр. 2. 360 (14): 1385-94. [Медлайн].
Schiffman M, Wacholder S. Из Индии в мир — лучший способ предотвратить рак шейки матки. N Engl J Med . 2009 апр. 2. 360 (14): 1453-5. [Медлайн].
Bruni L, Diaz M, Castellsague X, Ferrer E, Bosch FX, de Sanjose S.Распространенность вируса папилломы человека на 5 континентах: метаанализ 1 миллиона женщин с нормальными цитологическими данными. J Заразить Dis . 2010 15 декабря. 202 (12): 1789-99. [Медлайн].
Всемирная организация здравоохранения. Вирус папилломы человека (ВПЧ) и рак шейки матки. ВОЗ. Доступно по адресу https://www.who.int/news-room/fact-sheets/detail/human-papillomavirus-(hpv)-and-cervical-cancer. 24 января 2019 г .; Дата обращения: 5 февраля 2019 г.
Dunne EF, Unger ER, Sternberg M, McQuillan G, Swan DC, Patel SS, et al.Распространенность инфекции ВПЧ среди женщин в США. ЯМА . 2007 28 февраля. 297 (8): 813-9. [Медлайн].
Ho GY, Bierman R, Beardsley L, Chang CJ, Burk RD. Естественное течение цервиковагинальной папилломавирусной инфекции у молодых женщин. N Engl J Med . 1998 12 февраля. 338 (7): 423-8. [Медлайн].
Burk RD, Ho GY, Beardsley L, Lempa M, Peters M, Bierman R. Сексуальное поведение и характеристики партнера являются преобладающими факторами риска заражения генитальным вирусом папилломы человека у молодых женщин. J Заразить Dis . 1996 Октябрь 174 (4): 679-89. [Медлайн].
Фигероа Дж. П., Уорд Э, Люти Т. Э., Вермунд Ш., Братвейт А. Р., Бурк Р. Д.. Распространенность вируса папилломы человека среди посетителей клиник ЗППП на Ямайке: связь молодого возраста и повышенной сексуальной активности. Секс Трансмиссия . 1995 март-апрель. 22 (2): 114-8. [Медлайн].
Dinh TH, Sternberg M, Dunne EF, Markowitz LE. Остроконечные кондиломы среди молодежи в возрасте от 18 до 59 лет в США, национальное обследование состояния здоровья и питания, 1999-2004 гг. Секс Трансмиссия . 2008 апр. 35 (4): 357-60. [Медлайн].
Майзельс А. Цитологическая диагностика вируса папилломы человека. Влияние возраста и срока беременности. Acta Cytol . 1992 июль-авг. 36 (4): 480-2. [Медлайн].
Evander M, Edlund K, Gustafsson A, Jonsson M, Karlsson R, Rylander E, et al. Инфекция вируса папилломы человека у молодых женщин преходяща: популяционное когортное исследование. J Заразить Dis . 1995 апр.171 (4): 1026-30. [Медлайн].
Демпси А.Ф., Коутский Л.А. Национальное бремя остроконечных кондилом: первый шаг в определении проблемы. Секс Трансмиссия . 2008 апр. 35 (4): 361-2. [Медлайн].
Дэвис А.Дж., Эманс С.Дж. Инфекция вируса папилломы человека у пациентов детского и подросткового возраста. Дж. Педиатр . 1989 июл.115 (1): 1-9. [Медлайн].
Shelton TB, Jerkins GR, Noe HN. Condylomata acuminata в педиатрии. Дж Урол . 1986 марта, 135 (3): 548-9. [Медлайн].
Cannistra SA, Niloff JM. Рак шейки матки. N Engl J Med . 1996, 18 апреля. 334 (16): 1030-8. [Медлайн].
Stoler MH. Вирусы папилломы человека и неоплазия шейки матки: модель канцерогенеза. Int J Gynecol Pathol . 2000 января 19 (1): 16-28. [Медлайн].
Arima Y, Winer RL, Feng Q, Hughes JP, Lee SK, Stern ME, et al.Развитие остроконечных кондилом после случайного выявления инфекции вируса папилломы человека у молодых мужчин. J Заразить Dis . 15 октября 2010 г. 202 (8): 1181-4. [Медлайн].
Стерджисс Е.А., Джин Ф., Мартин С.Дж., Грулич А., Боуден Ф.Дж. Распространенность других инфекций, передаваемых половым путем, у пациентов с впервые выявленными аногенитальными бородавками в клинике сексуального здоровья. Сексуальное здоровье . 2010 марта 7 (1): 55-9. [Медлайн].
Barclay L. Новое руководство рекомендует анализ ДНК ВПЧ для первичного скрининга.9 января 2015 года. Medscape Medical News. WebMD Inc. Доступно по адресу http://www.medscape.com/viewarticle/837832.
Huh WK, Ault KA, Chelmow D, Davey DD, Goulart RA, Garcia FA и др. Использование первичного тестирования на вирус папилломы человека высокого риска для скрининга рака шейки матки: временное клиническое руководство. Акушерский гинекол . 2015 Февраль 125 (2): 330-7. [Медлайн].
[Рекомендации] Целевая группа превентивных служб США. Скрининг рака шейки матки.Целевая группа по профилактическим услугам США. Доступно на http://www.uspreventiveservicestaskforce.org/uspstf/uspscerv.htm. Доступ: 29 августа 2012 г.
[Рекомендации] Саслоу Д., Соломон Д., Лоусон Х.В. и др. Американское онкологическое общество, Американское общество кольпоскопии и патологии шейки матки и Американское общество клинической патологии руководящие принципы скрининга для профилактики и раннего выявления рака шейки матки. CA Cancer J Clin . 2012 май-июнь. 62 (3): 147-72. [Медлайн].
Каллиала И., Анттила А., Дайба Т., Хакулинен Т., Халттунен М., Ниеминен П. Частота и исход беременности среди пациентов с цервикальной интраэпителиальной неоплазией: ретроспективное когортное исследование. БЖОГ . 2012, январь, 119 (2): 227-35. [Медлайн].
Lazcano-Ponce E, Lorincz AT, Cruz-Valdez A, et al. Самостоятельный сбор вагинальных образцов для тестирования на вирус папилломы человека в профилактике рака шейки матки (МАРТ): рандомизированное контролируемое исследование на уровне сообщества. Ланцет . 2011 26 ноября. 378 (9806): 1868-73. [Медлайн].
Ли Дж. К., Ким М. К., Сонг Ш. и др. Сравнение обнаружения и типирования вируса папилломы человека с помощью гибридного захвата 2, линейного массива, ДНК-чипа и циклического секвенирования в образцах мазков из шейки матки. Int J Гинекольный рак . 2009 февраля 19 (2): 266-72. [Медлайн].
Nelson R. FDA OKs Тест ДНК ВПЧ для первичного скрининга рака шейки матки. Медицинские новости Medscape . 24 апреля 2014 г.[Полный текст].
Auborn KJ, Carter TH. Лечение гинекологических инфекций, вызванных вирусом папилломы человека. Clin Lab Med . 2000 июня, 20 (2): 407-22. [Медлайн].
Beutner KR, Wiley DJ, Douglas JM, Tyring SK, Fife K, Trofatter K и др. Остроконечные кондиломы и их лечение. Клин Инфекция Дис . 1999, 28 января, приложение 1: S37-56. [Медлайн].
Bergman A, Bhatia NN, Broen EM. Криотерапия для лечения кондилом половых органов при беременности. J Reprod Med . 1984 июля 29 (7): 432-5. [Медлайн].
Гарланд С.М., Олт К.А., Галл С.А. и др. Беременность и исходы новорожденных в клинических испытаниях вакцины против вируса папилломы человека типа 6/11/16/18: комбинированный анализ пяти рандомизированных контролируемых испытаний. Акушерский гинекол . 2009 декабрь 114 (6): 1179-88. [Медлайн].
Blomberg M, Friis S, Munk C, Bautz A, Kjaer SK. Остроконечные кондиломы и риск рака: датское исследование почти 50 000 пациентов с остроконечными кондиломами. J Заразить Dis . 2012 15 мая. 205 (10): 1544-53. [Медлайн].
Остроконечные кондиломы и сексуальное насилие у детей. Рабочая группа Американской академии дерматологии по детской дерматологии. J Am Acad Dermatol . 1984 Сентябрь 11 (3): 529-30. [Медлайн].
Diamantis ML, Bartlett BL, Tyring SK. Безопасность, эффективность и частота рецидивов крема имиквимод 5% для лечения аногенитальных бородавок. Skin Therapy Lett . 2009 июн.14 (5): 1-3, 5. [Medline].
Гарланд С.М., Уодделл Р., Миндел А., Денхэм И.М., Макклоски Дж. Открытое пилотное исследование фазы II, посвященное изучению оптимальной продолжительности применения 5% крема имиквимода для лечения наружных остроконечных кондилом у женщин. Int J ЗППП, СПИД . 2006 июл.17 (7): 448-52. [Медлайн].
Wagstaff AJ, Perry CM. Имиквимод для местного применения: обзор его использования при лечении аногенитальных бородавок, актинического кератоза, базальноклеточного рака и других кожных поражений. Наркотики . 2007. 67 (15): 2187-210. [Медлайн].
Веландер CE, Homesley HD, Smiles KA, Peets EA. Внутрипочвенный интерферон альфа-2b для лечения остроконечных кондилом. Am J Obstet Gynecol . 1990 Февраль 162 (2): 348-54. [Медлайн].
Эрон Л.Дж., Джадсон Ф., Такер С., Правер С., Миллс Дж., Мерфи К. и др. Интерферонотерапия остроконечных кондилом. N Engl J Med . 1986, 23 октября. 315 (17): 1059-64. [Медлайн].
Monsonego J, Cessot G, Ince SE, Galazka AR, Abdul-Ahad AK.Рандомизированное двойное слепое исследование рекомбинантного бета-интерферона для лечения острой кондиломы. Генитурин Мед . 1996 Апрель 72 (2): 111-4. [Медлайн]. [Полный текст].
Bornstein J, Pascal B, Zarfati D, Goldshmid N, Abramovici H. Рекомбинантный человеческий интерферон-бета для condylomata acuminata: рандомизированное двойное слепое плацебо-контролируемое исследование внутриочаговой терапии. Int J ЗППП, СПИД . 1997 Октябрь 8 (10): 614-21. [Медлайн].
Ян Дж., Пу Ю. Г., Цзэн З. М., Ю З. Дж., Хуанг Н., Дэн К. В..Интерферон для лечения остроконечных кондилом: систематический обзор. BMC Infect Dis . 2009 21 сентября, 9: 156. [Медлайн]. [Полный текст].
Хеллберг Д., Сваррер Т., Нильссон С., Валентин Дж. Самостоятельное лечение женских наружных генитальных бородавок 0,5% кремом подофиллотоксина (Кондилин) по сравнению с еженедельным применением 20% раствора подофиллина. Int J ЗППП, СПИД . 1995 июль-авг. 6 (4): 257-61. [Медлайн].
Кребс HB. Лечение обширных остроконечных кондилом вульвы местным 5-фторурацилом. South Med J . 1990 июл.83 (7): 761-4. [Медлайн].
Basita CS, Atallah AN, Saconato, da Silva EMK. 5-ФУ от остроконечных кондилом у здоровых людей. Кокрановская база данных систематических обзоров . Джон Вили и сыновья, ООО; 2010. 4.
Абдулла А.Н., Вальцман М., Уэйд А. Лечение наружных остроконечных кондилом с помощью криотерапии (жидкий азот) и трихлоруксусной кислоты. Секс Трансмиссия . 1993 ноябрь-декабрь.20 (6): 344-5. [Медлайн].
Tatti S, Swinehart JM, Thielert C, Tawfik H, Mescheder A, Beutner KR. Синекатехины, определенный экстракт зеленого чая, в лечении наружных аногенитальных бородавок: рандомизированное контролируемое исследование. Акушерский гинекол . 2008 июн.111 (6): 1371-9. [Медлайн].
Мельцер С.М., Монк Б.Дж., Тевари К.С. Катехины зеленого чая для лечения наружных кондилом. Am J Obstet Gynecol . 2009 Март 200 (3): 233.е1-7. [Медлайн].
Лэнгли ПК. Анализ экономической эффективности синекатехинов при лечении наружных остроконечных кондилом. J Med Econ . 2010 марта 13 (1): 1-7. [Медлайн].
Гилсон Р.Дж., Росс Дж., Мо Р., Роуэн Д., Соннекс С., Лейси С.Дж. Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование криотерапии по сравнению с криотерапией и кремом с подофиллотоксином в качестве лечения наружных аногенитальных бородавок. Заражение, передающееся половым путем .2009 декабрь 85 (7): 514-9. [Медлайн].
Duus BR, Philipsen T, Christensen JD, Lundvall F, Sondergaard J. Refractory condylomata acuminata: контролируемое клиническое испытание углекислотного лазера по сравнению с традиционным хирургическим лечением. Генитурин Мед . 1985 Февраль 61 (1): 59-61. [Медлайн]. [Полный текст].
Липов М. Лазерная физика стала проще. Curr Prob in Obstet Gynecol Fertil . 1986. 9: 445-493.
Aynaud O, Buffet M, Roman P, Plantier F, Dupin N.Изучение персистенции и частоты рецидивов у 106 пациентов с кондиломами и интраэпителиальной неоплазией после лечения СО2-лазером. Eur J Dermatol . 2008 март-апрель. 18 (2): 153-8. [Медлайн].
Иммуногенность и переносимость вакцины против широкоспектрального вируса папилломы человека (ВПЧ) у взрослых и молодых взрослых женщин (V503-004) — NCT03158220. ClinicalTrials.gov. 2018 13 марта; Доступ: 11 октября 2018 г.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.FDA одобряет расширенное использование Гардасила 9 для лиц в возрасте от 27 до 45 лет. Пресс-релиз FDA . 5 октября 2018 г. Доступно по адресу https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm622715.htm.
[Рекомендации] Консультативный комитет по практике иммунизации (ACIP). Рекомендуемый график иммунизации взрослых людей в возрасте 19 лет и старше, США, 2020 г. Центры по контролю и профилактике заболеваний. Доступно по адресу https://www.cdc.gov/vaccines/schedules/hcp/imz/adult.html. 3 февраля 2020 г .; Дата обращения: 19 февраля 2020 г.
Haug CJ. Вакцинация против вируса папилломы человека — причины для осторожности. N Engl J Med . 2008 21 августа. 359 (8): 861-2. [Медлайн].
Ким JJ, Голди SJ. Медицинские и экономические последствия вакцинации против ВПЧ в США. N Engl J Med . 2008 21 августа. 359 (8): 821-32. [Медлайн]. [Полный текст].
Четырехвалентная вакцина против вируса папилломы человека для предотвращения тяжелых поражений шейки матки. N Engl J Med . 2007 10 мая. 356 (19): 1915-27. [Медлайн].
График повторной иммунизации для лиц в возрасте от 4 месяцев до 18 лет, которые начали поздно или опаздывали более чем на 1 месяц. Центры по контролю и профилактике заболеваний (CDC). Доступно по адресу https://www.cdc.gov/vaccines/schedules/hcp/imz/catchup.html. 2018 фев 06; Доступ: 11 октября 2018 г.
Уокер Т.Ю., Элам-Эванс Л.Д., Янки Д., Марковиц Л.Е., Уильямс С.Л., Мбайи С.А. и др.Охват вакцинацией подростков в возрасте 13-17 лет на национальном, региональном, государственном и отдельных регионах — США, 2017 г. MMWR Morb Mortal Wkly Rep . 2018 24 августа. 67 (33): 909-917. [Медлайн]. [Полный текст].
Коутский Л.А., Олт К.А., Уиллер С.М., Браун Д.Р., Барр Э., Альварес Ф.Б. и др. Контролируемое испытание вакцины против вируса папилломы человека типа 16. N Engl J Med . 2002 21 ноября. 347 (21): 1645-51. [Медлайн].
Вилла LL, Коста Р.Л., Петта, Калифорния и др.Профилактическая четырехвалентная вакцина против вируса папилломы человека (типы 6, 11, 16 и 18) L1 вирусоподобных частиц для молодых женщин: рандомизированное двойное слепое плацебо-контролируемое многоцентровое испытание эффективности фазы II. Ланцет Онкол . 2005 г., май. 6 (5): 271-8. [Медлайн].
Прочтите TR, Hocking JS, Chen MY, Donovan B, Bradshaw CS, Fairley CK. Практическое исчезновение остроконечных кондилом у молодых женщин через 4 года после начала национальной программы вакцинации против вируса папилломы человека (ВПЧ). Заражение, передающееся половым путем . 2011 декабрь 87 (7): 544-7. [Медлайн].
Brown DR, Kjaer SK, Sigurdsson K, et al. Влияние четырехвалентного вируса папилломы человека (ВПЧ; типы 6, 11, 16 и 18) L1-вирусоподобной вакцины с частицами на инфекцию и заболевание, вызванное онкогенными невакцинными типами ВПЧ, у женщин в возрасте 16-26 лет, обычно не инфицированных ВПЧ. J Заразить Dis . 2009 г., 1. 199 (7): 926-35. [Медлайн].
Fairley CK, Hocking JS, Gurrin LC, Chen MY, Donovan B, Bradshaw CS.Быстрое снижение проявлений остроконечных кондилом после реализации национальной программы четырехвалентной вакцинации против вируса папилломы человека для молодых женщин. Заражение, передающееся половым путем . 2009 декабрь 85 (7): 499-502. [Медлайн].
Гарланд С.М., Эрнандес-Авила М., Уиллер С.М., Перес Г., Харпер Д.М., Леодольтер С. и др. Четырехвалентная вакцина против вируса папилломы человека для профилактики аногенитальных заболеваний. N Engl J Med . 2007 10 мая. 356 (19): 1928-43. [Медлайн].
Брукс М.Исследование в реальном мире подтверждает ценность вакцины против ВПЧ для женщин. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/821591. Доступ: 17 марта 2014 г.
Crowe E, Pandeya N, Brotherton JM, Dobson AJ, Kisely S, Lambert SB, et al. Эффективность четырехвалентной вакцины против вируса папилломы человека для профилактики аномалий шейки матки: исследование случай-контроль в рамках программы скрининга населения в Австралии. BMJ . 2014 4 марта. 348: g1458.[Медлайн]. [Полный текст].
Hitt E. Четырехвалентная вакцина против ВПЧ кажется безопасной, но скептики остаются. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/772019. Доступ: 16 октября 2012 г.
Кляйн Н.П., Хансен Дж., Чао С., Велисер С., Эмери М., Слезак Дж. И др. Безопасность четырехвалентной вакцины против вируса папилломы человека, регулярно вводимой женщинам. Arch Pediatr Adolesc Med . 2012 1. 1-9 октября. [Медлайн].
Нил Т.Отсутствие риска образования тромбов при использовании вакцины против ВПЧ. Медицинские новости Medscape. Доступно на http://www.medpagetoday.com/Cardiology/VenousThrombosis/46677. Доступ: 14 июля 2014 г.
Scheller NM, Pasternak B, Svanstrom H, Hviid A. Четырехвалентная вакцина против вируса папилломы человека и риск венозной тромбоэмболии. ЯМА . 2014 Июль 312 (2): 187-8. [Медлайн].
Джулиано А.Р., Палефски Дж. М., Голдстоун С. и др. Эффективность четырехвалентной вакцины против ВПЧ у мужчин. N Engl J Med . 2011 г. 3 февраля. 364 (5): 401-11. [Медлайн].
Palefsky JM, Giuliano AR, Goldstone S, et al. Вакцина против ВПЧ анального отверстия и интраэпителиальной неоплазии заднего прохода. N Engl J Med . 27 октября 2011 г. 365 (17): 1576-85. [Медлайн].
Kim JJ. Целевая вакцинация против вируса папилломы человека мужчин, практикующих секс с мужчинами, в США: анализ моделирования экономической эффективности. Ланцет Infect Dis . 2010 декабрь10 (12): 845-52. [Медлайн].
Wawer MJ, Tobian AA, Kigozi G, et al. Влияние обрезания у ВИЧ-отрицательных мужчин на передачу вируса папилломы человека ВИЧ-отрицательным женщинам: рандомизированное испытание в Ракаи, Уганда. Ланцет . 2011 15 января. 377 (9761): 209-18. [Медлайн]. [Полный текст].
[Рекомендации] Саслоу Д., Эндрюс К.С., Манассарам-Батист Д., Лумер Л., Лам К.Э., Фишер-Борн М. и др. Обновление рекомендаций по вакцинации против вируса папилломы человека: одобрение рекомендаций Американского онкологического общества. CA Cancer J Clin . 2016 Сентябрь 66 (5): 375-85. [Медлайн].
[Рекомендации] Свифт Д. Детям младше 15 лет рекомендуется две дозы вакцины против ВПЧ. Medscape Medical News. Доступно на http://www.medscape.com/viewarticle/870722. 20 октября 2016 г .;
Использование вакцины 9-Valent от вируса папилломы человека (ВПЧ): обновленные рекомендации Консультативного комитета по практике иммунизации по вакцинации против ВПЧ. MMWR Morb Mortal Wkly Rep .27 марта 2015 г. 64 (11): 300-304. [Полный текст].
Lowes R. Только что одобренный Гардасил 9 упаковывает больше защиты от ВПЧ / рака. Медицинские новости Medscape . 10 декабря 2014 г. [Полный текст].
FDA. FDA одобряет Гардасил 9 для предотвращения некоторых видов рака, вызванных пятью дополнительными типами ВПЧ. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно на http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm426485.htm. Доступ: 18 декабря 2014 г.
Гардасил 9 (9-валентная вакцина против вируса папилломы человека, рекомбинантная) [вкладыш в упаковке].Станция Уайтхаус, Нью-Джерси: Merck & Co, Inc., декабрь 2015 г. Доступно на [Полный текст].
Joura E, et al. Эффективность и иммуногенность новой 9-валентной вакцины из вирусоподобных частиц L1 HPV для женщин в возрасте от 16 до 26 лет. Тезисы (SS 8-4) представлены на EUROGIN 2014 5 ноября 2013 г.
VanDamme P, et al. Иммуногенность и безопасность новой 9-валентной вакцины из вирусоподобных частиц L1 HPV для мальчиков и девочек 9-15 лет; по сравнению с женщинами 16-26 лет.Тезисы (SS 8-5) представлены на EUROGIN 2014 5 ноября 2013 г.
Markowitz LE, Dunne EF, Saraiya M, Lawson HW, Chesson H, Unger ER. Четырехвалентная вакцина против вируса папилломы человека: рекомендации Консультативного комитета по практике иммунизации (ACIP). MMWR Recomm Rep . 2007 23 марта. 56: 1-24. [Медлайн].
[Рекомендации] Саслоу Д., Касл П. Е., Кокс Дж. Т., Дэйви Д. Д., Эйнштейн М. Х., Феррис Д. Г. и др. Руководство Американского онкологического общества по использованию вакцины против вируса папилломы человека (ВПЧ) для предотвращения рака шейки матки и его предшественников. CA Cancer J Clin . 2007 янв-фев. 57 (1): 7-28. [Медлайн].
[Рекомендации] Лицензирование FDA бивалентной вакцины против вируса папилломы человека (ВПЧ2, Церварикс) для использования у женщин и обновленные рекомендации Консультативного комитета по практике иммунизации (ACIP) по вакцинации против ВПЧ. MMWR Morb Mortal Wkly Rep . 2010 28 мая. 59 (20): 626-9. [Медлайн]. [Полный текст].
Рекомендации по применению четырехвалентной вакцины против вируса папилломы человека у мужчин — Консультативный комитет по практике иммунизации (ACIP), 2011. MMWR Morb Mortal Wkly Rep . 2011 декабря 23. 60 (50): 1705-8. [Медлайн].
FDA. Лицензирование FDA четырехвалентной вакцины против вируса папилломы человека (HPV4, Гардасил) для использования у мужчин и руководство Консультативного комитета по практике иммунизации (ACIP). MMWR Morb Mortal Wkly Rep . 2010 28 мая. 59 (20): 630-2. [Медлайн].
Дэвидсон Э.Дж., Босвелл С.М., Зер П. и др. Иммунологические и клинические ответы у женщин с интраэпителиальной неоплазией вульвы, вакцинированных вирусом осповакцины, кодирующим онкобелки вируса папилломы человека 16/18. Cancer Res . 2003 15 сентября. 63 (18): 6032-41. [Медлайн].
Болдуин П.Дж., ван дер Бург С.Х., Босвелл С.М. и др. Экспрессируемый осповакциной вирус папилломы человека 16 и 18 е6 и е7 в качестве терапевтической вакцинации против интраэпителиальной неоплазии вульвы и влагалища. Clin Cancer Res . 1 ноября 2003 г. 9 (14): 5205-13. [Медлайн].
Гренс К. ВПЧ, связанный с повышенным риском рака пищевода. Medscape [сериал онлайн]. Доступно на http: //www.medscape.com / viewarticle / 808770. Доступ: 19 августа 2013 г.
Liyanage SS, Rahman B, Ridda I, Newall AT, Tabrizi SN, Garland SM, et al. Этиологическая роль вируса папилломы человека в плоскоклеточном раке пищевода: метаанализ. PLoS One . 2013. 8 (7): e69238. [Медлайн]. [Полный текст].
Вирусный антиген вируса папилломы человека 16 | Вирус ВПЧ
Каталожный номер
HPV-001
Синонимы
Папилломавирус, ВПЧ, Вирус папилломы.
Введение
Семейство вирусов папилломы человека насчитывает более 200 типов. Более 30-40 типов ВПЧ передаются половым путем и инфицируют аногенитальную область, вызывая генитальные бородавки. Стойкая инфекция типами ВПЧ «высокого риска» приводит к появлению кожных бородавок и к предраковым поражениям и инвазивному раку. Инфекция ВПЧ считается источником всех случаев рака шейки матки.
Описание
Рекомбинантный антиген HPV-16 представляет собой полноразмерный белок, экспрессируемый в E.coli с молекулярной массой 56,7 кДа. Белок слит с GST-меткой, имеющей общую молекулярную массу 82,7 кДа, и очищается с помощью стандартной хроматографии.
Источник
E.Coli.
Внешний вид
Стерильный фильтрованный прозрачный жидкий состав.
Состав
Раствор рекомбинантного ВПЧ-16 в PBS, 100 мМ аргинине и 3М мочевине.
Стабильность
Рекомбинантный ВПЧ-16, хотя он стабилен при 4 ° C в течение 1 недели, следует хранить при температуре ниже -18 ° C.
Пожалуйста, не допускайте циклов замораживания-оттаивания.
Чистота
Белок имеет чистоту> 90% по данным 10% SDS-PAGE (окрашивание Кумасси).
Аминокислотная последовательность
MQVTFIYILVITCYENDVNVYHIFFQMSLWLPSEATVYLPPVPVSKVVSTDEYVARTN
IYYHAGTSRLLAVGHPYFPIKKPNNNKILVPKVSGLQYRVFRIHLPDPNKFGFPDTSF
YNPDTQRLVWACVGVEVGRGQPLGVGISGHPLLNKLDDTENASAYAANAGVDNRECIS
MDYKQTQLCLIGCKPPIGEHWGKGSPCTNVAVNPGDCPPLELINTVIQDGDMVHTGFG
AMDFTTLQANKSEVPLDICTSICKYPDYIKMVSEPYGDSLFFYLRREQMFVRHLFNRA
GTVGENVPDDLYIKGSGSTANLASSNYFPTPSGSMVTSDAQIFNKPYWLQRAQGHNNG
ICWGNQLFVTVVDTTRSTNMSLCAAISTSETTYKNTNFKEYLRHGEEYDLQFIFQLCK
ITLTADVMTYIHSMNSTILEDWNFGLQPPPGGTLEDTYRFVTQAIACQKHTPPAPKED
DPLKKYTFWEVNLKEKFSADLDQFPLGRKFLLQAGLKAKPKFTLGKRKATPTTSSTST
TAKRKKRKL.




 Согласно классификации Международного комитета по таксономии вирусов (ICTV), все вирусы папилломы относятся к семейству Papillomaviridae. Все типы папилломавирусов классифицируют по видам и родам, а также по степени родства вирусного генома. На данный момент насчитывают 170 видов, более того, продолжают обнаруживать все новые виды вируса.
Согласно классификации Международного комитета по таксономии вирусов (ICTV), все вирусы папилломы относятся к семейству Papillomaviridae. Все типы папилломавирусов классифицируют по видам и родам, а также по степени родства вирусного генома. На данный момент насчитывают 170 видов, более того, продолжают обнаруживать все новые виды вируса. В оставшихся 20% случаев инфекция развивается в непрогрессирующую цервикальную интраэпителиальную неоплазию I (CIN-1), которая не требует лечения и в итоге регрессирует. Реже у ВПЧ-позитивных женщин инфекция остается в организме длительное время и развивается в CIN-II или CIN-III; без диспансерного наблюдения 5% случаев CIN прогрессируют в рак шейки матки. Приблизительно 1% случаев высокоонкогенных типов инфекции развивается в рак шейки матки.
В оставшихся 20% случаев инфекция развивается в непрогрессирующую цервикальную интраэпителиальную неоплазию I (CIN-1), которая не требует лечения и в итоге регрессирует. Реже у ВПЧ-позитивных женщин инфекция остается в организме длительное время и развивается в CIN-II или CIN-III; без диспансерного наблюдения 5% случаев CIN прогрессируют в рак шейки матки. Приблизительно 1% случаев высокоонкогенных типов инфекции развивается в рак шейки матки.