Менингит
Основные факты- Менингит – это тяжелейшее заболевание с высокой летальностью, приводящее к серьезным долгосрочным осложнениям.
- Менингит остается одной из серьезнейших проблем здравоохранения в мире.
- Эпидемии менингита отмечаются по всему миру, особенно в странах Африки к югу от Сахары.
- Возбудителями менингита могут быть многие микроорганизмы, в том числе бактерии, вирусы, грибки и паразиты.
- Особое беспокойство вызывает бактериальный менингит. От этого типа менингита умирает приблизительно каждый десятый больной, и у каждого пятого развиваются тяжелые осложнения.
- Наиболее эффективным способом обеспечения длительной защиты от заболевания являются безопасные и недорогостоящие вакцины.
В данном информационном бюллетене основное внимание уделено четырем главным возбудителям острого бактериального менингита:
- neisseria meningitidis (менингококк)
- streptococcus pneumoniae (пневмококк)
- haemophilus influenzae (гемофильная палочка)
- streptococcus agalactiae (стрептококк группы B)
Во всем мире более половины всех случаев менингита со смертельным исходом вызваны этими бактериями, которые также вызывают ряд других тяжелых заболеваний, таких как сепсис и пневмонию.
К другим распространенным возбудителям менингита относятся другие бактерии, например mycobacterium tuberculosis, salmonella,
Менингит поражает людей всех возрастов, однако наибольшему риску подвержены дети раннего возраста. Новорожденные подвержены наибольшему риску заражения стрептококком группы В, дети раннего возраста – менингококком, пневмококком и haemophilus influenzae. Подростки и молодые взрослые в большей степени подвержены риску заболевания менингококковой инфекцией, тогда как пожилые люди – пневмококковой инфекцией.
В группе риска заболевания менингитом находятся жители всех регионов мира. Наибольшее бремя болезни отмечается в регионе Африки к югу от Сахары, известном как «африканский менингитный пояс», для которого характерен особенно высокий риск возникновения
эпидемий менингококкового, а также пневмококкового менингита.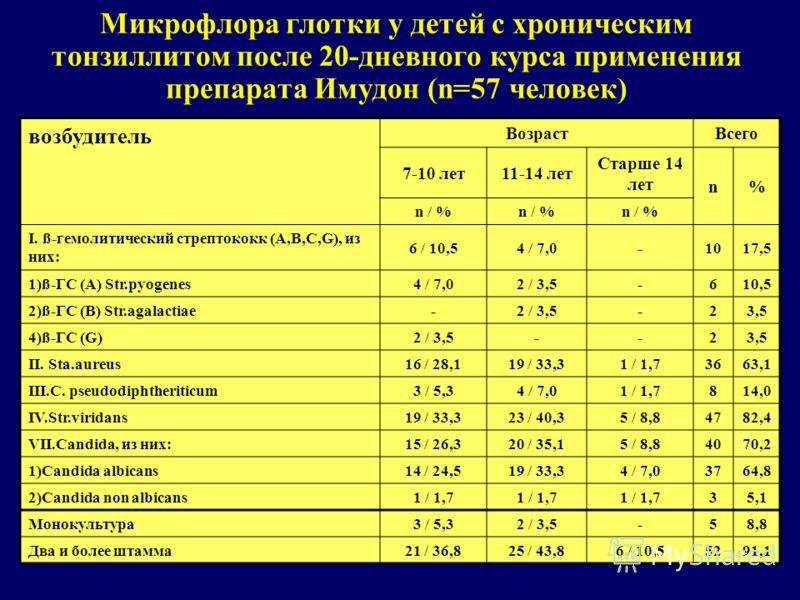
Наибольший риск отмечается в условиях пребывания людей в тесном контакте, например в рамках массовых скоплений людей, в лагерях беженцев, в перенаселенных жилых помещениях или в студенческой, военной и другой профессиональной среде. Иммунодефицит, связанный с ВИЧ-инфекцией или дефицитом комплемента, иммуносупрессия, активное или пассивное курение – все это также может повышать риск развития различных типов менингита.
Механизмы передачи инфекции зависят от типа возбудителя. Большинство бактерий, вызывающих менингит, например менингококк, пневмококк и haemophilus influenzae, присутствуют в слизистой носоглотки человека. Они распространяются воздушно-капельным путем с респираторными выделениями и выделениями из горла. Стрептококк группы В нередко присутствует в слизистой кишечника или влагалища и может передаваться от матери к ребенку при родах.
Носительство этих организмов обычно безвредно и приводит к формированию иммунитета к инфекции, однако в некоторых случаях может развиваться инвазивная бактериальная инфекция, вызывающая менингит и сепсис.
В зависимости от возбудителя инкубационный период может быть разным и при бактериальном менингите составлять от двух до 10 дней. Поскольку бактериальный менингит часто сопровождается сепсисом, описываемые клинические признаки и симптомы относятся к обеим патологиям.
Клинические признаки и симптомы:
- сильные головные боли
- ригидность мыщц затылка или боль в шее
- сильное повышение температуры тела
- светобоязнь
- судороги
- сыпь
- боль в суставах
- холодные конечности
- рвота
У младенцев могут отмечаться следующие симптомы:
- снижение аппетита
- сонливость, летаргия, кома
- раздражительность, плач при перемещениях
- затрудненное дыхание, хрип
- повышенная температура тела
- ригидность мышц затылка
- набухший родничок
- характерный пронзительный высокий крик
- судороги
- рвота
- сыпь
- бледность или пятна на коже
Наиболее эффективным способом снижения бремени болезни и смягчения негативного воздействия менингита на здоровье населения является обеспечение долгосрочной защиты от заболевания посредством вакцинопрофилактики.
В группе риска менингококкового менингита и менингита, вызванного стрептококком группы В в профилактических целях также используются антибиотики. При борьбе с эпидемиями менингококкового менингита применяются как вакцинация, так и антибиотики.
1. ВакцинацияУже много лет на рынке существуют зарегистрированные вакцины против менингококков, пневмококков и haemophilus influenzae. Известно несколько различных штаммов (также называемых серотипами или серогруппами) этих бактерий, и вакцины направлены на выработку иммунитета к наиболее опасным из них. Со временем с точки зрения охвата различных штаммов и доступности вакцин были достигнуты большие успехи, однако универсальная вакцина против всех этих возбудителей пока не разработана.
Менингококки
Выделяют 12 серогрупп менингококков, из которых в большинсте случаев возбудителями менингита являются бактерии серогрупп A, B, C, W, X и Y.
Существует три типа вакцин:
- Полисахарид-белковые конъюгированные вакцины используются для профилактики и реагирования на вспышки заболевания:
- Такие вакцины позволяют сформировать длительный иммунитет, а также предотвращают носительство инфекции, тем самым снижая распространение инфекции и формируя коллективный иммунитет.

- Они эффективны для защиты от заболевания детей младше двух лет.
- Эти вакцины выпускаются в разных формах:
- моновалентные вакцины (серогруппа А или С)
- четырехвалентные вакцины (серогруппы A, C, W, Y).
- комбинированные вакцины (менингококк серогруппы C и haemophilus influenzae типа b)
- Такие вакцины позволяют сформировать длительный иммунитет, а также предотвращают носительство инфекции, тем самым снижая распространение инфекции и формируя коллективный иммунитет.
- Вакцины на основе белка против менингококков серогруппы B. Эти вакцины защищают от менингита в любом возрасте, но, как представляется, не предотвращают носительство и передачу инфекции и, таким образом, не приводят к формированию популяционного иммунитета.
- Полисахаридные вакцины безопасны и эффективны для вакцинации детей и взрослых, однако слабо защищают детей грудного возраста. Формируемый иммунитет недолговечен, и популяционный иммунитет не формируется, поскольку вакцинация не предотвращает носительство.
Эти вакцины еще используются для борьбы со вспышками, однако идет их замена на конъюгированные вакцины.

Меры реагирования в области глобального общественного здравоохранения: элиминация эпидемий менингита, вызванного менингококком группы А, в менингитном поясе Африки
До внедрения конъюгированной вакцины против менингококка группы А в рамках кампаний массовой вакцинации (с 2010 г.) и ее включения в календарь плановых прививок (с 2016 г.) в странах африканского менингитного пояса этот возбудитель вызывал 80-85%
всех эпидемий менингита. По состоянию на апрель 2021 г. 24 из 26 стран менингитного пояса провели массовые профилактические кампании среди детей в возрасте 1-29 лет (на всей национальной территории или в районах повышенного риска), и в половине
из них эта вакцина была включена в национальные календари плановых прививок. Среди вакцинированного населения заболеваемость менингитом серогруппы А снизилась более чем на 99%, и с 2017 г. не было выявлено ни одного случая заболевания, вызванного
менингококком серогруппы А.
Продолжают регистрироваться отдельные случаи и вспышки менингита, вызванного другими серогруппами менингококков, кроме серогруппы В. Внедрение поливалентных менингококковых конъюгированных вакцин является приоритетной задачей в сфере общественного здравоохранения, решение которой позволит добиться элиминации эпидемий бактериального менингита в Африканском менингитном поясе.
Пневмококк
Известно более 97 серотипов пневмококков, 23 из которых вызывают большинство случаев заболевания пневмококковым менингитом.
- Конъюгированные вакцины эффективны с 6-недельного возраста для профилактики менингита и других тяжелых пневмококковых инфекций и рекомендованы для вакцинации младенцев и детей до 5 лет, а в некоторых странах – взрослых старше 65 лет, а также
представителей отдельных групп риска.

- Существует полисахаридная вакцина, разработанная для защиты от 23 серотипов, однако, как и другие полисахаридные вакцины, она считается менее эффективной по сравнению с конъюгированными вакцинами. Она используется, главным образом, для вакцинации против пневмонии среди лиц старше 65 лет, а также представителей определенных групп риска. Она не применяется для вакцинации детей младше 2 лет и менее эффективна для профилактики менингита.
Haemophilus influenzae
Известно 6 серотипов haemophilus influenzae, из которых главным возбудителем менингита является серотип b.
- Существуют конъюгированные вакцины, формирующие специфический иммунитет к haemophilus influenzae серотипа b (Hib). Они являются высокоэффективным средством профилактики заболевания, вызванного Hib и рекомендованы для включения в календари плановых прививок новорожденных.
Стрептококк группы В
Известо 10 серотипов стрептококков группы B, из которых чаще всего возбудителями менингита являются стрептококки типов 1a, 1b, II, III, IV и V.
- В настоящее время идет работа по созданию конъюгированных и белковых вакцин для профилактики инфекции стрептококками группы В у матерей и новорожденных.
Менингококки
Своевременное назначение антибиотиков лицам, находившимся в тесном контакте с больными менингококковой инфекцией, снижает риск передачи инфекции. За пределами африканского менингитного пояса химиопрофилактику рекомендовано назначать членам семьи больных,
находившимся с ними в тесном контакте. В странах менингитного пояса назначать химиопрофилактику лицам, имевшим тесные контакты с больными, рекомендуется в случае отсутствия эпидемии. Препаратом выбора является ципрофлоксацин; в качестве альтернативы
назначается цефтриаксон.
В странах менингитного пояса назначать химиопрофилактику лицам, имевшим тесные контакты с больными, рекомендуется в случае отсутствия эпидемии. Препаратом выбора является ципрофлоксацин; в качестве альтернативы
назначается цефтриаксон.
Стрептококк группы В
Во многих странах рекомендуется выявлять матерей, чьи дети находятся в группе риска по стрептококку группы В. Одним из способов выполнения этой задачи является всеобщий скрининг беременных на носительство стрептококка группы В. Для профилактики стрептококковой инфекции группы В у новорожденных матерям из группы риска во время родов назначается пенициллин внутривенно.
ДиагностикаПервоначальная диагностика менингита выполняется путем клинического осмотра с последующим проведением люмбальной пункции. В некоторых случаях бактерии могут быть видны в спинномозговой жидкости под микроскопом. Диагноз поддерживается или подтверждается
культуральным исследованием образцов спинномозговой жидкости или крови, экспресс-тестами или исследованием по методу полимеразной цепной реакции (ПЦР). Для выбора правильных мер по борьбе с инфекцией важно идентифицировать серогруппу возбудителя и
провести тестирование на его чувствительность к антибиотикам. Молекулярное типирование и полногеномное секвенирование позволяют выявить больше различий между штаммами и дают ценную информацию для принятия решений относительно необходимых противоэпидемических
мероприятий.
Для выбора правильных мер по борьбе с инфекцией важно идентифицировать серогруппу возбудителя и
провести тестирование на его чувствительность к антибиотикам. Молекулярное типирование и полногеномное секвенирование позволяют выявить больше различий между штаммами и дают ценную информацию для принятия решений относительно необходимых противоэпидемических
мероприятий.
Менингит без адекватного лечения у половины пациентов приводит к летальному исходу, в связи с чем он всегда должен рассматриваться как неотложное состояние. Всем пациентам с менингитом показана госпитализация. Как правило, после 24 часов с начала лечения изолировать больных не рекомендуется.
При бактериальном менингите лечение соответствующими антибиотиками следует начинать как можно скорее. В идеальном случае люмбальную пункцию следует выполнять до начала курса антибиотиков, поскольку антибиотики могут затруднить выполнение культурального
исследования спинномозговой жидкости. Тем не менее, определить тип возбудителя также можно путем исследования пробы крови пациента, и незамедлительное начало лечения остается приоритетом. Для лечения менингита применяется широкий спектр антибиотиков,
включая пенициллин, ампициллин и цефтриаксон. Во время эпидемий менингококкового и пневмококкового менингита препаратом выбора является цефтриаксон.
Тем не менее, определить тип возбудителя также можно путем исследования пробы крови пациента, и незамедлительное начало лечения остается приоритетом. Для лечения менингита применяется широкий спектр антибиотиков,
включая пенициллин, ампициллин и цефтриаксон. Во время эпидемий менингококкового и пневмококкового менингита препаратом выбора является цефтриаксон.
У каждого пятого пациента, перенесшего бактериальный менингит, могут наблюдаться долгосрочные последствия заболевания. К ним относятся потеря слуха, судороги, слабость в конечностях, нарушения зрения, речи, нарушения памяти, трудности в общении, а также шрамы и последствия ампутации конечностей в случае сепсиса.
Поддержка и последующее наблюдениеПоследствия менингита могут иметь колоссальное негативное воздействие на жизнь человека, его семьи и местного сообщества как в финансовом, так и в эмоциональном плане. Иногда такие осложнения, как глухота, трудности в обучении или поведенческие расстройства,
не распознаются родителями, опекунами или медицинскими работниками и поэтому остаются без лечения.
Иногда такие осложнения, как глухота, трудности в обучении или поведенческие расстройства,
не распознаются родителями, опекунами или медицинскими работниками и поэтому остаются без лечения.
Последствия перенесенного менингита зачастую требуют продолжительного лечения. Перманентное психосоциальное воздействие инвалидности, приобретенной в результате перенесенного менингита, может создавать у больных потребность в медицинской помощи, помощи
в сфере обучения, а также социальной и правозащитной поддержи. Несмотря на тяжелое бремя последствий менингита для больных, их семей и местных сообществ, доступ к услугам и поддержке при этих патологических состояниях часто недостаточен, особенно
в странах с низким и средним уровнем дохода. Лицам с инвалидностью, вызванной перенесенным менингитом, и их семьям должно быть рекомендовано обращаться за услугами и консультациями в местные и национальные общества инвалидов и другие организации,
ориентированные на помощь инвалидам, где им могут быть предоставлены жизненно важные консультации по вопросам их прав, экономических возможностей и социальной жизни, с тем чтобы люди, ставшие инвалидами вследствие перенесенного менингита, могли жить
полноценной жизнью.
Эпидемиологический надзор — от выявления случаев заболевания до их расследования и лабораторного подтверждения — является важнейшим условием успешной борьбы против менингококкового менингита. Основные цели эпиднадзора:
- обнаружение и подтверждение вспышек заболевания;
- мониторинг тенденций заболеваемости, включая распределение и эволюцию серогрупп и серотипов;
- оценка бремени болезни;
- мониторинг устойчивости возбудителей к антибиотикам;
- мониторинг циркуляции, распределения и эволюции отдельных штаммов;
- оценка эффективности стратегий по контролю менингита, в частности, программ вакцинопрофилактики.
Деятельность ВОЗ
ВОЗ при поддержке множества партнеров разработала глобальную дорожную карту по достижению целей в области борьбы с менингитом на период до 2030 г. В 2020 г. эта стратегия была одобрена в первой в истории резолюции Всемирной ассамблеи здравоохранения,
посвященной менингиту, и единогласно поддержана государствами-членами ВОЗ.
В дорожной карте поставлена глобальная задача по освобождению мира от менингита, в рамках которой сформулированы три амбициозные цели:
- элиминация эпидемий бактериального менингита;
- сокращение числа случаев вакциноуправляемого бактериального менингита на 50% и смертности от него на 70%;
- снижение числа случаев вызванной менингитом инвалидности и повышение качества жизни людей, перенесших менингит любого типа.
В дорожной карте изложен общий план достижения этих целей посредством согласованных действий по пяти взаимосвязанным направлениям:
- предупреждение и ликвидация эпидемий с упором на разработку новых недорогостоящих вакцин, достижение высокого охвата иммунизацией, совершенствование стратегий профилактики и реагирования на эпидемии;
- диагностика и лечение с акцентом на быстрое подтверждение диагноза и оптимальное оказание медицинской помощи;
- эпиднадзор за заболеваниями для информационного обеспечения решений в области профилактики и борьбы с менингитом;
- оказание помощи и поддержки лицам, перенесшим менингит, с упором на раннее выявление и расширение доступа к помощи и поддержке при осложнениях менингита;
- информационно-разъяснительная работа и взаимодействие с населением для повышения осведомленности о менингите, привлечения стран к борьбе с заболеванием и обеспечения реализации права людей на профилактику, лечение и последующий уход.

В рамках другой сопутствующей инициативы ВОЗ в консультации с государствами-членами работает над межсекторальным глобальным планом действий по эпилепсии и другим неврологическим расстройствам для решения многочисленных проблем и устранения пробелов в области ухода и обслуживания людей с эпилепсией и другими неврологическими расстройствами во всем мире. Вопросы защиты права людей с инвалидностью также признаются и рассматриваются в Глобальном плане действий ВОЗ по инвалидности, подготовленном в соответствии с положениями Конвенции о правах ребенка и Конвенции о правах инвалидов (КПИ), а также в эпохальной резолюции о достижении наивысшего уровня здоровья для людей с инвалидностью, принятой на 74-й сессии Всемирной ассамблеи здравоохранения.
Несмотря на то, что дорожная карта по борьбе с менингитом посвящена всем типам этого заболевания, в первую очередь она касается вопросов борьбы с основными возбудителями острого бактериального менингита (менингококк, пневмококк, haemophilus influenzae и стрептококк группы B). В 2019 г. эти бактерии были причиной более половины из 250 000 случаев смерти от всех форм менингита. Они также являются возбудителями других тяжелых заболеваний, таких как сепсис и пневмония. Против каждого из этих возбудителей
инфекций вакцины либо уже существуют, либо, как в случае со стрептококком группы В, ожидаются в ближайшие годы.
В 2019 г. эти бактерии были причиной более половины из 250 000 случаев смерти от всех форм менингита. Они также являются возбудителями других тяжелых заболеваний, таких как сепсис и пневмония. Против каждого из этих возбудителей
инфекций вакцины либо уже существуют, либо, как в случае со стрептококком группы В, ожидаются в ближайшие годы.
Источники:
Defeating meningitis 2030: baseline situation analysis
Достижение целей в области борьбы с менингитом на период до 2030 г. Глобальная дорожная карта
Конфедерация организаций по борьбе с менингитом (comomeningitis.org)
Веб-консультации по первому проекту межсекторального глобального плана действий по эпилепсии и другим неврологическим расстройствамБактериофаг стрептококковый инструкция по применению: показания, противопоказания, побочное действие – описание Streptococcal bacteriophag Раствор для приема внутрь, местного и наружного применения (42414)
Препарат используют для приема внутрь (через рот), ректального введения, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа и дренированные полости.
Рекомендуемые дозировки препарата
| Возраст пациента | Доза на 1 прием (мл) | |
| внутрь | в клизме | |
| 0-6 мес | 5 | 5-10 |
| 6-12 мес | 10 | 10-20 |
| от 1 года до 3 лет | 15 | 20-30 |
| от 3 до 8 лет | 15-20 | 30-40 |
| от 8 лет и старше | 20-30 | 40-50 |
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь в течение 7-20 дней (по клиническим показаниям).
В случае, если до применения бактериофага для лечения ран применялись химические, антисептики, рана должна быть тщательно промыта стерильным 0,9 % раствором натрия хлорида.
В зависимости от очага инфекции бактериофаг применяют:
1. В виде орошения, примочек и тампонирования в объеме до 200 мл в зависимости от размеров пораженного участка. При абсцессе после удаления гнойного содержимого с помощью пункции препарат вводят в количестве меньшем, чем объем удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
При абсцессе после удаления гнойного содержимого с помощью пункции препарат вводят в количестве меньшем, чем объем удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
2. При введении в полости (плевральную, суставную и другие ограниченные полости) до 100 мл оставляют капиллярный дренаж, через который бактериофаг вводят в течение нескольких дней.
3. При циститах, пиелонефритах, уретритах препарат принимают внутрь. В случае, если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку;
4. При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины, матки в дозе 5-10 мл ежедневно однократно,
5. При кольпите — по 10 мл орошением или тампонированием 2 раза в день. Тампоны закладывают на 2 часа.
5. При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введения смоченных турунд (оставляя их на 1 час).
Бактериофаг используют для полоскания, промывания, закапывания, введения смоченных турунд (оставляя их на 1 час).
6. При энтеральных инфекциях, дисбактериозс кишечника, препарат принимают внутрь 3 раза в день за 1 ч до приема пищи в течение 7-20 дней по клиническим показаниям. Возможно сочетание двукратного приема внутрь с однократным ректальным введением разовой возрастной дозы бактериофага в виде клизмы после опорожнения кишечника.
Применение бактериофага у детей (до 6 месяцев). При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки в дозе 5-10 мл. При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в виде высоких клизм) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или’ опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или’ опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалита, пиодермии,- инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи).,
Меры предосторожности при применении. Перед использованием флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Внимание! При помутнении препарат не применять!
Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором;
- снять колпачок, не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы;
- не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.

Вскрытие флакона и извлечение необходимого объема препарата может проводиться стерильным шприцем путем прокола пробки.
Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
13141516171819
20212223242526
2728293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Где живут микробы: 10 самых грязных мест в вашем доме :: Жилье :: РБК Недвижимость
Больше всего микробов живет на тех вещах, которые мы обычно упускаем из виду. Перед следующей уборкой советуем обратить внимание на десять самых грязных мест вашей квартиры
Перед следующей уборкой советуем обратить внимание на десять самых грязных мест вашей квартиры
Фото: Vanveenjf/Unsplash
С точки зрения микробной заселенности сиденье унитаза — это не самое опасное место в доме. Есть множество других очагов бактерий, которые ежедневно контактируют с нашим организмом. Например, зубные щетки и игровые геймпады. В конце концов такое взаимодействие приводит к пищевым отравлениям и аллергическим реакциям. Тщательная уборка в этих местах поможет обезопасить семью от заболеваний, вызываемых микроскопическими организмами.
В конце концов такое взаимодействие приводит к пищевым отравлениям и аллергическим реакциям. Тщательная уборка в этих местах поможет обезопасить семью от заболеваний, вызываемых микроскопическими организмами.
Редакция «РБК-Недвижимости» выбрала десять самых опасных вещей в квартире, которым следует уделить особое внимание.
Игровые рули и джойстики
Пульты от игровых приставок часто и подолгу контактируют с нашими руками, но при этом редко дезинфицируются. То же самое относится к смартфонам, компьютерным клавиатурам и мышкам. А если вы любите еще и перекусить во время игры, опасных бактерий будет намного больше. Тем самым вы создаете для них прекрасную питательную среду. Согласно исследованию ЮНИСЕФ, на каждые 100 кв. см игровых рулей и джойстиков приходится примерно 7,86 тыс. микробов. Это в пять раз больше, чем на ободке унитаза. Чтобы продезинфицировать устройство, извлеките из него батарейки и почистите ненужной зубной щеткой. Она должна быть сухой. После этого протрите поверхность геймпада тканью, смоченной в спиртовом или мыльном растворе.
Это в пять раз больше, чем на ободке унитаза. Чтобы продезинфицировать устройство, извлеките из него батарейки и почистите ненужной зубной щеткой. Она должна быть сухой. После этого протрите поверхность геймпада тканью, смоченной в спиртовом или мыльном растворе.
Подлокотники кресел и дивана
Чистить диваны и кресла нужно не только тогда, когда на обивку пролит напиток или рассыпаны крошки. Со временем там накапливается пыль и огромное количество болезнетворных микроорганизмов, среди которых — пылевые клещи. Эти паразиты могут спровоцировать приступ астмы, аллергию, ринит или дерматит. По данным ЮНИСЕФ, на каждых 100 кв. см подлокотников мягкой мебели обитает около 19,2 тыс. микробов. При этом на самом сиденье их в 12 раз меньше. Против микробов на мебели эффективна паровая очистка. Если у вас нет пароочистителя или паровой швабры, можно воспользоваться обычным пылесосом со щелевой насадкой. Особое внимание при этом уделите впадинам между сиденьем, спинкой и подлокотниками.
Особое внимание при этом уделите впадинам между сиденьем, спинкой и подлокотниками.
Кухонная раковина
Остатки пищи и теплая влажная среда в кухонной раковине — раздолье для микробов и грибков. Протирайте раковину после каждого мытья посуды и хотя бы раз в неделю обрабатывайте ее дезинфицирующим раствором. Особенно тщательно следует обработать слив: он считается самой грязной частью раковины. Не менее опасны поролоновые губки для посуды. Из-за высокой влажности и постоянного контакта с остатками пищи в их порах образуются целые колонии микроорганизмов. В ходе исследования Национального научного фонда США (NSF) 86% губок и тряпок дали положительный результат на дрожжи и плесень. В 75% образцов выявили кишечную палочку, еще в 18% — стафилококк. Эксперты рекомендуют менять губку не реже чем раз в неделю.
Разделочные доски
По подсчетам ученых, на поверхности разделочной доски микробов примерно в 200 раз больше, чем на ободке унитаза. Виной всему сырые рыба и мясо. Они содержат множество болезнетворных бактерий, которые гибнут только при термической обработке. Если у вас деревянная доска, на ней вдобавок может поселиться грибок. Старайтесь дезинфицировать доску не реже одного раза в неделю и каждые два-три месяца покупайте новую. Чтобы обезопасить семью, заведите минимум две разделочные доски: для свежего мяса и продуктов, которые употребляются в сыром виде. Например, для огурцов и листьев салата. А после мойки обязательно протирайте кухонные поверхности сухим полотенцем. Из-за влажности оставшиеся микроорганизмы могут выжить.
Виной всему сырые рыба и мясо. Они содержат множество болезнетворных бактерий, которые гибнут только при термической обработке. Если у вас деревянная доска, на ней вдобавок может поселиться грибок. Старайтесь дезинфицировать доску не реже одного раза в неделю и каждые два-три месяца покупайте новую. Чтобы обезопасить семью, заведите минимум две разделочные доски: для свежего мяса и продуктов, которые употребляются в сыром виде. Например, для огурцов и листьев салата. А после мойки обязательно протирайте кухонные поверхности сухим полотенцем. Из-за влажности оставшиеся микроорганизмы могут выжить.
Мелкие крошки, пятна от соуса, разводы от пролитого супа, контейнеры с немытыми овощами — все это делает холодильник одним из самых антисанитарных мест в доме. Ученые подсчитали: на 1 кв. см здесь обитает около 7,85 тыс. бактерий, в числе которых есть опасные сальмонелла, листерия и кишечная палочка. Избавиться от них помогает регулярная влажная уборка. Освободите холодильник от продуктов и продезинфицируйте все полки и стенки раствором теплой воды и уксуса. Отдельной обработки требует резиновый уплотнитель, где созданы наиболее благоприятные условия для бактерий. Особенно важно следить за чистотой холодильника в летний период: из-за высоких температур скорость размножения микробов увеличивается.
Избавиться от них помогает регулярная влажная уборка. Освободите холодильник от продуктов и продезинфицируйте все полки и стенки раствором теплой воды и уксуса. Отдельной обработки требует резиновый уплотнитель, где созданы наиболее благоприятные условия для бактерий. Особенно важно следить за чистотой холодильника в летний период: из-за высоких температур скорость размножения микробов увеличивается.
Ванна и шторка для душа
Как и в случае с раковиной, в ванне больше всего бактерий сосредоточено у канализационного слива. Залейте чистящее средство в сливное отверстие и оставьте на 5–10 минут, после чего смойте водой. Во время следующей уборки также не забудьте обработать смеситель, межплиточные швы, насадку для душа и стык между ванной и стеной. Для этого подойдет раствор соды или лимонной кислоты. Еще один очаг бактерий — виниловая шторка для ванной. Внизу она обычно покрыта желтоватыми разводами — это скопления бактерий. Старайтесь менять занавеску как можно чаще или замените ее тканевой, которую можно стирать в машинке. Кроме того, очень важно следить за уровнем влажности воздуха и регулярно проветривать ванную комнату.
Внизу она обычно покрыта желтоватыми разводами — это скопления бактерий. Старайтесь менять занавеску как можно чаще или замените ее тканевой, которую можно стирать в машинке. Кроме того, очень важно следить за уровнем влажности воздуха и регулярно проветривать ванную комнату.
Миски для корма животных
Корм может часами находиться в мисках домашних животных. Это создает питательную среду для бактерий и негативно отражается на здоровье питомцев и их хозяев. В кормушках и поилках ученые обнаружили 473,82 тыс. бактерий на 10 кв. см. Особенно опасными считаются пластиковые и керамические миски: в них микробиологи нашли кишечную палочку и стафилококк. Наиболее безвредны изделия из нержавеющей стали и стекла. Миска для корма животных требует ежедневной чистки. Тщательно удалите остатки пищи с помощью горячей воды и моющего средства. Раз в неделю кормушку также необходимо замачивать в растворе отбеливателя. Залейте ее дезинфицирующей жидкостью на 10 минут, затем промойте водой и высушите на воздухе.
Раз в неделю кормушку также необходимо замачивать в растворе отбеливателя. Залейте ее дезинфицирующей жидкостью на 10 минут, затем промойте водой и высушите на воздухе.
Дверные ручки и выключатели
Из-за частого и неизбежного использования дверные ручки становятся одним из наиболее грязных мест в доме. Это же относится к выключателям света и мебельным ручкам. Ученые из Вустерского политехнического института в США обнаружили 1,32 тыс. бактериальных колоний на 27 дверных ручках при оживленном университетском кампусе. Интересно, что уровень опасности напрямую зависит от типа ручки и материала, из которого она изготовлена. Британские исследователи выяснили: больше всего микробов скапливается на ручках рычажного типа. При этом медные ручки эффективно подавляют развитие бактерий. Возьмите за правило дезинфицировать их не реже одного раза в неделю. Для этого подойдут антибактериальные салфетки или спиртовой раствор.
Для этого подойдут антибактериальные салфетки или спиртовой раствор.
По данным ученых из Манчестерского университета, на зубной щетке обитает более 100 млн бактерий, в том числе кишечная палочка и стафилококк. Она поглощает все виды микробов, летающих в ванной комнате. Например, при смывании унитаза образуется водно-воздушный аэрозоль, насыщенный бактериями. Лучший способ минимизировать риск их распространения — это закрывать крышку перед каждым смыванием и хранить зубную щетку подальше от унитаза. Дорожный футляр для этих целей не подойдет. В нем щетка надолго останется влажной, что увеличит риск возникновения новых бактерий. Держатель для зубной щетки необходимо мыть теплой водой и мылом не реже одного-двух раз в неделю. После этого протрите его дезинфицирующей салфеткой.
Спальный матрас
Матрас буквально кишит пылевыми клещами, грибковыми спорами и бактериями. Основа их рациона — хлопья мертвой кожи. К тому же тут тепло, темно и влажно. Ученые советуют менять матрас через каждые семь-восемь лет. За такой период в нем успевает накопиться в среднем 4,5 кг кожных роговых чешуек. Это провоцирует аллергические реакции — заложенность носа, слезы, чихание, обострение астмы. Вот почему так важно регулярно пылесосить матрас и очищать подушки от пыли. Чтобы продлить «жизнь» матраса, не забывайте регулярно менять постельное белье. Его следует стирать при высокой температуре и гладить утюгом. Для защиты матраса можно также использовать специальные чехлы с влагонепроницаемой поверхностью.
Основа их рациона — хлопья мертвой кожи. К тому же тут тепло, темно и влажно. Ученые советуют менять матрас через каждые семь-восемь лет. За такой период в нем успевает накопиться в среднем 4,5 кг кожных роговых чешуек. Это провоцирует аллергические реакции — заложенность носа, слезы, чихание, обострение астмы. Вот почему так важно регулярно пылесосить матрас и очищать подушки от пыли. Чтобы продлить «жизнь» матраса, не забывайте регулярно менять постельное белье. Его следует стирать при высокой температуре и гладить утюгом. Для защиты матраса можно также использовать специальные чехлы с влагонепроницаемой поверхностью.
Стрептококковая инфекция группы B — Симптомы и причины
Обзор
Стрептококк группы B (стрептококк) — распространенная бактерия, часто переносимая в кишечнике или нижних отделах половых путей. Бактерия обычно безвредна для здоровых взрослых. Однако у новорожденных он может вызвать серьезное заболевание, известное как стрептококковая инфекция группы B.
Бактерия обычно безвредна для здоровых взрослых. Однако у новорожденных он может вызвать серьезное заболевание, известное как стрептококковая инфекция группы B.
Стрептококк группы B также может вызывать опасные инфекции у взрослых с определенными хроническими заболеваниями, такими как диабет или заболевание печени.Пожилые люди также подвержены повышенному риску заболевания из-за стрептококка группы B.
Если вы здоровый взрослый человек, вам ничего не нужно делать с стрептококком группы B. Если вы беременны, пройдите скрининг-тест на стрептококк группы B в третьем триместре. Если у вас стрептококк группы B, лечение антибиотиками во время родов может защитить вашего ребенка.
Продукты и услуги
Показать больше продуктов от Mayo ClinicСимптомы
Младенцы
Большинство детей, рожденных женщинами с стрептококком группы B, здоровы.Но те немногие, кто инфицированы стрептококком группы B во время родов, могут серьезно заболеть.
У младенцев заболевание, вызванное стрептококками группы B, может развиться в течение шести часов после рождения (раннее начало) или через несколько недель или месяцев после рождения (позднее начало).
Признаки и симптомы могут включать:
- Лихорадка
- Низкая температура тела
- Затруднение при кормлении
- Вялость, вялость или слабый мышечный тонус
- Затрудненное дыхание
- Раздражительность
- Дрожь
- Изъятия
- Сыпь
- Желтуха
Взрослые
Многие взрослые переносят стрептококк группы B в организме — обычно в кишечнике, влагалище, прямой кишке, мочевом пузыре или горле — и не имеют никаких признаков или симптомов.
Однако в некоторых случаях стрептококк группы B может вызывать инфекцию мочевыводящих путей или другие более серьезные инфекции. Признаки и симптомы инфекций, которые могут быть вызваны стрептококком группы B, включают следующее.
Инфекция мочевыводящих путей
- Сильные постоянные позывы к мочеиспусканию
- Чувство жжения или боли при мочеиспускании
- Частое выделение небольшого количества мочи
- Моча красного, ярко-розового цвета или цвета колы — признак крови в моче
- Боль в тазу
Инфекция крови (бактериемия)
- Лихорадка
- Озноб
- Замешательство или отсутствие бдительности
Пневмония
- Лихорадка
- Озноб
- Кашель
- Одышка
- Боль в груди при дыхании или кашле
Инфекция кожи или мягких тканей
- Отек, тепло или покраснение в области инфекции
- Боль в области инфекции
- Поражения с гноем или дренажом
Инфекция костей или суставов
- Лихорадка
- Озноб
- Отек, тепло или покраснение в области инфекции
- Боль в области инфекции
- Скованность или невозможность использования конечности или сустава
Когда обращаться к врачу
Если у вас есть признаки или симптомы стрептококковой инфекции группы B, особенно если вы беременны, страдаете хроническим заболеванием или вам больше 65 лет, немедленно обратитесь к врачу.
Если вы заметили у вашего ребенка признаки или симптомы стрептококковой инфекции группы B, немедленно обратитесь к врачу.
Причины
Многие здоровые люди переносят в организме стрептококковые бактерии группы B. Вы можете переносить бактерии в своем теле на короткое время — они могут приходить и уходить — или они могут быть у вас всегда. Бактерии стрептококка группы B не передаются половым путем и не передаются через пищу или воду.Как бактерии передаются кому-либо, кроме новорожденных, неизвестно.
Стрептококк группы B может передаваться ребенку во время родов через естественные родовые пути, если ребенок подвергается воздействию жидкостей, содержащих стрептококки группы B, или проглатывает их.
Факторы риска
Младенцы
Младенец подвергается повышенному риску развития стрептококковой инфекции группы B, если:
- Мать является носителем стрептококка группы В
- Ребенок родился преждевременно (ранее 37 недель)
- Вода у матери прекращается за 18 и более часов до родов
- У матери инфекция тканей плаценты и околоплодных вод (хориоамнионит)
- У матери инфекция мочевыводящих путей во время беременности
- Температура матери больше 100.
 4 F (38 C) во время родов
4 F (38 C) во время родов - Мать ранее родила ребенка с стрептококком группы B
Взрослые
Взрослые в возрасте 65 лет и старше подвергаются повышенному риску стрептококка группы B. Вы также подвержены повышенному риску, если у вас есть состояние, которое ослабляет вашу иммунную систему или другие серьезные заболевания, в том числе следующие:
- Диабет
- ВИЧ-инфекция
- Болезнь печени
- Болезнь сердца
- Рак или рак в анамнезе
Осложнения
Инфекция стрептококка группы B может привести к опасному для жизни заболеванию у младенцев, в том числе:
- Пневмония
- Воспаление оболочек и жидкости, окружающей головной и спинной мозг (менингит)
- Инфекция в кровотоке (бактериемия)
Если вы беременны, стрептококк группы B может вызвать следующее:
- Инфекция мочевыводящих путей
- Инфекция плаценты и околоплодных вод (хориоамнионит)
- Инфекция слизистой оболочки матки (эндометрит)
- Бактериемия
Если вы пожилой человек или имеете хроническое заболевание, стрептококковые бактерии группы B могут вызвать любое из следующих состояний:
- Кожная инфекция
- Бактериемия
- Инфекция мочевыводящих путей
- Пневмония
- Инфекции костей и суставов
- Инфекция сердечных клапанов (эндокардит)
- Менингит
Профилактика
Если вы беременны, Американский колледж акушеров и гинекологов рекомендует скрининг на стрептококк группы B на 36–37 неделях беременности. Ваш врач возьмет образцы мазков из влагалища и прямой кишки и отправит их в лабораторию для анализа.
Ваш врач возьмет образцы мазков из влагалища и прямой кишки и отправит их в лабораторию для анализа.
Положительный результат теста указывает на то, что вы являетесь носителем стрептококка группы B. Это не означает, что вы больны или что ваш ребенок пострадает, это означает, что вы подвержены повышенному риску передачи бактерий вашему ребенку.
Чтобы предотвратить распространение бактерий группы B на вашего ребенка во время схваток или родов, ваш врач может прописать вам внутривенный антибиотик — обычно пенициллин или родственное ему лекарство — когда начинаются роды.
Если у вас аллергия на пенициллин или родственные препараты, вы можете получить клиндамицин или ванкомицин в качестве альтернативы. Поскольку эффективность этих альтернатив недостаточно изучена, ваш ребенок будет находиться под наблюдением до 48 часов.
Заблаговременный прием пероральных антибиотиков не поможет, потому что бактерии могут вернуться до начала родов.
Лечение антибиотиками во время родов также рекомендуется, если вы:
- У вас инфекция мочевыводящих путей
- Роды родила с стрептококком группы В
- Повышение температуры во время родов
- Вы не родили ребенка в течение 18 часов после того, как у вас отошли воды
- Возникли роды до 37 недель и не тестировались на стрептококк группы B
Вакцина в разработке
Хотя она еще не доступна, исследователи работают над вакциной против стрептококка группы B, которая может помочь предотвратить инфицирование стрептококком группы B в будущем.
21 сентября 2021 г.
Streptococcus pneumoniae в мочевыводящих путях у детей с хронической болезнью почек
Emerg Infect Dis. 2011 Янв; 17 (1): 120–122.
Принадлежность автора: Гейдельбергский университет, Гейдельберг, Германия
Корреспондент. Адрес для переписки: Ирен Буркхардт, Отделение инфекционных болезней, микробиологии и гигиены Im Neuenheimer Feld 324, D-69115 Heidelberg, Германия; электронная почта: изд[email protected]Эта статья цитируется в других статьях PMC.Abstract
Streptococcus pneumoniae обычно не считается возбудителем инфекций мочевыводящих путей. Мы сообщаем о 3 детях с аномалиями мочевыводящих путей, у которых в моче было высокое количество S. pneumoniae (> 10 4 КОЕ / мл) и различные клинические симптомы.
Ключевые слова: Streptococcus pneumoniae, ИМП, пневмококкозурия, хроническая болезнь почек, дети, бактерии, отправка
Роль Streptococcus pneumoniae как возбудителя сепсиса, пневмонии и менингита хорошо известна ( 1 2 ).Однако опубликованные отчеты об инфекции мочевыводящих путей (ИМП), связанной с S. pneumoniae , немногочисленны, а S. pneumoniae обычно не считается возбудителем ИМП ни у взрослых, ни у детей ( 3 , 4 ). Мы сообщаем о 3 детях с аномалиями мочевыводящих путей и высоким уровнем S. pneumoniae в моче.
Отчеты о случаях
В июне 2008 года 23-месячный мальчик (пациент 1) получил помощь по поводу лихорадки и клинических признаков ИМП в отделении неотложной помощи детской больницы Гейдельбергского университета.Признаков респираторного заболевания у него не было. В его истории болезни были отмечены двусторонние кистозно-диспластические почки, врожденный клапан уретры (операция в октябре 2006 г.), терминальная почечная недостаточность и перитонеальный диализ с 2006 г., почечная анемия, гиперпаратиреоз, гиперфосфатемия, микроцефалия и нарушение нормального развития. Была взята кровь на посев и образец мочи. После 9 часов инкубации посев крови был положительным на S. pneumoniae , а количество мочи увеличилось на 10 5 КОЕ / мл на S.пневмония . Уровни лейкоцитов в крови были повышены (20 клеток / нл [норма <13 клеток / нл]), как и уровни лейкоцитов в моче (568 клеток / мкл [норма <4 клеток / мкл]). Мазок из зева был отрицательным на S. pneumoniae . Инфекция мальчика успешно вылечилась, и через 4 дня после госпитализации он был выписан. Дальнейший анализ показал, что оба изолята относятся к серотипу 15B и полностью чувствительны ко всем протестированным антибактериальным препаратам ().
Таблица 1
Характеристики изолятов Streptococcus pneumoniae у 3 детей с хронической болезнью почек, Германия, 2005–2010 гг. 3 В сентябре 2009 года 12-летний мальчик (пациент 2) обратился за помощью в нефрологическое отделение детской больницы Гейдельбергского университета. для ежегодного контрольного осмотра через 7 лет после трансплантации почки.Клинических признаков текущей инфекции у него не было. В его истории болезни были отмечены почечная недостаточность, врожденная непроходимость и рефлюкс уретрального клапана, трансплантация почки в 2002 году, илеоцекальный мешок, хроническая нефропатия трансплантата, метаболический ацидоз, гипертензия и почечная анемия. Образец мочи показал 10 5 КОЕ / мл S. pneumoniae и 10 3 КОЕ / мл Enterobacteriaceae . Уровень лейкоцитов в моче был немного повышен (16 клеток / мкл). Дальнейший анализ показал, что S.pneumoniae был серотипом 34 и полностью восприимчив ко всем протестированным антибактериальным препаратам (). В ноябре 2009 года педиатр направил 7-летнюю девочку (пациентка 3) в отделение неотложной помощи Детской больницы Гейдельбергского университета из-за отклонений от нормы в контрольной пробе мочи через 4 недели после чрескожной нефролитоапраксии и удаление конкремента. Было известно, что у нее цистинурия, и в 2004 году она уже перенесла экстракорпоральное лечение ударной волной с удалением конкремента.Температура была немного повышена (37,5 ° C), но дизурии и боли не было. Анализ мочи показал повышенный уровень лейкоцитов (158 клеток / мкл), и можно было вырастить 10 4 КОЕ / мл S. pneumoniae . Из-за легких симптомов лечение противомикробными препаратами не было начато. Дальнейший анализ показал, что изолят относится к серотипу 19F (). Для каждого пациента мочу обычно культивировали следующим образом: 2 образца по 1 мкл каждый помещали на чашку с агаром с 5% овечьей кровью и чашку с агаром МакКонки.В среду chromID CPS (bioMérieux, Нюртинген, Германия) вводили 10 мкл мочи. Все планшеты инкубировали 18–24 ч при 36 ° C ± 1 ° C на воздухе ( 5 ). Тестирование чувствительности проводили с использованием автоматизированной микробиологической системы BD Phoenix с панелями SMIC / ID (Becton Dickinson, Гейдельберг, Германия). Литература по инфекциям мочевыводящих путей, вызванным S. pneumoniae , немногочисленна. В 1980 году Грин и Селинджер описали пациента с абсцессом мягких тканей и ИМП, вызванными серотипом 3 ( 6 ).В 2004 году Dufke et al. описал пациента с пиелонефритом и уросепсисом, вызванными серотипом 6А ( 7 ). В 1988 году Нгуен и Пенн определили частоту пневмококков в образцах мочи взрослых и обнаружили, что 38 (0,18%) из 22 744 образцов положительны на S. pneumoniae ( 4 ). Аналогичным образом Miller et al. определили, что частота пневмококков в образцах мочи у детей была еще ниже: 43 (0,08%) из 53,499 образцов ( 3 ). Из 28 пациентов, по которым были доступны клинические данные, у 5 была дизурия, а у 2 — пиурия.Трое бессимптомных детей имели в анамнезе патологии мочеполовой системы; 6 бессимптомных детей имели в анамнезе рецидив ИМП с Enterobacteriaceae . Серотипы и чувствительность к антибиотикам соответствующих изолятов не сообщались. ИМП определяется как бактериурия (> 10 5 КОЕ / мл у взрослых,> 10 4 КОЕ / мл у детей) 1 уропатогена и типичных клинических признаков, например дизурии и позывов к мочеиспусканию. В зависимости от возраста пациента клинические признаки могут быть менее типичными, особенно у детей младше 2 лет.Обычно присутствует пиурия ( 8 , 9 ). Напротив, бессимптомная бактериурия определяется как уропатоген (> 10 5 КОЕ / мл у взрослых,> 10 4 КОЕ / мл у детей) без пиурии (<10 лейкоцитов / мкл) ( 9 ). Применение этих критериев к трем случаям в этом отчете дает следующие результаты. Если предположить, что S. pneumoniae является уропатогеном, случай 1 представляет собой ИМП, сопровождающуюся сепсисом. Других очагов заражения S.pneumoniae была очевидна или могла быть идентифицирована. Мы полагаем, что это восходящая ИМП у мальчика с известной олигурией из-за двусторонней кистозно-диспластической почки. Поскольку у пациента 3 наблюдались лишь легкие симптомы, диагностика ИМП не обязательна. Тем не менее, это не простая пневмококозурия из-за большого количества лейкоцитов в моче (158 клеток / мкл). Случай 2 сложнее классифицировать. Описанный эпизод может быть пневмококозурией из-за невысокого уровня лейкоцитов; тем не менее, это выше нормы.Повторная оценка всех микробиологических данных пациента 2 показала, что с 2005 г. мы получили 29 различных образцов мочи. В марте 2007 г. мы уже идентифицировали S. pneumoniae (10 4 КОЕ / мл) и пиурию (92 КОЕ / мкл). Кроме того, 10 4 КОЕ / мл Proteus mirabilis присутствовали и считались причиной пиурии; 11 из 27 образцов содержали α-гемолитические стрептококки> 10 3 КОЕ / мл (). К сожалению, изначально на этих бактериях не проводилось никаких тестов, позволяющих отличить пневмококки от других α-гемолитических стрептококков.Следовательно, мы можем только предполагать, содержали ли хотя бы некоторые из этих образцов S. pneumoniae . Принимая во внимание эти факты, мы полагаем, что это может быть случай бактериальной персистенции в соответствии с критериями, описанными Чангом и Шортлиффом (культуры ± один и тот же организм) ( 8 ). Результаты анализа образцов мочи 12-летнего мальчика с хронической болезнью почек, Германия, 2005–2010 годы Дальнейший анализ изолятов S. pneumoniae показал, что все 3 ребенка были поражены разными серотипами. Следовательно, у нас нет указаний на то, что какой-то один серотип имеет пристрастие к мочевыводящим путям. Теоретически с помощью вакцинации можно было бы избежать 2 случаев, то есть случая 3 (серотип 19F) и случая 1 (серотип 15B).Однако пациенту 3 было 4 года, когда в Германии в 2006 году началась рутинная программа вакцинации детей младше 2 лет. Поскольку программы наверстывания не существовало, этот ребенок никогда не был вакцинирован против пневмококков. Случай-пациент 1 регулярно вакцинировался гептавалентной пневмококковой конъюгированной вакциной в 2006–2007 гг., Но на момент начала заболевания ему было всего 23 месяца, то есть на 1 месяц меньше, чтобы иметь право на вакцинацию 23-валентной пневмококковой полисахаридной вакциной. Пациент 2 еще не вакцинирован против пневмококков.Таким образом, мы предлагаем добавить S. pneumoniae к потенциальным возбудителям ИМП у детей с аномалиями мочевыводящих путей. Серотипы и растворимость в желчи были определены в Национальном справочном центре по стрептококкам, Ахен, Германия. • Доктор Буркхардт — консультант по микробиологии, вирусологии и эпидемиологии инфекционных заболеваний, который работает в отделении инфекционных болезней, микробиологии и гигиены Гейдельбергского университета, Германия.Ее главный интерес — клинические проявления и эпидемиология пневмококковых заболеваний, а также определение факторов риска пневмококковых заболеваний. • Доктор Циммерманн — консультант по микробиологии, вирусологии и эпидемиологии инфекционных заболеваний. Он является старшим врачом отделения инфекционных болезней, микробиологии и гигиены Гейдельбергского университета, Германия. Его основные научные интересы включают лептоспироз и лейшманиоз. Предлагаемая ссылка на эту статью: Burckhardt I, Zimmermann S. Streptococcus pneumoniae в мочевыводящих путях у детей с хронической болезнью почек. Emerg Infect Dis [сериал в Интернете]. 2011, январь [, дата цитирования ]. http://dx.doi.org/10.3201/eid1701.100895 Emerg Infect Dis. 2011 Янв; 17 (1): 120–122. Принадлежность автора: Гейдельбергский университет, Гейдельберг, Германия Streptococcus pneumoniae обычно не считается возбудителем инфекций мочевыводящих путей. Мы сообщаем о 3 детях с аномалиями мочевыводящих путей, у которых в моче было высокое количество S. pneumoniae (> 10 4 КОЕ / мл) и различные клинические симптомы. Ключевые слова: Streptococcus pneumoniae, ИМП, пневмококкозурия, хроническая болезнь почек, дети, бактерии, отправка Роль Streptococcus pneumoniae как возбудителя сепсиса, пневмонии и менингита хорошо известна ( 1 2 ). Однако опубликованные отчеты об инфекции мочевыводящих путей (ИМП), связанной с S. pneumoniae , немногочисленны, а S. pneumoniae обычно не считается возбудителем ИМП ни у взрослых, ни у детей ( 3 , 4 ).Мы сообщаем о 3 детях с аномалиями мочевыводящих путей и высоким уровнем S. pneumoniae в моче. В июне 2008 года 23-месячный мальчик (пациент 1) получил помощь по поводу лихорадки и клинических признаков ИМП в отделении неотложной помощи детской больницы Гейдельбергского университета. Признаков респираторного заболевания у него не было. В его истории болезни были отмечены двусторонние кистозно-диспластические почки, врожденный клапан уретры (операция в октябре 2006 г.), терминальная почечная недостаточность и перитонеальный диализ с 2006 г., почечная анемия, гиперпаратиреоз, гиперфосфатемия, микроцефалия и нарушение нормального развития.Была взята кровь на посев и образец мочи. После 9 часов инкубации посев крови был положительным на S. pneumoniae , а в моче выросло 10 5 КОЕ / мл на S. pneumoniae . Уровни лейкоцитов в крови были повышены (20 клеток / нл [норма <13 клеток / нл]), как и уровни лейкоцитов в моче (568 клеток / мкл [норма <4 клеток / мкл]). Мазок из зева был отрицательным на S. pneumoniae . Инфекция мальчика успешно вылечилась, и через 4 дня после госпитализации он был выписан.Дальнейший анализ показал, что оба изолята относятся к серотипу 15B и полностью чувствительны ко всем протестированным антибактериальным препаратам (). Характеристики изолятов Streptococcus pneumoniae у 3 детей с хронической болезнью почек, Германия, 2005–2010 гг. 3 В сентябре 2009 года 12-летний мальчик (пациент 2) обратился за помощью в нефрологическое отделение детской больницы Гейдельбергского университета. для ежегодного контрольного осмотра через 7 лет после трансплантации почки.Клинических признаков текущей инфекции у него не было. В его истории болезни были отмечены почечная недостаточность, врожденная непроходимость и рефлюкс уретрального клапана, трансплантация почки в 2002 году, илеоцекальный мешок, хроническая нефропатия трансплантата, метаболический ацидоз, гипертензия и почечная анемия. Образец мочи показал 10 5 КОЕ / мл S. pneumoniae и 10 3 КОЕ / мл Enterobacteriaceae . Уровень лейкоцитов в моче был немного повышен (16 клеток / мкл). Дальнейший анализ показал, что S.pneumoniae был серотипом 34 и полностью восприимчив ко всем протестированным антибактериальным препаратам (). В ноябре 2009 года педиатр направил 7-летнюю девочку (пациентка 3) в отделение неотложной помощи Детской больницы Гейдельбергского университета из-за отклонений от нормы в контрольной пробе мочи через 4 недели после чрескожной нефролитоапраксии и удаление конкремента. Было известно, что у нее цистинурия, и в 2004 году она уже перенесла экстракорпоральное лечение ударной волной с удалением конкремента.Температура была немного повышена (37,5 ° C), но дизурии и боли не было. Анализ мочи показал повышенный уровень лейкоцитов (158 клеток / мкл), и можно было вырастить 10 4 КОЕ / мл S. pneumoniae . Из-за легких симптомов лечение противомикробными препаратами не было начато. Дальнейший анализ показал, что изолят относится к серотипу 19F (). Для каждого пациента мочу обычно культивировали следующим образом: 2 образца по 1 мкл каждый помещали на чашку с агаром с 5% овечьей кровью и чашку с агаром МакКонки.В среду chromID CPS (bioMérieux, Нюртинген, Германия) вводили 10 мкл мочи. Все планшеты инкубировали 18–24 ч при 36 ° C ± 1 ° C на воздухе ( 5 ). Тестирование чувствительности проводили с использованием автоматизированной микробиологической системы BD Phoenix с панелями SMIC / ID (Becton Dickinson, Гейдельберг, Германия). Литература по инфекциям мочевыводящих путей, вызванным S. pneumoniae , немногочисленна. В 1980 году Грин и Селинджер описали пациента с абсцессом мягких тканей и ИМП, вызванными серотипом 3 ( 6 ).В 2004 году Dufke et al. описал пациента с пиелонефритом и уросепсисом, вызванными серотипом 6А ( 7 ). В 1988 году Нгуен и Пенн определили частоту пневмококков в образцах мочи взрослых и обнаружили, что 38 (0,18%) из 22 744 образцов положительны на S. pneumoniae ( 4 ). Аналогичным образом Miller et al. определили, что частота пневмококков в образцах мочи у детей была еще ниже: 43 (0,08%) из 53,499 образцов ( 3 ). Из 28 пациентов, по которым были доступны клинические данные, у 5 была дизурия, а у 2 — пиурия.Трое бессимптомных детей имели в анамнезе патологии мочеполовой системы; 6 бессимптомных детей имели в анамнезе рецидив ИМП с Enterobacteriaceae . Серотипы и чувствительность к антибиотикам соответствующих изолятов не сообщались. ИМП определяется как бактериурия (> 10 5 КОЕ / мл у взрослых,> 10 4 КОЕ / мл у детей) 1 уропатогена и типичных клинических признаков, например дизурии и позывов к мочеиспусканию. В зависимости от возраста пациента клинические признаки могут быть менее типичными, особенно у детей младше 2 лет.Обычно присутствует пиурия ( 8 , 9 ). Напротив, бессимптомная бактериурия определяется как уропатоген (> 10 5 КОЕ / мл у взрослых,> 10 4 КОЕ / мл у детей) без пиурии (<10 лейкоцитов / мкл) ( 9 ). Применение этих критериев к трем случаям в этом отчете дает следующие результаты. Если предположить, что S. pneumoniae является уропатогеном, случай 1 представляет собой ИМП, сопровождающуюся сепсисом. Других очагов заражения S.pneumoniae была очевидна или могла быть идентифицирована. Мы полагаем, что это восходящая ИМП у мальчика с известной олигурией из-за двусторонней кистозно-диспластической почки. Поскольку у пациента 3 наблюдались лишь легкие симптомы, диагностика ИМП не обязательна. Тем не менее, это не простая пневмококозурия из-за большого количества лейкоцитов в моче (158 клеток / мкл). Случай 2 сложнее классифицировать. Описанный эпизод может быть пневмококозурией из-за невысокого уровня лейкоцитов; тем не менее, это выше нормы.Повторная оценка всех микробиологических данных пациента 2 показала, что с 2005 г. мы получили 29 различных образцов мочи. В марте 2007 г. мы уже идентифицировали S. pneumoniae (10 4 КОЕ / мл) и пиурию (92 КОЕ / мкл). Кроме того, 10 4 КОЕ / мл Proteus mirabilis присутствовали и считались причиной пиурии; 11 из 27 образцов содержали α-гемолитические стрептококки> 10 3 КОЕ / мл (). К сожалению, изначально на этих бактериях не проводилось никаких тестов, позволяющих отличить пневмококки от других α-гемолитических стрептококков.Следовательно, мы можем только предполагать, содержали ли хотя бы некоторые из этих образцов S. pneumoniae . Принимая во внимание эти факты, мы полагаем, что это может быть случай бактериальной персистенции в соответствии с критериями, описанными Чангом и Шортлиффом (культуры ± один и тот же организм) ( 8 ). Результаты анализа образцов мочи 12-летнего мальчика с хронической болезнью почек, Германия, 2005–2010 годы Дальнейший анализ изолятов S. pneumoniae показал, что все 3 ребенка были поражены разными серотипами. Следовательно, у нас нет указаний на то, что какой-то один серотип имеет пристрастие к мочевыводящим путям. Теоретически с помощью вакцинации можно было бы избежать 2 случаев, то есть случая 3 (серотип 19F) и случая 1 (серотип 15B).Однако пациенту 3 было 4 года, когда в Германии в 2006 году началась рутинная программа вакцинации детей младше 2 лет. Поскольку программы наверстывания не существовало, этот ребенок никогда не был вакцинирован против пневмококков. Случай-пациент 1 регулярно вакцинировался гептавалентной пневмококковой конъюгированной вакциной в 2006–2007 гг., Но на момент начала заболевания ему было всего 23 месяца, то есть на 1 месяц меньше, чтобы иметь право на вакцинацию 23-валентной пневмококковой полисахаридной вакциной. Пациент 2 еще не вакцинирован против пневмококков.Таким образом, мы предлагаем добавить S. pneumoniae к потенциальным возбудителям ИМП у детей с аномалиями мочевыводящих путей. Серотипы и растворимость в желчи были определены в Национальном справочном центре по стрептококкам, Ахен, Германия. • Доктор Буркхардт — консультант по микробиологии, вирусологии и эпидемиологии инфекционных заболеваний, который работает в отделении инфекционных болезней, микробиологии и гигиены Гейдельбергского университета, Германия.Ее главный интерес — клинические проявления и эпидемиология пневмококковых заболеваний, а также определение факторов риска пневмококковых заболеваний. • Доктор Циммерманн — консультант по микробиологии, вирусологии и эпидемиологии инфекционных заболеваний. Он является старшим врачом отделения инфекционных болезней, микробиологии и гигиены Гейдельбергского университета, Германия. Его основные научные интересы включают лептоспироз и лейшманиоз. Предлагаемая ссылка на эту статью: Burckhardt I, Zimmermann S. Streptococcus pneumoniae в мочевыводящих путях у детей с хронической болезнью почек. Emerg Infect Dis [сериал в Интернете]. 2011, январь [, дата цитирования ]. http://dx.doi.org/10.3201/eid1701.100895 Число инвазивных инфекций GBS среди пожилого населения постоянно увеличивается [5], но причина этого явления неясна.В Дании с 2005 по 2018 год заболеваемость инвазивным СГБ у взрослых старше 65 лет увеличилась более чем в два раза (с 3,23 до 8,34 на 100 000). Подобные тенденции наблюдались и в других странах [8,9,10,11,12]. Распространенность сопутствующих заболеваний, которые увеличиваются с возрастом, или рост колонизации GBS обсуждались как потенциальные факторы, способствующие этому. Хотя распространенность колонизации GBS у беременных женщин изучалась в многочисленных исследованиях, средняя оценка которых составляла около 20%, распространенность среди пожилого населения — особенно группы с увеличивающимся количеством инвазивных инфекций GBS — неизвестна.Скорость колонизации GBS связана с сексуальным опытом и активностью [22, 23]. Учитывая, что сексуальная активность у пожилых людей может меняться со временем [24] и, возможно, увеличилась в последние десятилетия, мы стремились определить уровень колонизации вагинального СГБ у пожилых женщин. Наше исследование показало, что распространенность колонизации GBS составляет 17% у женщин в постменопаузе (средний возраст 68 лет), что аналогично сообщению Moltó-Garcia et al. (17,8%) в Испании [25]. Эдвардс и др. сообщил о скорости колонизации 21.7% у 254 здоровых пожилых участников (средний возраст 73 года) в 2005 г. [15]. Каплан и др. обнаружили, что в 1983 г. распространенность колонизации GBS составляла 12% среди 167 пожилых жителей домов (средний возраст 84 года) [26]. Эти данные показывают, что скорость колонизации GBS у беременных женщин и здоровых пожилых людей одинакова [16]. Все изоляты GBS сохранили чувствительность к пенициллину. Однако по сравнению с нашим предыдущим исследованием, проведенным на изолятах GBS от беременных женщин, протестированных в период с 2009 по 2010 год в том же географическом районе, мы наблюдали более высокую долю изолятов, нечувствительных к эритромицину (22% против 14.6%), клиндамицину (14% против 8,2%) и как клиндамицину, так и эритромицину (11% против 7,7%), и это продемонстрировало индуцибельную резистентность к клиндамицину (8% против 5,8%) [20]. Однако научное сравнение невозможно, поскольку не было получено продольных данных. Мольто-Гарсия и др. сообщили об аналогичном уровне устойчивости к эритромицину (23,4%) среди образцов GBS, собранных в период с 2011 по 2012 год. Хотя они выявили более высокую распространенность конститутивной устойчивости к клиндамицину (20,6%), они наблюдали фенотип MLS B только у 0.9% их штаммов. О возрастающих тенденциях устойчивости также сообщалось в других источниках [7, 8, 9, 10, 11, 25, 27]. Возможно, что пожилые люди подвергались воздействию антибиотиков чаще, чем беременные женщины, и, следовательно, изоляты GBS демонстрируют более высокий уровень устойчивости. Однако в нашем исследовании мы не проводили такого сравнения. Мы обнаружили один изолят GBS с фенотипом L (устойчивый к клиндамицину, но чувствительный к эритромицину). Этот фенотип встречается редко и может возникать из-за инактивации линкозамид-специфичных нуклеотидил-трансфераз, кодируемых генами lnu [28].Альтернативно, этот необычный механизм устойчивости может быть также опосредован переносчиком ABC, кодируемым lsaC генами, и отвечать за перекрестную устойчивость к стрептограмину A (фенотип LSA) и плевромутилинам (фенотип LSAP) [29, 30]. В последнее время появляется все больше сообщений о таком фенотипе в США, Европе, Китае, Корее и других странах с распространенностью от 0,26% в Италии до 15,9% в Корее [31,32,33,34]. Этот фенотип был обнаружен в одном из наиболее распространенных клонов, циркулирующих во всем мире, ST19.Это наблюдение вызывает беспокойство, поскольку клиндамицин часто используется в качестве альтернативы пациентам с подтвержденной аллергией на пенициллин. Наиболее распространенными капсульными серотипами в нашей популяции были III, V и Ia [20]. ST1, ST19 и ST23 были преобладающими клонами, составляя 28% наших изолятов. Постоянно сообщалось, что все три ST в значительной степени связаны с бессимптомной колонизацией из-за их ограниченной инвазивной способности [14]. Однако, когда он принадлежит к капсульному серотипу V, ST1 был связан с инвазивным заболеванием, и предполагалось возможное происхождение от предка крупного рогатого скота, аналогично случаю гипервирулентного клона ST17 [35].Аналогичным образом, ST23 был обнаружен у носителей и инвазивных изолятов [36]. Клон ST17 был идентифицирован только в одном штамме. Мы подтвердили значительно более высокие показатели устойчивости к макролидам и клиндамицину, связанные с генетическим фоном ST1, принадлежащего к клональному комплексу 1, как описано ранее [27]. Однако, в отличие от Lopes et al., Которые сообщили об ассоциации ST1 и капсульного серотипа Ib, мы наблюдали связь с капсульным серотипом V [27]. Ассоциация ST1 и капсульного серотипа V также описана в другом месте [37]. У нашего исследования есть ограничения. Из-за медленного набора исследование было прекращено до достижения расчетного целевого размера выборки, в результате чего была получена относительно небольшая исследуемая популяция. Однако количество участников было сопоставимо (или даже больше) с таковыми в предыдущих исследованиях, а распространенность GBS была аналогична таковой в исследовании, в котором участвовало 600 человек [15, 25, 26]. Мы получили только вагинальные, а не ректовагинальные мазки, и, возможно, пропустили неизвестную часть людей, колонизировавших СГБ.Однако мы убеждены, что потенциальная разница между двумя методами отбора проб не повлияла существенно на общую скорость колонизации GBS в нашей исследуемой популяции. Восемь изолятов GBS были потеряны для фенотипического и генотипического анализа (рис. 1). Учитывая отсутствие связи между факторами риска, тестированием на резистентность и серотипом, маловероятно, что результаты этих восьми потерянных изолятов GBS изменили бы общие результаты. Ratjen FA. Муковисцидоз: патогенез и будущие стратегии лечения. Respir Care. 2009. 54 (5): 595–605. Артикул
PubMed
Google Scholar Гуджино ВБ. Муковисцидоз и солевой спор. Клетка. 1999. 96 (5): 607–10. CAS
Статья
PubMed
Google Scholar Сюретка MG. Микробиом легких при муковисцидозе. Ann Am Thorac Soc.2014; 11 (Приложение 1): S61–5. Артикул
PubMed
Google Scholar Керем Э., Кори М., Голд Р., Левисон Х. Функция легких и клиническое течение у пациентов с муковисцидозом после колонизации легких синегнойной палочкой. J Pediatr. 1990; 116 (5): 714–9. CAS
Статья
PubMed
Google Scholar Fauroux B, Hart N, Belfar S, Boule M, Tillous-Borde I, Bonnet D и др.Burkholderia cepacia связана с легочной гипертензией и повышенной смертностью пациентов с муковисцидозом. J Clin Microbiol. 2004. 42 (12): 5537–41. Артикул
PubMed
PubMed Central
Google Scholar Dasenbrook EC, Merlo CA, Diener-West M, Lechtzin N, Boyle MP. Персистентный метициллин-резистентный золотистый стафилококк и скорость снижения ОФВ1 при муковисцидозе. Am J Respir Crit Care Med. 2008. 178 (8): 814–21. Артикул
PubMed
Google Scholar Parkins MD, Surette MG. Понимание естественного течения и клинических последствий инфекций дыхательных путей при МВ, выходя за рамки классики. J Cyst Fibros. 2016; 15 (3): 270–1. Артикул
PubMed
Google Scholar Хирон Р., Маршандин Х., Кауниль Ф, Джумас-Билак Е., Фрейдьер А. М., Беллон Дж., Хассон Миссури, Терк Д., Бремонт Ф., Шабанон Г., Сегонд С.Клинико-микробиологические особенности Inquilinus sp. изолирует от пяти пациентов с муковисцидозом. J Clin Microbiol. 2005. 43 (8): 3938–43. Артикул
PubMed
PubMed Central
Google Scholar Degand N, Lotte R, Deconde le Butor C, Segonds C, Thouverez M, Ferroni A, Vallier C, Mely L, Carrere J. Эпидемическое распространение Pandoraea pulmonicola в центре кистозного фиброза. BMC Infect Dis. 2015; 15: 583. Артикул
PubMed
PubMed Central
Google Scholar A. Perry FKG, M. Brodlie, M. Ni Chroinin, D. Mullane, B. Plant, G. McElvaney, C. Gunaratnam, K. Schaffer, J. Egan, D. Kenna, C. Perry, JF Turton, Э. Махентиралингем, MM Ханнан. Ralstonia mannitolilytica — новая угроза при муковисцидозе и трансплантации легких. Доклад представлен на Европейской конференции по муковисцидозу, 2015 г. Реестр фонда кистозного фиброза. Отчет. 2013 г. Источник: https://www.cff.org/About-Us/Assets/2013-Annual-Report/. Годовой отчет Канадского реестра кистозного фиброза за 2013 год. Источник: http://www.cysticfibrosis.ca/uploads/cf%20care/Canadian-CF-Registry-2013-FINAL.pdf. Австралийский регистр данных по муковисцидозу за 2014 год. Источник: https://www.cysticfibrosis.org.au/media/wysiwyg/CF-Australia/medical-documents/CFA_DataRegistryReport_2014_Final.pdf. Реестр Европейского общества муковисцидоза 2013 г. Доступ по ссылке: https://www.ecfs.eu/sites/default/files/general-content-files/working-groups/ecfs-patient-registry/ECFSPR_Report2013_02.2016.pdf. Скольник К., Нгуен А., Сомаяджи Р., Торнтон С.С., Уодделл Б., Суретт М.Г. и др. Клинические последствия и характеристика стрептококковой инфекции группы А у взрослых с муковисцидозом. BMC Pulm Med. 2015; 15: 161. Артикул
PubMed
PubMed Central
Google Scholar Алмейда А., Злодей А., Жубрель С., Туак Г., Соваж Е., Розински-Чупин И. и др. Полногеномное сравнение выявляет геномные мутации между стрептококками группы B, взятыми у инфицированных новорожденных и их матерей.J Bacteriol. 2015; 197 (20): 3354–66. CAS
Статья
PubMed
PubMed Central
Google Scholar Phares CR, Lynfield R, Farley MM, Mohle-Boetani J, Harrison LH, Petit S, et al. Эпидемиология инвазивной стрептококковой инфекции группы B в США, 1999-2005 гг. ДЖАМА. 2008. 299 (17): 2056–65. CAS
Статья
PubMed
Google Scholar Zangwill KM, Schuchat A, Wenger JD. Стрептококковая инфекция группы B в США, 1990: отчет многогосударственной системы активного наблюдения. MMWR CDC Surveill Summ. 1992. 41 (6): 25–32. CAS
PubMed
Google Scholar Калин А., Акоста С., Куринчук Дж. Дж., Броклхерст П., Найт М. Тяжелый сепсис у женщин со стрептококком группы В во время беременности: предварительное национальное исследование случай-контроль в Великобритании. BMJ Open. 2015; 5 (10): e007976. Артикул
PubMed
PubMed Central
Google Scholar Джексон Л.А., Хилсдон Р., Фарли М.М., Харрисон Л.Х., Рейнгольд А.Л., Пликайтис Б.Д. и др. Факторы риска стрептококковой инфекции группы B у взрослых. Ann Intern Med. 1995. 123 (6): 415–20. CAS
Статья
PubMed
Google Scholar Verghese A, Mireault K, Arbeit RD. Стрептококковая бактериемия группы В у мужчин.Rev Infect Dis. 1986. 8 (6): 912–7. CAS
Статья
PubMed
Google Scholar Фарли М.М., Харви Р.С., Стулл Т. и др. Популяционная оценка инвазивного заболевания, вызванного стрептококком группы B, у небеременных взрослых. N Engl J Med. 1993; 328 (25): 1807. CAS
Статья
PubMed
Google Scholar Эйкель В., Каль Б., Рейниш Б. и др.Возникновение респираторного Streptococcus agalactiae у больных муковисцидозом. PLoS One. 2000; 4: 1–7. Google Scholar Доерн Г.В., Брогден-Торрес Б. Оптимальное использование селективных сред в чашках при первичной обработке образцов дыхательных путей от пациентов с муковисцидозом. J Clin Microbiol. 1992; 30: 2740–2. CAS
PubMed
PubMed Central
Google Scholar Розенфельд М, Зонтаг МК, Рен ЦЛ. Диагностика муковисцидоза и обследование новорожденных. Pediatr Clin N Am. 2016; 63 (4): 599–615. Артикул
Google Scholar Fuchs HJ, Borowitz DS, Christiansen DH, Morris EM, Nash ML, Ramsey BW и др. Эффект аэрозольной рекомбинантной ДНКазы человека на обострения респираторных симптомов и на функцию легких у пациентов с муковисцидозом. Группа исследования пульмозима. N Engl J Med.1994. 331 (10): 637–42. CAS
Статья
PubMed
Google Scholar Лам Дж. С., Сомаяджи Р., Суретт М.Г., Рабин Х.Р., Паркинс Мэриленд. Уменьшение плотности мокроты Pseudomonas Aeruginosa во время обострения муковисцидоза легких не предсказывает клинического ответа. BMC Infect Dis. 2015; 15: 145. Артикул
PubMed
PubMed Central
Google Scholar Ли Т.В., Браунли К.Г., Конвей С.П., Дентон М., Литтлвуд Дж. М.. Оценка нового определения хронической инфекции Pseudomonas aeruginosa у пациентов с муковисцидозом. J Cyst Fibros. 2003. 2 (1): 29–34. Артикул
PubMed
Google Scholar Waters V, Yau Y, Prasad S, Lu A, Atenafu E, Crandall I, et al. Stenotrophomonas maltophilia при муковисцидозе: серологический ответ и влияние на заболевание легких.Am J Respir Crit Care Med. 2011; 183 (5): 635–40. Артикул
PubMed
Google Scholar Сибли К.А., Сибли К.А., Леонг Т.А., Гринвис М.Э., Паркинс М.Д., Рабин Х.Р., Сюретт М.Г. Популяция Streptococcus Milleri из клиники кистозного фиброза выявляет специфичность пациента и внутривидовое разнообразие. J Clin Microbiol. 2010. 48: 2592–4. CAS
Статья
PubMed
PubMed Central
Google Scholar Барти К.Л., Уилсон М.Дж., Уильямс Д.В., Льюис М.А. Макрорестрикционная дактилоскопия бактерий группы Streptococcus Milleri с помощью гель-электрофореза в импульсном поле. J Clin Microbiol. 2000; 38: 2141–9. CAS
PubMed
PubMed Central
Google Scholar Thornton CS, Brown EL, Alcantara J, Rabin HR, Parkins MD. Распространенность и влияние Streptococcus Pneumoniae на взрослых пациентов с муковисцидозом: ретроспективный обзор диаграммы и исследование капсульного серотипирования.BMC Pulm Med. 2015; 15:49. Артикул
PubMed
PubMed Central
Google Scholar CLSI. Стандарты производительности для тестов на чувствительность к антимикробным препаратам; утвержденный стандарт-десятое издание, документ CLSI M02-A10. 2009. Институт клинических и лабораторных стандартов. Burns JL, Emerson J, Stapp JR, Yim DL, Krzewinski J, et al. Микробиология мокроты пациентов в центрах кистозного фиброза в США.Clin Infect Dis. 1998. 27: 158–63. CAS
Статья
PubMed
Google Scholar Fluegge K, Siedler A, Heinrich B., Schulte-Moenting J, Moennig MJ, Bartels DB, et al. Заболеваемость и клинические проявления инвазивных неонатальных стрептококковых инфекций группы B в Германии. Педиатрия. 2006; 117 (6): e1139–45. Артикул
PubMed
Google Scholar Brimil N, Barthell E, Heindrichs U, Kuhn M, Lutticken R, Spellerberg B. Эпидемиология колонизации Streptococcus agalactiae в Германии. Int J Med Microbiol. 2006. 296 (1): 39–44. Артикул
PubMed
Google Scholar Ривера Л., Саез-Льоренс Х, Ферис-Иглесиас Дж., Ип М., Саха С., Адриан П.В. и др. Заболеваемость и распределение серотипов инвазивной стрептококковой инфекции группы B у детей раннего возраста: обсервационное исследование в нескольких странах.BMC Pediatr. 2015; 15: 143. Артикул
PubMed
PubMed Central
Google Scholar Stoll BJ, Schuchat A. Материнское носительство стрептококков группы B в развивающихся странах. Pediatr Infect Dis J. 1998; 17 (6): 499–503. CAS
Статья
PubMed
Google Scholar Черч Д., Карсон Дж., Грегсон Д. Изучение точечной распространенности чувствительности к антибиотикам генитального стрептококка группы B, выделенного у женщин, родившихся на близком сроке, в Калгари, Альберта.Может ли заразить Dis Med Microbiol. 2012; 23 (3): 121–4. PubMed
PubMed Central
Google Scholar Гринвис М.Э., Сибли К.Д., Паркинс М.Д., Эшагуршан С.С., Рабин Х.Р., Сюретт М.Г. Устойчивость к макролидам и клиндамицину в изолятах группы Streptococcus Milleri из дыхательных путей пациентов с муковисцидозом. Антимикробные агенты Chemother. 2010. 54 (7): 2823–9. https://doi.org/10.1128/AAC.01845-09. CAS
Статья
PubMed
PubMed Central
Google Scholar Стрептококк группы B (GBS) — хорошо известная причина инфекции в перинатальном и послеродовом периодах, но его роль в качестве возбудителя мочевыводящих путей у взрослых в неакушерских ситуациях еще не определена.Мы провели проспективное 19-месячное исследование всех небеременных взрослых пациентов со значительной бактериурией СГБ. На этот микроорганизм приходилось 2% положительных культур мочи. В нашу серию вошли 60 пациентов, 85% из которых составляли женщины и 95% из них имели хотя бы одно основное заболевание. Патологии мочевыводящих путей (60%) и хроническая почечная недостаточность (27%) были среди наиболее частых основных проблем. В 65% случаев инфекция была внебольничной. Клинические проявления в равной степени относились к верхним и нижним мочевыводящим путям (37% и 38% случаев соответственно).Несмотря на лечение, клинический результат был плохим в 18% случаев. Все изоляты были чувствительны ко всем протестированным антибиотикам, кроме гентамицина. Мы пришли к выводу, что GBS является значительным патогеном мочевыводящих путей у небеременных взрослых и что его присутствие сигнализирует о необходимости скрининга на аномалии мочевыводящих путей. Clinical Infectious Diseases публикует клинически значимые статьи о патогенезе,
клиническое исследование, медицинская микробиология, диагностика, иммунные механизмы и лечение
заболеваний, вызванных инфекционными агентами.В специальные разделы включены статьи о противомикробных препаратах.
устойчивость, биотерроризм, возникающие инфекции, безопасность пищевых продуктов, больничная эпидемиология и
ВИЧ / СПИД. Кроме того, в журнале публикуются узконаправленные краткие отчеты, обзорные статьи,
редакционные статьи, комментарии и дополнения. Опубликовано для Общества инфекционистов.
Америки. Oxford University Press — это отделение Оксфордского университета. Издание во всем мире способствует достижению цели университета в области исследований, стипендий и образования.OUP — крупнейшая в мире университетская пресса с самым широким глобальным присутствием. В настоящее время он издает более 6000 новых публикаций в год, имеет офисы примерно в пятидесяти странах и насчитывает более 5 500 сотрудников по всему миру. Он стал известен миллионам людей благодаря разнообразной издательской программе, которая включает научные работы по всем академическим дисциплинам, библии, музыку, школьные и университетские учебники, книги по бизнесу, словари и справочники, а также академические журналы. Laupland, K.Б., Росс, Т., Питу, Д. Д., Черч, Д. Л., Грегсон, Д. Б. Инфекции мочевыводящих путей, возникающие в сообществе: оценка населения. Инфекция 35 , 150–153, DOI: 10.1007 / s15010-007-6180-2 (2007). CAS
Статья
PubMed
Google Scholar Ле Доар, К. и Хит, П. Т. Обзор глобальной эпидемиологии СГБ. Vaccine 31 Suppl 4, D7–12, doi: 10.1016 / j.vaccine.2013.01.009 (2013). Артикул
PubMed
Google Scholar Otaguiri, E. S. et al. Комменсал Streptococcus agalactiae , выделенный от пациентов, обследованных в университетской больнице Лондрина, Парана, Бразилия: капсульные типы, генотипирование, детерминанты чувствительности к противомикробным препаратам и вирулентности. BMC Microbiol. 13 , 297, DOI: 10.1186 / 1471-2180-13-297 (2013). Артикул
PubMed
PubMed Central
Google Scholar Тан, К.K., Ulett, KB, Steele, M., Benjamin, WH, Jr. & Ulett, GC Прогностическое значение полуколичественного подсчета бактериурии в диагностике инфекции мочевыводящих путей, вызванной стрептококками группы B: 4-летнее ретроспективное исследование у взрослых пациентов . BMC Infect. Дис. 12 , 273, DOI: 10.1186 / 1471-2334-12-273 (2012). Артикул
PubMed
PubMed Central
Google Scholar Фоксман Б. Эпидемиология инфекций мочевыводящих путей. Обзоры природы. Урология 7 , 653–660, DOI: 10.1038 / nrurol.2010.190 (2010). Артикул
PubMed
Google Scholar Ulett, K. B. et al. Разнообразие серотипов стрептококков группы B, вызывающих инфекцию мочевыводящих путей у взрослых. J. Clin. Microbiol. 47 , 2055–2060, DOI: 10.1128 / JCM.00154-09 (2009). Артикул
PubMed
PubMed Central
Google Scholar Николь, Л.E. et al. Руководство Американского общества инфекционных болезней по диагностике и лечению бессимптомной бактериурии у взрослых. Clin. Заразить. Дис. 40 , 643–654, DOI: 10.1086 / 427507 (2005). Артикул
PubMed
Google Scholar Ipe, DS, Sundac, L., Benjamin, WH, Jr., Moore, KH & Ulett, GC Бессимптомная бактериурия: уровни распространенности причинных микроорганизмов, этиология инфекции у различных групп пациентов и недавние достижения в области молекулярной биологии. обнаружение. FEMS Microbiol. Lett. 346 , 1–10, DOI: 10.1111 / 1574-6968.12204 (2013). CAS
Статья
PubMed
Google Scholar Фоксман, Б. Синдромы инфекций мочевыводящих путей: возникновение, рецидивы, бактериология, факторы риска и бремя болезней. Заражение. Дис. Clin. North Am. 28 , 1–13, DOI: 10.1016 / j.idc.2013.09.003 (2014). Артикул
PubMed
Google Scholar Улетт, К.Б., Шуемакер, Дж. Х., Бенджамин, У. Х., младший, Тан, К. К. и Улетт, Г. С. Стрептококковый цистит группы B у пациента с диабетом и массивным абдоминально-тазовым абсцессом: клинический случай. J. Med. Отчеты о случаях 6 , 237–240, DOI: 10.1186 / 1752-1947-6-237 (2012). Артикул
Google Scholar Клайн, К. А. и Льюис, А. Л. грамположительные уропатогены, полимикробная инфекция мочевыводящих путей и новая микробиота мочевыводящих путей. Microbiology Spectrum 4 , DOI: DOI: 10.1128 / microbiolspec.UTI-0012-2012 (2016). Dando, S.J. et al. Патогены, проникающие в центральную нервную систему: пути заражения и клеточные и молекулярные механизмы инвазии. Clin. Microbiol. Ред. 27 , 691–726, DOI: 10.1128 / CMR.00118-13 (2014). CAS
Статья
PubMed
PubMed Central
Google Scholar Окумура, К.Y. & Nizet, V. Уверенность и саботаж: уклонение от врожденной защиты хозяина инвазивными грамположительными бактериальными патогенами. Annu. Rev. Microbiol. 68 , 439–458, DOI: 10.1146 / annurev-micro-0-155711 (2014). CAS
Статья
PubMed
PubMed Central
Google Scholar Ландвер-Кензель, С. и Хеннеке, П. Взаимодействие Streptococcus agalactiae и клеточного врожденного иммунитета при колонизации и болезнях. Границы иммунологии 5 , 519, DOI: 10.3389 / fimmu.2014.00519 (2014). CAS
Статья
PubMed
PubMed Central
Google Scholar Tan, C. K. et al. Полногеномное картирование цистита, вызванного Streptococcus agalactiae и Escherichia coli у мышей, позволяет идентифицировать уникальный транскриптом мочевого пузыря, который указывает на патоген-специфичную антимикробную защиту от инфекции мочевыводящих путей. Заражение. Иммун. 80 , 3145–3160, DOI: 10.1128 / IAI.00023-12 (2012). CAS
Статья
PubMed
PubMed Central
Google Scholar Ulett, G.C. et al. Инфекция мочевыводящих путей, вызванная стрептококками группы B (GBS), включает связывание GBS с уроэпителием мочевого пузыря и сильную, но специфичную для GBS индукцию интерлейкина 1альфа. J. Infect. Дис. 201 , 866–870, DOI: 10,1086 / 650696 (2010). Артикул
PubMed
Google Scholar Клайн, К. А., Шварц, Д. Дж., Льюис, У. Г., Халтгрен, С. Дж. И Льюис, А. Л. Активация и подавление иммунитета стрептококками группы В на мышиной модели инфекции мочевыводящих путей. Заражение. Иммун. 79 , 3588–3595, DOI: 10.1128 / IAI.00122-11 (2011). CAS
Статья
PubMed
PubMed Central
Google Scholar Клайн, К.А., Шварц, Д. Дж., Гилберт, Н. М., Халтгрен, С. Дж. И Льюис, А. Л. Иммунная модуляция стрептококками группы B влияет на восприимчивость хозяина к инфекции мочевыводящих путей, вызываемой уропатогенными Escherichia coli . Заражение. Иммун. 80 , 4186–4194, DOI: 10.1128 / IAI.00684-12 (2012). CAS
Статья
PubMed
PubMed Central
Google Scholar Kulkarni, R. et al. бета-гемолизин / цитолизин Streptococcus группы B усиливает воспаление хозяина, но незаменим для развития инфекции мочевыводящих путей. PLoS ONE 8 , e59091, DOI: 10.1371 / journal.pone.0059091 (2013). CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
PubMed Central
Google Scholar Ulett, G.C. et al. Уропатогенные Escherichia coli Вирулентность и врожденный иммунный ответ при инфекции мочевыводящих путей. Curr. Opin. Microbiol. 16 , 100–107, DOI: 10.1016 / j.mib.2013.01.005 (2013). CAS
Статья
PubMed
Google Scholar Ипе, Д.С., Хортон, Э. и Улетт, Г. С. Основы бактериурии: стратегии сохранения микробов в моче. Границы клеточной и инфекционной микробиологии 6 , 14, DOI: 10.3389 / fcimb.2016.00014 (2016). CAS
Статья
PubMed
PubMed Central
Google Scholar Ipe, D. S. et al. Открытие и характеристика использования мочи человека бессимптомной бактериурией, вызывающей Streptococcus agalactiae . Заражение. Иммун. 84 , 307–319, DOI: 10.1128 / IAI.00938-15 (2015). CAS
Статья
PubMed
PubMed Central
Google Scholar Zec, K. et al. Миграция нейтрофилов в инфицированный уроэпителий регулируется перекрестными помехами между резидентными и вспомогательными макрофагами. Патогены 5 , DOI: 10.3390 / pathogens5010015 (2016). Carey, A.J. et al.Uropathogenic Escherichia coli задействует CD14-зависимую передачу сигналов, позволяющую контролировать острую инфекцию мочевых путей, зависимую от макрофагов мочевого пузыря. J. Infect. Дис. 213 , 659–668, DOI: 10.1093 / infdis / jiv424 (2016). CAS
Статья
PubMed
Google Scholar Schiwon, M. et al. Перекрестное взаимодействие между сторожевыми и вспомогательными макрофагами позволяет нейтрофилам мигрировать в инфицированный уроэпителий. Ячейка 156 , 456–468, DOI: 10.1016 / j.cell.2014.01.006 (2014). CAS
Статья
PubMed
PubMed Central
Google Scholar Klumpp, D. J. et al. Уропатогенный Escherichia coli индуцирует внешний и внутренний каскады, чтобы инициировать уротелиальный апоптоз. Заражение. Иммун. 74 , 5106–5113, DOI: 10.1128 / IAI.00376-06 (2006). CAS
Статья
PubMed
PubMed Central
Google Scholar Клумпп, Д.J. et al. Uropathogenic Escherichia coli потенцирует апоптоз, вызванный пилусами 1 типа, подавляя NF-kappaB. Заражение. Иммун. 69 , 6689–6695, DOI: 10.1128 / IAI.69.11.6689-6695.2001 (2001). CAS
Статья
PubMed
PubMed Central
Google Scholar Thumbikat, P. et al. Индуцированная бактериями передача сигналов уроплакина опосредует ответ мочевого пузыря на инфекцию. PLoS Pathog. 5 , e1000415, DOI: 10.1371 / journal.ppat.1000415 (2009). CAS
Статья
PubMed
PubMed Central
Google Scholar Роза-Фрайле, М., Драмси, С. и Спеллерберг, Б. Стрептококковый гемолизин и пигмент группы B, сказка о близнецах. FEMS Microbiol. Ред. 38 , 932–946, DOI: 10.1111 / 1574-6976.12071 (2014). CAS
Статья
PubMed
PubMed Central
Google Scholar Дуэлл, Б.Л., Кэри, А. Дж., Дандо, С. Дж., Шембри, М. А. и Улетт, Г. С. Уроэпителиальные клетки мочевого пузыря человека взаимодействуют с моноцитами, способствуя синтезу ИЛ-10 и другим цитокиновым ответам на уропатогенную кишечную палочку , Escherichia coli . PLoS ONE 8 , e78013, DOI: 10.1371 / journal.pone.0078013 (2013). CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
PubMed Central
Google Scholar Дуэлл, Б. Л., Криппс, А.W., Schembri, M. A. & Ulett, G. C. Модели совместного культивирования эпителиальных клеток для изучения инфекционных заболеваний: преимущества и ограничения. Журнал биомедицины и биотехнологии 2011 , 852419, DOI: 10.1155 / 2011/852419 (2011). Артикул
Google Scholar Clahsen, T. & Schaper, F. Интерлейкин-6 действует подобно классическому хемокину на моноцитарные клетки, индуцируя активацию интегрина, клеточную адгезию, полимеризацию актина, хемотаксис и трансмиграцию. J. Leukoc. Биол. 84 , 1521–1529, DOI: 10.1189 / jlb.0308178 (2008). CAS
Статья
PubMed
Google Scholar Доран, К. С., Лю, Г. Й. и Низет, В. Стрептококковый бета-гемолизин / цитолизин группы B активирует сигнальные пути нейтрофилов в эндотелии головного мозга и способствует развитию менингита. J. Clin. Вкладывать деньги. 112 , 736–744, DOI: 10.1172 / JCI17335 (2003). CAS
Статья
PubMed
PubMed Central
Google Scholar Доран, К. С., Чанг, Дж. С., Бенуа, В. М., Экманн, Л. и Низет, В. Стрептококковый бета-гемолизин / цитолизин группы B способствует инвазии эпителиальных клеток легких человека и высвобождению интерлейкина-8. J. Infect. Дис. 185 , 196–203, DOI: 10.1086 / 338475 (2002). CAS
Статья
PubMed
Google Scholar Сивик, К.Э. и Мобли, Х. Л. Ведение войны против уропатогенной Escherichia coli : возвращение мочевыводящих путей. Заражение. Иммун. 78 , 568–585, DOI: 10.1128 / IAI.01000-09 (2010). CAS
Статья
PubMed
Google Scholar Hannan, T. J. et al. Контрольные точки «хозяин-патоген» и узкие места среди населения при стойкой и внутриклеточной уропатогенной Escherichia coli инфекции мочевого пузыря. FEMS Microbiol. Ред. 36 , 616–648, DOI: 10.1111 / j.1574-6976.2012.00339.x (2012). CAS
Статья
Google Scholar Bokil, N.J. et al. Интрамакрофагальная выживаемость уропатогенных Escherichia coli : различия между различными клиническими изолятами и между макрофагами мыши и человека. Иммунобиология 216 , 1164–1171, DOI: 10.1016 / j.imbio.2011.05.011 (2011). CAS
Статья
PubMed
Google Scholar Mora-Bau, G. et al. Макрофаги подрывают адаптивный иммунитет к инфекции мочевыводящих путей. PLoS Pathog. 11 , e1005044, DOI: 10.1371 / journal.ppat.1005044 (2015). CAS
Статья
PubMed
PubMed Central
Google Scholar Пулити, М., Уэмацу, С., Akira, S., Bistoni, F. & Tissi, L. Дефицит Toll-подобного рецептора 2 связан с повышенной тяжестью стрептококковой болезни группы B. Заражение. Иммун. 77 , 1524–1531, DOI: 10.1128 / IAI.00965-08 (2009). CAS
Статья
PubMed
PubMed Central
Google Scholar Grönberg-Hernandez, J., Sunden, F., Connolly, J., Svanborg, C. & Wullt, B. Генетический контроль вариабельного врожденного иммунного ответа на бессимптомную бактериурию. PLoS ONE 6 , e28289, doi: 10.1371 / journal.pone.0028289 (2011). CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
Google Scholar Годали Г., Амбите И. и Сванборг К. Врожденный иммунитет и генетические детерминанты восприимчивости к инфекциям мочевыводящих путей. Curr. Opin. Заразить. Дис. 28 , 88–96, DOI: 10.1097 / QCO.0000000000000127 (2015). CAS
Статья
PubMed
Google Scholar Коста, А.и другие. Активация инфламмасомы NLRP3 стрептококками группы B. J. Immunol. 188 , 1953–1960, DOI: 10.4049 / jimmunol.1102543 (2012). CAS
Статья
PubMed
PubMed Central
Google Scholar Bebien, M. et al. Образующий поры токсин бета-гемолизин / цитолизин запускает p38 MAPK-зависимую продукцию IL-10 в макрофагах и подавляет врожденный иммунитет. PLoS Pathog. 8 , e1002812, DOI: 10.1371 / journal.ppat.1002812 (2012). CAS
Статья
PubMed
PubMed Central
Google Scholar Hensler, M. E., Miyamoto, S. & Nizet, V. Бета-гемолизин / цитолизин стрептококка группы B напрямую ухудшает жизнеспособность и функцию кардиомиоцитов. PLoS ONE 3 , e2446, DOI: 10.1371 / journal.pone.0002446 (2008). CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
PubMed Central
Google Scholar Алкувайти, К., Тейлор, А., Хекелс, Дж. Э., Доран, К. С. и Христодулидес, М. Взаимодействие стрептококков группы B с менингеальными клетками и астроцитами человека in vitro . PLoS ONE 7 , e42660, doi: 10.1371 / journal.pone.0042660 (2012). CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
PubMed Central
Google Scholar Бергсбакен Т., Финк С.Л. и Куксон Б.Т. Пироптоз: гибель и воспаление клеток-хозяев. Нат. Rev. Microbiol. 7 , 99–109, DOI: 10.1038 / nrmicro2070 (2009). CAS
Статья
PubMed
PubMed Central
Google Scholar Мяо, Э. А., Раджан, Дж. В. и Адерем, А. Пироптозная гибель клеток, индуцированная каспазой-1. Immunol. Ред. 243 , 206–214, DOI: 10.1111 / j.1600-065X.2011.01044.x (2011). CAS
Статья
PubMed
PubMed Central
Google Scholar Улетт, Г.C., Bohnsack, J. F., Armstrong, J. & Adderson, E. E. Бета-гемолизин-независимая индукция апоптоза макрофагов, инфицированных стрептококком серотипа III группы B. J. Infect. Дис. 188 , 1049–1053, DOI: 10.1086 / 378202 (2003). CAS
Статья
PubMed
Google Scholar Ulett, G.C. & Adderson, E.E. Оксид азота является ключевой детерминантой апоптоза макрофагов мышей, индуцированного стрептококками группы B. J. Infect. Дис. 191 , 1761–1770, DOI: 10.1086 / 429693 (2005). CAS
Статья
PubMed
Google Scholar Феррейра Эдуардо да Кошта, А. и др. . Активные формы кислорода, участвующие в индукции апоптоза клеток респираторного эпителия человека (A549) Streptococcus agalactiae . Микробиология 162 , 94–99, DOI: 10.1099 / mic.0.000202 (2016). CAS
Статья
PubMed
Google Scholar Дхакал, Б. К. и Малви, М. А. Порообразующий токсин альфа-гемолизин UPEC запускает протеолиз белков-хозяев, нарушая клеточную адгезию, воспалительные процессы и пути выживания. Cell Host Microbe 11 , 58–69, DOI: 10.1016 / j.chom.2011.12.003 (2012). CAS
Статья
PubMed
PubMed Central
Google Scholar Ямамото, Ю.и другие. Дыхательный метаболизм Streptococcus группы B активируется окружающей средой гемом и хиноном и способствует вирулентности. Мол. Microbiol. 56 , 525–534, DOI: 10.1111 / j.1365-2958.2005.04555.x (2005). CAS
Статья
PubMed
PubMed Central
Google Scholar Афонина И. С., Мюллер К., Мартин С. Дж. И Бейаерт Р. Протеолитический процессинг цитокинов семейства интерлейкина-1: вариации на общую тему. Иммунитет 42 , 991–1004, DOI: 10.1016 / j.immuni.2015.06.003 (2015). CAS
Статья
PubMed
Google Scholar Biondo, C. et al. Ось интерлейкин-1бета / CXCL1 / 2 / нейтрофилы опосредует защиту хозяина от стрептококковой инфекции группы B. Заражение. Иммун. 82 , 4508–4517, DOI: 10.1128 / IAI.02104-14 (2014). CAS
Статья
PubMed
PubMed Central
Google Scholar Лю Г.Y. et al. Меч и щит: связанный стрептококковый бета-гемолизин / цитолизин группы B и функция пигмента каротиноида подрывают защиту фагоцитов хозяина. Proc. Natl. Акад. Sci. США 101 , 14491–14496, DOI: 10.1073 / pnas.0406143101 (2004). CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
Google Scholar Hensler, M. E. et al. Роль вирулентности бета-гемолизина / цитолизина Streptococcus группы B в модели ранней легочной инфекции у новорожденных кроликов. J. Infect. Дис. 191 , 1287–1291, DOI: 10,1086 / 428946 (2005). Артикул
PubMed
Google Scholar Пуджа С., Пушпанатан М. и Гунасекаран П. и Раджендран Дж. Инвазия, опосредованная эндоцитозом, и патогенность Streptococcus agalactiae в кардиомиоцитах крысы (H9C2). PLoS ONE 10 , e0139733, DOI: 10.1371 / journal.pone.0139733 (2015). CAS
Статья
PubMed
PubMed Central
Google Scholar Даньо, М. Образец Кровь Моча Моча Моча Серотип 15B 15B 9034 Optochin S S S S Растворимость в желчи Положительный Положительный Положительный Положительный Положительный Положительный Положительный S S
9032 1 S S Пенициллин <0.03 S <0,03 S <0,03 S 0,06 S Амоксициллин 1 4 <0,25 <0,25 S <0,25 S Цефотаксим <0,5 S <0,5 S <0.5 S <0,5 S Эритромицин <0,06 S <0,06 S 4 9032 9032 9032 9034 9032 9032 Клиндамицин 0,06 S 0,06 S 0,06 S > 2 R 16 T c5 S <0,5 S <0,5 S > 8 R Левофлоксацин 4 1 <0,5 S 1,0 S Меропенем <0,125 S <0,125 S <0,125 <0,125 125 S Ванкомицин <0,5 S <0,5 S <0,5 S <0,5 903 903 903 1 903 S <1 S <1 S <1 S Моксифлоксацин <0,2125 25 S <0,25 S <0,25 S Котримоксазол 1/19 I 4 1/19 1/19 9,5 S <0,5 / 9,5 S Обсуждение и выводы
Таблица 2
Дата поступления образца в лабораторию Тип образца мочи КОЕ / мл Виды Количество лейкоцитов, клеток / мкл 2005 апр Катетер 10 5 α-Гемолитические стрептококки Proteus mirabilis июль 2005 г. Midstream 10 5 α-гемолитические стрептококки 23 903 2005 сен Средний поток 10 5 Streptococcus pyogenes Нет данных 10 3 α-Гемолитические стрептококки 2007 Мар 10 4 Proteus mirabilis 2008 мар. 4 Proteus mirabilis 2008 июн Midstream 10 5 Proteus mirabilis -Гемолитические стрептококки 90 303 Июль 2008 г. Мидстрим 10 5 α-Гемолитические стрептококки 150 2008 Ноябрь 9033 9033 9033 9033 903 903 903 904 904 стрептококки 90 март 2009 г. Средний поток 10 5 α-Гемолитические стрептококки 46 9033 9033 46 903 5 α-Гемолитические стрептококки 24 10 4 Proteus mirabilis 2009 сентябрь
9024 сентябрь
9024 9 сентября 16 10 3 Enterobacteriaceae 2010 Янв Мидстрим 10 5 α-Гемолитические стрептококки 94 9033 9024 9024 9024 mirabilis 2010 июн Midstream 10 5 α-гемолитические стрептококки 124 10 4 9069 лабораторные данные пациента 1 показали, что мы получили 3 пробы мочи до описанного эпизода и 8 — после него.Ни в одном из образцов мы не обнаружили S. pneumoniae или α-гемолитических стрептококков. От пациента 3 мы не получили никаких других материалов, кроме описанных. Подтверждение
Биографии
Сноски
Ссылки
1. О’Брайен К.Л., Вольфсон Л.Дж., Ватт Дж. П., Хенкл Э., Делориа-Нолл М., МакКолл Н. и др. Бремя болезней, вызываемых Streptococcus pneumoniae , у детей младше 5 лет: глобальные оценки. Ланцет. 2009; 374: 893–902 10.1016 / S0140-6736 (09) 61204-6 [PubMed] [CrossRef] [Google Scholar] 2.ван дер Полл Т., Опал С.М. Патогенез, лечение и профилактика пневмококковой пневмонии. Ланцет. 2009; 374: 1543–56 10.1016 / S0140-6736 (09) 61114-4 [PubMed] [CrossRef] [Google Scholar] 5. Gatermann S, Fünfstück R, Handrick W, Leitritz L, Mauch H, Naber KG и др. Harnwegsinfektionen. В: Mauch H, Podbielski A, Herrmann M, ред. Стандарты качества в микробиологической-инфекционной диагностике; Im Auftrag der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM). 2-е изд. Мюнхен: Urban & Fischer Verlag; 2005 г.п. 1–70. [Google Scholar] 6. Грин Р.Ф., Селинджер Д.С. Инфекция мочевыводящих путей и абсцесс мягких тканей, вызванные Streptococcus pneumoniae. South Med J. 1980; 73: 1550–1 10.1097 / 00007611-198011000-00046 [PubMed] [CrossRef] [Google Scholar] 7. Dufke S, Kunze-Kronawitter H, Schubert S Пиелонефрит и уросепсис, вызванные Streptococcus pneumoniae. J Clin Microbiol. 2004; 42: 4383–5 10.1128 / JCM.42.9.4383-4385.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Чанг С.Л., Шортлифф Л.Д. Инфекции мочевыводящих путей у детей [vi] Pediatr Clin North Am.2006; 53: 379–400 10.1016 / j.pcl.2006.02.011 [PubMed] [CrossRef] [Google Scholar] 9. Prelog M, Fischer H, Fille M, Allerberger F, Zimmerhackl LB Harnwegsinfektion im Kindesalter. Monatsschr Kinderheilkd. 2004; 152: 331–44 10.1007 / s00112-004-0907-2 [CrossRef] [Google Scholar] Streptococcus pneumoniae в мочевых путях у детей с хронической болезнью почек
Abstract
Отчеты о случаях
Таблица 1
Образец Кровь Моча Моча Моча Серотип 15B 15B 9034 Optochin S S S S Растворимость в желчи Положительный Положительный Положительный Положительный Положительный Положительный Положительный S S
9032 1 S S Пенициллин <0.03 S <0,03 S <0,03 S 0,06 S Амоксициллин 1 4 <0,25 <0,25 S <0,25 S Цефотаксим <0,5 S <0,5 S <0.5 S <0,5 S Эритромицин <0,06 S <0,06 S 4 9032 9032 9032 9034 9032 9032 Клиндамицин 0,06 S 0,06 S 0,06 S > 2 R 16 T c5 S <0,5 S <0,5 S > 8 R Левофлоксацин 4 1 <0,5 S 1,0 S Меропенем <0,125 S <0,125 S <0,125 <0,125 125 S Ванкомицин <0,5 S <0,5 S <0,5 S <0,5 903 903 903 1 903 S <1 S <1 S <1 S Моксифлоксацин <0,2125 25 S <0,25 S <0,25 S Котримоксазол 1/19 I 4 1/19 1/19 9,5 S <0,5 / 9,5 S Обсуждение и выводы
Таблица 2
Дата поступления образца в лабораторию Тип образца мочи КОЕ / мл Виды Количество лейкоцитов, клеток / мкл 2005 апр Катетер 10 5 α-Гемолитические стрептококки Proteus mirabilis июль 2005 г. Midstream 10 5 α-гемолитические стрептококки 23 903 2005 сен Средний поток 10 5 Streptococcus pyogenes Нет данных 10 3 α-Гемолитические стрептококки 2007 Мар 10 4 Proteus mirabilis 2008 мар. 4 Proteus mirabilis 2008 июн Midstream 10 5 Proteus mirabilis -Гемолитические стрептококки 90 303 Июль 2008 г. Мидстрим 10 5 α-Гемолитические стрептококки 150 2008 Ноябрь 9033 9033 9033 9033 903 903 903 904 904 стрептококки 90 март 2009 г. Средний поток 10 5 α-Гемолитические стрептококки 46 9033 9033 46 903 5 α-Гемолитические стрептококки 24 10 4 Proteus mirabilis 2009 сентябрь
9024 сентябрь
9024 9 сентября 16 10 3 Enterobacteriaceae 2010 Янв Мидстрим 10 5 α-Гемолитические стрептококки 94 9033 9024 9024 9024 mirabilis 2010 июн Midstream 10 5 α-гемолитические стрептококки 124 10 4 9069 лабораторные данные пациента 1 показали, что мы получили 3 пробы мочи до описанного эпизода и 8 — после него.Ни в одном из образцов мы не обнаружили S. pneumoniae или α-гемолитических стрептококков. От пациента 3 мы не получили никаких других материалов, кроме описанных. Подтверждение
Биографии
Сноски
Ссылки
1. О’Брайен К.Л., Вольфсон Л.Дж., Ватт Дж. П., Хенкл Э., Делориа-Нолл М., МакКолл Н. и др. Бремя болезней, вызываемых Streptococcus pneumoniae , у детей младше 5 лет: глобальные оценки. Ланцет. 2009; 374: 893–902 10.1016 / S0140-6736 (09) 61204-6 [PubMed] [CrossRef] [Google Scholar] 2.ван дер Полл Т., Опал С.М. Патогенез, лечение и профилактика пневмококковой пневмонии. Ланцет. 2009; 374: 1543–56 10.1016 / S0140-6736 (09) 61114-4 [PubMed] [CrossRef] [Google Scholar] 5. Gatermann S, Fünfstück R, Handrick W, Leitritz L, Mauch H, Naber KG и др. Harnwegsinfektionen. В: Mauch H, Podbielski A, Herrmann M, ред. Стандарты качества в микробиологической-инфекционной диагностике; Im Auftrag der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM). 2-е изд. Мюнхен: Urban & Fischer Verlag; 2005 г.п. 1–70. [Google Scholar] 6. Грин Р.Ф., Селинджер Д.С. Инфекция мочевыводящих путей и абсцесс мягких тканей, вызванные Streptococcus pneumoniae. South Med J. 1980; 73: 1550–1 10.1097 / 00007611-198011000-00046 [PubMed] [CrossRef] [Google Scholar] 7. Dufke S, Kunze-Kronawitter H, Schubert S Пиелонефрит и уросепсис, вызванные Streptococcus pneumoniae. J Clin Microbiol. 2004; 42: 4383–5 10.1128 / JCM.42.9.4383-4385.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Чанг С.Л., Шортлифф Л.Д. Инфекции мочевыводящих путей у детей [vi] Pediatr Clin North Am.2006; 53: 379–400 10.1016 / j.pcl.2006.02.011 [PubMed] [CrossRef] [Google Scholar] 9. Prelog M, Fischer H, Fille M, Allerberger F, Zimmerhackl LB Harnwegsinfektion im Kindesalter. Monatsschr Kinderheilkd. 2004; 152: 331–44 10.1007 / s00112-004-0907-2 [CrossRef] [Google Scholar] Колонизация стрептококков группы B у пожилых женщин | BMC Infectious Diseases
Стрептококк группы B (GBS) — важный патоген при заболеваниях человека, но как насчет муковисцидоза? | BMC Infectious Diseases
Причина инфекции мочевыводящих путей у небеременных взрослых по JSTOR
Абстрактный Патогенез инфекции мочевыводящих путей Streptococcus зависит от бактериального штамма и β-гемолизина / цитолизина, который опосредует цитотоксичность, синтез цитокинов, воспаление и вирулентность





 4 F (38 C) во время родов
4 F (38 C) во время родов