Памятка — рак желудка
Категория: Онкология.
Во время процедуры специальный зонд, имеющий световод, вводится в желудок, врач осматривает все его отделы, а также двенадцатиперстную кишку.
Доктор может взять на анализ желудочный сок или кусочки ткани слизистой. Больным, имеющим повышенный онкологический риск по раку желудка, рекомендуется проходить ФГС один — два раза в год.
В целях профилактики появления рака желудка нужно соблюдать общие правила гигиены, исключить по возможности стрессовые ситуации, которые могут привести к язве ЖКТ. Необходимо уменьшить влияние вредных факторов окружающей среды (промышленные отходы, автомобильные выхлопные газы). Следует обязательно укреплять иммунитет, с этой целью будут полезны занятия физкультурой, ежедневные прогулки, закаливающие процедуры.
Онкопрофилактическая диета
В целях профилактики рака желудка нужно соблюдать специальную диету.
Риск заболеть раком уменьшится, если ежедневно употреблять 200 – 250 мл молока. Хорошим средством профилактики злокачественных новообразований в желудке являются томаты. Рекомендуется ежедневно съедать по два – три спелых красных помидора. Они содержат антиоксиданты, способные стимулировать иммунитет.
Мощным антиоксидантом, препятствующим появлению онкологических болезней, является витамин Е. Много его содержится в растительном масле, орехах. В целях профилактики рака желудка нужно ежедневно есть 150 орехов или употреблять не менее 2-3 столовых ложек любого растительного масла. В онкопрофилактическую диету должны входить корень сельдерея, хрен, редька, редис. В их составе присутствуют индол и изотиоцианат — мощные антиканцерогенные вещества.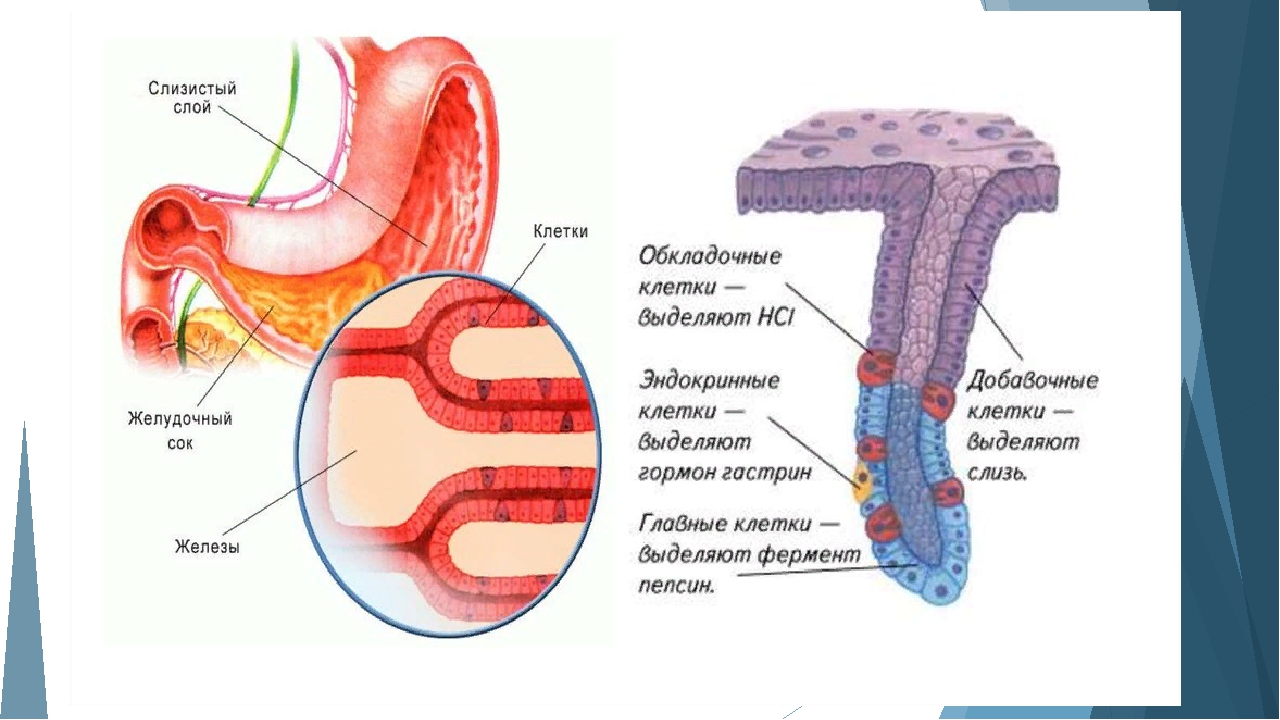
В качестве профилактики рака желудка нужно употреблять одну луковицу в день. В луке содержится кверцетин, он препятствует образованию раковых клеток. Следует включать в рацион жирные сорта рыбы (лосось, тунец, сардина, сельдь, скумбрия, макрель), в них содержится большое количество омега -3 — жирных кислот, которые повышают противоопухолевый иммунитет. Замечательным средством профилактики рака желудка считается зеленый чай. Этот напиток нужно пить ежедневно.
Профилактика появления рака желудка предусматривает действия, направленные на предупреждение появления хронических заболеваний желудочно — кишечного тракта. На протяжении жизни необходимо соблюдать общие правила санитарно — гигиенического режима, правильно питаться, по возможности исключить появление стрессовых ситуаций, которые могут привести к появлению язвы желудка.
Предотвращение появления таких предраковых заболеваний, как пернициозная анемия, хроническая язва желудка и двенадцатиперстной кишки имеют исключительное значение в профилактических мероприятиях, направленных на недопущение развития злокачественных новообразований этих органов.
Уменьшение влияния вредных факторов окружающей среды, таких как автомобильные выхлопные газы, промышленные отходы.
Нитраты, нитриты, в большом количестве содержащиеся в тепличных растениях (помидоры, огурцы), копченостях, также необходимо ограничить в питании, так как данные продукты являются опасным и с точки зрения канцерогенного влияния на организм.
Соблюдать умеренность в применении различных медикаментозных средств.
Свежие фрукты и овощи, богатые витаминами, макро и микроэлементами, сбалансируют рацион питания. также свежие овощи и фрукты служат хорошим источником антиоксидантов, которые эффективны в борьбе против появления раковых клеток.
Каждодневные вечерние прогулки, занятия физической культурой и закаливающие процедуры, все это укрепит иммунитет, придаст бодрости и дополнительных жизненных сил.
Рак желудка – один из самых опасных видов злокачественных опухолей. Зачастую он выявляется лишь на поздних стадиях и приводит к высокой смертности.
На протяжении последних десятилетий заболеваемость раком желудка неуклонно падает. Связывают это с улучшением питания и широким использованием холодильников для хранения продуктов. Но в нашей стране рак желудка — массовое явление. Заболеваемость у мужчин выше, чем у женщин.
Факторы риска развития рака желудка
- низкий уровень жизни;
- плохое питание;
- злоупотребление нитратами, солью, консервированными продуктами, крепкими спиртными напитками;
- недостаточное потребление белков, овощ ей, фруктов, витаминов;
- полипы, язва желудка, низкая кислотность желудочного сока;
- хеликобактериоз;
-
очень редко — врожденные генетические нарушения (семейный рак желудка).

Предраковым заболеванием считается хронический атрофический гастрит. Он вызывает уменьшение желез слизистой, угнетение функций желудка, ослабление выработки пищеварительных ферментов и соляной кислоты. Сначала клетки слизистой желудка теряют обычный вид и становятся похожими на клетки кишечника. Это так называемая кишечная метаплазия. В дальнейшем возникает дисплазия (неправильное развитие). Вот характерная последовательность изменения клеток слизистой желудка: атрофия — кишечная метаплазия — дисплазия — рак.
Хронический атрофический гастрит не имеет яркой клинической картины. Человека беспокоят неприятные ощущения после еды – ноющие тупые боли в подложечной области, тяжесть в желудке, тошнота, отрыжка, иногда с тухлым запахом. Могут быть нарушения стула (поносы или запоры), повышенное газообразование.
Хеликобактериоз
Многие исследования показали, что заражение хеликобактером (Helicobacter pylori) повышает риск рака желудка в 2-4 раза.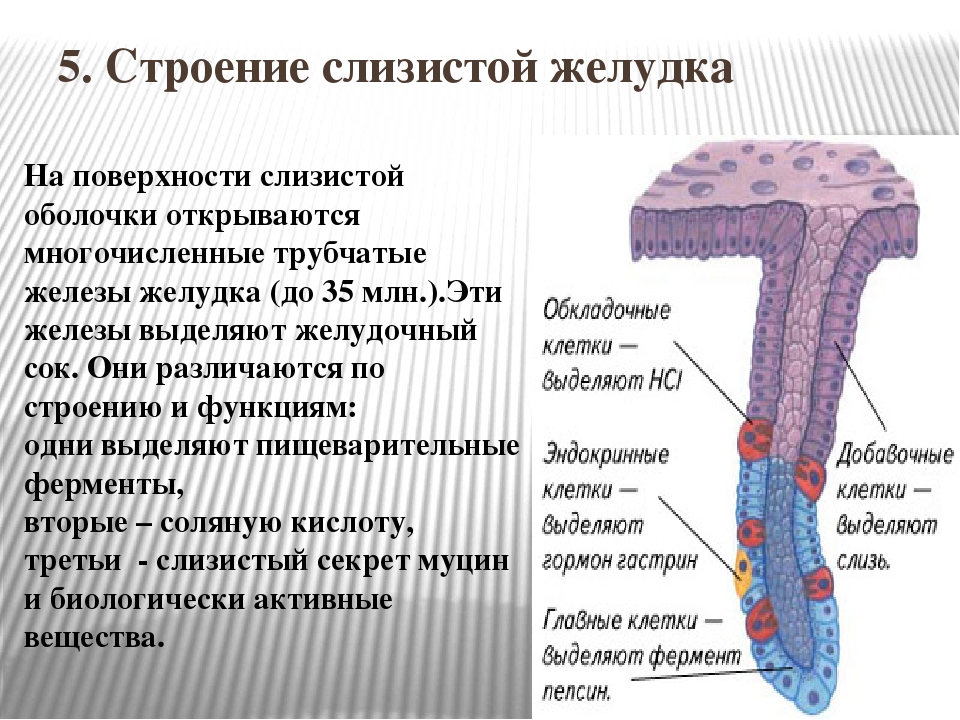 Инфицированность населения составляет около 40 %. Заразиться можно через грязные руки, загрязненные продукты, во время поцелуев. Профилактика заражения проста: мыть перед едой руки с мылом, обдавать кипятком фрукты, овощи, а также не целоваться с больными людьми.
Инфицированность населения составляет около 40 %. Заразиться можно через грязные руки, загрязненные продукты, во время поцелуев. Профилактика заражения проста: мыть перед едой руки с мылом, обдавать кипятком фрукты, овощи, а также не целоваться с больными людьми.
Как же бактерия противостоит воздействию соляной кислоты желудочного сока и не погибает? Выжить помогает особый фермент, уреаза — она расщепляет мочевину из содержимого желудка. В результате вокруг бактерии образуется облачко аммиака, который нейтрализует кислоту и дает возможность продержаться несколько часов. За это время бактерия ввинчивается в выстилку желудка при помощи спиральных жгутиков, удаляется от поверхности. Там бактерия может жить десятилетиями. Она медленно размножается, постепенно разрушает слизистую оболочку желудка и способствует развитию гастрита, язвы и рака желудка. Излечение хеликобактериоза улучшает состояние слизистой.
Кроме того, Helicobacter pylori является главной причиной злокачественной опухоли, развивающейся из скоплений лимфоидной ткани в слизистой — В-клеточной лимфомы желудка. Удивительно, что излечение хеликобактериоза приводит к полной регрессии лимфомы желудка и выздоровлению.
Удивительно, что излечение хеликобактериоза приводит к полной регрессии лимфомы желудка и выздоровлению.
Разработаны надежные методы диагностики хеликобактериоза и схемы его эффективного лечения при помощи антибиотиков. Если obacter pylori обнаружена у одного члена семьи, то, как правило, заражены все остальные. Поэтому необходимо лечение всей семьи. К сожалению, инфекция часто рецидивирует. Поэтому необходимо периодически обследоваться и после лечения. Наилучшей первичной профилактикой рака желудка является правильное питание и соблюдение онкопрофилактической диеты. Очень важно своевременное выявление и лечение хронического атрофического гастрита, язвы, полипов, хеликобактериоза.
В настоящее время, существует возможность следить за состоянием желудка с помощью фиброгастроскопии (ФГС). Специальный зонд со световодом вводится в желудок. Во время процедуры врач может осмотреть все отделы желудка и двенадцатиперстную кишку, взять для анализов желудочный сок и кусочки ткани слизистой и даже удалить полипы желудка, не прибегая к полостной операции.
Следует внимательно относиться к своему состоянию. В зависимости от расположения и вида опухоли, проявления болезни могут быть самые разные:
- кровотечение, черный стул;
- боли в подложечной области;
- чувство тяжести, распирания в подложечной области после еды, отрыжка, тошнота и рвота;
- нарушение глотания, чувство помех и при прохождении твердой пищи;
- потеря аппетита, отвращение к ранее любимой пище, например к мясу, общая слабость, потеря веса.
Если у вас появились какие — либо из перечисленных симптомов, необходимо срочно обратиться к онкологу и пройти обследование.
Железистые клетки эпителия в тканях желудка что вырабатывают
Железистые клетки участвуют в переработке пищи и выработке слизи для желудка.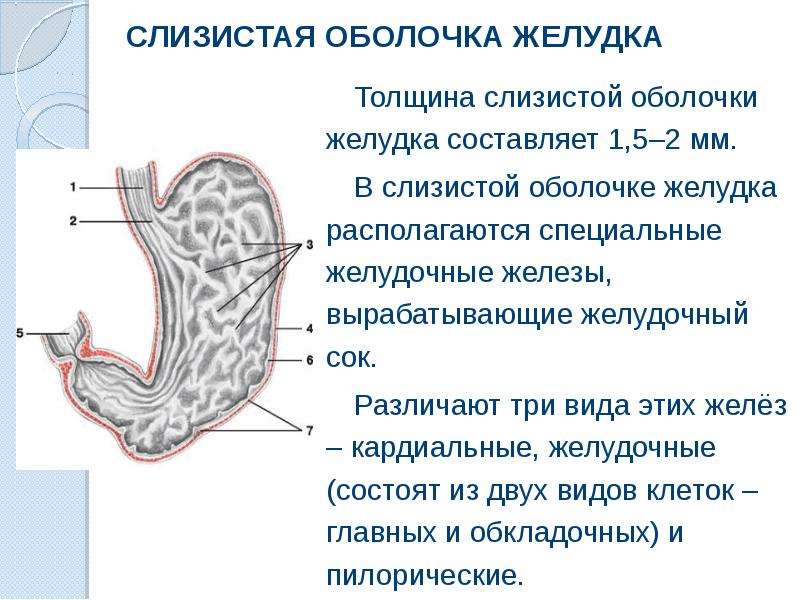 Они имеют сложное строение, их функционирование зависит от состояния желудка и всего организма, качества и количества поступаемой пищи и тд. Железистые клетки образуют несколько видов клеток, различных по своему строению и функции. Сегодня мы поговорим о клетках железистого эпителия. Читайте следующую статью на страницах журнала https://gastritinform.ru// и вы узнаете о строении и работе железистых клетках кишечника и желудочно-кишечного тракта.
Они имеют сложное строение, их функционирование зависит от состояния желудка и всего организма, качества и количества поступаемой пищи и тд. Железистые клетки образуют несколько видов клеток, различных по своему строению и функции. Сегодня мы поговорим о клетках железистого эпителия. Читайте следующую статью на страницах журнала https://gastritinform.ru// и вы узнаете о строении и работе железистых клетках кишечника и желудочно-кишечного тракта.
Железистые клетки желудка
Желудок — расширенная часть пищеварительной трубки, в которой накапливается и переваривается пища. В желудке начинают перевариваться белки и жиры. Слизистая оболочка желудка включает несколько видов клеток.
Железистые клетки желудка выделяют 2—2,5 л желудочного сока в сутки. Его состав зависит от характера пищи. Обкладочные клетки выделяют соляную кислоту, необходимую для активации пищеварительных ферментов желудка. Главные клетки образуют пищеварительные ферменты. Добавочные клетки выделяют слизистый секрет.
Желудочный сок имеет кислую реакцию. Соляная кислота активирует фермент желудочного сока — пепсин, вызывает набухание и переваривание белков и способствует последующему их расщеплению до аминокислот.
Слизь защищает оболочку желудка от механических и химических раздражений. Кроме пепсина, желудочный сок содержит ферменты — желатиназу, гидролизующую желатин, липазу, расщепляющую эмульгированные жиры молока на глицерин и жирные кислоты, химозин, створаживающий молоко.
Железистые клетки желудка зародышевый листок
Зародышевый листок – это слой клеток, занимающий определенное положение . Каждый зародышевый листок развивается в заданном направлении, принимает участие в возникновении зачатков определенных органов . Из зародышевых листков формируются ткани и органы. Желудок относится к такой системе органов, как пищеварительная система, а она развивается из зародышевого листка эндодермы.
Железистые клетки слизистой оболочки желудка
youtube.com/embed/8kVv2t4fubM?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
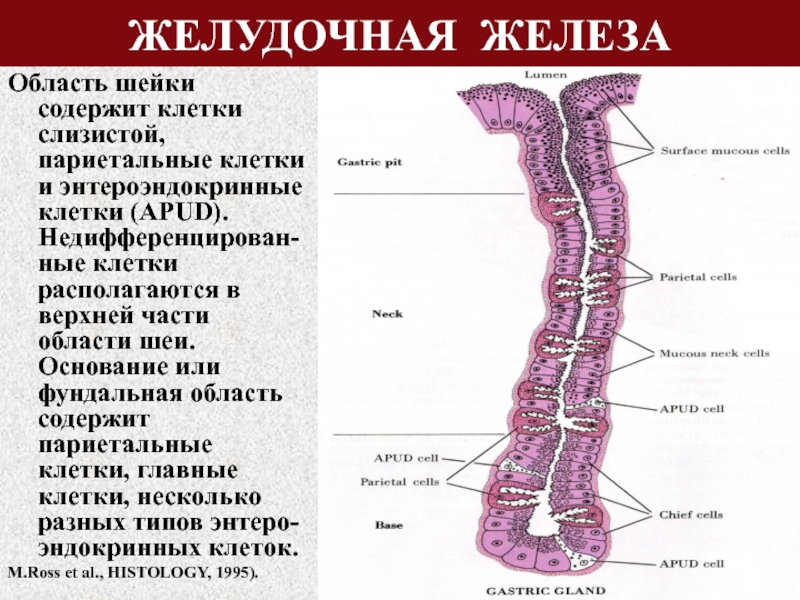
В глубине слизистой оболочки заключены многочисленные железы. Железы в области входа в желудок (кардиальные) вырабатывают слизь, железы в области привратника (пилорические) выделяют также ферменты, расщепляющие белки. Секрет желёз в области дна желудка (фундальных) содержит пепсин и соляную кислоту.
Слизистая оболочка желудка представляет собой слой, сверху которого находятся цилиндрические эпителиальные клетки, под которыми расположена рыхлая соединительная ткань и далее тонкий слой гладких мышц. В рыхлой соединительной ткани слизистой оболочки находятся железы желудка.
Различают три вида клеток, образующих эти железы. Одни из них называются главными. Эти железы продуцируют пепсиногены и химозин. Следующий вид клеток называется париетальными или обкладочными клетками. В них производится синтез соляной кислоты и гастромукопротеина.
Третий вид клеток – это добавочные клетки или мукоциты. Они производят мукоидный секрет. В области привратника (пилоруса) находятся гормонально-активные клетки. Эти клетки синтезируют гастрин. . Очень важной функцией железистых клеток желудка является формирование защитного слизистого барьера. Необходим непрерывный синтез желудочной слизи, который производится слизеобразующими клетками.
Разновидности железистых клеток слизистой оболочки желудка
Фундальные железы располагаются в слизистой дна и тела желудка. Их количество резко преобладает. Это простые трубчатые, как правило, неразветвленные железы. Они плотно располагаются в слизистой пластинке. Между ними находятся узкие прослойки рыхлой соединительной ткани с кровеносными капиллярами.
Пилорические железы располагаются в слизистой оболочке пилорического отдела желудка. Их значительно меньше и они располагаются дальше друг от друга. В этом отделе глубокие желудочные ямки, поэтому секреторные отделы располагаются глубже и разветвляются, то есть это простые разветвленные трубчатые железы.
В секреторных отделах они содержат слизистые клетки и большое количество эндокринных клеток. Они вырабатывают слабощелочную слизь.
Кардиальные железы располагаются в кардиальном отделе желудка, их сравнительно немного. Это простые трубчатые разветвленные железы. В их секреторном отделе преобладают слизистые клетки, много эндокринных клеток и встречаются париетальные и главные клетки. Они вырабатывают мало соляной кислоты и пепсиногена, то есть слабо разведенный желудочный сок.
Слизь в желудке выделяют железистые клетки
Слизь в желудке, которая на профессиональном языке называется «муцин» — гелеобразное вещество, вырабатываемое клетками органа и располагающееся на поверхности желудка. Если это вещество не будет вырабатываться, стенки желудка покроются язвами, а питательные микроэлементы перестанут правильно усваиваться.
Если это вещество не будет вырабатываться, стенки желудка покроются язвами, а питательные микроэлементы перестанут правильно усваиваться.
Сбой деятельности железистых клеток может привести к повышенной выработке слизи, что также негативно скажется на работе органа и приведет к нарушению усвоения пищи. Выработка муцина в определенном количестве происходит постоянно, этот процесс естественный и не считается отклонением. Муцин ежедневно производится для поддержания стенок органа. Если ткани желудка повреждаются, выработка слизи увеличивается в разы, это защитная реакция.
Если их не лечить, они увеличатся в размерах и превратятся в пептические язвы. Подобные новообразования травмируют эпителий органа и провоцируют различные заболевания, некоторые из которых плохо поддаются лечению.
Сбой деятельности железистых клеток может привести к повышенной выработке слизи что также негативно скажется на работе органа и приведет к нарушению усвоения пищиДлительный гастрит и гипертрофия слизистой даже могут стать причиной возникновения рака желудка. Чтобы предотвратить такие негативные последствия, при первых признаках недуга требуется немедленно посетить специалиста.
Чтобы предотвратить такие негативные последствия, при первых признаках недуга требуется немедленно посетить специалиста.
Слизь муцин в желудке выделяют железистые клетки
Сбой деятельности железистых клеток может привести к повышенной выработке слизи, что также негативно скажется на работе органа и приведет к нарушению усвоения пищи. Муцин выделяют железистые клетки, он необходим для переработки пищи (за счет него перерабатывается и соляная кислота) и защиты желудка. У здорового человека слизистая оболочка имеет толщину около 1,5 мм, внешне она напоминает желе и имеет достаточно вязкую структуру.
В зависимости от того, какие клетки производят вещество, бывает мутная, розовая и пенистая слизь (это вид растворяется хуже всего). Выработка муцина в определенном количестве происходит постоянно, этот процесс естественный и не считается отклонением. Медики связывают избыток этого вещества с неправильным питанием и некоторыми привычками человека.
Муцин ежедневно производится для поддержания стенок органа.
Если ткани желудка повреждаются, выработка слизи увеличивается в разы, это защитная реакция. Поскольку большое количество муцина свидетельствует о начале атрофического процесса и отмирании некоторых желез, пускать недуг на самотек нельзя, последствия такого игнорирования могут быть самыми печальными.
Соляную кислоту в желудке вырабатывают железистые клетки
Соляная кислота входит в состав желудочного сока. Как следует из названия, ее вырабатывают обкладочные клетки, которые находятся в слизистой оболочке желудка. Благодаря такому составу желудочный сок создает в желудке кислую среду.
Соляная кислота входит в состав желудочного сока ее вырабатывают обкладочные клетки которые находятся в слизистой оболочке желудкаЭто необходимо для правильной работы фермента пепсина, который расщепляет белки до мономеров. Пепсин активен только в кислой среде, поэтому при пониженной кислотности желудка белки плохо расщепляются. Слизистая оболочка содержит специальные клетки, которые защищают желудок от действия кислоты.
Профермент пепсиноген выделяется железистыми клетками желудка
Проферменты пищеварительного фермента желудка (пепсина), используемые в качестве биохимических маркеров состояния слизистой оболочки желудка. Пепсиногены – неактивные предшественники (проферменты) основного пищеварительного фермента желудка – пепсина.
Выделяют 2 вида пепсиногенов, которые несколько различаются по структуре и функциональным свойствам:
- пепсиноген I и пепсиноген II. Пепсиноген I продуцируется преимущественно железами слизистой оболочки дна желудка;
- пепсиноген II – также и кардиальной, антральной и дуоденальной слизистой.
Они превращаются в пепсин под действием соляной кислоты желудочного сока – при этом для пепсиногена I оптимальна высокая кислотность (рН=1,5-2,0), а для пепсиногена II более низкая (рН=4,5). В небольших концентрациях пепсиногены попадают в кровь.
Исследование уровня пепсиногенов в сыворотке крови используют для оценки состояния слизистой оболочки желудка.
Пепсиногены используют как маркер атрофического гастрита (состояние, расцениваемое как предраковое), но не как опухолевый маркер.
Что делать чтоб железистые клетки в желудке были в норме
Если ультразвуковое исследование показало, что толщина слоя муцина изменилась, первым делом пациенту посоветуют изменить рацион и назначат специальное питание. Если организм начинает производить муцин в избытке, необходимо придерживаться определенных правил питания и соблюдать режим.
Из рациона нужно исключить некачественную и вредную пищу, особенно фастфуд, жирное, жареное и газированные напитки. Потребление продуктов с добавлением канцерогенов и большого количества жиров рано или поздно негативно отразится на деятельности желудочно-кишечного тракта. Чем раньше они будут исключены, тем лучше. Чтобы желудок функционировал должным образом и был здоровым, в сутки необходимо пить минимум полтора литра фильтрованной воды и не есть всухомятку.
Источники:
- https://gastritinform.
 ru/m.ekamedcenter.ru/articles/anatomiya-zheludka-stroenie-zheludka-lechenie-zheludka.html
ru/m.ekamedcenter.ru/articles/anatomiya-zheludka-stroenie-zheludka-lechenie-zheludka.html - https://ashgb.ru/gastrit/cliz-v-zheludke-prichiny-i-lechenie-patologii-chto-delat-i-kak-izbavitsya.html
- https://studbooks.net/2483696/meditsina/zheludok
- https://kaz-ekzams.ru/biologiya/uchebnaya-literatura-po-biologii/biologia-repetitor/588-stroenie-i-funkcii-pishhevaritelnoj-sistemy.html
- https://invitro.by/analizes/for-doctors/486/10429/
- https://vseozhivote.ru/zheludok/sliz-prichini-ilecheniye.html
Post Views: 2 454
Навигация по записям
Экспрессия белка GRP94 на базолатеральных мембранах париетальных клеток слизистой оболочки желудка
БИОХИМИЯ, 2014, том 79, вып. 1, с. 13–21
УДК 577.218
© 2014 Р.М. Арин, Ю. Руеда, О. Казис, М. Галлего, А.И. Валледжо, Б. Очоа
КЛЮЧЕВЫЕ СЛОВА: париетальные (пристеночные) клетки слизистой оболочки желудка, шапероны, рецептор аденозина.
Аннотация
Белок GRP94 является членом семейства протеинов теплового шока (Hsp) и обычно располагается в эндоплазматическом ретикулуме (ЭР). Иногда он может экскретироваться, минуя KDEL-зависимый механизм удерживания белков в ЭР. Избыточная экспрессия GRP94 происходит в клетках карцином желудка или желудочно-кишечного тракта. Однако мало что известно о физиологической роли этого белка в клетках слизистой оболочки желудка. Мы определяли содержание GRP94 в мембранах пристеночных клеток слизистой оболочки желудка кролика, секретирующих соляную кислоту, используя различные способы фракционирования субклеточных компонентов и селективной солюбилизации клеточных мембранных белков, метод вестерн-блоттинга, а также изучали связывание радиоактивного лиганда с мембранами париетальных клеток. Было установлено, что функционально активный белок GRP94 экспрессирован на поверхности пристеночных клеток слизистой оболочки желудка и располагается на мембранах их базолатеральных доменов. Мы показали, что GRP94 не является интегральным мембранным белком, поскольку частично экстрагируется 50 мМ Na2CO3. Однако даже 100 мМ Na2CO3 экстрагировал не весь белок GRP94, что свидетельствовало о прочности его связывания с плазматическими мембранами. Присутствие GRP94 в изолированных плазматических мембранах было продемонстрировано методом вестерн-блоттинга, а его функционирование – в экспериментах по связыванию меченного радиоактивного лиганда N-этилкарбоксамидо[3H]аденозина ([3H]NECA). Рассчитанные двумя способами значения равновесной константы диссоциации (KD) для этого лиганда при 4° находились в диапазоне нмолей, а ингибирование связывания лиганда под действием специфичного к GRP94 конкурентного ингибитора радицикола свидетельствовало о том, что акцепторный участок белка был экспонирован на поверхность мембраны. Анализ мембранных субфракций методом вестерн-блоттинга показал, что GRP94 экспрессируется на базолатеральной мембране пристеночных клеток слизистой оболочки желудка, в то время как его содержание в мембране апикальной части клеток незначительно.
Однако даже 100 мМ Na2CO3 экстрагировал не весь белок GRP94, что свидетельствовало о прочности его связывания с плазматическими мембранами. Присутствие GRP94 в изолированных плазматических мембранах было продемонстрировано методом вестерн-блоттинга, а его функционирование – в экспериментах по связыванию меченного радиоактивного лиганда N-этилкарбоксамидо[3H]аденозина ([3H]NECA). Рассчитанные двумя способами значения равновесной константы диссоциации (KD) для этого лиганда при 4° находились в диапазоне нмолей, а ингибирование связывания лиганда под действием специфичного к GRP94 конкурентного ингибитора радицикола свидетельствовало о том, что акцепторный участок белка был экспонирован на поверхность мембраны. Анализ мембранных субфракций методом вестерн-блоттинга показал, что GRP94 экспрессируется на базолатеральной мембране пристеночных клеток слизистой оболочки желудка, в то время как его содержание в мембране апикальной части клеток незначительно. Таким образом, можно предположить, что GRP94 участвует в функционировании базолатеральных мембран.
Таким образом, можно предположить, что GRP94 участвует в функционировании базолатеральных мембран.
Механизмы взаимодействия Helicobacter pylori c эпителием слизистой оболочки желудка. II. Реакция эпителия слизистой оболочки желудка в ответ на колонизацию и персистирование H. pylori | Поздеев
1. Поздеев О.К., Поздеева А.О., Валеева Ю.В., Гуляев П.Е. Механизмы взаимодействия Helicobacter pylori c эпителием слизистой оболочки желудка. I. Факторы патогенности, способствующие успешной колонизации // Инфекция и иммунитет. 2018. Т. 8, № 3. С. 273–283. doi: 10.15789/2220-7619-2018-3-273-283
2. Al-Daccak R., Mooney N., Charron D. MHC class II signaling in antigen-presenting cells. Curr. Opin. Immunol., 2004, vol. 16, no. 1, pp. 108–113. doi: 10.1016/j.coi.2003.11.006
3. Amieva M.R., El-Omar E.M. Host-bacterial interactions in Helicobacter pylori infection. Gastroenterology, 2008, vol. 134, no. 1, pp. 306–323. doi: 10.1053/j.gastro.2007.11.009
Amieva M.R., El-Omar E.M. Host-bacterial interactions in Helicobacter pylori infection. Gastroenterology, 2008, vol. 134, no. 1, pp. 306–323. doi: 10.1053/j.gastro.2007.11.009
4. Amieva M.R., Vogelmann R., Covacci A., Tompkins L.S., Nelson W.J., Falkow S. Disruption of the epithelial apical-junctional complex by Helicobacter pylori CagA. Science, 2003, vol. 300, no. 5624, pp. 1430–1434. doi: 10.1126/science.1081919
5. Ashktorab H., Dashwood R.H., Dashwood M.M., Zaidi S.I., Hewitt S.M., Green W.R., Lee E.L., Daremipouran M., Nouraie M., Malekzadeh R., Smoot D.T. H. pylori-induced apoptosis in human gastric cancer cells mediated via the release of apoptosis-inducing factor from mitochondria. Helicobacter, 2008, vol. 13, no. 6, pp. 506–517. doi: 10.1111/j.1523-5378.2008.00646.x
6. Bagnoli F., Buti L., Tompkins L., Covacci A., Amieva M.R. Helicobacter pylori CagA induces a transition from polarized to invasive phenotypes in MDCK cells. Proc. Natl. Acad. Sci. USA, 2005, vol. 102, no. 45, pp. 16339–16344. doi: 10.1073/pnas.0502598102
Bagnoli F., Buti L., Tompkins L., Covacci A., Amieva M.R. Helicobacter pylori CagA induces a transition from polarized to invasive phenotypes in MDCK cells. Proc. Natl. Acad. Sci. USA, 2005, vol. 102, no. 45, pp. 16339–16344. doi: 10.1073/pnas.0502598102
7. Barrera C.A., Beswick E.J., Sierra J.C., Bland D., Espejo R., Mifflin R., Adegboyega P., Crowe S.E., Ernst P.B. Polarized expression of CD74 by gastric epithelial cells. J. Histochem. Cytochem., 2005, vol. 53, no. 12, pp. 1481–1489. doi: 10.1369/jhc.4A6552.2005
8. Beswick E.J., Bland D.A., Suarez G., Barrera C.A., Fan X.J., Reyes V.E. Helicobacter pylori binds to CD74 on gastric epithelial cells and stimulates interleukin-8 production. Infect. Immun., 2005, vol. 73, no. 5, pp. 2736–2743. doi: 10.1128/IAI.73.5.27362743.2005
9. Beswick E.J., Pinchuk I.V., Minch K., Suarez G., Sierra J.C., Yamaoka Y., Reyes V.E. The Helicobacter pylori urease B subunit binds to CD74 on gastric epithelial cells and induces NF-kappaB activation and interleukin-8 production. Infect. Immun., 2006, vol. 74, no. 2, pp. 1148–1155. doi: 10.1128/IAI.74.2.1148-1155.2006
Beswick E.J., Pinchuk I.V., Minch K., Suarez G., Sierra J.C., Yamaoka Y., Reyes V.E. The Helicobacter pylori urease B subunit binds to CD74 on gastric epithelial cells and induces NF-kappaB activation and interleukin-8 production. Infect. Immun., 2006, vol. 74, no. 2, pp. 1148–1155. doi: 10.1128/IAI.74.2.1148-1155.2006
10. Beswick E.J., Pinchuk I.V., Suarez G., Sierra J.C., Reyes V.E. Helicobacter pylori CagA-dependent macrophage migration inhibitory factor produced by gastric epithelial cells binds to CD74 and stimulates procarcinogenic events. J. Immunol., 2006, vol. 176, no. 11, pp. 6794–6801. doi: 10.4049/jimmunol.176.11.6794
11. Chang Y.J., Wu M.S., Lin J.T., Pestell R.G., Blaser M.J., Chen C.C. Mechanisms for Helicobacter pylori CagA-induced cyclin D1 expression that affect cell cycle. Cell. Microbiol., 2006, vol. 8, no. 11, pp. 1740–1752. doi: 10.1111/j.1462-5822.2006.00743.x
1740–1752. doi: 10.1111/j.1462-5822.2006.00743.x
12. Churin Y., Al-Ghoul L., Kepp O., Meyer T.E., Birchmeier W., Naumann M. Helicobacter pylori CagA protein targets the c-Met receptor and enhances the motogenic response. J. Cell. Biol., 2003, vol. 161, no. 2, pp. 249–255. doi: 10.1083/jcb.200208039
13. Crabtree J.E., Farmery S.M., Lindley I.J., Figura N., Peichl P., Tompkins D.S. CagA/cytotoxic strains of Helicobacter pylori and interleukin-8 in gastric epithelial cell lines. J. Clin. Pathol., 1994, vol. 47, no. 10, pp. 945–950. doi: 10.1136/jcp.47.10.945
14. Crabtree J.E., Naumann M. Epithelial cell signaling in Helicobacter pylori infection. Curr. Signal Transd., 2006, vol. 1, no. 1, pp. 53–65. doi: 10.2174/157436206775269253
15. Crabtree J.E., Shallcross T.M., Heatley R.V., Wyatt J.I. Mucosal tumour necrosis factor alpha and interleukin-6 in patients with Helicobacter pylori associated gastritis. Gut, 1991, vol. 32 , no. 12, pp. 1473–1477. doi: 10.1136/gut.32.12.1473
Crabtree J.E., Shallcross T.M., Heatley R.V., Wyatt J.I. Mucosal tumour necrosis factor alpha and interleukin-6 in patients with Helicobacter pylori associated gastritis. Gut, 1991, vol. 32 , no. 12, pp. 1473–1477. doi: 10.1136/gut.32.12.1473
16. Crabtree J.E., Wyatt J.I., Trejdosiewicz L.K., Peichl P., Nichols P.H., Ramsay N., Primrose J.N., Lindley I.J.D. Interleukin-8 expression in Helicobacter pylori infected, normal, and neoplastic gastroduodenal mucosa. J. Clin. Pathol., 1994, vol. 47, no. 1, pp. 61–66. doi: 10.1136/jcp.47.1.61
17. De Guzman B.B., Hisatsune J., Nakayama M., Yahiro K., Wada A., Yamasaki E., Nishi Y., Yamazaki S., Azuma T., Ito Y., Ohtani M., van der Wijk T., den Hertog J., Moss J., Hirayama T. Cytotoxicity and recognition of receptor-like protein tyrosine phosphatases, RPTPalpha and RPTPbeta, by Helicobacter pylori m2VacA. Cell. Microbiol., 2005, vol. 7, no. 9, pp. 1285–1293. doi: 10.1111/j.1462-5822.2005.00556.x
Cell. Microbiol., 2005, vol. 7, no. 9, pp. 1285–1293. doi: 10.1111/j.1462-5822.2005.00556.x
18. Fan X., Crowe S.E., Behar S., Gunasena H., Ye G., Haeberle H., Van Houten N., Gourley W.K., Ernst P.B., Reyes V.E. The effect of class II major histocompatibility complex expression on adherence of Helicobacter pylori and induction of apoptosis in gastric epithelial cells: a mechanism for T helper cell type 1-mediated damage. J. Exp. Med., 1998, vol. 187, no. 10, pp. 1659–1669. doi: 10.1084/jem.187.10.1659
19. Fan X., Gunasena H., Cheng Z., Espejo R., Crowe S.E., Ernst P.B., Reyes V.E. Helicobacter pylori urease binds to class II MHC on gastric epithelial cells and induces their apoptosis. J. Immunol., 2000, vol. 165, no. 4, pp. 1918–1924. doi: 10.4049/jimmunol.165.4.1918
20. Fischer W., Prassl S., Haas R. Virulence mechanisms and persistence strategies of the human gastric pathogen Helicobacter pylori. Curr. Top. Microbiol. Immunol., 2009, vol. 337, pp. 129–171. doi: 10.1007/978-3-642-01846-6_5
Fischer W., Prassl S., Haas R. Virulence mechanisms and persistence strategies of the human gastric pathogen Helicobacter pylori. Curr. Top. Microbiol. Immunol., 2009, vol. 337, pp. 129–171. doi: 10.1007/978-3-642-01846-6_5
21. Higashi H., Tsutsumi R., Muto S., Sugiyama T., Azuma T., Asaka M., Hatakeyama M. SHP-2 tyrosine phosphatase as an intracellular target of Helicobacter pylori CagA protein. Science, 2002, vol. 295, no. 5555, pp. 683–686. doi: 10.1126/science.1067147.
22. Ishiguro Y., Ohkawara T., Sakuraba H., Yamagata K., Hiraga H., Yamaguchi S., Fukuda S., Munakata A., Nakane A., Nishihira J. Macrophage migration inhibitory factor has a proinflammatory activity via the p38 pathway in glucocorticoid-resistant ulcerative colitis. Clin. Immunol., 2006, vol. 120, no. 3, pp. 335–341. doi: 10.1016/j.clim.2006.05.010
23. Iwai H., Kim M., Yoshikawa Y., Ashida H., Ogawa M., Fujita Y., Muller D., Kirikae T., Jackson P.K., Kotani S., Sasakawa C. A bacterial effector targets Mad2L2, an APC inhibitor, to modulate host cell cycling. Cell, 2007, vol. 130, no. 4, pp. 611–623. doi: 10.1016/j.cell.2007.06.043
Iwai H., Kim M., Yoshikawa Y., Ashida H., Ogawa M., Fujita Y., Muller D., Kirikae T., Jackson P.K., Kotani S., Sasakawa C. A bacterial effector targets Mad2L2, an APC inhibitor, to modulate host cell cycling. Cell, 2007, vol. 130, no. 4, pp. 611–623. doi: 10.1016/j.cell.2007.06.043
24. Jung H.C., Kim J.M., Song I.S., Kim C.Y. Helicobacter pylori induces an array of pro-inflammatory cytokines in human gastric epithelial cells: quantification of mRNA for interleukin-8, -1 alpha/beta, granulocyte-macrophage colony-stimulating factor, monocyte chemoattractant protein-1 and tumour necrosis factor-alpha. J. Gastroenterol. Hepatol., 1997, vol. 12, no. 7, pp. 473– 480. doi: 10.1111/j.1440-1746.1997.tb00469.x
25. Kabir S. The role of interleukin-17 in the Helicobacter pylori induced infection and immunity. Helicobacter, 2011, vol. 16, no. 1, pp. 1–8. doi: 10.1111/j.1523-5378.2010.00812.x
1, pp. 1–8. doi: 10.1111/j.1523-5378.2010.00812.x
26. Keates S., Keates A.C., Warny M., Peek R.M. Jr, Murray P.G., Kelly C.P. Differential activation on of mitogen-activated protein kinases in AGS gastric ati epithelial cells by cag+ and cag– Helicobacter pylori. J. Immunol., 1999, vol. 163, no. 10, pp. 5552–5559.
27. Lu H., Murata-Kamiya N., Saito Y., Hatakeyama M. Role of partitioning-defective 1/microtubule affinity-regulating kinases in the morphogenetic activity of Helicobacter pylori CagA. J. Biol. Chem., 2009, vol. 284, no. 34, pp. 23024–23036. doi: 10.1074/jbc.M109.001008
28. Lu H., Wu J.Y., Kudo T., Ohno T., Graham D.Y., Yamaoka Y. Regulation of interleukin-6 promoter activation in gastric epithelial cells infected with Helicobacter pylori. Mol.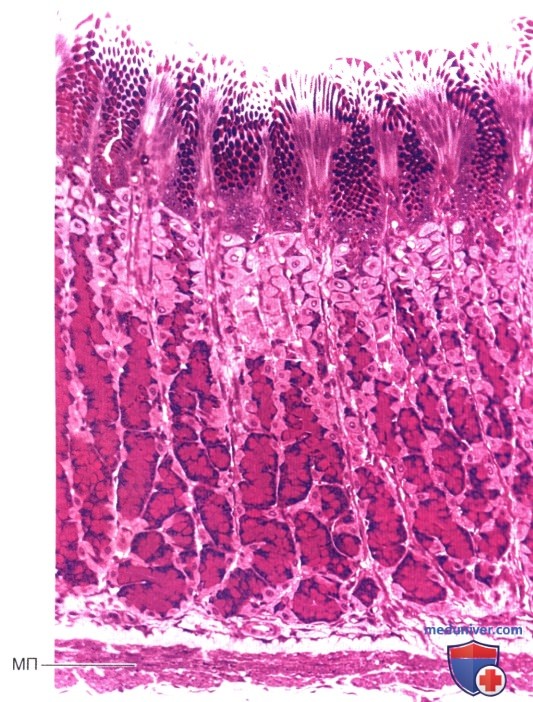 Biol. Cell, 2005, vol. 16, no. 10, pp. 4954–4966. doi: 10.1091/mbc.E05-05-0426
Biol. Cell, 2005, vol. 16, no. 10, pp. 4954–4966. doi: 10.1091/mbc.E05-05-0426
29. Matsushima K., Shiroo M., Kung H.F., Copeland T.D. Purification and characterization of a cytosolic 65-kilodalton phosphoprotein in human leukocytes whose phosphorylation is augmented by stimulation with interleukin 1. Biochemistry, 1988, vol. 27, no. 10, pp. 3765–3770. doi: 10.1021/bi00410a037
30. Mimuro H., Suzuki T., Nagai S., Rieder G., Suzuki M., Nagai T., Fujita Y., Nagamatsu K., Ishijima N., Koyasu S., Haas R., Sasakawa C. Helicobacter pylori dampens gut epithelial self-renewal by inhibiting apoptosis, a bacterial strategy to enhance colonization of the stomach. Cell Host Microbe, 2007, vol. 2, no. 4, pp. 250–263. doi: 10.1016/j.chom.2007.09.005
31. Mimuro H., Suzuki T.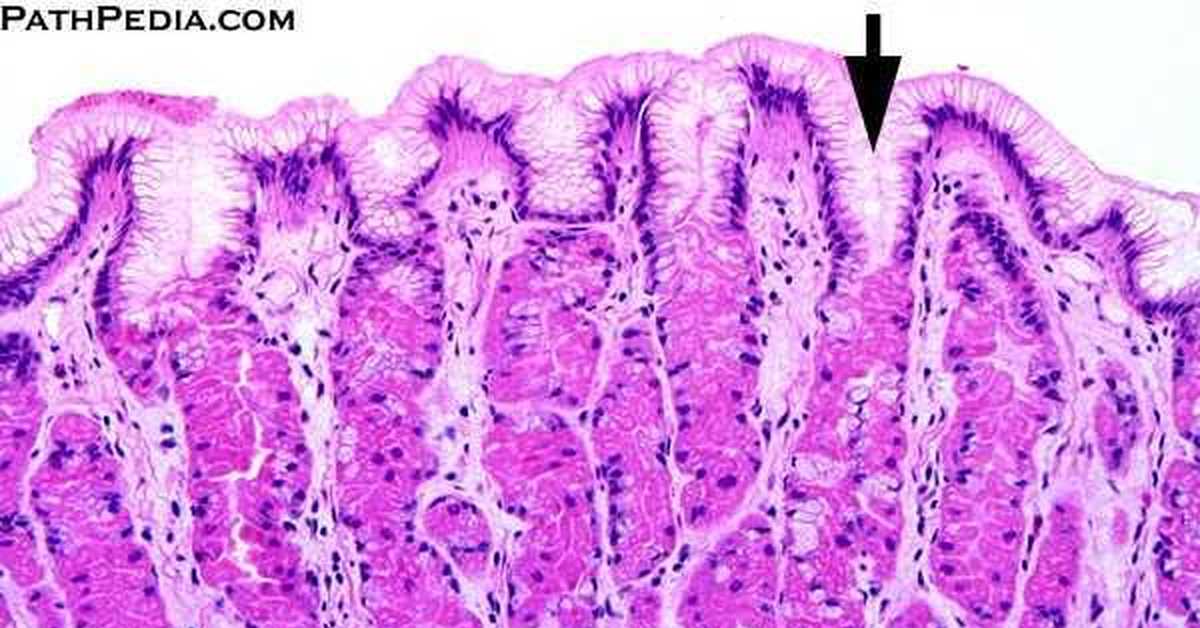 , Tanaka J., Asahi M., Haas R., Sasakawa C. Grb2 is a key mediator of helicobacter pylori CagA protein activities. Mol. Cell, 2002, vol. 10, no. 4, pp. 745–755. doi: 10.1016/S1097-2765(02)00681-0
, Tanaka J., Asahi M., Haas R., Sasakawa C. Grb2 is a key mediator of helicobacter pylori CagA protein activities. Mol. Cell, 2002, vol. 10, no. 4, pp. 745–755. doi: 10.1016/S1097-2765(02)00681-0
32. Mitchell R.A., Liao H., Chesney J., Fingerle-Rowson G., Baugh J., David J., Bucala R. Macrophage migration inhibitory factor (MIF) sustains macrophage proinflammatory function by inhibiting p53: regulatory role in the innate immune response. Proc Natl. Acad. Sci. USA, 2002, vol. 99, no. 1, pp. 345–350. doi: 10.1073/pnas.012511599
33. Mizuno T., Ando T., Nobata K., Tsuzuki T., Maeda O., Watanabe O., Minami M., Ina K., Kusugami K., Peek R.M., Goto H. Interleukin-17 levels in Helicobacter pylori-infected gastric mucosa and pathologic sequelae of colonization. World J. Gastroenterol., 2005, vol. 11, no. 40, pp. 6305–6311. doi: 10.3748/wjg. v11.i40.6305
v11.i40.6305
34. Murata-Kamiya N., Kurashima Y., Teishikata Y., Yamahashi Y., Saito Y., Higashi H., Aburatani H., Akiyama T., Peek R.M., Azuma T., Hatakeyama M. Helicobacter pylori CagA interacts with E-cadherin and deregulates the beta-catenin signal that promotes intestinal transdifferentiation in gastric epithelial cells. Oncogene, 2007, vol. 26, no. 32, pp. 4617–4626. doi: 10.1038/sj.onc.1210251
35. Odenbreit S., Kavermann H., Püls J., Haas R. CagA tyrosine phosphorylation and interleukin-8 induction by Helicobacter pylori are independent from alpAB, HopZ and bab group outer membrane proteins. Int. J. Med. Microbiol., 2002, vol. 292, no. 3–4, pp. 257–266. doi: 10.1078/1438-4221-00205
36. Olivares D., Gisbert J.P., Pajares J.M. Helicobacter pylori infection and gastric mucosal epithelial cell apoptosis. Rev. Esp. Enferm. Dig., 2005, vol. 97, no. 7, pp. 505–520.
Rev. Esp. Enferm. Dig., 2005, vol. 97, no. 7, pp. 505–520.
37. Oppenheim J.J., Zachariae C.O., Mukaida N., Matsushima K. Properties of the novel proinflammatory supergene “intercrine” cytokine family. Annu. Rev. Immunol., 1991, vol. 9, pp. 617–648. doi: 10.1146/annurev.iy.09.040191.003153
38. Parsons J.T. Focal adhesion kinase: the first ten years. J. Cell. Science, 2003, vol. 116, no. 8, pp. 1409–1416. doi: 10.1242/jcs.00373
39. Pinchuk I.V., Morris K.T., Nofchissey R.A., Earley R.B., Wu J.Y., Ma T.Y., Beswick E.J. Stromal cells induce Th27 during Helicobacter pylori infection and in the gastric tumor microenvironment. PLoS One, 2013, vol. 8, no. 1, pp. e53798. doi: 10.1371/journal.pone.0053798
40. Saadat I., Higashi H., Obuse C., Umeda M., Murata-Kamiya N., Saito Y., Lu H.S., Ohnishi N., Azuma T., Suzuki A., Ohno S., Hatakeyama M. Helicobacter pylori CagA targets PAR1/MARK kinase to disrupt epithelial cell polarity. Nature, 2007, vol. 447, no. 7142, pp. 330–333. doi: 10.1038/nature05765
Saadat I., Higashi H., Obuse C., Umeda M., Murata-Kamiya N., Saito Y., Lu H.S., Ohnishi N., Azuma T., Suzuki A., Ohno S., Hatakeyama M. Helicobacter pylori CagA targets PAR1/MARK kinase to disrupt epithelial cell polarity. Nature, 2007, vol. 447, no. 7142, pp. 330–333. doi: 10.1038/nature05765
41. Saberi S., Douraghi M., Azadmanesh K., Shokrgozar M.A., Zeraati H., Hosseini M.E., Mohagheghi M.A., Parsaeian M., Mohammadi M. A potential association between Helicobacter pylori CagA EPIYA and multimerization motifs with cytokeratin 18 cleavage rate during early apoptosis. Helicobacter, 2012, vol. 17, no. 5, pp. 350–357. doi: 10.1111/j.1523-5378.2012.00954.x
42. Sebkova L., Pellicanò A., Monteleone G., Grazioli B., Guarnieri G., Imeneo M., Pallone F., Luzza F. Extracellular signal-regulated protein kinase mediates interleukin 17 (IL-17)-induced IL-8 secretion in Helicobacter pylori-infected human gastric epithelial cells. Infect. Immun., 2004, vol. 72, no. 9, pp. 5019–5026. doi: 10.1128/IAI.72.9.5019-5026.2004
Infect. Immun., 2004, vol. 72, no. 9, pp. 5019–5026. doi: 10.1128/IAI.72.9.5019-5026.2004
43. Shi Y., Liu X.F., Zhuang Y., Zhang J.Y., Liu T., Yin Z., Wu C., Mao X.H., Jia K.R., Wang F.J., Guo H., Flavell R.A., Zhao Z., Liu K.Y., Xiao B., Guo Y., Zhang W.J., Zhou W.Y., Guo G., Zou Q.M. Helicobacter pylori-induced Th27 responses modulate Th2 cell responses, benefit bacterial growth, and contribute to pathology in mice. J. Immunol., 2010, vol. 184, no. 9, pp. 5121–5129. doi: 10.4049/jimmunol.0901115
44. Tan S., Tompkins L.S., Amieva M.R. Helicobacter pylori usurps cell polarity to turn the cell surface into a replicative niche. PLoS Pathog., 2009, vol. 5, no. 5: e1000407. doi: 10.1371/journal.ppat.1000407
45. Tanahashi T., Kita M., Kodama T., Yamaoka Y.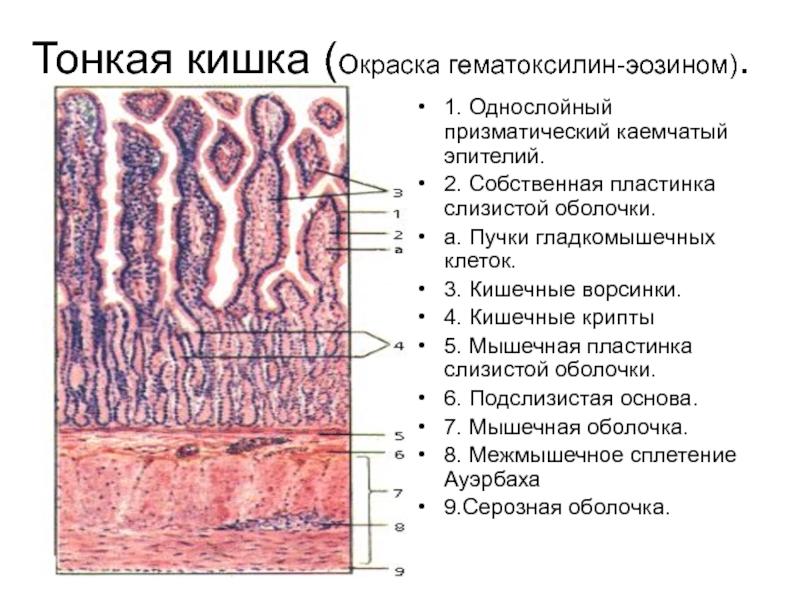 , Sawai N., Ohno T., Mitsufuji S., Wei Y.P., Kashima K., Imanishi J. Cytokine expression and production by purified Helicobacter pylori urease in human gastric epithelial cells. Infect. Immun., 2000, vol. 68, no. 2, pp. 664–671. doi: 10.1128/IAI.68.2.664-671.2000
, Sawai N., Ohno T., Mitsufuji S., Wei Y.P., Kashima K., Imanishi J. Cytokine expression and production by purified Helicobacter pylori urease in human gastric epithelial cells. Infect. Immun., 2000, vol. 68, no. 2, pp. 664–671. doi: 10.1128/IAI.68.2.664-671.2000
46. Wessler S., Backert S. Molecular mechanisms of epithelial-barrier disruption by Helicobacter pylori. Trends Microbiol., 2008, vol. 16, no. 8, pp. 397–405. doi: 10.1016/j.tim.2008.05.005
47. Wessler S., Höcker M., Fischer W., Wang T.C., Rosewicz S., Haas R., Wiedenmann B., Meyer T.F., Naumann M. Helicobacter pylori activates the histidine decarboxylase promoter through a mitogen-activated protein kinase pathway independent of pathogenicity island-encoded virulence factors. J. Biol. Chem., 2000, vol. 275, no. 5, pp. 3629–3636. doi: 10.1074/jbc.275.5.3629
48. Xia H.H., Talley N.J. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am. J. Gastroenterol., 2001, vol. 96, no. 1, pp. 16–26. doi: 10.1016/S0002-9270(00)02240-1
Xia H.H., Talley N.J. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am. J. Gastroenterol., 2001, vol. 96, no. 1, pp. 16–26. doi: 10.1016/S0002-9270(00)02240-1
49. Xia Z., Dickens M., Raingeaud J., Davis R.J., Greenberg M.E. Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis. Science, 1995, vol. 270, no. 5240, pp. 1326–1331. doi: 10.1126/science.270.5240.1326
50. Xiong S., Mu T., Wang G., Jiang X. Mitochondria-mediated apoptosis in mammals. Protein Cell., 2014, vol. 5, no. 10, pp. 737–749. doi: 10.1007/s13238-014-0089-1
51. Yokoyama K., Higashi H., Ishikawa S., Fujii Y., Kondo S., Kato H., Azuma T., Wada A., Hirayama T., Aburatani H., Hatakeyama M. Functional antagonism between Helicobacter pylori CagA and vacuolating toxin VacA in control of the NFAT signaling pathway in gastric epithelial cells. Proc. Natl. Acad. Sci. USA, 2005, vol. 102, no. 27, pp. 9661–9666. doi: 10.1073/pnas.0502529102
Proc. Natl. Acad. Sci. USA, 2005, vol. 102, no. 27, pp. 9661–9666. doi: 10.1073/pnas.0502529102
Клеточный состав желез при воспалительном процессе в слизистой оболочке желудка у детей Текст научной статьи по специальности «Фундаментальная медицина»
УДК 611
И. С. Аккуратова, Р. М. Левит, Е. М. Спивак, А. С. Надежин Клеточный состав желез при воспалительном процессе в слизистой оболочке желудка у детей
Исследован материал биопсии слизистой оболочки желудка 110 детей с хроническим гастритом с определением клеточных субпопуляций. Установлены закономерности перераспределения клеточных пулов при воспалительном процессе в зависимости от его степени и при наличии признаков атрофии.
Ключевые слова: желудок, слизистая оболочка, воспаление, дети.
I. S. Akkuratova, R. М. Levit, Е. М. Spivak, А. S. Nadezhin
Cellular Composition of Glands at the Inflammatory Process in Children’s Mucous Membrane of a Stomach
The material of biopsy of a mucous membrane of a stomach of 110 children with chronic gastritis with definition of cellular subpopulations is investigated. Consistent patterns of redistribution of cellular pools at the inflammatory process depending on its degree and in the presence of atrophy signs are determined.
Keywords: stomach, mucous membrane, inflammation, children.
В настоящее время для оценки характера воспаления в слизистой оболочке желудка (СОЖ) используют визуально-аналоговую шкалу. Оно сопровождается лейкоцитарной и лимфоплазмо-цитарной инфильтрацией, которые являются качественными и количественными маркерами его активности и выраженности. Современные классификационные подходы морфологической диагностики не учитывают изменений клеточного состава желез. Исследование гастробиоптатов в широкой клинической практике не предусматривает морфометрического анализа гистологического материала. При этом отсутствуют объективные количественные показатели, характеризующие отдельные субпопуляции клеток СОЖ в норме и патологии.
Современные классификационные подходы морфологической диагностики не учитывают изменений клеточного состава желез. Исследование гастробиоптатов в широкой клинической практике не предусматривает морфометрического анализа гистологического материала. При этом отсутствуют объективные количественные показатели, характеризующие отдельные субпопуляции клеток СОЖ в норме и патологии.
Цель работы — установить особенности клеточного состава желез слизистой оболочки желудка в норме и при наличии хронического воспалительного процесса у детей для совершенствования морфологической диагностики указанной патологии.
Материал и методы
Материалом для работы послужили данные гастробиопсии СОЖ из тела и антрального отдела желудка 110 детей с верифицированным диагнозом «хронический гастрит». Материал подвергали стандартной проводке с приготовлением
парафиновых срезов толщиной 5 мкм. Препараты окрашивали гематоксилином и эозином. В соответствии с общепринятой визуально-аналоговой шкалой определяли выраженность и активность воспалительного процесса (отсутствие, незначительный, умеренный и выраженный), а также степень атрофии СОЖ.
Препараты окрашивали гематоксилином и эозином. В соответствии с общепринятой визуально-аналоговой шкалой определяли выраженность и активность воспалительного процесса (отсутствие, незначительный, умеренный и выраженный), а также степень атрофии СОЖ.
Исследование цитологического состава желез СОЖ тела желудка предусматривало выделение основных субпопуляций: секретирующие (главные и обкладочные), эндокринные (энтерохро-маффинные и энтерохромаффиноподобные), му-цинопродуцирующие (добавочные) клетки. В антральном отделе определялись обкладочные, энтерохромаффинные, добавочные и бокаловидные клетки пилорических желез. Количество клеток субпопуляций выражалось в %о к их общему числу.
Математическая обработка цифрового материала проведена с помощью программы «81а1Р1ш 2009».
Полученные результаты и их обсуждение
При анализе 110 биопсий в соответствии с визуально-аналоговой шкалой установлено, что воспалительный процесс в СОЖ антрального отдела регистрируется в 85,5 % случаев, в 56,4 % наблюдений он носит распространенный характер. Изолированного воспаления только в теле
Изолированного воспаления только в теле
© Аккуратова И. С., Левит Р. М., Спивак Е. М., Надежин А. С., 2013 Клеточный состав желез при воспалительном процессе в слизистой оболочке желудка у детей 123
желудка не отмечено. В абсолютном большинстве случаев процесс имеет поверхностный характер. Оценка степени воспаления показала, что в теле оно чаще незначительное (59,7 %), тогда как в антруме более чем в трети наблюдений — выраженное (36,1 %, р < 0,01).
Изучение клеточного состава желез слизистой оболочки тела желудка (табл. 1) показало, что по мере увеличения выраженности воспалительного процесса происходит значительное перераспределение отдельных субпопуляций. Наблюдается достоверное снижение числа главных клеток: на 13,2 % при незначительном, на 22,6 % — умерен-
ном и на 29,4 % — выраженном воспалении по сравнению с нормой. Параллельно практически в той же степени имеет место увеличение количества добавочных клеток: на 11,4 %, 22,4 % и 31,1 % соответственно. Пул обкладочных клеток статистически значимо возрастает при умеренном (на 20,1 %) и выраженном (на 17,8 %) воспалительном процессе в теле желудка. Суммарное число энтерохромаффинных и энтерохромаффи-ноподобных клеток существенно повышается только при воспалении незначительной выраженности (до 24 ± 3 против 16 ± 2 в норме, р < 0,05).
Параллельно практически в той же степени имеет место увеличение количества добавочных клеток: на 11,4 %, 22,4 % и 31,1 % соответственно. Пул обкладочных клеток статистически значимо возрастает при умеренном (на 20,1 %) и выраженном (на 17,8 %) воспалительном процессе в теле желудка. Суммарное число энтерохромаффинных и энтерохромаффи-ноподобных клеток существенно повышается только при воспалении незначительной выраженности (до 24 ± 3 против 16 ± 2 в норме, р < 0,05).
Таблица 1
Клеточный состав желез слизистой оболочки тела желудка у детей в зависимости от степени воспалительного
процесса (/)
Клеточные субпопуляции Воспалительный процесс в теле СОЖ
норма (отсутствует) n = 48 незначительный n = 37 умеренный n = 8 выраженный n = 17
Главные клетки 469 ± 13 407±19 * 363 ± 39 ** 331 ± 25 ***
Обкладочные клетки 214 ± 10 225 ± 12 257 ± 28 ** 252±17 *
Энтерохромаф-финные + энтерохромаф-финоподобные клетки 16 ± 2 24 ± 3 * 17 ± 6 15 ± 3
Добавочные клетки 299 ± 11 341±18 * 366 ± 30 * 392 ± 17 ***
Примечание: здесь и в других таблицах знаками *, ** и *** обозначена достоверность различий по сравнению с нормой при значениях р < 0,05; < 0,01 и < 0,005 соответственно.
Гистологическая оценка пилорических желез (табл. 2) позволила установить, что при отсутствии воспалительного процесса в СОЖ у абсолютного большинства детей выявляется субпопуляция обкладочных клеток (в среднем 103 %о). Именно этот пул подвергается наиболее существенным изменениям в условиях хронического
воспаления. По нашим данным их количество резко снижается по отношению к норме уже при незначительном воспалении (на 45,6 %). При нарастании его степени падение числа обкладоч-ных клеток в антральном отделе СОЖ становится еще более выраженным.
Таблица 2
Клеточный состав желез слизистой оболочки антрального отдела желудка у детей в зависимости от степени
воспалительного процесса (/)
Клеточные субпопуляции Воспалительный процесс в антральном отделе СОЖ
норма (отсутствует) n = 16 незначительный n = 30 умеренный n = 23 выраженный n = 30
Обкладочные клетки 103 ± 26 56 ± 12 * 34 ± 10 * 35 ± 10 ***
Энтерохромаф-финные клетки 34 ± 9 37 ± 5 41 ± 4 45 ± 5 *
Добавочные клетки 855 ± 25 891 ± 14 913 ± 10 909 ± 11
Бокаловидные клетки 6 ± 2 10 ± 2 11 ± 4 8 ± 2
Так же, как и в теле желудка, в этой зоне наблюдается рост субпопуляции добавочных клеток, что носит характер тенденции, не достигая уровня статистической значимости по отношению к контролю.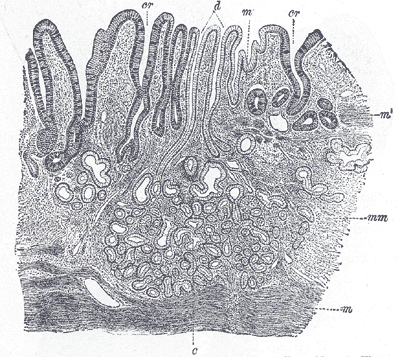
Выявлена прямая корреляция количества эн-терохромаффинных клеток пилорических желез со степенью хронического воспаления. Этот показатель максимально увеличивается в группе детей с выраженным процессом в слизистой оболочке антрума (на 32,4 % по отношению к норме, р < 0,05).
Бокаловидные клетки составляют самую малую субпопуляцию эпителия СОЖ у детей. Их число не имеет значимых межгрупповых различий.
Анализируя закономерности изменения клеточного состава СОЖ в условиях патологии, мы пришли к следующему заключению. Воспалительный процесс в антральном отделе сопровождается увеличением субпопуляции энтерохро-маффинных клеток пилорических желез, значительную часть которых составляют О-клетки, продуцирующие гастрин. Гастринемия вызывает гиперплазию обкладочных клеток тела желудка, что приводит к состоянию гиперацидности. Добавочные клетки синтезируют муцин, защищающий СОЖ от повреждающего действия агрессивных факторов. Поэтому значительный рост их количества, прежде всего, именно в теле желудка, можно расценивать как местную компенсаторно-приспособительную реакцию. В условиях текущего воспалительного процесса, по нашему мнению, нарушается дифференцировка
Поэтому значительный рост их количества, прежде всего, именно в теле желудка, можно расценивать как местную компенсаторно-приспособительную реакцию. В условиях текущего воспалительного процесса, по нашему мнению, нарушается дифференцировка
добавочных клеток в пепсинопродуцирующие. Это обеспечивает повышенное выделение муцина, но сопровождается уменьшением субпопуляции главных клеток.
Возможность развития атрофии СОЖ на фоне хронического воспаления у детей является одним из наиболее обсуждаемых вопросов педиатрической гастроэнтерологии. В настоящее время нет единой точки зрения на эту проблему. В некоторых работах имеются указания на появление признаков атрофии при длительно существующем воспалительном процессе в подростковом и даже детском возрасте [2], тогда как результаты других исследований не подтверждают этих данных [1].
В классическом понимании атрофический процесс в СОЖ представляет собой необратимую утрату железистого аппарата с замещением его фиброзной тканью либо метаплазированным эпителием. Таким образом, в случае истинной атрофии в железах СОЖ должны необратимо уменьшаться субпопуляции главных и обкладоч-ных клеток.
Таким образом, в случае истинной атрофии в железах СОЖ должны необратимо уменьшаться субпопуляции главных и обкладоч-ных клеток.
Учитывая вышеизложенное, мы провели сопоставление клеточного состава СОЖ гастроби-оптатов с отсутствием и наличием признаков атрофии, важнейшим из которых было снижение числа желез в препарате (табл. 3). В результате анализа статистически значимых межгрупповых различий не отмечено ни по одному из сравниваемых показателей.
Таблица 3
Клеточный состав желез слизистой оболочки желудка у детей в зависимости от наличия или отсутствия
признаков атрофии (//)
Слизистая оболочка тела желудка
Группы Клеточные субпопуляции
Главные Обкладочные ЭХ + ЭХП Добавочные
Признаки атрофии отсутствуют 407 ± 33 215 ± 16 17 ± 3 360 ± 22
Наличие признаков атрофии 373 ± 18 255 ± 11 18 ± 2 358 ± 16
Клеточный состав желез при воспалительном процессе в слизистой оболочке желудка у детей 125
Слизистая оболочка антрального отдела желудка
Группы Клеточные субпопуляции
Обкладочные ЭХ Добавочные Бокаловидные
Признаки атрофии отсутствуют 50 ± 15 46 ± 8 893 ± 14 6 ± 3
Наличие признаков атрофии 26 ± 7 44 ± 3 920 ± 7 10 ± 2
Примечание: ЭХ — энтерохромаффинные клети; ЭХП — энтерохромаффиноподобные клетки.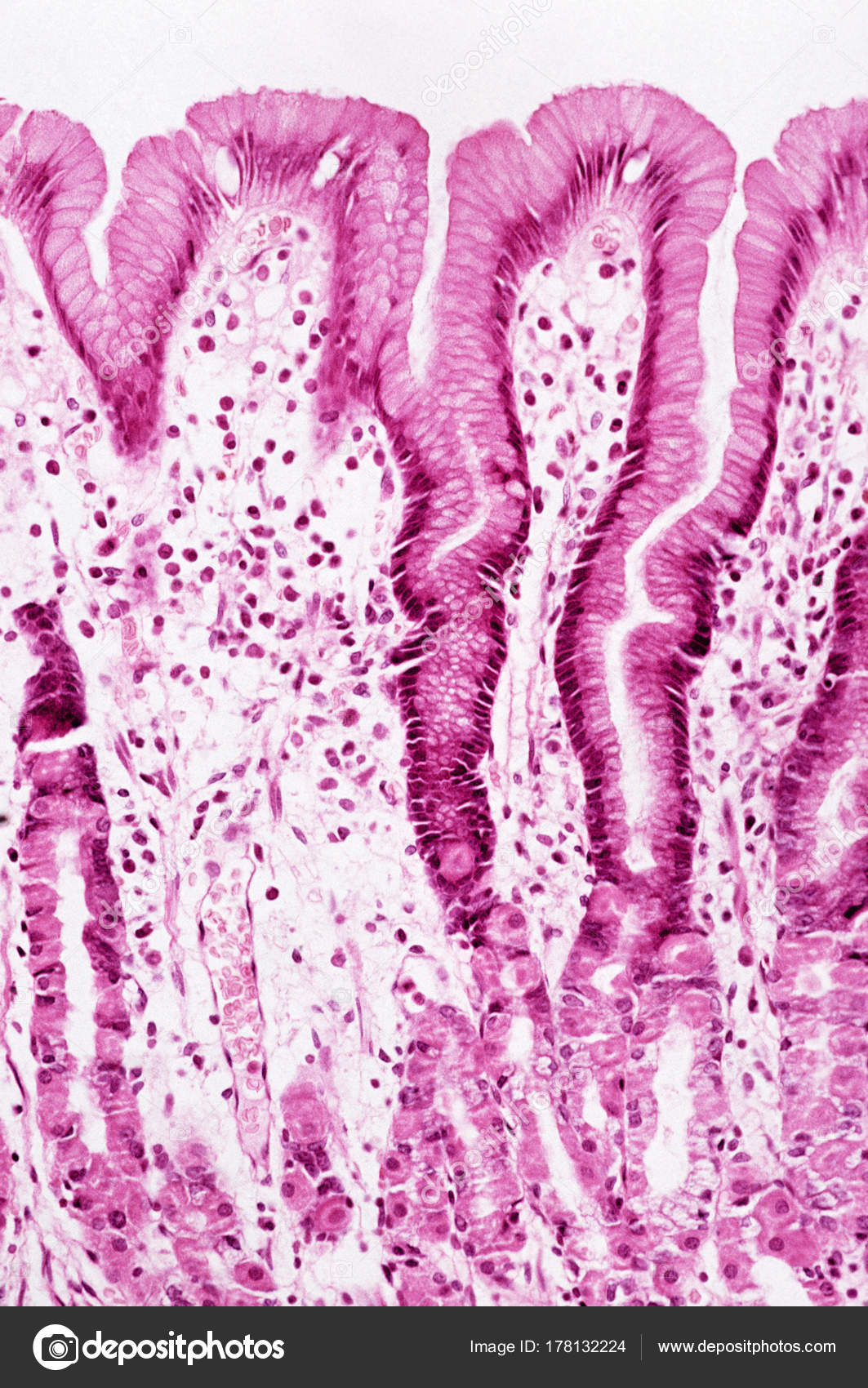 Межгрупповые различия отсутствуют (р > 0,05).
Межгрупповые различия отсутствуют (р > 0,05).
Выводы
1. Хроническое воспаление сопровождается значительным перераспределением субпопуляций клеток слизистой оболочки желудка, степень которого возрастает по мере увеличения выраженности процесса.
2. В железах тела желудка отмечается снижение числа главных при увеличении обкладочных и добавочных клеток. В пилорических железах происходит существенное уменьшение обкла-
дочных с параллельным ростом количества добавочных и энтерохромаффинных клеток.
3. Уменьшение числа желез желудка, а также изменение их клеточного состава в абсолютном большинстве случаев являются обратимыми. Эти признаки отражают текущее воспаление слизистой оболочки и поэтому не могут считаться надежными критериями истинного атрофического процесса. пу’у patsiyent. — 2006. — № 6. — 8. 7-8.
пу’у patsiyent. — 2006. — № 6. — 8. 7-8.
2. Novikova, V. Р. Diagnostika autoimmunnogo gas-v doatroficheskuyu stadiyu [Tekst] / V. Р. Novikova [i dr.] // Rossiyskiy immunologicheskiy zhurnal. — 2008. — № 2-3. — 8. 236.
- Профессор : Пак Сон Чхол
- Биография
- Доктор медицинских наук университета Корё
- Бывший врач-стажёр, терапевт медицинского центра университета Корё
- Бывший клиницист-терапевт Больницы ‘Анам’ при университете Корё
- Доцент, терапевт Больницы Кангвонского Университета
Рак желудка происходит в случае, если канцерогены постоянно оказывают влияние на нормальные клетки слизистой оболочки желудка, то последние превращаются в клетки рака, размножение которых не регулируется.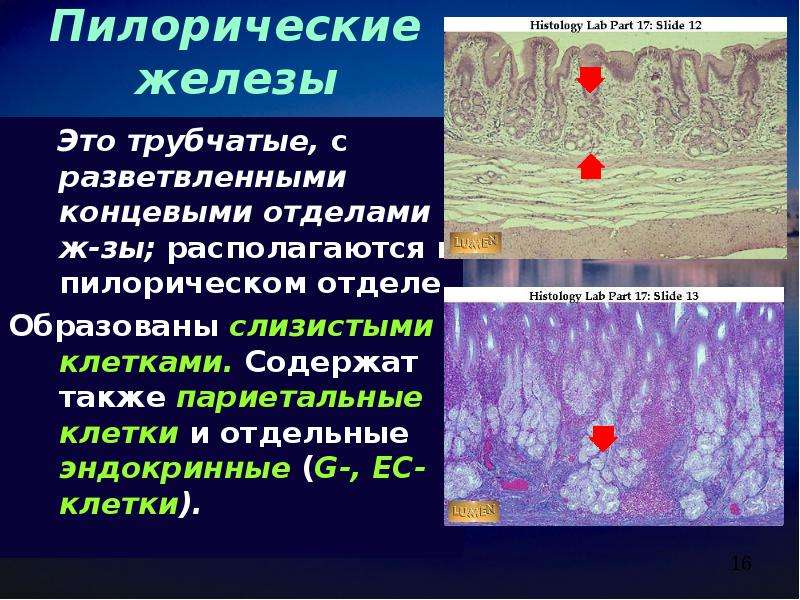 Аденокарцинома — это самый распространённый вид рака желудка, которая в основном образуется в слизистой оболочке желудка, и распространяется через стенку желудка в подслизистую основу, в мышечный слой, в слой кишечной стенки и на лимфатические узлы, или кровь разносит больные клетки к другим органам, в том числе печени и брюшине.
Аденокарцинома — это самый распространённый вид рака желудка, которая в основном образуется в слизистой оболочке желудка, и распространяется через стенку желудка в подслизистую основу, в мышечный слой, в слой кишечной стенки и на лимфатические узлы, или кровь разносит больные клетки к другим органам, в том числе печени и брюшине.
Если раковые клетки наблюдаются только в слизистой оболочке или в подслизистой основе желудка, то это называется раком желудка на ранних стадиях. 50% больных раком желудка находятся на ранних стадиях. Эндоскопическая резекция или хирургическая операция дают надежду на излечение рака на более, чем 90%.
В Больнице Кангвонского Университета открылись центр гастроэнтерологии и клиника лечения рака желудка, где активно проводится эндоскопическая резекция слизистой оболочки у больных раком желудка на ранних стадиях. Данный метод лечения позволяет иметь нормальный желудок, что может улучшить качество жизни. Наша больница прилагает максимум усилий для успешного лечения больных раком желудка путём обмена научно-техническими знаниями и внедрения современного медицинского оборудования.
Наша больница прилагает максимум усилий для успешного лечения больных раком желудка путём обмена научно-техническими знаниями и внедрения современного медицинского оборудования.
Диссертации к защите 2021 | Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова
13 сентября 2021 г.
Наумова Ольга Вячеславовна
МОЛЕКУЛЯРНО-БИОХИМИЧЕСКИЕ МАРКЕРЫ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ ПРИ ХРОНИЧЕСКОМ ВОЗДЕЙСТВИИ
РТУТИ
диссертация на соискание ученой степени кандидата биологических наук по специальности 3.2.4 — Медицина труда. Диссертационный Совет 24.1.176.01
(Д.001.012.01). Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова»
105275, г. Москва, проспект Буденного, 31, тел. +7(495)365-02-09; e-mail: [email protected]
16 сентября 2021 г.
Объявление о защите Русановой Дины Владимировны
Диссертационный совет 24. 1.176.01 (Д.001.012.01) при Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова» (105275, г. Москва, проспект Буденного, 31; тел. 365-02-09; web: www.irioh.ru; e-mail: [email protected]) объявляет, что Русанова Дина Владимировна представила диссертацию «МЕХАНИЗМЫ И ЗАКОНОМЕРНОСТИ ФОРМИРОВАНИЯ ПОРАЖЕНИЙ ПРОВОДЯЩИХ ПУТЕЙ ЦЕНТРАЛЬНОЙ И ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ ПРИ ВОЗДЕЙСТВИИ МЕТАЛЛИЧЕСКОЙ РТУТИ (КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ)» на соискание ученой степени доктора биологических наук по специальности 3.2.4 — Медицина труда.
1.176.01 (Д.001.012.01) при Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова» (105275, г. Москва, проспект Буденного, 31; тел. 365-02-09; web: www.irioh.ru; e-mail: [email protected]) объявляет, что Русанова Дина Владимировна представила диссертацию «МЕХАНИЗМЫ И ЗАКОНОМЕРНОСТИ ФОРМИРОВАНИЯ ПОРАЖЕНИЙ ПРОВОДЯЩИХ ПУТЕЙ ЦЕНТРАЛЬНОЙ И ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ ПРИ ВОЗДЕЙСТВИИ МЕТАЛЛИЧЕСКОЙ РТУТИ (КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ)» на соискание ученой степени доктора биологических наук по специальности 3.2.4 — Медицина труда.
Защита диссертации состоится 22 декабря 2021 года в конференц-зале института.
Председатель диссертационного совета 24.1.176.01 (Д.001.012.01) — Бухтияров Игорь Валентинович.
28 июня 2021 г.
Русанова Дина Владимировна
МЕХАНИЗМЫ И ЗАКОНОМЕРНОСТИ ФОРМИРОВАНИЯ
ПОРАЖЕНИЙ ПРОВОДЯЩИХ ПУТЕЙ ЦЕНТРАЛЬНОЙ И
ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ ПРИ ВОЗДЕЙСТВИИ
МЕТАЛЛИЧЕСКОЙ РТУТИ
(КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ)
диссертация на соискание ученой степени доктора биологических наук по специальности 3. 2.4 — Медицина труда. Диссертационный Совет 24.1.176.01 (Д.001.012.01). Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова»
2.4 — Медицина труда. Диссертационный Совет 24.1.176.01 (Д.001.012.01). Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова»
105275, г. Москва, проспект Буденного, 31, тел. +7(495)365-02-09; e-mail: [email protected]
15 сентября 2021 г.
Объявление о защите Брылёвой Марии Сергеевны
Диссертационный совет 24.1.176.01 (Д.001.012.01) при Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова» (105275, г. Москва, проспект Буденного, 31; тел. 365-02-09; web: www.irioh.ru; e-mail: [email protected]) объявляет, что Брылёва Мария Сергеевна представила диссертацию «СОЦИАЛЬНО-ГИГИЕНИЧЕСКОЕ ИССЛЕДОВАНИЕ СМЕРТНОСТИ НАСЕЛЕНИЯ ПРОМЫШЛЕННЫХ МОНОГОРОДОВ АРКТИКИ» на соискание ученой степени кандидата биологических наук по специальности 3.2.4 — Медицина труда.
Защита диссертации состоится 22 ноября 2021 года в конференц-зале института.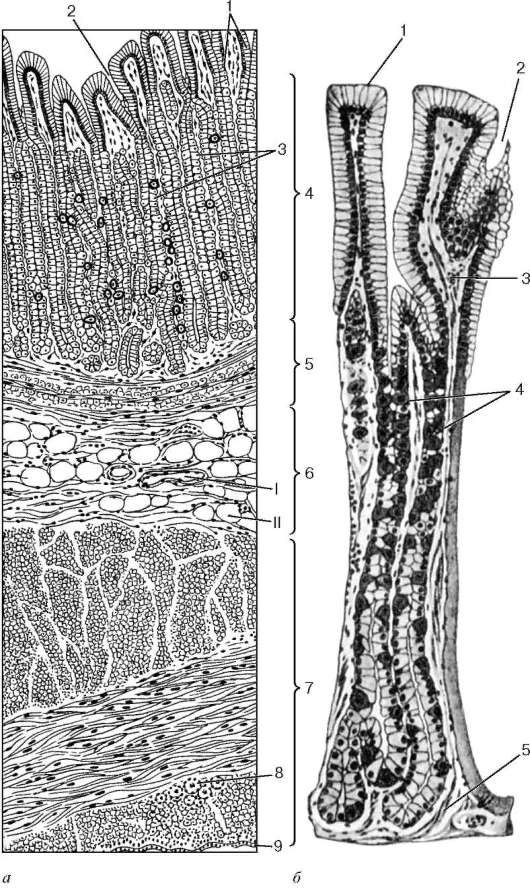
Председатель диссертационного совета 24.1.176.01 (Д.001.012.01) — Бухтияров Игорь Валентинович.
28 июня 2021 г.
Брылёва Мария Сергеевна
СОЦИАЛЬНО-ГИГИЕНИЧЕСКОЕ ИССЛЕДОВАНИЕ СМЕРТНОСТИ НАСЕЛЕНИЯ ПРОМЫШЛЕННЫХ МОНОГОРОДОВ АРКТИКИ
диссертация на соискание ученой степени кандидата биологических наук по специальности 3.2.4 — Медицина труда. Диссертационный Совет 24.1.176.01 (Д.001.012.01). Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова»
105275, г. Москва, проспект Буденного, 31, тел. +7(495)365-02-09; e-mail: [email protected]
16 сентября 2021 г.
Объявление о защите Финагиной Елизаветы Андреевны
Диссертационный совет 24.1.176.01 (Д.001.012.01) при Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова» (105275, г. Москва, проспект Буденного, 31; тел. 365-02-09; web: www.irioh.ru; e-mail: [email protected]) объявляет, что Финагина Елизавета Андреевна представила диссертацию «АНДРОГЕННЫЙ ДЕФИЦИТ И ПОКАЗАТЕЛИ МУЖСКОГО ЗДОРОВЬЯ У МАШИНИСТОВ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА» на соискание ученой степени кандидата медицинских наук по специальности 3.2.4 — Медицина труда.
365-02-09; web: www.irioh.ru; e-mail: [email protected]) объявляет, что Финагина Елизавета Андреевна представила диссертацию «АНДРОГЕННЫЙ ДЕФИЦИТ И ПОКАЗАТЕЛИ МУЖСКОГО ЗДОРОВЬЯ У МАШИНИСТОВ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА» на соискание ученой степени кандидата медицинских наук по специальности 3.2.4 — Медицина труда.
Защита диссертации состоится 22 ноября 2021 года в конференц-зале института.
Председатель диссертационного совета 24.1.176.01 (Д.001.012.01) — Бухтияров Игорь Валентинович.
24 июня 2021 г.
Финагина Елизавета Андреевна
АНДРОГЕННЫЙ ДЕФИЦИТ И ПОКАЗАТЕЛИ МУЖСКОГО ЗДОРОВЬЯ У МАШИНИСТОВ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА
диссертация на соискание ученой степени кандидата медицинских наук по специальности 3.2.4 — Медицина труда. Диссертационный Совет 24.1.176.01 (Д.001.012.01). Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова»
105275, г. Москва, проспект Буденного, 31, тел. +7(495)365-02-09; e-mail: [email protected]
Москва, проспект Буденного, 31, тел. +7(495)365-02-09; e-mail: [email protected]
17 марта 2021 г.
Объявление о защите Кузьминой Светланы Валерьевны
Диссертационный совет Д 001.012.01 при Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова» (105275, г. Москва, проспект Буденного, 31; тел. 365-02-09; web: www.irioh.ru; e-mail: [email protected]) объявляет, что Кузьмина Светлана Валерьевна представила диссертацию «РИСКИ НАРУШЕНИЯ МЕНТАЛЬНОГО ЗДОРОВЬЯ РАБОТНИКОВ ПРОИЗВОДСТВ ХИМИЧЕСКИХ ВЕЩЕСТВ. КЛИНИКО-ЭПИДЕМИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ РАННЕЙ ДИАГНОСТИКИ И ПРОФИЛАКТИКИ» на соискание ученой степени доктора медицинских наук по специальности 14.02.04 — Медицина труда.
Защита диссертации состоится 28 июня 2021 года в конференц-зале института.
Председатель диссертационного совета Д 001.012.01 Бухтияров Игорь Валентинович.
10 февраля 2021 г.
Кузьмина Светлана Валерьевна
РИСКИ НАРУШЕНИЯ МЕНТАЛЬНОГО ЗДОРОВЬЯ РАБОТНИКОВ ПРОИЗВОДСТВ ХИМИЧЕСКИХ ВЕЩЕСТВ. КЛИНИКО-ЭПИДЕМИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ РАННЕЙ ДИАГНОСТИКИ И ПРОФИЛАКТИКИ
диссертация на соискание ученой степени доктора медицинских наук по специальности 14.02.04 — Медицина труда. Диссертационный Совет Д.001.012.01. Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда имени академика Н.Ф. Измерова»
105275, г. Москва, проспект Буденного, 31, тел. +7(495)365-02-09; e-mail: [email protected]
Макроскопическая и микроскопическая анатомия желудка
Макро и микроскопическая анатомия желудка
Желудок — это расширенный участок пищеварительной трубки между пищеводом и тонкой кишкой. Показана его характерная форма вместе с терминами, используемыми для описания основных областей желудка. Правая сторона живота, показанная выше, называется большей кривизной, а левая — меньшей. Стенка желудка структурно похожа на другие части пищеварительной трубки, за исключением того, что желудок имеет дополнительный наклонный слой гладких мышц внутри кругового слоя, который помогает выполнять сложные шлифовальные движения. |
В пустом состоянии желудок сокращен, а его слизистая и подслизистая оболочка вздымаются в отчетливые складки, называемые морщины ; при растяжении с пищей морщинки «разглаживаются» и становятся плоскими.На изображении справа показаны морщинки на поверхности живота собаки. |
Внутри желудка происходит резкий переход от многослойного плоского эпителия, простирающегося от пищевода, к цилиндрическому эпителию, предназначенному для секреции. У большинства видов этот переход очень близок к отверстию пищевода, но у некоторых, в частности у лошадей и грызунов, многослойные плоские клетки выстилают большую часть дна и части тела. На изображении справа представлена поверхность слизистой оболочки желудка лошади, на которой виден эпителий пищевода (вверху) и железистый эпителий (внизу).Существа, прикрепленные к поверхности, — это боты, личиночные формы Gasterophilus . |
Если осмотреть слизистую оболочку желудка через ручную линзу, можно увидеть, что она покрыта множеством мелких отверстий. Это отверстия желудочных ямок , которые входят в слизистую в виде прямых и разветвленных канальцев, образуя желудочные железы. |
Четыре основных типа секреторных эпителиальных клеток покрывают поверхность желудка и доходят до ямок и желез желудка:
Существуют различия в распределении этих типов клеток по областям желудка — например, париетальных клеток много в железах тела, но практически нет в пилорических железах. |
Вот интересная мелочь о желудке: у утконоса его нет. У этого странного млекопитающего дистальный отдел пищевода расширен, но у утконоса нет железистого желудка.Более того, в его геноме есть делеции некоторых ключевых генов, задействованных в отделах желудка, включая гены пепсиногенов, H + / K + АТФазы желудка (протонный насос) и гормона гастрина.
Отправляйте комментарии [email protected]
Поляризованные эпителиальные монослои слизистой оболочки желудка раскрывают понимание гомеостаза слизистой оболочки и защиты от инфекции
Введение
Helicobacter pylori, грамотрицательная бактерия, которая поражает около половины населения человека, может сохраняться в желудке на протяжении десятилетий и в некоторых случаях приводить к аденокарциноме желудка. 1–4 Исключительная способность избегать иммунной защиты слизистой оболочки, по-видимому, неразрывно связана с хроническим воспалительным статусом. 5–7 Воспалительная реакция слизистой оболочки опосредует защиту хозяина от инфекции и восстановление тканей за счет усиленной регенерации, аспект, который был вовлечен в развитие опухоли.8
1–4 Исключительная способность избегать иммунной защиты слизистой оболочки, по-видимому, неразрывно связана с хроническим воспалительным статусом. 5–7 Воспалительная реакция слизистой оболочки опосредует защиту хозяина от инфекции и восстановление тканей за счет усиленной регенерации, аспект, который был вовлечен в развитие опухоли.8
H. pylori прикрепляется к ямкам желудка 9, но в конечном итоге может проникать в железы 10 и взаимодействовать с компартментом стволовых клеток, расположенным в основании.11 Эксперименты на мышах показали, что гиперплазия и другие патологические изменения в желудке происходят в основном в ответ на такую глубокую железистую колонизацию.11 Таким образом, более подробные исследования динамики инфекции выиграют от надежной модели in vitro, которая воспроизводит особенности базальных желез. отсек.
В последние годы возросшее понимание биологии стволовых клеток привело к развитию органоидных культур как способа поддержания взрослых стволовых клеток in vitro 12, 13, включая клетки, полученные путем выделения желез из образцов ткани желудка. 14 15 Эпителий антрального отдела поддерживается стволовыми клетками Lgr5 +, расположенными в основании желез 16, где секретируется MUC6. Поддержание этих стволовых клеток in vitro с помощью сигнальных факторов ниши Wnt и R-spondin позволяет создавать долгоживущие культуры органоидов желудка, и было выдвинуто предположение, что решающую роль в этом играет строма посредством секреции факторов ниши (17-19).
14 15 Эпителий антрального отдела поддерживается стволовыми клетками Lgr5 +, расположенными в основании желез 16, где секретируется MUC6. Поддержание этих стволовых клеток in vitro с помощью сигнальных факторов ниши Wnt и R-spondin позволяет создавать долгоживущие культуры органоидов желудка, и было выдвинуто предположение, что решающую роль в этом играет строма посредством секреции факторов ниши (17-19).
Органоиды можно вводить с H. pylori для моделирования инфекции in vitro, 20 21 но эта система не поддерживает крупномасштабные исследования инфекций.Альтернативный подход заключался в переносе органоидных клеток в двумерную (2D) монослойную культуру 14, но инфицированные культуры погибают в течение 24 часов. Это может быть связано не только с потерей архитектуры и поляризации ткани, что дает бактериям доступ к гораздо большей части поверхности клетки, чем in situ, но и с рассеянием защитных муцинов. Таким образом, система, которая обеспечивает обычную инфекцию при сохранении эпителиальной архитектуры, характеризующейся поляризованными клетками и плотными контактами, а также неповрежденным слоем слизи, может, таким образом, поддерживать длительную инфекцию H.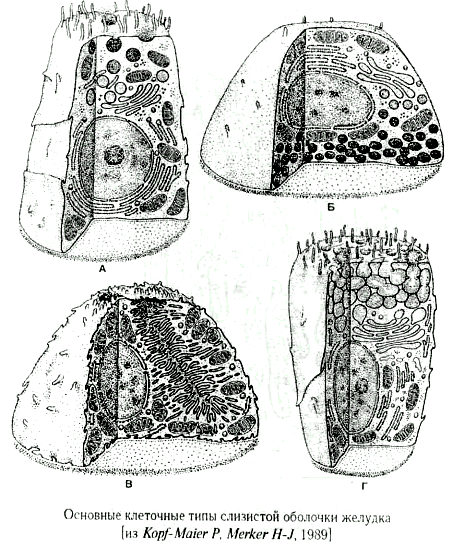 pylori .
pylori .
Здесь мы использовали методологию интерфейса воздух-жидкость (ALI) для создания «слизистых» культур — функциональных, долгоживущих, поляризованных эпителиальных монослоев — из здоровой ткани желудка человека, которые полностью воспроизводят различные клеточные линии, обнаруженные в антральных желудочных железах у человека. на месте. Эти успехи были достигнуты путем сочетания установленных методов культивирования на основе поликарбонатных фильтров 18 22 с более свежими знаниями о размножении первичных GI-клеток из взрослых стволовых клеток.14 15 23
Далее мы показываем, что эта система делает возможным направленную дифференцировку в фовеолярные или базальные фенотипы либо посредством модуляции передачи сигналов Wnt, либо путем сокультивирования с определенной стромальной популяцией. Апикальная поверхность монослоя защищена секретируемой слизью, что делает возможным хроническое инфицирование in vitro вирусом H. pylori. Эти особенности представляют ключевые преимущества по сравнению с существующими методами культивирования и позволяют проводить углубленные исследования механизмов хронического воспаления, роли слизи в эпителиальной защите и факторов, контролирующих эпителиальный гомеостаз во время инфекции. Таким образом, он представляет собой важный новый инструмент для освещения механизмов, лежащих в основе желудочного канцерогенеза.
Таким образом, он представляет собой важный новый инструмент для освещения механизмов, лежащих в основе желудочного канцерогенеза.
Результаты
Создание культур слизистой оболочки желудка на фильтрах
Желудочные железы были изолированы из образцов антрального отдела желудка человека (рис. 1А), как описано ранее.14 Антральный отдел (рис. 1А пунктирная линия) был идентифицирован как область, противоположная глазному дну ( отмечен хирургом), не имеющий типичных для тела морщин. Диссоциированные клетки из свежей ткани или органоидов желудка высевали на покрытые коллагеном поликарбонатные фильтры.Через 3 дня среду на поверхности клеток удаляют, чтобы создать условия на границе раздела воздух-жидкость (рис. 1B). В течение следующих 10 дней они развивают морфологию зрелого эпителия, становясь все выше (рис. 1C). Через 10–13 дней прозрачная слизь начинает скапливаться поверх монослоя (~ 50–100 мкл / неделя), и ее необходимо регулярно удалять (см. Дополнительный фильм в Интернете). Клетки из зрелых монослоев можно пассировать на новые фильтры или выращивать как органоиды, и наоборот, таким образом, эти два метода взаимопревращаемы.Культуры слизистой оболочки желудка содержат спорадические Ki67-положительные пролиферативные клетки (рис. 1D) даже после 1 и 2 месяцев культивирования (рис. 1E, F), что указывает на их стабильность даже без пассирования.
Клетки из зрелых монослоев можно пассировать на новые фильтры или выращивать как органоиды, и наоборот, таким образом, эти два метода взаимопревращаемы.Культуры слизистой оболочки желудка содержат спорадические Ki67-положительные пролиферативные клетки (рис. 1D) даже после 1 и 2 месяцев культивирования (рис. 1E, F), что указывает на их стабильность даже без пассирования.
(A) Пример рукавной резекции, показывающий расположение антрального отдела, тела и глазного дна. Глазное дно (отмеченное хирургом) определяет ориентацию ткани. Антрум берут из нижней части резекции, лишенной морщин желудка. (B) Схема метода культивирования мукозоидов: клетки высевают с плотностью слияния на поликарбонатные фильтры вставок лунок, помещенных в 24-луночный планшет, и среду над слоем клеток удаляют через 3 дня, чтобы инициировать культивирование на границе раздела воздух-жидкость (C) Через 1 день после посева клетки образовали сливной монослой.На 3-й день они увеличиваются в высоте и среда над клетками удаляется. Высота и поляризация клеточного слоя продолжают увеличиваться, и на 10-й день на поверхности присутствует слой муцина. Высота монослоя измерялась с помощью программного обеспечения FIJI. (D – F) Мечение иммунофлюоресценции (IF) антителом Ki67 маркирует пролиферирующие клетки в культурах мукозоидов между 2 неделями и 2 месяцами культивирования. (G – I) уровни экспрессии мРНК генов, специфичных для эпителиальных (G), стволовых (H) и железистых клеток (I), определенные из двух параллельных культур слизистой оболочки за восемь пассажей (6 месяцев), как определено с помощью кПЦР.ΔCt = разница между Ct каждого гена по сравнению с GAPDH . Результаты взяты из одной из двух проанализированных культур мукозоидов. Масштабные линейки: 10 мкм. GAPDH, глицеральдегид-3-фосфатдегидрогеназа; H. pylori, Helicobacter pylori ; мРНК, информационная РНК; qRT-PCR, количественная ПЦР с обратной транскрипцией.
Высота и поляризация клеточного слоя продолжают увеличиваться, и на 10-й день на поверхности присутствует слой муцина. Высота монослоя измерялась с помощью программного обеспечения FIJI. (D – F) Мечение иммунофлюоресценции (IF) антителом Ki67 маркирует пролиферирующие клетки в культурах мукозоидов между 2 неделями и 2 месяцами культивирования. (G – I) уровни экспрессии мРНК генов, специфичных для эпителиальных (G), стволовых (H) и железистых клеток (I), определенные из двух параллельных культур слизистой оболочки за восемь пассажей (6 месяцев), как определено с помощью кПЦР.ΔCt = разница между Ct каждого гена по сравнению с GAPDH . Результаты взяты из одной из двух проанализированных культур мукозоидов. Масштабные линейки: 10 мкм. GAPDH, глицеральдегид-3-фосфатдегидрогеназа; H. pylori, Helicobacter pylori ; мРНК, информационная РНК; qRT-PCR, количественная ПЦР с обратной транскрипцией.
Мы использовали количественную ПЦР с обратной транскрипцией (qRT-PCR), чтобы контролировать долгосрочную стабильность культур, которые пассировали один раз в месяц. Экспрессия маркеров эпителия желудка KRT8 , 18 и 19 , EPCAM и CHD1 оставалась постоянной до 7 месяцев (фигура 1G).Экспрессия маркера стволовых клеток желудка Lgr512 также оставалась постоянной после первого пассажа, как и β-катенин и CD44 , маркер пролиферирующих и стволовых клеток в желудке34 (фигура 1H). В то же время маркеры дифференцированных фенотипов железы также экспрессировались на постоянных уровнях, включая пепсиноген C ( PGC ) для главных клеток, MUC6 для клеток у основания железы, MUC5AC для фовеолярных, хромогранин A ( CHGA ) для энтероэндокринных и ATP4B для париетальных клеток (рис. 1I), что указывает на то, что фенотипический состав остается неизменным с течением времени.
Экспрессия маркеров эпителия желудка KRT8 , 18 и 19 , EPCAM и CHD1 оставалась постоянной до 7 месяцев (фигура 1G).Экспрессия маркера стволовых клеток желудка Lgr512 также оставалась постоянной после первого пассажа, как и β-катенин и CD44 , маркер пролиферирующих и стволовых клеток в желудке34 (фигура 1H). В то же время маркеры дифференцированных фенотипов железы также экспрессировались на постоянных уровнях, включая пепсиноген C ( PGC ) для главных клеток, MUC6 для клеток у основания железы, MUC5AC для фовеолярных, хромогранин A ( CHGA ) для энтероэндокринных и ATP4B для париетальных клеток (рис. 1I), что указывает на то, что фенотипический состав остается неизменным с течением времени.
Заметная поляризация культур слизистой оболочки
Поляризация культур слизистой оболочки желудка отражает то, что наблюдается в желудке, причем апикальная сторона обращена вверх, где собирается слизь, а базальная сторона обращена к фильтру, где поглощаются питательные вещества и факторы роста. Ядра локализованы на базальной стороне (рисунок 2A), в то время как E-кадгерин экспрессируется только базолатерально и никогда не апикально (рисунки 1C и 3D после посева), а экспрессия маркера плотного соединения окклюдина ограничена апикальной стороной (рисунок 2B).Трансэпителиальное электрическое сопротивление (TEER) миграции ионов колебалось от 370 до 470 Ом * см 2 , в зависимости от плотности клеток, которая выше, чем толстая кишка, но ниже, чем эпителий легких.25 Вид сверху показывает, что плотные контакты (зеленые) выглядят как характерные точки, соединяющие апикально смежные клетки, образующие непрерывный барьер (рисунок 2С). Поскольку эпителиальные барьеры имеют высокий оборот, пролиферация, а также экструзия клеток одинаково важны для сохранения постоянного числа клеток. Интересно, что когда мы визуализировали нижние стопки, мы обнаружили инвагинации плотных соединений, которые формировали розетко-подобные структуры с окружающими клетками (рисунок 2D).Сходный феномен был описан во время экструзии клеток, которая запускает базальную физиологическую перестройку плотных контактов 26, 27, чтобы поддерживать целостность эпителиального барьера. Чтобы еще больше подчеркнуть высокую поляризацию культур, мы проанализировали секретируемые белки желудочного эпителия в апикальном и базальном компартментах. Железы содержат большое количество слизистых клеток, в частности муцин MUC5AC. IF-анализ недифференцированных культур слизистой оболочки также выявил небольшое количество внутриклеточных MUC5AC и большое количество гранул MUC6, которые накапливаются апикально для секреции (рис. 2E-F) и способствуют формированию апикального слоя слизи (см. Дополнительный онлайн-фильм 1).С другой стороны, мы наблюдали базальное накопление гранул CHGA, типичных для энтероэндокринных клеток (рисунок 2G и дополнительный рисунок 1A онлайн). Редкие PGCII-положительные клетки (<0,5%), обнаруженные в культурах мукозоидов, представляют собой главные клетки, выделяющие пепсиноген на апикальной стороне (рисунок 2H и дополнительный рисунок 1B онлайн).
Ядра локализованы на базальной стороне (рисунок 2A), в то время как E-кадгерин экспрессируется только базолатерально и никогда не апикально (рисунки 1C и 3D после посева), а экспрессия маркера плотного соединения окклюдина ограничена апикальной стороной (рисунок 2B).Трансэпителиальное электрическое сопротивление (TEER) миграции ионов колебалось от 370 до 470 Ом * см 2 , в зависимости от плотности клеток, которая выше, чем толстая кишка, но ниже, чем эпителий легких.25 Вид сверху показывает, что плотные контакты (зеленые) выглядят как характерные точки, соединяющие апикально смежные клетки, образующие непрерывный барьер (рисунок 2С). Поскольку эпителиальные барьеры имеют высокий оборот, пролиферация, а также экструзия клеток одинаково важны для сохранения постоянного числа клеток. Интересно, что когда мы визуализировали нижние стопки, мы обнаружили инвагинации плотных соединений, которые формировали розетко-подобные структуры с окружающими клетками (рисунок 2D).Сходный феномен был описан во время экструзии клеток, которая запускает базальную физиологическую перестройку плотных контактов 26, 27, чтобы поддерживать целостность эпителиального барьера. Чтобы еще больше подчеркнуть высокую поляризацию культур, мы проанализировали секретируемые белки желудочного эпителия в апикальном и базальном компартментах. Железы содержат большое количество слизистых клеток, в частности муцин MUC5AC. IF-анализ недифференцированных культур слизистой оболочки также выявил небольшое количество внутриклеточных MUC5AC и большое количество гранул MUC6, которые накапливаются апикально для секреции (рис. 2E-F) и способствуют формированию апикального слоя слизи (см. Дополнительный онлайн-фильм 1).С другой стороны, мы наблюдали базальное накопление гранул CHGA, типичных для энтероэндокринных клеток (рисунок 2G и дополнительный рисунок 1A онлайн). Редкие PGCII-положительные клетки (<0,5%), обнаруженные в культурах мукозоидов, представляют собой главные клетки, выделяющие пепсиноген на апикальной стороне (рисунок 2H и дополнительный рисунок 1B онлайн).
(A) Окрашивание H&E среза культуры слизистых оболочек показывает базальное распределение ядер. (B) Мечение IF против окклюдина показывает, что клетки апикально соединены плотными контактами.(C) IF вид сверху культуры мукозоидов, показывающий, что окклюдин присутствует во всех соединениях клеток. (D) IF-изображение нижнего участка того же монослоя, показывающее базальную перестройку апикального окклюдина вокруг клеток, организованных в розетко-подобную структуру. (E) Некоторые гранулы в клетках из (+ W + R) культур слизистых оболочек антрального отдела кишечника положительны в отношении MUC5AC апикально. (F) клетки из (+ W + R) культур антрального отдела слизистой оболочки показывают большое количество апикальных MUC6-положительных гранул. (G) Мечение IF против хромогранина А, показывающее положительные гранулы на базальной стороне гормон-продуцирующих энтероэндокринных клеток культуры антральных слизистых оболочек (H).Мечение IF против пепсиногена CII, показывающее главные клетки, продуцирующие пепсиноген II, в культуре мукозоидов антрального отдела. Масштабные линейки: 10 мкм.
Динамика дифференцировки и пролиферации
Эксперименты по отслеживанию клонов на мышах продемонстрировали, что основание антральных желез заселено Lgr5 -экспрессирующими стволовыми клетками, которые способны повторно заселять всю железу. Эти клетки пролиферируют и мигрируют вверх к ямке железы, образуя фовеолярный клон.12 Ниша стволовых клеток in vivo в значительной степени зависит от активации пути Wnt, что имитируется добавлением в культуральную среду рекомбинантного Wnt3A (+ W) и R-спондин (RSPO) 1 (+ R) 14, приводящий к высвобождению β-катенина в цитоплазме и транслокации в ядро (рисунок 3A), где он действует как транскрипционный коактиватор факторов транскрипции.Лишение культур Wnt3A / RSPO1 (-W-R) в течение 6 дней удаляет β-катенин из ядра (рис. 3B) и имитирует процесс дифференцировки в фовеолярный фенотип. Зона пролиферации в желудке находится чуть ниже ямок слизистой оболочки желудка. В антральном отделе, который характеризуется более высоким фовеолярным отделом, эта зона расположена глубоко в ямках 28 (рис. 3E). В культурах, лишенных Wnt3A и RSPO1, мы заметили повышенное количество пролиферативных клеток Ki67 + (рисунок 3C, количественное определение D в F), что увеличивает высоту и плотность клеток, что типично для ямок (рисунок 3G).Лишение Wnt3A и RSPO1 дополнительно привело к резкому снижению экспрессии маркера стволовых клеток LGR5 (фигура 3H). Чтобы проверить, является ли эта дифференцировка обратимой, мы высевали первичные клетки на фильтры для создания культур слизистых оболочек, а затем удалили Wnt3A и RSPO1 на 12 или 30 дней. Отдельные клетки переносили в условия культивирования органоидов, восстанавливая поступление WN3A и RSPO1. Способность образовывать органоиды была значительно и навсегда снижена по сравнению с контролем, даже когда Wnt и RSPO были отменены только в течение 12 дней (рисунок 3I).
Рисунок 3Две или три различных культуры слизистой оболочки антрального отдела использовали для оценки влияния Wnt и RSPO на клеточную дифференцировку и пролиферацию. (A) Мечение IF против β-катенина, показывающее универсальную ядерную локализацию в состоянии + W + R. (B) β-катенин отсутствует в ядре после отмены W / R в течение 6 дней. (C, D) Удаление W / R также сопровождается увеличением количества клеток, положительных по маркеру пролиферации Ki67, и увеличением роста. (E) Срез антрального отдела желудка, окрашенный на Ki67, показывает субфовеолярную локализацию компартмента пролиферации в антральном отделе.(F, G) Количественная оценка Ki67-положительных клеток и плотности клеток после изъятия W / R из восьми секций n> 400 (H) LGR5, определенной с помощью qRT-PCR, по сравнению с таковой в среде + W + R. Столбцы представляют собой среднее из трех. (I) Сканирование плитки 50 мкл капли Matrigel, засеянной 30 000 клеток, с последующим 6-дневным ростом сфероидов. Слева: культуры мукозоидов культивировали в течение 30 дней в среде + W + R перед переносом в культуры Matrigel в среде + W + R для выращивания органоидов. Показаны репрезентативные изображения трех независимых культур.В центре: культивирование слизистых оболочек в течение 6 дней в среде + W + R с последующим удалением Wnt3A и RSPO1 в течение 12 дней с последующими 12 днями в среде + W + R, что приводит к резкому снижению выживаемости органоидов. Справа: клетки, культивированные без Wnt3A и RSPO1, не генерировали никаких органоидов. Непарный t-критерий: **** P≤0,00005; ** P≤0,005. Немаркированные стержни: 10 мкм. Lgr5, рецептор 5, связанный с G-белком, содержащий богатые лейцином повторы; qRT-PCR, количественная ПЦР с обратной транскрипцией; РСПО, Р-спондин.
Дифференциация регулирует секрецию слизи
Железы слизистой оболочки желудка защищены от кислоты и пищеварительных ферментов гелем слизи, который полимеризуется с разной плотностью.В нормальной слизистой оболочке антрального отдела MUC5AC продуцируется на поверхности, тогда как MUC6 экспрессируется глубже в железе.29 30 Точно так же культуры слизистых оболочек, выращенные в среде + W + R, содержат низкие уровни MUC5AC (красный) (рисунок 4A), в то время как среда -WR индуцирует экстенсивное производство этого муцина (рисунок 4B). Противоположное наблюдается для MUC6 (рисунок 4C, D). Смешанный MUC5AC / MUC6, а также мягкий пролиферативный фенотип получают, если альтернативно удалять Wnt3A и RSPO1 (см. Дополнительный рисунок 2 в Интернете). Гранулы муцина обнаруживаются с помощью электронной микроскопии и накапливаются на апикальной стороне в обоих условиях, хотя в культурах -W-R апикальные гранулы крупнее и многочисленнее (рис. 4E, F).Эта дифференцированная продукция муцинов была подтверждена с помощью ОТ-ПЦР (рисунок 4G). Масс-спектрометрический анализ слизи из культур + W + R по сравнению с культурами -WR подтвердил, что наиболее распространенными муцинами являются MUC5AC и MUC6, и что последний секретируется в культурах + W + R, что соответствует базовым условиям (рисунок 4H и дополнительная таблица 1 онлайн. ). Факторы трипсина 1 и 2, гастрокин 1 и особенно лизоцим антимикробного белка также присутствуют в слизи в большом количестве (рис. 4H и дополнительная таблица 1 в Интернете).Интересно, что белок PROM1, связанный со стволовыми клетками, также присутствует в высоких количествах в слизи, хотя его секреция только прогнозируется (рисунок 4H). Таким образом, культуры слизистых оболочек воспроизводят основные характеристики исходной ткани и предоставляют уникальную возможность изучить слизь и изменения в апикальном секрете при различных физиологических и, в конечном итоге, патологических состояниях.
Рисунок 4(A – B) IF-мечение фовеолярного маркера MUC5AC показывает, что экспрессия низкая в состоянии + W + R и увеличивается после отмены W / R в течение 6 дней (-W-R).(C – D) Напротив, экспрессия базального маркера MUC6 высока в состоянии + W + R и резко снижается после отмены W / R в течение 6 дней (-W-R). (E) ЭМ культуры антральных слизистых оболочек в условиях + W + R, показывающая обогащенные MUC6 гранулы апикальной слизи. (F) Повышенное накопление и секреция гранул, обогащенных MUC5AC, в культурах антральных слизистых оболочек в условиях -W-R. (G) анализ qRT-PCR показывает, что относительные уровни мРНК MUC5AC выше при отмене W / R, тогда как уровни MUC6 высоки в + W + R.Столбцы представляют собой среднее значение ± стандартное отклонение двух независимых экспериментов * P <0,05. (H) Протеомный анализ общей слизи, продуцируемой четырьмя образцами антральной культуры слизистых оболочек, выявил дифференциальную секрецию муцинов, секретируемых ферментов и других белков при сравнении + W + R и -W-R. Wnt и RSPO удаляли на 5 дней. График в виде прямоугольников и усов представляет среднее и минимальное / максимальное значения нормализованного сигнала LFQ, рассчитанного с помощью программного обеспечения MaxQuant (четыре образца слизи на условие). На графике показаны только высокосекретируемые белки с более чем двумя уникальными пептидами в четырех условиях, с наивысшей нормализованной интенсивностью и наивысшим баллом (> 250) и обнаруженные в слизи, полученной из всех четырех культур слизистых оболочек антрального отдела.ЭМ, электронная микрофотография; LFQ, количественное определение без этикеток; мРНК, информационная РНК; qRT-PCR, количественная ПЦР с обратной транскрипцией; РСПО, Р-спондин.
Перекрестная связь между стромальными клетками и эпителием
Слизистая оболочка желудка состоит из желез, интеркалированных собственной пластинкой, состоящей из стромальных фибробластов. Эти стромальные клетки отличаются от миофибробластов слизистой оболочки мышечной оболочки непосредственно под железами (рис. 5А). Мы изолировали и увеличили стромальные клетки желудка (GSC) собственной пластинки и добавили их в базальный компартмент культур.Через 6 дней уровень эпителиальной информационной РНК (мРНК) LGR5 был снижен, как было определено с помощью q-PCR. Этот эффект был воспроизведен путем воздействия на культуры GSC-кондиционированной среды (рис. 5В), что позволяет предположить, что ответственным является секретируемый фактор. Чтобы проверить, связано ли снижение экспрессии Lgr5 с изменениями пути передачи сигналов Wnt, мы титровали GSC-кондиционированную среду на линии репортерных клеток Wnt, активированной 50% супернатанта LWnt3A (линия клеток, продуцирующая большое количество Wnt3A) (рис. 5C). ).В то время как 50% супернатант LWnt3A генерировал сильный репортерный сигнал (фигура 5C и дополнительная фигура 3A, верхняя панель), комбинация с GSC-кондиционированной средой уменьшала сигнал (фигура 5C и дополнительная фигура 3A в режиме онлайн, нижняя панель). Распределение β-катенина также показало расположение ядра только тогда, когда путь Wnt активируется Wnt3A и RSPO1 (рисунок 5D, F), но не тогда, когда клетки совместно культивируются с GSC (рисунок 5H) и претерпевают частичную дифференцировку в фовеолярный фенотип, как показано увеличение количества клеток, продуцирующих MUC5AC (рисунок 5I по сравнению с 5G).Строма собственной пластинки, таким образом, снижает способность эпителия к стволу и индуцирует частичную дифференцировку посредством секретируемых факторов, которые ингибируют путь Wnt зависимым от β-катенина способом. Чтобы дополнительно проанализировать, какие факторы ответственны за снижение экспрессии Lgr5, мы проверили экспрессию мРНК всех растворимых ингибиторов Wnt. Мы наблюдали сильную экспрессию sFRP1 , DKK1 и DKK3 , а также BARX1 , регулирующего фактор транскрипции sFRPs (рисунок 5J).Поскольку эпителиальный гомеостаз строго контролируется, сигналы, полученные от других клеток, могут нарушать это равновесие, на что указывают розеткообразные структуры, наблюдаемые в культурах слизистой оболочки желудка, которые указывают на возможные места экструзии и регенерации клеток. Розетки были в изобилии в культурах, содержащих активаторы Wnt, но почти отсутствовали без активаторов Wnt, в то время как присутствие GSC приводило к снижению количества (см. Дополнительную диаграмму 3C-E и количественную оценку в B). Это указывает на то, что культуры слизистой оболочки желудка позволяют моделировать связь между эпителием и стромой в сокультурах, представляя собой чувствительную систему для анализа стволовости и эпителиального гомеостаза.
Рисунок 5(A) Схема желудочной железы, показывающая положение стромы собственной пластинки, из которой происходят изолированные GSC. (B) Фильтры, содержащие культуры антральных слизистых оболочек, перемещали в лунки, содержащие GSC, и культивировали совместно в течение 6 дней или, альтернативно, культивировали с 50% идентичной среды, кондиционированной GSC. Уровни экспрессии мРНК LGR5 измеряли с помощью qRT-PCR и выражали относительно условия + W + R; Столбцы представляют собой среднее значение ± SEM трех независимых биологических повторов; * Р <0.05, **** P <0,00005, непарный t-критерий. (C) Т-клетки 293, трансфицированные сайтом связывания 7x для TCF, управляющего экспрессией GFP , использовали для измерения активации пути Wnt. Среду, кондиционированную GSC, титровали в постоянном присутствии 50% среды, кондиционированной LWnt3A. (D, E) Культуры слизистых оболочек, выращенные в среде -W-R, почти не показывают ядерного β-катенина (D), но сильно экспрессируют MUC5AC (E). (F, G) Культуры антральных слизистых оболочек, выращенные в среде + W + R, обнаруживают ядерный β-катенин (F), но почти не экспрессируют определяемый MUC5AC (G).(H, I) После 6 дней совместного культивирования с GSC в присутствии + W + R β-катенин больше не локализуется в ядрах (H), и MUC5AC снова экспрессируется (I). (J) Экспрессия растворимых ингибиторов Wnt в GSC, обнаруженная с помощью RT-PCR. Экспрессию SFRP2 и DKK3 тестировали с праймерами против двух разных участков, охватывающих экзоны. Масштабные линейки: 10 мкм. GSC, стромальные клетки желудка; мРНК, информационная РНК; qRT-PCR, ПЦР с обратной транскрипцией.
Отчетливые ответы базальных и фовеолярных клеток на
H.pyloriДля моделирования инфекции, вызванной H. pylori , мы инфицировали культуры слизистой оболочки желудка с помощью P12 при множественности инфекции (MOI) 100 в течение 3 дней. Чтобы изучить, как «базальные» и «фовеолярные» культуры реагируют на инфекцию, культуры слизистых оболочек антрального отдела трех пациентов культивировали в течение 13 дней перед удалением Wnt3A и RSPO1 из половины культур в течение 5 дней. Полученные недифференцированные монослои MUC6 hi и фовеолярного типа MUC5AC hi инфицировали в течение 3 дней, затем анализировали с помощью qPCR и микрочипа.Никаких значительных изменений жизнеспособности бактерий в условиях + W + R по сравнению с –W-R не наблюдалось (рисунок 6A). Экспрессия генов, связанных со стволовыми клетками, была снижена в дифференцированных клетках, как и ожидалось, и экспрессия MUC6 и MUC5AC изменилась соответственно (см. Дополнительные рисунки 2A, B в Интернете).
Рисунок 6(A) Выживаемость бактерий (P12) при заражении культур слизистых слизистой оболочки антрального отдела + W + R (MOI = 25) по сравнению с -W-R (четыре разных образца на состояние), выраженная в процентах от введенного количества.(B – I) Культуры антральных слизистых оболочек, полученные от трех разных пациентов, культивировали в течение 13 дней. Параллельные образцы были дифференцированы путем исключения Wnt3A и RSPO1 из культуры в течение 5 дней с последующим заражением P12 в течение 3 дней при MOI 100. (B) Экспрессия IκBα ( NFKBIA ) была проанализирована с помощью qRT-PCR и нормализована к не- инфицированные контрольные клетки в + W + R. Показанные результаты являются репрезентативными для двух биологических повторностей. (C) РНК из трех биологических повторов анализировали с помощью микроматрицы.На тепловой карте представлены гены-мишени NF-κB, сгруппированные по их функциям. (D – I) Проверка результатов выбранных массивов с помощью qRT-PCR, нормализованных к незараженным контрольным клеткам в + W + R. Показанные результаты являются репрезентативными для двух биологических повторностей. (J, K) Культуры слизистых от трех разных пациентов культивировали, как в (B – I), затем обрабатывали 10 мкг / мл TNF-α или 5 мкг / мл IL-1β в течение 3 дней. Экспрессию IL-8 анализировали с помощью qRT-PCR и нормализовали для необработанных контрольных клеток в среде + W + R. нс: не имеет значения; * Р <0.005, непарный t-критерий. Планки погрешностей представляют собой минимальные и максимальные значения из технических реплик. ИЛ, интерлейкин; qRT-PCR, количественная ПЦР с обратной транскрипцией; TNF-a, фактор некроза опухоли альфа.
Далее мы сосредоточились на воспалительной реакции, опосредованной NF-κB. После инфицирования NFKBIA обычно разрушается, позволяя p65 проникать в ядро и активировать транскрипцию κB-чувствительных генов, включая сам IκBα, создавая петлю отрицательной обратной связи. Интересно, что транскрипция NFKBIA была намного выше, если заражение проводилось в условиях + W + R по сравнению с -W-R (фигура 6B), что позволяет предположить, что способность базального компартмента воспринимать бактерии значительно выше по сравнению с фовеолами.Чтобы подтвердить это наблюдение, мы проанализировали все потенциальные гены-мишени NF-κB на нашем микрочипе. После заражения у большинства генов-мишеней была повышенная регуляция в + W + R по сравнению с состоянием -W-R (фигура 6C). Мы использовали кПЦР для проверки нескольких важных медиаторов воспаления, зависимых от NF-κB, включая хемокины, рекрутирующие Т-клетки, интерлейкин 8 ( CXCL8 ), CXCL1 , CXCL3 , CCL20 и IL-23A как а также лимфотоксин B ( LTB ) (рисунок 6D – H).Сильная активация в ответ на инфекцию наблюдалась только в среде + W + R.
Поскольку это говорит о том, что клетки основания железы демонстрируют гораздо более сильный воспалительный ответ, мы проверили, связано ли это с большей чувствительностью к воспалительным стимулам. С этой целью культуры + W + R и -W-R обрабатывали либо фактором некроза опухоли альфа (TNF-α), либо IL-1β в течение 3 дней с последующей количественной ПЦР. TNF-α индуцировал экспрессию IL-8 , независимо от W / R (фигура 6J), тогда как IL-1β индуцировал IL-8 предпочтительно в культурах + W + R (фигура 6K).Поскольку TNF-α, но не IL-1β экспрессируется эпителиальными клетками, мы проверили его экспрессию после заражения. H. pylori индуцирует экспрессию TNF-α преимущественно в культурах + W + R (фиг. 6I), подтверждая наше наблюдение, что компартмент стволовых клеток желудка преимущественно реагирует на инфекцию, в то время как клетки в фовеолярном компартменте остаются молчаливыми.
Апикальная динамика
инфекции H. pyloriВо время инфекции бактерии всегда располагались в очагах и не разрушали монослой, как в традиционной 2D-культуре.Поэтому мы исследовали динамику адгезии и роль слизи в борьбе с инфекцией. Конфокальные изображения инфицированных культур антральных слизистых оболочек (+ W + R) через 72 часа показывают, что некоторые из этих колоний все еще задерживаются в слизи (рисунок 7A, увеличение слева) или прилипают к поверхности эпителия (рисунок 7A, увеличение справа). Транслокация бактериального белка CagA была подтверждена присутствием фосфорилированного белка, обнаруженного с помощью вестерн-блоттинга (фигура 7B). Чтобы улучшить разрешение, мы использовали изогенный штамм, экспрессирующий зеленый флуоресцентный белок (GFP), и обрезали фильтр до областей, содержащих зеленую флуоресценцию, чтобы обогатить инфицированные клетки перед обработкой для электронной микроскопии.Интересно, что через 12–24 часов большинство бактерий становятся кокковыми, продуцируют большое количество пузырьков, и большинство из них контактирует не с эпителием на апикальной поверхности, а через микроворсинки (рисунок 7C, левая панель). Однако спиральные бактерии также могут быть обнаружены прилипшими к поверхности через 6 часов после заражения (рис. 7C, правая панель).
Рисунок 7(A) Культуры антральных слизистых оболочек, инфицированные в течение 72 часов при MOI 50, меченные антителом против CagA, демонстрирующие группы бактерий, которые еще не прикрепились к клеткам (*) или не прикрепились к поверхности (**).(B) Вестерн-блот-анализ фосфорилированного CagA, обнаруженного с помощью антитела против PY99 в клеточных лизатах из неинфицированных клеток (левая полоса), культур антральных слизистых оболочек, инфицированных P12 при MOI 100 в течение 72 часов (средняя полоса), и тех же клеток, засеянных как плоские монослои на покрытом коллагеном пластике, инфицированном в течение 18 часов при MOI 25 (правая полоса) (C), левая панель: ЭМ культуры антрального слизистого тела, показывающая взаимодействие между микроворсинками и очагами коккоидных бактерий через 24 часа после инфицирования: правая панель: спиральная бактерия, прикрепившаяся к апикальной поверхности через 6 часов после заражения.P12-GFP MOI = 100. (D) Парафиновый срез культуры слизистой оболочки, инфицированной P12 при MOI 50 в течение 72 часов. Яркий слой указывает на слой ячеек. Бактерии в основном связаны со сплошным слоем слизи, в который удалось проникнуть лишь немногим (стрелки). (E) Слизь собирали из культур слизистой оболочки, инфицированных P12 при MOI 100 или неинфицированных контролей, центрифугировали для удаления бактерий и использовали для внесения устойчивых к канамицину изогенных штаммов P12-GFP в течение 1 и 2 часов. Образец помещали на чашки с канамицином и подсчитывали колонии относительно количества посеянных бактерий.Результаты представляют собой процент колоний по сравнению с входными +/- SD трех образцов слизи. ЭМ, электронная микрофотография; H. pylori, Helicobacter pylor i; PY99, фосфорилированный тирозин.
Поскольку апикальная сторона также характеризуется наличием слизи, мы проанализировали изображения необработанных срезов, которые показали, что большинство бактерий заблокировано слоем слизи (рисунок 7D), который они могут пересечь лишь изредка, чтобы образовать очаговые колонии наверху. ячеек (стрелки). Это может объяснить, почему культуры мукозоидов не инфицированы однородно.Интересно, что мы заметили, что слизь является физическим барьером и обладает бактерицидной активностью. Мы аспирировали поверхностную слизь из P12-инфицированных и неинфицированных антральных культур (+ W + R), удаляли бактерии центрифугированием и инкубировали с изогенным штаммом P12-GFP, экспрессирующим кассету устойчивости к канамицину в векторе GFP, высеянным в различных разведениях на канамицин. чашки, затем подсчитали колонии. Слизь из инфицированных культур убила все бактерии через 2 часа, в то время как слизь из неинфицированных культур вообще не повлияла на жизнеспособность бактерий (рисунок 7E).Это показывает, что слизь желудка играет центральную роль в борьбе с инфекцией H. pylori , действуя сначала как физический барьер, который затем становится токсичным для бактерий после инфицирования эпителия. Это может объяснить, почему в наших культурах мукозоидов, а также in vivo инфекция является очаговой, и отдельные бактерии, покидающие очаги, могут погибнуть при контакте со слизью.
Долгосрочное инфицирование культур слизистой оболочки желудка
H. pyloriДля моделирования длительной инфекции H.pylori , мы инфицировали культуры мукозоидов в течение 24 часов при MOI 100 и промывали поверхность фосфатно-солевым буфером (PBS) после первого дня, чтобы удалить свободно плавающие бактерии. Для мониторинга динамики бактерий мы использовали изогенный штамм P12, экспрессирующий GFP. Инфекции были прекращены через 4 недели, что намного превосходит любую другую модель инфекции, особенно при использовании внеклеточных бактерий. Накопившаяся слизь, содержащая бактерии, удалялась регулярно, но при переносе на агар образовывались только спорадические колонии (не показано), вероятно, из-за высокой токсичности слизи.Конфокальные изображения длительно инфицированных монослоев показывают, что бактерии сильно конденсируются в кластеры диаметром ~ 5 мкм (рис. 8A). Изображения с большим увеличением показывают, что отдельные бактерии за пределами скоплений имеют кокковидную форму, напоминающую действие дефенсинов 31 (рис. 8B и увеличенное изображение). Относительное количество бактериальных клеток по сравнению с человеческими клетками контролировали каждую неделю с помощью qPCR соответствующей геномной ДНК (фигура 8C). В день 0 бактерии были немедленно лизированы. В день 1 лизис проводили после промывания PBS, и каждую неделю после этого сначала удаляли слизь.Количество бактерий со временем уменьшалось и не определялось через 4 недели (рисунок 8C). Однако уровни мРНК TNF-α и IL-8 были лишь немного увеличены через 2 недели (фигура 8D), но стали заметно повышенными через 4 недели после инфицирования (фигура 8E). Экспрессия мРНК MUC5AC была резко снижена в оба момента времени (фигура 8D, E). Мы пришли к выводу, что наша система может моделировать эффект длительной инфекции и показывает стойкое воспаление.
Рисунок 8Культуры слизистых оболочек антрального канала были инфицированы изогенным H.pylori , штамм P12-GFP при MOI 100. Через 24 часа поверхность дважды промывали PBS и удаляли слизь каждые 3-4 дня. (A) Через 2 недели фильтры фиксировали и метили антителами против cagA и E-кадгерина с последующим введением цельного IF. (B) Изображение с большим увеличением и детали (*) увеличены в правом верхнем углу той же инфекции, что и в (A). (C) Относительное количество P12-GFP по отношению к клеткам-хозяевам рассчитывали с помощью кПЦР, сравнивая количество 16-секундной последовательности рибосомной ДНК с последовательностью человеческого GAPDH .(D, E) Экспрессию TNF-α , IL-8, и MUC5AC анализировали с помощью qRT-PCR после 2 и 4 недель инфекции и нормализовали до неинфицированного контроля. День-0 ДНК собирали непосредственно после нанесения бактерий; день-1 ДНК собирали после промывания PBS. Δ Ct — разница между Ct каждого гена по сравнению с GAPDH , горизонтальный знак — это среднее значение, представленное точками, каждая точка — одна повторность. GAPDH, глицеральдегид-3-фосфатдегидрогеназа; ИЛ, интерлейкин; NI, незараженный; PBS, забуференный фосфатом физиологический раствор; qPCR, количественная ПЦР; TNF-α, фактор некроза опухоли альфа.
Обсуждение
Используя новую систему культивирования слизистых оболочек эпителия желудка, мы предоставляем интересную информацию о различных аспектах взаимодействия патогена и ткани хозяина, что напоминает подлинное состояние in vivo. Благодаря поразительной степени поляризации и функциональной целостности эпителия в сочетании со значительно сниженной частотой прохождения мы достигли полной дифференциации по всем антральным фенотипам, о чем ранее не сообщалось в чистых культурах эпителия взрослых.Было обнаружено, что изменения интенсивности передачи сигналов Wnt контролируют дифференцировку базальных в фовеолярные типы клеток. Секреция апикальной слизи представляет собой защитный экран от бактерий, предотвращая чрезмерную гибель клеток-хозяев и, в свою очередь, создавая условия для гомеостатической инфекции H. pylori . Исследование эффектов стромальных клеток из собственной пластинки, окружающей желудочные железы, показало, что они вызывают дифференцировку за счет действия секретируемых ингибиторов Wnt. Таким образом, будущие исследования с этой моделью позволят детально изучить пути передачи сигналов между эпителием и стромой и то, как на них влияет бактериальная инфекция.
Глубокие эффекты, возникающие в результате изменений в передаче сигналов в микросреде, иллюстрируются удивительной легкостью, с которой культуры трансформируются из фенотипа основания железы MUC6 hi в фовеолярный фенотип MUC5AC hi при удалении Wnt3A и RSPO1. Заражение этими отдельными монослойными фенотипами указывает на то, что активация пути NF-κB существенно выше у основания железы, чем в ямках. Об этом фенотипе свидетельствует активация генов-мишеней p65 в культурах базального типа, включая медиаторы воспаления LTB , IL-8 , CXCL1-3 , CCL20 , IL-23A и TNF. -α , как ранее было обнаружено, сверхэкспрессируется H.pylori- инфицированных пациентов.32-34 Фовеолярная линия, с другой стороны, также была менее чувствительна к провоспалительному цитокину IL-1β, происходящему из макрофагов. В совокупности эти наблюдения подтверждают мнение о том, что поверхностные инфекции H. pylori на поверхности железы вызывают лишь незначительные иммунологические реакции, вероятно, объясняющие отсутствие явных симптомов у здоровых носителей H. pylori . Будущие исследования с культурами слизистой оболочки желудка помогут выяснить, в какой степени недавно описанный H.pylori , опосредованная системой секреции 4 типа (cag PAI), транслокация эффекторной молекулы гептоз-1,7-бисфосфата (HBP) 35 36 отвечает за индукцию NF-κB в этом весьма аутентичном сценарии поляризации и функции эпителия.
Другой интересный результат — очевидная связь между путями NF-κB и Wnt. Клетки фовеолярного типа возникают в отсутствие передачи сигналов Wnt или экспрессии генов-мишеней Wnt. Действительно, ранее было показано, что главный медиатор передачи сигналов Wnt, β-катенин, регулирует воспаление посредством перекрестного взаимодействия с сигнальным путем NF-κB, 37 подтверждая представление о том, что активная передача сигналов Wnt может придавать способность эпителиального компартмента отвечать на воспалительные сигналы.Мы ожидаем, что новая модель инфекции позволит по-новому взглянуть на координацию этих двух путей в желудочной железе во время инфекции. Примечательно, что этот подход может объяснить связь между воспалением и измененным гомеостазом компартмента стволовых клеток во время хронической инфекции H. pylori и то, как это может привести к злокачественной трансформации.
H. pylori может проникать глубоко в железы и взаимодействовать с компартментом стволовых клеток, где вызывает гиперплазию11 и воспаление.Иммунные клетки, такие как макрофаги, Т-лимфоциты и В-клетки, затем проникают в слизистую оболочку и нацелены на эпителий, 38 усугубляя воспаление. Более того, H. pylori может дестабилизировать геном хозяина, индуцируя двухцепочечные разрывы ДНК и сдвигая механизмы репарации в сторону негомологичного соединения концов, подверженного ошибкам. бактерии могут способствовать развитию неоплазии.Культуры слизистой оболочки желудка предлагают уникальный инструмент для исследования ранних канцерогенных явлений, поскольку они позволяют беспрецедентно продлить период инфицирования в сочетании со способностью подвергать эпителий минимальной цитокиновой среде в базальном компартменте, чтобы имитировать хроническую воспалительную среду.
Чтобы колонизировать эпителиальную поверхность, бактерии должны преодолеть гелеобразную слизистую оболочку желудка, продвигаемую их жгутиками. 41 Мы наблюдали, что лишь немногим бактериям удалось пройти через слизь, образовав редкие бактериальные колонии.Через два дня после инокуляции культур большинство бактерий все еще находится на поверхности слизи, что позволяет предположить, что различия в приспособленности бактерий и поддержание эффективного слизистого барьера играют роль в контроле судьбы патогенов. В отличие от мукозоидных культур, органоидные культуры обычно выращивают в матригеле, который стабилизируется антибиотиками, потенциально влияя на приспособленность бактерий. Было показано, что секреция слизи играет центральную роль в защите эпителия в других областях желудочно-кишечного тракта.42 43 Мы только начинаем осознавать важную роль, которую слизь играет в желудочно-кишечном тракте, например, как место иммунной защиты, а система культивирования слизистых оболочек позволяет исследовать слизь в культуре и производить обильное количество слизи, которую можно собрать. для дальнейшего анализа.
Таким образом, наша модель закладывает основу для изучения детерминант и эффектов хронической инфекции H. pylori in vitro, а также влияния муцинов и модификаций муцина на комменсальные и патогенные бактерии.Процедура, которая одинаково хорошо работает для определения слизистых оболочек тела желудка (данные не показаны), вероятно, будет перенесена на другие цилиндрические эпителии человека и других видов млекопитающих, а также может оказаться полезной в качестве инструмента скрининга лекарств, влияющего на персонализированная медицина будущего.
Материалы и методы
Материал ткани человека, выделение желудочной железы и сфероидная культура
Образцы ткани желудка были предоставлены Центром бариатрической и метаболической хирургии Университета Шарите и Центром ожирения и метаболической медицины Helios Klinikum, ( оба в Берлине, Германия) с предварительного одобрения этического комитета Медицинского университета Шарите, Берлин (EA1 / 129/12).Псевдонимизированные образцы (см. Дополнительную онлайн-таблицу 2) были получены от в общей сложности 12 пациентов, отрицательных по H. pylori , подвергшихся резекции желудочного рукава и обработанных, как описано ранее для органоидных культур.14 Вкратце, ткань промывали в PBS перед удалением жира и соединительной ткани. ткань. Затем его разрезали на части размером ~ 1 мм 2 и промывали холодным PBS до тех пор, пока супернатант не стал прозрачным (8–10 раз), с последующей 30-минутной инкубацией в хелатирующем растворе (5,6 мМ Na2HPO4 / 8.0 мМ Kh3PO4 / 96,2 мМ NaCl / 1,6 мМ KCl / 43,4 мМ сахарозы / 54,9 мМ D-сорбитол / 0,5 мМ DL-дитиотреитол / 2 мМ EDTA в H 2 O) при 37 ° C на платформе для встряхивания. Фрагменты ткани оставляли для осаждения, переносили в чашку Петри и выделяли железы, слегка надавливая на предметное стекло, перед ресуспендированием в среде, содержащей 10% инактивированной нагреванием фетальной телячьей сыворотки (Biochrom). После переноса в пробирку Фалькона более крупные фрагменты удаляли, оставляя их отстаиваться в течение 1 мин перед переносом супернатанта, содержащего большую часть изолированных желез, в новую пробирку.После промывания раствор центрифугировали в течение 5 минут при 250 г , ресуспендировали в усовершенствованной среде Игла, модифицированной Дульбекко / F12 (Invitrogen), и растирали с помощью полированной пламенной стеклянной пипеткой до тех пор, пока не остались только отдельные клетки и очень маленькие комки. Количество клеток оценивали с помощью гемоцитометра и ресуспендировали в соответствующем объеме культуральной среды для создания культур мукозоидов или инициирования культур органоидов.
Создание культур слизистой оболочки желудка
Около 200 000–250 000 клеток, полученных либо непосредственно из свежевыделенных желез, либо из органоидов, были засеяны в 200 мкл культуральной среды в покрытой коллагеном оболочке (Gibco A10644-01, 15 мкг / см 2 ) вставки трансвелл (Millipore PIHP01250), помещенные в 24-луночный планшет при 37 ° C, 5% CO 2 в увлажненном инкубаторе.Пространство между фильтром и лункой было заполнено 400 мкл культуральной среды (см. Дополнительную таблицу 2 онлайн). На 3-й день среду, покрывающую клетки, удаляли из вставки в лунку, чтобы начать культивирование ALI. Впоследствии 500 мкл среды под фильтром заменяли дважды в неделю.
Инфекция
H. pyloriH. pylori P12 (коллекция штаммов P511) и изогенные штаммы P12-GFP (коллекция штаммов P421) выращивали и собирали для заражения, как описано ранее.14 Число бактерий определяли путем измерения оптической плотности при 550 нм. Заражение проводили в 30 мкл PBS поверх фильтров в течение от 6 часов до 3 дней. Длительное инфицирование (2 и 4 недели) проводили при MOI 100 в течение 1 дня с последующей промывкой PBS и удалением избытка слизи при каждой смене среды.
Просветные клетки, чувствительные к аминокислотам в слизистой оболочке желудка — FullText — Digestion 2011, Vol. 83, Прил. 1
Аннотация
Химиотерапия питательных веществ в желудочно-кишечном тракте играет физиологически важную роль в регуляции поведения при приеме пищи, включая пищеварение, абсорбцию, метаболизм и другие последующие функции организма посредством активации мозга.Свободные аминокислоты, выделяемые из съеденной пищи, являются, конечно, незаменимыми питательными веществами, которые составляют белки организма и иногда определяют вкус пищи. Глутамат, одна из самых распространенных аминокислот в продуктах питания и высвобожденная свободная форма, существенно влияет на восприятие вкуса умами. Недавно было обнаружено, что диетический глутамат выполняет множество полезных функций в желудочно-кишечном тракте. Однако точный механизм восприятия глутамата все еще остается неясным. Используя первичные культуры клеток слизистой оболочки желудка крыс, мы продемонстрировали, что секретирующие соматостатин D-клетки являются клетками-кандидатами для восприятия глутамата в желудке за счет ингибирования высвобождения соматостатина.Учитывая, что соматостатин является одним из основных негативных регуляторов функций желудка, предполагается, что некоторые части полезных эффектов глутамата можно объяснить подавлением ингибирующих эффектов соматостатина, то есть стимуляцией, глутаматом.
© 2011 S. Karger AG, Базель
Введение
Желудочно-кишечный тракт (ЖКТ) является важным органом для переваривания диетических продуктов после абсорбции и метаболизма питательных веществ, высвобождаемых из переваренных продуктов, таких как аминокислоты, сахар, жирные кислоты и т. Д.Эти питательные вещества обнаруживаются «системой химического распознавания питательных веществ», включающей люминальные датчики на слизистой оболочке желудочно-кишечного тракта. Информация от этой системы передается из желудочно-кишечного тракта в мозг, и она играет важную роль в распознавании качества питательных веществ и в регулировании приема пищи.
Недавний прогресс в области вкусовых ощущений с использованием методов молекулярной биологии и выделения клеток показал, что определенные типы клеток слизистой оболочки ЖКТ, особенно эндокринные клетки, экспрессируют сенсоры, специфичные для вкуса и питательных веществ.Эти сенсоры способствуют регуляции секреции гормонов в ответ на вкусовые вещества и питательные вещества, как показано в таблице 1.
Таблица 1
Профили экспрессии гормонов и сенсоров питательных веществ в эндокринных клетках ЖКТ
С 1970-х годов сообщалось, что свободные аминокислоты, высвобождаемые из белка во время пищеварения, вызывают секрецию гормонов ЖКТ, таких как гастрин и холецистокинин (таблица 1). Глутамат является одной из наиболее распространенных аминокислот в пищевых продуктах и служит агонистом вкусовых рецепторов «умами», таких как гетеродимер вкусовых рецепторов 1/3 типа (T1R1 / T1R3) и подтипы метаботропных рецепторов глутамата (mGluR), расположенные на вкусе. почки языка [1].В области вкусов вкус «умами» теперь признан одним из пяти основных вкусов, наряду со сладостью, кислинкой, горечью и соленостью [1]. Наша группа изучает физиологическую роль диетического глутамата на поведение, связанное с потреблением пищи, от пищеварительного тракта до мозга [2,3,4,5,6,7]. Благодаря исследованиям, направленным на выяснение механизма восприятия умами (глутамата) и других аминокислот в желудочно-кишечном тракте, мы охарактеризовали распределение этих возможных сенсоров с использованием диспергированных клеток слизистой оболочки желудка крыс, фракционированных с помощью противоточного отмучивания и центрифугирования в градиенте плотности.В настоящем исследовании мы объединяем анализ распределения сенсоров с функциональным анализом и предлагаем новые роли этих сенсоров аминокислот в функциях желудка крыс.
Материалы и методы
Выделение клеток, обогащение и ОТ-ПЦР в реальном времени
Животных, используемых для этого исследования, содержали в соответствии с руководящими принципами Комитета по животным в Ajinomoto Co., Inc. Изолированные клетки получали из Sprague — Желудки крысы Dawley (Charles-River, Yokohama, Japan) с помощью методов градиента плотности и центробежного отмучивания, как описано ранее [8].Для анализа экспрессии аминокислотного сенсора мы количественно определили экспрессию T1R1, mGluR1-8, кальций-чувствительного рецептора (CaSR) и G-белок-связанных рецепторов семейства C группы 6 подтипа A (GPRC6A).
Высвобождение соматостатина из культивируемых эндокринных клеток меньшего размера
После характеристики каждого типа клеток более мелкие фракции эндокринных клеток, богатые D-клетками, культивировали в течение 2 дней в среде DMEM / F12 (1: 1) с добавлением инактивированного нагреванием 10% FBS ( Gibco / BRL, Гейтерсбург, Мэриленд, США), 10 нг / мл эпидермального фактора роста, 100 единиц / мл пенициллина, 100 единиц / мл стрептомицина и 0.25 мкг / мл амфотерицина B. Затем конфлюэнтные клетки инкубировали в течение 90 мин с указанной аминокислотой (10 мкг M ) в стандартном (STD) буфере, содержащем (мкл M ) 147 Na + , 5,0 K + , 131 Cl — , 1,3 мг 2+ , 1,3 SO 4 2–, 2 Ca 2+ , 25 HCO 3 — , 15 Hepes и 20 D -глюкоза при pH 7,4. Высвобождение соматостатина из клеток в культуральную среду измеряли с помощью имеющихся в продаже наборов ELISA (Phoenix Pharmaceuticals, Inc., Бурлингейм, Калифорния, США).
Результаты
Экспрессия сенсоров глутамата и аминокислот во фракциях клеток слизистой оболочки желудка
В результате анализа экспрессии каждого клеточного маркера методами ОТ-ПЦР в реальном времени мы обозначили пять обогащенных фракций как поверхностные слизистые клетки (Muc5ac), меньшие эндокринные клетки (соматостатин и грелин), более крупные эндокринные клетки (грелин и гистидиндекарбоксилаза, HDC, то есть гистамин), париетальные клетки (H + , K + -субъединица β-АТФазы) и главные клетки (пепсиноген C), соответственно (таблица 2).Экспрессия эндокринных маркеров указывает на то, что D-клетки, секретирующие соматостатин, в основном обогащены меньшей фракцией эндокринных клеток.
Таблица 2
Профили экспрессии сенсоров глутамата и аминокислот во фракциях клеток, выделенных из слизистой оболочки желудка крысы
Используя эти специфические обогащенные клетками фракции, мы исследовали, какие клетки экспрессируют сенсоры глутамата и аминокислот, как показано в таблице 2. Поскольку Уровень экспрессии нескольких сенсоров, таких как T1R1, mGluR1, 2, 3, 4, 7 и GPRC6A, был довольно низким, мы количественно оценили эти сенсоры с помощью вложенной ПЦР.Экспрессия T1R1 была умеренно выше во фракции париетальных клеток по сравнению со всей слизистой оболочкой желудка. Среди метаботропных рецепторов глутамата группы 1 (которые соединяются с белком G q для активации фосфолипазы C) экспрессия mGluR1 наблюдалась в париетальных и более крупных эндокринных клетках, тогда как экспрессия mGluR5 наблюдалась как в более мелких, так и в более крупных эндокринных клетках. Напротив, профили экспрессии резко изменились в метаботропных рецепторах глутамата 2 и 3 групп (оба из которых соединяются с белком G i для ингибирования аденилатциклазы).И mGluR2, и mGluR3 экспрессировались специфически в меньших эндокринных клетках и париетальных клетках. Напротив, экспрессия mGluR4 и mGluR7 была специфичной для меньших эндокринных клеток, тогда как экспрессия mGluR6 была умеренно высокой в главных клетках и более крупных эндокринных клетках.
Что касается других аминокислотных сенсоров, CaSR экспрессировался специфически в меньших эндокринных клетках, тогда как экспрессия GPRC6A была высокой в париетальных клетках и меньших эндокринных клетках и умеренно выше в главных клетках и более крупных эндокринных клетках.
Влияние аминокислот на высвобождение соматостатина из фракции меньших эндокринных клеток желудка
По результатам ОТ-ПЦР в реальном времени фракция меньших эндокринных клеток с высоким уровнем экспрессии CaSR, GPRC6A и Gi-связывающих mGluR, таких как mGluR2, 3, 4, 7 Таким образом, мы затем оценили эффект этих благоприятных для рецепторов аминокислот на высвобождение соматостатина из культивируемых эндокринных клеток меньшего размера. Благоприятные для CaSR аминокислоты, такие как фенилаланин, триптофан и гистидин, значительно увеличивали высвобождение соматостатина более чем в два раза по сравнению с контролем.Аналогичным образом, цистеин, благоприятный как для CaSR, так и для GPRC6A, значительно стимулировал высвобождение соматостатина более чем в два раза. Напротив, GPRC6A-благоприятный лизин не имел эффекта по сравнению с контролем. Интересно, что глутамат и аспартат, благоприятные для mGluR, значительно снижали высвобождение соматостатина на 20%.
Обсуждение
Ранее мы сообщали, что нанесение глутамата в просвет желудка крысы вызывало повышение активности афферентных волокон желудочной ветви блуждающего нерва [6].Интересно, что другие аминокислоты не проявляли таких эффектов, хотя каждая из аминокислот реагировала на попадание в просвет кишечника [9,10]. Таким образом, из 20 диетических аминокислот, входящих в состав белков организма, только глутамат может передавать информацию о питательных веществах из желудка в мозг. Однако точный механизм восприятия глутамата в просвете остается неясным.
В настоящем исследовании мы охарактеризовали распределение сенсоров глутамата и других аминокислот на слизистой оболочке желудка в попытке выяснить механизм восприятия глутамина в просвете просвета.Тем не менее, мы столкнулись с двумя серьезными экспериментальными проблемами: (1) мы не смогли найти достаточно специфических антител для иммуноокрашивания и (2) экспрессия рецепторов, связанных с G-белком (GPCR), была очень низкой, когда образцы были собраны как целая ткань. Основываясь на этих выводах, мы пришли к выводу, что анализ всей ткани может вводить в заблуждение. Чтобы преодолеть эти проблемы, мы использовали модифицированный метод выделения клеток, который позволил нам культивировать клетки в течение нескольких дней и напрямую оценивать функции клеток.
Как сообщалось ранее, мы могли успешно фракционировать слизистую оболочку желудка крысы на различные типы клеток, включая поверхностные слизистые клетки, париетальные клетки, главные клетки, а также более мелкие и более крупные эндокринные клетки. Кроме того, мы могли культивировать некоторые фракции. Большинство этих клеток (за исключением полностью закрытых эндокринных клеток) могут контактировать с пищевым глутаматом и аминокислотами через просвет желудочных желез, поэтому обладают потенциалом для регулирования функций пищеварения желудка.
Используя эти фракции, мы количественно оценили экспрессию аминокислотных сенсоров в семействе C GPCR, таких как mGluR, T1R1, CaSR и GPCR6A.Веллендорф и Браунер-Осборн [11] недавно сообщили, что этот класс GPCR важен для определения питательных веществ, особенно аминокислот. Их профили аминокислотной селективности для CaSR, GPRC6A и гетеродимера T1R1 / T1R3 показали, что ароматические аминокислоты, такие как фенилаланин, триптофан и гистидин, были CaSR-специфичными. Цистеин благоприятен как для CaSR, так и для GPRC6A. Напротив, лизин кажется благоприятным для GPRC6A. Интересно, что наши результаты показали, что соматостатин-секретирующие D-клетки более мелкие фракции эндокринных клеток экспрессировали высоко и относительно специфично CaSR, GPRC6A и Gi-связывающие mGluRs, такие как mGluR 2, 3, 4, 7.Экспрессия CaSR в париетальных клетках была очень низкой по сравнению с более мелкой фракцией эндокринных клеток, богатой D-клетками. Таким образом, мы функционально оценили эффект GPCR-предпочтительных аминокислот семейства C на высвобождение соматостатина с использованием культуры этой фракции.
Поскольку соматостатин является паракринным гормоном слизистой оболочки желудка [12,13,14,15], менее целесообразно измерять системную концентрацию соматостатина в крови. Напротив, первичная культура D-клеток представляет собой ценную систему для локального количественного определения гормона.Используя нашу систему культивирования клеток, CaSR-специфические аминокислоты, включая фенилаланин, триптофан и гистидин, значительно стимулировали высвобождение соматостатина более чем в два раза. Аналогичным образом, цистеин, благоприятный как для CaSR, так и для GPRC6A, значительно стимулировал высвобождение соматостатина более чем в два раза. Однако лизин, благоприятный для GPRC6A, не имел никакого эффекта. Эти результаты показывают, что CaSR, но не GPRC6A, играет функционально важную роль в стимуляции высвобождения соматостатина в D-клетках.
Интересно, что глутамат и аспартат, несмотря на проявление слабой агонистической активности против CaSR, значительно снижали высвобождение соматостатина.Фракция также высоко экспрессирует G i -связанные с белком mGluR, активация которых ингибирует аденилатциклазу [12,13,14]. Мы предполагаем, что mGluR могут быть более эффективными рецепторами, чем CaSR, для подавления высвобождения соматостатина. Это обеспечит механизм ранее описанных эффектов глутамата в желудке. Действительно, диетический глутамат, как сообщается, стимулирует желудочную секрецию и моторику у собак и людей [16,17,18]. Поскольку соматостатин является ингибирующим регулятором экзокринной и эндокринной секреции желудка [12,13,14,15], разумно предположить, что ингибирование высвобождения соматостатина через стимуляцию G и -связанных белков mGluR (i.е. ингибирование ингибирующего эффекта) приводит к стимуляции желудочной секреции. Хотя D-клетки представляют собой эндокринные клетки закрытого типа в теле желудка [12,13,14,15], мы наблюдали с помощью иммуногистохимического анализа, что часть D-клеток в теле, по-видимому, была открытого типа [ неопубликованные данные]. Кроме того, D-клетки экспрессируют нейрон-специфические маркеры и функционируют подобно паранейрональным клеткам [19,20]. Таким образом, D-клетки могут непосредственно участвовать в модуляции передачи сигналов глутамата в просвет блуждающих нервов в слизистой оболочке желудка.
В заключение, используя D-клетки, выделенные из слизистой оболочки желудка крысы, мы продемонстрировали роль GPCR, mGluR и CaSR семейства C в восприятии глутамата и аминокислот и в регуляции высвобождения соматостатина. Необходимы дальнейшие исследования, чтобы прояснить функциональную взаимосвязь между глутаматом, mGluR, связанными с G i , и высвобождением соматостатина в желудке.
Благодарности
Авторы выражают благодарность доктору Гэри К. Бошампу (Центр химических чувств Монелла, Филадельфия, Пенсильвания)., США) за ценные комментарии к рукописи; Доктор Такуя Мацумото и г-н Кен-ичиро Накамура за их техническую помощь.
Заявление о раскрытии информации
Конфликт интересов отсутствует.
Список литературы
- Чаудхари Н., Ропер С.Д.: Клеточная биология вкуса.J Cell Biol 2010; 190: 285–296.
- Кондо Т., Тории К. Активация мозга веществами умами через вкусовые и висцеральные сигнальные пути и физиологическое значение. Биол Фарм Булл 2008; 31: 1827–1832.
- Накамура Э, Тории К., Унеяма Х: физиологические роли диетического свободного глутамата в желудочно-кишечных функциях.Биол Фарм Булл 2008; 31: 1841–1843.
- Цуругизава Т., Уэмацу А., Накамура Э., Хасумура М., Хирота М., Кондо Т., Унеяма Х., Тории К.: Механизмы нейронного ответа на пищевые стимулы желудочно-кишечного тракта: ось кишечник-мозг. Гастроэнтерология 2009; 137: 262–273.
- Uematsu A, Tsurugizawa T., Kondoh T., Torii K: обусловленное обучение предпочтению вкусовых качеств крысам путем внутрижелудочного введения л -глутамата.Neurosci Lett 2009; 451: 190–193.
- Унеяма Х., Нидзима А, Сан-Габриэль А, Тории К.: определение аминокислот в просвете слизистой оболочки желудка крысы. Am J Physiol 2006; 291: G1163 – G1170.
- Uneyama H, San Gabriel A, Kawai M, Tomoe M, Torii K: физиологическая роль диетического свободного глутамата в пищеварении.Asia Pac J Clin Nutr 2008; 17 (приложение 1): 372–375.
- Накамура Э., Хасумура М., Сан-Габриэль А., Унеяма Х., Тории К.: Новые рубежи в исследованиях сенсоров питательных веществ в кишечнике: люминальные глутамат-чувствительные клетки в слизистой оболочке желудка крысы. J Pharmacol Sci 2010; 112: 13–18.
- Нидзима А: Влияние оральной и кишечной стимуляции субстанцией умами на активность блуждающего нерва желудка.Physiol Behav 1991; 49: 1025–1028.
- Niijima A, Torii K, Uneyama H: Роль химических датчиков блуждающего нерва в портальной области печени и двенадцатиперстной кишки: электрофизиологическое исследование. Chem Senses 2005; 30 (приложение 1): i178 – i179.
- Wellendorph P, Brauner-Osborne H: Молекулярная основа восприятия аминокислот семейством C рецепторов, связанных с G-белком.Br J Pharmacol 2009; 156: 869–884.
- Шуберт М.Л .: Желудочная секреция. Curr Opin Gastroenterol 2003; 19: 519–525.
- Шуберт М.Л .: Желудочная секреция.Курр Опин Гастроэнтерол 2005; 21: 636–643.
- Шамбурек Р. Д., Шуберт М. Л.: Контроль секреции желудочного сока. Антагонисты гистаминовых рецепторов H 2 и ингибиторы H + , K + -АТФазы. Gastroenterol Clin North Am 1992; 21: 527–550.
- Ван Оп ден Бош Дж., Адриаенсен Д., Ван Нассау Л., Тиммерманс Дж. П.: Роль (и) соматостатина, структурно родственных пептидов и рецепторов соматостатина в желудочно-кишечном тракте: обзор.Regul Pept 2009; 156: 1–8.
- Кочетков А.М., Шлыгин Г.К., Лоранская Т.И., Василевская Л.С., Кондрашев С. Применение глутамата натрия в комплексной терапии больных атрофическим гастритом. Вопр Питан 1992; 5/6: 19–22.
- Toyomasu Y, Mochiki E, Yanai M, Ogata K, Tabe Y, Ando H, Ohno T, Aihara R, Zai H, Kuwano H: Внутрижелудочный мононатрий L -глутамат стимулирует перистальтику верхних отделов кишечника через блуждающий нерв у находящихся в сознании собак.Am J Physiol Regul Integr Comp Physiol 2010; 298: R1125 – R1135.
- Василевская Л.С., Рымшина М.В., Шлыгин Г.К .: Влияние глутамата и комбинации с инозинмонофосфатом на желудочную секрецию. Вопр Питан 1993; 3: 29–33.
- Аримура А, Фишбэк ДжБ: Соматостатин: регуляция секреции.Нейроэндокринология 1981; 33: 246–256.
- Чжао С.М., Мартинес В., Пикерас Л., Ван Л., Таш И., Чен Д.: Контроль секреции желудочной кислоты у мышей с дефицитом рецептора соматостатина-2: переход от эндокринных / паракринных к нейрокринным путям. Эндокринология 2008; 149: 498–505.
- Hakanson R, Bottcher G, Ekblad E, Panula P, Simonsson M, Dohlsten M, Hallberg T, Sundler F: гистамин в эндокринных клетках желудка.Обследование нескольких видов с использованием панели антител к гистамину. Гистохимия 1986; 86: 5–17.
- Ринди Г., Некки В., Савио А., Торселло А., Золи М., Локателли В., Раймондо Ф, Кокки Д., Сольча Е.: Характеристика клеток желудочного грелина у человека и других млекопитающих: исследования на тканях взрослых и плода.Histochem Cell Biol 2002; 117: 511–519.
- Саката I, Накамура К., Ямадзаки М., Мацубара М., Хаяши Ю., Кангава К., Сакаи Т.: Клетки, продуцирующие грелин, существуют в желудочно-кишечном тракте крыс как клетки двух типов: клетки закрытого и открытого типа. Пептиды 2002; 23: 531-536.
- Stengel A, Tache Y: Несфатин-1 — роль возможного нового мощного регулятора приема пищи.Regul Pept 2010; 163: 18–23.
- Stengel A, Goebel M, Yakubov I, Wang L, Witcher D, Coskun T, Tache Y, Sachs G, Lambrecht NW: Идентификация и характеристика иммунореактивности несфатина-1 в типах эндокринных клеток оксинтной слизистой оболочки желудка крыс. Эндокринология 2009; 150: 232–238.
- Buchan AM, Sikora LK, Levy JG, McIntosh CH, Dyck I, Brown JC: иммуноцитохимическое исследование с моноклональными антителами к соматостатину. Гистохимия 1985; 83: 175–180.
- Шуберт М.Л., Эдвардс Н.Ф., Махлуф Г.М.: Регулирование секреции желудочного соматостатина у мышей по кислотности просвета: механизм локальной обратной связи.Гастроэнтерология 1988; 94: 317–322.
- Schusdziarra V, Harris V, Conlon JM, Arimura A, Unger R: Высвобождение соматостатина поджелудочной железы и желудка в ответ на внутрижелудочные и интрадуоденальные питательные вещества и HCl у собак. Дж. Клин Инвест 1978; 62: 509–518.
- Walsh JH, Richardson CT, Fordtran JS: pH-зависимость секреции кислоты и высвобождения гастрина у здоровых и язвенных субъектов.Дж. Клин Инвест, 1975; 55: 462–468.
- Гейбель Дж. П., Вагнер К. А., Кароппо Р., Куреши И., Глёкнер Дж., Мануэлидис Л., Кирхгоф П., Радебольд К. Шрам, связанный с рецептором двухвалентных ионов желудка, является модулятором секреции желудочной кислоты. J Biol Chem 2001; 276: 39549–39552.
- Buchan AM, Squires PE, Ring M, Meloche RM: Механизм действия рецептора, чувствительного к кальцию, в антральных гастриновых клетках человека.Гастроэнтерология 2001; 120: 1128–1139.
- Ray JM, Squires PE, Curtis SB, Meloche MR, Buchan AM: Экспрессия кальций-чувствительного рецептора на антральных гастриновых клетках человека в культуре. Дж. Клин Инвест 1997; 99: 2328–2333.
- Кидд М., Модлин И.М., Густафссон Б.И., Дроздов И., Хаусо О., Пфрагнер Р.: Люминальная регуляция высвобождения серотонина нормальными и неопластическими клетками ЕС человека опосредуется солями желчных кислот, аминами, вкусовыми веществами и ольфактантами.Am J Physiol Gastrointest Liver Physiol 2008; 295: G260 – G272.
- Kim M, Cooke HJ, Javed NH, Carey HV, Christofi F, Raybould HE: D -Глюкоза высвобождает 5-гидрокситриптамин из человеческих клеток bon в качестве модели энтерохромаффинных клеток. Гастроэнтерология 2001; 121: 1400–1406.
- Браун Т., Воланд П., Кунц Л., Принц С., Грацл М.: Энтерохромаффинные клетки кишечника человека: сенсоры для специй и отдушек. Гастроэнтерология 2007; 132: 1890–1901.
- Дойхара Х, Нозава К., Кавабата-Шода Э, Кодзима Р., Йокояма Т., Ито Н: агонисты TRPA1 задерживают опорожнение желудка у крыс через серотонинергические пути.Наунин Шмидебергс Arch Pharmacol 2009; 380: 353–357.
- Дойхара Х, Нозава К., Кодзима Р., Кавабата-Сёда Э, Йокояма Т., Ито Н: клетки QGP-1 высвобождают 5-HT посредством активации TRPA1; модель энтерохромаффинных клеток человека. Mol Cell Biochem 2009; 331: 239–245.
- Nozawa K, Kawabata-Shoda E, Doihara H, Kojima R, Okada H, Mochizuki S, Sano Y, Inamura K, Matsushime H, Koizumi T, Yokoyama T, Ito H: TRPA1 регулирует моторику желудочно-кишечного тракта посредством высвобождения серотонина из энтерохромаффинных клеток.Proc Natl Acad Sci USA 2009; 106: 3408–3413.
- Chey WY, Escoffery R: клетки секреции в желудочно-кишечном тракте. Эндокринология 1976; 98: 1390–1395.
- Usellini L, Finzi G, Riva C, Capella C, Mochizuki T, Yanaihara C, Yanaihara N, Solcia E: Ультраструктурная идентификация секретиновых клеток человека методом иммунного золота.Совместное хранение хромогранина А и серотонина. Гистохимия 1990; 94: 113–120.
- Бейлисс WM, Старлинг EH: Механизм секреции поджелудочной железы. J. Physiol 1902; 28: 325–353.
- Buchan AM, Polak JM, Solcia E, Capella C, Hudson D, Pearse AG: Электронные иммуногистохимические доказательства того, что кишечная клетка I человека является источником CCK.Gut 1978; 19: 403–407.
- Liou AP, Lu X, Sei Y, Zhao X, Pechhold S, Carrero RJ, Raybould HE, Wank S: рецептор Gpr40, связанный с G-белком, непосредственно опосредует секрецию холецистокинина, индуцированную длинноцепочечными жирными кислотами. Гастроэнтерология 2010 (в печати).
- Танака Т., Кацума С., Адачи Т., Кошимидзу Т.А., Хирасава А., Цудзимото Г.: свободные жирные кислоты индуцируют секрецию холецистокинина через GPR120.Наунин Шмидебергс Arch Pharmacol 2008; 377: 523–527.
- Choi S, Lee M, Shiu AL, Yo SJ, Hallden G, Aponte GW: активация GPR93 гидролизатом белка индуцирует транскрипцию и секрецию CCK в клетках STC-1. Am J Physiol Gastrointest Liver Physiol 2007; 292: G1366 – G1375.
- Hira T, Nakajima S, Eto Y, Hara H: рецептор, чувствительный к кальцию, опосредует индуцированную фенилаланином секрецию холецистокинина в энтероэндокринных клетках STC-1.FEBS J 2008; 275: 4620–4626.
- Jeon TI, Zhu B, Larson JL, Osborne TF: SREBP-2 регулирует секрецию кишечных пептидов через передачу сигналов рецептора горького вкуса в кишечнике у мышей. Дж. Клин Инвест 2008; 118: 3693–3700.
- Hao S, Sternini C, Raybould HE: Роль рецепторов CCK1 и Y2 в активации нейронов заднего мозга, индуцированной внутрижелудочным введением лигандов рецептора горького вкуса.Am J Physiol Regul Integr Comp Physiol 2008; 294: R33 – R38.
- Usellini L, Buchan AM, Polak JM, Capella C, Cornaggia M, Solcia E: Ультраструктурная локализация мотилина в эндокринных клетках кишечника человека и собаки методом иммунного золота. Гистохимия 1984; 81: 363–368.
- Christofides ND, Bloom SR, Besterman HS, Adrian TE, Ghatei MA: высвобождение мотилина пероральными и внутривенными питательными веществами у человека. Gut 1979; 20: 102–106.
- Мицнегг П., Блум С.Р., Кристофидес Н., Бестерман Н., Домшке В., Домшке С., Вунш Е., Демлинг Л.: высвобождение мотилина в человеке.Scand J Gastroenterol Suppl 1976; 39: 53–56.
- Buffa R, Polak JM, Pearse AG, Solcia E, Grimelius L, Capella C: Идентификация кишечных клеток, хранящих желудочный ингибирующий пептид. Гистохимия 1975; 43: 249–255.
- Edfalk S, Steneberg P, Edlund H: Gpr40 экспрессируется в энтероэндокринных клетках и опосредует стимуляцию секреции инкретина свободными жирными кислотами.Диабет 2008; 57: 2280–2287.
- Parker HE, Habib AM, Rogers GJ, Gribble FM, Reimann F: нутриент-зависимая секреция глюкозозависимого инсулинотропного полипептида из первичных мышиных К-клеток. Диабетология 2009; 52: 289–298.
- Thomas FB, Mazzaferri EL, Crockett SE, Mekhjian HS, Gruemer HD, Cataland S: Стимуляция секреции желудочного ингибирующего полипептида и инсулина интрадуоденальной перфузией аминокислот.Гастроэнтерология 1976; 70: 523–527.
- Helmstaedter V, Taugner C, Feurle GE, Forssmann WG: Локализация нейротензин-иммунореактивных клеток в тонком кишечнике человека и различных млекопитающих. Гистохимия 1977; 53: 35–41.
- Barber DL, Cacace AM, Raucci DT, Ganz MB: Жирные кислоты стереоспецифически стимулируют высвобождение нейротензина и увеличивают [Ca 2+ ] i в эндокринных клетках кишечника.Am J Physiol 1991; 261: G497 – G503.
- Eissele R, Goke R, Willemer S, Harthus HP, Vermeer H, Arnold R, Goke B: глюкагоноподобные клетки пептида-1 в желудочно-кишечном тракте и поджелудочной железе крысы, свиньи и человека. Eur J Clin Invest 1992; 22: 283–291.
- Reimann F, Habib AM, Tolhurst G, Parker HE, Rogers GJ, Gribble FM: определение уровня глюкозы в l-клетках: исследование первичных клеток.Cell Metab 2008; 8: 532–539.
- Mulder H, Ekelund M, Ekblad E, Sundler F: Островковый амилоидный полипептид в кишечнике и поджелудочной железе: локализация, онтогенез и эффекты перистальтики кишечника. Пептиды 1997; 18: 771–783.
- Mulder H, Lindh AC, Ekblad E, Westermark P, Sundler F: островковый амилоидный полипептид экспрессируется в эндокринных клетках слизистой оболочки желудка у крысы и мыши.Гастроэнтерология 1994; 107: 712–719.
Автор Контакты
Кунио Тории, DVM, PhD
Группа фундаментальных исследований по физиологии питания
Лаборатории пограничных исследований, Институт инноваций, Ajinomoto Co., Inc.
1-1 Suzuki-cho, Kawasaki-ku, Kawasaki 210-8681 (Япония)
Тел.+81 44 244 7183, факс +81 44 210 5893, электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 10 марта 2011 г.
Дата выпуска: март 2011 г.
Количество страниц для печати: 6
Количество рисунков: 0
Количество столов: 2
ISSN: 0012-2823 (печать)
eISSN: 1421-9867 (онлайн)
Для дополнительной информации: https: // www.karger.com/DIG
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарственного средства: авторы и издатель приложили все усилия для обеспечения того, чтобы выбор и дозировка лекарств, указанные в этом тексте, соответствовали текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Производство слизи — Регулирование — TeachMePhysiology
В этой статье мы обсудим производство желудочной слизи в желудке.
Мы рассмотрим клетки, из которых состоит слизистая оболочка желудка, процесс производства слизи и механизмы контроля, участвующие в ее секреции.
Слизь желудка
Слизь желудка представляет собой гелеобразно-слизистый барьер, секретируемый эпителиальными клетками и железистыми клетками в стенке желудка. Он действует как часть барьера, который защищает стенку желудка от кислоты и пищеварительных ферментов в просвете желудка. Этот барьер также состоит из секреции бикарбоната и самих эпителиальных клеток, которые плотно соединены друг с другом.Вместе эти компоненты препятствуют эффективному перевариванию желудка.
Слизь секретируется эпителиальными клетками желудка, но слизь в основном секретируется фовеолярными клетками, обнаруженными в шейках ямок желудка. Клетки, секретирующие слизь, являются наиболее распространенным типом клеток в желудке, что указывает на то, насколько слизь важна для функционирования желудка.
Рис. 1. Диаграмма, показывающая слизь желудка. [/ caption]Клеточная анатомия
Клетки, составляющие эпителиальный слой, неравномерно распределяются по стенке желудка.По всему желудку расположены глубокие желудочные железы; ямки составлены инвагинациями эпителиальных клеток желудка.
В крайних зонах желудка — пилорической области и кардии — эти желудочные железы выделяют только слизь. Однако в других регионах наблюдается большее клеточное разнообразие компонентов желудочных желез:
- Париетальные клетки секретируют соляную кислоту и Внутренний фактор
- Главные клетки секретируют пепсиногенов
- Клетки ECL секретируют гистамин
На рис. 2 показаны различные типы клеток в ямках желудка.Обратите внимание, что клетки слизи находятся на шейке ямки желудка
Производство слизи
Производство слизи осуществляется эпителиальными клетками поверхности желудка и фовеолярными клетками. Сама слизь на 95 процентов состоит из воды, а оставшиеся пять процентов состоят из полимеров, которые придают слизи гелеобразную вязкость. Вязкость слизи динамична и может изменяться в зависимости от скорости секреции железистых клеток или скорости разложения протеолитическими ферментами в просвете желудка.
бикарбонатный элемент слизи важен, так как он обеспечивает повышенное на pH локально для эпителиальных клеток, защищая их от очень кислой среды желудка. Эти ионы бикарбоната образуются в секретирующих слизь клетках в результате реакции углекислого газа с водой с использованием фермента карбоангидразы . Затем ионы бикарбоната закачиваются в слой слизи, обменивая их с ионами хлора.
Контроль секретности
Подобно контролю слюнной секреции, желудочная секреция (включая секрецию слизи) в значительной степени контролируется нервными влияниями.Об увеличении выработки слизи сигнализирует стимуляция блуждающего нерва (черепной нерв 10) и опосредуется простагландинами. Клетки реагируют на внешние факторы, такие как механический стресс и элементы фаз головного и желудочного переваривания, увеличивая производство слизи по мере необходимости. У здоровых пациентов всегда имеется толстый слой слизи, защищающий желудок от самопереваривания.
[старт-клиника]
Клиническая значимость — Язвенная болезнь
Если по какой-либо причине слой слизи нарушен, эпителиальные клетки подвергаются воздействию концентрированной желудочной кислоты и пищеварительных ферментов, содержащихся в желудочном соке.Поскольку стенка желудка состоит из тех же белков и липидов, что и многие продукты, которые мы едим, если этот барьер слизистой оболочки нарушен, желудок начнет переваривать себя, образуя язвенную болезнь.
Существуют определенные преждевременные осложнения этого состояния, в том числе колонизация желудка Helicobacter pylori , воздействие нестероидных противовоспалительных препаратов (НПВП), таких как ибупрофен, и избыточная секреция кислоты, наблюдаемая при синдроме Золлингера-Эллисона.
Рис. 3. Диаграмма, показывающая, как происходит повреждение во время H.Инфекция Pylori. [/ Caption]Влияние НПВП на секрецию желудочной слизи известно около 40 лет. Такие лекарства, как ибупрофен и аспирин, произвели революцию в области немедленного лечения боли и воспаления, но могут оказывать неблагоприятное воздействие на слизистую оболочку желудочно-кишечного тракта. НПВП действуют, блокируя синтез простагландинов, , которые играют важную роль как в болевых ощущениях, так и в поддержании состояния слизистой оболочки.
Когда простагландины блокируются, выделяется меньше слизи желудка, клеточные соединения становятся менее плотными, а кровоток через слизистую оболочку поддерживается в меньшей степени.Это делает слой слизи менее эффективным в защите эпителия желудка, а также в борьбе с любым последующим повреждением эпителия. Вот почему пациенты, постоянно принимающие НПВП, подвергаются гораздо более высокому риску развития язвенной болезни.
[окончание клинической]
Желудок — Knowledge @ AMBOSS
Последнее обновление: 31 августа 2021 г.
Сводка
Желудок — это полый внутрибрюшинный орган в левом верхнем квадранте живота, между пищеводом и двенадцатиперстной кишкой в желудочно-кишечном тракте.Снабжена артериальной кровью из чревного ствола и его ветвей. Вены желудка впадают в воротную вену, а лимфатические сосуды в конечном итоге стекают в чревные лимфатические узлы. Он иннервируется симпатической и парасимпатической нервной системой, а также мышечно-кишечным сплетением и подслизистым сплетением кишечной нервной системы. Желудок имеет четыре гистологических слоя: слизистую оболочку, подслизистую оболочку, собственную мышечную оболочку и серозную оболочку. Слизистая оболочка выстлана многочисленными железами, содержащими специализированные клетки, производящие различные выделения: e.g., париетальные клетки, которые секретируют желудочную кислоту и внутренний фактор, и главные клетки желудка, которые секретируют пепсиноген. Ацетилхолин (АХ), гастрин и гистамин являются основными стимуляторами желудочной секреции. Соматостатин, холецистокинин (CCK), секретин и желудочный ингибирующий пептид (GIP) являются основными ингибиторами.
Макроанатомия
Обзор
[1]- Характеристики
- Расположение
- LUQ живота
- Области живота: эпигастральная, левое подреберье и пупочная область
- Перед желудком
- Кзади от желудка
- Функция
Анатомические части
- Срезы желудка
- Кардиа: часть желудка, которая расположена непосредственно дистальнее гастроэзофагеального сфинктера
- Дно желудка: куполообразная область желудка чуть латеральнее кардии
- Тело (желудок): основная часть желудка. желудок, который находится между дном и привратником
- Привратник: конечное коническое сужение желудка, которое можно подразделить на проксимальный антральный отдел и дистальный пилорический канал
- Искривления желудка
- Сфинктеры желудка
Антральный отдел и нижняя часть малой кривизны являются наиболее частыми участками язвенной болезни желудка.
Желудок — внутрибрюшинный орган.
Сосудистая сеть, лимфатическая система и иннервация желудка
[1]Артерии
Вены
Варикозное расширение вен пищевода развивается при портальной гипертензии из-за портосистемного шунтирования крови из левой желудочной вены (портальная система) в вены пищевода (полая система).
Лимфатическая система
Иннервация
Левый блуждающий нерв находится кпереди от желудка, а правый — кзади от него.Это можно запомнить с помощью мнемонического LARP: левый передний, правый задний.
Микроскопическая анатомия
Функция
Типы пищеварения
- Механическое пищеварение: перистальтика желудка относительно закрытого пилорического сфинктера → расщепление пищи на более мелкие частицы
- Химическое пищеварение: ферментативное расщепление пищи на химус (полужидкая смесь переваренной пищи и пищеварительных ферментов) желудочной кислотой и ферментами.
См. «Секреторные и регуляторные продукты желудочно-кишечного тракта.”
Желудочная кислота содержит большое количество соляной кислоты (HCl). Следовательно, повторная рвота может вызвать метаболический алкалоз из-за потери кислоты (H + ).
Фазы
Нарушение секреции желудка
Эмбриология
Клиническое значение
Источники
- Ольшевский П.К., Ли Д., Грейс М.К., Биллингтон С.Дж., Коц К.М., Левин А.С. Нейронная основа орексигенных эффектов грелина, действующего в латеральном гипоталамусе.. Пептиды . 2003; 24 (4): с.597-602.
- Стандринг С. Анатомия Грея: анатомические основы клинической практики . Elsevier Health Sciences ; 2016 г.
- Вакиль Б.Н. Физиология секреции желудочного сока. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/physiology-of-gastric-acid-secretion . Последнее обновление: 24 сентября 2018 г. Дата обращения: 30 января 2019 г.
|
Лунный свет стволовых клеток для защиты желудка от бактериальных захватчиков
Субпопуляция стволовых клеток выделяет антимикробные пептиды для защиты слизистой оболочки желудка от патогенных бактерий
Поверхности наших слизистых оболочек постоянно подвергаются воздействию многочисленных видов бактерий, некоторые из которых могут вызывать повреждение ДНК в клетках-хозяевах.Обычно это остается несущественным, так как быстрое обновление слизистой оболочки означает, что поврежденные клетки удаляются в течение нескольких дней. Однако, если долгоживущие стволовые клетки, из которых постоянно появляются новые замещающие клетки, получают повреждение, это может привести к развитию рака. Исследователи из Института биологии инфекций Макса Планка и Charité — Universitätsmedizin в Берлине обнаружили, что пул стволовых клеток желудка не просто делится для образования новых дочерних клеток, но и что они могут выделять антимикробные молекулы для активной защиты ниши стволовых клеток. против бактерий.
Поперечный разрез слизистой оболочки желудка мыши: Helicobacter pylori бактерии (зеленый) колонизируют полости желудочных желез. Ядра клеток слизистой оболочки изображены синим цветом, их цитоскелет — красным.
© Сигал / Шарите
Поперечный разрез слизистой оболочки желудка мыши: Helicobacter pylori бактерии (зеленый) колонизируют полости желудочных желез.Ядра клеток слизистой оболочки изображены синим цветом, их цитоскелет — красным.
© Сигал / Шарите
Группа исследовала инфекции, вызванные возбудителем желудочного заболевания Helicobacter pylori , бактерией, которая хронически колонизирует желудок примерно у половины населения мира и, как известно, вызывает рак желудка. Майкл Сигал из Charité, который руководил исследованием с командой Макса Планка Томаса Ф. Мейера, ранее показал, что бактерия не только колонизирует поверхность желудочного эпителия, но и способна проникать глубоко в основание желудочных желез, где стволовые клетки располагаются.
В ответ на инфекцию стромальные клетки подлежащей соединительной ткани продуцируют повышенное количество фактора, называемого R-спондином, который усиливает активность так называемого пути Wnt — почти универсального фактора обновления стволовых клеток в различных тканях. В ответ стволовые клетки увеличивают свой оборот, что приводит к гиперплазии, утолщению слизистой оболочки, что типично для пациентов с гастритом.
Субпопуляция стволовых клеток
Хотя команда увидела, что R-спондин привел к падению числа колонизирующих бактерий, они не были уверены, что причиной этого является только увеличение тканевого оборота.Теперь они обнаружили, что субпопуляция стволовых клеток в самом основании железы не отвечает на R-спондин повышенным оборотом. Вместо этого эта популяция дифференцируется в секреторные клетки и начинает продуцировать и выделять антимикробные пептиды в железу, тем самым защищая свою собственную нишу от бактериальной атаки. Когда команда увеличила способность стромальных клеток желудка продуцировать R-спондин, стволовые клетки после инфекции вырабатывали еще большее количество антимикробных пептидов, и желудочные железы были полностью очищены от бактерий.Это демонстрирует высокую эффективность антибактериальных соединений, продуцируемых в нише стволовых клеток.
По словам Мейера, эти открытия добавляют значительный вес к нашему растущему пониманию того, что эпителий слизистой оболочки сам по себе представляет собой чрезвычайно важный участок иммунной защиты. «Ниша стволовых клеток слизистой оболочки желудка — и, вероятно, многих других тканей — имеет средства защиты от бактериальных захватчиков. Вероятно, это важный механизм для поддержания генетической целостности взрослых стволовых клеток ».
Результаты также могут иметь важное значение для других желудочно-кишечных заболеваний, таких как Morbus Crohn, которое, как полагают, является результатом нарушения нормальной функции эпителиального барьера. Вполне вероятно, что и здесь компартмент стволовых клеток обладает способностью контролировать производство противомикробных препаратов. «Было бы огромным клиническим преимуществом, если бы такие противомикробные препараты можно было бы использовать в качестве маркеров для идентификации пациентов, у которых эта защитная защита нарушена», — добавляет Сигал. Кроме того, команда продолжит исследовать, каким образом нарушение защиты эпителия может играть роль в канцерогенезе.
.

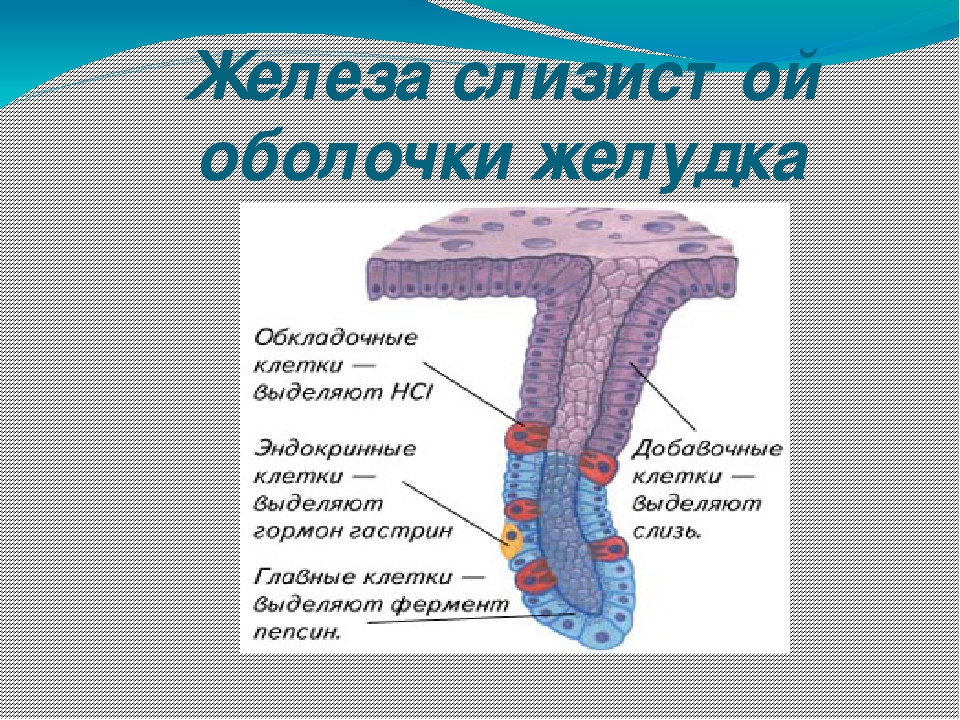 В секреторных отделах они содержат слизистые клетки и большое количество эндокринных клеток. Они вырабатывают слабощелочную слизь.
В секреторных отделах они содержат слизистые клетки и большое количество эндокринных клеток. Они вырабатывают слабощелочную слизь. Если ткани желудка повреждаются, выработка слизи увеличивается в разы, это защитная реакция. Поскольку большое количество муцина свидетельствует о начале атрофического процесса и отмирании некоторых желез, пускать недуг на самотек нельзя, последствия такого игнорирования могут быть самыми печальными.
Если ткани желудка повреждаются, выработка слизи увеличивается в разы, это защитная реакция. Поскольку большое количество муцина свидетельствует о начале атрофического процесса и отмирании некоторых желез, пускать недуг на самотек нельзя, последствия такого игнорирования могут быть самыми печальными. Пепсиногены используют как маркер атрофического гастрита (состояние, расцениваемое как предраковое), но не как опухолевый маркер.
Пепсиногены используют как маркер атрофического гастрита (состояние, расцениваемое как предраковое), но не как опухолевый маркер. ru/m.ekamedcenter.ru/articles/anatomiya-zheludka-stroenie-zheludka-lechenie-zheludka.html
ru/m.ekamedcenter.ru/articles/anatomiya-zheludka-stroenie-zheludka-lechenie-zheludka.html Самый дистальный и узкий отдел желудка называется pylorus — поскольку пища разжижается в желудке, она проходит через пилорический канал в тонкий кишечник.
Самый дистальный и узкий отдел желудка называется pylorus — поскольку пища разжижается в желудке, она проходит через пилорический канал в тонкий кишечник.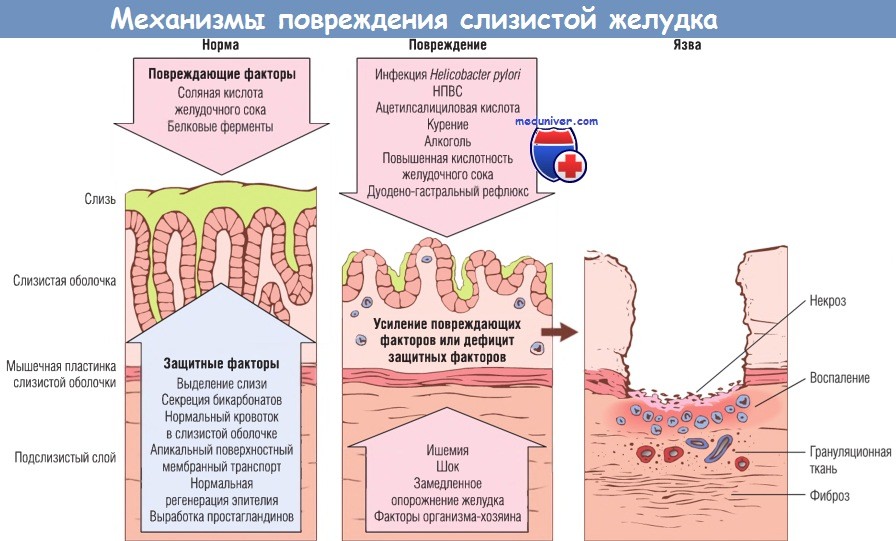
 На микрофотографии справа показана ямка желудка, инвагинирующая в слизистую оболочку (фундальная область желудка енота). Обратите внимание, что все поверхностные клетки и клетки в шейке ямки имеют пенистый вид — это слизистые клетки. Другие типы клеток расположены дальше в яме, и на этом изображении их трудно различить.
На микрофотографии справа показана ямка желудка, инвагинирующая в слизистую оболочку (фундальная область желудка енота). Обратите внимание, что все поверхностные клетки и клетки в шейке ямки имеют пенистый вид — это слизистые клетки. Другие типы клеток расположены дальше в яме, и на этом изображении их трудно различить.